骨髓间充质干细胞的线粒体在改善卵母细胞药物中的应用的制作方法
本发明属于生物医学工程技术领域,尤其涉及骨髓间充质干细胞的线粒体在改善卵母细胞药物中的应用。
背景技术:
卵子质量差是导致辅助生殖反复失败的重要原因。线粒体数目的减少与卵母细胞衰老有关,功能障碍的线粒体会影响卵母细胞成熟的晚期阶段和早期胚胎形成。因此,关于改善卵子质量的研究主要集中在改善线粒体的功能上。
研究或临床应用阶段用于改善卵子质量的方法有:1)线粒体活化剂:生长激素、辅酶q10、白藜芦醇、左旋肉碱、α-硫辛酸,其中,临床常用生长激素、辅酶q10改用于善卵子质量,其余活化剂应用较少;2)线粒体替代治疗:细胞浆移植、核移植、纺锤体移植和极体移植;线粒体替代治疗还处于实验研究阶段,未进入临床应用中。
目前,暂无有效改善卵子质量的药物或方法;原因在于上述两种方法均存在许多不足:1)线粒体活化剂疗效不确切、不显著,效果有限;2)在线粒体替代治疗中,异体细胞移植因会形成三亲胚胎的伦理问题;3)在线粒体替代治疗中,不同个体来源的线粒体dna与核基因组合后,暂无系统评估后代的健康风险,不可预测;4)线粒体替代治疗的效果不稳定。
因此,有必要研发一种用于改善卵母细胞质量的药物。
技术实现要素:
本发明目的在于克服现有技术存在的不足,而提供骨髓间充质干细胞的线粒体在改善卵母细胞药物中的应用,母体自身的骨髓间充质干细胞的线粒体的功能良好,注射到卵母细胞后可以改善卵母细胞的质量:用于体外受精、育儿。
为实现上述目的,本发明采取的技术方案为:骨髓间充质干细胞的线粒体在制备用于改善卵母细胞质量药物中的应用。
作为上述技术方案的改进,所述骨髓间充质干细胞的线粒体是通过以下步骤进行提取:
s1)复苏骨髓间充质干细胞,进行消化处理;消化后,骨髓间充质干细胞收集到容器中;
s2)离心弃上清,再向容器中加入pbs缓冲液进行重悬;骨髓间充质干细胞悬浮后,离心弃上清;
s3)向容器中加入预冷的mito-cytobuffer进行重悬,重悬后转移至另一容器中,并放入冰块;对骨髓间充质干细胞混合液进行多次抽吸;
s4)将骨髓间充质干细胞的匀浆物转移到另一容器中,离心、收集上清液;
s5)对步骤s4收集的上清液继续离心,收集上清液;
s6)重复步骤s5。
另外,本发明还提供一种用于改善卵母细胞质量的药物,其包含骨髓间充质干细胞的线粒体。
作为上述技术方案的改进,所述骨髓间充质干细胞的线粒体是通过以下步骤进行提取:
s1)复苏骨髓间充质干细胞,进行消化处理;消化后,骨髓间充质干细胞收集到容器中;
s2)离心弃上清,再向容器中加入pbs缓冲液进行重悬;骨髓间充质干细胞悬浮后,离心弃上清;
s3)向容器中加入预冷的mito-cytobuffer进行重悬,重悬后转移至另一容器中,并放入冰块;对骨髓间充质干细胞混合液进行多次抽吸;
s4)将骨髓间充质干细胞的匀浆物转移到另一容器中,离心、收集上清液;
s5)对步骤s4收集的上清液继续离心,收集上清液;
s6)重复步骤s5。
作为上述技术方案的改进,所述药物中骨髓间充质干细胞的线粒体dna拷贝数为4000~5000个。
本发明有益效果:本发明提供骨髓间充质干细胞的线粒体在改善卵母细胞药物中的应用,母体自身的骨髓间充质干细胞的线粒体的功能良好,注射到卵母细胞后可以改善卵母细胞的质量;本发明具有以下优点:
1)选择了一种高质量来源(骨髓间充质干细胞)的线粒体,治疗效果显著,成功使一名因胚胎质量差反复移植失败的女性妊娠、并分娩一健康婴儿;
2)不存在异体细胞线粒体移植的问题,从而不会导致“三亲”子代的伦理隐患,也不会因不同来源的线粒体-核基因组合使后代的健康存在潜在风险;
3)提供了一种标准化的技术流程,使技术更稳定,疗效更稳定。
附图说明
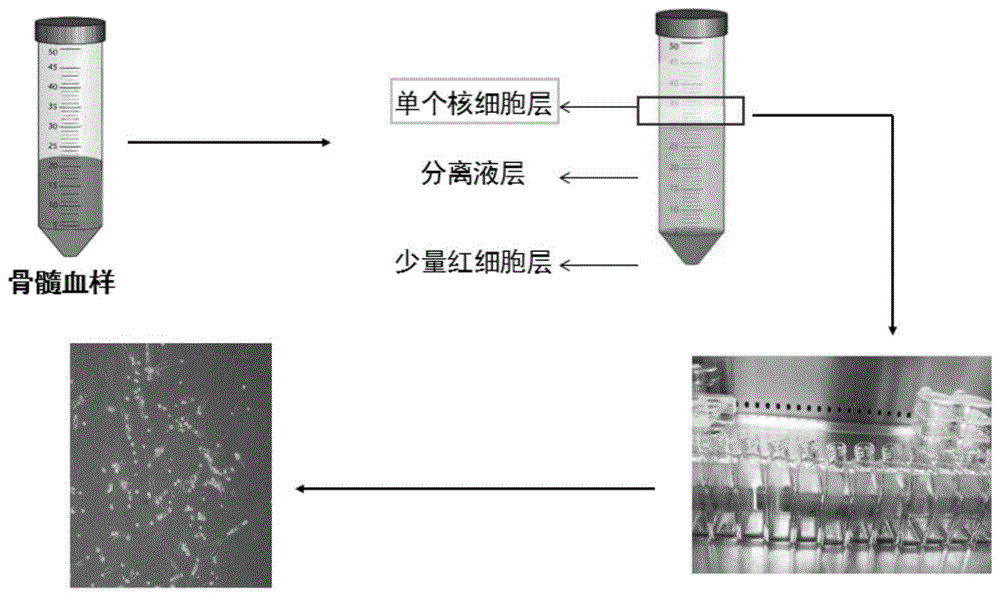
图1为显示骨髓间充质干细胞的分离培养及线粒体的提取;
图2为分离的骨髓间充质干细胞的鉴定;
图3为线粒体的电镜图;其中,3a来源于患者卵母细胞,3b来源于患者骨髓间充质干细胞;
图4显示线粒体的膜电位;
图5显示卵母细胞接受线粒体注射;其中,5a为线粒体注射过程,5b显示线粒体注射入卵母细胞内,5b图中白色亮点为线粒体和荧光标记的精子;
图6显示骨髓间充质干细胞线粒体注射卵母细胞后,囊胚发育良好。
具体实施方式
为更好地说明本发明的目的、技术方案和优点,下面将结合具体实施例和附图对本发明作进一步说明。
骨髓间充质干细胞的分离、接种
1)在20ml骨髓血样中加入10mlpbs混匀,用50ml离心管分装2管ficoll(密度1.077)淋巴细胞分离液15ml,将稀释骨髓缓慢加入ficoll液面上,水平离心机700g离心25min;
2)从界面上取出的mnc(云雾状层细胞)并加入50ml离心管内;
3)加入pbs15ml重悬,500g离心10min后弃上清;重复一次该步骤,并细胞计数;
4)将细胞种入六孔板中,每孔加2ml培养液,细胞密度不少于2×105/孔;
5)在co2体积分数5%、湿度95%以上和温度37℃条件下培养箱中静置培养,3~5天更换一次培养液;
6)待每孔细胞汇合度为80%~90%时,弃去培养液,用适量pbs液洗涤2次;
7)用0.25%edta(2.5g/l,0.25%)胰蛋白酶,消化3min后终止胰酶作用;
8)用吸管反复吹打后将细胞收集于15ml离心管中,加pbs至液体体积为8ml,300g离心5min,弃去上清,细胞用于后期实验。
骨髓间充质干细胞的鉴定
用脂肪细胞诱导培养基和成骨细胞诱导培养基对细胞进行诱导分化(成脂分化和成骨分化),随后进行油红染色和茜素红染色,并在显微镜下观察是否成功分化成脂肪细胞和成骨细胞,利用流式细胞仪检测骨髓间充质干细胞的表型为cd29/73/90/44/105/166阳性且cd45/34阴性的细胞。
如图2所示,本发明分离的细胞为骨髓间充质干细胞。
骨髓间充质干细胞的消化
1)全部吸出培养液弃去后,加入适量的pbs液;
2)弃去培养皿/瓶内pbs,加入适量的pbs液;
3)加入安全柜内复温的0.25%edta(2.5g/l,0.25%)胰蛋白酶,消化3min,倒置显微镜下观察,细胞开始皱缩时(细胞开始变圆)加入完全培养液,轻轻摇匀终止胰酶作用。
线粒体定量操作
线粒体基因提取(试剂盒:天根tianampgenomicdnakitcat:#sp304-2)
1)消化后的细胞,细胞数要求106个,400g离心5min沉淀弃上清;加入200μlga、20μlproteinasek溶液、200μl缓冲液gb,充分颠倒混匀,70℃放置10min;
2)加人200μl无水乙醇,充分振荡混匀15sec,此时可能会出现絮状沉淀,简短离心以去除管盖内壁的水珠;
3)将上一步所得溶液和絮状沉淀都加入一个吸附柱cb3中(吸附柱放入收集管中),12,000rpm(~13,400×g)离心30sec,倒掉废液,将吸附柱cb3放回收集管中;
4)向吸附柱cb3中加入500μl缓冲液gd,12,000rpm(~13,400×g)离心30sec,倒掉废液,将吸附柱cb3放入收集管中;
5)向吸附柱cb3中加入600μl漂洗液pw,12,000rpm(~13,400×g)离心30sec,倒掉废液,将吸附柱cb3放入收集管中;
6)重复操作步骤5;
7)将吸附柱cb3放回收集管中,12,000rpm(~13,400×g)离心2min,倒掉废液;将吸附柱cb3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液;
8)将吸附柱cb3转入一个干净的离心管中,向吸附膜的中间部位悬空滴加50~200μl洗脱缓冲液te,室温放置2~5min,12,000rpm(~13,400×g)离心2min,将溶液收集到离心管中;
构建线粒体定量质粒
1)取新5个线粒体基因nd1\nd6\12s\atp6\16s,构建新标准曲线质粒:
a.稀释nd1\nd6\12s\atp6r、f引物10μm;
b.构建pcr体系:
pcr循环条件:94℃,3min;94℃,30s;55℃,1min;72℃,20s;循环数30cycles。
c.回收胶配制:70ml1×tae,0.7g琼脂糖配成70ml,1%浓度回收胶,倒入模版内;
d.跑胶:pcr结束,加入6×loadingbuffer,选取dnamaker2000,dnamarker2000包涵:100,250,500,750,1000,2000bp条带;恒压123v电泳
e.观察结果:在紫外灯照射仪下观察目的条带是否存在,若存在,留做下一步实验。
2)切胶回收标准曲线目的基因pcr产物
a.柱平衡步骤:向吸附柱ca2中(吸附柱放入收集管中)加入500μl平衡液bl,12,000rpm(~13,400×g)离心1min,倒掉收集管中的废液,将吸附柱重新放回收集管中;
b.将单一的目的dna条带从琼脂糖凝胶中切下放入干净的离心管中,称取重量;
c.向胶块中加入等倍体积溶液pn(如果凝胶重为0.1g,其体积可视为100μl,则加入100μlpn溶液),50℃水浴放置,使胶块充分溶解;
d.将上一步所得溶液加入一个吸附柱ca2中(吸附柱放入收集管中),室温放置2min,12,000rpm(~13,400×g)离心30~60sec,倒掉收集管中的废液,将吸附柱ca2放入收集管中;
e.向吸附柱ca2中加入600μl漂洗液pw,12,000rpm(~13,400×g)离心30~60sec,倒掉收集管中的废液,将吸附柱ca2放入收集管中;
f.重复操作步骤e;
g.将吸附柱ca2放回收集管中,12,000rpm(~13,400×g)离心2min,尽量除尽漂洗液;将吸附柱ca2置于室温放置数分钟,彻底地晾干;
h.将吸附柱ca2放到一个干净离心管中,向吸附膜中间位置悬空滴加适量洗脱缓冲液eb,室温放置2min;12,000rpm(~13,400×g)离心2min收集dna溶液。
3)标准曲线目的基因pcr产物连接t载体:在微量离心管中配制下列dna溶液,全量为10μl:加入pmd18-tvector0.5μl,加入dna4.5μl,加入solμtioni5μl;混匀,放入4℃冰箱过夜反应。
4)配制lb培养基:蛋白胨0.5g,酵母提取物0.25g,氯化钠0.5g,1g琼脂,加水50ml;加热熔化,用1mol/lnaoh溶液调节ph至偏碱性;灭菌:1kg压力灭菌15min。
5)配制amp+平板:配置100mg/ml氨苄青霉素溶液,分装成小份于-20℃贮存,常以25~50μg/ml的终浓度添加于生长培养基;将培养基倒入培养皿,待平板冷却凝固后,倒置平板。
6)质粒转化、涂板:取0.2ml大肠杆菌感受态细胞,在无菌条件下,加入到连接液的eppendorf管,混匀,置冰浴中30min;冰浴后,将正在转化反应的细胞悬浮液加入已调好42℃的恒温水浴槽内,保温2min;倒入lb培养液1ml,置37℃水浴1小时,用移液器取0.1ml的转化菌液直接涂布含50μg/mlamp储液lb固体平皿上,共涂布1个培养皿;将第培养皿先放室温15min左右,使涂布上的菌液干燥不会流动;然后倒置放于恒温箱中37℃培养过夜,第二天取出培养皿,观察对照平皿和转化平皿菌落情况。
7)配制lbamp+培养基:用50ml离心管分装40ml基础培养基lb培养基;加入80μlamp抗生素500×储存液,上下颠倒混匀;lbamp+培养基分装20支15ml离心管,每支2ml。
8)目的基因质粒克隆挑菌、培养:在酒精灯火焰前挑菌,菌落选择圆大均匀白色菌落,放入已准备好的lbamp+培养基中;每个平板挑取5个克隆菌落,标记每支试管;放入摇床内,37℃,200转过夜,约12小时。
9)目的基因质粒抽提
a.柱平衡步骤:向吸附柱cp3中(吸附柱放入收集管中)加入500μl的平衡液bl,12,000rpm(~13,400×g)离心1min,倒掉收集管中的废液,将吸附柱重新放回收集管中;
b.取1~5ml过夜培养的菌液,加入离心管中,使用常规台式离心机,12,000rpm(~13,400×g)离心1min,尽量吸除上清;
c.向留有菌体沉淀的离心管中加入250μl溶液p1,使用移液器或涡旋振荡器彻底悬浮细菌沉淀;
d.向离心管中加入250μl溶液p2,温和地上下翻转6~8次使菌体充分裂解;
e.向离心管中加入350μl溶液p3,立即温和地上下翻转6~8次,充分混匀,此时将出现白色絮状沉淀;12,000rpm(~13,400×g)离心10min。
f.将上一步收集的上清液用移液器转移到吸附柱cp3中(吸附柱放入收集管中),12,000rpm(~13,400×g)离心30~60sec,倒掉收集管中的废液,将吸附柱cp3放入收集管中;
g.向吸附柱cp3中加入600μl漂洗液pw,12,000rpm(~13,400×g)离心30~60sec,倒掉收集管中的废液,将吸附柱cp3放入收集管中;
h.重复操作步骤g;
i.将吸附柱cp3放入收集管中,12,000rpm(~13,400×g)离心2min;
j.将吸附柱cp3置于干净的离心管中,向吸附膜的中间部位滴加50~100μl洗脱缓冲液eb,室温放置2min,12,000rpm(~13,400×g)离心2min,将质粒溶液收集到离心管中。
10)使用thermonanodrop2000测量目的基因质粒dna浓度、纯度。
11)质粒测序:选择正确序列的基因质粒,如果不正确需从构建线粒体定量质粒部分重新开始做一遍。
12)荧光实时定量pcr线粒体拷贝数定量实验
a.绘制标准曲线
测质粒浓度:16s、atp6、12s、nd1,16s、atp6、12s、nd1稀释成2×108copies/μl~2×104copies/μl;16s、atp6、12s、nd1各自的上下游引物,模板:16s2×104,5,6,7或8,nd22×104,5,6,7或8,atp62×104,5,6,7或8,12s2×104,5,6,7或8;横坐标:质粒copy,纵坐标:tm值,绘制标准曲线。
b.qpcr
模板:gzf2hepa,g183hepa,8500hepa,h1hepadna,mscdna,16s、atp6、12s、nd1各自的上下游引物。拷贝数计算:拷贝数=(质量/分子量)×6.0×1023。例如pgem-t载体长3003bp,插入的目的片断长162bp,每个碱基的平均分子量是330,(每对碱基/bp是660,)质粒原液约250μg/ml,阿弗加德罗常数(每mol的微粒数)是6.02e+23/mol。那么每2μl的绝对模板数量是:=14.4e+10。所以,10-4~10-7质粒的模板分子数是14.4e+6~3。
msc细胞(骨髓间充质干细胞)线粒体提取
1)患者取卵3天前准备复苏骨髓间充质干细胞,复苏细胞量为4×106~5×106,复苏在2~3个225cm2培养瓶里;
2)患者取卵日,消化细胞,收集到50ml离心管里,细胞计数,代入换算出标准曲线与拷贝数的关系表计算本次需要溶解线粒体的液体体积,400g离心6min;
3)弃上清,加入20mlpbs重悬洗一次,400g离心6min,弃上清;
4)将收集的细胞沉淀用1.5ml冰预冷的mito-cytobμffer重悬,将细胞从50ml离心管转移到2ml离心管内,放入预先准备好的冷冻冰块,用10ml注射器加上超细针头(0.45规格)抽吸30次;
5)将细胞匀浆物转移到离心管,4℃、1500g离心5min;细胞核、大的膜碎片、未裂解细胞等在管底;
6)收集上清液并转移到新的离心管,4℃、1500g离心5min,弃沉淀;
7)将上清液转移到新的离心管,4℃、12,000g离心15min,弃上清,备用。
如图3所示,患者卵母细胞中线粒体为球状、短棒状的异常线粒体,表明患者卵母细胞的线粒体的功能差;患者骨髓间充质干细胞中线粒体未正常形态,具有脊状结构。
对线粒体进行jc-1染色测定其膜电位,结果如图4所示,数值越高,线粒体的功能越低;两个患者msc细胞线粒体膜电位差异不大,颗粒细胞膜电位比msc差。
msc细胞来源线粒体的注射
1)取卵后,卵丘复合物在培养箱中培养2小时,拆除颗粒细胞,在倒置显微镜下观察卵母细胞是否成熟,只有成熟的卵母细胞才可用于线粒体注射;
2)按照线粒体dna拷贝数的标准曲线,用受精液稀释制备好的线粒体沉淀;
3)在显微注射仪上安装好显微固定针和注射针,注射针选用tpc的od6.5μm的规格;根据线粒体dna拷贝数的标准曲线、显微注射针的直径、注射的长度计算注射线粒体的体积;
4)镜下制动精子,先将精子吸入注射针中,然后将精子转移到msc来源线粒体的液滴中,在镜下按照刻度吸取100μm长度的线粒体dna溶液,制动好的精子作为标记物;
5)将卵膜与注射针的尖端调整到同一个水平面上,注射并以精子作为标记物,将注射针前段的线粒体dna溶液全部注射到卵母细胞中去,注射进入卵母细胞的线粒体dna拷贝数大约为4000~5000个(如图5所示);
6)将注射后的卵母细胞放入卵裂液中继续培养,在培养到第三天或者囊胚期移植或者玻璃化冷冻保存。
如图6所示,卵母细胞接受骨髓间充质干细胞线粒体注射后,囊胚发育良好。
最后所应当说明的是,以上实施例用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者同等替换,而不脱离本发明技术方案的实质和范围。
- 还没有人留言评论。精彩留言会获得点赞!