一种高效诱导鱼类多能性干细胞的方法以及用于该方法的诱导培养基与流程
本发明属于生物技术领域,尤其涉及一种高效诱导鱼类多能性干细胞的方法以及用于该方法的诱导培养基。
背景技术:
诱导多能性干细胞是日本科学家yamanaka等首先提出来的,通过在体细胞中强制表达四个转录因子(oct4,sox2,klf4和c-myc),将体细胞诱导为具有多能性的干细胞,并命名为诱导多能性干细胞(inducedpluripotentstemcell,ipsc),ipsc已经具备了正常胚胎干细胞的发育多潜能,而且由于它可以规避治疗性克隆在临床应用面临的伦理和法律问题,并且在普通胚胎干细胞培养环境中就可以进行相关的实验操作,能方便地进行大规模的扩增培养用于细胞治疗。
2013年,rossello等利用yamanaka的四因子体系在斑马鱼中成功获得斑马鱼诱导多能性干细胞。之后,肖亚梅等通过dox(盐酸强力霉素,是一种常用抗生素四环素tetracycline的类似物,在生物学实验中常用于tet-on系统的诱导性表达的诱导剂)调控的tet-on慢病毒体系感染斑马鱼成纤维细胞表达oct4,sox2,klf4和c-myc,也成功获得斑马鱼诱导多能性干细胞。
然而dox在鱼类多能性干细胞的诱导中效率低下,严重制约了鱼类诱导多能性干细胞的研究及应用。同时通过人为向细胞中导入几个外源基因使细胞命运发生改变,会不可避免的存在安全风险。基于此,建立新型、高效、安全的鱼类多能性干细胞的诱导方法是鱼类发育生物学研究以及建立鱼类育种新技术的迫切需求。
技术实现要素:
本发明所要解决的技术问题是,克服以上背景技术中提到的不足和缺陷,提供一种不需要引入外源基因、高效诱导鱼类多能性干细胞的方法及其用于该方法的诱导培养基。
为解决上述技术问题,本发明提出的技术方案为:
一种诱导鱼类多能性干细胞的方法,包括如下步骤:首先,通过体外培养获得鱼尾鳍成纤维细胞,用胰酶消化成单细胞后接种于培养皿,然后用诱导培养基对接种后得到的鱼尾鳍成纤维细胞进行连续诱导,再经人工挑克隆及传代培养后,得到鱼类诱导多能性干细胞。
上述的方法,优选的,所述通过体外培养获得鱼尾鳍成纤维细胞的具体操作,包括如下步骤:剪取鱼尾鳍的小块鳍条后置于磷酸缓冲液中进行反复漂洗,用灭菌后的剪刀将鳍条剪碎成组织块,离心后用磷酸缓冲液重悬组织块,进行二次离心,吸去上清,将组织块均匀地铺在培养皿底,放入二氧化碳培养箱中培养,然后加入成纤维细胞培养基继续培养,待细胞长满整个培养皿,用胰酶消化后传代培养,培养至2-4代,即得到所述的鱼尾鳍成纤维细胞。尾鳍细胞是可以在不影响供体鱼的存活的前提下最容易获得的细胞,并且培养也最容易,因此采用鱼尾鳍细胞进行诱导是最佳选择。
优选的,所述二氧化碳培养箱中,二氧化碳的体积浓度为3-7%,温度为25-28℃,放入二氧化碳培养箱中培养1-3h后加入成纤维细胞培养基继续在二氧化碳培养箱中培养。
优选的,所述成纤维细胞培养基的成分包括:体积百分比为2.5%的鲤鱼血清,体积百分比为7.5%的胎牛血清,体积百分比为1%的非必需氨基酸细胞培养添加物,体积百分比为1%的青链双抗,体积百分比1%的l-谷氨酰胺,终浓度为10ng/ml的重组成纤维细胞生长因子,余量为dmem培养基。加入终浓度为10ng/ml的重组成纤维细胞生长因子的目的是进行预处理,以优化尾鳍细胞生长状况。
优选的,所述接种的密度为1×105/ml,接种的时间为22-24h;所述连续诱导期间,每隔1-2天更换一次诱导培养基,不进行胰酶消化和传代培养。所述连续诱导的过程中按1:1连续培养,即不将一个培养皿中的细胞分为多个培养皿传代培养。
优选的,所述诱导培养基的基础成分包括:体积百分比为10%的血清替代物,体积百分比为7.5%的胎牛血清,体积百分比为2.5%的鲤鱼血清,体积百分比为1%的谷氨酸细胞培养添加物,体积百分比为1%的非必需氨基酸细胞培养添加物,体积百分比为1%的青链双抗,终浓度为0.10-0.25mm的丙戊酸钠,终浓度为2-5μm的tgf-β通路抑制剂,终浓度为1-2.5μm的单胺氧化酶抑制剂,终浓度为0.01-0.025μm的视黄酸受体α激活剂,余量为knockoutdmem培养基。
优选的,所述连续诱导的总时长为18天,在第0-8天、第9-10天和第11-18天采用的诱导培养基分别为第i阶段诱导培养基、第ii阶段诱导培养基和第iii阶段诱导培养基;
所述第i阶段诱导培养基在所述基础成分的基础上,还包括终浓度为10-50ng/ml的重组成纤维细胞生长因子、终浓度为4-10μm的糖原合酶激酶抑制剂3、终浓度为10-25μm的腺苷酸环化酶激活剂、终浓度为1-2.5μm的dot1l选择性抑制剂;
所述第ii阶段诱导培养基在所述基础成分的基础上,还包括终浓度为5-12.5ng/ml的重组成纤维细胞生长因子、终浓度为2-5μm的糖原合酶激酶抑制剂3、终浓度为1-5μm的腺苷酸环化酶激活剂、终浓度为1-2.5μm的dot1l选择性抑制剂;
所述第iii阶段诱导培养基在所述基础成分的基础上,还包括终浓度为5-12.5ng/ml的重组成纤维细胞生长因子、终浓度为2-5μm的糖原合酶激酶抑制剂3、终浓度为2-5μm的腺苷酸环化酶激活剂、终浓度为0.01-0.025μm的s-腺苷基-l-高半胱氨酸水解酶抑制剂、终浓度为0.01-0.025μm的甲基转移酶抑制剂、终浓度为1-2.5μm的组蛋白甲基转移酶dot1l抑制剂。
连续诱导的第0-8天、第9-10天和第11-18天,这三个时间段的选择是根据诱导细胞生长状态和细胞形态变化来选择的,也预示了体细胞向干细胞转变过程中的三个阶段,即成纤维细胞向胚外内胚层细胞转换阶段、胚外内胚层细胞向多潜能细胞转换阶段、干细胞形成阶段。特定时间段采用特定培养基是根据体细胞向干细胞转变过程中需要不同的小分子刺激,第i阶段中重组成纤维细胞生长因子、tgf-β通路抑制剂等小分子化合物能强力刺激多能性基因表达,完成细胞转变的启动;第ii阶段是在第一阶段基础上降低重组成纤维细胞生长因子以及腺苷酸环化酶激活剂等小分子浓度,以提高细胞活性;第iii阶段中通过甲基转移酶抑制剂、组蛋白甲基转移酶dot1l抑制剂进一步促进细胞甲基化程度增高,维持干细胞的干性。
优选的,所述鱼类包括锦鲤(经济养殖鱼类)、四倍体鲫鲤(人工杂交多倍体鱼类)或斑马鱼(模式动物)。
与现有技术相比,本发明的有益效果为:
1、本发明的诱导方法,采用含有化学小分子的诱导培养基进行诱导,不需要引入外源基因,提高了未来应用的安全性,小分子诱导过程灵活可控,可提高诱导效率,并且诱导方法可操作性强,重复性好,可稳定诱导出多能性干细胞,从而适用于未来鱼类多能性干细胞的诱导应用。
2、本发明的诱导方法,建立了适用于鱼类小分子诱导多能性干细胞的诱导培养基和诱导技术体系,首次将化学小分子应用到诱导鱼类多能性干细胞,并成功获得了尾鳍成纤维细胞来源的诱导多能性干细胞,填补了化学小分子诱导鱼类多能性干细胞的空白,为鱼类干细胞研究的应用提供了更多的选择。
3、本发明的诱导培养基,根据诱导细胞生长状态和细胞形态变化分为三个阶段,第i阶段中重组成纤维细胞生长因子、tgf-β通路抑制剂等小分子化合物能强力刺激多能性基因表达,完成细胞转变的启动;第ii阶段是在第一阶段基础上降低重组成纤维细胞生长因子以及腺苷酸环化酶激活剂等小分子浓度,以提高细胞活性;第iii阶段中通过甲基转移酶抑制剂、组蛋白甲基转移酶dot1l抑制剂进一步促进细胞甲基化程度增高,维持干细胞的干性;总的来说,本发明的诱导培养基不需要引入外源基因,提高了未来应用的安全性,诱导过程灵活可控,可提高诱导效率。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
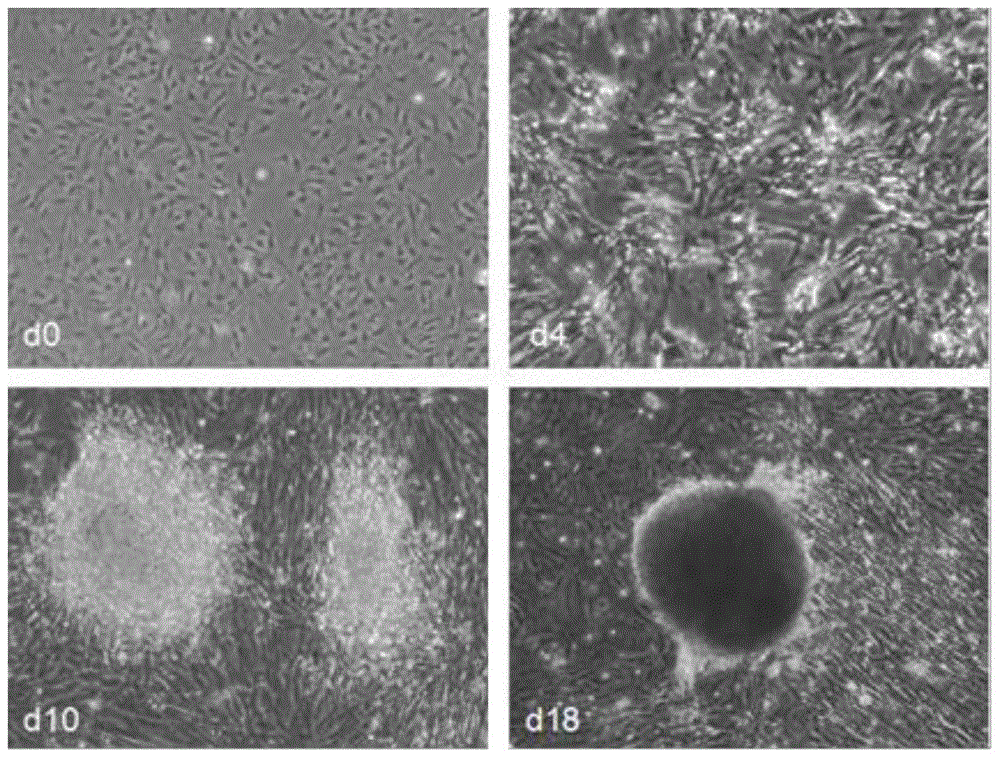
图1是锦鲤尾鳍成纤维细胞的多能性干细胞诱导过程中的细胞显微照片;
图2是四倍体鲫鲤尾鳍成纤维细胞的多能性干细胞诱导过程中的细胞显微照片;
图3是斑马鱼尾鳍成纤维细胞的多能性干细胞诱导过程中的细胞显微照片;
图4是锦鲤多能性干细胞的碱性磷酸酶(ap)染色鉴定的显微照片;
图5是rt-pcr验证锦鲤多能性干细胞的干性基因表达结果;
图6是免疫荧光标记技术验证诱导多能性干细胞的干性基因表达图;
图7是诱导多能性干细胞移植形成嵌合体的显微照片。
具体实施方式
为了便于理解本发明,下文将结合说明书附图和较佳的实施例对本发明做更全面、细致地描述,但本发明的保护范围并不限于以下具体实施例。
除非另有定义,下文中所使用的所有专业术语与本领域技术人员通常理解含义相同。本文中所使用的专业术语只是为了描述具体实施例的目的,并不是旨在限制本发明的保护范围。
除非另有特别说明,本发明中用到的各种原材料、试剂、仪器和设备等均可通过市场购买得到或者可通过现有方法制备得到。
诱导后的细胞通过碱性磷酸酶(ap)染色、rt-pcr鉴定部分多能性基因的表达和通过显微注射到斑马鱼胚胎进行诱导干细胞的多能性检测。
实施例1:锦鲤多能性干细胞的诱导
一种本发明的诱导鱼类多能性干细胞的方法,以锦鲤作为尾鳍成纤维细胞供体,采用化学小分子诱导培养基分三个阶段进行连续诱导,具体操作过程如下:
(1)尾鳍成纤维细胞原代培养:从锦鲤的尾鳍中剪取小块鳍条置于磷酸缓冲液(pbs)中,对其进行反复漂洗,用灭过菌的剪刀将组织块剪碎,1200rpm离心3min,离心后再用磷酸缓冲液重悬组织块,二次离心,吸去上清,将组织块均匀地铺在培养皿底,放入28℃、5%co2的二氧化碳培养箱进行培养,2h后加成纤维细胞培养基继续培养;
成纤维细胞培养基的成分包括:体积百分比为2.5%的鲤鱼血清,体积百分比为7.5%的胎牛血清,体积百分比为1%的非必需氨基酸细胞培养添加物,体积百分比为1%的青链双抗,体积百分比1%的l-谷氨酰胺,终浓度为10ng/ml的重组成纤维细胞生长因子,余量为dmem培养基;
(2)尾鳍成纤维细胞传代培养:待细胞长满整个培养皿、融合度达到90%时,用质量浓度为0.25%的胰酶消化后分皿进行传代培养,培养至2-4代,即得到锦鲤的尾鳍成纤维细胞(见图1-d0);
(3)多能性干细胞的诱导:用胰酶消化尾鳍成纤维细胞为单细胞后重新接种铺皿,密度为1×105/ml,接种24h后加入第i阶段诱导培养基,第9天换第ii阶段诱导培养基,第11天换第iii阶段诱导培养基,在每个阶段培养时,均每2天更换一次诱导培养基,不进行胰酶消化和传代培养,诱导过程中的锦鲤成纤维细胞如图1(d4,d10,d18)所示,经人工挑克隆及传代培养后,得到锦鲤诱导多能性干细胞;
第i、ii、iii阶段诱导培养基的基础成分包括:体积百分比为10%的血清替代物,体积百分比为7.5%的胎牛血清,体积百分比为2.5%的鲤鱼血清,体积百分比为1%的谷氨酸细胞培养添加物,体积百分比为1%的非必需氨基酸细胞培养添加物,体积百分比为1%的青链双抗,终浓度为0.25mm的丙戊酸钠,终浓度为5μm的tgf-β通路抑制剂,终浓度为2.5μm的单胺氧化酶抑制剂,终浓度为0.025μm的视黄酸受体α激活剂,余量为knockoutdmem培养基;其中:
第i阶段诱导培养基在基础成分的基础上还添加:终浓度为50ng/ml的重组成纤维细胞生长因子、终浓度为10μm的糖原合酶激酶抑制剂3、终浓度为25μm的腺苷酸环化酶激活剂、终浓度为2.5μm的dot1l选择性抑制剂;
第ii阶段诱导培养基在基础成分的基础上还添加:终浓度为12.5ng/ml的重组成纤维细胞生长因子、终浓度为5μm的糖原合酶激酶抑制剂3、终浓度为5μm的腺苷酸环化酶激活剂、终浓度为2.5μm的dot1l选择性抑制剂;
第iii阶段诱导培养基在基础成分的基础上还添加:终浓度为12.5ng/ml的重组成纤维细胞生长因子、终浓度为5μm的糖原合酶激酶抑制剂3、终浓度为5μm的腺苷酸环化酶激活剂、终浓度为0.025μm的s-腺苷基-l-高半胱氨酸水解酶抑制剂、终浓度为0.025μm的甲基转移酶抑制剂、终浓度为2.5μm的组蛋白甲基转移酶dot1l抑制剂。
实施例2:四倍体鲫鲤多能性干细胞的诱导
一种本发明的诱导鱼类多能性干细胞的方法,以四倍体鲫鲤作为尾鳍成纤维细胞供体,采用化学小分子诱导培养基分三个阶段进行连续诱导,具体操作过程如下:
(1)尾鳍成纤维细胞原代培养:从四倍体鲫鲤的尾鳍中剪取小块鳍条置于磷酸缓冲液(pbs)中,对其进行反复漂洗,用灭过菌的剪刀将组织块剪碎,1200rpm离心3min,离心后再用磷酸缓冲液重悬组织块,二次离心,吸去上清,将组织块均匀地铺在培养皿底,放入28℃、5%co2的二氧化碳培养箱进行培养,2h后加成纤维细胞培养基继续培养;
成纤维细胞培养基的成分包括:体积百分比为2.5%的鲤鱼血清,体积百分比为7.5%的胎牛血清,体积百分比为1%的非必需氨基酸细胞培养添加物,体积百分比为1%的青链双抗,体积百分比1%的l-谷氨酰胺,终浓度为10ng/ml的重组成纤维细胞生长因子,余量为dmem培养基;
(2)尾鳍成纤维细胞传代培养:待细胞长满整个培养皿、融合度达到90%时,用质量浓度为0.25%的胰酶消化后分皿进行传代培养,培养至2-4代,即得到四倍体鲫鲤的尾鳍成纤维细胞(见图2-d0);
(3)多能性干细胞的诱导:用胰酶消化尾鳍成纤维细胞为单细胞后重新接种铺皿,密度为1×105/ml,接种24h后加入第i阶段诱导培养基,第9天换第ii阶段诱导培养基,第11天换第iii阶段诱导培养基,在每个阶段培养时,均每2天更换一次培养基,不进行胰酶消化和传代培养,诱导过程中的四倍体鲫鲤尾鳍成纤维细胞如图2(d2,d8,d10)所示,经人工挑克隆及传代培养后,得到四倍体鲫鲤诱导多能性干细胞;
第i、ii、iii阶段诱导培养基的基础成分包括:体积百分比为10%的血清替代物,体积百分比为7.5%的胎牛血清,体积百分比为2.5%的鲤鱼血清,体积百分比为1%的谷氨酸细胞培养添加物,体积百分比为1%的非必需氨基酸细胞培养添加物,体积百分比为1%的青链双抗,终浓度为0.25mm的丙戊酸钠,终浓度为5μm的tgf-β通路抑制剂,终浓度为2.5μm的单胺氧化酶抑制剂,终浓度为0.025μm的视黄酸受体α激活剂,余量为knockoutdmem培养基;其中:
第i阶段诱导培养基在基础成分的基础上还添加:终浓度为50ng/ml的重组成纤维细胞生长因子、终浓度为10μm的糖原合酶激酶抑制剂3、终浓度为25μm的腺苷酸环化酶激活剂、终浓度为2.5μm的dot1l选择性抑制剂;
第ii阶段诱导培养基在基础成分的基础上还添加:终浓度为12.5ng/ml的重组成纤维细胞生长因子、终浓度为5μm的糖原合酶激酶抑制剂3、终浓度为5μm的腺苷酸环化酶激活剂、终浓度为2.5μm的dot1l选择性抑制剂;
第iii阶段诱导培养基在基础成分的基础上还添加:终浓度为12.5ng/ml的重组成纤维细胞生长因子、终浓度为5μm的糖原合酶激酶抑制剂3、终浓度为5μm的腺苷酸环化酶激活剂、终浓度为0.025μm的s-腺苷基-l-高半胱氨酸水解酶抑制剂、终浓度为0.025μm的甲基转移酶抑制剂、终浓度为2.5μm的组蛋白甲基转移酶dot1l抑制剂。
实施例3:斑马鱼多能性干细胞的诱导
一种本发明的诱导鱼类多能性干细胞的方法,以斑马鱼作为尾鳍成纤维细胞供体,采用化学小分子诱导培养基分三个阶段进行诱导,具体操作过程如下:
(1)尾鳍成纤维细胞原代培养:从斑马鱼的尾鳍中剪取小块鳍条置于磷酸缓冲液(pbs)中,对其进行反复漂洗,用灭过菌的剪刀将组织块剪碎,1200rpm离心3min,离心后再用磷酸缓冲液重悬组织块,二次离心,吸去上清,将组织块均匀地铺在培养皿底,放入28℃、5%co2的二氧化碳培养箱进行培养,2h后加成纤维细胞培养基继续培养;
成纤维细胞培养基的成分包括:体积百分比为2.5%的鲤鱼血清,体积百分比为7.5%的胎牛血清,体积百分比为1%的非必需氨基酸细胞培养添加物,体积百分比为1%的青链双抗,体积百分比1%的l-谷氨酰胺,终浓度为10ng/ml的重组成纤维细胞生长因子,余量为dmem培养基;
(2)尾鳍成纤维细胞传代培养:待细胞长满整个培养皿、融合度达到90%时,用质量浓度为0.25%的胰酶消化后分皿进行传代培养,培养至2~4代,即得到斑马鱼的鱼尾鳍成纤维细胞(见图3-d0);
(3)多能性干细胞的诱导:用胰酶消化斑马鱼尾鳍成纤维细胞为单细胞后重新接种铺皿,密度为1×105/ml,接种24h后加入第i阶段诱导培养基,第9天换第ii阶段诱导培养基,第11天换第iii阶段诱导培养基,在每个阶段培养时,均2天更换一次培养基,不进行胰酶消化和传代培养,诱导过程中的斑马鱼尾鳍成纤维细胞如图3(d2,d8,d20)所示,经人工挑克隆及传代培养后,得到斑马鱼诱导多能性干细胞;
第i、ii、iii阶段诱导培养基的基础成分包括:体积百分比为10%的血清替代物,体积百分比为7.5%的胎牛血清,体积百分比为2.5%的鲤鱼血清,体积百分比为1%的谷氨酸细胞培养添加物,体积百分比为1%的非必需氨基酸细胞培养添加物,体积百分比为1%的青链双抗,终浓度为0.10mm的丙戊酸钠,终浓度为2μm的tgf-β通路抑制剂,终浓度为1μm的单胺氧化酶抑制剂,终浓度为0.01μm的视黄酸受体α激活剂,余量为knockoutdmem培养基;其中:
第i阶段诱导培养基在基础成分的基础上还添加:终浓度为10ng/ml的重组成纤维细胞生长因子、终浓度为4μm的糖原合酶激酶抑制剂3、终浓度为10μm的腺苷酸环化酶激活剂、终浓度为1μm的dot1l选择性抑制剂;
第ii阶段诱导培养基在基础成分的基础上还添加:终浓度为5ng/ml的重组成纤维细胞生长因子、终浓度为2μm的糖原合酶激酶抑制剂3、终浓度为1μm的腺苷酸环化酶激活剂、终浓度为1μm的dot1l选择性抑制剂;
第iii阶段诱导培养基在基础成分的基础上还添加:终浓度为5ng/ml的重组成纤维细胞生长因子、终浓度为2μm的糖原合酶激酶抑制剂3、终浓度为2μm的腺苷酸环化酶激活剂、终浓度为0.01μm的s-腺苷基-l-高半胱氨酸水解酶抑制剂、终浓度为0.01μm的甲基转移酶抑制剂、终浓度为1μm的组蛋白甲基转移酶dot1l抑制剂。
实施例4.鱼类诱导多能性干细胞的鉴定
将实施例1中诱导形成的克隆团细胞进行碱性磷酸酶(ap)染色,染色结果呈阳性(见图4);收集实施例1中得到的锦鲤尾鳍诱导多能性干细胞rna样品,经过rt-pcr鉴定部分多能性基因的表达,oct4、sox2、nanog、lin28和klf17等多能性基因均有表达(见图5);免疫荧光检测锦鲤尾鳍诱导多能性干细胞部分多能性基因的表达,结果显示都为阳性表达(见图6);收集锦鲤诱导多能性干细胞,用细胞膜标记染料pkh26染色后显微注射到斑马鱼胚胎中,经胚胎发育形成嵌合体(见图7)。
综上结果表明,本发明所述的诱导培养基和诱导方法可以成功诱导获得鱼类诱导多能性干细胞。经过多能性的鉴定已经获得了稳定的诱导多能性干细胞系,说明了利用本发明的诱导培养基和诱导方法,可以高效诱导鱼类诱导多能性干细胞系,具有重要的科学价值,为鱼类诱导多能性干细胞的进一步研究提供了很好的材料。
本发明采用的培养基涉及的各组分分别购自:
糖原合酶激酶抑制剂3(chir99021)购自biovision公司,货号为1677-5;
重组成纤维细胞生长因子recombinanthumanfgf-basic(bfgf)购自peprotech公司,货号为100-18b;
腺苷酸环化酶激活剂-毛喉素(forskolin)购自selleck公司,货号为s2449;
s-腺苷基-l-高半胱氨酸水解酶抑制剂(dznep)购自selleck公司,货号为s7120;
甲基转移酶抑制剂(5-aza-dc)购自enzo公司,货号为alx-480-096-m005;
组蛋白甲基转移酶dot1l抑制剂(sgc0946)购自selleck公司,货号为s7079;
血清替代物knockoutserumreplacement(ksr)购自gibco公司,货号为a3181502;
谷氨酸细胞培养添加物(glutamaxtm-i)购自gibco公司,货号为35050061;
非必需氨基酸memnon-essentialaminoacidsneaa购自gibco公司,货号为11140050;
青链双抗(penicillin-streptomycin)购自gibco公司,货号为15070063;
丙戊酸钠(vpa)购自sigma公司,货号为p4543;
tgf-β通路抑制剂(repsox)购自selleck公司,货号为s7223;
单胺氧化酶抑制剂-反苯环丙胺(tranylcypromine)购自sigma公司,货号为1672905;
视黄酸受体α激活剂(am580)购自tocris公司,货号为0760;
dot1l选择性抑制剂(epz004777)购自selleck公司,货号为s7353;
knockoutdmem购自gibco公司,货号为10829018;
胎牛血清(fetalbovineserum)购自gibco公司,货号为10099141。
- 还没有人留言评论。精彩留言会获得点赞!