转录因子组合诱导成纤维细胞转分化为类睾丸间质细胞的方法与流程
本发明属生物医学领域,涉及细胞转分化的过程及其用途,具体涉及利用慢病毒载体表达多种转录因子诱导成纤维细胞转分化为具有雄激素合成分泌功能的类睾丸间质细胞的方法,同时利用这种类睾丸间质细胞移植到雄性睾丸间质内,为治疗雄性性腺机能减退综合征提供新的治疗方法。
背景技术:
睾丸间质细胞是雄性个体睾酮的主要来源,对雄性精子发生、性别分化和第二性征的发育和维持起着至关重要的作用。睾丸间质细胞合成睾酮能力在青春期后随着年龄的增长而逐渐下降。与此同时,环境污染、生活节奏的加快、和人口老龄化等因素使得睾丸间质细胞自身功能障碍引发的雄激素不足或缺乏症,即性腺机能减退(hypogonadism)的发病率逐年升高。传统的雄性激素进行替代治疗对性腺机能减退有一定的作用,但这种治疗要持续终身,副作用十分显著,容易出现肝脏功能损害、精子生成减少、前列腺癌等并发症,有副作用的同时还给患者带来极大的经济压力(Wang等,J.Androl.,2009,32(1):1-10;Chen等,Endocrindogy,2002,143(5):1637-1642)。
随着组织工程技术的发展,国内外专家尝试开展了近亲供体移植术或干细胞移植术治疗性腺机能减退,取得了较好的效果。但睾丸间质细胞仅存于睾丸,数量有限(仅占睾丸细胞总量的2-5%),虽然对睾丸间质细胞已经有了较为成熟的分离方法,但分离过程中的细胞损失不可避免,且成年睾丸间质细胞不能再进行有丝分裂,未成熟的睾丸间质细胞在后续培养中又会失去其分裂特性,这些因素加剧了睾丸间质种子细胞的稀缺。此外,这种移植普遍依靠同种异体供应,患者术后需要长期服用免疫抑制剂,副作用大的同时还承受着一系列伦理学争议,极大地限制了该技术在临床上的广泛应用。
尽管间充质干细胞或胚胎干细胞也可用于诱导分化为能产生类固醇的类睾丸间质细胞,但要将这些细胞用于临床研究仍然存在着以下几方面的缺陷:(1)诱导干细胞或者iPSCs(induced pluripotent stem cells,即,诱导的多能干细胞)分化为睾丸间质细胞的分化效率和纯度都很低,且得到的细胞生成类固醇的能力非常有限;(2)胚胎干细胞面临免疫排斥、伦理道德问题及植入部位形成畸胎瘤风险;(3)间充质干细胞表型不均一,其鉴定无明确标准,分离纯化及大量扩增面临技术困难;(4)虽然iPSCs规避了胚胎干细胞带来的伦理问题,但是其来源的可靠性和技术安全性仍是临床应用中所面临的最大障碍。
成体细胞转分化技术与干细胞定向分化技术相比具有诱导时间短,诱导效率高,细胞致瘤性低,且转分化过程不需要依赖于细胞的分裂等明显的优势,因而被认为是未来人类再生医学的重要的技术手段。该技术能直接将体细胞转分化为其它类型细胞,为再生医学提供了极其宝贵的资源,它使得用非胚胎材料获得病人特异的任何谱系的细胞成为可能。近年来已经有研究表明,转录因子能被诱导成纤维细胞转分化多种类型的细胞,包括心肌细胞、神经细胞、肝样细胞、软骨细胞等,这些都充分体现了转分化技术在再生医学领域的巨大潜能。如果能将成纤维细胞转分化为具雄激素合成和分泌功能的类睾丸间质细胞,则可同时解决临床细胞治疗中睾丸间质细胞移植种子细胞来源不足以及免疫排斥两个实际问题。这是目前本领域研究的焦点。但是,目前还没有关于利用何种转录因子或转录因子组合能够诱导类睾丸间质细胞的相关报道。
技术实现要素:
鉴于现有技术的缺点,本发明主要解决的技术问题是提供一种利用转录因子组合诱导成纤维细胞转分化为类睾丸间质细胞的方法。通过该方法获得的类睾丸间质细胞(Induced Leydig-like cells,iLCs)可用于治疗雄性性腺机能缺乏综合征。
在第一方面,本发明提供一种利用转录因子组合诱导成纤维细胞转分化为类睾丸间质细胞的方法,所述方法包括将所需转录因子分别克隆至慢病毒载体,包装成病毒颗粒并转染至成纤维细胞;利用过表达转录因子的方法诱导成纤维细胞转分化为诱导型睾丸间质细胞。
本领域技术人员应该理解,用于本发明的成纤维细胞可以从相应地动物或人体中提取(主要是胚胎成纤维细胞和成体成纤维细胞),或者通过基因工程方法诱导胚胎干细胞或者iPSCs分化所得的成纤维细胞(Yang Y,et al.Stem cells and development,2015,24(4):459-70;Sonoyama T,et al.Endocrinology,2012,153(9):4336-45)。可用的成纤维细胞可以来源于皮肤,例如鼠尾或者人皮肤的成纤维细胞,也可以是内脏成纤维细胞(例如,心脏等的成纤维细胞)或者是胚胎成纤维细胞。
用于本发明的转录因子可以从相应的动物或者人体细胞中提取,来源可以包括,但不限于,人、小鼠和大鼠。而这些转录因子的核苷酸序列可以按照Itatura等人所述的方法(Science,1977,198:1056-1063)来合成,也可以利用本领域已知的技术从宿主基因组中获得和鉴定基因。本领域已知的技术包括进行基因的合成、克隆和表达载体的构建、DNA序列分析及鉴定、宿主细胞的转化和培养以及表达产物的分离鉴定等操作(参见Sambrook et al.,Molecular Cloning:A Laboratory Manual,Cold Spring Harbor Laboratory Press,Cold Spring Harbor,NY,1989)。
用于本发明的转录因子选自Dmrt1、Nr0b1、Sp1、Wt1、Nr4a1、Nr5a2、AP1、Creb1、Smad3、Nr5a1或Gata4。优选地,用于本发明的转录因子是选自由Dmrt1、Nr0b1、Sp1、Wt1、Nr4a1、Nr5a2、AP1、Creb1、Smad3、Nr5a1和Gata4组成的组中的部分或全部转录因子的组合。所述转录因子组合可以为Dmrt1、Nr0b1、Sp1、Wt1、Nr4a1、Nr5a2、AP1、Creb1、Smad3、Nr5a1和Gata4的组合;Dmrt1、Nr0b1、Sp1、Wt1、Nr4a1、Nr5a2、AP1、Nr5a1和Gata4的组合;Dmrt1、Sp1、Wt1、AP1、Nr5a1和Gata4的组合;Dmrtl、Wt1、AP1、Nr5a1和Gata4的组合;Dmrt1、Sp1、Wt1、Nr5a1和Gata4的组合;Dmrt1、Sp1、AP1、Nr5a1和Gata4的组合;Dmrt1、Nr5a1、Gata4和Wt1的组合或者Nr5a1、Gata4、Dmrt1和AP1的组合;或Dmrt1、Gata4和Nr5a1的组合。
最优的转录因子组合为Dmrt1、Nr5a1和Gata4的组合;其次是Dmrt1、Nr5a1、Gata4和Wt1的组合或者Nr5a1、Gata4、Dmrt1和AP1的组合;再次是Dmrt1、Sp1、Wt1、AP1、Nr5a1和Gata4;最后为11种因子的组合,即Nr0b1、Sp1、Wt1、Nr4a1、Nr5a2、AP1、Creb1、Smad3、Nr5a1和Gata4的组合。
本发明中所述的转录因子Dmrt1(Doublesex and Mab-3Related Transcription factor 1)核苷酸序列为SEQ ID Nos:1-3;
本发明中所述的转录因子Nr0b1(nuclear receptor subfamily 0group B member 1)核苷酸序列为SEQ ID Nos:4-6;
本发明中所述的转录因子Sp1(transcription factor Sp1)核苷酸序列为SEQ ID Nos:7-9;
本发明中所述的转录因子Wt1(Wilms tumor 1)核苷酸序列为SEQ ID No:10-12s;
本发明中所述的转录因子Nr4a1(nuclear receptor subfamily 4group A member 1)核苷酸序列为SEQ ID Nos:13-15;
本发明中所述的转录因子Nr5a2(nuclear receptor subfamily 4group A member2)核苷酸序列为SEQ ID Nos:16-18;
本发明中所述的转录因子AP1(Jun proto-oncogene)核苷酸序列为SEQ ID Nos:19-21;
本发明中所述的转录因子Creb1(cAMP responsive element binding protein 1)核苷酸序列为SEQ ID Nos:22-24;
本发明中所述的转录因子Smad3(SMAD family member 3)核苷酸序列为SEQ ID Nos:25-27;
本发明中所述的转录因子Nr5a1(nuclear receptor subfamily 5,group A,member 1)核苷酸序列为SEQ ID Nos:28-30;
本发明中所述的转录因子Gata4(GATA binding protein 4)核苷酸序列为SEQ ID Nos:31-33。
在优选的实施方案中,本发明涉及一种利用转录因子组合诱导成纤维细胞转分化为类睾丸间质细胞的方法,该方法包括以下步骤:
1)分离并纯化用于病毒载体感染的成纤维细胞;这些成纤维细胞可以来源于皮肤(鼠尾或者人皮肤)、内脏成纤维细胞(心脏等)或者胚胎成纤维细胞;
2)获得用于成纤维细胞转分化为类睾丸间质细胞的11种转录因子的核苷酸序列,并分别克隆到慢病毒表达载体pLVX-EF1α-IRES-ZsGreen1(Cat:#631982,Clonetch,大连宝生物工程有限公司,中国),该重组载体可以表达绿色荧光作为报告基因;
3)将11种表达转录因子的慢病毒载体分别转染293T细胞(Cat:#632180,Clonetch,大连宝生物工程有限公司,中国)中,获得完整包装的病毒颗粒;
4)构建表达樱桃红荧光报告蛋白(cherry)的小鼠胚胎成纤维细胞株;首先利用链式聚合酶反应(PCR)获得胆固醇侧链裂解酶基因cyp11a1(cytochrome P450,family 11,subfamily a,polypeptide 1)的启动子序列和编码樱桃红荧光报告蛋白基因的融合DNA片段(SEQ ID No:34),并将其克隆到慢病毒载体(pEZX-LvPM02,购自GeneCopoeia Inc.,USA)中;获得完整包装的病毒颗粒后,转染成纤维细胞,利用嘌呤霉素筛选1周后,挑选阳性克隆并用常规的细胞培养方法获得含报告基因的成纤维细胞株;
5)将3)获得的包装完整的11种表达转录因子的慢病毒颗粒,等量同时转染4)种获得的含报告基因的成纤维细胞株;培养3-7天后,利用流式细胞仪分析表达红色荧光阳性细胞的百分比,并利用I-125放射性酶联免疫方法检测培养细胞上清中睾酮的含量;
6)将3)获得的包装完整的11种表达转录因子的慢病毒颗粒,组成11种转录因子组合,每个组合内分别含有10种转录因子(即每种组合缺失一种不同的转录因子);将这些转录因子组合,按照5)所述的方法感染含报告基因的成纤维细胞,然后分析表达红色荧光的阳性细胞的百分比及细胞上清中睾酮的含量;将这些数据与5)中获得的数据进行对比和统计分析;对于存在显著差异的结果则表明,缺失的转录因子在成纤维细胞转分化为类睾丸间质细胞过程中具有重要的调控作用;
7)将6)中没有显著差异调控作用的转录因子排除(共有5种),然后将剩余的转录因子重新组合(共6种),然后按照6)的方法继续筛选,以睾酮产量作为分析指标,最终获得合成和分泌睾酮量最高的转录因子组合;
8)按照7)所述的方法,最优的转录因子组合为Dmrt1、Nr5a1和Gata4;其次是Dmrt1、Nr5a1、Gata4、Dmrt1和Wt1或者Nr5a1、Gata4、Dmrt1和AP1;再次是Nr5a1、Gata4、Dmrt1、Sp1、Wt1和AP1;最后为11种因子组合Nr0b1、Sp1、Wt1、Nr4a1、Nr5a2、AP1、Creb1、Smad3、Nr5a1和Gata4;
9)按照5)的方法,将最优的转录因子组合转染按1)方法分离得到成纤维细胞,再培养3-10天,利用分子生物学方法,如实时荧光定量PCR、蛋白杂交、基因芯片等,检测这些转分化细胞中睾酮合成和分泌通路中各必需基因及蛋白的表达情况,并利用I-125放射性酶联免疫方法检测培养细胞上清中睾酮的产量;
10)将转分化后的细胞用于治疗雄性性腺机能低下相关疾病。
本领域技术人员应该理解,可以将用来诱导成纤维细胞转分化为类睾丸间质细胞的试剂包装成试剂盒。因此,在本发明第二方面,本发明还提供一种用于诱导成纤维细胞转分化为类睾丸间质的试剂盒,所述试剂盒包括用于获得成纤维细胞的试剂、慢病毒载体和转录因子的组合。其中所述转录因子来源于人、小鼠或大鼠,并且所述转录因子的组合为选自由Dmrt1、Nr0b1、Sp1、Wt1、Nr4a1、Nr5a2、AP1、Creb1、Smad3、Nr5a1和Gata4组成的组中的部分或全部转录因子的组合。对于转录因子的组合的选择与上述诱导成纤维细胞转分化为类睾丸间质的方法对于转录因子组合的选择相同。所用的成纤维细胞为胚胎成纤维细胞、内脏成纤维细胞或皮肤成纤维细胞。
在第三方面,本发明提供由本发明第一方面的方法诱导分化的类睾丸间质细胞,所述类睾丸间质细胞可以用于治疗雄性性腺机能缺乏综合征。
在第四方面,本发明提供由本发明第一方面的方法诱导分化的类睾丸间质细胞在制备用于治疗雄性性腺机能缺乏综合征的试剂盒中的应用。
在第五方面,本发明提供一种治疗雄性性腺机能缺乏综合征的方法,所述方法包括向有此需要的患者的两侧睾丸的睾丸间质内注射有效量的由本发明第一方面的方法诱导分化的类睾丸间质细胞。
在第六方面,本发明提供一种用于治疗雄性性腺机能缺乏综合征的试剂盒,所述试剂盒包括由本发明第一方面的方法诱导分化的类睾丸间质细胞。
睾丸间质细胞(Leydig cell,LC)是哺乳动物睾丸间质中最主要的一种细胞,是雄性体内雄激素合成和分泌的最主要来源。已有研究显示,睾丸间质细胞的增殖分化异常、数量减少及激素合成分泌功能减退都会导致体内雄激素缺乏,进而引起多种雄性生殖疾病的发生。
所述的雄性性腺机能低下综合征包括,但不限于先天性性腺机能减退、衰老所致性腺机能减退、及睾丸间质细胞损伤而造成的性腺机能低下。
利用转分化的类睾丸间质细胞治疗雄性性腺机能缺乏综合征的步骤如下:
1)利用流式细胞仪将转分化的类睾丸间质细胞分选出来并扩大培养;
2)将细胞用胰蛋白酶消化后,磷酸缓冲液(PBS)洗涤和重悬,调整密度至每毫升1-5×106个;
3)将动物或者人麻醉后,将其平躺于实验台,露出两侧睾丸。每侧睾丸用微量注射器将106-107个细胞注射到睾丸间质中,并于移植后7-60天取血清检测血清睾酮含量。
综上所述,本发明提供下述技术方案:
1.一种诱导成纤维细胞转分化为类睾丸间质细胞的方法,其特征在于将所需转录因子分别克隆至慢病毒载体,包装成病毒颗粒并转染至成纤维细胞;利用过表达转录因子的方法诱导成纤维细胞转分化为诱导型睾丸间质细胞,
其中所述转录因子来源于人、小鼠或大鼠,并且所述转录因子为选自由Dmrt1、Nr0b1、Sp1、Wt1、Nr4a1、Nr5a2、AP1、Creb1、Smad3、Nr5a1和Gata4组成的组中的部分或全部转录因子的组合。
2.根据第1项所述的方法,其中所述转录因子组合为Dmrt1、Gata4和Nr5a1的组合。
3.根据第1项所述的方法,其中所述转录因子组合为Dmrt1、Nr0b1、Sp1、Wt1、Nr4a1、Nr5a2、AP1、Nr5a1和Gata4的组合。
4.根据第1项所述的方法,其中所述转录因子组合为Dmrt1、Sp1、Wt1、AP1、Nr5a1和Gata4的组合。
5.根据第1项所述的方法,其中所述转录因子组合为Dmrt1、Wt1、AP1、Nr5a1和Gata4的组合。
6.根据第1项所述的方法,其中所述转录因子组合为Dmrt1、Sp1、Wt1、Nr5a1和Gata4的组合。
7.根据第1项所述的方法,其中所述转录因子组合为Dmrt1、Sp1、AP1、Nr5a1和Gata4的组合。
8.根据第1项所述的方法,其中所述转录因子组合为Dmrt1、Gata4、Nr5a1和AP1的组合或Dmrt1、Gata4、Nr5a1和Wt1的组合。
9.根据第1项所述的方法,其中所述转录因子组合为Dmrt1、Nr0b1、Sp1、Wt1、Nr4a1、Nr5a2、AP1、Creb1、Smad3、Nr5a1和Gata4的组合。
10.根据第1项所述的方法,其中所述成纤维细胞为胚胎成纤维细胞、内脏成纤维细胞或皮肤成纤维细胞。
11.一种用于诱导成纤维细胞转分化为类睾丸间质的试剂盒,所述试剂盒包括用于获得成纤维细胞的试剂、慢病毒载体和转录因子的组合,其中所述转录因子来源于人、小鼠或大鼠,并且所述转录因子的组合为选自由Dmrt1、Nr0b1、Sp1、Wt1、Nr4a1、Nr5a2、AP1、Creb1、Smad3、Nr5a1和Gata4组成的组中的部分或全部转录因子的组合。
12.根据第11项所述的试剂盒,其中所述转录因子组合为Dmrt1、Gata4和Nr5a1的组合。
13.根据第11项所述的试剂盒,其中所述转录因子组合为Dmrt1、Nr0b1、Sp1、Wt1、Nr4a1、Nr5a2、AP1、Nr5a1和Gata4的组合。
14.根据第11项所述的试剂盒,其中所述转录因子组合为Dmrt1、Sp1、Wt1、AP1、Nr5a1和Gata4的组合。
15.根据第11项所述的试剂盒,其中所述转录因子组合为Dmrt1、Wt1、AP1、Nr5a1和Gata4的组合。
16.根据第11项所述的试剂盒,其中所述转录因子组合为Dmrt1、Sp1、Wt1、Nr5a1和Gata4的组合。
17.根据第11项所述的试剂盒,其中所述转录因子组合为Dmrt1、Sp1、AP1、Nr5a1和Gata4的组合。
18.根据第11项所述的试剂盒,其中所述转录因子组合为Dmrt1、Gata4和Nr5a1的组合。
19.根据第11项所述的试剂盒,其中所述转录因子组合为Dmrt1、Nr0b1、Sp1、Wt1、Nr4a1、Nr5a2、AP1、Creb1、Smad3、Nr5a1和Gata4的组合。
20.根据第11项所述的试剂盒,其中所述试剂盒所用的成纤维细胞为胚胎成纤维细胞、内脏成纤维细胞或皮肤成纤维细胞。
21.一种治疗雄性性腺机能缺乏综合征的方法,所述方法包括向有此需要的患者的两侧睾丸的睾丸间质内注射有效量的第1-10项中任一项的方法诱导分化的类睾丸间质细胞。
22.一种治疗雄性性腺机能缺乏综合征的试剂盒,所述试剂盒包括由第1-10项中任一项的方法诱导分化的类睾丸间质细胞。
本发明较传统干细胞诱导分化方法体现出了两个明显优势:1)耗时短,在成纤维细胞中过表达转录因子后第3天,即可在宿主细胞中检测到雄激素合成关键酶基因的表达,其表达量及合成睾酮的能力随着培养时间的延长不断增加,到第10天后达到稳定。整个分化过程显著优于传统iPSCs诱导分化所需时间(20天以上);2)规避了畸胎瘤的风险及伦理问题。由于转分化过程中细胞数量没有明显增殖,且分化过程并不经过多能干细胞阶段,因而规避了畸胎瘤的风险及医学伦理等问题;3)供体细胞可来源于受用人自身。
附图说明
从下面结合附图的详细描述中,本发明的上述特征和优点将更明显,其中:
图1、PCR扩增11种转录因子基因的琼脂糖凝胶电泳分析。M,DNA分子量梯度;1,Dmrt1;2,Nr0b1;3,Sp1;4,Wt1;5,Nr4a1;6,Nr5a2;7,AP1;8,Creb1;9,Smad3;10,Nr5a1;11,Gata4。
图2、11种转录因子组成的组合诱导胚胎成纤维细胞转分化为类睾丸间质细胞。(A)转分化后细胞形态;(B)转分化后细胞合成和分泌睾酮的含量;(C、D)转分化后流式分析结果。
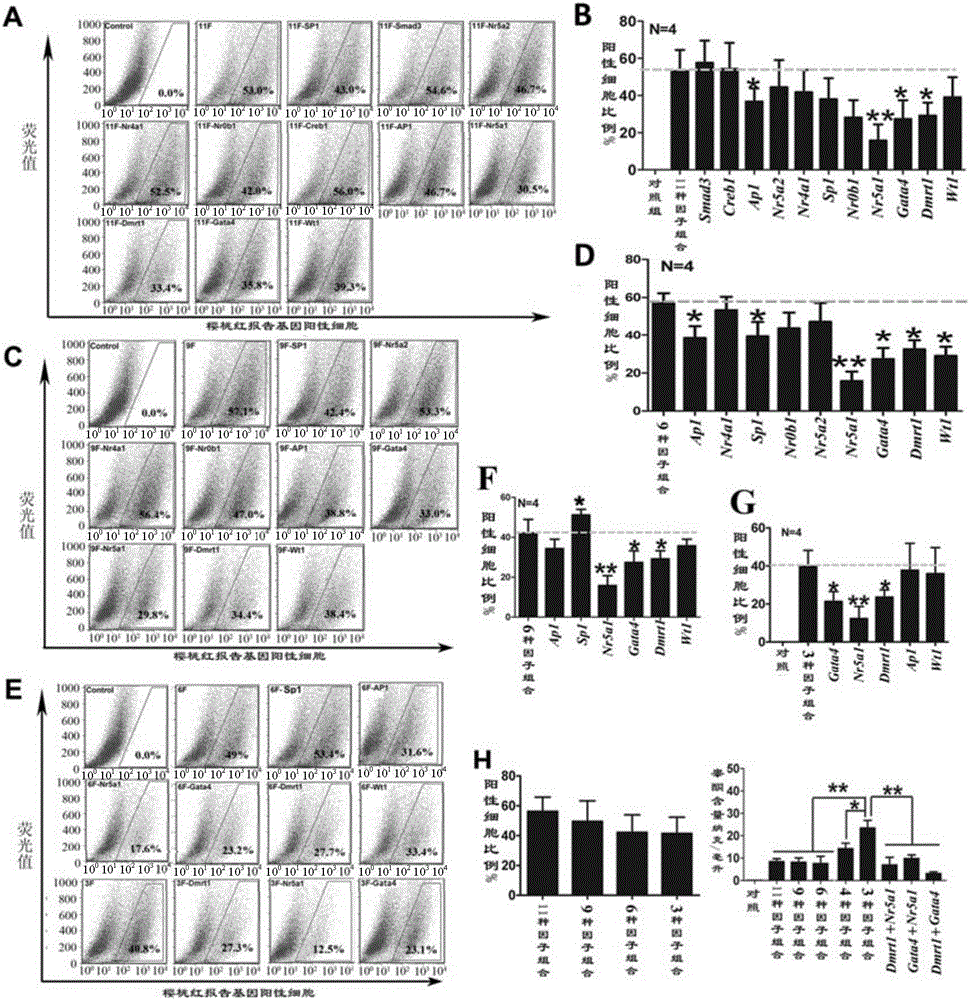
图3、诱导成纤维细胞转分化的转录因子组合筛选结果分析。(A,C,E)不同转录因子组合诱导成纤维细胞转分化后的流式分析结果;(B,D,F,G,H)流式分析后报告基因阳性细胞率统计结果图;(I)不同转录因子组合诱导后细胞合成和分泌睾酮的情况;数据以均数±标准差(Mean±SD)表示,P<0.05用*表示,P<0.01用**表示,P<0.001用***表示;N=4代表本数据是由4次重复实验结果分析得到。
图4、类睾丸间质细胞的雄激素合成相关蛋白表达及睾酮合成变化趋势。(A)转分化细胞中睾丸间质细胞标记蛋白的免疫荧光结果;(B)蛋白杂交实验结果;(C)类睾丸间质细胞合成睾酮产量的分析。
图5、类睾丸间质细胞移植后对雄激素低下模型大鼠血清睾酮的恢复分析。(A)细胞移植操作流程;(B)细胞移植前后睾丸切片苏木精-伊红染色分析;(C)EDS造模后7天血清睾酮变化;(D)细胞移植4、14、21、28天后模型大鼠血清睾酮含量的变化;(E)类睾丸间质细胞移植后大鼠体重变化;(F)细胞移植后大鼠睾丸重量变化;数据以均数±标准差表示,P<0.05用*表示,P<0.01用**表示,P<0.001用***表示;ns代表组间数据没有显著性差异。
图6、类睾丸间质细胞移植14天和28天后在大鼠睾丸中的分布及睾丸间质细胞特异性蛋白表达分析。
缩略词:GFP代表绿色荧光蛋白;
Merge代表两种荧光重合图;
CYP11A1代表胆固醇侧链裂解酶;
CYP17A1代表17α-羟化酶,17、20-裂解酶;
StAR代表类固醇激素合成急性调节蛋白;
HSD3B代表羟基-δ-5-类固醇脱氢酶,3β-固醇δ异构酶;
HSD17b3代表17β-羟基类固醇脱氢酶3;
LHCGR代表促黄体生成激素受体;
EDS代表的乙烷二甲烷硫砜;
control代表对照细胞;
iLCs代表转分化细胞;
MEFs代表成纤维细胞;
testis代表动物睾丸;
model代表模型动物处理组
序列表说明
为了清楚起见,以下对后附序列表中各个序列作简要说明:
表1.本发明中所述转录因子/融合蛋白的序列号及其相关信息
具体实施方式
以下通过实施例来进一步阐明本发明。但是应该理解,所述实施例只是举例说明的目的,并不意欲限制本发明的范围和精神。需要说明的是,本领域技术人员应该理解或者根据已有的技术方法,本发明及下列实施例中所用的试剂、酶类、PCR反应所需引物序列等除特别说明外,均为可从试剂公司商购分析纯级别的试剂、酶类及自行设计的引物。
实施例1、11种转录因子慢病毒表达载体的构建及病毒包装
首先,利用RNA抽提试剂盒(Cat.#:74134,Qiagen,购自广州健仑生物科技有限公司,中国)从小鼠睾丸中获得总RNA。然后再利用PrimeScriptTM II 1st Strand cDNA Synthesis Kit(Cat.#:6210A,大连宝生物科技有限公司,中国)合成cDNA,并置于-80℃保存。由华大基因公司分别设计并合成用于扩增转录因子Dmrt1、Nr0b1、Sp1、Wt1、Nr4a1、Nr5a2、AP1、Creb1、Smad3、Nr5a1和Gata4基因的上下游引物,并在正向与反向引物两端分别引入酶切位点(下划线部分,表2)。
按照常规的PCR方法,以小鼠睾丸cDNA为模板,添加上下游引物(表2),然后设立PCR反应条件,94℃变性3min后进入循环,循环参数为94℃变性30秒,55℃退火15秒,72℃延伸30秒,共30个循环。电泳检测目的DNA片段(图1)。按照已有的方法建立标准的限制性内切酶消化体系,然后利用BamH I(购自New England Biolabs,Inc.,USA)和EcoR I(购自New England Biolabs,Inc.,USA)处理并回收这些目的DNA片段。然后,与利用相同限制性内切酶处理并回收的慢病毒表达载体pLVX-EF1α-IRES-ZsGreen1相连,分别构建出重组表达质粒pLVX-Dmrt1、pLVX-Nr0b1、pLVX-Sp1、pLVX-Wt1、pLVX-Nr4a1、pLVX-Nr5a2、pLVX-AP1、pLVX-Creb1、pLVX-Smad3、pLVX-Nr5a1和pLVX-Gata4(具体操作参考Sambrook et al.,Molecular Cloning:A Laboratory Manual,Cold Spring Harbor Laboratory Press,Cold Spring Harbor,NY,1989)。利用相同的方法将编码cyp11a1-mcherry的目的DNA片段(SEQ ID No:34)用限制性内切酶消化后,连接到相同处理的慢病毒表达载体pEZX-LvPM02(购自GeneCopoeia Inc.,USA)中,构建出重组表达质粒pEZX-cyp11a1-mcherry。
复苏并培养293T细胞(Cat:#632180,购自大连宝生物工程有限公司,中国),然后将1.5×106个293T细胞铺在10cm2的培养皿上,加入10毫升含有10%胎牛血清的DMEM(Dulbecco′s Modified Eagle Medium)培养基(Cat.#:12100-046,invitrogen Inc.,USA),于37℃含5%二氧化碳的培养箱中培养48小时。按照慢病毒包装试剂盒(Cat.#:631247,Lenti-XTM HTX Packaging System,Clontech Inc.USA)操作说明进行慢病毒包装。简言之,在无菌的聚丙烯管中,将2.5μg的慢病毒表达质粒和5.0μl(0.5μg/μl)Lenti-Pac HIV混合物(Cat.#:HPK-LvTR-20,GeneCopoeia Inc.,USA)稀释到200μl的Opti-MEMI溶液(Cat.#:31985-062,invitrogen Inc.,USA)中,室温孵育25分钟后形成复合物。将该复合物直接添加到含有293T细胞的培养皿中,37℃孵育过夜(12小时)。更换新鲜DMEM培养基(Cat.#:12100-046,invitrogen Inc.,USA)并继续放回二氧化碳培养箱中培养48-72小时。用15毫升离心管收集含有病毒的培养基,500xg离心10分钟,收集上清并利用PCR方法检测慢病毒的滴度后,分装并储存在-80℃中备用。
实施例2、用于转分化的胚胎成纤维细胞及成体成纤维细胞的分离
为了获得胚胎成纤维细胞(mouse embryonic fibroblasts,MEFs),首先处死怀孕12.5天-14.5天的孕鼠,然后,用剪刀切开腹部和子宫,取出胚胎。再用无菌镊子剔除胚胎周围的包膜、胚胎的四肢、头及内脏。磷酸缓冲液清洗后将胚胎组织块转移至青霉素瓶中用剪刀绞碎,加入2毫升胰酶,37℃孵育10分钟。250xg离心5分钟,弃上清,用含有10%牛血清和抗生素的DMEM培养基(Cat.#:12100-046,invitrogen Inc.,USA)重悬细胞,并接种到培养皿中;培养24小时后,更换新鲜DMEM培养基;待细胞长满,可收获并冻存于液氮中。
对于成体成纤维细胞的分离,本发明采用小鼠尾尖成纤维细胞(Tail-tip fibroblasts,TTFs)。首先,剪取成年小鼠尾尖,磷酸缓冲液冲洗。用注射器针头,将表皮层和真皮层剥离后,将剩余部分用剪刀绞成1cm3左右的组织块。将组织块转移至明胶包被的培养皿中,并在培养皿中加入6毫升DMEM培养基中培养5天。弃旧培养基,磷酸缓冲液洗涤两次后,胰酶消化1分钟,并吹打成细胞悬液。将细胞悬液收集至15毫升离心管中,250xg离心5分钟。弃上清,加入新鲜培养基培养至慢病毒转化实验。
实施例3、构建表达报告基因cyp11a1-mcherry的小鼠成纤维细胞株(cyp11a1-mcherry-Fibroblasts)
从实施例1中获得足够数量的慢病毒质粒pEZX-cyp11a1-mcherry,然后将1×108U滴度的慢病毒加入到含有1×106个MEFs或者TTFs(实施例2分离)的培养皿中并培养24小时。弃去含病毒的DMEM培养基(Cat.#:12100-046,invitrogen Inc.,USA),更换新鲜DMEM培养基,继续培养72小时后,加入终浓度为2微克/毫升(μg/ml)的嘌呤霉素进行筛选,连续筛选1周(图2A)。随机挑取阳性克隆进行扩增,用PCR及蛋白杂交等分子生物学方法进行验证。
实施例4、转录因子Dmrt1、Nr0b1、Sp1、Wt1、Nr4a1、Nr5a2、AP1、Creb1、Smad3、Nr5a1和Gata4组合诱导小鼠胚胎成纤维细胞转分化为睾丸间质细胞
按照实施例3中,将1×106个含有报告基因的成纤维细胞(cyp11a1-mcherry-Fibroblasts)接种到新鲜DMEM培养基中。培养72小时后,将11种转录因子慢病毒颗粒按照等质量比例混合(所有病毒颗粒的总质量浓度为10微克/毫升),然后加入到细胞培养基中感染培养24小时。去掉含病毒的培养基,更换新鲜DMEM培养基继续培养7天。胰酶消化,利用流式细胞仪检测能表达樱桃红报告基因的阳性细胞比例,同时,利用放射性酶联免疫方法检测转染后细胞上清中睾酮的含量(Liu et al.,Journal of steriod biochemistry and molecular biology,2014,144:483-91)。
实验结果表明,在含有报告基因的成纤维细胞(cyp11a1-mCherry-fibroblasts)加入全部11个转录因子感染后,表达樱桃红报告基因的阳性细胞比例为53%(图2C、D),且这些阳性细胞具有合成和分泌睾酮的能力,其平均浓度达到8.46纳克/毫升(ng/ml)(图2B)。这个结果也提示,这11个转录因子组成的组合可以诱导成纤维细胞转分化为具合成分泌睾酮能力的类睾丸间质细胞。
实施例5、促进成纤维细胞转分化为类睾丸间质细胞的最优转录因子组合的筛选
通过逐一排除法,将不显著影响表达樱桃红报告基因阳性细胞的百分比或睾酮合成产量的转录因子排除。对11种转录因子进行重新组合,每个组合内分别含有10种转录因子(即每种组合缺失一种不同的转录因子),然后转染含有报告基因的成纤维细胞株。培养3-10天后,利用流式细胞仪分析表达樱桃红报告基因阳性细胞的比例及通过放射性酶联免疫方法检测培养基上清睾酮的含量。
第一轮筛选结果显示,在含有11种转录因子的组合中去掉Smad3和Creb1不影响表达樱桃红报告基因阳性细胞的比例及细胞合成睾酮的能力,因此,将Smad3和Creb1作为非必需的因子而排除(图3A,B)。
第二轮筛选结果显示,在9因子中删除Nr5a2、Nr4a1和Nr0b1也不会显著的影响表达樱桃红报告基因阳性细胞的百分比及细胞合成睾酮的能力,因此,将Nr5a2、Nr4a1和Nr0b1也作为非必须的转录因子从9个因子中排除,而余下的6个因子保留作下一轮筛选(图3C,D)。
第三轮筛选结果显示,在6因子中删除SP1、AP1或Wt1同样不会显著影响樱桃红报告基因阳性细胞的百分比及细胞合成睾酮的能力,而分别删除Dmrt1、Gata4或Nr5a1可显著影响表达樱桃红报告基因阳性细胞平均百分比,使其从49%分别降至27.7%、23.2%及17.6%。而Dmrt1、Gata4和Nr5a1共同感染成纤维细胞后表达樱桃红报告基因细胞的百分比平均则为40.8%(图3E);而该组合转分化后的细胞培养上清中睾酮平均浓度达到23.4纳克/毫升(ng/ml),与6因子及11因子相比,分别上调了3.1倍及2.76倍。
由此可见,Dmrt1、Gata4和Nr5a1组合为成纤维细胞转分化为类睾酮间质细胞的最优转录因子组合(图3E-G)。在这3因子中加入AP1或Wt1均不会显著增加樱桃红报告基因阳性细胞的百分比,但能提高转分化细胞合成睾酮的能力(图3G、H、I)。因此,Dmrt1、Gata4、Nr5a1和AP1的组合或Dmrt1、Gata4、Nr5a1和Wt1的组合也是具有显著促进成纤维细胞转分化为具睾酮合成能力的类睾丸间质细胞的能力。
实施例6、类睾丸间质细胞表达睾丸间质细胞特异性标记蛋白及睾酮合成能力分析
免疫荧光、Western鉴定转分化后的细胞是否表达Leydig细胞关键蛋白,结果显示,转分化后的细胞表达胆固醇侧链裂解酶(cytochrome P450,family 11,subfamily a,polypeptide 1,Cyp11a1)、类固醇激素合成急性调节蛋白(Steroidogenic acute regulatory protein,StAR)、羟基-δ-5-类固醇脱氢酶,3β固醇δ异构酶1(hydroxy-delta-5-steroid dehydrogenase,3beta-and steroid delta-isomerase 1,hsd3b1)、17β-羟基类固醇脱氢酶3(hydroxysteroid(17-beta)dehydrogenase 3,hsd17b3)及促黄体生成激素受体蛋白(Luteinizing hormone receptor,LHCGR)(图4A),蛋白杂交实验进一步证实了这些结果(图4B)。对成纤维细胞及转分化细胞的睾酮合成能力进行分析,结果显示,转染2天后,转分化细胞的培养上清中即可检测到睾酮,且睾酮浓度随着培养时间的延长而逐渐升高,第10天达到顶峰(图4C)。而作为对照,成纤维细胞既不能表达睾丸间质细胞特异性蛋白,也不具有合成睾酮功能(图4C)。
实施例7、建立了成体睾丸间质细胞“敲除”鼠模型
成年大鼠或者小鼠睾丸含有大量的成体睾丸间质细胞,这些细胞能大量合成和分泌雄性激素。按照90毫克/公斤体重剂量,在雄性鼠(购自广东省医学动物实验中心,12周龄)腹腔注射乙烷二甲烷硫砜(Ethane Dimefhane sulfonaft,EDS)。注射7天后,鼠睾丸中所有成熟睾丸间质细胞(ALCs)会发生凋亡,而动物体内血清睾酮含量将下降至放射性同位素酶联免疫检测方法的下限。这种成体睾丸间质细胞“敲除”动物可以用作研究先天性性腺机能减退、衰老所致性腺机能减退、及睾丸间质细胞损伤而造成的性腺机能低下等疾病的模型。
实施例8、移植类睾丸间质细胞可提升睾丸间质细胞“敲除”鼠的血清睾酮至正常水平
转分化的类睾丸间质细胞在动物体内用于恢复雄激素低下模型鼠血清睾酮的实验过程如图5A所示。简言之,首先在雄性大鼠腹腔注射EDS进行造模,造模7天后进行细胞移植。将转分化的类睾丸间质细胞用磷酸缓冲液洗涤重悬,调整细胞密度为每毫升1×107个。将模型鼠用戊巴比妥钠麻醉后,将其平躺于实验台,露出两侧睾丸。用75%酒精溶液擦拭睾丸外皮肤,然后,用微量注射器取100万个类睾丸间质细胞注射入睾丸间质中。注射后留针5分钟,再继续注射另一侧睾丸。分别在注射后0天,14天,21天,28天取血清及组织样品进行检测。
实验结果显示,细胞移植后7天,模型组睾丸间质细胞急剧减少,而曲细精管中的细胞无显著变化,说明EDS可选择性地促进睾丸间质细胞发生凋亡。而移植的成纤维细胞(MEFs)及类睾丸间质细胞(iLCs)能在模型鼠睾丸间质中均匀分布(图5B)。血清睾酮检测结果表明,移植后7天,模型组动物的血清睾酮显著下降(图5C)。而类睾丸间质细胞移植14天后,检测结果显示,模型鼠的血清睾酮开始上升,21天时恢复至正常水平的50%,而28天后基本恢复到正常水平,而成纤维细胞移植组及模型组的血清睾酮水平未见明显提升(图5D)。
由于睾酮对雄性体重及睾丸发育有着重要的影响,因此对细胞移植前后大鼠体重及睾丸称重检测发现,血清睾酮低下会显著导致大鼠的体重及睾丸重量减轻。类睾丸间质细胞移植可促进体重及睾丸重量恢复至正常水平,而模型组及成纤维细胞移植组则无明显的帮助(图5E,F)。
利用绿色荧光报告蛋白对移植后的细胞定位进行追踪,结果发现,移植后14天、28天GFP标记的类睾丸间质细胞均分布于睾丸间质中,同时还表达睾丸间质细胞特异标记蛋白胆固醇侧链裂解酶(cytochrome P450,family 11,subfamily a,polypeptide 1,Cyp11a1)。尽管荧光蛋白标记的成纤维细胞(MEFs)也能定殖于睾丸间质中,但其并不能表达睾丸间质细胞特异标记蛋白(图6)。
综上所述,转分化的类睾丸间质细胞移植后可定殖于雄性鼠睾丸间质中,同时表达睾丸间质细胞特异标记蛋白,也可以合成和分泌雄激素,这些具雄激素合成功能的转分化细胞可促进雄激素低下模型大鼠血清睾酮的恢复,并具有治疗先天性性腺机能减退、衰老所致性腺机能减退、及睾丸间质细胞损伤而造成的性腺机能低下等疾病的潜在应用价值。
应该理解,尽管参考其示例性的实施方案,已经对本发明进行具体地显示和描述,但是本领域的普通技术人员应该理解,在不背离由权利要求书所定义的本发明的精神和范围的条件下,可以在其中进行各种形式和细节的变化,可以进行各种实施方案的任意组合。因此,本发明的范围包括在权利说明书等同目的和范围内的所用修改。
- 还没有人留言评论。精彩留言会获得点赞!