促进tau蛋白去磷酸化的嵌合体及其编码基因以及它们的应用的制作方法
本发明涉及基因工程技术领域,具体涉及促进tau蛋白去磷酸化的嵌合体及其编码基因以及它们的应用。
背景技术:
阿尔茨海默病(alzheimer’sdisease,ad)是最常见的一种痴呆症,约占痴呆症的50-70%。据统计,2016年中国有约1000万,全球则有4400万ad患者。随着人口的老龄化,ad的发病率将进一步上升,预计到2050年中国将有约4000万ad患者。目前所有治疗ad的药物都是表征药物(symptomaticdrugs),只能短暂缓解症状而不能延缓病情的进展。全球迫切期待有能真正改变ad进展的新药(disease-modifyingdrugs)。
ad的两个特征性的病理变化是老年斑(senileplaques,sps)及神经原纤维缠结(neurofibrillarytangles,nfts),分别是由β-淀粉样蛋白(aβ)及高度磷酸化的tau蛋白形成的聚合物,其中tau病变而不是aβ病变与ad的痴呆程度呈正相关。最新的研究显示高度磷酸化的tau介导aβ诱导的神经毒性,为aβ的神经毒性所必需;并且高度磷酸化的tau是朊脘病毒样蛋白(prion-likeprotein),能在神经元间传播从而导致tau病变的扩散,提示其可能是ad必需的药物靶点。
除了ad外,高度磷酸化的tau的聚集也见于连锁于17号染色体伴帕金森病的额颞叶痴呆(frontotemporaldementialinkedtochromosome-17parkinsonism,ftdp-17)、皮克氏病(pick’sdisease,pid)、进行性核上麻痹(progressivesupranuclearpalsy,psp)、皮质基底节变性(corticobasaldegeneration,cbd)、原发性年龄相关性tau病(primaryage-relatedtauopathy,part)、嗜银颗粒病(argyrophilicgraindisease,agd)、老化相关tau星形胶质细胞病(aging-relatedtauastrogliopathy,artag)、慢性创伤性脑病(chronictraumaticencephalopathy,cte)、球形胶质细胞tau病变(globularglialtauopathy,ggt)、帕金森病(parkinson’sdisease,pd)、亨廷顿病(huntington’sdisease,hd)等一系列神经退行性疾病。这类疾病包括ad被统称为tau疾病(tauopathies)。高度磷酸化的tau蛋白是引起这类疾病的重要原因,故也是这类疾病的重要治疗靶点。
目前提出的多种基于tau蛋白的治疗提案主要集中在对tau蛋白的降解上。该方案之所以受青睐,主要基于下述原因:(1)大量的证据表明,降低细胞内tau蛋白的含量,在动物模型中甚少引起副作用;(2)降低tau蛋白的含量可抑制tau蛋白的聚集,而tau蛋白的聚集则是引起神经元退行性变的重要原因;(3)降低tau蛋白的含量可降低多种因素(比如aβ)引起的神经元兴奋性神经毒性作用。因此,降低tau蛋白也被认为是一种新的潜在的治疗癫痫及中风的方案。
降低细胞内靶蛋白常用的技术方法有两种。(1)用sirna、mirna或反义寡核苷酸降低靶蛋白的表达,由于这些寡核苷酸在组织中的分布不好,药物代谢动力学较差,加之有脱靶的可能性,目前其在临床的应用受到限制,还有待进一步改进;(2)增强靶蛋白的降解:常见的方法是增强蛋白降解系统包括蛋白酶系统及自噬系统的活性。但非特异性地增强蛋白降解系统的活性易引起其它非靶蛋白的降解而严重副作用,故目前尚未有激活蛋白降解系统的药物获批在临床应用。
技术实现要素:
针对现有技术的如上缺陷,本发明的目的是构建一种促进tau蛋白去磷酸化的嵌合体(dephosorylation-targetingchimaeras,简称为deptac嵌合体),以对高度磷酸化的tau蛋白去磷酸化,从而抑制其功能。为了实现此目的,本发明的发明人通过深入研究发现,基于蛋白降解靶向嵌合体(proteolysistargetingchimeras,deptac)技术的相似原理,可以构建一种双功能蛋白嵌合体,其一端能特异结合靶蛋白(也即tau蛋白),另一端特异结合特定的磷酸酯酶,两者之间经由连接序列(linker)连接,并在特异结合特定的磷酸酯酶一端再连接穿膜肽序列。如此构建的蛋白嵌合体因能同时结合靶蛋白及磷酸酯酶,使靶蛋白临近磷酸酯酶,选择性诱导tau蛋白发生去磷酸化。而且,所述deptac技术除了对靶蛋白的选择性,还有下面的优点:(1)能作用于许多传统难以成药的靶点。许多传统的小分子药物必须作用于靶蛋白的特定的结合口袋(bindingpockets),才能发挥抑制作用。deptac技术则没有这种限制,其只要能与靶蛋白的任何区段相互作用,并且无需很高的亲和力,即可导致靶蛋白的快速降解(本申请为对靶蛋白去磷酸化)从而抑制靶蛋白的功能,故能作用于许多传统难以成药的靶点。(2)deptac技术在细胞内能被重复使用,能起到类似催化的效应,故无需很高浓度即可达到治疗效果。
为此,第一方面,本发明提供了一种促进tau蛋白去磷酸化的嵌合体,该嵌合体包括tau蛋白结合序列、连接序列、磷酸酯酶募集序列和穿膜肽序列,所述tau蛋白结合序列与所述磷酸酯酶募集序列通过连接序列连接。
在优选的实施方式中,所述磷酸酯酶为abαc型磷酸酯酶2a。
在优选的实施方式中,所述tau蛋白结合序列为β微管蛋白的第422-434片段;优选的,所述tau蛋白结合序列的氨基酸序列如seq.id.no:1所示。
在优选的实施方式中,所述连接序列的氨基酸序列如seq.id.no:2所示。
在优选的实施方式中,所述磷酸酯酶募集序列为全长人源性tau蛋白的第224-236片段;优选的,所述磷酸酯酶募集序列的氨基酸序列如seq.id.no:3所示。
在优选的实施方式中,所述穿膜肽序列的氨基酸序列如seq.id.no:4所示。
在优选的实施方式中,所述嵌合体的氨基酸序列如seq.id.no:5所示。
第二方面,本发明提供了编码如上所述的促进tau蛋白去磷酸化的嵌合体的基因。
在优选的实施方式中,所述基因的核苷酸序列如seq.id.no:6所示。
第三方面,本发明提供了一种重组载体,该重组载体包括载体以及连接在所述载体上的如上所述的基因。
在优选的实施方式中,所述载体为质粒或腺病毒载体,所述质粒优选为pires2-egfp质粒,所述腺病毒载体优选为腺病毒aov002载体;优选的,所述基因连接在腺病毒载体的ecori和bamhi酶切位点之间的读码框内。
第四方面,本发明提供了如上所述的嵌合体、如上所述的基因或如上所述的重组载体在制备用于治疗和/或预防与tau蛋白有关的疾病的药物中的应用。
可选地,所述疾病为阿尔茨海默病(ad)、连锁于17号染色体伴帕金森病的额颞叶痴呆(frontotemporaldementialinkedtochromosome-17parkinsonism,ftdp-17)、皮克氏病(pick’sdisease,pid)、进行性核上麻痹(progressivesupranuclearpalsy,psp)、皮质基底节变性(corticobasaldegeneration,cbd)、原发性年龄相关性tau病(primaryage-relatedtauopathy,part)、嗜银颗粒病(argyrophilicgraindisease,agd)、老化相关tau星形胶质细胞病(aging-relatedtauastrogliopathy,artag)、慢性创伤性脑病(chronictraumaticencephalopathy,cte)、球形胶质细胞tau病变(globularglialtauopathy,ggt)、帕金森病(parkinson’sdisease,pd)、亨廷顿病(huntington’sdisease,hd)、脑卒中和癫痫中的至少一种。
第五方面,本发明还提供了促进有需要的患者体内的tau蛋白去磷酸化的方法,该方法包括向患者给药有效量的如上所述的嵌合体、如上所述的基因或如上所述的重组载体;
优选地,所述给药方式选自鼻服、吸入、局部、口服、肌内、皮下、经皮、腹腔、硬膜外、鞘内和静脉内途径中的至少一种。
本发明通过将编码本发明提供的促进tau蛋白去磷酸化的嵌合体的基因克隆到质粒中,获得的重组质粒,能够在细胞中高效表达。此外,使用本发明的嵌合体处理sd大鼠原代神经元或转染htau-gfp的hek293细胞,可有效降低tau蛋白在ser396和at8表位的磷酸化水平。由此表明,本发明所述的促进tau蛋白去磷酸化的嵌合体可在预防和治疗包括阿尔茨海默病在内的一系列tau疾病中发挥作用。
附图说明
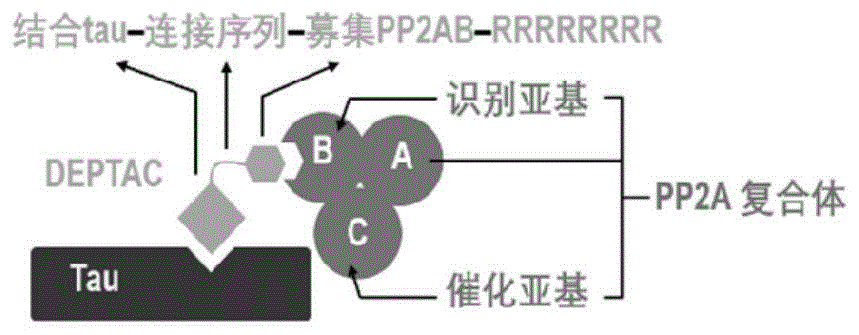
图1为本发明提供的嵌合体对tau蛋白去磷酸化的示意图。
图2显示了嵌合体deptac在大鼠原代神经元细胞中对tau蛋白的去磷酸化情况;
其中,“deptac”为本发明提供的嵌合体,“at8”为一种磷酸化tau蛋白抗体,可检测ser202和thr205位点发生磷酸化的人源性或小鼠源性tau蛋白,去磷酸化后at8检测到的tau磷酸化水平降低;“ps396”为一种磷酸化tau蛋白抗体,可检测ser396位点发生磷酸化的人源性或小鼠源性tau蛋白,去磷酸化后ps396检测到的tau磷酸化水平降低;“tau5”为一种tau蛋白抗体,可检测人源性tau蛋白和小鼠源性tau蛋白的总体水平。
图3显示了嵌合体deptac在hek293细胞中对tau蛋白的去磷酸化情况;
其中,“deptac”为本发明提供的嵌合体,“at8”为一种磷酸化tau蛋白抗体,可检测ser202和thr205位点发生磷酸化的人源性或小鼠源性tau蛋白,去磷酸化后at8检测到的tau磷酸化水平降低;“ps396”为一种磷酸化tau蛋白抗体,可检测ser396位点发生磷酸化的人源性或小鼠源性tau蛋白,去磷酸化后ps396检测到的tau磷酸化水平降低;“tau5”为一种tau蛋白抗体,可检测人源性tau蛋白和小鼠源性tau蛋白的总体水平。
图4显示了表达嵌合体deptac的基因在hek293细胞中的表达情况;其中,flag标签的表达水平与deptac的表达量正相关。
图5为pires2-egfp质粒的示意图。
具体实施方式
在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
第一方面,本发明提供了一种促进tau蛋白去磷酸化的嵌合体,该嵌合体包括tau蛋白结合序列、连接序列、磷酸酯酶募集序列和穿膜肽序列,所述tau蛋白结合序列与所述磷酸酯酶募集序列通过连接序列连接。
根据本发明,所述磷酸酯酶可以为任意的能够对靶蛋白进行去磷酸化的磷酸酯酶,在本发明一种优选的情况下,所述磷酸酯酶为磷酸酯酶2a,更优选为abαc型磷酸酯酶2a。
根据本发明,所述tau蛋白结合序列可以为任意的能够和tau蛋白进行特异性结合的序列,优选的,所述tau蛋白结合序列为β微管蛋白(β-tubulin)的422-434连续片段,其可特异性的识别并结合tau蛋白(例如,tau1);进一步优选的,所述tau蛋白结合序列的氨基酸序列如seq.id.no:1(yqqyqdatadeqg)所示。
根据本发明,所述连接序列可以为本领域中常规使用的能够连接两段氨基酸序列的linker,优选的,所述连接序列的氨基酸序列如seq.id.no:2(gsgs)所示。
根据本发明,所述磷酸酯酶募集序列可以为任意的能够募集磷酸酯酶,以对靶蛋白去磷酸化的磷酸酯酶募集序列。在本发明一种优选的情况下,所述磷酸酯酶募集序列为能够募集abαc型磷酸酯酶2a(其b亚基为55kd)的序列;更优选的,所述磷酸酯酶募集序列为全长人源性tau蛋白的第224-236片段,其可募集abαc型磷酸酯酶2a,选择性诱导tau蛋白发生去磷酸化,所述磷酸酯酶募集序列的氨基酸序列如seq.id.no:3(kkvavvrtppksp)所示。
根据本发明,所述穿膜肽可以为任意的能够携带目的片段进入细胞中从而实现其功能的肽,根据本发明一种优选的实施方式,所述穿膜肽的氨基酸序列如seq.id.no:4(rrrrrrrr)所示。
根据本发明一种特别优选的实施方式,所述嵌合体的氨基酸序列如seq.id.no:5所示,其包括tau蛋白特异性结合序列(yqqyqdatadeqg)、连接序列(gsgs)、磷酸酯酶募集序列(kkvavvrtppksp)和穿膜序列(rrrrrrrr),从而能够募集abαc型磷酸酯酶2a,以对特异性结合的tau蛋白进行去磷酸化(如图1所示)。
seq.id.no:5:
yqqyqdatadeqggsgskkvavvrtppksprrrrrrrr
根据本发明,所述嵌合体还可以连接有本领域常规的其他序列,例如,还可以连接标记基因(例如,编码β-半乳糖苷酶、荧光素酶、绿色荧光蛋白或其它荧光蛋白的基因)、表达标签(例如,flag标签)、与转录序列相关的相关转录调控序列(例如,启动子、增强子等)。这些均为本领域技术人员所公知,本发明在此不再赘述。
第二方面,本发明提供了编码如上所述的促进tau蛋白去磷酸化的嵌合体的基因。
本领域公知,组成蛋白质的20种不同的氨基酸中,除met(atg)或trp(tgg)分别为单一密码子编码外,其他18种氨基酸分别由2-6个密码子编码(sambrook等,分子克隆,冷泉港实验室出版社,纽约,美国,第二版,1989,见950页附录d)。即由于遗传密码子的简并性,决定一个氨基酸的密码子大多不止一个,三联体密码子中第三个核苷酸的置换,往往不会改变氨基酸的组成,因此编码相同蛋白的基因的核苷酸序列可以不同。本领域人员根据公知的密码子表,从本发明公开的氨基酸序列,完全可以推导出能够编码它们的基因的核苷酸序列,通过生物学方法(如pcr方法、突变方法)或化学合成方法得到所述核苷酸序列,因此该部分核苷酸序列都应该包括在本发明范围内。相反,利用本文公开的dna序列,也可以通过本领域公知的方法,例如sambrook等的方法(分子克隆,冷泉港实验室出版社,纽约,美国,第二版,1989)进行,通过修改本发明提供的核酸序列,得到与本发明所述木聚糖酶活性一致的氨基酸序列。
优选地,所述基因的核苷酸序列如seqidno:6所示。
seqidno:6
taccagcagtaccaggacgccacggccgacgaacaagggggcagcggcagcaagaaggtggcagtggtccgtactccacccaagtcgccgcgtcgtcgtcgtcgtcgtcgtcgt
第三方面,本发明还提供了一种重组载体,该重组载体包括载体以及连接在所述载体上的如上所述的基因。
根据本发明一种优选的实施方式,所述载体可以为质粒,例如,可以为pires2-egfp质粒,具体图谱如图5所示。目的基因的插入位点可以在cmv与pres之间。
根据本发明另一种优选的实施方式,所述载体为腺病毒载体,腺病毒是一种大分子(36kb)双链无包膜dna病毒,它通过受体介导的内吞作用进入细胞内,然后腺病毒基因组转移至细胞核内,保持在染色体外,不整合进入宿主细胞基因组中,因此,通过将目的基因整合到腺病毒载体中能够有效地将目的基因输送至细胞内,并且不影响细胞的染色体。进一步优选的,所述腺病毒载体为腺病毒aov002载体。
其中,所述目的基因可以插入到腺病毒载体的常规插入位点,优选的,所述目的基因插入到腺病毒载体的ecori和bamhi酶切位点之间的读码框内。具体的,可以通过使用ecori和bamhi对腺病毒载体和目的基因分别进行酶切,之后使用连接酶将两者连接,从而包装得到能稳定表达本发明提供的嵌合体的腺相关病毒(adeno-associatedvirus,aav)。
第四方面,本发明还提供了如上所述的嵌合体、如上所述的基因或如上所述的重组载体在制备用于治疗和/或预防与tau蛋白有关的疾病的药物中的应用。
根据本发明,所述疾病可以为阿尔茨海默病、连锁于17号染色体伴帕金森病的额颞叶痴呆、皮克氏病、进行性核上麻痹、皮质基底节变性、原发性年龄相关性tau病、嗜银颗粒病、老化相关tau星形胶质细胞病、慢性创伤性脑病、球形胶质细胞tau病变、帕金森病、亨廷顿病、脑卒中和癫痫中的至少一种。
根据本发明,所述药物中除了含有本发明的嵌合体作为活性成分外,还可以含有本领域公知的其他用于治疗相关疾病的药物以配合使用,还可以含有适配于不同剂型的药学上可接受的载体、赋形剂等成分。
第五方面,本发明还提供了促进有需要的患者体内的tau蛋白去磷酸化的方法,该方法包括向患者给药有效量的如上所述的嵌合体、如上所述的基因或如上所述的重组载体;
根据本发明,所述给药可以通过选自以下至少一种方式而实现:鼻服、吸入、局部、口服、肌内、皮下、经皮、腹腔、硬膜外、鞘内和静脉内途径。
以下将通过实施例对本发明进行详细描述。
以下实施例中;
htau-gfp质粒委托和元生物技术(上海)股份有限公司进行构建,可转染不表达人源性tau蛋白的细胞以使其表达人源性tau蛋白,该质粒可以在细胞内表达人源性tau蛋白,人源性tau蛋白在表达后磷酸化水平会比较高,能用t8和ps396抗体检测到;
hek293细胞购自中国典型培养物保藏中心细胞库(武汉大学),货号gdc0187;
大鼠原代神经元来源于原代培养的胚胎期约15天sd胎鼠海马和皮层神经元,本身有内源性鼠tau的表达,可用at8和ps396抗体检测其基础磷酸化水平;
其他生化试剂均可从普通生化试剂公司购买。
实施例
委托和元生物技术(上海)股份有限公司构建表达本申请嵌合体的pires2-egfp质粒,命名为deptac-flag质粒。
其中,为了便于测定本申请嵌合体的表达,在seq.id.no:5的末端还添加有flag标签,序列如seq.id.no:7(dykddddk)所示,其编码序列如seq.id.no:8(gattacaaggatgacgacgataag)所示。
委托武汉昊德生物科技有限公司合成本申请嵌合体(seq.id.no:5),分子量约4.443kd,纯度为95%。
对比例
委托和元生物技术(上海)股份有限公司构建表达参照的嵌合体的pires2-egfp质粒,相对于实施例的嵌合体,不含有磷酸酯酶募集序列。
委托武汉昊德生物科技有限公司合成参照嵌合体,纯度为95%,相对于seq.id.no:5,不含有磷酸酯酶募集序列。
测试例1
高压灭菌200μl、/1mltip头各一盒。向培养有hek293细胞的培养瓶中加入1mltrypsin液,消化1分钟(37℃,5%co2)。用手轻拍培养瓶壁可观察到细胞完全从壁上脱落下来时,加入1ml的含血清培养基终止反应。加入培养液吹打细胞,并转至培养板中进行培养,待细胞贴壁,细胞密度约为60%-80%时转染deptac-flag质粒,转染后继续培养24h后,用ripa液裂解细胞并收集细胞提取液,再用抗flag抗体进行westernblot检测,确定deptac-flag的表达。结果如图4所示,有图4可以看出,本申请的嵌合体能够在hek293细胞中进行高效表达。
测试例2
胚胎期12-15天的sd胎鼠,于无菌条件下取脑并于预冷解剖液(100%dme-f12)中分离去除软膜、血管等组织,取皮层和海马组织,漂洗后用眼科剪将皮质反复剪切成碎块,移入培养皿中,吸除解剖液后加入0.25%胰蛋白酶2ml,37℃培养箱中消化20min,弃去剩余消化液,用接种液(90%dme/f12、10%胎牛血清、105u/l青霉素、0.1g/l链霉素溶液)洗3次,每次洗涤后使组织块充分沉降到试管底,弃去上清液,最后再用接种液(90%dme/f12、10%胎牛血清、105u/l青霉素、0.1g/l链霉素溶液)1ml混悬,反复吹打混悬液中的组织块至浑浊后,将上清液移入培养瓶待用。加入1ml接种液后再次吹打,如此反复3-4次,组织块逐渐消化后,弃去最终残块。收集含单细胞悬液的上清液约4-5ml于培养瓶中,以接种液(90%dme/f12、10%胎牛血清、105u/l青霉素、0.1g/l链霉素溶液)重新悬浮细胞并进行细胞记数。按约1x107个细胞/孔的密度将细胞接种于6孔培养板中,培养4h至细胞贴壁后,更换全培养液(97%neurobasal、2%b27、1%谷氨酰胺、105u/l青霉素、0.1g/l链霉素溶液)培养3天后,之后换用阿糖胞苷培养液(97%neurobasal、2%b27、1%谷氨酰胺、105u/l青霉素、0.1g/l链霉素溶液、阿糖胞苷2.5ug/ml)培养3天,以抑制神经胶质细胞及杂细胞生长,获得单纯培养的原代神经细胞。最后每隔3天用全培养液1次,每次半换液。在原代神经元培养第五天时,用完全培养基将seq.id.no:5所示多肽稀释为目标浓度(10nm、100nm)后继续培养原代神经元24h。再用ripa液裂解细胞并收集细胞提取液,再用tau5(一种tau蛋白抗体,可检测人源性tau蛋白和小鼠源性tau蛋白的总体水平)、at8(一种磷酸化tau蛋白抗体,可检测ser202和thr205位点发生磷酸化的人源性或小鼠源性tau蛋白,去磷酸化后at8检测到的tau磷酸化水平降低)、ps396抗体(一种磷酸化tau蛋白抗体,可检测ser396位点发生磷酸化的人源性或小鼠源性tau蛋白,去磷酸化后ps396检测到的tau磷酸化水平降低)进行westernblot,定量分析tau磷酸化以及tau总蛋白含量的变化。
结果如图2所示,有图2可以看出,在大鼠原代神经元细胞中,嵌合体可有效降低tau蛋白在ser396和at8表位的磷酸化水平,且具有剂量依赖性。
测试例3
在hek293细胞培养瓶中加入1mltrypsin液,消化1分钟(37℃,5%co2)。用手轻拍培养瓶壁可观察到细胞完全从壁上脱落下来时,加入1ml的含血清培养基终止反应。加入培养液吹打细胞,并转至培养板中进行培养,待细胞贴壁,细胞密度约为60%-80%时转染htau-gfp质粒,转染后继续培养24h后,观察细胞生长状态,当超过60%以上的细胞表达gfp时,在培养基中加入seq.id.no:5所示多肽(0、10nm、20nm、50nm、100nm),并继续培养细胞24小时。用ripa液裂解细胞并收集细胞提取液,用tau5(一种tau蛋白抗体,可检测人源性tau蛋白和小鼠源性tau蛋白的总体水平)、at8(一种磷酸化tau蛋白抗体,可检测ser202和thr205位点发生磷酸化的人源性或小鼠源性tau蛋白,去磷酸化后at8检测到的tau磷酸化水平降低)、ps396抗体(一种磷酸化tau蛋白抗体,可检测ser396位点发生磷酸化的人源性或小鼠源性tau蛋白,去磷酸化后ps396检测到的tau磷酸化水平降低)进行免疫印迹,定量分析tau磷酸化以及tau总蛋白含量。
结果如图3所示,有图3可以看出,在转染有htau-gfp的hek293细胞中,嵌合体可有效降低tau蛋白在ser396和at8表位的磷酸化水平,且具有剂量依赖性。
其中:1、细胞提取液的制备方法如下:
(1)在显微镜下观察细胞培养板内细胞生长状况和密度;
(2)将1×pbs和细胞培养板放在冰上预冷,按照6孔板每孔加入80μl/6cm培养皿加入150μl配制1×缓冲液+pmsf(1:100)+蛋白水解酶混合抑制剂(1:1000)混合液;
(3)用1ml加样枪贴着细胞培养板底壁吸出培养基,贴壁加入1ml1×pbs,根据细胞密度轻柔冲洗1-3遍,用1ml和200μl加样枪贴着细胞培养板底壁吸出pbs,加入混合液后用超纯水清洗细胞刮子,用细胞刮子稍用力刮孔板底部,吸出细胞悬液至1.5mlep管中,不同样品间需清洗细胞刮子;
(4)煮沸10min(先以最高温度煮沸再以150℃维持沸腾,打开抗氧表位);
(5)离心后20khz超声20次(为了打开dna链,超声机按i打开o关闭,每超完一个样品后先在双蒸水中超三次再用卫生纸擦干,超声枪头不能接触气泡和ep管底部);
(6)振荡混匀置于-20℃冰箱。
2、免疫印迹法定量分析tau蛋白含量的过程
1、搭架子(两种玻璃板,三个瓶子,五个试剂,滤纸,卫生纸,垃圾桶,枪,枪头,梳齿)
(1)擦净桌面和底架,洗净梳齿、玻璃板、蒸馏水瓶和上、下部胶瓶,并烘干上、下部胶瓶,拿出配制电泳胶的试剂恢复至室温;
(2)将较高的玻璃板朝内叠在一起,按住上部使下部紧贴桌面使其平齐,将夹子向外翻夹紧,放在底架上用夹子扣住。
(3)注入双蒸水检验是否漏液,若漏液则重装后再检漏。
2、制备电泳胶(见表1,天冷时ap和temed可加1.5倍)
表1
(1)依次加入20%arc/bis,tris缓冲液,temed和10%ap,用移液器吹打混匀,整个过程防止混合液中混有气泡;
(2)沿两个角分别将分离胶缓缓注入到胶膜内(吸取时深入液面下轻柔吹打混匀,每次枪头留少量液体以防产生气泡),每块胶用量为3×900μl,观察胶不漏后沿两个角分别用双蒸水将胶膜的空隙处填满(防止氧气抑制聚合并保持下部胶水平,可多放一段时间);
(3)等待凝胶30min左右待分离胶凝固后倾去双蒸水,并用滤纸将剩余水吸尽,并用记号笔标出下部胶的上沿;
(4)沿两个角分别将浓缩胶缓缓注入到胶膜内,斜着从左往右插入所需规格梳齿(上样量<20μl用小梳齿,上样量>20μl用大梳齿),在泳道间补胶避免缩胶,等待凝胶50min。
3、样品的处理
在细胞提取液中加入现配的溴酚蓝和β-巯基乙醇(还原剂),溴酚蓝:β-巯基乙醇=1:3,混合液:样品=1:10,100℃沸水浴10min,在振荡器上振荡20秒钟后分装,若结果不佳每次上样前将样品100℃沸水浴10min。
4、上样和蛋白的电泳分离(上样针,样品,排插,marker,电泳液,电泳槽,蒸馏水瓶)
清洗电泳架下面的导电丝,将转移到电泳架上,用记号笔标出泳道及编号,缓慢垂直拔出梳齿,用电泳液加满凝胶槽,用微量加样器取样品加入各个泳道(marker加1μl于第1和8泳道,加入溴酚蓝和1×buffer混合液加于第15泳道平衡)。上完样后将电泳架转移至电泳槽,加电泳液后盖上盖子使红色对红色,黑色对黑色,加样后先用恒流10ma/块胶电泳约30min(按两次启动),待溴酚蓝指示剂电泳至浓缩胶与分离胶交界处成以线状时,改为恒压100v(若无法恒压可调高电流)电泳约60min至溴酚蓝到凝胶底部且marker完全跑开。
5、转膜(标记nc膜,转膜液,滤纸,冰盒,盆子,盘子,转膜槽,塑料板,清洗镊子)
(1)将nc膜用记号笔标记后浸于回收的转膜液10min-20min(有利于蛋白质的固定,能平衡凝胶且去除sds),按住两旁的卡口取下凝胶槽,用小板撬起玻璃板和白瓷板右侧中间部分,期间保持剩余胶的电泳。
(2)依欲显分子量范围用玻璃板垂直略倾斜并轻微地左右来回一次切胶,用镊子将浸过转膜液的三层滤纸贴在胶上,用小板小心地将胶撬起放在的海绵上(滤纸朝下),另一面贴上倒置的nc膜,将胶和nc膜浸没至转膜液中(胶在上)用玻璃棒赶气泡,用镊子夹起小心放在手上(胶在上),用镊子将浸过转膜液的三层滤纸贴在胶上,倒置放在海绵上,再贴上三层滤纸。由下至上放置黑塑料板→一层海绵→三层滤纸→胶→nc膜→三层滤纸→一层海绵→透明塑料板,若不紧可用橡皮筋固定。
(3)红对红,白对黑,将转膜槽放入冰浴中(通电前不要将胶长时间泡在转膜液中,以免蛋白质扩散分解),转移电流为恒流276ma,电压一般在140v(可以适当补充甲醇提高电压),具体转移时间根据所需要转移的蛋白质的分子量的大小决定,转移的蛋白质的分子量<100kda时时间为1h,>100kda时时间为1.5h。
6、免疫印迹显色(清洗镊子,装有双蒸水的盒子,牛奶,保鲜袋,卫生纸,一抗,冰盒,平板,透明胶,tbst,黑色塑料袋,二抗)
(1)封闭:转膜结束后小心地将nc膜用含5%脱脂奶粉的tbs封闭液于室温振荡封闭1h或4℃过夜,回收未与胶接触的滤纸。
(2)一抗孵育:取出nc膜,用1×tbs漂去膜表面残留的奶渍,用镊子夹着nc膜竖在卫生纸上除去多余的水,将nc膜marker一侧朝外置于保鲜袋中用卫生纸排水排气。加入一抗(可加入0.1%的吐温20降低背景)封口贴在平板上(有marker和蛋白的一面朝上),透明胶带不要压在目标条带上,于4℃孵育过夜。
(3)二抗孵育:次日从孵育袋中取出nc膜并回收一抗,用tbst缓冲液漂洗3×5min,用1×tbs漂去膜表面残留的盐离子,用镊子夹着nc膜竖在卫生纸上除去多余的水,将nc膜置于保鲜袋中用卫生纸排水排气。避光加入荧光素标记的羊抗兔或羊抗鼠的odyssey二抗(可加入0.1%的吐温20降低背景),封口贴在平板上(有marker和蛋白的一面朝上),透明胶带不要压在目标条带上,于室温慢摇孵育1h(超过1h可能会增加背景,天冷可延长至2h)后,从孵育袋中取出nc膜并回收二抗,用tbst缓冲液漂洗3×5min。漂洗完毕后,用1×tbs漂洗去掉膜表面残留的盐离子。
(4)显色:先用蘸有无水乙醇的擦镜纸将玻璃板擦干净。将marker侧朝下,按分子量从小到大在扫描仪由上至下方向放置,覆盖塑料薄膜并排气。打开odyssey软件,点击file→new→browse→输入日期,点击obtainimage选择扫膜长、宽,扫描成像并保存原图,点击alterimage调整图像,用文本框标记样品和抗体类型,点击exportimagefile→save,收好膜后再用卫生纸将玻璃板擦干净。
由此可见,本发明所述的特异性降解tau蛋白的嵌合体可降解细胞中的tau蛋白含量。由于tau蛋白在细胞内异常聚集参与20多种神经退行性疾病,其聚积量与这些退行性疾病的神经变性和记忆障碍正相关,因此,降解tau蛋白即可达到预防或/和治疗tau-相关的神经退行性变性病,如阿尔茨海默病、连锁于17号染色体伴帕金森病的额颞叶痴呆、皮克氏病、进行性核上麻痹、皮质基底节变性、原发性年龄相关性tau病、嗜银颗粒病、老化相关tau星形胶质细胞病、慢性创伤性脑病、球形胶质细胞tau病变、帕金森病、亨廷顿病、脑卒中和癫痫。
以上详细描述了本发明的优选实施方式,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。
sequencelisting
<110>华中科技大学
<120>促进tau蛋白去磷酸化的嵌合体及其编码基因以及它们的应用
<130>hbi0184hust
<160>8
<170>patentinversion3.3
<210>1
<211>13
<212>prt
<213>tau蛋白结合序列的氨基酸序列
<400>1
tyrglnglntyrglnaspalathralaaspgluglngly
1510
<210>2
<211>4
<212>prt
<213>连接序列的氨基酸序列
<400>2
glyserglyser
1
<210>3
<211>13
<212>prt
<213>磷酸酯酶募集序列的氨基酸序列
<400>3
lyslysvalalavalvalargthrproprolysserpro
1510
<210>4
<211>8
<212>prt
<213>穿膜肽的氨基酸序列
<400>4
argargargargargargargarg
15
<210>5
<211>38
<212>prt
<213>嵌合体的氨基酸序列
<400>5
tyrglnglntyrglnaspalathralaaspgluglnglyglysergly
151015
serlyslysvalalavalvalargthrproprolysserproargarg
202530
argargargargargarg
35
<210>6
<211>114
<212>dna
<213>嵌合体的编码序列
<400>6
taccagcagtaccaggacgccacggccgacgaacaagggggcagcggcagcaagaaggtg60
gcagtggtccgtactccacccaagtcgccgcgtcgtcgtcgtcgtcgtcgtcgt114
<210>7
<211>8
<212>prt
<213>flag标签的氨基酸序列
<400>7
asptyrlysaspaspaspasplys
15
<210>8
<211>24
<212>dna
<213>flag标签的编码序列
<400>8
gattacaaggatgacgacgataag24
- 还没有人留言评论。精彩留言会获得点赞!