矮牵牛基因PhLcyB及其应用的制作方法
本发明涉及生物技术和植物遗传育种领域,具体地说,涉及矮牵牛基因phlcyb及其应用。
背景技术:
矮牵牛(petuniahybrida)为多年生草本,常作一二年生栽培,花单生,呈漏斗状,重瓣花球形,是茄科,碧冬茄属植物。原产南美阿根廷,现已在世界各地广泛流传。经过欧美、日本等国的园艺家的不断育种改良,现在矮牵牛的栽培品种已经上百种。
在1995年,邵莉等将矮牵牛chs基因通过农杆菌介导的方式转入植物体,矮牵牛出现花色白化的现象,并且影响植物正常的繁殖能力。研究者自此发现矮牵牛的生长周期短和再生体系的成熟等条件适用于研究花色遗传和转录后基因沉默。自1995~2018年,化占勇、杨伟苑、richard等许多研究者都使用矮牵牛作为验证基因功能的试验材料。如2016年,杨伟苑等用矮牵牛验证纤维素合成酶催化亚基(cellulosesynthasecatalyticsubunits,cesas)基因的功能,经研究发现,被侵染后的植株在表型上出现植株变矮,茎、花梗和花丝等直径变粗,柱头和种子等出现畸形的一些现象。从而验证phcesa3基因在植物生长发育及抗性方面具有重要地位。
病毒诱导的基因沉默(virus-inducedgenesilencing,vigs),是指携带植物目的基因cdna的病毒,在侵染植物体后可诱导内源基因的mrna发生特异性降解,使该基因发生转录水平后的基因沉默,相应表型发生变异,从而可以通过植物表型或生理指标上的变化反映该基因的功能。与传统遗传转化的方法相比,vigs技术是一种免去大规模筛选突变体,能够在当代完成目的基因验证,有操作简单、适用于植物基因功能分析,成为了功能基因组学研究领域最具吸引力的技术手段之一。vigs技术被广泛用于植物的生长发育、抗病虫、代谢调控等相关基因的功能研究中。vigs技术也被应用于不同类型的植物,如烟草、拟南芥、矮牵牛、番茄、大豆、小麦、草莓等。
技术实现要素:
本发明的目的是提供矮牵牛基因phlcyb及其应用。
为了实现本发明目的,本发明采用矮牵牛为实验材料,成功克隆了phlcyb基因全长序列,并通过vigs技术验证了phlcyb基因的功能。
第一方面,本发明提供矮牵牛基因phlcyb,其特征在于,其为:
i)seqidno:1所示的核苷酸序列;
ii)seqidno:1所示的核苷酸序列经取代、缺失和/或增加一个或多个核苷酸且表达相同功能蛋白质的核苷酸序列;
iii)在严格条件下与seqidno:1所示序列杂交且表达相同功能蛋白质的核苷酸序列,所述严格条件为在含0.1%sds的0.1×sspe或含0.1%sds的0.1×ssc溶液中,在65℃下杂交,并用该溶液洗膜;或
iv)与i)、ii)或iii)的核苷酸序列具有90%以上同源性且表达相同功能蛋白质的核苷酸序列。
第二方面,本发明提供含有所述基因phlcyb的生物材料,所述生物材料包括但不限于重组dna、表达盒、转座子、质粒载体、噬菌体载体、病毒载体、工程菌或非可再生的植物部分。
第三方面,本发明提供所述基因phlcyb或含有所述基因phlcyb的生物材料在调控植物叶片中类胡萝卜素合成中的应用,其中,所述植物包括但不限于矮牵牛。
具体地,所述调控是指提高植物叶片中类胡萝卜素的含量。
本发明中,类胡萝卜素包括胡萝卜素和叶黄素。
第四方面,本发明提供所述基因phlcyb或含有所述基因phlcyb的生物材料在制备转基因植物中的应用。
第五方面,本发明提供所述基因phlcyb或含有所述基因phlcyb的生物材料在植物育种中的应用。
所述育种的目的包括调控植物叶片中类胡萝卜素的合成,其中,所述植物包括但不限于矮牵牛。
第六方面,本发明提供所一种提高植物叶片中类胡萝卜素含量的方法,所述方法包括:
1)使植物包含所述基因phlcyb;或
2)使植物过表达所述基因phlcyb。
其中,所述植物包括但不限于矮牵牛。
进一步地,所述方法包括但不限于转基因、杂交、回交、自交或无性繁殖。
过表达基因phlcyb的方法可选自以下1)~4),或任选的组合:
1)通过向植物中导入具有所述基因phlcyb的质粒;
2)通过增加植物染色体上所述基因phlcyb的拷贝数;
3)通过将强启动子与所述基因phlcyb可操作地连接;
4)通过导入增强子。
本发明中,携带有所述目的基因的表达载体可通过使用ti质粒、植物病毒载体、直接dna转化、微注射、电穿孔等常规生物技术方法导入植物细胞中(weissbach,1998,methodforplantmolecularbiologyviii,academypress,newyork,第411-463页;geiserson和corey,1998,plantmolecularbiology,2ndedition)。
借由上述技术方案,本发明至少具有下列优点及有益效果:
本发明首次成功克隆了phlcyb基因全长序列,并通过vigs技术验证了phlcyb基因具有的调控植物(如矮牵牛)叶片中类胡萝卜素合成的生物学功能。实验表明,phlcyb基因沉默的植株叶片出现大面积白化现象,花瓣没有明显变化。对白化叶进行片生化检测发现phlcyb基因沉默后叶片中类胡萝卜素含量明显降低,可知phlcyb基因对矮牵牛叶片中类胡萝卜素代谢的调节有重要作用。本发明的phlcyb基因可用于植物新品种的培育,有利于提高植物叶片中类胡萝卜素的含量。
附图说明
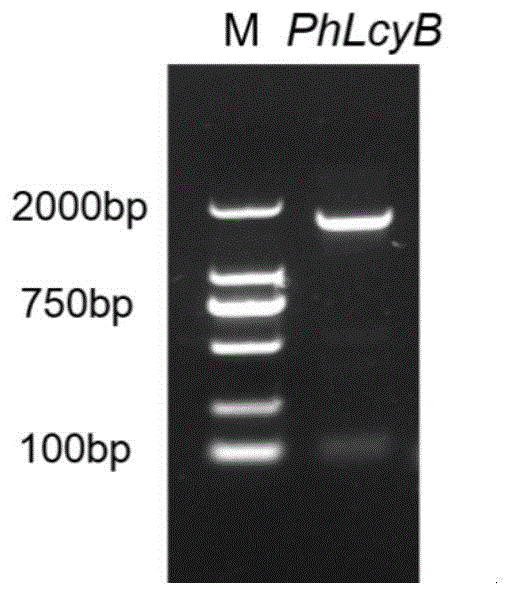
图1为本发明较佳实施例中矮牵牛基因phlcyb扩增产物的琼脂糖电泳检测结果。
图2为本发明较佳实施例中重组载体ptrv2-phlcyb和ptrv2-phchs的结构示意图。
图3为本发明较佳实施例中携带phchs、phlcyb基因片段的重组载体验证结果。
图4为本发明较佳实施例中通过vigs技术侵染的矮牵牛植株的表型对比。
图5为本发明较佳实施例中矮牵牛叶片中类胡萝卜素总含量、胡萝卜素和叶黄素的相对含量/mg·g-1·fw。
图6为本发明较佳实施例中矮牵牛转基因植株中trv-phlcyb基因半定量分析结果。
图7为本发明较佳实施例中矮牵牛转基因植株中trv-phlcyb基因荧光定量表达分析结果。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例均按照常规实验条件,如sambrook等分子克隆实验手册(sambrookj&russelldw,molecularcloning:alaboratorymanual,2001),或按照制造厂商说明书建议的条件。
实施例矮牵牛基因phlcyb的克隆及功能分析
1材料与方法
1.1植物材料
本发明以矮牵牛‘旭日’为材料。在植物生长室内播种种植矮牵牛‘旭日’,待长到4片新叶时,作为vigs功能验证的实验材料。
1.1.1矮牵牛总rna提取及反转录
用北京艾德莱生物科技有限公司的easyspinplus植物rna快速提取试剂盒提取植物样品的总rna,矮牵牛总rna进行琼脂糖凝胶电泳,结果表明总rna较完整,可用于后续实验。用北京全式金公司的transscriptfirst-strandcdnasynthesissupermix试剂盒对rna进行反转录得到cdna模板。
1.2矮牵牛phlcyb基因的克隆和测定
根据矮牵牛‘旭日’转录组测序结果中lcyb基因的unigene信息,在genbank中进行比对,找到lcyb基因的起始位置。再结合unigene序列设计特异性上游引物primerphlcyb-f3和下游引物primerphlcyb-r3。pcr程序:94℃预变性5min;94℃变性45sec,55℃退火30sec,72℃延伸1min,32个循环;72℃延伸10min;保温4℃。pcr产物经琼脂糖凝胶电泳检测后,切胶回收目的片段,进行目的克隆和测序。
1.3载体构建
1.3.1phlcyb和phchs基因片段的克隆
根据已构建的矮牵牛转录组文库测序的结果和已经克隆得到的phlcyb基因序列,设计扩增phlcyb和phchs基因(phchs基因genbank:x14599.1)片段的引物,设计引物时引入ecori、bamhi酶切位点序列,引物见表1。pcr扩增产物经琼脂糖凝胶检测并回收目的条带,经测序验证后用于下一步实验。
1.3.2ptrv2-phlcyb和ptrv2-phchs重组载体的构建及验证
采用takaraquickcuttmbamhi和ecori对phlcyb和phchs基因片段的扩增产物和ptrv2质粒进行双酶切,将双酶切产物分别经琼脂糖凝胶检测并回收目的条带后,采用takarat4dna连接酶进行过夜连接,将连接产物转化e.colidh5α,选取阳性克隆菌液进行测序验证,并提取重组质粒ptrv2-phlcyb和ptrv2-phchs,进行pcr扩增验证。
1.4侵染方法
将质粒ptrv2、重组质粒ptrv2-phlcyb和ptrv2-phchs通过电击转化法转化农杆菌gv3101,将分别含有ptrv1、ptrv2、ptrv2-phlcyb和ptrv2-phchs的农杆菌gv3101菌液在含有50mg/l卡那霉素、50mg/l庆大霉素和50mg/l利福平的lb固体培养基上培养36-48h,挑取各自单菌落,于5ml含有相同种类和浓度的lb液体培养基培养24h,转入含有50mg/l卡那霉素、50mg/l庆大霉素、200μmas、10mmmes的200mllb培养基中培养过夜。待菌液od600约为0.8时,4000rpm离心10min,用含有200μmas、10mmmes、10mmmgcl2的悬菌液分别收集菌液。调节各个菌液od600均为1.0,将ptrv1菌液与ptrv2菌液按体积比1:1混合、ptrv1菌液与ptrv2-phlcyb按体积比1:1混合和ptrv2-phchs菌液按体积比1:1混合,避光室温静置活化4h后侵染。采用注射法侵染4叶期的矮牵牛植株,侵染后用灭菌去离子水冲洗2次。暗处理24h后,放置于植物生长室中培养,待矮牵牛成年后进行后续实验使用。
1.5矮牵牛类胡萝卜素总含量、胡萝卜素和叶黄素含量测定
本实施例中采用有机溶剂法测量矮牵牛类胡萝卜素总含量、胡萝卜素和叶黄素的含量。以5个样本为生物学重复,经过研磨后,准确称取0.25g植物样品,迅速加入25ml丙酮:无水乙醇为1:1(体积比)的混合液,吹打混匀,避光保存4h。以丙酮:无水乙醇为1:1(体积比)的混合液为空白对照,使用d30核酸蛋白测定仪,在a(吸光值)的程序下测量波长为470、474、485、642.5、649、665nm的吸光值。
通过以下公式:
叶绿素a(mg/l)=9.99a(665)-0.0872a(642.5)
叶绿素b(mg/l)=17.7a(642.5)-3.04a(665)
类胡萝卜素总含量(mg/l)=4.92a(474)-0.0255[a]-0.225[b]
胡萝卜素(mg/l)=12.6a(485)-6.00a(470)-0.0298[a]+0.336[b]
叶黄素(mg/l)=10.2a(470)-11.5a(485)-0.0036[a]-0.652[b]
叶绿素a及叶绿素b的浓度分别用[a]、[b]表示,计算如下:
叶绿素a(mg·g-1·fw)=叶绿素a(mg/l)×提取液总体积(l)/样品鲜重(g)
叶绿素b(mg·g-1·fw)=叶绿素b(mg/l)×提取液总体积(l)/样品鲜重(g)
类胡萝卜素总含量(mg·g-1·fw)=总类胡萝卜素(mg/l)×提取液总体积(l)/样品鲜重(g)
胡萝卜素含量(mg·g-1·fw)=胡萝卜素(mg/l)×提取液总体积(l)/样品鲜重(g)
叶黄素含量(mg·g-1·fw)=叶黄素(mg/l)×提取液总体积(l)/样品鲜重(g)
1.6矮牵牛phlcyb基因的表达状况分析
1.6.1矮牵牛phlcyb基因的半定量pcr表达分析
对成年的矮牵牛植株进行表型性状观测统计。根据已扩增的矮牵牛phlcyb基因序列的结果,设计矮牵牛phlcyb基因的特异引物,并且根据trv1序列设计扩增trv1所需要的引物(表1),对phlcyb和trv1扩增并进行半定量表达分析,使用26s为内参基因。
pcr体系(25μl):cdna模板1μl,上游引物(10μm)1μl,下游引物(10μm)1μl,2×taqpcrmastermix12.5μl,ddh2o补至25μl。
pcr程序:94℃预变性5min;94℃变性40s,退火55℃30s,延伸72℃40s,32个循环;延伸72℃10min;保温4℃。对pcr产物用1%琼脂糖凝胶电泳方法分析相对表达量。
1.6.2矮牵牛phlcyb基因的荧光定量表达分析(qrt-pcr)
根据已扩增的矮牵牛phlcyb基因全长序列设计荧光定量表达分析(qrt-pcr)引物,采用qrt-pcr分析,以26s为内参基因,采用2-δδct方法,引物信息见表1。
表1引物信息
2结果与分析
2.1矮牵牛phlcyb基因的克隆与序列分析
以矮牵牛叶片为实验材料提取rna,克隆得到phlcyb基因的全长1662bp。phlcyb基因扩增产物的琼脂糖电泳检测结果见图1。
2.2构建trv重组载体和鉴定结果
依照实验设计构建ptrv2-phlcyb和ptrv2-phchs重组载体示意图(图2,其中ptrv2-phlcyb的插入片段phlcyb以及ptrv2-phchs的插入片段phchs的核酸序列分别如seqidno:2和3所示)。将ptrv2-phlcyb和ptrv2-phchs重组载体转化e.colidh5α后,提取阳性克隆的菌液质粒,以ptrv2-phlcyb和ptrv2-phchs重组质粒为模板,使用trv2载体设计引物pcr扩增进行验证。经琼脂糖凝胶电泳检测(图3),图3表明目的条带约为722bp和532bp,符合预期目标,证明ptrv2-phlcyb和ptrv2-phchs重组载体构建成功。
2.3通过vigs体系侵染的矮牵牛植株的表型对比
采用注射法侵染4叶期的矮牵牛植株,侵染后随着植株渐渐长大,表型变化也逐渐显现(图4),trv-phlcyb植株在成熟期,叶片出现大面积的白化现象,花瓣没有出现明显变化;阳性对照trv-phchs植株叶片没有出现明显变化,花瓣出现了大面积白化现象;阴性对照trv空载体对照植株与空白对照(mockcontrol,即野生型)植株相比叶和花均没有出现明显的变化。
2.4类胡萝卜素含量的测定
以矮牵牛mock对照(空白对照)植株叶片、trv空载体(阴性对照)浸染的矮牵牛植株叶片、trv-phlcyb浸染的矮牵牛植株叶片为实验材料,测定类胡萝卜素总含量、胡萝卜素和叶黄素的相对含量(图5),表明trv-phlcyb浸染植株的叶片中类胡萝卜素总含量、胡萝卜素和叶黄素的相对含量均明显低于mock对照植株、trv空载体浸染的植株,而mock对照植株和trv空载体浸染的植株叶片中类胡萝卜素总含量、胡萝卜素和叶黄素的相对含量相差不大。
2.5矮牵牛phlcyb基因的定量表达分析
以trv-phlcyb,trv空载体对照和mock对照成熟植株的叶片为实验材料,提取rna进行半定量pcr和qrt-pcr分析。图6半定量pcr结果显示trv-phlcyb植株,trv空载体对照植株均检测出trv1载体,表明农杆菌侵染成功。trv-phlcyb植株中phlcyb基因表达量明显低于trv空载体对照和mock对照植株中phlcyb基因表达量。图7qrt-pcr分析结果显示trv-phlcyb植株中phlcyb基因表达量明显低于trv空载体对照和mock对照植株中phlcyb基因表达量,这与半定量pcr结果一致。而trv空载体对照和mock对照植株中phlcyb基因表达量相比并未出现明显变化。
本发明成功克隆了phlcyb基因的全长序列,构建trv-phlcyb和trv-phchs重组载体,采用vigs技术通过注射法对矮牵牛进行侵染。验证了phlcyb基因的功能,从表型上可以看出phlcyb基因沉默的植株叶片出现大面积白化现象,花瓣没有明显变化。对白化叶进行片生化检测发现phlcyb基因沉默后叶片中类胡萝卜素含量明显降低,可知phlcyb基因对矮牵牛叶片中类胡萝卜素代谢的调节有重要作用。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
序列表
<110>北京农学院
<120>矮牵牛基因phlcyb及其应用
<130>khp181118127.0
<160>3
<170>siposequencelisting1.0
<210>1
<211>1662
<212>dna
<213>矮牵牛(petuniahybrida)
<400>1
aatagcaatttagcacgggaaacagaaaagcaggaaatacaaatagttactatggcaact60
atttggaaaagcaaaaatagaacaatgtattaacatgtgctacgtataattgaacaaaga120
ttcctgataagttattctgtatcctttaataaattgttgatcatagttactaaaggaaga180
gttccctttgtcattatctctattctagaagtatttgaagcttgagagaaaagggacagc240
ccaaaaaatataagatcgggaagaaacagccgagatgacaagaagccatgccaataacga300
ggttctagatcaaagaaggcatcgaaaaaccttctcgtagcaggcaagtcaagcttcaga360
aggatatccataccaaagcaaaagaattctctttgacgtctccgttctatgggccacaag420
tctttccaaacagctgcagacaattcattacctagtttacctctctctgaaccaaggtat480
tgaattattgcattagcaacaataggagctgcagctagggtccttgctaccatataacca540
gttgaaggatgaaccataccagctgtaccaccaattccaacaactctctgaggtagtaca600
ggaagggggcctcccattggaattacacaacgttcatcctcttcaatgctcttaattttt660
atacccaagtgatctaaacgagccaccattctttcttgaatatcgtccatacgtaaacca720
ggacgagctacaagggaggtttcttcaagaaatattctgtttgatgaaaatggcattgca780
tataaaaaagttggaattttactatttctttccttcagctccatgttattatcaagatgc840
gaatctcgccaatccatgaaaaccatcttatttgtatcaaagggatgctcctccacttct900
gccaaaataccataagctacttgatacccaggattatatggcttgtcatactgaacaaga960
gatctagaaaaaccagtagcatcaagaaccactgttgcctgaatagttacaccatcgtcg1020
caaatcagcatagatttagcttcctcgtgaattacctttataactttagcctgatggaat1080
tttacaccattacgtatgcacttctgcatcattttagacttcagttgcttcctattaacc1140
cttccataaggcctatcaagatctttagtgctattttcatcgacataaacaaccgcacca1200
gaccatgtagcgtcgaggcaatccaacaaatccatagcctcaaattcatccacccaaaca1260
ccatagctattaggccatatcaatttaggcgacgggtcaatcgaacaaaccgacagtcca1320
gcctcggatacctgctgagcaacacagcaagacctgcaggtccaccaccaaccacagcta1380
aatctacaacaaccccttttgaagggtcatacataggaagctcaaaatcaagattttcct1440
ttttagtctcaggtacaagctccaaaagtgtactactccctgccataacacaaacccttt1500
taccccaattttcacaaaattttcttgaaccaaacttctgaggcttcacatagctaaaag1560
agctagctttaataacatattcatgaattggttgcagaaactcaagtttattaggggttt1620
tcaacaaagtatccatgttggtcccaaagttgttgaaaatac1662
<210>2
<211>441
<212>dna
<213>矮牵牛(petuniahybrida)
<400>2
gctacttgatacccaggattatatggcttgtcatactgaacaagagatctagaaaaacca60
gtagcatcaagaaccactgttgcctgaatagttacaccatcgtcgcaaatcagcatagat120
ttagcttcctcgtgaattacctttataactttagcctgatggaattttacaccattacgt180
atgcacttctgcatcattttagacttcagttgcttcctattaacccttccataaggccta240
tcaagatctttagtgctattttcatcgacataaacaaccgcaccagaccatgtagcgtcg300
aggcaatccaacaaatccatagcctcaaattcatccacccaaacaccatagctattaggc360
catatcaatttaggcgacgggtcaatcgaacaaaccgacagtccagcctcggatacctgc420
tgagcaacacagcaagacctg441
<210>3
<211>251
<212>dna
<213>矮牵牛(petuniahybrida)
<400>3
gtggaggcattccaaccattgggcatttctgactggaactctatcttctggattgcacac60
cctggtgggccggctattttggaccaagttgaactaaagttgggcttaaagcctgagaaa120
cttagggctacaagacatgtcttgagtgagtatggaaatatgtcaagtgcttgtgttctc180
tttattttggatgaaatgagaaaggcttcatcaaaagaagggcttggtaccactggtgaa240
ggtcttgaatg251
- 还没有人留言评论。精彩留言会获得点赞!