硫桥联的喹唑啉类四齿铂配合物磷光材料及其制备方法与流程
本发明涉及电致发光技术领域,是一类基于具有刚性结构的硫桥联的喹唑啉类四齿铂配合物磷光材料。
背景技术:
由于有机电致发光二极管(oleds)拥有自发光、可弯曲、轻薄、发光效率和亮度高、驱动电压低、全固态、温度适应范围广等优点,因此被广泛应用于平板显示、固体照明和各种电子设备中。与此同时,对oleds功能材料,特别是对oleds的效率寿命起决定性作用的发光层材料的需求也在快速增长。
在全彩显示和照明领域中蓝光材料都是不可缺少,一方面蓝光材料不仅可以直接制备三基色显示器,实现全彩显色,另一方面可以与橘红色或红色发光材料制备混合白光oleds,降低制作成本。目前有多种方法制备蓝色发光材料。普通的蓝色荧光材料仅能利用25%的单线态激子,内量子效率(iqe)理论上最高为25%,在电致发光过程中又存在各种能量损失和稳定性差等问题;重金属磷光材料,如ir、pt配合物,具有重原子自旋轨道耦合(soc)效应,使三线态激子以辐射跃迁方式回到基态,充分利用单线态和三线态激子,使内量子效率理论上达到100%,并且可以利用丰富的配位方式实现光谱调节。因此制备重金属配位的磷光材料成为实现高性能蓝光材料的重要途径,吸引越来越多的研究人员来探索。其中铂配合物具有平面结构,与八面体结构的铱等重金属配合物相比,在配体选择性上具有更好的灵活性,可以设计出二齿、三齿、四齿的配体结构,同时其合成的可控性也较好。
四齿配合物具有比二齿和三齿铂配合物更强的刚性结构,可以有效的降低非辐射衰减,大幅度提高发光效率和热稳定,而且可以灵活调节配体结构改变发光颜色。最初四齿铂配合物是以氮原子连接配体,虽然达到了发光蓝移的效果,但是量子效率较低。目前四齿铂配合物主要以咔唑基、芴等作为桥将配体连接起来为主,但是其发光颜色普遍达不到深蓝光,近年来,为实现深蓝光发射,一般将桥连基团换成低共轭的氧原子、碳原子等。硫作为与氧同一主族的元素,两者有许多相似性,将其应用到四齿铂配合物桥连单元中是对有机光电材料领域一种新的探索。并且硫原子具有丰富的价态变化、能够形成多种桥键单元,调节发光颜色。由于硫的特殊性能,其可以与hg、cu等金属离子络合,因此同样可以应用于生物传感领域。
技术实现要素:
技术问题:本发明的目的是开发出一类具有制备简便、成本低廉并且具有优异光电性能、稳定性、溶解性等优点的硫桥联的喹唑啉类四齿铂配合物磷光材料。
技术方案:本发明的硫桥联的喹唑啉类四齿铂配合物磷光材料,该铂配合物具体是由硫原子、砜桥联的喹唑啉类四齿铂配合物,其结构通式为下述式(i)和式(ii)所表示的化合物:
其中r是苯基、4-氟取代苯基、2,4-二氟取代苯基、3,4,5-三氟取代苯基、4-三氟甲基取代苯基、2-三氟甲基取代苯基、2,6-二甲基取代苯基、4-甲氧基取代苯基、4-硝基取代苯基、4-n,n-二甲胺取代苯基、2-苯并噻吩基、2-苯并呋喃基、9-(4-取代苯基)咔唑、9-(4-取代苯基)吩噻嗪、2取代9,9-二甲基芴基、叔丁烷氧基、2,6-二甲基取代苯氧基、六氢吡啶基、n-咔唑基、n-二苯胺基、n-二(4-叔丁基苯基)胺基、n-吩噻嗪基或9,9-二甲基氢化吖啶基中的一种。
本发明的硫桥联的喹唑啉类四齿铂配合物磷光材料的制备方法,所述的式(ι)和式(ii)所示的硫桥联的喹唑啉类四齿铂配合物磷光材料的制备方法包含以下步骤:
步骤1)2-(3-卤代苯基)-4-氯喹唑啉与rh溶于极性溶剂中,在碱、催化剂的存在下,25~120℃反应6~24h,得到如式(1)所表示的喹唑啉类衍生物,其中x是-br、-i;
步骤2)如式(1)所表示的喹唑啉类衍生物溶于极性溶剂中,加入硫化试剂、碱、钯催化剂,在100~150℃下反应6~12h,得到如式(2)所表示的硫原子桥联的配体;
步骤3)如式(2)所表示的硫原子桥联的配体溶于极性溶剂中,加入氧化剂、催化剂,25~50℃下反应3~24h,得到如式(3)所表示的砜桥配体;
步骤4)如式(2)所表示的硫原子桥联的配体溶于极性溶剂中,加入铂盐、相转移催化剂,先室温搅拌12~24h,然后升温至120~150℃下反应24h~72h,得到如式(4)所表示的硫原子桥联的喹唑啉类四齿铂配合物;
步骤5)如式(3)所表示的砜桥配体溶于极性溶剂中,加入铂盐、相转移催化剂,先室温搅拌12~24h,然后升温至120~150℃下反应24h~72h,得到如式(5)所表示的砜桥联的喹唑啉类四齿铂配合物。
其中:
步骤1)中:反应物用量是,按摩尔份数计,2-(3-溴苯基)-4-氯喹唑啉1份,带有活性基团的化合物rh1~4份,催化剂0.01~0.1份,极性溶剂10~50份,碱0.1~10份;所述r是苯基、4-氟取代苯基、2,4-二氟取代苯基、3,4,5-三氟取代苯基、4-三氟甲基取代苯基、2-三氟甲基取代苯基、2,6-二甲基取代苯基、4-甲氧基取代苯基、4-硝基取代苯基、4-n,n-二甲胺取代苯基、2-苯并噻吩基、2-苯并呋喃基、9-(4-取代苯基)咔唑、9-(4-取代苯基)吩噻嗪、2取代9,9-二甲基芴基、叔丁烷氧基、2,6-二甲基取代苯氧基、六氢吡啶基、n-咔唑基、n-二苯胺基、n-二(4-叔丁基苯基)胺基、n-吩噻嗪基或9,9-二甲基氢化吖啶基;所述的催化剂是四三苯基磷钯、双(二亚芐基丙酮)钯、三(二亚芐基丙酮)二钯、二(三苯基膦)二氯化钯或1,1'-二(二苯膦基)二茂铁二氯化钯;所述的碱是碳酸钾、碳酸钠、叔丁醇钠、叔丁醇钾、正丁基锂或氢化钠;所述有机溶剂是乙醇、乙二醇二甲醚、甲苯,四氢呋喃、二甲基亚砜、n,n—二甲基甲酰胺、n,n—二甲基乙酰胺或1,4-二氧六环中的一种或几种的混合物。
步骤2)中:反应物用量是,按摩尔份数计,如式(1)所表示的化合物1份,硫化试剂0.5~1份,碱0.6~1份,钯催化剂0.05~0.1份,有机溶剂10~30份;所述的硫化试剂是硫代乙酸钾、硫代乙酸钠、硫脲、硫化钠、硫氰化钾或硫;所述催化剂是四三苯基磷钯、双(二亚芐基丙酮)钯、三(二亚芐基丙酮)二钯、二(三苯基膦)二氯化钯、1,1'-二(二苯膦基)二茂铁二氯化钯、碘化亚铜或氧化铜;所述的碱是氢氧化钠、氢氧化钾、碳酸钾、磷酸钾、乙酸钾、氟化钾、碳酸铯、叔丁醇钠或叔丁醇钾;所述极性溶剂是甲苯、丙酮、聚乙二醇、二甲基亚砜、n,n—二甲基甲酰胺、n,n—二甲基乙酰胺或四氢呋喃中的一种或几种的混合物。
步骤3)中:反应物用量是,按摩尔份数计,如式(2)所表示的硫桥配体1份,氧化剂5~50份,催化剂0-0.1份,极性溶剂10~30份;所述氧化剂是双氧水、硝酸铜、硝酸银、氯化银、高锰酸钾、亚硫酸氢钾、次氯酸钠、高碘酸、铬酸酐、过氧乙酸或过氧苯甲酸中的一种或几种的混合物;所述催化剂是氯化铁、钨酸钠或钒酸钠;所述极性溶剂是乙酸、乙酸酐、乙腈、水、丙酮、二氯甲烷或乙醚中的一种或几种的混合物。
步骤4)中:反应物用量是,按摩尔份数计,如式(2)所表示的硫桥配体1份,铂盐1.1~2份,相转移催化剂0~0.5份,极性溶剂10~30份;所述铂盐是四氯铂酸钾、四氯铂酸铵、三氯氨合铂酸钾、二氯二(二甲基亚砜)化铂或二氯二(四氢噻吩)化铂;所述相转移催化剂是四丁基溴化铵、三辛基甲基氯化铵、苄基三乙基氯化铵、四丁基氯化铵、四丁基硫酸氢铵、十二烷基三甲基氯化铵、十四烷基三甲基氯化铵或18—冠—6;所述极性溶剂是乙酸、二氯甲烷、氯仿、四氯化碳、1,2-二氯乙烷、乙二醇乙醚、甘油、缩水甘油醚、乙醇、甲醇或水中的一种或几种的混合物。
步骤5)中:反应物用量是,按摩尔份数计,如式(3)所表示的砜桥配体1份,铂盐1.1~2份,相转移催化剂0~0.5份,极性溶剂10~30份;所述铂盐是四氯铂酸钾、四氯铂酸铵、三氯氨合铂酸钾、二氯二(二甲基亚砜)化铂或二氯二(四氢噻吩)化铂;所述相转移催化剂是四丁基溴化铵、三辛基甲基氯化铵、苄基三乙基氯化铵、四丁基氯化铵、四丁基硫酸氢铵、十二烷基三甲基氯化铵、十四烷基三甲基氯化铵或18—冠—6;所述极性溶剂是乙酸、二氯甲烷、氯仿、四氯化碳、1,2-二氯乙烷、乙二醇乙醚、甘油、缩水甘油醚、乙醇、甲醇或水中的一种或几种的混合物。
有益效果:与现有技术相比,本发明具有以下优点:
本发明的硫桥联的喹唑啉类四齿铂配合物磷光材料,最有益的效果是通过在配体骨架上引入硫原子包裹铂核的刚性非共轭结构,硫原子将分子共轭打断,发光波长减小,实现蓝移,在很大程度上的提高了该磷光材料的发光效率和色纯度。通过对作为桥键的硫原子进行氧化,能够使材料发光产生不同程度的蓝移现象。本发明中用含活性基团的化合物取代卤原子,进一步提高配合物的溶解性、空穴传输能力、热稳定性,另外这些基团的引入可以产生一定的空间效应,从而减少配合物发光中心之间的相互作用,减少三重态激子的自淬灭现象,提高材料的发光性能。与部分金属离子有络合作用的硫原子的引入赋予化合物分子具有检测金属离子的效果,使得该材料不仅能应用于有机光电材料领域,也能应用到生物传感中。
附图说明
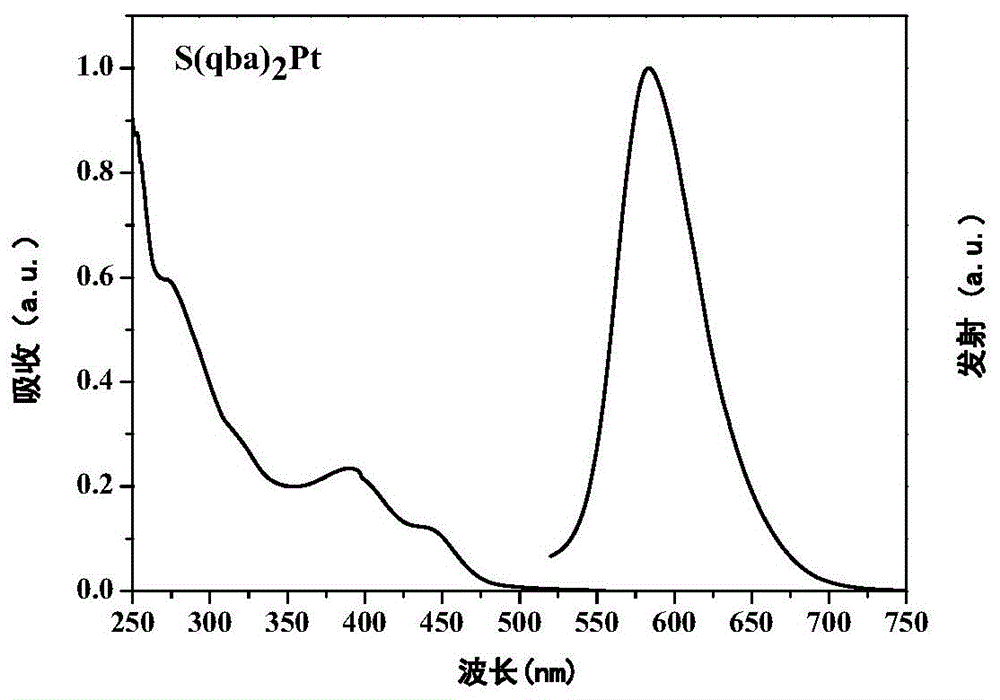
图1为实施例3中,硫桥联的喹唑啉类四齿铂配合物磷光材料s(qba)2pt在二氯甲烷中的紫外吸收(uv)光谱和荧光发射(pl)光谱。
图2为实施例6中,硫桥联的喹唑啉类四齿铂配合物磷光材料s(qcz)2pt在二氯甲烷中的紫外吸收(uv)光谱和荧光发射(pl)光谱。
图3为实施例9中,硫桥联的喹唑啉类四齿铂配合物磷光材料s(qpd)2pt在二氯甲烷中的紫外吸收(uv)光谱和荧光发射(pl)光谱。
图4为实施例11中,硫桥联的喹唑啉类四齿铂配合物磷光材料s(qbao)2pt在二氯甲烷中的紫外吸收(uv)光谱和荧光发射(pl)光谱。
具体实施方式
为了更好地理解本发明专利的内容,下面通过具体的实例和图例来进一步说明本发明的技术方案,具体包括合成、性质测定等。这些实施实例只是对本发明的说明,并不限制本发明。
实施例1、2-(3-溴苯基)-4-二苯胺基喹唑啉qba的制备
称取2-(3-溴苯基)-4-氯喹唑啉0.35g(1mmol)、60%氢化钠0.08g(2mmol)、二苯胺0.25g(1.5mmol)于两口瓶中,氮气保护下加入溶剂二甲基亚砜,30℃反应10h。反应结束后将反应液倒入水中,有大量白色沉淀生产,抽滤,柱层析,用石油醚:乙酸乙酯=20:1展开剂层析分离,得到白色固体qba0.3g(0.67mmol),产率为67%。1hnmr(400mhz,cdcl3)δ7.93(m,8h),7.46(dd,j=5.3,3.2hz,4h),7.12(dd,j=5.4,3.1hz,4h),5.84(s,2h).
实施例2、配体硫原子桥连的喹唑啉s(qba)2的制备
称取2-(3-溴苯基)-4-二苯胺基喹唑啉qba0.225g(0.5mmol)、磷酸钾0.064g(0.3mmol)、硫代乙酸钾0.029g(0.25mmol)、双(二亚苄基丙酮)钯0.023g(0.025mmol),1,1-双(二苯基膦)二茂铁0.02g(0.035mmol),氮气保护下加入甲苯3ml、丙酮1.5ml混合溶剂,110℃反应7h。反应结束后冷却至室温,二氯甲烷萃取,加入无水硫酸钠干燥,柱层析,用石油醚:乙酸乙酯=10:1展开剂层析分离,得到0.1g白色固体s(qba)2,产率为52%。1hnmr(400mhz,cdcl3)δ=8.38(s,2h),8.11(d,j=7.6,2h),7.96(d,j=7.9,2h),7.65(t,j=7.7,2h),7.39–7.28(m,17h),7.17(t,j=11.1,16h).
实施例3、配合物s(qba)2pt的制备
称取硫原子桥连的喹唑啉s(qba)20.077g(0.1mmol)、四氯铂酸钾0.05g(0.1mmol)、四丁基溴化铵4mg,氮气保护下加入5ml乙酸,室温搅拌12小时,升温至120℃反应70h。反应结束后冷却至室温,加入15ml去离子水,有沉淀析出,抽滤,干燥,柱层析,用二氯甲烷:乙酸乙酯=5:1展开剂层析分离,得到0.032g橙红色固体s(qba)2pt,产率为25%。1hnmr(400mhz,cdcl3)δ=8.14–8.07(m,2h),7.47(t,j=7.7,4h),7.42–7.28(m,9h),7.09(t,j=7.6,1h),6.99–6.93(m,2h).maldi-tof-ms(m/z):calcdfor[m]+c52h34n6spt:969.37,found:969.594.
实施例4、2-(3-溴苯基)-4-咔唑基喹唑啉qcz的制备
称取2-(3-溴苯基)-4-氯喹唑啉0.35g(1mmol)、60%氢化钠0.08g(2mmol)、咔唑0.28g(1.5mmol)于两口瓶中,氮气保护下加入溶剂二甲基亚砜10ml,30℃反应8h。反应结束后将反应液倒入水中,有大量黄色沉淀生产,抽滤,柱层析,用石油醚:乙酸乙酯=20:1展开剂层析分离,得到黄色固体qcz0.36g(0.8mmol),产率为80%。1hnmr(400mhz,dmso)δ=8.32(d,j=7.1,2h),8.27(d,j=8.2,1h),8.15–8.08(m,2h),8.06(d,j=9.3,1h),7.75(d,j=8.4,1h),7.67(dd,j=9.5,6.8,1h),7.50–7.36(m,7h),7.14(dd,j=8.2,3.6,1h).
实施例5、配体硫原子桥连的喹唑啉s(qcz)2的制备
称取2-(3-溴苯基)-4-咔唑基喹唑啉qcz0.23g(0.5mmol)、磷酸钾0.064g(0.3mmol)、硫代乙酸钾0.029g(0.25mmol)、双(二亚苄基丙酮)钯0.023g(0.025mmol),1,1-双(二苯基膦)二茂铁0.02g(0.035mmol),氮气保护下加入甲苯3ml、丙酮1.5ml混合溶剂,110℃反应8h。反应结束后冷却至室温,二氯甲烷萃取,加入无水硫酸钠干燥,柱层析,用石油醚:乙酸乙酯=10:1展开剂层析分离,得到0.16g黄色固体s(qcz)2,产率为72%。1hnmr(400mhz,cdcl3)δ=8.77(s,1h),8.53(d,j=6.8,1h),8.22(d,j=9.1,1h),8.13(d,j=7.2,2h),7.94(t,j=7.2,1h),7.82(d,j=8.0,1h),7.55–7.45(m,3h),7.43(d,j=7.3,2h),7.35(dd,j=14.9,6.3,4h).
实施例6、配合物s(qcz)2pt的制备
称取硫原子桥连的喹唑啉s(qcz)20.08g(0.1mmol)、四氯铂酸钾0.05g(0.12mmol)、四丁基溴化铵4mg,氮气保护下加入5ml乙酸,0.5ml去离子水,室温搅拌12小时,升温至120℃反应70h。反应结束后冷却至室温,加入20ml去离子水,有沉淀析出,抽滤,干燥,柱层析,用二氯甲烷:石油醚=5:1展开剂层析分离,得到0.023g橙红色固体s(qcz)2pt,产率为19%。1hnmr(400mhz,cdcl3)δ=8.78(s,2h),8.53(d,j=7.8,2h),8.22(d,j=8.6,4h),8.13(d,j=6.9,4h),7.94(d,j=8.4,2h),7.82(d,j=8.4,2h),7.43(s,7h),7.38–7.31(m,10h).maldi-tof-ms(m/z):calcdfor[m]+c44h30n6spt:869.91,found:869.77.maldi-tof-ms(m/z):calcdfor[m]+c52h30n6spt:966.00,found:965.448.
实施例7、2-(3-溴苯基)-4-哌啶基喹唑啉qpd的制备
称取2-(3-溴苯基)-4-氯喹唑啉0.35g(1mmol)、60%氢化钠0.08g(2mmol)于两口瓶中,氮气保护下加入溶剂二甲基亚砜10ml、哌啶0.12ml(1.5mmol),在30℃条件下反应6h。反应结束后将反应液倒入水中,有大量白色沉淀生产,抽滤,柱层析,用石油醚:乙酸乙酯=50:1展开剂层析分离,得到白色固体qpd0.25g(0.68mmol),产率为68%。1hnmr(400mhz,dmso)δ=8.58(s,1h),8.45(d,j=7.9,1h),7.94(d,j=8.1,1h),7.86(d,j=9.4,1h),7.80(t,j=7.1,1h),7.68(d,j=9.0,1h),7.49(dt,j=15.7,8.0,2h),3.77(s,4h),1.72(s,6h).
实施例8、配体硫原子桥连的喹唑啉s(qpd)2的制备
称取2-(3-溴苯基)-4-哌啶基喹唑啉qpd0.18g(0.5mmol)、磷酸钾0.064g(0.3mmol)、硫代乙酸钾0.029g(0.25mmol)、双(二亚苄基丙酮)钯0.023g(0.025mmol),1,1-双(二苯基膦)二茂铁0.02g(0.035mmol),氮气保护下加入甲苯3ml、丙酮1.5ml混合溶剂,110℃反应7h。反应结束后冷却至室温,二氯甲烷萃取,加入无水硫酸钠干燥,柱层析,用石油醚:乙酸乙酯=20:1展开剂层析分离,得到0.10g白色固体s(qpd)2,产率为57%。1hnmr(400mhz,cdcl3)δ=8.65(s,2h),8.48(d,j=7.6,2h),7.91(dd,j=27.0,8.6,4h),7.74–7.67(m,2h),7.51–7.38(m,7h),3.77–3.68(m,8h),1.84–1.72(m,15h).
实施例9、配合物s(qpd)2pt的制备
称取硫原子桥连的喹唑啉s(qpd)20.06g(0.1mmol)、四氯铂酸钾0.05g(0.12mmol)、四丁基溴化铵4mg,氮气保护下加入5ml乙酸,0.5ml去离子水,室温搅拌12小时,升温至120℃反应70h。反应结束后冷却至室温,加入20ml去离子水,有沉淀析出,抽滤,干燥,柱层析,用二氯甲烷:石油醚=5:1展开剂层析分离,得到0.012g橙红色固体s(qpd)2pt,产率为12%。1hnmr(400mhz,cdcl3)δ=8.17–8.06(m,2h),7.96–7.69(m,4h),7.64–7.37(m,4h),7.23–7.14(m,2h),7.11–6.98(m,2h),4.11(d,j=22.2,8h),1.94(dd,j=41.7,11.1,12h).maldi-tof-ms(m/z):calcdfor[m]+c38h34n6spt:801.88,found:801.398.
实施例10、配体s(qbao)2的制备
称取硫原子桥连的喹唑啉s(qba)20.22g(0.3mmol)、30%双氧水3ml,加入1ml乙酸和2ml乙酸酐,室温搅拌12小时。反应结束后除去溶剂,干燥,柱层析,用乙酸乙酯:石油醚=5:1展开剂层析分离,得到0.052g黄色色固体s(qbao)2,产率为23%。1hnmr(400mhz,cdcl3)δ=8.74(s,2h),7.82(d,j=6.5,2h),7.72(dd,j=7.0,3.5,2h),7.40(dd,j=9.1,4.0,9h),7.34(d,j=3.3,4h),7.26(s,15h).
实施例11、配合物s(qbao)2pt的制备
称取硫原子桥连的喹唑啉s(qbao)20.16g(0.1mmol)、四氯铂酸钾0.1g(0.12mmol)、四丁基溴化铵4mg,氮气保护下加入5ml乙酸,0.5ml去离子水,室温搅拌12小时,升温至120℃反应70h。反应结束后冷却至室温,加入20ml去离子水,有沉淀析出,抽滤,干燥,柱层析,用二氯甲烷:石油醚=5:1展开剂层析分离,得到0.05g橙黄色色固体s(qbao)2pt,产率为20%。1hnmr(400mhz,cdcl3)δ=7.73(dd,j=9.2,6.3,2h),7.54(dd,j=16.4,11.4,8h),7.40(dd,j=13.8,7.4,13h),7.24–7.14(m,9h).maldi-tof-ms(m/z):calcdfor[m]+c38h34n6spt:1002.03,found:1001.901.
- 还没有人留言评论。精彩留言会获得点赞!