一种子宫内膜异位症诊断、预后标志物及其应用的制作方法
本发明属于医学领域和生物技术领域,具体涉及bcar3基因作为子宫内膜异位症诊断、预后以及标志物及治疗药物的应用,可根据个体bcar3基因在子宫在位内膜中表达水平进行子宫内膜异位症的诊断及病情发展的判断。
背景技术:
子宫内膜异位症(endometriosis,ems,简称内异症)是妇科常见病及难治病,它虽为雌激素依赖的良性疾病,但有病灶分布广泛、形态多样、局部侵袭、远处转移及复发等多种类似恶性肿瘤的生物学行为。内异症发病机制众说纷纭,其中“经血逆流学说”是解释其发病机制的经典学说,但无法解释的是,经血逆流是生育年龄女性常见生理现象,发生率为90%左右,而内异症发生率仅为10%-15%,说明内异症在位内膜基因表达谱与正常内膜相比存在显著差异,细胞粘附、侵袭等相关基因表达紊乱导致在位细胞功能改变,形成异位种植的基本条件。同时,自身免疫功能异常及异位内膜雌激素代谢增强等同样在内异症发生中起重要作用。
近年来,microrna作为调控基因表达的小rna,在疾病发生机理中的源头作用受到关注,microrna可通过与靶mrna3’非编码区(3’utrs)不完全互补配对,负向调控靶基因表达。本课题组前期研究证明:mir-126-3p在内异症在位内膜间质细胞中低表达导致其侵袭性增强。mir-126-5p及mir-126-3p来自同一前体pre-mir-126,在多种组织及细胞中表达水平相当,变化趋势相同,发挥相似的功能。mir-126-5p在多种癌症中低表达,其本身可作为抑癌基因抑制肿瘤细胞迁移及侵袭。生物信息学预测软件结果显示bcar3基因是mir-126-5p下游靶标之一。本研究证实低表达可促进内异症在位内膜间质细胞迁移及侵袭能力;mir-126-5p可以负向调控bcar3表达及对间质细胞的迁移及侵袭的影响。
bcar3(breastcanceranti-estrogenresistance3)基因,又称and-34或nsp2,属nsp(novelsrchomology2(sh2)-containingprotein)家族。bcar3蛋白能在活体外诱导雌激素依赖性乳腺癌细胞对抗雌激素药物产生耐药,是导致雌激素受体阳性乳腺癌患者抗雌激素药物耐药而使内分泌治疗失败的重要原因之一。异位内膜局部抗雌激素作用是避免内异症发生的保护因素,而局部抗雌激素作用被抑制将促进异位病灶形成,那么,bcar3作为候选基因之一值得探讨。bcar3异常高表达还可诱导细胞骨架重排,促进细胞粘附、迁移及侵袭,bcar3已被报道高表达于乳腺癌、卵巢癌及多数内膜癌细胞中,但bcar3在内异症中的作用尚无报道,本次研究证实bcar3高表达可促进内异症在位内膜间质细胞迁移及侵袭能力。
子宫内膜异位症是具有侵袭、种植、复发及广泛生长等类似于恶性肿瘤生物学行为的疑难病及常见病,且具有恶变倾向。主要临床症状表现为继发性痛经进行性加重、慢性盆腔疼痛、不孕等。并且,因其特有的生物学发展特性,造成临床手术后复发风险大,不孕率增加。因此急需获得新的标志物在内异症的诊断及预后过程中为临床提供参考,在相同高危因素作用下,在位内膜与异位内膜存在一致的病理性增殖变化趋势,甚至异位内膜较在位内膜对高危因素更敏感。因此mir-126-5p和bcar3在内异症在位内膜中的表达情况可以作为预测内异症风险及诊断的标志物,mir-126-5p和bcar3的干扰物可以作为药物在内异症治疗中发挥作用。
技术实现要素:
本发明的目的是提供一种子宫内膜异位症诊断、预后标志物,mir-126-5p和bcar3在内异症中均为差异表达基因,二者在内异症异位内膜及在位内膜中的表达与正常内膜中均存在显著差异,因此,mir-126-5p和bcar3参与内异症发生。阐明mir-126-5p和bcar3在内异症中的作用和机理对开发以mir-126-5p和bcar3为策略的内异症的诊断、预后具有及其重要的意义和应用前景。
本发明的另一目的在于提供了mir-126-5p和bcar3作为子宫内膜异位症治疗药物的应用。
为了实现上述目的,本发明采用以下技术方案。
一种子宫内膜异位症诊断、预后标志物及其应用,其特征在于该标志物为mir-126-5p或bcar3。
所述的bcar3在制备用于诊断和/或预后评估内异症的试剂盒中的应用。
所述的bcar3为子宫内膜异位症疾病风险评估的生物标志物。
所述的mir-126-5p或bcar3的重组病毒载体制备具有抑制内异症功能的产品中的应用。
所述的mir-126-5p或bcar3的重组病毒载体,用于制备预防和/或治疗内异症的药物。
与现有技术相比,本发明的有益效果如下。
本发明提供的bcar3基因在内异症异位内膜及在位内膜中均高表达,其中iii-iv期患者表达水平高于i-ii期患者;同时发现bcar3在上皮细胞及间质细胞中的表达模式存在差异:上皮细胞中,bcar3在异位内膜上皮细胞中高表达,在在位内膜上皮细胞与正常对照相比无明显差异;间质细胞中,bcar3表达量依次为:异位内膜最高,在位内膜次之,而正常内膜最低,三者差异明显。bcar3检测试剂盒对bcar3在子宫内膜中表达水平进行特异性的检测能达到到诊断和/或预后评估内异症的目的,此外,可以评估子宫内膜异位症的风险;体外细胞实验显示,mir-126-5p低表达、bcar3高表达可促进内异症在位内膜间质细胞迁移及侵袭能力;mir-126-5p可以负向调控bcar3表达及对间质细胞的迁移及侵袭的影响。mir-126-5pagomir和靶向敲低bcar3的重组慢病毒载体通过抑制bcar3的表达,能够起到抑制内异症细胞侵袭和迀移,以及促进细胞凋亡起到抗肿瘤作用;将mir-126-5pagomir和bcar3的重组慢病毒载体作为药物,导入体内,对内异症将具有预防及治疗作用。因此,mir-126-5p和bcar3可以作为一种新的生物标志物,应用于内异症的诊断和/或预后评估;而与之相应的mir-126-5pagomir和bcar3的重组慢病毒载体,可以作为一种新型的药物,对内异症具有潜在的预防和治疗价值。
附图说明
图1是内异症异位内膜及在位内膜bcar3蛋白同时表达于内膜上皮及间质细胞。上皮细胞中:异位内膜表达量明显高于在位内膜(p<0.05),在位内膜和正常子宫内膜比较无显著差别;而在间质细胞中,异位内膜表达量最高,在位内膜组次之,正常子宫内膜组最低,三者间差别有统计学意义(p<0.01)。
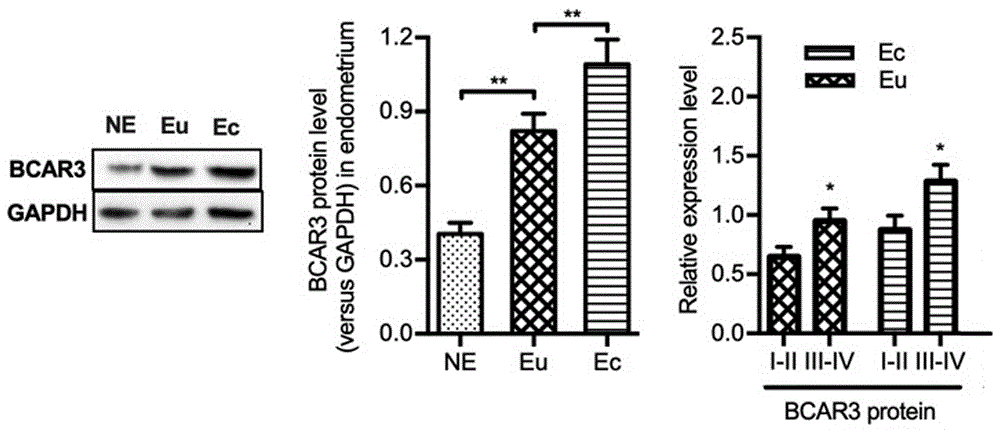
图2是异位内膜、在位内膜、正常内膜组bcar3蛋白相对表达水平分别为1.09±0.10、0.82±0.07、0.40±0.05,有非常显著统计学差异,p<0.01。iii-iv期内异症患者在位内膜及异位内膜中,bcar3蛋白表达水平较i-ii期患者增高,p<0.05。
图3是异位内膜、在位内膜、正常内膜组bcar3mrna相对表达水平分别为1.75±0.09、1.53±0.07、1.16±0.14,有显著统计学差异,p<0.05。iii-iv期与i-ii期内异症患者在位内膜及异位内膜中,bcar3mrna表达水平相似。
图4是内异症异位内膜及在位内膜中mir-126-5p的表达情况,异位内膜组(0.36±0.04)表达水平明显低于在位内膜组(0.40±0.04),差异显著,p<0.01,而在位内膜组又明显低于正常对照组(1.09±0.09),p<0.01。
图5是相关性分析:mir-126-5p与bcar3mrna呈弱负相关r=-0.417,p<0.01;mir-126-5p与bcar3蛋白呈强负相关:r=-0.669,p<0.01。
图6是mir-126-5pagomir及阴性对照转染内异症在位内膜间质细胞,mir-126-5pantagomir及阴性对照转染正常内膜间质细胞。
图7是内异症在位内膜间质细胞转染mir-126-5pagomir后细胞迁移能力显著低于阴性对照组和未转染组(p<0.01)。相反的,正常内膜间质细胞转染mir-126-5pantagmir后细胞迁移能力高于阴性对照组和未转染组(p<0.01)。
图8是内异症在位内膜间质细胞转染mir-126-5pagomir后细胞侵袭能力显著低于阴性对照组和未转染组(p<0.01)。相反的,正常内膜间质细胞转染mir-126-5pantagmir后细胞侵袭能力高于阴性对照组和未转染组(p<0.01)。
图9是qrt-pcr和westernblot检测在内异症在位内膜间质细胞与正常内膜间质细胞中bcar3mrna和蛋白表达比较,bcar3mrna表达为1.74±0.13vs1.10±0.08,p<0.01;bcar3蛋白表达为0.98±0.05vs.0.54±0.05,p<0.01。
图10是沉默在位内膜间质细胞bcar3基因,与对照组比较,bcar3蛋白表达显著降低。
图11是沉默在位内膜间质细胞bcar3基因,与对照组比较,迁移能力显著下降(p<0.01);同时过表达正常内膜间质细胞bcar3基因,迁移能力较对照组显著上升(p<0.01)。
图12是沉默在位内膜间质细胞bcar3基因,与对照组比较,侵袭能力显著下降(p<0.01);同时过表达正常内膜间质细胞bcar3基因,侵袭能力较对照组显著上升(p<0.01)。
图13是分别构建了含有野生型wt-bcar33’utr和突变型mut-bcar33’utr的荧光素酶报告质粒,荧光素酶实验结果提示,mir-126-5pagomir可抑制wt-bcar33’utr荧光活性,而对mut-bcar33’utr荧光活性没有影响,提示mir-126-5p可直接结合bcar33’utr。
图14是为验证mir-126-5p可调控bcar3表达,向escs中转染mir-126-5pagomir,发现mir-126-5pagomir可明显下调bcar3蛋白水平(p<0.01)。反之,向nescs中转染mir-126-5pantagomir,bcar3蛋白表达明显上调。
图15是在mir-126-5p稳定下调的nescs中沉默bcar3基因,发现沉默bcar3可抑制mir-126-5p低表达对nescs迁移及侵袭的促进作用。
图16是在mir-126-5p稳定上调的escs中过表达bcar3基因,发现mir-126-5p过表达后对escs迁移及侵袭的抑制可被上调的bcar3逆转。
具体实施方式
下面结合具体的实施例对本发明作进一步的说明,以下实施例将有助于对本发明的了解,但这些实施例仅为了对本发明加以说明,本发明并不限于这些内容。在实施例中未作特殊说明的操作方法均为本技术领域常规操作方法。
实施例
标本选择。
选择因卵巢子宫内膜异位症行子宫切除术患者32例(43.38±5.01岁),收集其配对的在位内膜(eutopicendometrium,eu)及异位内膜(ectopicendometrium,ec)作为实验组;同期选择因宫颈上皮内瘤变行子宫切除术患者31例(43.74±4.69岁),收集其子宫内膜(eutopicnormalendometrium,en)作为对照组。两组患者均月经规律,未合并其它内外科疾病,术前6个月未接受激素类药物治疗。全部病例经术后病理确定诊断。此项研究取得辽宁省肿瘤医院伦理委员会批准。新鲜标本离体后分为3部分:部分用10%中性甲醛固定,石蜡包埋;部分立即置于液氮中,冻存于-80℃冰箱待用;部分立即细胞提取。
1.细胞培养
利用本研究团队系列研究中已经较成熟的方法[20,21],用0.1%i型胶原酶(sigma,usa)37℃孵箱恒温消化60min,100目筛网过滤去除组织残渣,将滤过液离心后重悬于无血清dmem/f12培养基,再次过400目筛网,再次离心滤过液,将滤过液中的间质细胞,重悬于含1%青霉素/链霉素、10%胎牛血清dmem/f12培养基(gibco,usa)中;将滤网翻面后,用pbs充分洗下滤网上的上皮细胞,冲洗液离心后,重悬于用含10%fbs的dmem/f12培养液(含100iu/ml青霉素,100iu/ml链霉素)中,37℃、5%co2下培养。hek293t细胞培养于含有10%胎牛血清的dmem培养基(gibco,usa)中,37℃、5%co2条件下培养。
2.总rna提取及qrt-pcr
采用trizol试剂(invitrogen,carlsbad,ca,usa)提取总rna,所有的操作都在去rnase的条件下进行。分光光度法测定rna浓度。mrna参照
3.免疫组化
组织经甲醛固定、石蜡包埋后制成4μm厚切片。将切片脱蜡至水,经热修复暴露抗原决定族,10%山羊血清室温封闭30min,抗体4℃孵育过夜(bcar3,1:400,abcam,usa;e-cadherin,1:400,cellsignaling,usa;vimentin,1:400,cellsignaling,usa),生物素标记的二抗(博士德,中国)室温孵育1h,dab试剂(中山金桥,中国)染色10min。结果判定:切片随机编号,双盲阅片。以出现棕黄色或深褐色颗粒为阳性表达,无棕黄色或深褐色颗粒为阴性表达。光学显微镜观察,按阳性细胞百分比及阳性细胞染色强度评分,his=a×b。①a代表阳性细胞的百分比对应的评分:无阳性细胞显色,a=0;阳性细胞显色数<10%,a=1;阳性细胞显色数10%-50%,a=2;阳性细胞显色数>50%,a=3。②b代表阳性细胞染色强度:不显色,b=0;浅黄色,b=1;棕黄色,b=2;深黄色,b=3。判定标准:his=0分,为阴性(-);his=1-3分,为弱阳性(+);his=4-6分,为阳性(++);his=7-9分,为强阳性(+++)。
4.蛋白提取及免疫印迹
ripa裂解液(凯基,中国)从组织及培养细胞提取蛋白,参照bca试剂盒(thermoscientific,usa)测定蛋白的浓度。10%sds-page胶按分子量分离蛋白后,转移至pvdf膜(millipore,usa),5%脱脂奶粉封闭2h,抗体4℃孵育过夜,hrp偶联的二抗孵育2h。ecl试剂(thermoscientific,usa)于imagequantlas4000(gehealthcarelifesciences,usa)系统中检测信号强度。
5.双荧光素基因报告
以bcar3cdna为模板用pcr技术扩增bcar33’utr,再将产物连接入pmirglo载体中,应用单点突变试剂盒(qiagen,usa)构建bcar33’utr突变(mt),进行双荧光素报告基因研究。hek293t细胞接种至24孔板后,800ngwt或mt与mir-126-5pagomir或阴性对照(吉玛基因,中国)在lipofectamine2000(invitrogen,usa)作用下进行转染。24h后以海肾荧光活性作为内参对照,采用dual-gloluciferaseassaysystem(promega,usa)检测萤火虫荧光活性。
6.细胞转染及感染
mir-126-5pagomir、mir-126-5pantagomir和阴性对照序列购自吉玛基因(中国)。选取处于对数生长期的内膜间质细胞接种于6孔板中,待细胞汇合度达50%时,按照lipofectamine2000试剂说明书进行转染,寡核苷酸的转染终浓度为20μmol/l,6h后换成完全培养基继续培养,48小时后通过荧光定量pcr检测转染效率。
包含bcar3cdna,bcar3sirna或阴性对照序列的慢病毒购自吉凯基因(中国)。当6孔板中在位内膜间质细胞融合度达到50%或在位内膜上皮细胞融合度达到60%时,更换含有10%胎牛血清和8μg/mlpolybrene的dmem/f12培养基,每孔加入慢病毒颗粒在为内膜间质细胞至终浓度为50mn、上皮细胞至终浓度为100mn。转染后72h,通过观察绿色荧光蛋白检测转染效率。
7.transwell迁移及侵袭实验。
各组细胞处理48h后,用胰酶消化,无血清培养基稀释至1×105cell/ml,取200μl接种于上室(孔径8μm,24孔板;db,usa),下室加入600μl含20%血清的培养液,每组设3个复孔,37摄氏度、5%co2条件下培养24h。取出培养小室,用棉签擦去膜上层的细胞,用10%中性甲醛固定15min,结晶紫染色30min。在做侵袭实验前,将matrigel基质胶(bd,usa)用预冷无血清dmem/f12培养基1:7稀释后,加入transwell小室。待基质胶充分凝固后,进行上述步骤。最后于倒置显微镜下每组随机选取5个高倍视野计数细胞个数。
8.数据统计
数据均显示为平均值±标准误。数据统计应用spss21.0,以t检验及anova进行显著性统计学分析,以pearson's相关检验进行相关行分析。p<0.05(双侧检验)为有统计学意义。
8.1子宫内膜异位症异位内膜及在位内膜中bcar3基因的表达
免疫组化结果见图1,内异症异位内膜及在位内膜bcar3蛋白同时表达于内膜上皮及间质细胞。上皮细胞中:异位内膜表达量明显高于在位内膜(p<0.05),在位内膜和正常子宫内膜比较无显著差别;而在间质细胞中,异位内膜表达量最高,在位内膜组次之,正常子宫内膜组最低,三者间差别有统计学意义(p<0.01)。westernblot结果见图2,异位内膜、在位内膜、正常内膜组bcar3蛋白相对表达水平分别为1.09±0.10、0.82±0.07、0.40±0.05,有非常显著统计学差异,p<0.01。iii-iv期内异症患者在位内膜及异位内膜中,bcar3蛋白表达水平较i-ii期患者增高,p<0.05;qrt-pcr结果见图3,异位内膜、在位内膜、正常内膜组bcar3mrna相对表达水平分别为1.75±0.09、1.53±0.07、1.16±0.14,有显著统计学差异,p<0.05。iii-iv期与i-ii期内异症患者在位内膜及异位内膜中,bcar3mrna表达水平相似;
8.2mir-126-5p的表达及与bcar3基因表达相关性分析
图4为内异症异位内膜及在位内膜中mir-126-5p的表达情况,异位内膜组(0.36±0.04)表达水平明显低于在位内膜组(0.40±0.04),差异显著,p<0.01,而在位内膜组又明显低于正常对照组(1.09±0.09),p<0.01;图5为相关性分析:mir-126-5p与bcar3mrna呈弱负相关r=-0.417,p<0.01;mir-126-5p与bcar3蛋白呈强负相关:r=-0.669,p<0.01;8.3.mir-126-5p低表达促进在位内膜间质细胞迁移及侵袭;图6为mir-126-5pagomir及阴性对照转染内异症在位内膜间质细胞,mir-126-5pantagomir及阴性对照转染正常内膜间质细胞。通过transwell检测细胞迁移及侵袭能力,图7内异症在位内膜间质细胞转染mir-126-5pagomir后细胞迁移能力显著低于阴性对照组和未转染组(p<0.01)。相反的,正常内膜间质细胞转染mir-126-5pantagmir后细胞迁移能力高于阴性对照组和未转染组(p<0.01)。图8内异症在位内膜间质细胞转染mir-126-5pagomir后细胞侵袭能力显著低于阴性对照组和未转染组(p<0.01)。相反的,正常内膜间质细胞转染mir-126-5pantagmir后细胞侵袭能力高于阴性对照组和未转染组(p<0.01)。
8.4.bcar3促进子宫内膜异位症在位内膜间质细胞的迁移及侵袭
图9为qrt-pcr和westernblot检测在内异症在位内膜间质细胞与正常内膜间质细胞中bcar3mrna和蛋白表达比较,bcar3mrna表达为1.74±0.13vs1.10±0.08,p<0.01;bcar3蛋白表达为0.98±0.05vs.0.54±0.05,p<0.01;图10为沉默在位内膜间质细胞bcar3基因,与对照组比较,bcar3蛋白表达显著降低;图11沉默在位内膜间质细胞bcar3基因,与对照组比较,迁移能力显著下降(p<0.01);同时过表达正常内膜间质细胞bcar3基因,迁移能力较对照组显著上升(p<0.01);图12沉默在位内膜间质细胞bcar3基因,与对照组比较,侵袭能力显著下降(p<0.01);同时过表达正常内膜间质细胞bcar3基因,侵袭能力较对照组显著上升(p<0.01)。
8.5mir-126-5p调控bcar3基因表达及其功能
图13为分别构建了含有野生型wt-bcar33’utr和突变型mut-bcar33’utr的荧光素酶报告质粒,荧光素酶实验结果提示,mir-126-5pagomir可抑制wt-bcar33’utr荧光活性,而对mut-bcar33’utr荧光活性没有影响,提示mir-126-5p可直接结合bcar33’utr。图14为为验证mir-126-5p可调控bcar3表达,向escs中转染mir-126-5pagomir,发现mir-126-5pagomir可明显下调bcar3蛋白水平(p<0.01)。反之,向nescs中转染mir-126-5pantagomir,bcar3蛋白表达明显上调。图15为在mir-126-5p稳定下调的nescs中沉默bcar3基因,发现沉默bcar3可抑制mir-126-5p低表达对nescs迁移及侵袭的促进作用。图16为在mir-126-5p稳定上调的escs中过表达bcar3基因,发现mir-126-5p过表达后对escs迁移及侵袭的抑制可被上调的bcar3逆转。
- 还没有人留言评论。精彩留言会获得点赞!