一种改善间质干细胞生物学功能的方法与流程
本发明涉及一种改善间质干细胞生物学功能的方法。
背景技术:
干细胞是生物体中具有自我更新和分化潜能的种子细胞,在胚胎发育与疾病损伤条件下可发挥组织再生与修复功能,被视为具有再生多组织多器官的潜能。干细胞的分离与体外培养,有望为其临床转化奠定基础,最终实现对人类一系列疾病谱的精准治疗,提高人类的生活质量,延长人类寿命。
其中,间质干细胞治疗作为细胞治疗重要的组成部分,最初是从骨髓中分离得到的一种非造血类的干细胞,它参与构成骨髓造血微环境,对造血干细胞的增殖与分化具有明显的支持作用(friedenstein,a.j.,etal.,1974)。随后发现间质干细胞可粘附于塑料培养板上生长,具有类似于成纤维细胞的形态,能自我更新,体外可分化为成骨细胞、脂肪细胞、软骨细胞,表达cd29、cd44、cd73、cd54、cd90、cd105和cd166,但不表达造血干细胞标志物cd11b、cd14、cd19、cd34、cd45等(kfoury,y.,etal.,2015)。传统上一直认为,干细胞是通过分化为特定细胞来替代病损的组织器官,间质干细胞具有直接分化为成骨细胞、软骨细胞的能力,可以通过直接替代损伤细胞从而在大段骨缺损或软骨损伤的修复中发挥作用。近年来的研究发现,msc具有营养支持与免疫调节功能可能在组织损伤修复与疾病治疗中扮演了更加重要的角色。例如,msc通过旁分泌营养介质(trophicmediators)可以抑制缺血导致的凋亡、抑制瘢痕形成、刺激血管新生和维持血管稳定性、刺激组织内源性干细胞分裂(caplan,a.i.,etal.,2011);在msc的免疫调节方面(wang,y.,etal.,2014),msc能抑制t细胞由丝裂原刺激的增殖反应,增加调节性t细胞比例,降低th1/th2比例,进而引起th17数量下降;msc可以抑制b细胞的增殖、活化以及其抗体分泌,影响b细胞的趋化功能;msc抑制nk细胞增殖、细胞毒作用和细胞因子的分泌;msc还影响apc细胞的抗原递呈功能,通过下调抗原提呈细胞表面的mhc分子以及共刺激分子(cd40、cd86、cd80)和抑制dc细胞成熟来抑制t细胞的活化。同时,参与msc免疫调节作用的主要分子包tgfβ、前列腺素e2(pge-2)、一氧化氮(no)、吲哚胺-2,3-双加氧酶(ido)等。
间质干细胞广泛分布于全身各个组织和器官,除骨髓外,还存在于牙龈,骨骼肌、脂肪等组织中,参与组织的损伤修复及稳态维持。由于其易分离,可向成骨、成脂、成软骨等多个方向分化,具有免疫调节和旁分泌功能,决定了其在损伤修复和组织再生中的广阔应用前景。到目前为止,在www.clinicaltrials.gov注册的与间质干细胞相关的临床实验超过600项,适应症包括移植物抗宿主病(graft-versus-hostdisease,gvhd)、心肌梗死(myocardialinfarction,mi)、肝硬化(hepaticcirrhosis)、多发性硬化(multiplesclerosis,ms)、系统性红斑狼疮(systemiclupuserythematosus,sle)、器官移植(organtransplantation)等方面(mendicino,m.,etal.,2014;trounson,a.,etal.,2015)。本课题组前期已掌握通过流式细胞仪分选7日龄nestin-gfp转基因小鼠的msc的方法,并且鉴定出表面标志物cd29、cd44、cd73、cd90、cd105和cd166可用于分选msc,建立了一套完整的msc分选体系,推进了msc的临床转化进程。要实现其临床转化,首先要具备充足细胞。但是7日龄小鼠的骨髓体积小,细胞总量远少于成体小鼠,成体小鼠提取的骨髓间质干细胞是种子细胞的常见来源。而基于目前的msc培养技术,成体组织中分离的msc在体外扩增十代后增殖能力下降,限制了其应用前景,因此需要探究一种能够促进成体msc长期扩增培养的方法。
细胞扩增是一个能量代谢极其旺盛的过程,需要充足的能量以供合成大量dna和蛋白质,而线粒体作为细胞能量代谢的核心场所,在调控细胞增殖中起着重要作用。线粒体在不同的功能状态下表现出不同的线粒体形态(chen,h.,etal.,2017)。(如表1所示)
表1线粒体形态
鉴于线粒体形态结构在干细胞增殖中的重要作用,调控线粒体动力蛋白的表达和活性,被认为具有促进细胞扩增和细胞保护的作用。线粒体的动力蛋白包括线粒体分裂蛋白和融合蛋白两大家族,线粒体分裂蛋白中以drp1为主要介导线粒体分裂的蛋白,抑制drp1的活性可延长线粒体,使线粒体形态呈现为管状。
mdivi-1是一种新发现的线粒体分裂抑制剂,可通过抑制线粒体分裂蛋白drp1的装配而抑制线粒体分裂。在循环系统的研究中,mdivi-1可改善脑卒中的预后,保护细胞抵抗缺血再灌注损伤,提示其对细胞具有保护作用(li,l.,etal.,2017;dedkova,b.,etal.,2012;prasad,n.,etal.,2012)。因此,向培养基中增添mdivi-1有望保护msc,实现成体msc的长期培养、扩增。目前尚未见有关研究报道实现靶向线粒体的改变和msc的长期培养扩增。
技术实现要素:
基于上述问题,本发明的目的在于克服上述现有技术的不足之处而提供一种一种间质干细胞扩增培养基,本发明提供了一种改善间质干细胞生物学功能的方法,以及通过该方法得到的间质干细胞及其用途。本发明所提供的改善间质干细胞生物学功能的方法是通过线粒体分裂抑制剂靶向线粒体来改善间质干细胞生物学功能的,采用该方法可解决成体组织中分离的msc扩增代数有限,增殖能力较弱以及生物学功能较差的技术难题,并且可以延缓间质干细胞衰老。
为实现上述目的,本发明采取的技术方案包括以下几个方面:
在第一个方面,本发明提供了一种间质干细胞扩增培养基,所述间质干细胞扩增培养基含有液体基础培养基和线粒体分裂抑制剂;优选地,所述线粒体分裂抑制剂为mdivi-1。
本发明所述的mdivi-1是一种小分子化合物,中文名为:3-(2,4-二氯-5-甲氧基苯基)-2-3-二氢-2-硫代氧-4(1h)-喹唑啉酮或3-(2,4-二氯-5-甲氧基苯基)-2-磺酰基-4(3h)-喹唑啉酮;分子式为:c15h10cl2n2o2s;分子量为:353.22。
优选地,所述间质干细胞扩增培养基的制备方法包括以下步骤:
(1)将mdivi-1溶解于dmso中,得到mdivi-1的储存溶液;
(2)将步骤(1)得到的mdivi-1的储存溶液添加到液体基础培养基中,得到间质干细胞扩增培养基。
优选地,所述线粒体分裂抑制剂在所述间质干细胞扩增培养基中的浓度为1~10μmol/l;优选地,所述线粒体分裂抑制剂在所述间质干细胞扩增培养基中的浓度为5μmol/l。
优选地,所述间质干细胞扩增培养基为无血清培养基,所述间质干细胞扩增培养基包括:所述液体基础培养基、所述线粒体分裂抑制剂、10.01μg/l的细胞培养营养添加物、1ng/ml的白血病抑制因子、抗氧化剂、1%的非必需氨基酸和40ng/ml的细胞生长因子;优选地,所述液体基础培养基为dmem/f12培养基,所述细胞培养营养添加物包括亚硒酸钠、胰岛素、转铁蛋白和乙醇胺,所述亚硒酸钠、胰岛素、转铁蛋白和乙醇胺的重量比为1:1000:1000:1,所述白血病抑制因子为lif,所述抗氧化剂包括还原型谷胱甘肽、β-巯基乙醇中的至少一种,所述细胞生长因子包括bfgf、egf,所述bfgf、egf的重量比为1:1;更优选地,所述还原型谷胱甘肽在间质干细胞扩增培养基中的浓度为1.5mg/l,所述β-巯基乙醇在间质干细胞扩增培养基中的浓度为0.1mmol/l。
优选地,所述间质干细胞扩增培养基为有血清培养基,所述间质干细胞培养基包括:所述液体基础培养基、所述线粒体分裂抑制剂和血清;优选地,所述液体基础培养基为dmem高糖培养基,所述液体基础培养基和血清的重量比为9:1。
优选地,所述间质干细胞为骨髓、脂肪、脐带或胎儿来源的间质干细胞。优选地,所述间质干细胞为人或小鼠的间质干细胞。更优选地,所述所述间质干细胞为骨髓来源的间质干细胞。
在第二个方面,本发明提供了一种改善间质干细胞生物学功能的方法,所述方法是通过线粒体分裂抑制剂靶向间质干细胞的线粒体来改善间质干细胞生物学功能的;优选地,所述方法是以间质干细胞为种子细胞,采用上述所述的间质干细胞扩增培养基进行扩增培养的。通过在msc培养液中添加线粒体分裂抑制剂,不仅促进msc长期扩增,而且使msc衰老明显延缓,促进其分泌多种细胞因子。
优选地,所述线粒体分裂抑制剂为mdivi-1,所述改善间质干细胞生物学功能包括延缓间质干细胞衰老、提高间质干细胞增值能力。
优选地,所述改善间质干细胞生物学功能包括延缓间质干细胞衰老、提高间质干细胞增值能力。
在第三个方面,本发明提供了一种采用上述所述的方法得到的间质干细胞。
在第四个方面,本发明提供了线粒体分裂抑制剂、或上述所述的间质干细胞扩增培养基在制备改善间质干细胞生物学功能的制剂、或培养基中的用途;优选地,所述线粒体分裂抑制剂为mdivi-1,所述改善间质干细胞生物学功能包括延缓间质干细胞衰老、提高间质干细胞增值能力。
在第五个方面,本发明提供了上述所述的间质干细胞在制备治疗急性脑卒中、炎症性疾病的药物中的用途。
本发明提供了一种新的利用所述的骨髓间质干细胞扩增培养基进行人骨髓间质干细胞体外长期培养扩增方法,其具体步骤是:利用所述骨髓间质干细胞扩增培养基对骨髓间质干细胞进行扩增培养,细胞瓶置于5%co2、37℃温度培养箱中进行培养,根据细胞增殖情况,每2~3天更换骨髓间质干细胞培养基一次;骨髓间质干细胞在所述骨髓间质干细胞扩增培养基中连续培养10~15天,骨髓间质干细胞的干细胞球直径为500~1000微米时,1500rpm离心5min后吸去培养基,利用0.125%胰酶进行消化,轻轻吹匀至刚好无肉眼可见细胞球,加入3倍体积pbs稀释胰酶。1500rpm离心5min后吸去胰酶,pbs洗2遍后加入所述骨髓间质干细胞扩增培养基,以1:3比例传代。
本发明解决了体外培养骨髓间质干细胞易衰老的技术难题,达到长期规模化培养人或小鼠骨髓间质干细胞的目的,而且经这种方法培养的骨髓间质干细胞的基因稳定,质量可控,为广泛应用于临床提供重要的、充足的骨髓间质干细胞。
本发明的骨髓间质干细胞培养基中添加了其他特殊成分:线粒体分裂抑制剂mdivi-1。
特殊成分的作用机理说明:
线粒体分裂抑制剂mdivi-1:骨髓间质干细胞在衰老过程中伴随着线粒体形态由管状变为点状,测序发现该过程伴随着线粒体分裂蛋白drp1的表达显著升高。mdivi-1为线粒体分裂蛋白drp1的抑制剂,加入培养基有以下作用:
(1)抑制骨髓间质干细胞线粒体由管状变为点状;
(2)促进骨髓间充质的增殖,有利于骨髓间质干细胞的长期培养。
(3)在相同的培养时间下,添加mdivi-1的培养基中的间质干细胞比对照组培养基中的细胞扩增更快;
(4)在长期培养后,添加mdivi-1的培养基中的间质干细胞相比对照组培养基中的细胞,其线粒体功能得到靶向改变,促进了其分泌多种细胞因子。
(5)添加mdivi-1可使间质干细胞在体内移植的存活时间增加,促进机体损伤修复,有效提高间质干细胞治疗急性脑卒中及多种炎症性疾病的效果。
综上所述,本发明的有益效果为:
(1)本发明通过在msc培养液中添加微量的mdivi-1显著提高了骨髓间质干细胞的扩增效果,在较短时间内可以有效提高骨髓间质干细胞总数量,进而为临床前研究提供充足的骨髓间质干细胞,奠定技术基础,且本发明的操作简便。
(2)本发明所提供的方法可明显延缓骨髓间质干细胞的衰老,最长可实现小鼠骨髓间质干细胞在体外有效扩增达10个月,也为其余种类干细胞的长期培养提供可能性。
(3)本发明方法扩增获得的骨髓间质干细胞具有多向分化和定向分化潜能,具有较好的生物活性,通过靶向线粒体的方法更能显著提高msc的治疗效果,对急性脑卒中的治疗及后续恢复具有应用前景。有助于解决细胞治疗的临床转化中msc数量、功能不足等问题,具有良好的应用前景。
附图说明
图1为间质干细胞体外培养后出现细胞衰老检测结果图;
图2为间质干细胞衰老过程中的线粒体形态与功能改变检测结果图;
图3为干扰drp1后间质干细胞增殖及衰老检测结果图;
图4为间质干细胞培养液中加入mdivi-1之后增殖及衰老检测结果图;
图5为加入mdivi-1扩增培养到第8代的间质干细胞体内治疗mcao模型小鼠效果检测图。
具体实施方式
可以理解的是,在此描述的特定实施方式通过举例的方式来表示,其并不作为对本发明的限制。在不偏离于本发明范围的情况下,本发明的主要特征可以用于各种实施方式。本领域的技术人员将会意识到或能够确认,仅仅使用常规实验,许多等同物都能应用于本文所描述的特定步骤中。这些等同物被认为处在本发明的范围之内,并且被权利要求所覆盖。
实施例1msc培养与表型鉴定
取健康成年小鼠骨髓共5ml,与1×pbs按1:1稀释,采用ficoll-paque淋巴分离液用密度梯度离心法从骨髓中分离出单个核细胞(2000rpm,30min),收集到的单个核细胞按1×105/cm2密度接种到75cm2培养瓶进行培养。用l-dmem培养基在37℃、5%co2条件下培养3天后,去除悬浮细胞,换液继续培养。待细胞长至80%密度后,吸去培养基,用pbs洗涤2次,用0.125%胰酶消化1-ni72min,传代比例为1:3。msc由健康小鼠骨髓分离得到,临床用msc的分离、扩增、冻存、复苏等均在符合gmp(goodmanufacturingpractice)标准的条件下进行。在倒置显微镜下每日观察原代和传代细胞的生长情况和形态特征,拍片记录。取体外培养的msc消化成单细胞悬液,用含0.1%bsa+0.05%nan3的pbs(ph7.4)洗涤一遍,弃去上清,调整细胞密度为106/ml于流式管,采用流式抗体cd29、cd34、cd44、cd45、cd73、cd90、cd105、cd166标记msc,充分震荡混匀,4℃,避光孵育30min,然后用含0.1%bsa+0.05%nan3的pbs(ph7.4)洗涤两遍,以去除多余抗体;弃上清,用200ul1%pfa重悬细胞,流式检测msc细胞表型(cd29+,cd34-,cd44+,cd45-,cd73+,cd90+,cd105+,cd166+),证明体外培养对msc细胞表型无影响。将p2代细胞传至六孔板,长至60%左右待用。
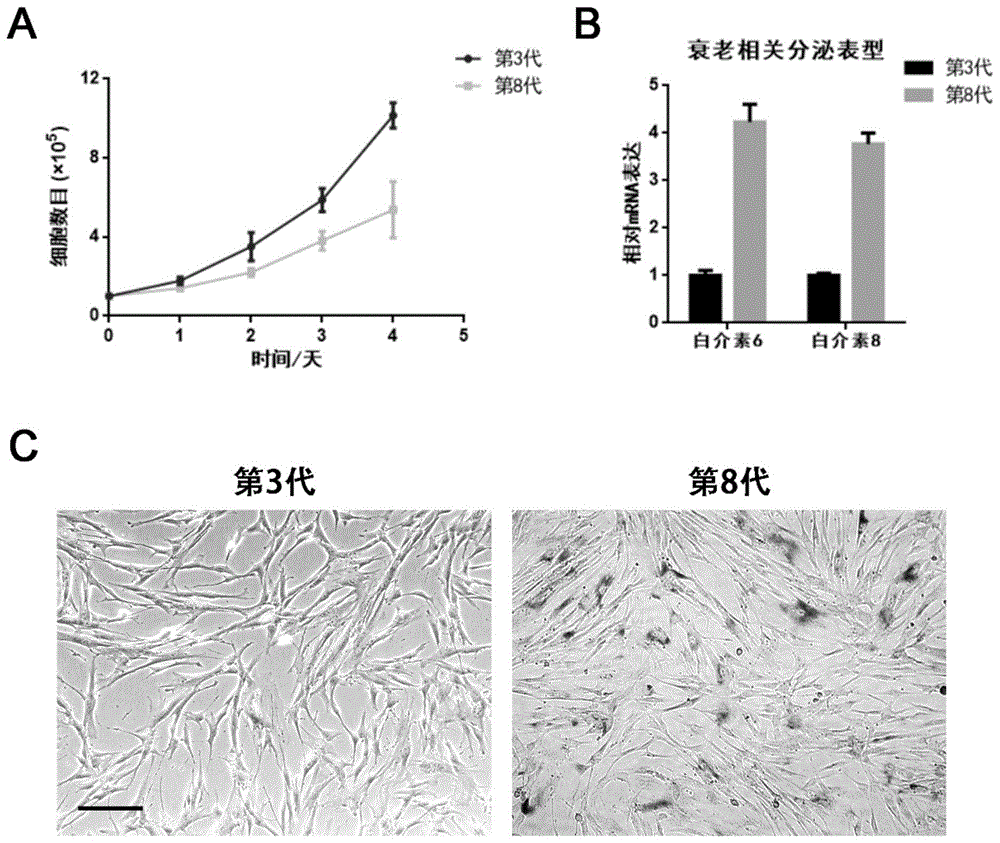
实施例2间质干细胞体外培养后出现细胞衰老检测
本实施例从人骨髓中分离出间质干细胞进行实验。取培养至第3代和第8代细胞用pbs溶液进行稀释,用细胞计数板对间质干细胞进行连续四天的计数,并以第一天培养的细胞数为基准绘制细胞数目的统计图如图1a所示,结果显示:在间质干细胞的传代培养中,第8代细胞随着体外的长期培养细胞增殖能力明显低于第3代细胞。细胞衰老表现为细胞体积的增大、细胞核染色质损伤、β-gal的表达增加以及多种衰老相关分泌因子(本例选取白介素6、白介素8进行阐述)的分泌增多,分别消化第3代细胞和第8代细胞至1.5ml离心管中,加入trizol处理,5分钟后加入氯仿,以每分钟12000转离心10分钟收集水样层并用异丙醇沉淀rna进行提取,以提取的rna为模板,以dntp为底物加入逆转录酶在pcr仪中进行逆转录pcr反应生成cdna,后通过荧光定量pcr检测白介素6和白介素8的表达,以第3代间质干细胞中白介素6和白介素8的表达为基准,第8代间质干细胞的表达相对量绘制统计图如图1b所示,结果显示第8代细胞中衰老相关分泌蛋白(白介素6、白介素8)明显增多。图1c将两组细胞分别接种至12孔板中并对β-gal进行染色并用普通显微镜明场进行拍照,结果显示第8代细胞内β-gal表达增多,提示间质干细胞在体外培养基的长期培养过程中发生衰老。
实施例3间质干细胞衰老过程中的线粒体形态与功能改变检测
本实例取培养至第3代及8代msc进行实验。将msc种植在24孔板(提前铺了拍照专用的圆玻片),包埋固定,穿透后通过抗tom20抗体对线粒体进行免疫荧光染色,用激光共聚焦显微镜对其进行荧光观察并采集图片,通过灰度处理后得到图2a,图2b对拍照收集得到的约500个线粒体依据joshi等评分方法进行线粒体评分,并对评分结果进行统计学分析得出,结果显示msc随着传代数增加线粒体由管状转变为点状。使用seahorse细胞能量代谢分析仪,分别检测第3代及第8代msc线粒体的氧耗率(ocr)及细胞外酸度(ecar),图2c显示第8代线粒体基础耗氧率及最大耗氧率均明显高于第3代线粒体,图2d显示第8代线粒体相对细胞外酸度比率低于第3代,随着干细胞的传代,线粒体供能方式更多以氧化磷酸化方式进行,而糖酵解减少,提示线粒体有明显的衰老迹象。将在12孔板培养的第3代及第8代msc进行消化,用pbs洗涤细胞3次后加入cellrox试剂检测细胞总的活性氧水平,图2e显示通过流式细胞仪检测发现第8代间质干细胞细胞总的活性氧水平显著增加。另一方面,采用sigma-aldrich公司生产的mak064乳酸检测试剂盒,通过酶标仪测定相对乳酸生成率,图2f结果显示第8代msc乳酸生成率相较于第3代有所下降。
实施例4干扰drp1后间质干细胞增殖及衰老检测
本实例选取培养至第8代的msc,分别设立对照组(无处理)及干扰组(在培养基中添加mdivi-1干扰drp1),并对其进行检测。图3a-f实验步骤参考图二,图3a显示经过drp1干扰的msc点状线粒体相对较少,管状线粒体显著增多,提示干扰组的线粒体结构明显改变。图3b结果显示干扰组的基础耗氧率及最大耗氧率的变化均低于对照组,图3d结果显示经过干扰drp1后,干扰组相对细胞外酸度比率变化显著高于对照组,提示干扰drp-1后细胞代谢水平发生改变。
使用trizol提取两个组的rna,逆转录成cdna后通过荧光定量pcr法对细胞周期阻滞相关基因p16及p21进行表达检测。图3c结果显示经drp-1干扰后p16、p21表达下调,提示其衰老进程有所减缓。取对照组和干扰组细胞用pbs溶液进行稀释,用细胞计数板对两组细胞进行连续四天的计数,并以第一天培养的细胞数为基准绘制细胞数目的统计图如图3e所示,结果显示干扰组细胞增殖能力明显高于对照组细胞。同时,利用β-半乳糖苷酶检测试剂盒对两个组进行β-gal染色检测细胞衰老,图3f结果显示干扰组染色阳性数量比对照组显著减少,提示进行drp1干扰后,线粒体结构和功能改变后细胞衰老减缓。
实施例5间质干细胞培养液中加入mdivi-1之后增殖及衰老检测
本实施例取培养至第8代加入mdivi-1抑制剂(抑制drp1蛋白的功能)和对照组的msc进行实验。用pbs溶液进行稀释后用细胞计数板对连续培养4天的msc进行计数,图4a以第一天计数的细胞数为基准绘制细胞数目统计图,添加mdivi-1抑制剂组的msc培养至第四天的细胞数明显多于对照组细胞数,提示加入mdivi-1抑制剂后,细胞增殖能力显著增加。进一步,通过荧光定量pcr检测对照组与抑制剂组p16、p18的mrna表达,以对照组p16、p18表达量为基准,抑制剂组的相对表达量绘制统计图如图4b所示,对比未添加mdivi-1抑制剂的培养基,添加入mdivi-1抑制剂的培养基培养后的间质干细胞细胞衰老标志物表达明显减少,说明了加入mdivi-1后细胞的衰老得到了抑制。将msc种植在24孔板中,加入mdivi-1抑制剂进行培养两天后用多聚甲醛固定,穿透封闭后用ki67一抗进行免疫荧光染色,并通过荧光显微镜进行应该拍照,ki67在细胞周期的s期、g2期和m期表达,而在g0期和g1期(非增殖期)不表达,针对ki67蛋白的单抗能检测细胞的增殖情况,通过ki67的检测如图4c我们发现添加mdivi-1的抑制组ki67表达明显增多,即抑制组细胞增殖能力增强。另一方面,将msc种植在24孔板中,固定、穿透、封闭后通过抗tom20抗体对线粒体进行免疫荧光染色,采集图片后利用灰度处理后对约500个线粒体依据joshi等评分方法进行线粒体评分并对评分结果进行统计学分析得到图4d,图中显示加入mdivi-1的抑制剂组间质干细胞点状线粒体明显减少,管状线粒体增多,提示mdivi-1可以对间质干细胞内线粒体形态进行调控。使用seahorse细胞能量代谢仪,分别检测对照组和抑制剂组msc线粒体的ocr及ecar,以对照组ocr及ecar为基准绘制统计图,如图4e显示抑制剂组线粒体基础耗氧率低于对照组,如图4f所示抑制剂组细胞外酸度比较对照组明显增加,提示添加mdivi-1抑制剂后,线粒体供能方式以糖酵解为主,氧化磷酸化减弱。图4g采用sigma-aldrich公司生产的mak064乳酸检测试剂盒,通过酶标仪测定相对乳酸生成率,显示抑制剂组相对对照组乳酸生成量的明显增多。将在12孔板培养的对照组及抑制剂组msc进行消化,用pbs洗涤细胞3次后加入cellrox试剂检测细胞总的活性氧水平,图4h显示通过流式细胞仪检测发现抑制剂组相对对照组细胞中总的活性氧强度的下降。
实施例6加入mdivi-1扩增培养到第8代的间质干细胞体内治疗mcao模型小鼠效果检测
(1)mcao模型构建
①大鼠术前禁食12h,自由饮水。腹腔注射10%水合氯醛350mg/kg诱导麻醉,仰卧位固定,取颈正中切口,分离右侧颈总动脉、颈外静脉及颈内静脉,电凝烧断颈外动脉分支,结扎并游离颈外动脉主干,在游离段上剪一小口,将末端烧成圆头的4-0尼龙线置入颈外动脉,经颈总动脉分叉如颈内动脉,深度由颈总动脉分叉处算起约18~20mm,直到有轻微阻力感为止。大鼠脑缺血1.5h时将线栓退至颈外动脉残端,形成再灌注。
②sham组插入栓线仅约10mm,不阻断大脑中动脉血流供应。
(2)将动物分为4组,每组8只:
①假手术(sham)组;
②pbs治疗(pbs)组;
③msc治疗(msc)组;
④msc+抑制剂组治疗(msc+mdivi-1)组。
取脑中风模型大脑中动脉组织,用匀浆器将组织磨碎,加入trizol处理组织。5分钟后,加入氯仿,以每分钟12000转离心10分钟,取样品水样层,通过异丙醇沉淀rna进行提取,以提取的rna为模板,以dntp为底物加入逆转录酶在pcr仪中进行逆转录成cdna,后通过荧光定量pcr检测各组脑组织炎性因子tnf-α,ifn-γ,白介素1β,白介素6的表达情况,如图5a-d所示msc+mdivi-1治疗组的脑组织中炎性因子tnf-α,ifn-γ,白介素1β,白介素6的mrna表达量显著下调,提示通过mdivi-1靶向改变间质干细胞线粒体可有效延缓msc衰老,进一步提高msc治疗急性脑卒中及多种炎症性疾病的效果。
另一方面,本发明还利用多种动物模型(loh、ibd等)验证延缓衰老后的msc相比同一代数的细胞有显著的治疗提升效果,具有更好的生物学功能。
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
- 还没有人留言评论。精彩留言会获得点赞!