一种抗氧化肽及其应用的制作方法
本发明涉及一种抗氧化肽及其应用,属于生物技术领域。
背景技术:
生物活性肽,是分子结构介于氨基酸和蛋白质之间的一类化合物,具调节机体新陈代谢、参与生命活动的物质。具有抗氧化活性的生物活性肽又被称为抗氧化肽。
人体内如癌症、风湿、动脉粥样硬化等许多慢性疾病的发生,与机体自由基氧化损伤有很大的关系。在正常的生理环境中,机体都会产生少量的活性氧自由基(ROS),机体内的抗氧化体系(包括抗氧化酶和非酶类抗氧化剂)能快速清除过量自由基,以维持其生理适宜浓度。但在受到氧化损伤时,自由基累积过多,会发生氧化应激反应。因此,人体适量摄入抗氧化剂能有效预防氧化应激,维持体内自由基平衡。
抗氧化活性的检测方法有很多,但目前尚缺乏统一的抗氧化评价指标体系。生物体内自由基种类繁多,抗氧化肽的抗氧化活性与其肽段的分子量大小、氨基酸组成以及氨基酸序列顺序等因素密切相关,即使是相同结构的抗氧化肽在不同自由基的反应介质中,表现出来的抗氧化活性也不同。因此,单一的抗氧化指标不能科学的评价生物活性肽的抗氧化活性,需要采用多种指标联合评价抗氧化肽体外抗氧化活性。
技术实现要素:
本发明要解决的技术问题,在于提供一种抗氧化肽及其应用,通过综合评价抗氧化活性,得到抗氧化活性较好的抗氧化肽。
本发明是这样实现的:
本发明首先提供了一种抗氧化肽,所述抗氧化肽为含Cys残基的肽段,分子量为700-800Da。
优选地,所述抗氧化肽的氨基酸序列为Thr Ile Asp Cys Asp Arg。
本发明还提供了所述抗氧化肽的用途,即应用于保健品、食品添加剂或化妆品。
本发明具有如下优点:通过清除DPPH·自由基、ABTS·+自由基,还原力和亚油酸自氧化抑制率四个指标对抗氧化肽进行抗氧化活性进行综合评价。结果表明,在清除DPPH·自由基和还原力中,含有Cys的肽段具有明显活性,其余肽段均清除DPPH·自由基活性和还原能力很弱;在ABTS·+自由基中,含有Cys的肽段也具有一定的清除ABTS·+自由基的能力,其余不含Cys和Tyr的肽段均活性很弱;在抑制亚油酸自氧化中,含有Cys的肽段均表现出抑制亚油酸自氧化能力。在细胞抗氧化研究中,TIDCDR能不同程度的上调细胞内GSH-Px、CAT、SOD抗氧化酶活性,降低细胞上清液LDH漏出和细胞内MDA含量。
附图说明
下面参照附图结合实施例对本发明作进一步的说明。
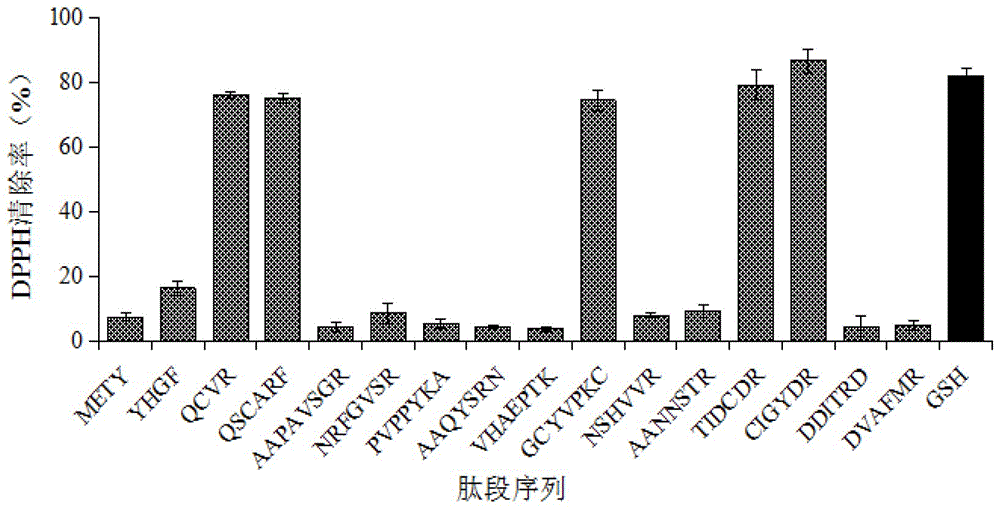
图1为抗氧化肽对DPPH·的清除作用。
图2为抗氧化肽还原力。
图3为抗氧化肽清除ABTS·+活性。
图4为抗氧化肽对亚油酸自氧化的抑制。
图5为抗氧化肽对LO2细胞H2O2氧化损伤的保护作用。
图6为抗氧化肽对LDH活力的影响。
图7为抗氧化肽对细胞MDA生成量的影响。
图8为抗氧化肽对细胞内GSH-Px活力的影响。
图9为抗氧化肽对细胞内CAT活力的影响。
图10为抗氧化肽对内SOD活力的影响。
具体实施方式
一、鲍内脏蛋白酶解、分离纯化与肽段的氨基酸序列分析
1、方法
鲍内脏→酶解→酶解液→截留分子量30000Da超滤膜超滤→截留分子量200Da纳滤膜浓缩→冻干→酶解产物→SephadexG-15分离→HW-40f中压柱分离→半制备反相高效液相(RP-HPLC)分离纯化→ESI-LC MS结构分析。
具体如下:
(1)以鲍内脏为底物,分别选择木瓜蛋白酶、中性蛋白酶、胰蛋白酶和碱性蛋白酶进行酶解,胰蛋白酶的酶解条件为料液比1:20g/mL、加酶量2500U/g、酶解温度45℃、pH 8.0;碱性蛋白酶酶解条件为料液比1:30g/mL、加酶量3000U/g、酶解温度55℃、pH 9.5;中性蛋白酶酶解条件为料液比1:30g/mL、加酶量3000U/g、酶解温度55℃、pH 7.5;木瓜蛋白酶酶解条件为料液比1:30g/mL、加酶量3000U/g、酶解温度60℃、pH 6.5,此条件下酶解3h,原料中蛋白质水解度分别为18.21±0.71、15.98±0.21、25.14±0.42和18.67±0.32%。酶解液经截留分子量30000Da超滤膜超滤、截留分子量200Da纳滤膜浓缩,冻干得鲍内脏酶解物。
(2)SephadexG-15分离:Sephadex G-15凝胶色谱柱规格为洗脱条件为:上样溶度50mg/mL,上样量2mL,超纯水为流动相,流速24mL/h,每10min收集一管,220nm检测,记录并绘制吸光度曲线,收集各洗脱峰,冷冻干燥各洗脱组分。
(3)HW-40f中压柱分离:HW-40f填料凝胶色谱中压玻璃柱型号为洗脱条件为:上样溶度,上样量2mL,超纯水为流动相,流速2mL/min,柱压<3bar,220nm检测,记录并绘制吸光度曲线,收集各洗脱峰,冷冻干燥各洗脱组分。
(4)半制备反相高效液相(RP-HPLC)分离纯化:采用Green ODS-2 C18 P/N 84176(5um,120A)色谱柱。流速2mg/min,溶度10mg/ml,进样量1ml,柱温为30℃,检测波长220nm,流动相:A-超纯水(体积分数0.05%TFA),B-乙腈(体积分数0.05%TFA);洗脱条件:0~30min:95%A+5%B~60%A+40%B;30~40min:5%A+95%B。
2、结果
(1)经Sephadex G-15凝胶色谱柱和HW-40f中压制备柱分离得到12个鲍内脏蛋白肽组分,分别为胰蛋白酶组分:AVH-TA、AVH-TD、AVH-TE;碱性蛋白酶组分:AVH-AA、AVH-AD、AVH-AE;中性蛋白酶组分:AVH-NA、AVH-ND、AVH-NE;木瓜蛋白酶组分:AVH-PA、AVH-PD、AVH-PE(大分子量肽组分A、中等分子量肽组分D和小分子量肽组分E),结果发现小分子量肽组分E抗氧化能力均显著高于肽组分A和肽组分D。AVH-TE,AVH-AE,AVH-NE和AVH-PE清除DPPH·自由基IC50分别为0.832、1.935、1.793和1.138mg/mL,还原力ECA700nm=0.5分别为2.176,3.464,2.107和1.987mg/mL,亚油酸抑制率分别为90.4±4.88,89.8±1.20,90.2±6.77和89.9±1.4%。
(2)使用半制备型反相高效液相色谱(RP-HPLC)分离小分子组分AVH-TE、AVH-AE、AVH-NE和AVH-PE,共得到8个主要组分,分别为AVH-TE-1、AVH-TE-2、AVH-AE-1、AVH-AE-2、AVH-NE-1、AVH-NE-2、AVH-PE-1和AVH-NE-2。
(3)对AVH-TE-1、AVH-TE-2、AVH-AE-1、AVH-AE-2、AVH-NE-1、AVH-NE-2、AVH-PE-1和AVH-NE-2进行氨基酸序列分析,得到16个肽目标肽段,分别为METY,YHGF,QCVR,QSCARF,AAPAVSGR,NRFGVSR,PVPPYKA,AAQYSRN,VHAEPTK,GCYVPKC,NSHVVR,AANNSTR,TIDCDR,CIGYDR,DDITRD,DVAFMR,如表1所示。
表1抗氧化肽序列与分子量
注:平均亲水性值>2,说明肽的溶解性非常的好,即使短暂与空气接触,也有可能吸潮;0<平均亲水性值为≤2,说明肽在水中溶解性很好,无需添加助溶剂亦可取得较好的溶解效果;-2<平均亲水性值为≤0,说明肽在水中的溶解性一般,可借助超声和调整溶液温度(≤30℃)助溶;平均亲水性值为≤-2,说明肽的溶解性差。
二、合成肽体外抗氧化活性的测定
化学合成以上16条肽进行体外抗氧化活性评价。
1、DPPH·自由基清除活性
方法:参考文献(刘帅涛,陶慧林,李锦艳.4种黄酮小分子对DPPH自由基的清除作用及构效关系研究[J].分析测试学报,2012,01:71-75),进行DPPH·自由基清除率的测定,根据公式(2-1)计算:
Asample:2mL样品+2mL DPPH·溶液的吸光值
Ablank:2mL样品+2mL乙醇溶液的吸光值
Acontrol:2mL乙醇溶液+2mL DPPH·溶液的吸光值
结果:抗氧化肽样品溶度为1mg/mL时的DPPH·自由基清除活性如图1所示。可以看出,含有Cys残基的QCVR,QSCARF,GCYVPKC,TIDCDR和CIGYDR均表现出很强的清除DPPH·自由基活性,IC50值如表2-1所示,其中CIGYDR活性最强(IC50值为0.207mg/mL),强于GSH(IC50值为0.252mg/mL);TIDCDR次之(IC50值为0.267mg/mL),与GSH相当。而不含Cys残基的肽段均没有明显活性。
表2-1抗氧化肽清除DPPH·的回归方程和IC50
2、还原力测定
方法:参考文献(Oyaizu M.Antioxidative activities of browning products of glucosamine fractionated by organic solvent and thin-layer chromatography[J].Nippon Shokuhin Kogyo Gakkaishi,1988,35(11):771-775),取一定溶度多肽样品1mL,分别加入1mL磷酸盐缓冲溶液(0.2mol/L,pH 6.6)和质量分数1%铁氰化钾溶液1mL,于50℃水浴中反应20min,然后加入体积分数10%的三氯乙酸1mL,摇匀,于3000r/min离心10min,吸取上清液2mL加入2mL蒸馏水和0.4mL 0.1%的三氯化铁溶液,混合均匀,室温下反应10min后在波长700nm处测定吸光值。
结果:抗氧化肽在样品浓度为1mg/mL时的还原力值如图2所示。可以看出,抗氧化肽的还原力与清除DPPH·自由基活性结果趋势一致,含有Cys残基的肽段具有很强的还原力,其他肽段没有明显活性。抗氧化肽的ECA700nm=0.5值如表2-2所示。其中含有2个Cys的GCYVPKC肽段活力最强,其次是TIDCDR和CIGYDR,均比GSH的活性高。
表2-2抗氧化肽还原能力的回归方程和EC50
3、ABTS·+自由基清除活性
采用南京试剂盒总抗氧化能力(T-AOC)检测试剂盒(ABTS法)。合成肽段在溶度为1mg/mL时的ABTS·+自由基清除率如图3所示。可以看出含有Tyr残基的肽段均表现出较强的清除ABTS·+自由基能力,其IC50值如表2-3所示,其中CIGYDR,GCYVPKC和YHGF活性最好,大小关系为CIGYDR(IC50值为0.144mg/mL)>YHGF(IC50值为0.268mg/mL)>GCYVPKC(IC50值为0.389mg/mL);而只含有Cys氨基的肽段,如QCVR,QSCARF,TIDCDR以及GSH也具有一定的清除能力。
表2-3抗氧化肽清除ABTS·+的回归方程和IC50
4、抑制亚油酸自氧化活性
方法:参考文献(Osawa T,Namiki M.Natural antioxidants isolated from Eucalyptus leaf waxes[J].Journal of Agricultural and Food Chemistry,1985,33(5):777-780),用10mL 0.05M pH 7.0的磷酸盐缓冲溶液配置一定溶度的待测样品,取1mL待测样品加入1.5%亚油酸(用95%的乙醇溶液配置)1mL。用蒸馏水定容到2.5mL,避光并放在暗处保持50±1℃恒温。
过氧化值的测定采用硫氰酸铁法:取0.1mL亚油酸反应溶液,加入4.7mL 75%的乙醇和0.1mL 30%的硫氰酸铵,再加入0.1mL 0.02M已经溶解于3.5%盐酸中的氯化亚铁,迅速混匀,准确反应3min后,500nm下测定吸光度。0h测定的OD值计为A0,144h后的OD值计为At。抗氧化能力以144h时的氧化抑制率表示,抑制率按公式(2-4)计算:
结果:抗氧化肽在样品浓度0.5mg/mL时,对亚油酸自氧化抑制相关如图4所示。大部分肽段均表现出一定的抑制亚油酸自氧化的能力。
5、抗氧化肽对细胞氧化损伤模型中的保护作用
选用上述氧化活性较高的四条肽段YHGF、GCYVPKC、TIDCDR和CIGYDR,研究对人体肝细胞(LO2)H2O2氧化损伤的保护作用。通过MTT法,评价合成肽段对细胞保护效果,分析4条合成肽段对LO2细胞H2O2氧化损伤时细胞上清液中乳酸脱氢酶LDH活性、细胞内过氧化氢酶CAT、超氧化物歧化酶SOD、谷胱甘肽过氧化物酶GSH-Px活性和丙二醛MDA生成量的影响。
图5为抗氧化肽对LO2细胞H2O2氧化损伤的保护作用,图6为抗氧化肽对LDH活力的影响,图7为抗氧化肽对细胞MDA生成量的影响,图8为抗氧化肽对细胞内GSH-Px活力的影响,图9为抗氧化肽对细胞内CAT活力的影响,图10为抗氧化肽对内SOD活力的影响。说明TIDCDR肽段对H2O2诱导的LO2细胞氧化损伤具有保护作用,能显著提高H2O2氧化损伤的LO2细胞的存活率、降低细胞中MDA生成量、显著提高细胞SOD活力、极显著提高细胞内GSH-Px、CAT活力。
虽然以上描述了本发明的具体实施方式,但是熟悉本技术领域的技术人员应当理解,我们所描述的具体的实施例只是说明性的,而不是用于对本发明的范围的限定,熟悉本领域的技术人员在依照本发明的精神所作的等效的修饰以及变化,都应当涵盖在本发明的权利要求所保护的范围内。
- 还没有人留言评论。精彩留言会获得点赞!