一种利用海洋细菌发酵产褐藻酸裂解酶的方法与流程
本发明属于生物工程领域,涉及微生物发酵工艺,尤其涉及一种利用海洋细菌发酵产褐藻酸裂解酶的方法。
背景技术:
海洋蕴含了丰富的生物质资源,是人类食品、医药等的重要来源。我国海洋资源丰富,是世界上海洋藻类养殖及加工利用规模最大的国家,海藻产量约占世界总产量的60%,超过了1300万吨。褐藻是海洋中含量丰富的经济类海藻,代表植物包括海带、鹿角菜、巨藻和马尾藻等。褐藻酸又名海藻酸、藻酸、海藻素等,是褐藻细胞壁及细胞间质中的一种水溶性酸性多糖,由两种互为c5差向异构体的单体(β-d-甘露糖醛酸、α-l-古罗糖醛酸)聚合而成。褐藻酸结构复杂,物化性质多样,由于其具有金属螯合和高粘滞性能,常作为稳定剂、增稠剂和乳化剂广泛应用于食品、化工和制药等领域。褐藻酸也具有生物活性,如β-d-甘露糖醛酸能诱导单核细胞分泌细胞因子,相反α-l-古罗糖醛酸能抑制白细胞分泌白介素和肿瘤坏死因子,在提高机体免疫力和治疗免疫疾病等方面有良好的用途。作为海藻工业的主体产品,虽然褐藻酸己广泛应用于多个领域,但在生产加工技术、综合利用水平、产业化程度、产品种类及质量上与国外相比还有较大差距,仍主要停留在初级加工阶段,产品附加值低,因此开展新工艺、新技术、新产品的研究与开发是实现海藻生物资源高值化利用的关键。
近年来,随着海洋药物和海洋保健制品的蓬勃发展,海洋多糖及其降解产物的研究也引起了广泛的重视。褐藻酸降解产物——褐藻寡糖具有良好生物活性和药用价值,是目前研究最受关注的海洋活性物质之一。褐藻寡糖不仅具有褐藻酸大分子的某些功能性质,而且具有很多褐藻酸所不具备的独特的生理活性和功能特性。在食品工业里,褐藻寡糖作为食品材料或添加剂应用甚广;在造纸工业里,用水溶性的褐藻寡糖代替部分松香,能增加纸的光泽和光滑度,提高其耐揉性;在农业领域,褐藻寡糖可用作农作物的杀螨剂和农药的稳定剂,调节剂等,还能促进植物生长和诱导抗逆性等。此外,褐藻寡糖还广泛应用于冶金、石油、日用化工等各个领域。依其生物活性,褐藻寡糖具有整肠、解毒、降血糖血脂、抗炎、抗菌、抗肿瘤、免疫调节等作用,可作为糖尿病、肥胖症、直肠结肠癌、习惯性便秘患者的疗效食品。此外,寡糖药物的开发也越来越多,可用于心脑血管疾病和病毒方面的药用研究。
褐藻寡糖的生产可以采用物理法、化学法和酶解法。其中物理法操作复杂,降解条件难以控制;化学法往往存在目标寡糖的产量低、回收率低和污染环境等问题。而酶解法具有专一性强,条件温和,降解过程及产物分子质量易控制,褐藻寡糖活性高并且对环境无污染的特点,已逐渐成为褐藻寡糖生产最有潜力的生产方式。褐藻酸裂解酶是一类多糖裂解酶,通过β消除反应切断β-1,4糖苷键将褐藻酸大分子降解成低分子量的褐藻寡糖或单糖。由于尚未发现能够作用于褐藻酸的水解酶,因此,褐藻酸裂解酶是目前唯一有效的褐藻酸降解酶类。褐藻酸裂解酶来源广泛,存在于海洋动物、海洋藻类以及微生物中,其中产褐藻酸裂解酶的微生物种类复杂,分布广泛,是目前研究最多的。已报道的产褐藻酸裂解酶的海洋细菌有光合细菌、弧菌、棒杆菌、黄杆菌、假平胞菌、交替单胞菌、假单胞菌、假交替单胞菌等,此类细菌以褐藻酸为碳源和能源之一,有的甚至以褐藻酸为唯一碳源,褐藻酸的存在可以诱导细菌产酶。土壤细菌中产褐藻酸裂解酶的大多是革兰氏阴性菌,已报道的有固氮菌、肠杆菌、克雷伯氏菌等,革兰氏阳性菌产褐藻酸裂解酶报道很少,有芽抱杆菌和梭菌。可能因为生长环境的不同,土壤细菌与海洋细菌所产褐藻酸裂解酶在酶学性质、底物特异性等方面都有很大不同,具有一些特殊的性质。
褐藻酸裂解酶作为一种重要的海洋生物酶,有着广泛的生物学功能和应用。褐藻酸裂解酶除了用于制备功能性褐藻寡糖外,还用于降解海藻废物制备乙醇燃料、制备原生质体以及提取海藻植物dna等。海藻细胞中褐藻多糖的粘度很大,很难将dna、单细胞、原生质体和胞内活性物质分开,利用裂解酶可使褐藻酸很快降解,粘度下降,方便这些物质的提取。作为海藻解壁酶,这种海藻细胞分离作用大大排除了海藻遗传工程研究的障碍,推动了海藻遗传工程的发展。在医学上,海藻酸裂解酶早已作为药品酶用于治疗由致病菌(pseudomonasaergenes)引起的慢性疾病。
然而,现有的褐藻酸裂解酶普遍存在酶活力较低、酶稳定性较差、酶与产物结合紧密、分离困难等问题,这些缺点限制了褐藻酸裂解酶的推广应用。目前,我国对褐藻酸裂解酶的研究比较基础,国内外的研究也主要集中于菌种分离、基因工程菌的构建及酶学性质的改善、酶解产物的构效等方面,而有关褐藻酸裂解酶的发酵工艺的研究报道很少,褐藻酸裂解酶工业用酶的缺乏成为褐藻与褐藻酸高值化加工的瓶颈。发酵培养基的成分及条件的优化是提高褐藻胶裂解酶活性、降低成本、缩短发酵时间的重要手段之一。因此寻找高产酶的菌株、对产酶菌株进行发酵优化以提升酶活性就显得尤为重要。有鉴于此,本发明人研究和设计了一种利用海洋细菌发酵产褐藻酸裂解酶的方法,本案由此产生。
技术实现要素:
本发明所要解决的技术问题是针对现有技术的不足,提供一种新的、操作简单、产酶效果好的海洋细菌水生黄杆菌发酵产褐藻酸裂解酶的方法。
本发明所要解决的技术问题是通过以下的技术方案来实现的:
一种利用海洋细菌发酵产褐藻酸裂解酶的方法,其特征在于,所述海洋细菌为水生黄杆菌(flavobacteriummizutaii),来源于海洋微生物菌种保藏管理中心mccc,保藏编号1a08665,所述方法包括如下步骤:
s1、种子液的制备:将水生黄杆菌活化后接入种子培养基中,500ml三角瓶中装液量为100ml,温度28±2℃,转速150-180r/min,摇床振荡培养10-12h;取培养物进行镜检,确认菌体生长良好,无杂菌污染,即可接种于种子罐中;
s2、种子液扩大培养:按种子罐容积的30-40%投入种子培养基,121℃高压蒸汽灭菌20-30min,冷却至30℃以下后,将种子液以1%-3%的接种量接入种子培养基中,28±2℃培养14-16h,取培养物进行镜检,确认菌体生长良好,无杂菌污染,即可接种于发酵罐中;
s3、发酵产酶培养:按发酵罐容积的40-50%投入发酵培养基,121℃高压蒸汽灭菌20-30min,冷却至30℃以下后,将步骤s2得到的种子液以4%-6%的接种量接入发酵培养基中,分别在发酵的第10、20、30、40h补加浓度为2g/l的褐藻酸钠溶液1l,整个发酵培养时间为44-48h,获得含有褐藻酸裂解酶的发酵液;
s4、发酵液的提取:取发酵液在4℃、13000r/min的条件下离心10min除菌体,向上清液中缓慢加入硫酸铵至80%饱和度,4℃静置3h,然后在4℃、13000r/min的条件下离心10min,弃去上清液,沉淀溶于20mmol/l磷酸盐缓冲液(ph7.5)中,4℃透析过夜,再次在4℃、13000r/min的条件下离心10min,取上清液即获得褐藻酸裂解酶粗酶液。
步骤s1中,所述菌株活化的方法为:将低温冷冻保藏的水生黄杆菌菌株解冻后,划线接种于2216e固体培养基上,在28℃恒温培养24h。
步骤s1与s2中,所述种子培养基的配方为:葡萄糖5-7g/l,蛋白胨5-7g/l,酵母浸粉2-4g/l,nacl27-33g/l,kh2po43.6-4.4g/l,mgso4·7h2o0.5-0.7g/l,feso4·7h2o0.01-0.02g/l,葡萄糖酸钙1.4-2.0g/l,na2so43.1-3.3g/l,nahco30.13-0.19g/l,kbr0.08-0.1g/l,h3bo36.5-7.0mg/l,nasio34.0-4.8mg/l,naf2.3-2.7mg/l,2,4-d1.9-2.3mg/l,酪氨酸2.1-2.5g/l,环己六醇0.05-0.06g/l,ph值为7.4-7.8。
步骤s2中,所述种子罐的通气量为0.5-1.0vvm,搅拌转速为150-180r/min。
步骤s3中,所述发酵培养基的配方为:褐藻酸钠4-6g/l,豆饼粉15-20g/l,nacl27-33g/l,kh2po43.6-4.4g/l,mgso4·7h2o0.5-0.7g/l,feso4·7h2o0.01-0.02g/l,葡萄糖酸钙1.4-2.0g/l,na2so43.1-3.3g/l,nahco30.13-0.19g/l,kbr0.08-0.1g/l,h3bo36.5-7.0mg/l,nasio34.0-4.8mg/l,naf2.3-2.7mg/l,(nh4)2moo40.7-0.9g/l,mnso40.04-0.06g/l,正十二烷2.7-3.3g/l,没食子酸1.6-2.0mg/l,酪氨酸2.1-2.5g/l,阿拉伯半乳聚糖10-15mg/l,无水甲醇18-22ml/l,地塞米松85-95mg/l,腐胺3.3-3.9mg/l,乙酰水杨酸45-55μmol/l。
步骤s3中,所述发酵培养基的初始ph值为7.5-8.5,优选为8.0。
步骤s3中,所述发酵温度为25±1℃,发酵罐的通气量为1.5-2.0vvm,搅拌转速为240-260r/min。
所述2216e固体培养基的配方为:蛋白胨5g/l,酵母浸粉1g/l,柠檬酸铁0.01g/l,琼脂20g/l,陈海水1000ml,ph7.2-7.6。
本发明具有如下有益效果:
(1)本发明选择了海洋细菌水生黄杆菌(flavobacteriummizutaii)为出发菌株,水生黄杆菌产褐藻酸裂解酶为胞外酶,有利于后续粗酶的分离和纯化。
(2)本发明对水生黄杆菌的产酶规律进行了深入研究,对产酶发酵条件进行了优化,确定了发酵温度、接种量、转速、初始ph等重要参数值。同时对发酵培养基也进行了优化,获得了碳源、氮源、无机盐等常规物质的浓度,并且还添加了适量的(nh4)2moo4、mnso4、正十二烷、没食子酸、酪氨酸、阿拉伯半乳聚糖、无水甲醇、地塞米松、腐胺和乙酰水杨酸作为水生黄杆菌产酶的诱导剂或促进剂,极大地提高了水生黄杆菌的产酶能力,在一个实施例中,褐藻酸裂解酶活力达到134.2u/ml,发酵效果显著,可应用于大规模生产。
(3)褐藻胶裂解酶为诱导性酶,本发明在发酵过程中选择褐藻酸钠为唯一碳源,既能满足水生黄杆菌的正常生长代谢,还能诱导其产酶。在发酵过程中通过间歇性补加褐藻酸钠溶液的方法使发酵培养基中褐藻酸钠浓度始终维持在适当水平,从而提高水生黄杆菌菌体生物量,进一步延长其产酶期,使水生黄杆菌产酶能力充分发挥,最终提高褐藻酸裂解酶活力与产量。
附图说明
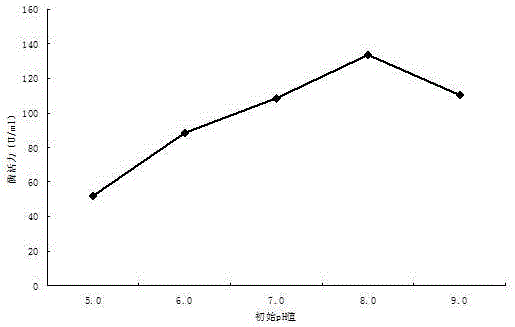
图1:发酵培养基初始ph值对产酶的影响;
图2:发酵温度对产酶的影响;
图3:接种量对产酶的影响;
图4:豆饼粉添加量对产酶的影响;
图5:地塞米松添加量对产酶的影响;
图6:乙酰水杨酸添加量对产酶的影响。
具体实施方式
下面通过具体实施例,对本发明的技术方案作进一步具体的说明。
在本发明中,若非特指,所有设备和原料均可从市场购得或是本行业常用的,下述实施例中的方法,如无特别说明,均为本领域常规方法。
实施例1
一种利用海洋细菌发酵产褐藻酸裂解酶的方法,包括如下步骤:
s1、种子液的制备:水生黄杆菌(flavobacteriummizutaii)来源于海洋微生物菌种保藏管理中心mccc,保藏编号1a08665,将低温冷冻保藏的菌株解冻后,划线接种于2216e固体培养基(配方为:蛋白胨5g/l,酵母浸粉1g/l,柠檬酸铁0.01g/l,琼脂20g/l,陈海水1000ml,ph7.4)上,在28℃恒温培养24h;将活化的菌株后接入种子培养基中,500ml三角瓶中装液量为100ml,温度28℃,转速180r/min,摇床振荡培养12h;取培养物进行镜检,确认菌体生长良好,无杂菌污染,即可接种于种子罐中;种子培养基的配方为:葡萄糖6g/l,蛋白胨6g/l,酵母浸粉3g/l,nacl30g/l,kh2po44.0g/l,mgso4·7h2o0.6g/l,feso4·7h2o0.015g/l,葡萄糖酸钙1.7g/l,na2so43.2g/l,nahco30.16g/l,kbr0.09g/l,h3bo36.75mg/l,nasio34.4mg/l,naf2.5mg/l,2,4-d2.1mg/l,酪氨酸2.4g/l,环己六醇0.05g/l,ph值为7.6。
s2、种子液扩大培养:按种子罐容积的40%投入种子培养基,121℃高压蒸汽灭菌25min,冷却至30℃以下后,将种子液以2%的接种量接入种子培养基中,28℃培养16h,种子罐的通气量为0.75vvm,搅拌转速为180r/min,取培养物进行镜检,确认菌体生长良好,无杂菌污染,即可接种于发酵罐中。
s3、发酵产酶培养:按发酵罐容积的50%投入发酵培养基,121℃高压蒸汽灭菌30min,冷却至30℃以下后,将步骤s2得到的种子液以5%的接种量接入发酵培养基中,分别在发酵的第10、20、30、40h补加浓度为2g/l的褐藻酸钠溶液1l,整个发酵培养时间为48h,发酵温度为25℃,发酵罐的通气量为1.8vvm,搅拌转速为250r/min,获得含有褐藻酸裂解酶的发酵液;发酵培养基的配方为:褐藻酸钠5g/l,豆饼粉17.5g/l,nacl30g/l,kh2po44.0g/l,mgso4·7h2o0.6g/l,feso4·7h2o0.015g/l,葡萄糖酸钙1.7g/l,na2so43.2g/l,nahco30.16g/l,kbr0.09g/l,h3bo37.0mg/l,nasio34.4mg/l,naf2.5mg/l,(nh4)2moo40.8g/l,mnso40.05g/l,正十二烷3.0g/l,没食子酸1.8mg/l,酪氨酸2.3g/l,阿拉伯半乳聚糖13mg/l,无水甲醇20ml/l,地塞米松90mg/l,腐胺3.6mg/l,乙酰水杨酸50μmol/l,初始ph值为8.0。
s4、发酵液的提取:取发酵液在4℃、13000r/min的条件下离心10min除菌体,向上清液中缓慢加入硫酸铵至80%饱和度,4℃静置3h,然后在4℃、13000r/min的条件下离心10min,弃去上清液,沉淀溶于20mmol/l磷酸盐缓冲液(ph7.5)中,4℃透析过夜,再次在4℃、13000r/min的条件下离心10min,取上清液即获得褐藻酸裂解酶粗酶液。
褐藻酸裂解酶活力测定
采用dns(3,5-二硝基水杨酸)法测还原糖含量。取0.1ml粗酶液与0.9ml的3mg/ml褐藻酸钠底物于40℃水浴中反应15min,加入1mldns并煮沸5min显色,然后立即用冷水冷却至室温并定容至5ml,同时以灭活酶液组作为空白对照,在540nm下测定吸光值,根据上述葡萄糖标准曲线计算还原糖含量。酶活力单位定义为:在该反应条件下,催化底物每分钟产生1μmol还原糖所需的酶量作为一个酶活力单位(u)。
实施例2发酵条件的优化
1、发酵培养基初始ph值的优化
根据实施例1提供的方法,在发酵产酶培养时,将发酵培养基初始ph值分别调至5.0、6.0、7.0、8.0、9.0,发酵结束后制备粗酶液并测定褐藻酸裂解酶活力,确定最佳初始ph值。
发酵培养基的初始ph值造成菌体细胞细胞膜氧化还原电位的不同,直接影响氧化还原反应的进行和自由能的生成,从而影响细胞膜的活性,故对培养基中营养物质的吸收和酶的分泌造成影响。由图1可知,当ph值为5.0时,水生黄杆菌的产酶能力较低,这主要由于ph5.0的酸性条件不适合于该菌生长;在ph6.0-9.0范围内该菌产酶能力较高,并在ph值为8.0时最高,达到133.5u/ml,因此,发酵培养基的初始ph值选择8.0。
2、发酵温度的优化
根据实施例1提供的方法,在发酵产酶培养时,将发酵温度分别设置为20、25、30、35、40℃,发酵结束后制备粗酶液并测定褐藻酸裂解酶活力,确定最佳发酵温度。
发酵温度影响发酵液的理化性质及微生物的代谢调控机制,因此在发酵过程中需要维持适宜的温度才能保证菌体的正常生长代谢。此外温度对酶的稳定性也有重要影响。由图2可知,当发酵温度在20-25℃范围内,酶活力随着温度的升高而升高;当温度大于25℃时,酶活力迅速下降,当温度为40℃时,酶活力仅为47.9u/ml,因此25℃为水生黄杆菌产褐藻酸裂解酶的最适温度,此温度下酶活力达到129.8u/ml。
3、接种量的优化
根据实施例1提供的方法,在发酵产酶培养时,将种子液的接种量分别设置为1%、3%、5%、7%、9%,发酵结束后制备粗酶液并测定褐藻酸裂解酶活力,确定最佳发酵温度。
接种量多少对发酵过程中的延滞期长短以及对数生长期菌体的生长情况都有较大的影响。接种量过少会使菌体生长缓慢,培养时间增加;接种量过多则会使菌体大量繁殖,消耗大量营养,不利于产酶。由图3可知,当接种量在1%-5%范围内,酶活力随着接种量的增加而升高,且在5%时达到最高值,为131.7u/ml,当接种量继续增加,酶活力逐渐下降,这可能是由于接种量过大导致菌体生长旺盛,消耗营养物质而不利于产酶,因此,接种量选择5%。
实施例3发酵培养基的优化
1、豆饼粉添加量的优化
根据实施例1提供的方法,在发酵产酶培养时,将发酵培养基中豆饼粉的添加量分别设置为5、10、15、20、25、30g/l,其它成分不变,发酵结束后制备粗酶液并测定褐藻酸裂解酶活力,确定豆饼粉的添加量。
氮源是发酵培养基的主要成分之一,对微生物的生长代谢有着重要影响。研究表明有机氮源较无机氮源更容易被细菌分解利用,有机氮源还能提供某些生长因子,使菌体高效快速生长。相较于蛋白胨、酵母浸粉而言,豆饼粉是一种来源广泛、价格地理低廉的有机氮源。由图4可知,当豆饼粉添加量为5g/l-15g/l时,褐藻酸裂解酶活力随豆饼粉添加量的增大呈明显上升趋势,当豆饼粉添加量为15g/l-20g/l时,褐藻酸裂解酶活力差异不显著,当豆饼粉添加量大于20g/l时,褐藻酸裂解酶活力呈下降趋势,说明氮源过多,可能会影响菌体按比例吸收营养物质,不利于代谢途径中褐藻酸裂解酶的积累。因此,豆饼粉添加量选择15g/l-20g/l。
2、地塞米松添加量的优化
根据实施例1提供的方法,在发酵产酶培养时,将发酵培养基中地塞米松的添加量分别设置为0、30、60、90、120、150mg/l,其它成分不变,发酵结束后制备粗酶液并测定褐藻酸裂解酶活力,确定地塞米松的添加量。
糖皮质激素是机体内极为重要的一类调节分子,它对机体的发育、生长、代谢以及免疫功能等起着重要调节作用。经我们研究发现,地塞米松对水生黄杆菌也具有调节脂肪、蛋白质等生物合成和代谢的作用,因此在发酵培养基中适量添加地塞米松,可以提高水生黄杆菌的产酶能力。由图5可知,不添加地塞米松时,褐藻酸裂解酶活力为71.2u/ml,地塞米松添加量在30-150mg/l范围内,褐藻酸裂解酶活力较不添加时均有所提高,当地塞米松添加量为90mg/l时,褐藻酸裂解酶活力达到最大值,为134.4u/ml,表明此添加量最有利于提高水生黄杆菌产酶能力,因此地塞米松添加量选择90mg/l。
3、乙酰水杨酸添加量的优化
根据实施例1提供的方法,在发酵产酶培养时,将发酵培养基中乙酰水杨酸的添加量分别设置为0、25、50、75、100、125μmol/l,其它成分不变,发酵结束后制备粗酶液并测定褐藻酸裂解酶活力,确定乙酰水杨酸的添加量。
乙酰水杨酸是水杨酸的衍生物,水杨酸作为一种信号分子,可以诱导许多植物或微生物的生理反应。我们研究发现,外源添加乙酰水杨酸对水生黄杆菌产褐藻酸裂解酶的能力有一定影响,可以作为产褐藻酸裂解酶的诱导剂。由图6可知,不添加乙酰水杨酸时,褐藻酸裂解酶活力为84.5u/ml,随着乙酰水杨酸添加量的增加,褐藻酸裂解酶活力先升高后降低,当乙酰水杨酸添加量为50μmol/l时,褐藻酸裂解酶活力达到最大值,为130.7u/ml,当乙酰水杨酸添加量大于75μmol/l时,褐藻酸裂解酶活力显著降低,表明乙酰水杨酸添加量过多对水生黄杆菌的生长代谢产生了抑制作用。因此乙酰水杨酸添加量选择50μmol/l。
对比例1
根据实施例1提供的方法,在发酵产酶培养时,发酵培养基采用以下配方:褐藻酸钠5g/l,豆饼粉17.5g/l,nacl30g/l,kh2po44.0g/l,mgso4·7h2o0.6g/l,feso4·7h2o0.015g/l,葡萄糖酸钙1.7g/l,na2so43.2g/l,nahco30.16g/l,kbr0.09g/l,h3bo36.75mg/l,nasio34.4mg/l,naf2.5mg/l,其它条件不变,发酵结束后制备粗酶液并测定褐藻酸裂解酶活力。
由表1可知,与对比例1相比,实施例1采用的发酵培养基在相同的发酵工艺下能显著促进水生黄杆菌发酵生产褐藻酸裂解酶,酶活力达到134.2u/ml,较对比例1提高了43.6%。在碳源、氮源、无机盐等常规物质相同的情况下,本发明的发酵培养基中添加了适量的(nh4)2moo4、mnso4、正十二烷、没食子酸、酪氨酸、阿拉伯半乳聚糖、无水甲醇、地塞米松、腐胺和乙酰水杨酸,作为水生黄杆菌产酶的诱导剂或促进剂,显著提高了水生黄杆菌的产酶能力。
对比例2
根据实施例1提供的方法,在发酵产酶培养时,将种子液以5%的接种量接入与实施例1相同的发酵培养基中,发酵温度为25℃,发酵罐的通气量为1.8vvm,搅拌转速为250r/min,发酵培养时间为48h,不进行褐藻酸钠补料,发酵结束后制备粗酶液并测定褐藻酸裂解酶活力。
由表2可知,与对比例2相比,实施例1采用的褐藻酸钠补料策略能显著促进水生黄杆菌发酵生产褐藻酸裂解酶,酶活力较对比例2提高了43.6%。褐藻胶裂解酶为诱导性酶,本发明在发酵过程中选择褐藻酸钠为唯一碳源,既能满足水生黄杆菌的正常生长代谢,还能诱导其产酶。在发酵过程中通过间歇性补加褐藻酸钠溶液的方法使发酵培养基中褐藻酸钠浓度始终维持在适当水平,从而提高水生黄杆菌菌体生物量,进一步延长其产酶期,使水生黄杆菌产酶能力充分发挥,最终提高褐藻酸裂解酶活力与产量。
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出的实施例。
- 还没有人留言评论。精彩留言会获得点赞!