一种循环肿瘤细胞的泵驱动式循环俘获系统及其控制方法与流程
本申请涉及生物医学技术领域,特别是涉及一种循环肿瘤细胞的泵驱动式循环俘获系统及其控制方法。
背景技术:
肿瘤转移是人类社会亟待攻克的重大问题,在癌症导致的死亡患者中,90%的病人死于肿瘤转移或转移的并发症。循环肿瘤细胞是肿瘤转移的元凶和主要载体。循环肿瘤细胞(ctc,circulatingtumorcell)的概念于1869年由澳大利亚籍医生ashworth首次提出,是指从肿瘤原发部位或转移灶上掉落至外周血循环中的肿瘤细胞,可能是细胞主动脱离、手术操作等内外部因素导致的。液态活检技术(特别是指检测血液中ctc的技术)有望实现肿瘤的早期检测,被mittechnologyreview2015评为十大突破技术之一。目前已报道的液态活检技术(免疫磁珠分离、亲和色谱富集等)体积通量低,无法应用于大体积样品中脱落ctc的快速检出,微孔过滤技术是最有望实现复杂临床样品的高体积通量液态活检的方法之一。
在目前基于尺寸分离的微孔过滤技术中,由于ctc与其他血细胞在尺寸上有一定重叠,尚无法实现大体积临床样品中痕量ctc的高效、高纯度分离。
技术实现要素:
本申请提供一种循环肿瘤细胞的泵驱动式循环俘获系统及其控制方法,以解决现有技术无法实现大体积临床样品中痕量ctc的高效、高纯度分离的问题。
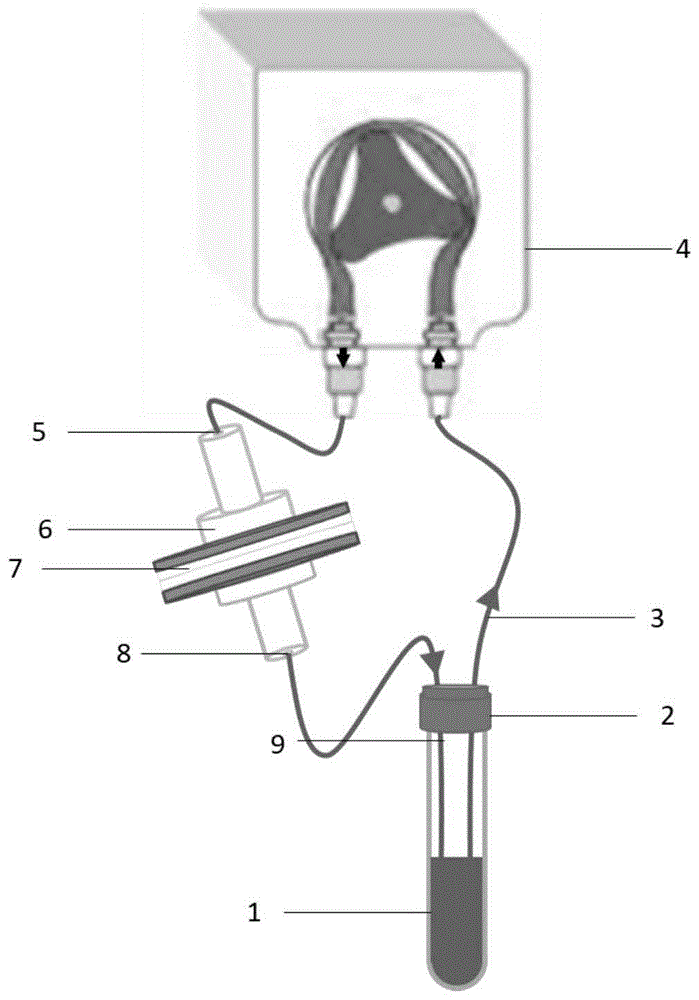
一种循环肿瘤细胞的泵驱动式循环俘获系统,包括抗凝管、密封胶塞盖、进液管道、微量蠕动泵、过滤装置以及出液管道;
所述密封胶塞盖设置在所述抗凝管的管口;
所述进液管道的一端穿过所述密封胶塞盖进入所述抗凝管的内部,所述进液管道的另一端连接在所述微量蠕动泵的输入端;
所述过滤装置的一端连接在所述微量蠕动泵的输出端,所述过滤装置的另一端连接在所述出液管道的一端,所述出液管道的另一端穿过所述密封胶塞盖进入所述抗凝管的内部;
其中,所述过滤装置包括上连接头、膜负载结构、高孔隙率滤膜以及下连接头,所述上连接头和所述下连接头分别设置在所述膜负载结构的输入端和输出端;所述高孔隙率滤膜设置在所述膜负载结构的内部;所述上连接头与所述微量蠕动泵的输出端连接;所述下连接头与所述出液管道连接;
所述进液管道、所述微量蠕动泵、所述上连接头、所述膜负载结构、所述高孔隙率滤膜、所述下连接头以及所述出液管道闭合形成循环回路;其中,所述高孔隙率滤膜的膜孔的孔径根据目标细胞直径进行调整;
所述抗凝管用于放置样品溶液;所述微量蠕动泵用于驱动所述样品溶液在所述循环回路中循环往复以实现循环肿瘤细胞的高效、高纯度俘获。
进一步地,所述抗凝管的内壁涂覆edta。
进一步地,所述膜负载结构采用含磁环式膜负载结构。
进一步地,所述膜负载结构密封。
进一步地,所述进液管道和所述出液管道的管道内径为0.5mm~12mm,管道壁厚为0.8mm~5mm;所述进液管道和所述出液管道的内壁涂覆pva或bsa。
进一步地,所述高孔隙率滤膜采用聚对二甲苯制成。
进一步地,所述高孔隙率滤膜的面积为1mm2~400mm2,厚度为10μm。
进一步地,所述高孔隙率滤膜的膜孔为六边形;所述高孔隙率滤膜的膜孔的直径为2μm-100μm;相邻两个膜孔之间的间距小于10μm。
一种循环肿瘤细胞的泵驱动式循环俘获系统的控制方法,具体包括以下步骤:
步骤1,检测设置有所述高孔隙率滤膜的所述膜负载结构的密封性,如果所述膜负载结构密封,执行步骤2;
步骤2,将样品溶液置于所述抗凝管中,再将所述抗凝管通过所述密封胶塞盖密封;
步骤3,将进液管道、微量蠕动泵、过滤装置以及出液管道依次连接;将进液管道穿过所述密封胶塞盖进入所述抗凝管的内部并深入所述样品溶液中;将出液管道穿过所述密封胶塞盖进入所述抗凝管的内部并深入所述样品溶液中,以得到如权利要求1-8所述的一种循环肿瘤细胞的泵驱动式循环俘获系统,从而形成样品溶液的循环回路;
其中,所述过滤装置包括上连接头、膜负载结构、高孔隙率滤膜以及下连接头,所述上连接头和所述下连接头分别设置在所述膜负载结构的输入端和输出端;所述高孔隙率滤膜设置在所述膜负载结构的内部;所述上连接头与所述微量蠕动泵的输出端连接;所述下连接头与所述出液管道连接;
步骤4,打开微量蠕动泵,调节泵速、循环时间、循环次数,使样品溶液在循环回路中多次稳定、均匀地循环流动;
步骤5,关闭微量蠕动泵,拆下膜负载结构和高孔隙率滤膜,在高孔隙率滤膜上进行观察俘获ctc的数量及形态特征。
进一步地,所述步骤1中检测设置有所述高孔隙率滤膜的所述膜负载结构的密封性的方法是:
在所述膜负载结构中加入pbs缓冲液,观察所述膜负载结构的外部是否有pbs缓冲液渗出;如果有pbs缓冲液渗出,则所述膜负载结构未密封;如果有pbs缓冲液未渗出,则所述膜负载结构密封。
与现有技术相比,本申请包括以下优点:
本发明采用抗凝管容纳待检测血液,抗凝管作为循环俘获系统的进口和出口;采用微量蠕动泵为整个循环俘获系统提供动力,可以根据实际情况人为控制流速;采用过滤装置可在大量背景细胞中实现ctc高通量的循环俘获和分离。本发明通过将循环俘获系统的进出口闭合,实现定量血液的循环过滤,基于ctc与其他血细胞物理性质(尺寸、硬度、细胞核大小等)的不同,在不引入外源成分(生物纯化试剂或化学纯化试剂)的前提下通过纯物理的方式,实现痕量ctc的高效、高纯度分离。本发明采用高孔隙率滤膜与泵驱动式循环系统结合的方式,通过对流速及循环次数的控制,根据不同细胞过孔条件的差异,在多次循环过滤中增加ctc(其物理特性是较大、较硬)俘获率的同时,降低其他血细胞如白细胞(其物理特性是较小、较软)的俘获,从而实现ctc的高效、高纯度分离。本发明实现了临床样品中ctc的快速、高效分离;本发明实现了在大背景血细胞中ctc的高纯度分离;本发明旨在基于物理性质通过循环过滤实现ctc的高效、高活性分离。本发明的操作简单、条件可控,可应用于生物医学工程领域,为临床应用提供了有效手段。
附图说明
图1是本发明中一种循环肿瘤细胞的泵驱动式循环俘获系统的结构示意图;
图2是本发明中高孔隙率滤膜的结构示意图;
图3是本发明中过滤装置中含磁环式膜负载结构的截面示意图;
图4是本发明中含磁环式膜负载结构的结构示意图;
图5是本发明中图4所示含磁环式膜负载结构的分解结构示意图;
图6a是本发明中采用表3中类型1的高孔隙率滤膜进行ctc俘获时利用重力驱动捕获、泵驱动单次捕获与泵驱动循环俘获三种不同方式得到的捕获率结果对比图;
图6b是本发明中采用表3中类型2的高孔隙率滤膜进行ctc俘获时利用重力驱动捕获、泵驱动单次捕获与泵驱动循环俘获三种不同方式得到的捕获率结果对比图;
图6c是本发明中采用表3中类型3的高孔隙率滤膜进行ctc俘获时利用重力驱动捕获、泵驱动单次捕获与泵驱动循环俘获三种不同方式得到的捕获率结果对比图;。
附图标记如下:
1-抗凝管,2-密封胶塞盖,3-进液管道,4-微量蠕动泵,5-上连接头,6-膜负载结构,7-高孔隙率滤膜,8-下连接头,9-出液管道,10-膜孔,61-上导流筒,62-上环形磁铁,63-上支架,64-下支架,65-下环形磁铁,66-下导流筒。
具体实施方式
为使本申请的上述目的、特征和优点能够更加明显易懂,下面结合附图和具体实施方式对本申请作进一步详细的说明。
现有技术中由于滤膜的孔隙率不高,容易造成膜孔堵塞等情况,仅设计为泵驱动式或重力驱动的单次过滤,由于ctc与白细胞的尺寸相近,这种方式无法实现大体积临床样品中痕量ctc的高效、高纯度分离。
本实施例采用高孔隙率滤膜与泵驱动式循环系统结合的方式,通过对流速及循环次数的控制,在多次循环过滤中增加了ctc(其物理特性是较大、较硬)俘获率的同时,降低了其他血细胞如白细胞(其物理特性是较小、较软)的俘获,从而实现了ctc的高效、高纯度分离。
参照图1,展示出了本申请一种循环肿瘤细胞的泵驱动式循环俘获系统,包括抗凝管1、密封胶塞盖2、进液管道3、微量蠕动泵4、过滤装置以及出液管道9;
所述密封胶塞盖2设置在所述抗凝管1的管口;
所述进液管道3的一端穿过所述密封胶塞盖2进入所述抗凝管1的内部,所述进液管道3的另一端连接在所述微量蠕动泵4的输入端;
所述过滤装置的一端连接在所述微量蠕动泵4的输出端,所述过滤装置的另一端连接在所述出液管道9的一端,所述出液管道9的另一端穿过所述密封胶塞盖2进入所述抗凝管1的内部;
所述过滤装置包括上连接头5、膜负载结构6、高孔隙率滤膜7以及下连接头8,所述上连接头5和所述下连接头8分别设置在所述膜负载结构6的输入端和输出端;所述高孔隙率滤膜7设置在所述膜负载结构6的内部;所述上连接头5与所述微量蠕动泵4的输出端连接;所述下连接头8与所述出液管道9连接;
所述进液管道3、所述微量蠕动泵4、所述上连接头5、所述膜负载结构6、所述高孔隙率滤膜7、所述下连接头8以及所述出液管道9闭合形成循环回路;其中,所述高孔隙率滤膜7的膜孔孔径根据目标细胞的直径进行调整;
所述抗凝管1用于放置样品溶液;所述微量蠕动泵4用于驱动所述样品溶液在所述循环回路中循环往复以实现循环肿瘤细胞的高效、高纯度俘获。
其中,本实施例的抗凝管1不限于如图1所示的管状结构,可为任何形式的液体闭合循环装置,包括所有体外血液采集装置及活体动物体内“透析式”血液闭合流通装置。
抗凝管1用于放置样品溶液,样品溶液也即待检测血液(细胞系悬液、未稀释全血等)。为了避免放置在抗凝管1内的待检测血液出现凝固现象,在抗凝管1的内壁涂覆edta(即乙二胺四乙酸)。抗凝管1需要保持密封性,因此,进液管道3和出液管道9都需要插入至待检测血液的液面以下,实现循环俘获系统的闭合循环。
所述膜负载结构6密封,为可拆式封闭结构。所述膜负载结构6采用含磁环式膜负载结构。本实施优选含磁环式膜负载结构,其优点是操作简单、密封性强。膜负载结构6与上连接头5和下连接头8可以通过螺纹紧密连接。
如图3、图4以及图5所示,含磁环式膜负载结构包括上导流筒61、上环形磁铁62、上支架63、下支架64、下环形磁铁65以及下导流筒66,上导流筒61和下导流筒66为圆筒结构,上导流筒61与上连接头5通过螺纹连接,下导流筒66与下连接头8通过螺纹连接;上支架63和下支架64均由圆筒和圆盘构成,高孔隙率滤膜7设置在上支架63的圆盘和下支架64的圆盘之间;所述上环形磁铁62和下环形磁铁65分别设置在上支架63的圆盘和下支架64的圆盘上,在上环形磁铁62和下环形磁铁65的吸力下使得上支架63的圆盘和下支架64的圆盘之间紧密贴合。
所述进液管道3和所述出液管道9的管道内径为0.5mm~12mm,管道壁厚为0.8mm~5mm。进液管道3和出液管道9可根据实际血液量和流速的需求进行调整。
所述进液管道3和所述出液管道9的内壁涂覆pva(聚乙烯醇)或bsa(牛血清白蛋白),防止细胞粘附在所述进液管道3和所述出液管道9的内壁上。
所述高孔隙率滤膜7采用聚对二甲苯制成。聚对二甲苯具有优异的生物兼容性(已被fda批准)和良好的透光性,其在生物医学领域已经得到了广泛应用。
所述高孔隙率滤膜7的面积为1mm2~400mm2,厚度为10μm。高孔隙率滤膜7的面积在1mm2~400mm2之间保证最大有效微孔个数为1.5*106,保证5ml血液(样品溶液)循环过滤1h不堵塞。高孔隙率滤膜7的10μm的厚度,由于高孔隙率滤膜7足够薄,保证血液(样品溶液)通过高孔隙率滤膜7时受到的阻力足够小,从而通量足够高,细胞受到阻力小活性足够高。10μm的厚度又保证足够薄的同时可以有一定的韧性,保证可操作性。
如图2所示,所述高孔隙率滤膜7的膜孔10为六边形;所述高孔隙率滤膜7的膜孔10的直径为2μm-100μm;相邻两个膜孔10之间的间距小于10μm。本实施例中高孔隙率滤膜7采用六边形的原因是:综合考虑孔隙率与孔-孔间距均一性等原因,经计算,六边形要好于正方形、三角形、圆形等。膜孔间距越小,孔隙率越高,单位时间过滤通量越高。膜孔10的孔径大小根据待检测血液中的待分离细胞的大小进行调整,可以根据分离细胞的尺寸制备相应尺寸的高孔隙率滤膜7,一般同一滤膜孔径相同。
如表1所示,是ctc与血液中其他细胞的尺寸区别。
表1血液中细胞成分的大小比较
本实施例通过将进液管道3、出液管道9深入待检测血液中,在微量蠕动泵4的驱动下促进待检测血液的循环,在此过程中待检测血液多次经过高孔隙率滤膜7,实现ctc的多次循环富集。本实施基于ctc物理性质的特点,ctc和其他细胞的主要区别在于:大小和硬度差异,即ctc比其他血细胞更大、更硬。通过计算可知,对循环速度以及循环次数的控制可以使得ctc的俘获数量逐渐增加的同时,其他血细胞(主要指白细胞)逐渐减少,从而高俘获率、高纯度地将ctc从待检测血液中分离出来。
如表2所示,是本实施例与其他分离ctc的原理的结果对比表,主要对ctc的回收率以及ctc的纯度进行比较。
表2本实施与其他分离方法的比较
本实施例采用了三种类型的高孔隙率滤膜7进行试验,如表3所示,为3中类型的高孔隙率滤膜7的尺寸数据。
表33种高孔隙率滤膜7的尺寸数据表
图6a-6c是表3中提供的类型1-类型3的高孔隙率滤膜7,在肿瘤细胞回收试验中的回收率比较图,可以看到本实施例中提供的循环过滤的肿瘤细胞捕获率要远高于重力驱动的肿瘤细胞捕获率以及单次泵驱动的肿瘤细胞捕获率。
本发明采用抗凝管容纳待检测血液,抗凝管作为循环俘获系统的进口和出口;采用微量蠕动泵为整个循环俘获系统提供动力,可以根据实际情况人为控制流速;采用过滤装置可在大量背景细胞中实现ctc高通量的循环俘获和分离。本发明通过将循环俘获系统的进出口闭合,实现定量血液的循环过滤,基于ctc与其他血细胞物理性质(尺寸、硬度、细胞核大小等)的不同,在不引入外源成分(生物纯化试剂或化学纯化试剂)的前提下通过纯物理的方式,实现痕量ctc的高效、高纯度分离。本发明采用高孔隙率滤膜与泵驱动式循环系统结合的方式,通过对流速及循环次数的控制,根据不同细胞过孔条件的差异,在多次循环过滤中增加ctc(其物理特性是较大、较硬)俘获率的同时,降低其他血细胞如白细胞(其物理特性是较小、较软)的俘获,从而实现ctc的高效、高纯度分离。本发明实现了临床样品中ctc的快速、高效分离;本发明实现了在大背景血细胞中ctc的高纯度分离;本发明旨在基于物理性质通过循环过滤实现ctc的高效、高活性分离。本发明的操作简单、条件可控,可应用于生物医学工程领域,为临床应用提供了有效手段。
本实施提供的一种循环肿瘤细胞的泵驱动式循环俘获系统,可以应用于活体透析,实现低血液成分损失的全身血液过滤。即把全身血液中的所有ctc高效、高纯度分离出来,从而克服ctc的稀有性和异质性,获得体内全部ctc时间谱特征。在应用于活体透析的过程中,由于高孔隙率滤膜7的孔隙率大,透析过程受到流体阻力小,从而在不影响生命体征的前提下可实现全身血液的过滤;同时,由于此系统可实现高效、高纯度的ctc分离,从而在透析过程中不会造成血液中正常细胞的损失从而保证了生命体的参数体征。
一种循环肿瘤细胞的泵驱动式循环俘获系统的控制方法,具体包括以下步骤:
步骤1,检测设置有所述高孔隙率滤膜7的所述膜负载结构6的密封性,如果所述膜负载结构6密封,执行步骤2;
步骤2,将样品溶液置于所述抗凝管1中,再将所述抗凝管1通过所述密封胶塞盖2密封;
步骤3,将进液管道3、微量蠕动泵4、过滤装置以及出液管道9依次连接;将进液管道3穿过所述密封胶塞盖2进入所述抗凝管1的内部并深入所述样品溶液中;将出液管道9穿过所述密封胶塞盖2进入所述抗凝管1的内部并深入所述样品溶液中,以得到上述的一种循环肿瘤细胞的泵驱动式循环俘获系统,从而形成样品溶液的循环回路;
其中,所述过滤装置包括上连接头5、膜负载结构6、高孔隙率滤膜7以及下连接头8,所述上连接头5和所述下连接头8分别设置在所述膜负载结构6的输入端和输出端;所述高孔隙率滤膜7设置在所述膜负载结构6的内部;所述上连接头5与所述微量蠕动泵4的输出端连接;所述下连接头8与所述出液管道9连接;
步骤4,打开微量蠕动泵4,调节泵速、循环时间、循环次数,使样品溶液在循环回路中多次稳定、均匀地循环流动;
步骤5,关闭微量蠕动泵4,拆下膜负载结构6和高孔隙率滤膜7,在高孔隙率滤膜7上进行观察俘获ctc的数量及形态特征。
本实施中的样品溶液指待检测血液。将待检测血液放置在抗凝管1中,使用密封胶塞盖2将抗凝管1的管口封住;将进液管道3的下端和出液管道9的下端穿过密封胶塞盖2上的相适应的小孔(即密封胶塞盖2上设置有与进液管道3匹配的第一小孔以及与出液管道9匹配的第二小孔,第一小孔和第二小孔在图中均为示出),使得抗凝管1形成密封的环境。进液管道3的上端连接在微量蠕动泵4的输入端,上连接头5的上端连接在微量蠕动泵4的输出端,上连接头5的下端连接在膜负载结构6的输入端,膜负载结构6的输出端连接在下连接头8的上端;下连接头8的下端连接在出液管道9的上端。
当开启微量蠕动泵4后,调节泵速、循环时间、循环次数(微量蠕动泵4可保持持续、稳定的液体流速,且可根据具体需求调节泵速,实现ctc的高效分离),使样品溶液在循环回路中多次稳定、均匀地循环流动。由于循环肿瘤细胞ctc较大较硬,需要更高的泵速才能通过,相应的白细胞较小较软,较低的泵速可使其通过膜孔10。泵速的选择要综合考虑循环肿瘤细胞ctc和白细胞各自的物理特性,使循环肿瘤细胞ctc留在高孔隙率滤膜7上,白细胞通过高孔隙率滤膜7。循环时间和次数主要考虑当循环一定次数后,ctc的俘获率缓慢升高直至饱和,根据饱和点决定循环时间和循环次数。
通过对泵速、膜孔10的直径以及循环次数的控制,保证ctc的高回收率,同时利用白细胞的以及其他血细胞比ctc的体积更小、变形能力更强的特点,使待检测血液多次循环后,其他血细胞大概率通过膜孔10,从而实现高孔隙率滤膜7对ctc的高纯度俘获。
即待检测血液在微量蠕动泵4的驱动下,沿着进液管道3进入微量蠕动泵4的输入端,再通过微量蠕动泵4的输出端通过上连接头5经过膜负载结构6,其中,膜负载结构6中设置有高孔隙率滤膜7,待检测血液经过高孔隙率滤膜7时,由于ctc比待检测血液中的其他血细胞更大、更硬,并且不具备较强的变形能力,所以ctc不能通过高孔隙率滤膜7,从而残留在高孔隙率滤膜7,待循环结束后,取下高孔隙率滤膜7,观察俘获ctc的数量及形态特征。
所述步骤1中检测设置有所述高孔隙率滤膜7的所述膜负载结构6的密封性的方法是:
在所述膜负载结构6中加入pbs缓冲液,观察所述膜负载结构6的外部是否有pbs缓冲液渗出;如果有pbs缓冲液渗出,则所述膜负载结构6未密封;如果有pbs缓冲液未渗出,则所述膜负载结构6密封。
以上对本申请所提供的一种循环肿瘤细胞的泵驱动式循环俘获系统及其控制方法,进行了详细介绍,本文中应用了具体个例对本申请的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本申请的方法及其核心思想;同时,对于本领域的一般技术人员,依据本申请的思想,在具体实施方式及应用范围上均会有改变之处,综上所述,本说明书内容不应理解为对本申请的限制。
- 还没有人留言评论。精彩留言会获得点赞!