海洋芽孢杆菌SP-5及其右旋糖酐酶的制作方法
本发明涉及一种微生物,特别是一种分离自中国江苏连云港海州湾海虾中的芽孢杆菌sp-5(bacillussp.)cgmccno.17010;本发明还涉及该菌株产的右旋糖酐酶的性质。
背景技术:
右旋糖酐酶(ec3.2.1.11)是一类能够专一性水解右旋糖酐内部α-1,6-糖苷键的糖苷水解酶,在制糖工业、血浆代替品的生产以及预防和治疗牙菌斑等方面都有着广泛的应用。右旋糖酐酶主要来源于微生物。目前研究报道的产右旋糖酐酶的微生物主要是真菌和细菌,真菌有青霉属、拟青霉属、曲霉属、镰孢属、轮枝孢属、长蠕孢属、毛壳属以及酵母,细菌有乳杆菌属、链球菌属、纤维弧菌属、噬细胞菌属、短杆菌属、假单胞菌属、棒杆菌属、节杆菌属以及黄杆菌属,这些产生菌主要来源于陆地。
而海洋蕴藏着丰富的微生物资源,由于其环境的特殊性,海洋微生物所产生的酶,具有耐盐、耐碱、耐低温等特性,在工业生产中更有利用价值。因此从海洋环境筛选高产右旋糖酐酶的菌株,是今后研究和开发右旋糖酐酶的关键。
技术实现要素:
本发明所要解决的技术问题是针对现有技术的不足,提供一种新的能产右旋糖酐酶的来自海洋的芽孢杆菌sp-5。
本专利要提供的另一个技术问题是提供上述来自海洋的芽孢杆菌sp-5产右旋糖酐酶的方法。
本发明所要解决的问题是通过以下的技术方案来实现的。本发明是一种来自海洋的芽孢杆菌(bacillussp.)sp-5,其保藏号为cgmcc.17010。
本发明所涉及的菌株sp-5是来自中国江苏省连云港海虾中分离得到的芽孢杆菌(bacillussp.)sp-5,该菌株已于2018年12月19日保藏在中国微生物菌株保藏中心cgmcc,保藏编号为cgmccno.17010。保藏单位地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,联系电话:010-64807355。
本发明所要解决的技术问题还可以通过以下的技术方案来进一步实现。本发明还公开了一种如以上技术方案所述的来自海洋的芽孢杆菌(bacillussp.)sp-5产右旋糖酐酶的方法,其特点是,将芽孢杆菌sp-5从斜面种子接种到2216e培养基中,装液量为20%,在30℃、180r/min下培养8h得到种子液;将种子液接种至产酶培养基中,接种量为2%,装液量为20%,在30℃、180r/min下培养48h,然后10000rpm离心10min,所得上清液用10000的中空纤维滤膜在3000rpm离心浓缩10倍得到粗酶液,4℃保存备用。
本发明所要解决的技术问题还可以通过以下的技术方案来进一步实现。本发明还公开了一种如以上技术方案所述方法所产的右旋糖酐酶,其特点是:该右旋糖酐酶是利用所述的芽孢杆菌sp-5采用以上所述的方法制得。
与现有技术相比,本发明具有以下优点:本发明提供了一种新的从海洋环境筛选高产右旋糖酐酶的菌株sp-5,并公开了产酶方法。本发明有效地拓宽了右旋糖酐酶的来源。本发明所产右旋糖酐酶具有较优的酶性质,具有广泛的应用前景。
附图说明:
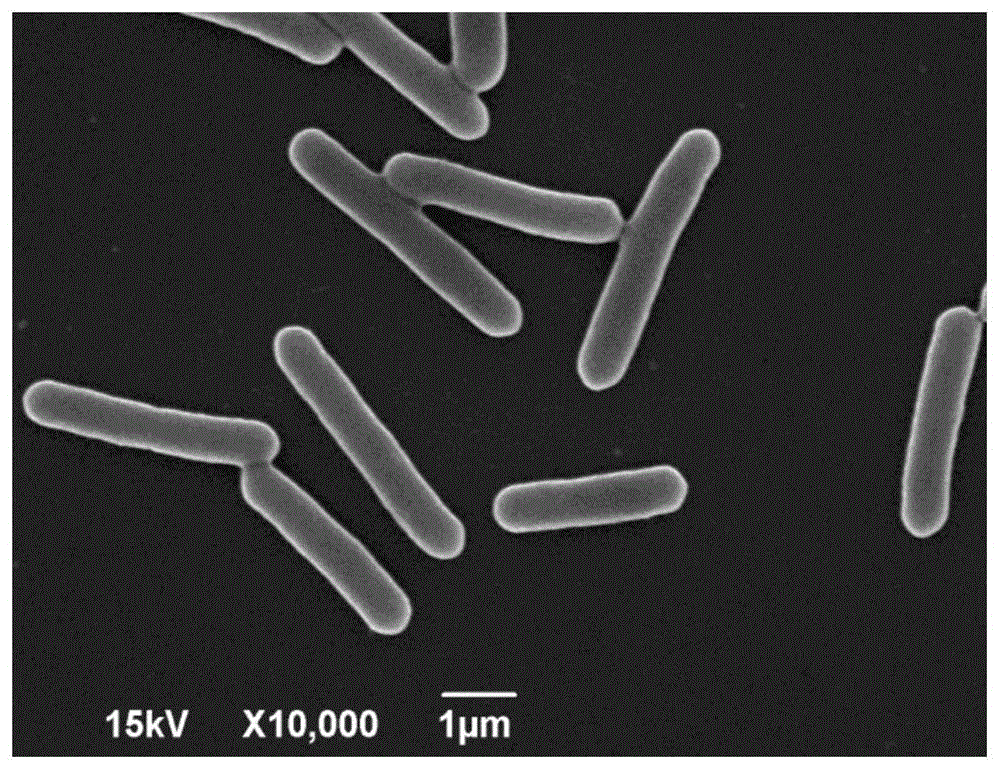
图1为菌株sp-5扫描电镜照片形态(10000×)图;
图2为菌株sp-5在初筛平板上形成的透明圈图;
图3为菌株sp-5系统进化树图;
图4为温度对菌株sp-5生长的影响图;
图5为nacl浓度对菌株生长的影响图;
图6为ph对菌株sp-5生长的影响图;
图7为碳源对菌株sp-5生长的影响图;
图8为氮源对菌株sp-5生长的影响图;
图9为温度对菌株sp-5右旋糖酐酶的影响图;
图10为菌株sp-5右旋糖酐酶的热稳定性图;
图11为ph对菌株sp-5右旋糖酐酶的影响图,▲乙酸乙酸钠缓冲液,●磷酸钠缓冲液,■tris-hcl缓冲液;
图12为菌株sp-5右旋糖酐酶的ph稳定性图,▲乙酸钠缓冲液,●磷酸钠缓冲液,■tris-hcl缓冲液;
图13为nacl浓度对菌株sp-5右旋糖酐酶的影响图;
图14为sp-5菌株右旋糖酐酶的底物特异性图;
图15为菌株sp-5右旋糖酐酶的水解产物图,g1-g6:葡萄糖,麦芽糖,麦芽三糖,麦芽四糖,麦芽五糖,麦芽七糖;s1-s5:右旋糖酐t20,右旋糖酐t40,右旋糖酐t70,右旋糖酐t500,右旋糖酐t2000。
本发明芽孢杆菌(bacillussp.)sp-5已于2018年12月19日保藏与中国微生物菌种保藏管理委员会普通微生物中心cgmcc,保藏编号为cgmccno.17010。保藏地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所。
具体实施方式
以下参照附图,进一步描述本发明的具体技术方案,以便于本领域的技术人员进一步地理解本发明,而不构成对其权利的限制。
实施例1,一种来自海洋麻虾虾酱中的芽孢杆菌(bacillussp.)sp-5cgmccno.17010。该菌株具体有以下特征:菌株为革兰氏阳性长杆菌,砖红色不透明菌落,边缘呈锯齿状,表面干燥不光滑;该菌株鸟氨酸、精氨酸脱羧酶、甲基红实验呈阳性,赖氨酸、硫化氢反应呈阴性;能利用麦芽糖、蔗糖、葡萄糖、甘露醇、赤藓醇、核糖、蕈糖。该菌株在低于4℃不能生长,生长温度范围为20-45℃,最适生长温度为35℃;ph生长范围为6-11,最适生长ph为8;nacl浓度范围为0-12%,没有nacl生长,最适生长nacl浓度为2%;0.5%麸皮和0.5%酵母粉有利于菌株sp-5生长。
1、菌株sp-5的筛选方法
1.1所涉及的培养基
2216e培养基:0.1%酵母粉,0.5%鱼粉蛋白胨,1.5%琼脂,陈海水配制,ph8.0.初筛培养基:0.5%鱼粉蛋白胨,0.1%酵母粉,0.2%蓝色葡聚糖2000,1%右旋糖酐t20,1.5%琼脂,陈海水配制,ph8.0。
种子培养基:0.1%酵母粉,0.5%鱼粉蛋白胨,陈海水配制,ph8.0。
产酶培养基:0.5%酵母粉,0.5%麸皮,1%右旋糖酐t20,2%nacl,ph8.0。
1.2菌株的筛选方法
直接称取1g海虾研磨后放入50ml2216e培养基中,20℃、180r/min培养2-5d。选取合适的培养液的稀释液涂布初筛培养基,20℃培养3-4d,菌落长出后加入95%乙醇,-20℃冷冻3~4h,观察菌落周围是否出现透明圈。挑取有透明圈的单菌落菌株接入产酶培养基,20℃、180r/min培养2d,10000r/min离心15min取上清液测定酶活力大小。选出透明圈较大和酶活力较高的菌株。
2、本发明菌株sp-5的形态特征与生理生化特征
2.1形态特征
菌株sp-5为革兰氏阳性杆菌,大小为2-3μm×0.5-0.8μm(见图1),菌株sp-5有芽孢,无鞭毛,无荚膜,在2216e固体培养基中培养48h后,菌落呈砖红色,边缘呈锯齿状,表面干燥不光滑。在含有蓝色葡聚糖的初筛培养基上能够产生透明圈(见图2)。
2.1生理生化特征
该菌株鸟氨酸、精氨酸脱羧酶、甲基红实验呈阳性,赖氨酸、硫化氢反应呈阴性;能利用麦芽糖、蔗糖、葡萄糖、甘露醇、赤藓醇、核糖、蕈糖,部分生理生化结果见表1。
表1菌株sp-5的生理生化特征
注:+:阳性;-:阴性。
2.3菌株sp-5的分子生物学鉴定
用细菌基因组提取试剂盒提取sp-5的基因组,选用扩增原核微生物16srdna序列的通用引物(27f:5’-agagtttgatcctggctcag-3’和1492r:5’-ggttaccttgttacgactt-3’)进行聚合酶链式反应。反应体系:taqplusploymerase(0.4μl),上下游引物(各1μl),dntp(1μl),pcrbuffer(2μl),dna模板(2μl),ddwater(12.6μl)。反应条件:94℃变性3min,94℃变性30s,55℃退火30s,72℃延伸90s,30个循环;72℃5min。将pcr产物琼脂糖电泳纯化回收并构建克隆载体,挑选阳性克隆子送往上海生工测序,将测得的序列反向互补拼接后,获得1515bp的碱基片段;将所得序列提交至genbank数据库,通过16srdna序列同源性比对,可以初步确定该菌株为芽孢杆菌(bacillus),将亲缘关系较近的菌株16srdna运用mega软件进行多重比较,用中邻接法(neibor-joingmethod)建系统进化树,从进化树表明菌株sp-5与bacillus亲缘关系最近。参见图3。
3、菌株sp-5的生长特性
提供的菌株sp-5,对其生长特性进行了细致研究,获得了该菌株的生长条件。
3.1种子液制备:将菌株sp-5斜面种子接种到2216e培养基中,装液量20%,30℃,180r/min,培养8h。
3.2温度对菌株sp-5生长的影响
将种子液以2%的接种量接种至2216e培养基,ph8.0,转速180r/min,装液量20%,分别在不同温度下培养6h,在600nm波长下测定od值,该菌株在0℃与4℃不生长,该菌株生长温度范围为20-45℃,最适生长温度为35℃,见图4。3.3nacl浓度对菌株sp-5生长的影响
按照3.1方法制备种子液,以2%的接种量接种至培养基:0.1%酵母粉,0.5%鱼粉蛋白胨,0-12%nacl,蒸馏水配制,ph8.0,装液量20%,在35℃、180r/min下培养6h,在600nm波长下测定od值。菌株sp-5在nacl浓度为0-12%范围内能生长,最适生长的nacl浓度为2%,见图5。
3.4ph对菌株sp-5生长的影响:
按照3.1方法制备种子液,以2%的接种量接种至培养基:0.1%酵母粉、0.5%鱼粉蛋白胨,2%的nacl,蒸馏水配制,ph5.0-10.0,为了防止培养过程中ph的变化,加入终浓度为10mmol/l的缓冲液:ph5.0-6.0(mes缓冲液),ph6.5-7.0(pipes缓冲液),ph7.5-8.0(hepes缓冲液),ph9.0-11.0直接用naoh调。培养条件同3.3。该菌株生长的ph范围6-11,最适生长ph为8,见图6。
3.5碳氮源对菌株sp-5生长的影响
以0.5%的碳源(右旋糖酐t20、玉米粉、糊精、麦芽糖、木薯淀粉、乳糖、马铃薯淀粉、蔗糖、葡萄糖、麸皮)和0.5%的氮源(酵母粉、鱼粉蛋白胨、花生粕、尿素、干酪素、豆粕、氯化铵、硝酸钠、硫酸铵)用于替换培养基中的酵母粉和蛋白胨,培养条件同3.3。0.5%麸皮和0.5%酵母粉有利于菌株sp-5生长,见图7-8。
实施例2,一种如实施例1所述来自海洋的芽孢杆菌sp-5产右旋糖酐酶的方法:将芽孢杆菌sp-5从斜面种子接种到2216e培养基中,装液量为20%,在30℃、180r/min下培养8h得到种子液;将种子液接种至产酶培养基中,接种量为2%,装液量为20%,在30℃、180r/min下培养48h,然后10000rpm离心10min,所得上清液用10000的中空纤维滤膜在3000rpm离心浓缩10倍得到粗酶液,4℃保存备用。
所产的右旋糖酐酶的性质如下:该菌株sp-5产的右旋糖酐酶最适作用温度为40℃,该菌株产的右旋糖酐酶在30-50℃下有较高的催化活力。该酶的稳定性较好,40℃酶的半衰期为5h,50℃保温1h后酶活力仅能保持约75%。最适作用ph为6,在ph5-8范围内有较好的稳定性。nh4+、li+对酶稳定性有一定的保护作用,而fe3+、cu2+、ni+、mn2+、co2+对酶稳定性有一定的抑制作用;该酶比较偏好作用于分子量较小的右旋糖酐;该酶在1mnacl下能维持80%的酶活力,在2mnacl下能维持75%的酶活,在3mnacl下仅能维持20%的酶活;该酶水解右旋糖酐的产物为葡萄糖,由菌株sp-5所产生的右旋糖酐酶为一种外切型右旋糖酐酶。
4、菌株sp-5右旋糖酐酶粗酶性质
4.1粗酶液制备
将菌株sp-5从斜面种子接种到2216e培养基中,装液量为20%,在30℃、180r/min下培养8h得到种子液;将种子液接种至产酶培养基中,接种量为2%,装液量为20%,在30℃、180r/min下培养48h,然后10000rpm离心10min,所得上清液用10000的中空纤维滤膜在3000rpm离心浓缩10倍得到粗酶液,4℃保存备用。
4.2温度对菌株sp-5右旋糖酐酶活性的影响
分别在不同温度下测定菌株sp-5右旋糖酐酶活力,计算相对酶活力,该菌株产的右旋糖酐酶在30-50℃下有较高的催化活力,最适作用温度为40℃,见图9。
4.3菌株sp-5右旋糖酐酶的热稳定性
将酶液分别置于不同温度(30℃、40℃、50℃)的水浴锅中保温1-5h,每隔1小时取出样品迅速冷却保藏,待温育结束后统一进行酶活力测定,以未处理酶液作对照,计算相对酶活。该酶的稳定性较好,40℃酶的半衰期为5h,50℃保温1h后酶活力仅能保持约75%。见图10。
4.4ph对菌株sp-5右旋糖酐酶活性的影响
将酶液与不同ph的3%的右旋糖酐溶液在40℃下进行酶活力的测定,不同ph的缓冲液为:50mm乙酸钠缓冲液(ph4.0-6.0)、50mm磷酸钠缓冲液(ph6.0-7.5)和50mmtris-hcl缓冲液(ph7.5-9.0),该酶在ph5-8有较高的催化活力,最适酶作用ph为6,见图11。
4.5菌株sp-5右旋糖酐酶的ph稳定性
将酶液与浓度为50mmol/l的各种不同ph缓冲液(按照4.4中的缓冲液)混合,并在25℃的水浴锅中保温1h取出测定酶活力,将未处理酶液的酶活设为100%,计算相对酶活力。该菌株产的右旋糖酐酶在ph5.0-8.0范围内残余酶活力能维持80%以上,有相对好的稳定性,见图12。
4.6nacl浓度对菌株sp-5右旋糖酐酶活性的影响
将酶液与不同nacl浓度(1-4m)的3%的右旋糖酐溶液在40℃下进行酶活力的测定,以不含nacl的底物为对照,计算相对酶活力。该酶在1mnacl下能维持80%的酶活力,在2mnacl下能维持75%的酶活,在3mnacl下仅能维持20%的酶活,见图13。
4.8菌株sp-5右旋糖酐酶底物特异性
将多种不同分子量的右旋糖酐(右旋糖酐t20,右旋糖酐t40,右旋糖酐t70,右旋糖酐t500,右旋糖酐t2000)于50mmol/l乙酸-乙酸钠缓冲液(ph6.0)中,测定酶活力。该右旋糖酐酶偏好作用于分子量较小的右旋糖酐,结果如图14。4.9金属离子对sp-5右旋糖酐酶稳定性的影响
将酶液与不同的金属离子混合,并使金属离子的终浓度分别为1mmol/l、5mmol/l和10mmol/l,然后在30℃水浴锅中保温1h后取出测定酶活力,并以不含金属离子的酶液为对照计算相对酶活力。在1mmol/l、5mmol/l和10mmol/l浓度时,不同金属离子对右旋糖酐酶稳定性的影响如表2所示,从表中可知nh4+、li+对酶稳定性有作用,而fe3+、cu2+、ni+、mn2+、co2+对酶稳定性,而其他离子对酶的稳定性影响较小,见表2。
表2金属离子对sp-5右旋糖酐酶稳定性的影响
4.9菌株sp-5右旋糖酐酶水解产物分析
将酶液与不同分子量的右旋糖酐(右旋糖酐t20,右旋糖酐t40,右旋糖酐t70,右旋糖酐t500,右旋糖酐t2000)在40℃下酶解3h,对产物进行薄层层析分析。对照标准品发现,该酶水解不同分子量的右旋糖酐产物为葡萄糖,表明由菌株sp-5所产的右旋糖酐酶酶外切型右旋糖酐酶,见图15。
4.10右旋糖酐酶活的测定:
①右旋糖酐酶活测定方法:将50μl酶液加入到150μl3%的右旋糖酐t70的乙酸-乙酸钠缓冲液(0.05mol/l,ph6.0)中,在40℃水浴中反应30min,加入200μldns,沸水浴中煮沸5min,终止反应并显色,加入3ml去离子水震荡混匀,取200μl与96孔酶标板上与540nm下进行吸光值测定。
②酶活力单位定义(u/ml):在一定温度和ph下,每分钟催化产1umol还原糖的酶量为一个活力单位。
- 还没有人留言评论。精彩留言会获得点赞!