一种用于生产抗体的微流控芯片的制作方法
本发明涉及微流控技术领域,具体涉及一种用于生产抗体的微流控芯片。
背景技术:
抗体是诊断和治疗领域应用最广泛的工具之一。目前抗体可以通过体内和体外两种手段制备,其中体内手段即促进动物产生腹水,体外手段即通过组织培养杂交瘤细胞产生上清。
组织培养杂交瘤细胞上清中单克隆抗体含量通常少于0.01mg/ml,而腹水中单克隆抗体含量在1-100.00mg/ml。组织培养杂交瘤细胞通常需要9周时间,而制备腹水时间不超过4周。制备腹水由于使用活体动物,一直受到动物保护人士的诟病。此外,无论组织培养还是动物制备腹水的方式,其成本都非常高昂,所以造成了目前抗体价格极高的问题。
目前体外手段通常采用celline培养瓶制备单克隆抗体,该培养瓶价格昂贵,操作过程极为复杂,无法实现连续化生产,培养过程需要大量的人工操作,且需要严格的流程避免污染。
微流控芯片技术(microfludics)是把生物、化学、医学分析过程的样品制备、反应、分离、检测等基本操作单元集成到一块微米尺度的芯片上,自动完成分析全过程,且可以多次使用,其装置特征主要是其容纳流体的有效结构(通道、反应室和其它某些功能部件)至少在一个维度上为微米级尺度。由于微米级的结构,流体在其中显示和产生了与宏观尺度不同的特殊性能,因此发展出独特的分析产生的性能。微流控芯片已广泛应用于分离、检测、反应、细胞培养等,然而,目前仍没有可连续化、高效生产抗体的微流控芯片。
技术实现要素:
本发明旨在提供一种能够连续化操作、成本低廉,且无交叉污染风险的生产抗体的微流控芯片,用来替代现有体外组织培养制备抗体的产品。
为此,本发明的第一方面,提供了一种用于生产抗体的微流控芯片,包括芯片本体,
所述芯片本体内设置有液体通道及气体通道;
所述液体通道包括依次连通的进样通道、混合通道、反应通道、收集通道,所述进样通道设置有进样口,所述收集通道设置有收集口;
所述气体通道包括依次连通的气体入口、气路通道、气体出口;
所述反应通道与所述气路通道之间,可进行气体交换且不进行液体交换。
进一步,所述混合通道、收集通道与所述气路通道之间,可进行气体交换且不进行液体交换。
进一步,所述进样口的个数为1-5个;当所述进样口的个数为2-5个时,每个进样口分别通过一个进样通道与所述混合通道相连。
本发明进样口的个数可根据抗体生产过程所用溶液的种类进行选择,在具体的实施方式中,所述进样口的个数为3个,分别对应抗体生产所需的细胞悬液(杂交瘤细胞)、imdm完全培养基和胎牛血清(fbs)。
进一步,所述芯片本体包括第一芯板和第二芯板;
所述液体通道设置在所述第一芯板内,所述气体通道设置在所述第二芯板内。
进一步,所述气体入口、气体出口设置在所述第一芯板内。
进一步,所述混合通道为蛇形结构、人骨结构或微柱阵列。
进一步,所述收集通道的孔径沿所述反应通道向所述收集口方向逐渐增大。
进一步,所述收集通道和所述收集口之间设有过滤膜,所述过滤膜的孔径小于生产抗体所用细胞的直径,且大于10kda。在具体的实施方式中,所述生产抗体所用细胞为杂交瘤细胞。
进一步,所述反应通道与所述气路通道之间设置有弹性薄膜,所述薄膜透气不透液体,且可在所述气路通道内气体压力变化时发生形变。
进一步,所述混合通道、收集通道与所述气路通道之间设置有弹性薄膜,所述薄膜透气不透液体,且可在所述气路通道内气体压力变化时发生形变。
进一步,所述薄膜为硅胶膜、3mtm3394或pdms膜。
进一步,所述薄膜的厚度为0.1-0.3mm。
进一步,所述气路通道的宽度为1-3mm,深度为0.5-1.5mm。
进一步,所述微流控芯片除过滤膜和薄膜以外部分的材质为pdms、ps、pmma、coc、abs、pc或玻璃。
本发明的第二方面,提供了一种用于生产抗体的装置,所述装置包括本发明所述的微流控芯片。
进一步,所述进样口连接液体动力源,所述液体动力源能够持续提供液体流入和流量控制。在具体的实施方式中,所述液体动力源为注射泵、蠕动泵或恒压泵。
进一步,所述气体入口和所述气体出口连接气体动力源,所述气体动力源能够提供o2、去除co2且可调节o2的压力。
本发明的第三方面,提供了本发明所述的微流控芯片或装置在生产抗体方面的应用。
与现有技术相比,本发明的有益效果包括,
1、通过应用本发明的微流控芯片,对抗体的生产可以实现连续化操作,避免celline培养瓶的多个人工操作步骤,并且避免了污染的可能;
2、本发明的微流控芯片自带气体交换和温度控制系统,在抗体生产的过程中,避免了大型的细胞培养箱的使用;
3、与培养瓶相比,微流控芯片管道体积小,杂交瘤细胞与培养基中的营养物质接触更充分,产生抗体效率更高。
附图说明
通过阅读下文优选实施方式的详细描述,各种其他的优点和益处对于本领域普通技术人员将变得清楚明了。附图仅用于示出优选实施方式的目的,而并不认为是对本发明的限制。而且在整个附图中,用相同的参考符号表示相同的部件。在附图中:
图1为微流控芯片为两层芯板的结构示意图;
图2为微流控芯片的剖视图;
图3为微流控芯片的局部结构示意图;
图4为微流控芯片与动力源的连接示意图;
图5为细胞密度观测点的设置图;
图6为微流控芯片为三层芯板的结构示意图;
附图标记:
100-微流控芯片;
110-第一芯板;111-进样口;1111-第一进样口;1112-第二进样口;1113-第三进样口;112-进样通道;1121-第一进样通道;1122-第二进样通道;1123-第三进样通道;113-混合通道;114-反应通道;115-收集通道;116-收集口;117-气体入口;118-气体出口;119-过滤膜;
120-第二芯板;121-气路通道;122-薄膜;
130-第一动力源;140-第二动力源;150-第三动力源;160-第四动力源;170-第五动力源;180-第一细胞密度观测点;190-第二细胞密度观测点;
200-微流控芯片;
2101-第一芯板上板;211-进样口;2111-第一进样口;2112-第二进样口;2113-第三进样口;216-收集口;217-气体入口;218-气体出口;
2102-第一芯板下板;212-进样通道;2121-第一进样通道;2122-第二进样通道;2123-第三进样通道;213-混合通道;214-反应通道;215-收集通道;
220-第二芯板;221-气路通道。
具体实施方式
下面将参照附图更详细地描述本公开的示例性实施方式。虽然附图中显示了本公开的示例性实施方式,然而应当理解,可以以各种形式实现本公开而不应被这里阐述的实施方式所限制。相反,提供这些实施方式是为了能够更透彻地理解本公开,并且能够将本公开的范围完整的传达给本领域的技术人员。
在本发明中限定了一些方位词,在未做出相反说明的情况下,所使用的方位词如“左、右、上、下”是指本发明提供的微流控芯片在正常使用情况下定义的,这些方位词是为了便于理解而采用的,因而不构成对本发明保护范围的限制。
以下为方便进行描述,以杂交瘤细胞产生抗体为例进行说明,但应当理解的是,本申请的微流控芯片不限于此。
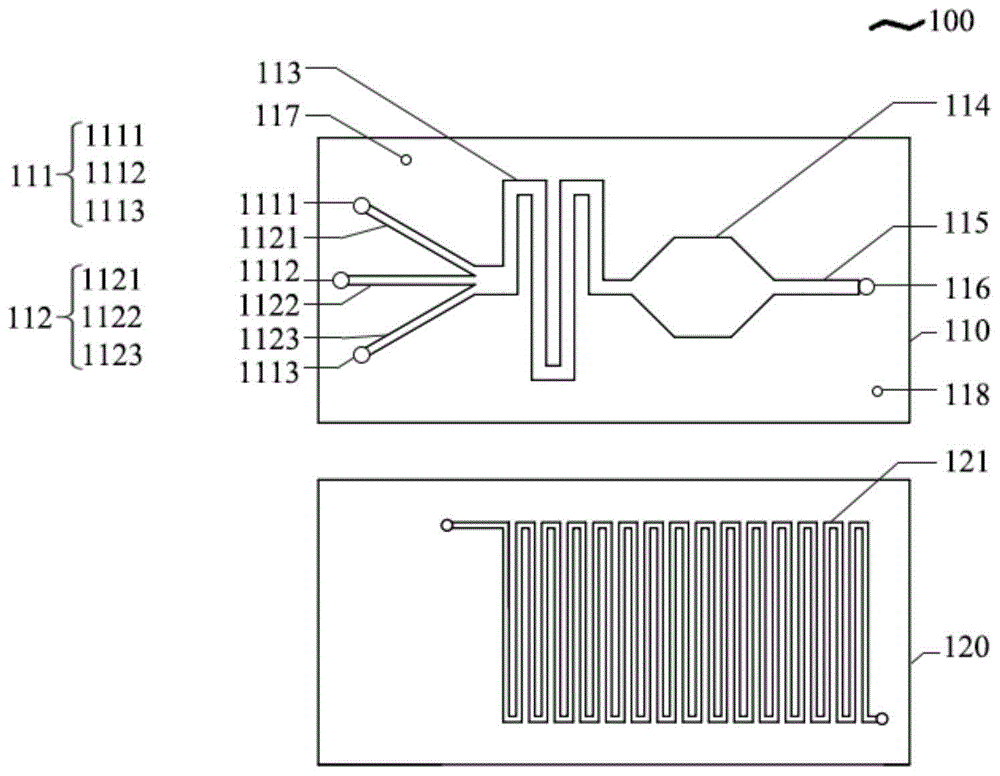
请参照图1,本发明的一个实施例提供一种微流控芯片100,包括芯片本体,所述芯片本体内设置有液体通道及气体通道;所述液体通道包括依次连通的进样通道112、混合通道113、反应通道114、收集通道115,所述进样通道112设置有进样口111,所述收集通道115设置有收集口116;所述气体通道包括依次连通的气体入口117、气路通道121、气体出口118;所述反应通道114与所述气路通道121之间,可进行气体交换且不进行液体交换。
在进一步的实施例中,混合通道113、收集通道115与气路通道121之间,可进行气体交换且不进行液体交换。
在进一步的实施例中,所述进样口111的个数可根据抗体生产过程所用溶液的种类进行选择,如图1所示,所述进样口的个数为3个,第一进样口1111、第二进样口1112和第三进样口1113分别对应抗体生产所需的imdm完全培养基、细胞悬液和胎牛血清(fbs);所述第一进样口1111通过第一进样通道1121,第二进样口1112通过第二进样通道1122,第三进样口1113通过第三进样通道1123与混合通道113相连通。
所述混合通道113可为微流控芯片领域常见的混合结构,只需保证加入的液体充分混合均匀即可,具体地,所述混合通道113为蛇形结构、人骨结构、微柱阵列等常见混合结构。
在进一步的实施例中,如图2所示,所述收集通道115的孔径沿反应通道114向收集口116方向逐渐增大。所述收集通道115和所述收集口116之间设有过滤膜119,所述过滤膜119的孔径小于杂交瘤细胞的直径,且大于10kda,即10kda以下的蛋白质分子可穿过所述过滤膜119。
在反应通道114中,杂交瘤细胞在生长过程中持续产生抗体,进行收集时,溶液中的抗体和杂交瘤细胞同时流向收集口116,由于收集通道115的孔径沿反应通道114向收集口116逐渐增大,如图2中所示,收集通道115的上壁向上倾斜,液体流速沿该方向逐渐减小。由于杂交瘤细胞密度较大,易于沉降于收集通道115的底部,因此主要是生产得到的抗体和其它溶液聚集于过滤膜119处。过滤膜119的孔径小于杂交瘤细胞的直径且大于10kda,确保所有杂交瘤细胞留在收集通道115中,而抗体能够通过过滤膜119,目标抗体最终通过收集口116得到了收集。过滤膜119需要覆盖收集口116的全部面积。
在进一步的实施例中,所述反应通道114与所述气路通道121之间,为一层弹性薄膜122,所述薄膜122透气不透液体,且可在所述气路通道121内气体压力变化时发生形变。薄膜122需要覆盖气路通道121和反应通道114。
在进一步的实施例中,所述混合通道113、收集通道115与所述气路通道121之间,为一层弹性薄膜122,所述薄膜122透气不透液体,且可在所述气路通道121内气体压力变化时发生形变。薄膜122需要覆盖气路通道121和混合通道113、收集通道115。
如图3所示,气体入口117提供具有一定压力的o2,其压力可以通过入口处的动力源进行调节。常规压力下,薄膜122处于常规状态;当o2呈现低压状态时,薄膜122向气路通道121一侧形变;当o2呈现高压状态时,薄膜122向反应通道114一侧形变。
薄膜122为硅胶膜、3mtm3394或pdms膜,厚度为0.1-0.3mm,具有良好的透气性且不透液体,当o2压力变化时,一方面可促进o2经薄膜122进入反应通道114,促进杂交瘤细胞的生长,并且迫使co2透过薄膜122排出反应通道114,避免过量co2引起的ph变化影响杂交瘤细胞生长环境,具体地,由于所述薄膜122具有透气性,使用过程中,可以通过增加o2分压,首先迫使o2透过薄膜122进入反应通道114;之后降低o2分压,使得o2分压小于反应通道114中混合气体分压,反应通道114中的混合气体压力高于气路通道121,混合气体通过薄膜122,部分co2排出,通过重复上述过程,实现o2进入反应通道114,co2从反应通道114排出;另一方面,通过气压调节可实现薄膜122的上下形变,促进了细胞在反应通道114中的流动,避免了大量细胞聚集在收集通道115处,通过薄膜122的规律形变,可促进杂交瘤细胞在整个反应通道114中均匀分布,有利于杂交瘤细胞和培养基等营养物质充分接触。
微流控芯片的材质除过滤膜119和薄膜122以外部分的材质可选用pdms、ps、pmma、coc、abs、pc或玻璃等透明材质,本实施例优选pdms或ps,通过注塑或印压工艺制成。需要说明的是,本发明的微流控芯片可以为一层、两层、三层或更多层结构组成,为便于加工,在一些实施例中优选为两层或三层芯板结构,根据需求在各层芯板上采用常规加工方式加工出流道及孔等结构,芯板之间采用热压、胶粘或等离子键合等常规手段封合。
在一个实施例中,参照图1所示,微流控芯片100为两层芯板结构,在第一芯板110上根据进样通道112、混合通道113、反应通道114、收集通道115的宽度和深度进行加工,同时设置穿孔结构的进样口111、收集口116、气体入口117和气体出口118,保证液体和气体的进入及流通。
在另一个实施例中,参照图6所示,微流控芯片200为三层芯板结构,第一芯板210分为第一芯板上板2101和第一芯板下板2102两层独立结构,其中第一芯板上板2101设置进样口211、收集口216、气体入口217和气体出口218,均为穿孔结构;第一芯板下板2102设置的进样通道212、混合通道213、反应通道214、收集通道215结构的深度和第一芯板下板2102的厚度一致,该方式能够减少上述结构的加工面,降低管道的粗糙度,有利于抗体的生产;第二芯板220上设置气路通道221。
以cho细胞系为例,结合图1-5,对本发明的微流控芯片的工作过程说明如下:
芯片使用前做灭菌处理,灭菌方式可采用酒精或者紫外灯消毒。
如图4所示,将第一进样口1121、第二进样口1122和第三进样口1123分别连接第一动力源130、第二动力源140、第三动力源150,其中第一动力源130提供imdm完全培养基、第二动力源140提供杂交瘤细胞悬液、第三动力源150提供胎牛血清(fbs)。所述动力源能够持续提供上述三种溶液,且可以调节三种溶液的流量。
芯片的收集口116连接第四动力源160,所述第一动力源130与第四动力源160相连接。
气体入口117和所述气体出口118连接第五动力源170,第五动力源170能够提供一定温度和压力的o2,并且去除co2;且第五动力源170能够控制和调节o2的压力。
如图5所示,在混合通道113上方设第一细胞密度观测点180,在反应通道114和收集通道115的连接处设第二细胞密度观测点190,通过显微镜可观测观测点处单位时间的细胞密度,通过观测第一细胞密度观测点180,可估算进入反应通道114的杂交瘤细胞数量是否达到最佳条件;通过观测第二细胞密度观测点190可以监测杂交瘤细胞的生长情况。根据细胞数量及时进行营养物质补充或者血清收集。
首先开启第五动力源170,为整个芯片提供气体和温度控制,将芯片温度维持在37℃。
接着,开启第一动力源130、第二动力源140、第三动力源150,持续按照一定比例泵入imdm完全培养基、杂交瘤细胞悬液、胎牛血清,三种溶液分别经第一进样通道1121、第二进样通道1122和第三进样通道1123进入混合通道113,在混合通道113中充分混合。
再通过显微镜观测第一细胞密度观测点180,估算进入反应通道114的杂交瘤细胞,保证最佳数量的杂交瘤细胞进入反应通道114。
进入反应通道114的杂交瘤细胞数量达到要求之后,关闭第二动力源140。在第五动力源170持续供给o2的条件下,反应通道114中的杂交瘤细胞在imdm完全培养基和fbs的液体环境中持续产生抗体,并进行增殖,产生的co2透过薄膜122进入气路通道121,避免杂交瘤细胞生长环境受co2影响。
在抗体生产过程中,imdm完全培养基和fbs两种溶液以较低的流量持续/间歇的进入芯片中,每当有imdm完全培养基和fbs进入芯片之后,由于芯片是密闭腔体,由于新的液体的进入,杂交瘤细胞和产生的抗体溶液会经过反应通道114进入收集通道115,由于收集通道115的孔径沿反应通道114向收集口116逐渐增大,液体流速沿该方向逐渐减小。由于杂交瘤细胞密度较大,易于沉降于收集通道115的底部,因此主要是生产得到的抗体和其它溶液透过过滤膜119,继而经收集口116进入第四动力源160。其中生产得到的抗体在第四动力源160中收集,过滤后的培养基可以根据需要再运输到第一动力源130重复利用。上述过程中的流量调整,可以通过观测第二细胞密度观测点190的杂交瘤细胞密度,从而判断整个反应管道的细胞密度,以此判断是否调整imdm完全培养基和fbs流量。
通常,imdm完全培养基和fbs溶液有利于杂交瘤细胞增殖和产生抗体,且杂交瘤细胞在大量增殖和产生抗体时对培养基和fbs的消耗较大。因此,是否持续/间歇地供给培养基和fbs进入芯片,可根据杂交瘤细胞的密度进行确定。
如图3所示,在上述收集过程中如果大量细胞聚集在收集通道115或过滤膜119处,可以调整第五动力源170供给的o2的压力,使其按照一定周期高/低压运动,以使薄膜122发生周期形变,从而引起细胞震荡,在整个反应通道114再次均匀分布。
本发明未涉及的部分均与现有技术相同或可采用现有技术加以实现。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
- 还没有人留言评论。精彩留言会获得点赞!