一种联合水解菌体蛋白和大豆蛋白的工艺的制作方法
本发明属于生物
技术领域:
,具体涉及一种联合水解菌体蛋白和大豆蛋白的工艺。
背景技术:
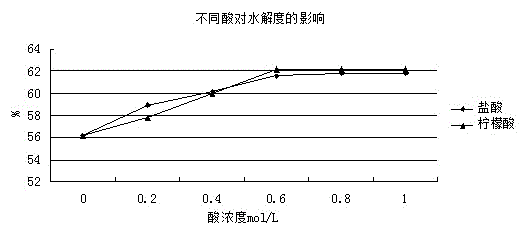
:菌体蛋白是微生物发酵生产氨基酸的过程中的副产品,含有丰富的蛋白质和其他营养物质。研究表明,采用菌体蛋白酶解液替代豆粕水解产物作为氮源来培养微生物,对微生物的发酵影响并不大,申请人在实际的工业生产中偶然发现,菌体蛋白水解产物中添加一定比例的豆粕水解产物,能够提高微生物发酵生产苏氨酸的产量,但是考虑到豆粕水解产物中含有一定的色素等杂质,不利于后续苏氨酸的纯化,因此,可以采用大豆蛋白水解产物进行替换,考虑到操作的简便性和可控性,可以将菌体蛋白和大豆蛋白进行联合水解,但是两种蛋白结构和组分存在较大的差异,适合菌体蛋白的水解工艺并不能适合大豆蛋白,反之亦然,现有技术并没有对二者联合水解的工艺参数进行详细的阐述,如何对菌体蛋白和大豆蛋白进行联合水解,以简化程序,降低能耗,使得营养价值最大化,从而更有效地提升苏氨酸的发酵效率,是工业化生产过程中需要解决的技术问题。文献1“大豆蛋白水解物中肽分子分布的研究,中国粮油学报2001年”研究采用超滤法与凝胶过滤色谱(gfc)相结合实验方法就大豆蛋白酶解产物寡肽混合物的分子量的分布状况进行了测定。研究结果表明,木瓜蛋白酶与asl.398蛋白酶的酶解物中以分子量在1000d以下的小肽为主:木瓜蛋白酶解产物中分子量1000d以下的占63.9%,1000~2000d之间的4.64%,2000~4000d之间的占8.21%,4000~10000d之间的占8.20%,分子量10000d以上的占15%;as1.398蛋白酶酶解物中分子量1000d以下的占72.1%,1000d~2000d的占6.42%,2000d~4000d之间的占2.5%,4000~10000d之间的占3.92%,10000d以上的占15%。然而,单独的木瓜蛋白酶或者asl.398蛋白酶对菌体蛋白的水解效率较差,不合适共同水解。文献2“酶解高水解度大豆蛋白肽的研究,粮油加工与食品机械2005年”通过对中性蛋白酶、木瓜蛋白酶、alcalase碱性蛋白酶3种酶对大豆分离蛋白水解程度的研究,优化试验方案,探索制备高水解度大豆蛋白水解液的条件组合,并对3种酶进行了比较,以找出适合于大豆蛋白水解的蛋白酶。文献3“中性蛋白酶水解红曲霉菌体蛋白的研究,中国调味品2011年”为了使红曲霉菌体滤渣得到高值化利用,对红曲霉菌体的酶解条件进行了研究。采用中性蛋白酶对红曲霉菌体进行酶解,通过单因素试验和正交试验,确定了最佳的酶解条件:酶解ph为6.5,酶解温度为45℃,底物浓度为35g/l,酶量为6000u/g(菌体),酶解时间为16h。在最佳条件下进行验证试验,酶解的水解度为9.12%,总水解度为14.73%。该研究得到的水解度偏低,而且水解方法也不能完全照搬应用于水解大豆蛋白。申请人之前的专利技术“一种利用菌体蛋白酶解液代替酵母粉的l-色氨酸绿色生产方法”对菌体蛋白酶解进行系统研究,提高了水解度。申请人继续进行改进和优化,以得到适合同时水解菌体蛋白和大豆蛋白的水解体系。技术实现要素:为了能够同时对菌体蛋白和大豆蛋白进行联合水解,以提高发酵效率,克服现有技术的不足,本发明提供了一种联合水解菌体蛋白和大豆蛋白的工艺。本发明是通过如下方案来实现的。一种联合水解菌体蛋白和大豆蛋白的工艺,其包括如下步骤:按照重量比2-4:1取菌体蛋白和大豆蛋白,然后按照1g:5-10ml的比例添加酸的水溶液,搅拌均匀,然后置于高速剪切机剪切,静置30-90min,再以超声波处理,静置2h,然后调整ph为3.0,温度为40℃,再添加酸性蛋白酶,酶解时间为4-6h,然后调整ph为7.0,温度为50℃,再添加沙雷肽酶,酶解时间为4-6h,最后灭酶,得到水解液。优选地,所述酸的水溶液为柠檬酸水溶液。进一步优选地,所述柠檬酸水溶液的浓度为0.4-0.8m。更优选地,所述柠檬酸水溶液的浓度为0.6m。优选地,所述高速剪切机的剪切速度为8000-10000rpm,剪切时间为60-90s。优选地,所述超声波处理的时间为30-90s,超声波频率为25khz。优选地,所述酸性蛋白酶的添加量为2000u/g干物质。优选地,所述沙雷肽酶的添加量为1000u/g干物质。本发明的出发点和取得的有益效果主要包括但是并不限于以下几个方面:由于菌体蛋白和大豆蛋白在蛋白三维结构组成方面存在较大的差异,常规适合水解单一蛋白的体系并不适合水解两种蛋白,需要开发一种联合水解两种蛋白的体系。本发明在弱酸条件下,对两种蛋白进行物理辅助初步水解,不但能够水解部分蛋白,而且有利于后续的酶水解。本发明采用柠檬酸取代盐酸,水解条件温和,不会破坏氨基酸组分,而且水解度有一定程度的提高。本发明采用高速剪切和超声波处理在弱酸条件下进行处理,不仅使得菌体蛋白细胞壁破裂,并且加快了传质过程,降低了体系的粘度,有助于水解;还能够使得蛋白质链被破坏或变得松散,使得蛋白质内部结构发生变化,提高蛋白溶解性和亲水性,从而有利于进一步的水解。本发明采用酸性蛋白酶和沙雷肽酶先后酶解的方式,两种酶均处于最佳的反应体系,水解度较单独使用酸性蛋白酶或者沙雷肽酶时,水解度分别提高了32%或51%。与纯酸法和纯碱法相比,本发明方法水解两种蛋白,水解效率高,反应条件温和,产生毒性物质的可能性较少,同时随着酶反应的进行,蛋白质的分子量逐渐变小,并转化为肽或者氨基酸,其物理性状及机能特性都发生明显变化,在营养学上比蛋白质和氨基酸具有更多的优点。附图说明图1:不同酸对水解度的影响;图2:不同酶及其组合对水解度的影响。具体实施方式本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的产品及方法已经通过较佳实施例进行了描述,相关人员明显能在不脱离本
发明内容、精神和范围内对本文所述的产品及方法进行改动或适当变更与组合,来实现和应用本发明技术。为了进一步理解本发明,下面结合实施例对本发明进行详细说明。实施例1一种联合水解菌体蛋白和大豆蛋白的工艺,其包括如下步骤:菌体蛋白的获得方式:利用高速碟片分离机将苏氨酸发酵液中的菌体蛋白分离,回收菌体蛋白,烘干。按照重量比2:1取菌体蛋白和大豆蛋白,然后按照1g:10ml的比例添加浓度为0.6m的柠檬酸水溶液,搅拌均匀,然后置于高速剪切机中以10000rpm的速度剪切90s,静置60min,再以超声波处理60s,超声频率为25khz,再静置2h,然后调整ph为3.0,温度为40℃,再添加酸性蛋白酶,添加量为2000u/g干物质,酶解时间为5h,然后调整ph为7.0,温度为50℃,再添加沙雷肽酶,添加量为1000u/g干物质,酶解时间为5h,最后100℃灭酶5min,得到水解液。实施例2一种联合水解菌体蛋白和大豆蛋白的工艺,其包括如下步骤:按照重量比3:1取菌体蛋白和大豆蛋白,然后按照1g:8ml的比例添加浓度为0.6m的柠檬酸水溶液,搅拌均匀,然后置于高速剪切机中以8000rpm的速度剪切120s,静置90min,再以超声波处理45s,超声频率为25khz,再静置2h,然后调整ph为3.0,温度为40℃,再添加酸性蛋白酶,添加量为2000u/g干物质,酶解时间为6h,然后调整ph为7.0,温度为50℃,再添加沙雷肽酶,添加量为1000u/g干物质,酶解时间为4h,最后100℃灭酶5min,得到水解液。对比例1菌体蛋白水解的水解液的制备方法为:取菌体蛋白,粉碎,按照1g:5ml的比例添加浓度为0.6m的盐酸溶液,混匀,在100℃下处理1h,之后添加as.1398蛋白酶在水解温度为40℃,ph为7.5,加酶量为0.5%的条件下,进行水解12h,最大水解度为50%。利用上述方法来水解大豆蛋白,最终大豆蛋白的水解度仅为20%左右,可见,该方法并不适合水解大豆蛋白。对比例2大豆蛋白水解液的制备方法:将大豆蛋白添加到5倍重量的水中,搅拌均匀,然后以置于高速剪切机中以10000rpm的速度剪切90s,再采用碱性蛋白酶水解6h,水解温度为60℃,ph为8.0,加酶量为8000u/g干物质,最终水解度为25%。利用上述方法来水解菌体蛋白,最终菌体蛋白的水解度仅为35%左右,该方法并不适合水解菌体蛋白。实施例3指标检测方法:凯氏定氮法测定总蛋白;sds-page对蛋白分子量进行区分测定;蛋白水解度测定方法采用茚三酮显色法测定水解度。1、不同浓度的柠檬酸溶液和盐酸溶液对水解度的影响。设置酸的浓度梯度为0,0.2,0.4,0.6,0.8,1.0,单位为mol/l;如图1所示,横向观察,随着酸浓度的增加,水解度也在增加,酸浓度达到0.6ml/l时,水解度接近峰值,继续增加酸的浓度,对水解度并没有明显影响,考虑到酸对氨基酸有一定的破坏,因此,选择较低浓度的酸最为适宜,纵向观察,较低浓度时,盐酸对水解度的影响较大,随着酸浓度的增大,柠檬酸对水解度的影响更大,峰值也比盐酸略高,考虑到柠檬酸为弱酸,对氨基酸的影响相对较小,选择柠檬酸较为适宜。2、不同的酶及其组合对水解度的影响。组1:仅使用酸性蛋白酶;组2:仅使用沙雷肽酶;组3:同时添加两种酶;组4:本发明实施例1。如图2所示,单独使用酸性蛋白酶或者沙雷肽酶时,水解度分别为47%和41%,同时添加两种酶时,水解度并没有明显提高,主要原因是,两种酶的酶解条件并不完全吻合,无法进行兼顾,而本发明采用先后酶解的方式,两种酶均处于最佳的反应体系,水解度较单独使用酸性蛋白酶或者沙雷肽酶时,水解度分别提高了32%或51%。3、本发明水解液的蛋白组分测定,具体结果见表1:表1指标分子量在1000da以下的比例%分子量在1000-10000da之间的比例%分子量大于10000da的比例%实施例181.910.27.9实施例280.611.38.1由表1可以看出,多肽的分子量主要集中在10000以下,特别是分子量1000以下最多,分别为81.9%和80.6%,这部分组分是在1-8个氨基酸组成的小肽段,许多功能性小肽多集中在这部分,可以作为氮源或者活性物质被微生物充分利用,有利于提高菌株活力。4.本发明水解液(实施例1为例)中主要氨基酸的组成。具体见表2表2氨基酸类型百分比%谷氨酸9.3甘氨酸8.5天冬氨酸7.1蛋氨酸6.9苏氨酸5.1赖氨酸5.8亮氨酸9.1半胱氨酸5.0异亮氨酸7.2组氨酸2.8丙氨酸3.1丝氨酸4.9脯氨酸3.7精氨酸5.4酪氨酸4.3缬氨酸4.6苯丙氨酸5.7由表2可知,本发明水解液各类氨基酸组分均衡,适合作为微生物发酵的氮源。实施例3利用水解液制备培养基:蔗糖60g/l,葡萄糖30g/l,水解液200g/l,硫酸铵5g/l,磷酸二氢钾0.5g/l,磷酸氢二钾0.5g/l,七水硫酸镁0.1g/l,七水硫酸亚铁10mg/l,一水硫酸锰10mg/l,vb12mg/l,vh50μg/l。培养基1:水解液采用本发明实施例1制备的水解液;培养基2:水解液原料采用等量的菌体蛋白,其余同实施例1;培养基3:水解液原料采用等量的大豆蛋白,其余同实施例1;培养基4:水解液使用20g/l的酵母粉替代。发酵工艺为:将大肠杆菌工程菌trfc种子液按照1.5%的接种量接入到含有发酵培养基的发酵罐中进行发酵,接种密度od600为0.4,温度36℃,搅拌转速为300rpm,通过通气和搅拌控制溶氧量为20%,以泡敌消泡,发酵时间为36h,停止发酵,收集苏氨酸发酵液;发酵过程中需要流加补料液,具体如下:1)通过流加50%的蔗糖溶液控制含糖量为3%,直至发酵结束;2)通过流加20%的氨水控制ph为7.0,直至发酵结束。不同发酵培养基对苏氨酸产量和糖酸转化率的影响见表3。表3如表3所示,采用菌体蛋白和大豆蛋白联合水解液来作为发酵氮源,苏氨酸产量和糖酸转化率均最高,其不仅仅可以提供氮源,还能够提供大肠杆菌发酵产酸所需要的必需氨基酸,部分氨基酸还可以作为活性物质来激活苏氨酸合成途径的关键酶或者作为中间物质,提高糖酸转化率,从而提高苏氨酸的产量。以上实施例的说明只是用于帮助理解本发明的方法及其核心思想。应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护范围内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1