单细胞的高通量核酸谱分析的制作方法
本发明涉及用于对异质细胞群体中单细胞的核酸组合物进行谱分析的高通量的方法、系统和装置。
背景技术:
细胞异质性及其对生物功能和疾病的影响在人类免疫学、干细胞生物学和癌症研究中变得越来越重要。例如,通过使用逆转录酶聚合酶链反应(rt-pcr)对单个细胞进行转录分析,就有可能鉴定出在大量研究整个群体时无法观察到的罕见细胞或短暂细胞状态(bendall等人,2012;kalisky和blainey等人,2011;kalisky和quake,2011;levsky等人,2003)。然而,获得关于这些细胞的有意义的信息需要能够进行高通量分析的工具。目前用rt-pcr操作、分离和转录地对单细胞进行谱分析的方法比较繁琐,而且产量有限,只能检测数百个单个细胞。
基于液滴的微流体的超高通量能力是单细胞分析应用的理想选择(guo等人,2012;novak等人,2011;vyawahare等人,2010)。这些微流体技术依靠微滴(直径为1到100μm的微小的水性液体球体)将生物组分封装在油基乳液中(the等人,2008)。这些液滴本质上用作非常小的“试管”,从而将数百万个反应分隔开来。这种方法的一个主要优点是使用最少量的试剂,从而大大降低了给定实验的成本。此外,利用微流体技术,可以形成液滴并将其分离、向其注入试剂,并以千赫兹的速率进行分选,从而有可能以前所未有的通量进行数百万个单细胞反应。然而,实现这一方法的潜力的一个障碍是,在微滴中的单细胞的浓度下,细胞裂解物是rt-pcr的有效抑制剂(arezi等人,2010;hedman等人,2013;white等人,2011)。
为避免细胞裂解物对rt-pcr的抑制,以前的基于液滴的方法已使用了其中裂解物的浓度不再具有抑制性的较大的液滴(2nl),或者使用了可以凝固、漂洗并用dna染料染色的琼脂糖液滴(mary等人,2011;zhang等人,2012)。使用大液滴的方法只能分析总共约100个细胞,而琼脂糖方法不能使用taqman探针或细胞染色,从而排除了特定细胞类型与相关转录靶标的相关性。对细胞进行单细胞rt-pcr的另一种策略是将细胞分离到制作成弹性装置的微孔中。这种方法允许稳健和特异的单细胞转录谱分析。然而,由于每个微孔及其控制阀必须制造和单独控制,因此通量也被限于仅总共几百个细胞(kalisky和blainey等人,2011;kalisky和quake,2011;white等人,2013)。对单细胞进行单细胞rt-pcr的另一种策略是在微滴中裂解细胞,然后在rt-pcr之前稀释微滴(eastburn等人,2013)。虽然这种稀释方法是有效的,但它是一个非常繁琐的过程,限制了可加工性。
为了能够对异质群体中的大量细胞进行表达分析,需要新的将基于液滴的微流体技术的通量与微孔反应的特异性相结合的方法、系统和装置。本文提供的本发明的方面解决了这些需求。
技术实现要素:
本发明的一个方面涉及对单细胞的核酸组合物进行谱分析的方法。所述方法包括在液滴中分离单细胞,在所述液滴中裂解所述单细胞以从所述细胞释放模板核酸,在所述液滴中扩增所述模板核酸以产生经过扩增的核酸,以及在所述液滴中检测所述经过扩增的核酸。
本发明的另一个方面涉及聚合酶依赖性逻辑门。所述聚合酶依赖性逻辑门可用于本发明的谱分析方法。
本发明的另一方面涉及用于执行本发明的谱分析方法的微流体系统。
本发明的目的和优点将通过结合附图对本发明的优选实施例做出的以下详细说明而变得更加充分明显。
附图说明
图1示出了本发明的过程的示例性形式的示意图。
图2示出了示例性分支迁移介导的链置换报告子的示意图。半箭头表示所描绘的核酸链的3'端。在图2-4中,用给定数字(例如,“1”)表示的核酸部分与用相同数字表示的核酸部分基本相同,并且与用相同数字和星号(例如,“1*”)表示的核酸部分基本互补。
图3示出了采用是逻辑运算的示例性分支迁移介导的链置换逻辑门。半箭头表示所描绘的核酸链的3'端。
图4示出了采用是逻辑运算的示例性聚合酶依赖性逻辑门的示意图。半箭头表示所描绘的核酸链的3'端。
图5示出了采用或逻辑运算的示例性聚合酶依赖性逻辑门的示意图。半箭头表示所描绘的核酸链的3'端。
图6示出了采用与逻辑运算的示例性聚合酶依赖性逻辑门的示意图。半箭头表示所描绘的核酸链的3'端。
图7a-7d示出了采用与逻辑运算的替代性示例性聚合酶依赖性逻辑门的示意图。图7a示出了所述逻辑门的组成部分。图7b示出了在两个目标输入都存在的情况下逻辑门的运算。图7c和7d示出了在仅存在两个目标输入之一的情况下逻辑门的运算。半箭头表示所描绘的核酸链的3'端。图7a中所示的逻辑门在阈值链不存在的情况下可以构成兼或逻辑运算。
图8示出了采用与非逻辑运算的示例性聚合酶依赖性逻辑门的示意图。半箭头表示所描绘的核酸链的3'端。
图9a-9d示出了采用与非逻辑运算的替代性示例性聚合酶依赖性逻辑门的示意图。半箭头表示所描绘的核酸链的3'端。图9a示出了所述逻辑门的组成部分。图9b示出了在两个目标输入都存在的情况下逻辑门的运算,其中输入2的存在否定由输入1的存在产生的信号。图9c和9d示出了在仅存在两个目标输入之一的情况下逻辑门的运算。半箭头表示所描绘的核酸链的3'端。
图10示出了采用非逻辑运算的示例性聚合酶依赖性逻辑门的示意图。半箭头表示所描绘的核酸链的3'端。
图11示出了使用是逻辑运算的示例性聚合酶依赖性逻辑门的示意图,所述逻辑门使用lamp哑铃状产物的3'端作为输入。半箭头表示所描绘的核酸链的3'端。
图12示出了适于执行本文描述的方法的示例性装置。
图13示出了以本文描述的方法执行的用于分选液滴的示例性装置。
图14a和14b示出了裂解物对催化发夹组装(cha)扩增的影响。图14a示出了在存在裂解物的情况下使用cha的高背景。图14b示出了依赖于浓度的裂解物抑制。在图14a中,误差条表示平均值的+/-1标准差。
图15a和15b示出了ck19+人乳腺癌细胞(sk-br-3)和ck19-白细胞(molt-4)中上皮标记物ck19(krt19)的mrna的rt-lamp扩增。图15a示出了106个细胞/毫升裂解物浓度下的扩增,这一浓度相当于微滴中单细胞的裂解物浓度。图15b示出了高于和低于106个细胞/毫升裂解物浓度的扩增。误差条表示平均值的+/-1标准差。
图16示出了使用采用是逻辑运算、非逻辑运算、或逻辑运算、与逻辑运算或与非逻辑运算的聚合酶依赖性逻辑门的上皮表型标记物krt19和/或间充质表型标记物vim的lamp产物的荧光检测模式。是逻辑门是如图4所示构造的。非逻辑门是如图10所示构造的。或逻辑门是如图7a-7d所示构造的,其中省去了阈值链。与逻辑门是如图7a-7d所示构造的。与非逻辑门是如图9a-9d所示构造的。
图17a和17b示出了使用具有多重引物形式和如图4所示构造的是核酸逻辑门的rt-lamp对krt19rna(图17a)或vimrna(图17b)的荧光检测。误差条表示平均值的+/-1标准差。
图18a和18b示出了使用rt-lamp和或逻辑门(图18a)或与逻辑门(图18b)对krt19和/或vimrna的荧光检测。或门和逻辑门两者都是如图7a-7d所示构造的,除了或逻辑门缺少阈值链。误差条表示平均值的+/-1标准差。
图19a和19b示出了使用rt-lamp和非逻辑门(图19a)或与非逻辑门(图19b)对krt19和/或vimrna的荧光检测。非门是如图10所示构造的,并且与非门是如图9a-9d所示构造的。误差条表示平均值的+/-1标准差。
图20a和20b示出了上皮标记物ck19(krt19)在ck19+人乳腺癌细胞(sk-br-3)(图20a)中的mrna的rt-lamp扩增与ck19-白细胞(molt-4)(图20b)在悬浮于氟化油中的水性液滴中的mrna的rt-lamp扩增,使用dsdna特异性染料来指示扩增。
图21示出了雌激素受体(er)mrna转录物esr1在er+人乳腺癌细胞(mcf7)中的rt-lamp扩增与er-乳腺癌细胞(sk-br-3)在悬浮于氟化油中的水性液滴中的rt-lamp扩增的直方图,使用dsdna特异性染料来指示扩增。在检测之前,收集液滴并分批加热。
图22示出了人白细胞细胞系molt-4中的甘油醛3-磷酸脱氢酶(gapdh)mrna转录物在悬浮于氟化油中水性液滴中的rt-lamp扩增的直方图,使用dsdna依赖性染料来指示扩增。液滴在实施整个工作流程的集成的微流体装置中产生、温育和分析。
图23a和23b示出了使用多重和正交的是逻辑门和报告子复合物的上皮标记物ck19(krt19)和间充质标记物vim(vim)的rt-lamp扩增的直方图,其中krt19扩增将alexafluor647报告子活化,并且vim扩增将hex报告子活化。图23a示出了在60分钟或5分钟温育后人ck19-骨肉瘤细胞系(u-2os)和人ck19+乳腺癌细胞系(sk-br-3)的alexafluor647信号的直方图。图23b示出了在60分钟或5分钟温育后人vim-乳腺癌细胞系(sk-br-3)和人vim+骨肉瘤细胞系(u-2os)的hex信号的直方图。每个是门如图4所示构造,并且每个报告子复合物如图2所示构造。
图24a和24b示出了从基于esr1(er)lamp扩增来区分人er+乳腺癌细胞系mcf7和er-乳腺癌细胞系sk-br-3的液滴分选装置的废物出口(图24a)或分选物出口(图24b)收集的液滴。
图25示出了在来自两个细胞系的总rna样品中基于lamp的snp检测:sk-br-3,仅具有wtactb转录物(seqidno:1);以及molt-4,其在actb转录物(seqidno:2)的960位含有a->csnp。误差条表示平均值的+/-1标准差。
具体实施方式
本发明的一个方面涉及一种对单细胞的核酸组合物进行谱分析的方法。所述方法可以包括在液滴中分离单细胞,在所述液滴中裂解所述单细胞以从所述细胞释放模板核酸,在所述液滴中扩增所述模板核酸以产生经过扩增的核酸,以及在所述液滴中检测所述经过扩增的核酸。
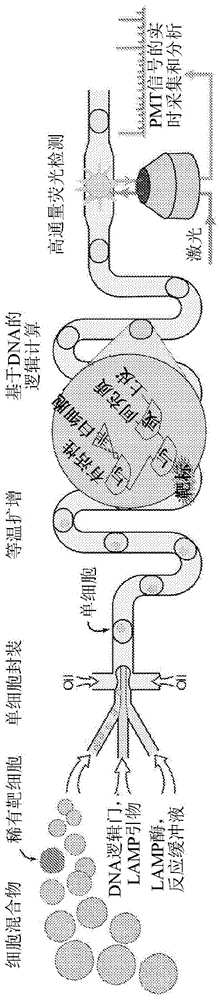
图1示出了这一过程的示例性形式的示意图。这一示例性过程用于针对循环肿瘤细胞(ctc)的存在对有核血细胞进行谱分析。图1中的分离被描述为“单细胞的封装”,裂解被描述为“细胞裂解”,扩增被描述为“扩增”,并且检测被描述为“基于dna的逻辑计算”和“高通量荧光检测”。如图1所示,分离、裂解、扩增和检测都可以以连续、高通量的方式在单一的由通道构成的网络中发生。这与分批进行某些步骤的过程形成对比。所述通道可以是使用任何合适的方法产生的微流体通道。以下实例中提供了一种示例性方法。如本文所用,“通道”是指嵌入固体装置中的通道以及暴露的管道。
所述分离可以包括在悬浮于与水不混溶介质中的水性液滴中分离所述细胞。这可以通过将细胞以连续的水性溶液流的形式通过微流体通道进料通过与水不混溶介质的入口来执行。与水不混溶的介质破坏了连续的水性溶液流,并“夹断(pinchoff)”不同的液滴,使得液滴悬浮在与水不混溶的介质中。细胞可以足够低的浓度存在于连续的水性溶液流中,使得每个形成的水性液滴中分离出一个或更少的细胞。与水不混溶的介质可以包括油。一种示例性的油是氟化油,如用于用于evagreen#1864005的qx200tm液滴产生油(加利福尼亚州赫拉克勒斯的伯乐公司(biorad,hercules,ca))。与水不混溶介质和/或水性相中存在的各种表面活性剂可以帮助稳定与水不混溶介质中的液滴。液滴优选具有约1pl到约100nl的体积,如约10pl到约10nl或约100pl到约1nl的体积。高于和低于这些量的量是可以接受的。
对于下游步骤,如裂解、扩增和检测,优选用一种或多种试剂(如裂解试剂、dna聚合酶、扩增引物、脱氧核苷酸三磷酸、rnase抑制剂、一个或多个核酸逻辑门和报告子)在液滴中分离每个细胞。这可以通过将含有这些试剂的一种或多种溶液与液滴形成处上游的含有细胞的溶液合并来执行。溶液可以在液滴形成之前形成相邻的层流。溶液被与水不混溶的介质共包封以形成液滴。液滴的形成从而用试剂分离出单个细胞。
与液滴中的细胞分离的裂解试剂可以包括洗涤剂。洗涤剂优选地包括非变性洗涤剂。非变性洗涤剂优选地包括非离子洗涤剂。示例性非变性非离子洗涤剂包含tween20(马萨诸塞州伯灵顿的密理博西格玛公司(milliporesigma,burlington,ma))、tritonx-100(密歇根州米德兰的陶氏化学公司(dowchemicalcompany,midland,mi))(4-(1,1,3,3-四甲基丁基)苯基-聚乙二醇、叔-辛基苯氧基聚乙氧基乙醇、聚乙二醇叔辛基苯基醚)、np-40(壬基苯氧基聚乙氧基乙醇)、nonidetp-40(荷兰海牙的壳牌化学公司(shellchemicalco.,thehague,thenetherlands))(辛基苯氧基聚乙氧基乙醇)等。洗涤剂优选地以约0.5%v/v到约5%v/v的浓度(如约1%v/v到约5%v/v的浓度或约2.5%v/v的浓度)存在于液滴中。裂解试剂可替代地或另外地包括裂解酶。示例性裂解酶包含溶菌酶和噬菌体裂解酶。溶菌酶的合适的溶菌酶浓度包含介于约1ku/ml于60ku/ml之间的浓度,如约30ku/ml。高于和低于这些量的浓度也是可以接受的。其它特定裂解酶的最佳浓度可以很容易地确定。洗涤剂应该足以裂解大多数细胞,尤其是加热时。对于具有细胞壁的细胞,如某些类型的细菌,除了裂解酶之外,裂解试剂优选包含洗涤剂。在本发明的一些形式中,不存在裂解试剂,并且仅通过加热就发生细胞裂解。
与液滴中的细胞分离的聚合酶可以是任何适于靶核酸下游扩增的聚合酶。为了对dna靶核酸进行扩增,聚合酶优选地是dna依赖性dna聚合酶。dna依赖性dna聚合酶是催化dna模板中dna复制的酶。示例性的dna依赖性dna聚合酶是taq聚合酶。为了对rna靶核酸进行扩增,聚合酶优选地是dna依赖性和rna依赖性dna聚合酶或dna依赖性dna聚合酶与单独的rna依赖性dna聚合酶的组合。rna依赖性dna聚合酶是催化从rna模板产生dna的酶。rna依赖性dna聚合酶有时也称为“逆转录酶”。dna依赖性和rna依赖性dna聚合酶是同时具有dna依赖性dna聚合酶活性和rna依赖性dna聚合酶(逆转录酶)活性的酶。本文所用的“扩增”与本领域通常使用意思的相同,除了在本文中还应理解为涵盖将rna靶核酸逆转录成dna。
对于某些类型的扩增(如等温扩增),聚合酶另外具有链置换活性,并且缺乏5'→3'核酸外切酶活性。聚合酶也可以含有或缺乏3'→5'核酸外切酶活性。聚合酶优选是热稳定的。一种示例性的聚合酶是bst2.0dna聚合酶(马萨诸塞州伊普斯维奇新英格兰生物实验室公司(newenglandbiolabs,inc.,ipswich,ma))。这种酶具有rna依赖性dna聚合酶(逆转录酶)活性,dna依赖性dna聚合酶活性和链置换活性,并且缺乏5'→3'核酸外切酶活性。具有这些特征的其它聚合酶是本领域众所周知的。
用液滴中的细胞分离的扩增引物包含任何适于核酸模板扩增的引物。许多扩增方法及其合适引物的设计在本领域中是已知的。在扩增中,dntp充当经过扩增的核酸的结构单元(buildingblock)。
与液滴中的细胞分离的核酸逻辑门可以包括任何一个或多个适于对核酸进行谱分析的核酸逻辑门。示例性核酸逻辑门在本领域中是已知的,并且在本文别处进行了描述。
用液滴中的细胞分离的报告子可以包括任何适用于总体地指示核酸存在或特异性地指示特定核酸存在的试剂。示例性报告子在本领域中是已知的,并且在本文别处进行了描述。
裂解步骤可以包括在液滴中存在或不存在裂解试剂的情况下加热细胞。这一步骤可以通过加热含有细胞或细胞和裂解试剂的液滴来进行。加热液滴可以通过使含有细胞或细胞和裂解试剂的液滴流过经加热区来进行。经加热区可以包括整个包含通道的装置或其子部分。在一些形式中,不需要加热步骤,因为将裂解试剂与细胞混合本身就足以裂解细胞。
所述扩增可以包括将dna模板扩增或将模板rna逆转录成dna,并扩增逆转录的dna。所用的扩增类型取决于用于谱分析的核酸的类型。例如,dna模板通常只需要扩增dna本身。相反,rna模板通常需要反转录和dna扩增。
扩增方法可以包括任何适于扩增核酸的方法。示例性方法包括pcr方法和等温扩增方法。逆转录可以与pcr或等温扩增方法相结合。示例性等温扩增方法包含无酶等温扩增方法和酶依赖等温扩增方法。示例性无酶等温扩增方法包含杂交链式反应(hcr)、催化发夹组装(cha)等。示例性酶依赖性等温扩增方法包含环介导等温扩增(lamp)、滚环扩增(rca)、多重置换扩增(mda)、重组酶聚合酶扩增(rpa)、基于核酸序列的扩增(nasba)等。
扩增过程中裂解试剂和/或未稀释的细胞裂解物的存在会抑制某些扩增方法,如pcr方法和无酶等温扩增方法(如hcr和cha)。如以下实例所示,在存在裂解试剂和未稀释的细胞裂解物的情况下,lamp能够产生强扩增信号。因此,在存在裂解试剂和/或未稀释的细胞裂解物的情况下进行的优选扩增方法包含酶介导的等温扩增方法,如lamp。
核酸扩增后,可以通过多种方法检测经过扩增的核酸。优选的方法包含荧光法。所述方法可以包含非特异性核酸检测和特异性核酸检测。
非特异性核酸检测使用非特异性核酸报告子(如非特异性荧光dna报告子)检测核酸,而不管特定序列如何。示例性的非特异性核酸报告子包含溴化乙锭、碘化丙锭、结晶紫、dutp缀合的探针、dapi(4',6-二氨基-2-苯基吲哚)、7-aad(7-氨基霉素d)、hoechst33258、hoechst33342、hoechst34580、picogreen(俄勒冈州尤金的分子探针公司(molecularprobes,inc.,eugene,or))、helixyte(加利福尼亚州桑尼维尔的aatbioquest公司(aatbioquest,sunnyvale,ca))、yoyo-1、diyo-1、toto-1、dito-1以及sybr染料(俄勒冈州尤金的分子探针公司)(如sybrgreeni、sybrgreenii、sybrgold等)。这些非特异性核酸报告子中有许多是dna嵌入剂。
特异性核酸检测用序列特异性核酸报告子(如序列特异性荧光核酸报告子)检测具有特定序列的核酸种类。许多序列特异性核酸荧光报告子在本领域中是已知的。示例性序列特异性荧光核酸报告子包含在结合到特定序列时释放淬灭剂的淬灭报告子。序列特异性荧光核酸报告子的一个实例示于图2中。这一报告子被配置成通过分支迁移介导的链置换进行操作。报告子包括退火重结合于基本互补的报告子链20(红色)的淬灭剂链22(黑色)。淬灭剂链22包括淬灭剂23(q)。报告子链20包括荧光团21(f)。淬灭剂链22退火重结合于报告子链20将淬灭剂23放置在荧光团21附近,从而淬灭荧光团21发出的任何荧光。报告子链20仅退火重结合于淬灭剂链22的第一部分(1*),从而留下淬灭剂链22的第二部分(2*)(称为黏性末端(toehold))暴露。淬灭剂链22被设计成与输入链24(蓝色)基本互补。输入链24是要检测的核酸。输入链24包括与黏性末端(1*)基本互补的部分(2)。当存在时,输入链24通过基本互补的部分与黏性末端结合,并在退火重结合于淬灭剂链22的剩余部分时从淬灭剂链22置换报告子链20。报告子链20的置换将荧光团21从淬灭剂23附近移除,从而产生活化的报告子(在图2中显示为“输出”)。活化的报告子可以在光激发下发出荧光。在另一种形式中,报告子链基本上与输入链互补,并包括一个黏性末端,这样输入链与报告子链上的黏性末端的结合并且随后的分支迁移将淬灭剂链从报告子链中置换出来。所得的输入链/报告子链双链体能够发荧光。
检测可以包括通过使用分子逻辑回路执行分子逻辑计算来对经过扩增的核酸的组合物进行谱分析。分子逻辑回路输入一种或多种特定种类的核酸,执行逻辑计算,并输出一种或多种不同种类的核酸。分子逻辑回路包括一个或多个单独使用或以多种组合使用的核酸逻辑门。如本文所用,“分子逻辑计算”或“分子计算”是指响应于一个或多个输入核酸(例如,输入链)从一个或多个核酸逻辑门产生一个或多个输出核酸(例如,输出链)。本文中的“产生”是指从核酸逻辑门输出核酸的置换,所述置换使得输出核酸可以被检测或用作一个或多个下游核酸逻辑门的输入,如下面进一步详细描述的。分子逻辑回路可以是含有一个或多个dna逻辑门的基于dna的分子逻辑回路、含有一个或多个逻辑门的基于rna的分子逻辑回路或其组合。
每个逻辑门被配置成执行特定的逻辑运算。示例性逻辑运算包含是、非、与、或、与非、非与、非或、异或、同或和蕴涵。
是门和非门各自被配置用于对单个输入进行谱分析。
当且仅当输入丰度较高时,是门产生输出(1)。这意味着如果输入丰度不高,门不能产生输出(0)。是门也可以称为“转导子”。下面的真值表中示出了由是门对输入a执行的逻辑运算:
非门是一种在其输出产生输入的反相形式的回路。它也被称为反相器。如果输入变量是a,则反相输出为非a。这也显示为a',或者顶部有横杠的a。下面的真值表中示出了由非门对输入a执行的逻辑运算:
与、或、与非、非与、非或、异或和同或运算各自被配置用于对多个输入进行谱分析。
与门被配置成仅当其所有输入都为高时产生高输出(1),否则不能产生高输出(0)。使用点(.)来表示与运算:a.b。有时将点省去:ab。下面的真值表中示出了由与门对输入a和b执行的逻辑运算:
如果一个或多个输入为高,则或门(也称为兼或门)被配置成产生高输出(1)。使用加号(+)来表示或运算。下面的真值表中示出了由或门对输入a和b执行的逻辑运算:
非与(nand)门等于与门后接非门。如果任一输入为低(0),则所有nand门的输出为高(1)。下面的真值表中示出了由nand门对输入a和b执行的逻辑运算:
与非门仅检测两个可能输入中的一个的存在。如果两个可能的输入中有且只有一个为高(1),则与非门的输出为高(1),并且如果获得任何其它条件,则所述输出为低(0)。否定输入b的与非门的真值表(a与非b)如下:
非或(nor)门等于或门后接非门。如果任一输入为高(1),则所有nor门的输出为低(0)。下面的真值表中示出了由nor门对输入a和b执行的逻辑运算:
异或(exor)门被配置成如果其两个输入中的一个(但不是两个)为高(1),则产生高输出。使用带圆圈的加号来表示exor运算。下面的真值表中示出了由异或门对输入a和b执行的逻辑运算:
同或(exnor)门的作用与exor门相反。同或门被配置成如果两个输入都为高(1),或者两个输入都为低(0),则产生高输出。如果它的两个输入中有一个(但不是两个)为高,则产生低输出为。下面的真值表中示出了由同或门对输入a和b执行的逻辑运算:
蕴涵门通过传递“如果-则”逻辑,采用conditional逻辑运算。
被配置成执行逻辑运算的核酸逻辑门在本领域中是已知的。参见例如baccouche等人,2014;chen等人,2015;deng等人,2014;li等人,2011;li等人,2013;li等人,2016;massey等人,2017;okamoto等人,2004;qian、winfree,2011;qian、winfree等人,2011;ravan等人,2017;thubagere等人,2017;wei等人,2016;xu等人,2014;yang等人,2013;yang等人,2016;yang等人,2014;yao等人,2015;zhang等人,2010;zhu等人,2013;zou等人,2017;us2007/0072215和wo2017/141068。
示例性逻辑门通过分支迁移介导的链置换进行操作,也称为黏性末端介导的分支迁移或随机游走分支迁移。图3示出了采用是逻辑运算的示例性分支迁移介导的链置换逻辑门的示意图。逻辑门包括退火重结合于基本互补的门链32(蓝色链)的输出链33(棕色链)。基本上与门链32互补的输入链31(绿色)与门链32的暴露的黏性末端(3*)部分结合,并且随后在进一步退火重结合于门链32时将输出链33置换出来。分支迁移介导的链置换机制可以被配置成生成采用其它运算的逻辑门,如非、与、或、非与、非或、异或、同或等运算。参见例如上面提供的参考资料。
其它示例性逻辑门包含聚合酶依赖性逻辑门。聚合酶依赖性逻辑门需要输入链沿门链的聚合酶介导的延伸来将输出链从门链置换出来。这些逻辑门被设计成在具有链置换活性但缺乏5'→3'核酸外切酶活性的聚合酶的情况下进行操作。图4中示出了采用是逻辑运算的示例性聚合酶依赖性逻辑门的示意图。聚合酶依赖性逻辑门包括退火重结合于门链42(蓝色)的输出链43(棕色)。输出链43退火重结合于门链42的输出链退火重结合部分(2*)。输出链43不退火重结合于门链42的输出链非退火重结合部分(1*),从而在门链42上留下暴露部分。输出链退火重结合部分比输出链非退火重结合部分更靠近门链42(棕色)的5'端。输入链41(绿色)退火重结合于门链42的输入链退火重结合部分(1*)。在图4的实例中,门链42的输入链退火重结合部分与输出链非退火重结合部分相同,但是不一定必须如此。输入链41不退火重结合于门链42的输入链非退火重结合部分(2*)。在图4的实例中,门链42的输入链非退火重结合部分与输出链退火重结合部分相同,但是不一定必须如此。仅仅将输入链41结合到门链42的输入链退火重结合部分本身不足以将输出链43从门链42置换出来。为了将输出链43从门链42置换出来,输入链41沿门链42延伸必须发生。然后,可以用报告子门直接检测输出链43,或者输出链可以充当一个或多个另外的逻辑门的输入。
门链的输入链非退火重结合部分不一定必须与输出链退火重结合部分相同。然而,为了在输入链的3'端附近有一个暴露部分以促进输入链的结合,输入链退火重结合部分和输出链非退火重结合部分至少部分地重叠。在一些形式中,输入链退火重结合部分是输出链非退火重结合部分的子部分。为了使输入链的结合不足以将输出链置换出来(即,为了使输入链沿着门链延伸对于输出链置换是必要的),输出链退火重结合部分和输入链非退火重结合部分至少部分地重叠。在一些形式中,输出链退火重结合部分和输入链退火重结合部分至少部分地重叠。然而,过多的重叠将仅仅通过输入链结合到门链的暴露部分而诱导输出链的置换,而不需要输入链的聚合酶介导的延伸。因此,输出链退火重结合部分和输入链退火重结合部分之间的任何重叠量都小于足以在没有聚合酶介导的延伸的情况下使输入链将输出链置换出来的量。在本发明的优选形式中,输出链退火重结合部分和输入链退火重结合部分不重叠。这被认为允许输入链和门链之间更快的结合动力学。
在一些形式中,门链的输入链退火重结合部分可以充当扩增反应的引物,其中输入链退火重结合部分与模板核酸上的序列结合。在一些形式中,扩增反应是lamp。门链可以充当lamp反应中的正向内部引物(fip)或反向内部引物(bip)。前向外引物(fp)和/或后向外引物(bp)的扩增分别可以置换最初与门链结合的输出链。
聚合酶依赖性逻辑门可以被配置成执行本文描述的任何逻辑运算,包含是、非、与、或、与非、非与、非或、异或、同或和蕴涵运算等。
图5中示出了一个示例性的聚合酶依赖性或逻辑门。门链53(绿色)的输入链退火重结合部分具有第一输入链退火重结合部分(01*)和第二输入链退火重结合部分(02*)。第一输入链退火重结合部分基本上与第一输入链51(红色)互补并退火重结合于所述第一输入链。第二输入链退火重结合部分(02*)基本上与第二输入链52(青色)互补并退火重结合于所述第二输入链。第一输入链51和第二输入链52之一或两者的退火重结合诱导其聚合酶介导的延伸,并将输出链54(蓝色)从门链置换出来。
图6示出了一个示例性的聚合酶依赖性与逻辑门。这一逻辑门具有没有预退火重结合输出链的门链63(绿色),而是采用原位产生的输出链64(红色/蓝色)。与或逻辑门一样,门链63的输入链退火重结合部分(02*01*)具有第一输入链退火重结合部分(01*)和第二输入链退火重结合部分(02*)。第一输入链退火重结合部分(01*)基本上与第一输入链61(红色)互补并退火重结合于所述第一输入链。第二输入链退火重结合部分(02*)基本上与第二输入链62(青色)互补并退火重结合于所述第二输入链。输出链64通过第一输入链61与第一输入链退火重结合部分的结合以及第一输入链61沿着门链的聚合酶介导的延伸而原位产生。然后,在第二输入链62与第二输入链退火重结合部分结合并且第二输入链延伸时,产生的输出链64被置换,以产生经过延伸的输入链65(青色/红色/蓝色)。
图7a-7d示出了替代性示例性的聚合酶依赖性与逻辑门。这一逻辑门包含至少两条不同的门链73、74(绿色、梅红)、输出链75(蓝色)和阈值链76。关于核酸使用的“不同”是指核酸具有不同的核苷酸序列。输出链75最初与门链73、74结合,但是基本上与阈值链76互补并且能够退火重结合于所述阈值链。至少两条不同的门链73、74中的每一条的阈值链76以及与其结合的输出链75以基本上等摩尔的浓度存在。本文中的“基本上等摩尔”是指一条链相对于其它相关链的等摩尔量或摩尔过量小于约40%、小于约35%、小于约30%、小于约25%、小于约20%、小于约15%、小于约10%、小于约5%、小于约4%、小于约3%、小于约2%或小于约1%。阈值链相对于输出链75与之结合的至少两条不同的门链73、74中的每一条稍微摩尔过量是可以接受的。稍微过量可以是小于约40%、小于约35%、小于约30%、小于约25%、小于约20%、小于约15%、小于约10%、小于约5%、小于约4%、小于约3%、小于约2%或小于约1%的摩尔过量。在本实例中,两条门链73、74中的每一条的输出链75是相同的。然而,它们不需要相同,只要它们各自具有能够与阈值链76(和任何下游逻辑门或报告子门)结合的部分,并且因此基本相同。至少两条不同的门链73、74中的第一条73(绿色)的输入链退火重结合部分退火重结合于至少两条不同的输入链71、72的第一条71(红色/输入1),但不退火重结合于至少两条不同的输入链71、72的第二条72(青色/输入2)。至少两条不同的门链73、74中的第二条74(梅红)的输入链退火重结合部分退火重结合于至少两条不同的输入链71、72的第二条72(青色/输入2),但不退火重结合于至少两条不同的输入链71、72的第一条71(红色/输入1)。如图7c和图7d所示,两条输入链71、72中仅一条的存在置换输出链75(1x)的小于或等于阈值链76的量的量。因此,阈值链76与所有经置换的输出链75结合,并通过下游逻辑门将其与检测或进一步的信号传递隔离。然而,如图7b所示,两条输入链71、72的存在置换输出链75(2x)的大于阈值链76的量的量。因此,阈值链76能够仅与经置换的输出链75的子集结合,从而留下第二子集自由用于检测或通过下游逻辑门进一步进行信号传递。如果阈值链76被省去,那么转导子73、75或74、75的活化足以产生自由输出链75(蓝色),并且这形成替代性的、示例性的或门。
图8示出了一个示例性的聚合酶依赖性与非逻辑门。这一逻辑门包括至少两条不同的门链83、84(绿色、梅红)。门链83、84各自与不同的输出链85、86(分别是蓝色、红色)结合。输出链85、86基本上彼此互补,并且一旦从门链83、84置换出来,能够退火重结合于彼此。至少两条不同的门链83、84中的第一条83(绿色)的输入链退火重结合部分退火重结合于至少两条不同的输入链81、82的第一条81(红色/输入1),但不退火重结合于至少两条不同的输入链81、82的第二条82(青色/输入2)。至少两条不同的门链83、84中的第二条84(梅红/输入2)的输入链退火重结合部分退火重结合于至少两条不同的输入链81、82的第二条82(梅红/输入2),但不退火重结合于至少两条不同的输入链81、82的第一条81(青色/输入2)。当两条不同的输入链81、82中只有一条81(青色/输入2或梅红/输入2)存在时,输出链85或86(分别为蓝色或红色)被置换,并且可以被检测到或用于下游逻辑门中的信号传递。当输入链81、82(青色/输入2和梅红/输入2)都存在时,经置换的输出链85、86在从门链83、84释放时退火重结合于彼此,并且将彼此与下游逻辑门中的检测或信号传递隔离。
图9a-9d示出了替代性示例性的聚合酶依赖性与非逻辑门。如图9a所示,这一逻辑门包括门链116(绿色),所述门链包括能够与第一输入链114(红色/输入1)结合的位点(输入1*)。门链116最初与输出链115(蓝色)结合。输出链115(蓝色)基本上与报告子链118(黑色)互补,并且另外包含能够与第二输入链119(梅红/输入2)结合的位点(输入2*)。门链116的输入链退火重结合部分退火重结合于第一输入链114(红色/输入1),但不退火重结合于第二输入链119(梅红/输入2)。如图9d所示,当仅存在第二输入链119(梅红/输入2)时,不发生反应。然而,当仅存在第一输入链114(红色/输入1)时,如图9c所示,输出链115(蓝色)在第一输入链114(红色/输入1)聚合时被置换,并且可以被检测或用于下游逻辑门中的信号传递。在这一实例中,输出链115与报告子链118(黑色)的黏性末端区域结合,从而置换淬灭剂链117(黑色),并产生荧光信号(根据所需的形式,输出链115可以替代性地与淬灭剂链117(黑色)结合,或者与聚合酶依赖性报告子门的报告子链或淬灭剂链结合)。当第二输入链119(梅红/输入2)也存在时,如图9b所示,输出链115退火重结合于第二输入链119(梅红/输入2),并且报告子链118(黑色)在第二输入链119(梅红/输入2)聚合时从输出链115置换出来。经置换的报告子链118然后与被置换的淬灭剂链117结合,从而去除荧光信号。
图10示出了另一个示例性的聚合酶依赖性非逻辑门。这一逻辑门包括活化的输出复合物,所述复合物包括充当输出链的报告子链118(黑色)和门链115(蓝色)。门链115(蓝色)在输入*部分与输入链119(梅红)基本互补。在其初始状态,报告子链118不与淬灭部分结合,并且因此产生荧光信号。当输入链119结合输出链115时,它在聚合时置换报告子链118。经过置换的报告子链118然后可以与淬灭剂链117(黑色)(其可以被称为“非链”)结合,以淬灭荧光信号。在这一实例中,链118和117包括荧光团-淬灭剂报告子复合物,但是原则上这一非运算可以作用于任何可逆逻辑门或输出链,其中链118和117可以没有荧光团或淬灭剂,链117可以构成来自另一个门的输出链或与链118基本互补的任何其它链,并且链118与链117的结合将有效地将链118隔离并阻止下游信号传递。类似于上述实施例,输出链115可以替代性地与淬灭剂链117(黑色)或聚合酶依赖性报告子门的报告子链或淬灭剂链结合,从而使报告子门的最初未结合成员成为非链。
聚合酶依赖性逻辑门中的门链的示例性长度包含约4、约10、约15、约20、约25、约30、约35、约40、约45、约50或更多个核苷酸碱基到约10、约15、约20、约25、约30、约35、约40、约45、约50、约60、约70、约80、约90、约100、约150、约200、约250、约300或更多个核苷酸碱基的长度。
聚合酶依赖性逻辑门中的门链的输出链退火重结合部分的示例性长度包含约2、约4、约10、约15、约20、约25、约30、约35、约40、约45、约50或更多个核苷酸碱基到约5、约10、约15、约20、约25、约30、约35、约40、约45、约50、约60、约70、约80、约90、约100、约150、约200、约250、约300或更多个核苷酸碱基的长度。
聚合酶依赖性逻辑门中的门链的输出链非退火重结合部分的示例性长度包含约1、约2、约4、约10、约15、约20、约25、约30、约35、约40、约45、约50或更多个核苷酸碱基到约5、约10、约15、约20、约25、约30、约35、约40、约45、约50、约60、约70、约80、约90、约100、约150、约200、约250、约300或更多个核苷酸碱基的长度。
聚合酶依赖性逻辑门中的门链的输入链退火重结合部分的示例性长度包含约1、约2、约4、约10、约15、约20、约25、约30、约35、约40、约45、约50或更多个核苷酸碱基到约5、约10、约15、约20、约25、约30、约35、约40、约45、约50、约60、约70、约80、约90、约100、约150、约200、约250、约300或更多个核苷酸碱基的长度。
聚合酶依赖性逻辑门中的输出链的示例性长度包含约2、约4、约10、约15、约20、约25、约30、约35、约40、约45、约50或更多个核苷酸碱基到约5、约10、约15、约20、约25、约30、约35、约40、约45、约50、约60、约70、约80、约90、约100、约150、约200、约250、约300或更多个核苷酸碱基的长度。
任何聚合酶依赖性逻辑门中的输入链可以包括一种经过扩增的核酸,或者可以包括来自回路中上游逻辑门的输出链。例如,当使用lamp时,输入链可以包括lamp扩增产物,如lamp哑铃状产物的一部分。例如,lamp哑铃状产物的3'部分可以与门链的输入链退火重结合部分结合。这种机构的示意图示出于图11中,其中lamp哑铃状产物91充当输入链。lamp哑铃状产物91的3'部分与门链92结合并沿着所述门链延伸,以产生经过延伸的输入链93,从而将输出链94从门链92置换出来。
任何聚合酶依赖性逻辑门中的输出链可以包括下游逻辑门的输入链或报告子门的输入链。
被配置成检测输出链的报告子门可以包括如图2所示的分支迁移介导的链置换报告子或聚合酶依赖性报告子门。通过在如图4所示的聚合酶依赖性逻辑门的门链42(如在5'端)上放置荧光团和在输出链43(如在3'端)上放置淬灭剂,可以产生聚合酶依赖性报告子门,从而产生报告子链和淬灭剂链。替代性地,通过在如图4所示的聚合酶依赖性逻辑门的输出链43(如在5'端)上放置荧光团和在门链42(如在3'端)上放置淬灭剂,可以产生聚合酶依赖性报告子门,从而产生报告子链和淬灭剂链。在任一种情况下,输入链的结合和聚合酶介导的延伸将淬灭剂链从报告子链中置换出来,并允许从荧光团检测到荧光。
如本文所用,“相同”是指相同的核酸序列。“基本上相同”是指在适于酶依赖性等温扩增的条件下(如环介导等温扩增(lamp))相同或足够相同以与相同的第三核酸序列结合的核酸序列。因此,基本相同涵盖相同,并且在此描述为基本相同的任何实施例因此可以相同。“互补”是指具有完美碱基配对的核酸序列。“基本上互补”是指具有完美碱基配对(互补性)或足以在适合于酶依赖性等温扩增(如lamp)的条件下彼此结合的碱基配对的核酸序列。因此,基本互补涵盖互补,并且在本文中描述为基本互补的任何实施例因此可以互补(完美碱基配对)。在本文所描述的任何实施例中,相同、基本相同、互补或基本相同可在2-200到碱基或以上的长度上发生,如至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个、至少11个、至少12个、至少13个、至少14个、至少15个、至少16个、至少17个、至少18个、至少19个、至少20个、至少21个、至少22个、至少23个、至少24个、至少25个、至少26个、至少27个、至少28个、至少29个、至少30个、至少31个、至少32个、至少33个、至少34个、至少35个、至少36个、至少37个、至少38个、至少39个、至少40个、至少41个、至少42个、至少43个、至少44个、至少45个、至少46个、至少47个、至少48个、至少49个、至少50个、至少60个、至少70个、至少80个、至少90个、至少100个、至少110个、至少120个、至少130个、至少140个、至少150个、至少160个、至少170个、至少180个、或至少190到至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个、至少11个、至少12个、至少13个、至少14个、至少15个、至少16个、至少17个、至少18个、至少19个、至少20个、至少21个、至少22个、至少23个、至少24个、至少25个、至少26个、至少27个、至少28个、至少29个、至少30个、至少31个、至少32个、至少33个、至少34个、至少35个、至少36个、至少37个、至少38个、至少39个、至少40个、至少41个、至少42个、至少43个、至少44个、至少45个、至少46个、至少47个、至少48个、至少49个、至少50个、至少60个、至少70个、至少80个、至少90个、至少100个、至少110个、至少120个、至少130个、至少140个、至少150个、至少160个、至少170个、至少180个、至少190个、至少200或更多碱基。
在本文所述的方法中,分离可以在裂解之前发生,裂解可以在扩增之前发生,和/或扩增可以在检测之前发生。在优选的形式中,在裂解、扩增和检测的整个过程中及其之间,液滴保持基本恒定的体积。在优选的形式中,裂解、扩增和检测都在于分离后不稀释液滴、不向液滴添加另外的试剂和/或不从液滴中除去试剂或液体的情况下发生。
在一些形式中,裂解、扩增和/或分子逻辑计算是在基本相同的温度下进行的。“基本上相同的温度”指的是跨越约50℃、约45℃、约40℃、约35℃、约30℃、约25℃、约20℃、约20℃、约15℃、约10℃、约5℃或更低的温度范围。
在一些形式中,裂解、扩增和/或分子逻辑计算是在基本恒定的温度下进行的。“基本恒定的温度”是指温度随时间推移保持在约50℃、约45℃、约40℃、约35℃、约30℃、约25℃、约20℃、约20℃、约15℃、约10℃、约5℃或更低的范围内。
在一些形式中,在裂解、扩增和/或进行分子逻辑计算的整个过程中及其之间保持基本恒定的温度。
在一些形式中,裂解、扩增和分子逻辑计算在约45℃、约50℃、约55℃、或约60℃至约70℃、约75℃、约80℃、约85℃或约90℃的温度下进行。
本文所述的方法可用于使用细胞的rna或dna作为核酸模板来对单细胞的核酸组合物的多个方面进行谱分析。例如,这些方法可用于用于表征细胞的mrna或mirna的表达模式的表达谱分析。某些细胞类型,如循环肿瘤细胞(ctc)或具有特定谱系的细胞,具有可区分的表达模式。参见例如sieuwerts等人,2011。本发明的方法可以用于区分ctc和非ctc,或用于一个谱系的细胞和另一个谱系的细胞。本发明的方法也可用于检测细胞中的某些遗传突变,如单核苷酸多态性(snp)或其它类型的突变。关于用于检测snp的合适的lamp引物的设计,参见例如,yongkiettrakul等人,2016;以及badolo等人,2012。
图12示出了适于执行本文描述的方法的示例性装置100。装置100包括由微流体通道101和管道107构成的单个连续网络,以及多个另外的元件。另外的元件包含细胞溶液入口102、试剂溶液入口103、油入口104、液滴形成器105、油提取器106、包括穿过加热元件109的管道107的温育段、油注射器110、激光器111和荧光检测器112。细胞溶液和试剂溶液分别通过细胞溶液入口102和试剂溶液入口103引入通道。细胞溶液可以包含任何期望进行谱分析的细胞的集合。试剂溶液可包含本文所述的任何试剂,如裂解试剂、dna聚合酶、扩增引物、脱氧核苷酸三磷酸、rnase抑制剂、一个或多个核酸逻辑门、一个或多个报告子或任何其它试剂。所述装置可以任选地包含一个以上(如两个、三个或更多个)的用于分别引入试剂的试剂溶液入口103(参见实例)。细胞溶液和一种或多种试剂溶液在液滴形成器105的上游合并以形成细胞和试剂溶液。细胞和试剂溶液可以包括每个细胞溶液和一种或多种试剂溶液的层流。细胞试剂溶液流向液滴形成器105。液滴形成器105包含连接到油入口104的将油垂直注入水性流中的油通道。注入的油将细胞试剂溶液分离成悬浮在油中的水性液滴。然后,液滴通过流经油提取器106而在油中被压缩,所述油提取器利用吸力去除液滴周围的一些油。被压缩的液滴流入温育段。管道段107的长度决定了每个液滴在温育段中花费的时间,以允许受控的细胞裂解、核酸模板扩增和核酸逻辑门的逻辑计算。通过加热元件109加热管道107促进细胞裂解和扩增。加热元件109可以加热整个装置100或其任何子部分,如温育段。然后,借助于将油注入通道的油注射器110,液滴在通道内松弛化。这允许在不受其它液滴干扰的情况下对每个单独的液滴进行分析,并为数据采集软件提供收集和处理收集的数据的时间。然后用激光器111照射在逻辑计算期间产生的活化的报告子,并用荧光检测器112检测荧光。根据发出的荧光,液滴分选可以通过分选装置进行。本发明的装置可以包含本文描述的示例性元件中的一些或全部,并且可以包含其它元件。
在一些形式中,装置100可被配置成在形成后的任何点分裂液滴以增加通量。
图13示出了能够分选液滴的示例性装置113。这一装置包括适于处理液滴的由微流体通道129构成的连续网络,以及一组能够导电的液体电极123、124。液滴首先流入注射口120,并通过经由另外的口121重新注入油而被隔开。在通过一个或多个激光器130和一个或多个检测器131测量液滴的荧光之后,液滴通过分选接合部位122。基于液滴的荧光,通过经由液体电极123和124施加电场,液滴被引导到分选物出口126或废物出口127。这种场的间歇施加在液滴上产生介电力,从而使液滴偏转到分选物出口126。通过参比电极123和分选电极124之间施加的dc电流的幅度和频率对分选进行微调。通过入口125施加的偏移油(biasoil)也对分选进行微调。减压分流器128对分选出口126和废物出口127之间的油压进行平衡,从而防止了会使分选中断的压力波动。
本发明的系统包含本文描述的用于执行本文所述的方法步骤的元件的任何组合。
无论是否明确描述,本文描述的要素和方法步骤可以以任何组合使用。
除非由引用组合的上下文另有说明或明确暗示相反,否则如本文所使用的方法步骤的所有组合可以以任何顺序执行。
如本文所用,除非内容另外明确指出,否则单数形式“一个/种(a/an)”、和“所述”包含复数个指示物。
如本文所使用的数字范围旨在包含含在所述范围内的无论是否具体公开的每个数字和数字子集。进一步地,这些数字范围应被解释为支持涉及所述范围内的任何数字或数字子集的权利要求。例如,应将从1到10的公开内容解释为支持从2到8、从3到7、从5到6、从1到9、从3.6到4.6、从3.5到9.9等的范围。
本文引用的所有专利、专利出版物和同行评审出版物(即“参考文献”)以相同的程度通过引用明确并入本文,其程度如同具体且独立地指示每个独立的参考值通过引用并入。在本公开与并入的参考文献之间存在冲突的情况下,应以本公开为准。
应当理解,本发明不限于本文展示和描述的部件的特定构型和布置,而是包括落入权利要求范围内的其如此修改的形式。
实例
背景
以下实例显示了本发明的用于对大量造血细胞中每个单独细胞的核酸组合物进行谱分析以检测所述造血细胞中的循环肿瘤细胞(ctc)的方面。
在癌症发展过程中,细胞从原发肿瘤中分离出来并扩散到整个血流中。这些ctc充当实时监测致癌作用的有价值的生物标记物,并且在本文中描述的对其进行检测的方法提供了癌症检测和治疗中的关键工具。
检测ctc仍然具有技术挑战性,因为其在正常造血细胞中的丰度极低,并且具有高度异质性的表型。本发明提供了一种提供以高灵敏度和特异性检测ctc的能力的用于单细胞分析的高通量平台。
ctc分析平台结合了分子计算的特异性和基于液滴的微流体的巨大通量。单细胞被封装在含有基于dna的逻辑回路的微滴中,所述逻辑回路输入细胞转录物,执行逻辑计算,并基于细胞的表型状态输出荧光信号(图1)。在一个每小时能处理数百万细胞的微流体装置上产生微滴并对微滴进行温育和分析。这种方法具有高度的可扩展性,可以应用于数十个rna输入,从而提供细胞表型状态的详细图谱。
材料和方法
装置制造
微流体装置由聚二甲基硅氧烷(pdms)通过软光刻工艺制成。将su-83025或3010光致抗蚀剂(microchem)沉积到硅晶片上并进行旋转以获得期望的层高度。使用光掩模来在uv曝光期间产生聚合光致抗蚀剂的图案。然后将图案化的晶片放入培养皿中形成模具,并且以11:1的聚合物:活化剂比例加入
dna复合物和引物混合物
除了报告子复合物链是通过hplc纯化的,所有的dna寡核苷酸都是使用标准脱盐技术从集成dna技术公司(爱荷华州科拉尔维尔)订购的。将所有的lamp引物在无dnase/rnase的水(英杰公司(invitrogen),目录号:10977023)中稀释,然后储存于-20℃下。将逻辑门和报告子链在用depc处理的10mm磷酸盐缓冲盐水(ph7.4)中稀释,然后保存在-20℃下。在用焦碳酸二乙酯(depc)处理的磷酸盐缓冲的磷酸盐缓冲盐水(pbs)中制备每种dna复合物的100x储液,并储存在-20℃下。在实验当天,通过加热到97℃持续5分钟并以-2℃/分钟的速度冷却到23℃来分别对每个dna复合物进行退火重结合。将dna复合物储存在冰上直到实验开始。在无dnase/rnase的水中制备20xlamp引物混合物,并储存在-20℃下。表1中示出了lamp实验中使用的引物和逻辑门的序列。
表1:lamp实验中使用的引物和逻辑门的序列
表2.cha实验中使用的寡核苷酸的序列
体外转录
krt19和vim转录物的dna模板由集成dna技术公司(爱荷华州科拉尔维尔)合成为“gblocks”(分别为seqidno:72和seqidno:73),并在t7启动子下克隆到pet-22b(+)载体中(可从novagen获得,目录号:69744-3)。体外转录是用hiscribetmt7高产率rna合成试剂盒(新英格兰生物实验室,目录号:e2040s)进行的,用genejetrna纯化试剂盒(赛默飞世尔科技公司(thermoscientific),目录号:k0731)对所得的rna进行纯化。在nanodroptm分光光度计(赛默飞世尔科技公司)上对rna浓度进行定量,将储液在-80℃下储存在用depc处理的pbs中。
细胞培养和染色
将molt-4细胞(美国模式培养物保藏所(americantypeculturecollection))每两天以1:8的比例传代培养,并使其在添加有10%fbs(gibco,目录号:10082147)和1x抗生素抗真菌剂(gibco,目录号:15240062)的rpmi-1640培养基(gibco,目录号:11875093)中生长。将sk-br-3、u-2os和mcf7细胞(美国类型培养物保藏中心)以1:4的比例每两天传代培养一次,并使其在添加有10%fbs和1x抗生素抗真菌剂的高葡萄糖(gibco,目录号:11965-092)的dmem中生长。在实验当天,收集每种细胞类型,并用杜尔贝科磷酸盐缓冲盐水(dpbs)洗涤两次(gibco,目录号:14190144)。然后在冰上用1μmcelltracetm钙黄绿素红-橙色am(英杰公司,目录号:c34851)、用于405nm激发的1μmcelltracetm钙黄绿素紫am(英杰公司,目录号:c34858)或0.6μm钙黄绿素am(bd生物科学公司(bdbiosciences),目录号:564061)的dpbs溶液对细胞进行30分钟染色。随后用dpbs洗涤细胞两次,并重新悬浮在18.75%v/voptipreptm密度梯度培养基(西格玛奥德里奇公司(sigmaaldrich),目录号:d1556)的dpbs溶液中以进行微流体分析。
批量rt-lamp实验
在伯乐公司cfxconnect上于65℃下一式三份进行批量rt-lamp测定。反应在10μl的总体积下进行,每份fip/bip引物1.6μm,每份f3/b3引物0.2μm,每份loopf/b引物0.4μm,1xwarmstartlamp主混合物(新英格兰生物实验室,目录号:e1700s),0.5u/μlsuperase·intmrnase抑制剂(英杰公司,目录号:am2696),和0.5x磷酸盐缓冲盐水。添加不同浓度的dna复合物。表1示出了lamp引物和逻辑门序列。在没有任何dna复合物的反应中,加入了lamp荧光染料(新英格兰生物实验室)作为通用lamp指示剂。在裂解物实验中,将1%tritonx-100(西格玛奥德里奇公司,目录号:t8787)包含在反应混合物中。在每个实验开始之前,将完整的、未染色的细胞加入每个孔中。对于所有实验,lamp引物的“标准浓度”被定义为对于给定的lamp引物组,每份fip/bip引物为1.6μm,每份f3/b3引物为0.2μm,并且每份loopf/b引物为0.4μm。
转导子正交性实验
实验如上文“分批rt-lamp实验”中所述一式三份进行,并且稍微进行了修改。每个反应包含两个lamp引物组:一个特异于krt19转录物,另一个特异于vim转录物。每个反应只添加一个转导子,从而识别vim或krt19扩增产物。将体外转录的krt19或vimrna以10nm的浓度加入到每个反应中。在每个转导子的非模板对照反应中也加入了pbs。每个反应包含预先退火重结合于200nm转导子输出链的400nm转导子门链,和预退火重结合至100nm报告子荧光团链的200nm报告子淬灭链。表1中示出了逻辑门序列和lamp引物序列。
用lamp输入进行的与逻辑门实验
实验类似于“分批rt-lamp实验”一式三份进行。每个反应都包含标准浓度(如“分批rt-lamp实验”中所限定)的krt19引物组和vimlamp引物组两者。加入浓度为10nm的体外转录krt19和/或vimrna。每个反应还含有预先退火重结合于100nmrepq的50nmrepf。每个反应包含krt19转导子和vim转导子两者:60nmkrt19转导子2预先退火重结合于120nmkrt19/vim转导子2输出,以及60nmvim转导子2预先退火重结合于120nmkrt19/vim转导子2输出。每个反应均含有预先退火重结合于60nmkrt19与vim门链的55nmkrt19与vim输出链。在krt19与vim逻辑实验中,包含了65nm的krt19与vim阈值链。表1中给出了所有lamp引物序列和逻辑链序列。
用lamp输入进行的或逻辑门实验
每个反应都包含标准浓度(如“分批rt-lamp实验”中所限定)的krt19引物组和vimlamp引物组。加入了浓度为1nm的体外转录的krt19和/或vimrna,或以等量的水作为非模板对照物。每个反应含有预先退火重结合于200nmrepq的100nmreff、预先退火重结合于200nmkrt19/vim转导子3输出的220nmkrt19转导子3和预先退火重结合于200nmkrt19/vim转导子3输出的220nmvim转导子3。实验如“分批rt-lamp实验”中所述一式三份进行。表1中给出了所有lamp引物序列和逻辑链序列。
用lamp输入进行的是逻辑门实验
每一个反应都包含标准浓度(如“分批rt-lamp实验”中所限定)的krt19引物组。加入浓度为1nm的体外转录的krt19rna,或以等量的水作为非模板对照物。每个反应均含有预先退火重结合于200nmrepq的100nmrepf和预先退火重结合于200nmkrt19/vim转导子3输出的220nmkrt19转导子3。实验如“分批rt-lamp实验”中所述一式三份进行。表1中给出了所有lamp引物序列和逻辑链序列。
用lamp输入进行的非逻辑门实验
每个反应包含预先退火重结合于100nmrepf的200nmkrt19与非vim输出、预先退火重结合于220nmkrt19与非vim抑制剂的240nmvim转导子4门,以及200nm未结合的repq。每个反应还包含标准浓度(如“分批rt-lamp实验”中所限定)的vimlamp引物组。加入1nmvim体外转录的rna,或以水作为阴性对照物。实验如“分批rt-lamp实验”中所述一式三份进行。
用lamp输入进行的与非逻辑门实验
每个反应包含预先退火重结合于200nmkrt19与非vim输出的220nmkrt19转导子4门、预先退火重结合于220nmkrt19与非vim抑制剂的240nmvim转导子4门,以及预先退火重结合于100nmrepf的200nmrepq。每个反应还包含标准浓度(如“分批rt-lamp实验”中所限定)的krt19和vimlamp引物组。加入1nmkrt19和/或vim体外转录的rna,或以水作为阴性对照物。实验如“分批rt-lamp实验”中所述一式三份进行。
用dsdna特异性报告子进行的液滴rt-lamp实验
实验如上文“用荧光逻辑门报告子进行的液滴rt-lamp实验”中所述进行,并进行了一些修改。在实验之前,如上文“细胞培养和染色”中所述,用钙黄绿素橙红am(英杰公司)分别对molt-4和sk-br-3细胞进行染色。使用具有100μm方通道的共流式微流体制滴器来产生体积约为1nl的液滴。制滴器由三个入口组成,其含有:
1.)悬浮在18.75%v/v的optipreptm密度培养基(西格玛奥德里奇公司,目录号:d1556)和磷酸盐缓冲盐水的混合物中的4x细胞混合物(900个细胞/μl),
2.)2xwarmstartlamp主混合物(新英格兰生物实验室公司,目录号:e1700s),
3.)含有lamp引物、superase·intmrnase抑制剂(英杰公司,目录号:am2696)、4xwarmstartlamp荧光染料(新英格兰生物实验室)和4%v/vtritonx-100(西格玛奥德里奇公司,目录号:t8787)的4x混合物。
将这些水性流组合成悬浮在氟化油(用于evagreen(伯乐公司,目录号:1864005)的qx200tm液滴产生油)中的液滴。入口1和3的流速为50μl/小时,入口2为100μl/小时,并且进油口为800μl/小时。选择细胞浓度(3,600个细胞/μl),使得大约每十个液滴中有一个含有单细胞。对于显微镜实验,将液滴收集到微量离心管中,并在荧光测量前于65℃下温育20分钟。将液滴放入pdms成像室,并在nikoneclipseti落射荧光显微镜(nikoneclipsetiepifluorescencemicroscope)上成像。
最终的rt-lamp条件包含每份fip/bip引物1.6μm、每份f3/b3引物0.2μm、每份loopf/b引物0.4μm、1xwarmstartlamp主混合物(新英格兰生物实验室公司)、0.5u/μlsuperase·intmrnase抑制剂(英杰公司)、1%tritonx-100(西格玛奥德里奇公司)、4.7%v/voptipreptm密度梯度介质(西格玛奥德里奇公司)、1xlamp荧光染料(新英格兰生物实验室公司)和0.5x磷酸盐缓冲液。用多重转导子进行的液滴rt-lamp实验
利用共流式微流体制滴器用lamp组分、逻辑门和裂解试剂封装细胞。在实验之前,将u-2os和sk-br-3细胞分别用钙黄绿素am(bd生物科学公司,目录号:564061)染色,如上文在“细胞培养和染色”中所述。选择60μm作为微流体通道的宽度和高度,产生体积约为250pl的液滴。这一滴水器由三个水性入口组成,其含有:
1.)悬浮在磷酸盐缓冲盐水中的10x细胞混合物(5,000个细胞/μl),
2.)2xwarmstartlamp主混合物(新英格兰生物实验室公司,目录号:e1700s),
3.)含有lamp引物、dna复合物、superase·intmrnase抑制剂(英杰公司,目录号:am2696)和6.25%v/vtween-20(西格玛奥德里奇公司,目录号:p9416)的2.5x混合物。
将这些水性流组合成悬浮在氟化油(用于evagreen(伯乐公司,目录号:1864005)的qx200tm液滴产生油)中的液滴。入口1的流速为80μl/小时,入口2为400μl/小时,入口3为320μl/小时,并且进油口为1200μl/小时。选择细胞浓度(5,000个细胞/μl),使得大约每十个液滴中有一个含有单细胞。将液滴收集到冰上的微量离心管中,并在荧光测量前于65℃温育60分钟或5分钟(对于阴性对照物)。然后将液滴重新注入第二个微流体装置进行荧光测量,其中液滴注入速率为400μl/小时,并且油再注入速率为1,200μl/小时。每个液滴通过一组激发波长分别为488nm、530nm和637nm的激光器(中国长春新产业光电技术公司(changchunnewindustriesoptoelectronicstech.co.,changchun,china)),并且每个通道通过一个光电倍增管(新泽西州牛顿索雷博公司(thorlabs,newton,nj))测量荧光。通过fpga卡(美国国家仪器公司(nationalinstruments))获得荧光数据,并用labview软件(美国国家仪器公司)对其进行分析。
每个条件包含如表1列出的krt19引物组和vim引物组。最终rt-lamp条件包含每份fip/bip引物1.6μm、每份f3/b3引物0.2μm、每份loopf/b引物0.4μm、预先退火重结合于200nmrepq链的100nmrepf-hex链、预先退火重结合于200nmrepq2链的100nmrepf2-af647链、预先退火重结合于100nmkrt19->rep转导子输出的110nmkrt19->rep转导子门链、预先退火重结合于100nmvim->rep转导子输出的110nmvim->rep转导子门、1xwarmstartlamp主混合物(新英格兰生物实验室公司)、0.5u/μlsuperase·intmrnase抑制剂(英杰公司)和2.5%v/vtween-20(西格玛奥德里奇公司,目录号:p9416)。
液滴esr1rt-lamp
实验按照“用多重转导子进行的液滴rt-lamp实验”进行,但进行了一些改动。将mcf7和sk-br-3细胞如上文“细胞培养和染色”中所述分别用钙黄绿素红-橙am(英杰公司)染色。在含125pg/μlrnasea的磷酸盐缓冲盐水中以9,000个细胞/μl的浓度将细胞装载到装置中(赛默飞世尔科技公司,目录号:en0531)。每个条件包含标准浓度(如“批量rt-lamp实验”中所限定)的esr1lamp引物组。表1中列出了esr1lamp引物序列。将warmstartlamp染料(新英格兰实验室公司)添加到入口3内作为通用lamp指示剂。最终的rt-lamp条件包含含有1xwarmstartlamp染料的1xwarmstartlamp主混合物(新英格兰生物实验室公司)、0.5u/μlsuperase·intmrnase抑制剂(英杰公司)和2.5%v/vtween-20(西格玛奥德里奇公司,目录号:p9416)。在冰上收集液滴,在65℃下温育50分钟,用473nm和532nm用于激发的激光测量荧光(长春新产业光电技术公司),类似于上述实验。入口1液滴产生的流速为40μl/小时,入口2为100μl/小时,入口3为80μl/小时,并且进油口为800μl/小时。
用集成装置进行的液滴rt-lamp
实验按照“液滴esr1rt-lamp”进行,但进行了一些改动。molt-4细胞用钙黄绿素红-橙am(英杰公司)染色,如上文“细胞培养和染色”中所述。在磷酸盐缓冲盐水中将细胞以9,000个细胞/μl的浓度装载到装置中。每个条件包含标准浓度(如“批量rt-lamp实验”中所限定)的gapdhlamp引物组。表1中列出了引物序列。最终的rt-lamp条件包含含有1xwarmstartlamp染料的1xwarmstartlamp主混合物(新英格兰生物实验室公司)、0.5u/μlsuperase·intmrnase抑制剂(英杰公司)和2.5%v/vtween-20(西格玛奥德里奇公司,目录号:p9416)。在如图12所示的单个集成装置中产生液滴并对其进行温育和分析。在提取了过量的油用于紧密的液滴填充之后,液滴从液滴发生器中流出,进入一段pe管(亚利桑那州哈瓦苏湖市scientificcommodities公司(scientificcommodities,inc.,lakehavasucity,az))。pe管的长度使得液滴在65℃的孵化箱中停留45分钟,然后被重新注入到用于荧光测量的微流体装置中。用473nm和532nm激光激发液滴,与上述实验类似地获取和分析数据。入口1液滴产生的流速为20μl/小时,入口2为50μl/小时,入口3为40μl/小时,并且进油口为400μl/小时。随后以390μl/小时的速度提取油,并以200μl/小时的速度重新注入,然后进行液滴测量。
催化发夹组装实验
催化发夹组装(cha)在tecanspark读板仪(tecansparkplatereader)上在37℃下以10μl反应进行。用490nm的激发波长和535nm的发射波长测量荧光。反应缓冲液由tenak(20mmtris、1mmedta、140mmnacl和5mmkcl,ph为8.0)和0.5%sds组成。每个反应都含有dna寡核苷酸,包含50nmh1、400nmh2、50nmh3、400nmh4、10nmck19感应子和预先退火重结合于100nmrepq-cha的50nmrepf-cha。按照“dna复合物和引物混合物”中所述分别对寡核苷酸进行退火重结合,但repf-cha和repq-cha除外,它们要一起退火重结合。表2给出了每个寡核苷酸的序列。对于cha背景实验,在有或没有100pmdna寡核苷酸“ck19输入”的情况下一式三份进行反应以引发反应。反应持续了12个小时。
对于裂解物抑制实验,将molt-4细胞滴定到lamp反应中,并且最终浓度范围为3.9*105个细胞/μl到1.0*108细胞/μl。在“ck19+”反应中,加入10nm的dna寡核苷酸“ck19输入”以引发反应,如果不加入所述“ck19输入”,则不加入引发剂。反应持续了8个小时。
液滴分选实验
液滴的产生方法与上述“液滴esr1rt-lamp”中使用的方法相似,但有一些改动。将mcf7细胞如上文“细胞培养和染色”中所述用钙黄绿素红-橙am(英杰公司)染色,并且将sk-br-3细胞分别用钙黄绿素紫am(英杰公司)染色。将细胞以1:1的比例混合,并在磷酸盐缓冲盐水中以9,000个细胞/μl的总浓度装载到装置中。每个条件包含标准浓度(如“批量rt-lamp实验”中所限定)的esr1lamp引物组。表1中列出了引物序列。将warmstartlamp染料(新英格兰实验室公司)添加到入口3内作为通用lamp指示剂。最终的rt-lamp条件包含含有1xwarmstartlamp染料的1xwarmstartlamp主混合物(rna和dna)(新英格兰生物实验室公司)、0.5u/μlsuperase·intmrnase抑制剂(英杰公司)和2.5%v/vtween-20(西格玛奥德里奇公司,目录号:p9416)。入口1液滴产生的流速为40μl/小时,入口2为100μl/小时,入口3为80μl/小时,并且进油口为800μl/小时。将液滴收集在冰上,在65℃温育1小时,并装载到如图13所示的分选装置中。另见(sciambi和abate,2015)。液滴的分选流速为100μl/小时,回注油的分选流速为400μl/小时,并且偏移油的分选流速为1,000μl/小时。用405nm、473nm和532nm用于激发的激光测量荧光(长春新产业光电技术公司),类似于上述实验。基于lamp染料通道(473nm激发)中的高荧光对液滴进行分选。每个分选脉冲通过分选(正)电极和参比(负)电极使用由崔克2210型高压放大器(纽约洛克波特的崔克公司(trekinc.,lockport,newyork))产生的具有800v振幅和250个脉冲周期的10khz方波施加。分选电极和参比电极用溶解在去离子水中的1mnacl填充。分选后,将液滴放入pdms成像室,并在nikoneclipseti落射荧光显微镜上成像。
actbsnp-lamp检测实验
实验以与上述“批量rt-lamp实验”中使用的方法类似的方法进行,但有一些修改。总rna是使用genejetrna纯化试剂盒(赛默飞世尔科技公司,目录号:k0731)从molt-4或sk-br-3细胞中提取的,并以1ng/μl的最终浓度添加。actblamp引物以标准浓度(如“批量rt-lamp实验”中所限定)添加。此外,添加了1μm“actb4b3-库”链。所有寡核苷酸序列见表1。加入warmstartlamp染料(新英格兰生物实验室公司)作为通用lamp指示剂。
结果
基于dna的ctc检测回路
以下实例示出了一个基于dna的回路,其输入多个细胞转录物,执行逻辑计算,并输出二进制ctc分类。早期实验表明,dna链置换级联不足以检测单细胞的转录物水平,因此需要输入扩增步骤。因此,寻求开发对高裂解物浓度敏感、具有选择性和抗性的扩增机制。
信号扩增:最初探索了一种催化发夹组装(cha)扩增机制。cha使用输入核酸作为催化剂来组装亚稳态发夹,从而产生线性信号扩增。cha扩增受到高信号背景和强细胞裂解物抑制的影响(图14a和14b)。经过彻底的表征之后,得出的结论是cha不足以扩增微流体液滴中单细胞的转录物。还测试了杂交链式反应(hcr)作为一种扩增机制,并发现了与cha类似的结果。在图14a中,误差条表示平均值的+/-1标准差。这些实验按照“催化发夹组装实验”中所述进行。
经确定,逆转录酶环介导等温扩增(rt-lamp)是一种用于扩增单细胞的转录物的稳健技术。lamp使用六个引物和一个链置换性dna聚合酶来指数扩增核酸靶标。通过rt-lamp,实现了超过106个细胞/毫升的目标使用浓度的次纳摩尔的检测灵敏度和裂解物抗性。使用上皮标记物细胞角蛋白19(ck19,krt19)的特异性引物,测试了rt-lamp区分人乳腺癌细胞(sk-br-3)和白细胞(molt-4)的能力。这些实验揭示了信号背景比>150的宽(50分钟)检测窗口(图15a和15b)。这种出色的信号扩增足以馈入下游分子逻辑门并在微流体芯片上检测。此外,经确定,ck19lamp即使在107个细胞/毫升(相当于每100pl液滴一个细胞)时也能可靠地区分sk-br-3和molt-4裂解物(图15b)。这些实验表明,在相当于微滴反应的条件下,上皮标记物krt19上的rt-lamp可以区分人乳腺癌细胞(sk-br-3)和白细胞(molt-4)。误差条表示所有实验中平均值的+/-1标准差。这些实验是按照“分批rt-lamp实验”中所述进行的。
分子逻辑:ctc检测回路必须整合来自多个转录物的信号来进行ctc分类。dna逻辑门可以对核酸输入执行复杂的分子逻辑和计算。设计了新的利用lamp聚合酶的链置换活性来驱动链置换的逻辑门。与传统的随机游走分支迁移级联相比,这种新机制提供了更好的动力学和更少的信号泄漏。
使用聚合酶驱动机制设计了所有基本的单输入和双输入逻辑门(图4-11)。从理论上讲,可以通过级联这些基本门来计算任意复杂的逻辑函数。作为初始演示,构建了检测上皮标记物(krt19)的是门(图4)、检测间充质标记物(vim)的非门(图10)、识别上皮(krt19)或间充质(vim)标记物的或门(图7a-d)、识别上皮(krt19)和间充质(vim)标记物的与门(图7a-7d),以及识别上皮(krt19)和间充质(vim)标记物的与非门(图9a-d)。这些门对于鉴定占据沿上皮-间充质或间充质-上皮转变状态的ctc至关重要。在这些门上的实验证明,在存在krt19和/或vim的情况下,强而均匀的荧光信号与逻辑门的设计逻辑运算一致(图16)。图16包含针对非门(图19a)、或门(图18a)、与门(图18b)和与非门(图19b)示出的时间轨迹的端点结果。这些实验按照“用lamp输入进行的与逻辑门实验”、“用lamp输入进行的或逻辑门实验”、“用lamp输入进行的是逻辑门实验”、“用lamp输入进行的非逻辑门实验”和“用lamp输入进行的与非逻辑门实验”中的描述进行。误差条表示所有曲线中平均值的+/-1标准差。
还证明了是门可以正交操作来检测多重lamp应中的特定扩增事件。使用识别vim(图17b)或krt19(图17a)的正交、多重lamp和是逻辑门进行实验,如上文“转导子正交性实验”中所述。误差条表示平均值的+/-1标准差。
超高通量微流体ctc筛选装置
以下实例提供了一种对在上述实验中开发的基于dna的逻辑回路的输出进行监测的集成的微流体装置。这些实验证明了使微流体液滴中的rt-lamp反应小型化的能力,并将其应用于区分单细胞的表型状态。
微流体液滴中的单细胞分析:在批量测定中优化lamp条件后,将其缩小到微乳液形式。将单细胞装载到微流体装置上,并封装在含有裂解试剂、rt-lamp试剂和dsdna特异性lamp指示剂的约1nl液滴中。用细胞染色法(钙黄绿素红-橙am,英杰公司)验证细胞和lamp信号的共定位。将液滴温育20分钟,并使用荧光显微拷贝成像。白细胞(molt-4)在背景之上没有显示krt19信号(图20b),而乳腺癌细胞(sk-br-3)显示出强krt19扩增(图20a)。这一实验证明了在微乳液滴中使用lamp来区分细胞类型的能力。这一实验按照“用dsdna特异性报告子进行的液滴rt-lamp实验”中所述进行。
进一步展示了使用采用连续检测的全微流体工作流程的更高通量单细胞分析。成功地应用这一技术对成千上万个mcf7(er+)和sk-br-3(er-)细胞的雌激素受体(er,esr1)表达进行了分析,如图21所示。正如预期的那样,与sk-br-3细胞相比,明显更大部分的mcf7细胞对lamp指示剂显示出高荧光。这表明所采用的方法可以基于细胞的mrna基因表达以高通量的方式成功区分细胞。这一实验按照“液滴esr1rt-lamp”中所述进行。
另外表明,在这些液滴测定中可以同时测定多个转录物,如图23a和23b所示。进行了一项多重转导子实验,其中krt19扩增活化alexafluor647报告子,并且vim扩增活化hex报告子。用这些转导子和报告子将sk-br-3(ck19+/vim-)和u-2os(ck19-/vim+)细胞封装在液滴中,发现每种细胞类型只活化其预期的报告子。这一实验按照“用多重转导子进行的液滴rt-lamp实验”中所述进行。
集成微流体装置:将所有三个微流体步骤结合到一个不需要用户干预的连续的工作流程中。这一装置包括三个模块。模块:(1)将单细胞封装在含有dna回路和扩增试剂的液滴中;(2)将反应温育特定的时间和温度;以及(3)使用荧光光谱法检测回路输出。图12中示出了一个示例性系统。如图22所示,能够使用这一装置在成千上万个molt-4细胞中扩增gapdh转录物。基于这些实验,可以制造每小时分析数百万个细胞的全自动微流体装置。这一实验按照“用集成装置进行的液滴rt-lamp”中所述进行。
微流体液滴分选:使用介电泳分选装置基于雌激素受体(er)转录物(esr1)的表达来分离两种细胞类型。将mcf7(er+)和sk-br-3(er-)细胞分别染色,混合在一起,然后基于rt-lamp扩增进行分选。如图24a和24b所示,这一装置成功地富集了分选物出口中的绿色荧光液滴,这表明esr1扩增较为成功。这个实验证明了根据细胞群体的转录状态物理分离细胞群体的能力。这些经过分选的池(pool)和未经分选的池可以通过rna测序或其它测定进一步分析。图13中描绘出了这种分选装置。另见sciambi和abate,2015。
另外的逻辑回路:上面概述的实验证明了使用链置换级联对微流体液滴中单细胞进行谱分析的能力。分子逻辑回路的一个优点是能够交换新元素以适应癌症类型甚至患者进行测定的能力。可以构建逻辑回路来对多个转录输入进行谱分析,如用于特定癌症类型的分子标记物信息面板(informativemolecularmarkerpanel)。所述微流体装置可用于对人类血液样品中的低丰度ctc进行检测和/或分类。
另外的样品和谱分析特征:本文所述的测定和装置可用于血液样品以外的样品。例如,可将来自组织活检的细胞分散并对其进行本文所述的核酸谱分析。谱分析可用于对多种核酸特征中的任何一种进行谱分析,并以多种形式对细胞进行分类。对mrna和/或mirna的表达模式进行谱分析以及对snp进行检测或谱分析仅提供了几个非限制性的实例。已经证明,通过区分molt-4和sk-br-3总rna,基于lamp的snp检测在液滴中是可行的。在actb转录物中含有snp的molt-4rna在sk-br-3核糖核酸之前被扩增。这些结果示于图25中。误差条表示平均值的+/-1标准差。这一snp实验如“actbsnp-lamp检测实验”中所述进行。
参考文献
arezib、mccarthym、hogrefeh.,“莫洛尼鼠白血病病毒逆转录酶突变体对常用rt-qpcr抑制剂表现出较高的抗性(mutantofmoloneymurineleukemiavirusreversetranscriptaseexhibitshigherresistancetocommonrt-qpcrinhibitors)”,《分析生物化学(analbiochem.)》,2010年5月15日;400(2):301-3。
baccouchea、montagnek、padiraca、fujiit、rondelezy.,“动态dna工具箱反应回路:走读(dynamicdna-toolboxreactioncircuits:awalkthrough)”,《方法(methods)》,2014年5月15日;67(2):234-49。
badoloa、okadok、guelbeogowm、aonumah、bandoh、fukumotos、sagnonn、kanukah,“用于检测冈比亚按蚊l1014fkdr-w突变的等位基因特异性环介导等温扩增法(as-lamp)的建立(developmentofanallele-specific,loop-mediated,isothermalamplificationmethod(as-lamp)todetectthel1014fkdr-wmutationinanophelesgambiaes.l.)”,《疟疾杂志(malariajournal)》,2012年7月6日;11:227。
bendallsc、nolangp,“从单细胞到癌症的深层表型(fromsinglecellstodeepphenotypesincancer)”,《自然生物技术(natbiotechnol.)》,2012年7月10日;30(7):639-47。
cheny、songy、wuf、liuw、fub、fengb、zhoux,“一种基于链置换反应和滚环扩增的响应多个低丰度dna片段输入信号的dna逻辑门及其在mirna检测中的应用(adnalogicgatebasedonstranddisplacementreactionandrollingcircleamplification,respondingtomultiplelow-abundancednafragmentinputsignals,anditsapplicationindetectingmirnas)”,《化学通讯(剑桥)(chemcommun(camb))》,2015年4月25日;51(32):6980-3。
dengw、xuh、dingw、liangh(2014),“基于金属黏性末端(metallo-toehold)链置换的dna逻辑门(logicgatebasedonmetallo-toeholdstranddisplacement)”,《公共科学图书馆期刊(plosone)》,9(11):e111650。
eastburndj、sciambia、abatear,《微流体液滴中超高通量哺乳动物单细胞逆转录聚合酶链反应(ultrahigh-throughputmammaliansingle-cellreverse-transcriptasepolymerasechainreactioninmicrofluidicdrops)》,《分析化学(analchem.)》,2013年8月20日;85(16):8016-21。
guomt、rotema、heymanja、weitzda,“用于高通量生物测定的液滴微流体(dropletmicrofluidicsforhigh-throughputbiologicalassays)”,《芯片实验室(labchip.)》,2012年6月21日;12(12):2146-55。
hedmanj、
kaliskyt、blaineyp、quakesr,“单细胞水平下的基因组分析(genomicanalysisatthesingle-celllevel)”,《遗传学年度评论(annurevgenet.)》,2011;45:431-45.
kaliskyt、quakesr,“单细胞基因组学(single-cellgenomics)”,《自然方法(natmethods)》,2011年4月;8(4):311-4。
levskyjm、singerrh,“基因表达和普通细胞的神话(geneexpressionandthemythoftheaveragecell)”,“细胞生物学发展趋势(trendscellbiol.)”,2003年1月;13(1):4-6。
lix、dingt、sunl、maoc,“基于切刻核酸内切酶循环等温扩增的超灵敏dna检测和其在逻辑门中的应用(ultrasensitivednadetectionbycycleisothermalamplificationbasedonnickingendonucleaseanditsapplicationtologicgates)”,《生物传感器与生物电子学(biosensbioelectron)》,2011年12月15日;30(1):241-8。
liw、yangy、yanh、liuy。“基于dna链置换的多数三个输入逻辑门和多个输入逻辑回路(three-inputmajoritylogicgateandmultipleinputlogiccircuitbasedondnastranddisplacement)”,《纳米快报(nanolett.)》,2013年6月12日;13(6):2980-8。
liw、zhangf、yanh、liuy,“基于dna的算术函数:一种基于dna链置换的半加法器(dnabasedarithmeticfunction:ahalfadderbasedondnastranddisplacement)”,《纳米级(nanoscale.)》,2016年2月14日;8(6):3775-84。
maryp、dauphinotl、boisn、potiermc、studerv、tabelingp,“用基于微滴的微流体技术分析单细胞水平下的基因表达(analysisofgeneexpressionatthesingle-celllevelusingmicrodroplet-basedmicrofluidictechnology)”,《生物微流体学(biomicrofluidics)》,2011年6月;5(2):24109。
masseym、medintzil、anconamg、algarwr,“时间选通的fret和基于dna的光子分子逻辑门:与、或、nand和nor(time-gatedfretanddna-basedphotonicmolecularlogicgates:and,or,nand,andnor)”,《美国化学学会传感器杂志(acssens.)》,2017年8月25日;2(8):1205-1214。
novakr、zengy、shugaj、venugopalang、fletcherda、smithmt、mathiesra,“用通过微流体方式产生的琼脂糖乳液进行单细胞多重基因检测和测序(single-cellmultiplexgenedetectionandsequencingwithmicrofluidicallygeneratedagaroseemulsions)”,《应用化学国际英文版(angewchemintedengl.)》,2011年1月10日;50(2):390-5。
okamotoa、tanakak、saitoi,“dna逻辑门(dnalogicgates)”,《美国化学会志(jamchemsoc.)》,2004年8月4日;126(30):9458-63。
qianl、winfreee,“用于合成大规模回路的简单的dna门基序(asimplednagatemotifforsynthesizinglarge-scalecircuits)”,《英国皇家学会界面杂志(jrsocinterface.)》,2011年9月7日;8(62):1281-97。
qianl、winfreee、bruckj,“dna链置换级联的神经网络计算(neuralnetworkcomputationwithdnastranddisplacementcascades)”,《自然(nature)》,2011年7月20日;475(7356):368-72。
ravanh、amandadim、esmaeili-mahanis,“基于dnadomino的纳米逻辑回路:核酸超灵敏多重分析的通用策略(dnadomino-basednanoscalelogiccircuit:aversatilestrategyforultrasensitivemultiplexedanalysisofnucleicacids)”,《分析化学》,2017年6月6日;89(11):6021-6028。
sciambia、abatear,“在30khz下对液滴进行精确的微流体分选(accuratemicrofluidicsortingofdropletsat30khz)”,《芯片实验室(labchip.)》,2015年10月22日;15:47-51.
sieuwertsam、mostertb、bolt-devriesj、peetersd、dejonghfe、stouthardjm、dirixly、vandampa、vangalena、deweerdv、kraanj、vanderspoelp、ramírez-morenor、vandeurzench、smidm、yujx、jiangj、wangy、gratamajw、sleijfers、foekensja、martensjw,“转移性乳腺癌患者循环肿瘤细胞和原发肿瘤中的mrna和微rna表达图谱(mrnaandmicrornaexpressionprofilesincirculatingtumorcellsandprimarytumorsofmetastaticbreastcancerpatients)”,《临床癌症研究(clincancerres.)》,2011年6月1日;17(11):3600-18。
tannerna、zhangy、evanstcjr,“实时环介导等温扩增中的同时多靶检测(simultaneousmultipletargetdetectioninreal-timeloop-mediatedisothermalamplification)”,《生物技术(biotechniques)》,2012年8月;53(2):81-9。
tehsy、linr、hunglh、leeap,“液滴微流体(dropletmicrofluidics)”,《芯片实验室(labchip.)》,2008年2月;8(2):198-220。
thubagereaj、thachukc、berleantj、johnsonrf、ardeleanda、cherrykm、qianl,“使用未纯化组分的大型dna链置换回路的编译程序辅助的系统构建(compiler-aidedsystematicconstructionoflarge-scalednastranddisplacementcircuitsusingunpurifiedcomponents)”,《自然通讯(natcommun.)》,2017年2月23日;8:14373。
vyawahares、griffithsad、mertenca,“微流体装置中生物和化学测定的微型化和并行化(miniaturizationandparallelizationofbiologicalandchemicalassaysinmicrofluidicdevices)”,《化学生物学(chembiol.)》,2010年10月29日;17(10):1052-65。
weih、hub、tangs、zhaog、guany,“通过滚环扩增平台组装以构建一组逻辑门的阻遏物逻辑模块(repressorlogicmodulesassembledbyrollingcircleamplificationplatformtoconstructasetoflogicgates)”,《科学报告(scirep.)》,2016年11月21日;6:37477。
whiteak、vaninsberghem、petrivoi、hamidim、sikorskid、marrama、piretj、aparicios、hansencl,“高通量微流体单细胞rt-qpcr(high-throughputmicrofluidicsingle-cellrt-qpcr)”,《美国国家科学院院刊(procnatlacadsciusa)》,2011年8月23日;108(34):13999-4004。
xuw、dengr、wangl、lij。“核酸内切酶介导的dna逻辑门多响应滚环扩增(multiresponsiverollingcircleamplificationfordnalogicgatesmediatedbyendonuclease)”,《分析化学》,2014年8月5日;86(15):7813-8。
yangj、shenl、maj、schlaberghi、lius、xuj、zhangc,“通过链置换调控的逻辑门运算的荧光纳米粒子信标(fluorescentnanoparticlebeaconforlogicgateoperationregulatedbystranddisplacement)”,《美国化学会—应用材料与界面(acsapplmaterinterfaces)》,2013年6月26日;5(12):5392-6。
yangj、songz、lius、zhangq、zhangc,“针对分子逻辑门在dna折纸上动态排列金纳米粒子(dynamicallyarranginggoldnanoparticlesondnaorigamiformolecularlogicgates)”,《美国化学会—应用材料与界面》,2016年8月31日;8(34):22451-6。
yangb、zhangxb、kanglp、huangzm、shengl、yurq、tanw,“智能分层nanoflare:用于多种dna逻辑门运算和细胞内有效递送的“纳米粒子实验室”(intelligentlayerednanoflare:"lab-on-a-nanoparticle"formultiplednalogicgateoperationsandefficientintracellulardelivery)”,《纳米级》,2014年8月7日;6(15):8990-6。
yaod、wangb、xiaos、songt、huangf、liangh,“是什么控制dna缀合金纳米粒子上的黏性末端介导的链置换反应中的“开/关”切换?(whatcontrolsthe"off/onswitch"inthetoehold-mediatedstranddisplacementreactionondnaconjugatedgoldnanoparticles?)”,《朗缪尔(langmuir)》,2015年6月30日;31(25):7055-61。
yongkiettrakuls、kampeeraj、chareanchimw、rattanajakr、pornthanakasemw、kiatpathomchaiw、kongkasuriyachaid,“用snp-lamp测定结合侧向流试纸法简单检测恶性疟原虫单核苷酸多态性(simpledetectionofsinglenucleotidepolymorphisminplasmodiumfalciparumbysnp-lampassaycombinedwithlateralflowdipstick)”,《国际寄生虫学(parasitolint.)》,2017年2月;66(1):964-971。
zanolilm、spotog,“用于微流体装置中核酸检测的等温扩增方法(isothermalamplificationmethodsforthedetectionofnucleicacidsinmicrofluidicdevices)”,《生物传感器(巴塞尔)(biosensors(basel))》,2012年12月27日;3(1):18-43。zhangc、yangj、xuj,“采用链置换的圆环形dna逻辑门(circulardnalogicgateswithstranddisplacement)”,《朗缪尔》,2010年2月2日;26(3):1416-9。
zhangh、jenkinsg、zouy、zhuz、yangcj,“使用琼脂糖液滴微流体的大规模平行单分子和单细胞乳液反转录聚合酶链反应(massivelyparallelsingle-moleculeandsingle-cellemulsionreversetranscriptionpolymerasechainreactionusingagarosedropletmicrofluidics)”,《分析化学》,2012年4月17日;84(8):3599-606。
zhuj、zhangl、dongs、wange,“四路结点驱动的dna链置换和其在构建多数逻辑回路中的应用(four-wayjunction-drivendnastranddisplacementanditsapplicationinbuildingmajoritylogiccircuit)”,《美国化学会—纳米(acsnano.)》,2013年11月26日;7(11):10211-7。
zouc、weix、zhangz、liuc、zhouc、liuy,“基于dna链置换的四次模拟计算(four-analogcomputationbasedondnastranddisplacement)”,《美国化学会omega刊(acsomega)》,20172(8),4143-4160。
序列表
<110>威斯康星校友研究基金会(wisconsinalumniresearchfoundation)
<120>单细胞的高通量核酸谱分析
<130>09824097-p180094wo01
<150>us62/639,822
<151>2018-03-07
<160>73
<170>patentin版本3.5
<210>1
<211>1921
<212>dna
<213>智人
<400>1
gagtgagcggcgcggggccaatcagcgtgcgccgttccgaaagttgccttttatggctcg60
agcggccgcggcggcgccctataaaacccagcggcgcgacgcgccaccaccgccgagacc120
gcgtccgccccgcgagcacagagcctcgcctttgccgatccgccgcccgtccacacccgc180
cgccagctcaccatggatgatgatatcgccgcgctcgtcgtcgacaacggctccggcatg240
tgcaaggccggcttcgcgggcgacgatgccccccgggccgtcttcccctccatcgtgggg300
cgccccaggcaccagggcgtgatggtgggcatgggtcagaaggattcctatgtgggcgac360
gaggcccagagcaagagaggcatcctcaccctgaagtaccccatcgagcacggcatcgtc420
accaactgggacgacatggagaaaatctggcaccacaccttctacaatgagctgcgtgtg480
gctcccgaggagcaccccgtgctgctgaccgaggcccccctgaaccccaaggccaaccgc540
gagaagatgacccagatcatgtttgagaccttcaacaccccagccatgtacgttgctatc600
caggctgtgctatccctgtacgcctctggccgtaccactggcatcgtgatggactccggt660
gacggggtcacccacactgtgcccatctacgaggggtatgccctcccccatgccatcctg720
cgtctggacctggctggccgggacctgactgactacctcatgaagatcctcaccgagcgc780
ggctacagcttcaccaccacggccgagcgggaaatcgtgcgtgacattaaggagaagctg840
tgctacgtcgccctggacttcgagcaagagatggccacggctgcttccagctcctccctg900
gagaagagctacgagctgcctgacggccaggtcatcaccattggcaatgagcggttccgc960
tgccctgaggcactcttccagccttccttcctgggcatggagtcctgtggcatccacgaa1020
actaccttcaactccatcatgaagtgtgacgtggacatccgcaaagacctgtacgccaac1080
acagtgctgtctggcggcaccaccatgtaccctggcattgccgacaggatgcagaaggag1140
atcactgccctggcacccagcacaatgaagatcaagatcattgctcctcctgagcgcaag1200
tactccgtgtggatcggcggctccatcctggcctcgctgtccaccttccagcagatgtgg1260
atcagcaagcaggagtatgacgagtccggcccctccatcgtccaccgcaaatgcttctag1320
gcggactatgacttagttgcgttacaccctttcttgacaaaacctaacttgcgcagaaaa1380
caagatgagattggcatggctttatttgttttttttgttttgttttggtttttttttttt1440
ttttggcttgactcaggatttaaaaactggaacggtgaaggtgacagcagtcggttggag1500
cgagcatcccccaaagttcacaatgtggccgaggactttgattgcacattgttgtttttt1560
taatagtcattccaaatatgagatgcgttgttacaggaagtcccttgccatcctaaaagc1620
caccccacttctctctaaggagaatggcccagtcctctcccaagtccacacaggggaggt1680
gatagcattgctttcgtgtaaattatgtaatgcaaaatttttttaatcttcgccttaata1740
cttttttattttgttttattttgaatgatgagccttcgtgcccccccttccccctttttt1800
gtcccccaacttgagatgtatgaaggcttttggtctccctgggagtgggtggaggcagcc1860
agggcttacctgtacactgacttgagaccagttgaataaaagtgcacaccttaaaaatga1920
g1921
<210>2
<211>1921
<212>dna
<213>智人
<400>2
gagtgagcggcgcggggccaatcagcgtgcgccgttccgaaagttgccttttatggctcg60
agcggccgcggcggcgccctataaaacccagcggcgcgacgcgccaccaccgccgagacc120
gcgtccgccccgcgagcacagagcctcgcctttgccgatccgccgcccgtccacacccgc180
cgccagctcaccatggatgatgatatcgccgcgctcgtcgtcgacaacggctccggcatg240
tgcaaggccggcttcgcgggcgacgatgccccccgggccgtcttcccctccatcgtgggg300
cgccccaggcaccagggcgtgatggtgggcatgggtcagaaggattcctatgtgggcgac360
gaggcccagagcaagagaggcatcctcaccctgaagtaccccatcgagcacggcatcgtc420
accaactgggacgacatggagaaaatctggcaccacaccttctacaatgagctgcgtgtg480
gctcccgaggagcaccccgtgctgctgaccgaggcccccctgaaccccaaggccaaccgc540
gagaagatgacccagatcatgtttgagaccttcaacaccccagccatgtacgttgctatc600
caggctgtgctatccctgtacgcctctggccgtaccactggcatcgtgatggactccggt660
gacggggtcacccacactgtgcccatctacgaggggtatgccctcccccatgccatcctg720
cgtctggacctggctggccgggacctgactgactacctcatgaagatcctcaccgagcgc780
ggctacagcttcaccaccacggccgagcgggaaatcgtgcgtgacattaaggagaagctg840
tgctacgtcgccctggacttcgagcaagagatggccacggctgcttccagctcctccctg900
gagaagagctacgagctgcctgacggccaggtcatcaccattggcaatgagcggttccgc960
tgccctgcggcactcttccagccttccttcctgggcatggagtcctgtggcatccacgaa1020
actaccttcaactccatcatgaagtgtgacgtggacatccgcaaagacctgtacgccaac1080
acagtgctgtctggcggcaccaccatgtaccctggcattgccgacaggatgcagaaggag1140
atcactgccctggcacccagcacaatgaagatcaagatcattgctcctcctgagcgcaag1200
tactccgtgtggatcggcggctccatcctggcctcgctgtccaccttccagcagatgtgg1260
atcagcaagcaggagtatgacgagtccggcccctccatcgtccaccgcaaatgcttctag1320
gcggactatgacttagttgcgttacaccctttcttgacaaaacctaacttgcgcagaaaa1380
caagatgagattggcatggctttatttgttttttttgttttgttttggtttttttttttt1440
ttttggcttgactcaggatttaaaaactggaacggtgaaggtgacagcagtcggttggag1500
cgagcatcccccaaagttcacaatgtggccgaggactttgattgcacattgttgtttttt1560
taatagtcattccaaatatgagatgcgttgttacaggaagtcccttgccatcctaaaagc1620
caccccacttctctctaaggagaatggcccagtcctctcccaagtccacacaggggaggt1680
gatagcattgctttcgtgtaaattatgtaatgcaaaatttttttaatcttcgccttaata1740
cttttttattttgttttattttgaatgatgagccttcgtgcccccccttccccctttttt1800
gtcccccaacttgagatgtatgaaggcttttggtctccctgggagtgggtggaggcagcc1860
agggcttacctgtacactgacttgagaccagttgaataaaagtgcacaccttaaaaatga1920
g1921
<210>3
<211>19
<212>dna
<213>人工序列
<220>
<223>引物krt19lamp-3f3
<400>3
agtgacatgcgaagccaat19
<210>4
<211>20
<212>dna
<213>人工序列
<220>
<223>引物krt19lamp-3b3
<400>4
gctttcatgctcagctgtga20
<210>5
<211>41
<212>dna
<213>人工序列
<220>
<223>引物krt19lamp-3fip
<400>5
agcgacctcccggttcaattctcgagcagaaccggaaggat41
<210>6
<211>41
<212>dna
<213>人工序列
<220>
<223>krt19lamp-3bip
<400>6
cacacggagcagctccagatgtgcagctcaatctcaagacc41
<210>7
<211>19
<212>dna
<213>人工序列
<220>
<223>引物krt19lamp-3lf
<400>7
tggtgaaccaggcttcagc19
<210>8
<211>22
<212>dna
<213>人工序列
<220>
<223>引物krt19lamp-3lb
<400>8
aggtccgaggttactgacctgc22
<210>9
<211>17
<212>dna
<213>人工序列
<220>
<223>引物vimlamp-2f3
<400>9
ccgcaccaacgagaagg17
<210>10
<211>18
<212>dna
<213>人工序列
<220>
<223>引物vimlamp-2b3
<400>10
tggttagctggtccacct18
<210>11
<211>38
<212>dna
<213>人工序列
<220>
<223>引物vimlamp-2fip
<400>11
tccaggaagcgcaccttgtcggagctgcaggagctgaa38
<210>12
<211>40
<212>dna
<213>人工序列
<220>
<223>引物vimlamp-2bip
<400>12
aagatcctgctggccgagctcccgcatctcctcctcgtag40
<210>13
<211>17
<212>dna
<213>人工序列
<220>
<223>引物vimlamp-2lf
<400>13
agttggcgaagcggtca17
<210>14
<211>20
<212>dna
<213>人工序列
<220>
<223>引物vimlamp-2lb
<400>14
cagctcaagggccaaggcaa20
<210>15
<211>18
<212>dna
<213>人工序列
<220>
<223>引物esr1lamp-1f3
<400>15
agagctgccaacctttgg18
<210>16
<211>19
<212>dna
<213>人工序列
<220>
<223>引物esr1lamp-1b3
<400>16
tgaaccagctccctgtctg19
<210>17
<211>40
<212>dna
<213>人工序列
<220>
<223>引物esr1lamp-1fip
<400>17
ggcactgaccatctggtcggaagcccgctcatgatcaaac40
<210>18
<211>40
<212>dna
<213>人工序列
<220>
<223>引物esr1lamp-1bip
<400>18
ttgttggatgctgagccccccccatcatcgaagcttcact40
<210>19
<211>22
<212>dna
<213>人工序列
<220>
<223>引物esr1lamp-1lf
<400>19
gccaggctgttcttcttagagc22
<210>20
<211>25
<212>dna
<213>人工序列
<220>
<223>引物esr1lamp-1lb
<400>20
actctattccgagtatgatcctacc25
<210>21
<211>16
<212>dna
<213>人工序列
<220>
<223>引物gapdhlamp-2f3
<400>21
gctgccaaggctgtgg16
<210>22
<211>18
<212>dna
<213>人工序列
<220>
<223>引物gapdhlamp-2b3
<400>22
cccaggatgcccttgagg18
<210>23
<211>41
<212>dna
<213>人工序列
<220>
<223>引物gapdhlamp-2fip
<400>23
gttggcagtggggacacggaacaaggtcatccctgagctga41
<210>24
<211>38
<212>dna
<213>人工序列
<220>
<223>引物gapdhlamp-2bip
<400>24
tgtcagtggtggacctgacctgtccgacgcctgcttca38
<210>25
<211>18
<212>dna
<213>人工序列
<220>
<223>引物gapdhlamp-2lf
<400>25
ggccatgccagtgagctt18
<210>26
<211>25
<212>dna
<213>人工序列
<220>
<223>引物gapdhlamp-2lb
<400>26
cgtctagaaaaacctgccaaatatg25
<210>27
<211>17
<212>dna
<213>人工序列
<220>
<223>引物actb4b3-snp
<400>27
ggctggaagagtgccgc17
<210>28
<211>18
<212>dna
<213>人工序列
<220>
<223>引物actb4f3
<400>28
gcggctacagcttcacca18
<210>29
<211>42
<212>dna
<213>人工序列
<220>
<223>引物actb4fip
<400>29
cgtggccatctcttgctcgaaggggaaatcgtgcgtgacatt42
<210>30
<211>38
<212>dna
<213>人工序列
<220>
<223>引物actb4bip
<400>30
gcttccagctcctccctggaccgctcattgccaatggt38
<210>31
<211>20
<212>dna
<213>人工序列
<220>
<223>引物actb4lf
<400>31
acgtagcacagcttctcctt20
<210>32
<211>19
<212>dna
<213>人工序列
<220>
<223>引物actb4lb
<400>32
gaagagctacgagctgcct19
<210>33
<211>17
<212>dna
<213>人工序列
<220>
<223>引物actb4b3-库
<400>33
gcggcactcttccagcc17
<210>34
<211>30
<212>dna
<213>人工序列
<220>
<223>报告子repf
<400>34
cgagtgctgcgtatgacaagggctagcgtt30
<210>35
<211>30
<212>dna
<213>人工序列
<220>
<223>报告子repf-hex
<400>35
cgagtgctgcgtatgacaagggctagcgtt30
<210>36
<211>22
<212>dna
<213>人工序列
<220>
<223>报告子repq
<400>36
cccttgtcatacgcagcactcg22
<210>37
<211>30
<212>dna
<213>人工序列
<220>
<223>报告子repf2-af647
<400>37
cgccgcgtcctgatctaactgactgactgc30
<210>38
<211>22
<212>dna
<213>人工序列
<220>
<223>报告子repq2
<400>38
tcagttagatcaggacgcggcg22
<210>39
<211>60
<212>dna
<213>人工序列
<220>
<223>krt19->rep转导子门
<400>39
cgagtgctgcgtatgacaagggctagcgttatgctacgagcgacctcccggttcaattct60
<210>40
<211>30
<212>dna
<213>人工序列
<220>
<223>krt19->rep转导子输出
<400>40
aacgctagcccttgtcatacgcagcactcg30
<210>41
<211>58
<212>dna
<213>人工序列
<220>
<223>vim->rep转导子门
<400>41
cgagtgctgcgtatgacaagggctagcgttatgctacgtccaggaagcgcaccttgtc58
<210>42
<211>30
<212>dna
<213>人工序列
<220>
<223>vim->rep转导子输出
<400>42
aacgctagcccttgtcatacgcagcactcg30
<210>43
<211>88
<212>dna
<213>人工序列
<220>
<223>krt19与vim链1
<400>43
cgagtgctgcgtatgacaagggctagcgttatgctacgtccaggaagcgcaccttgtcat60
gctacgagcgacctcccggttcaattct88
<210>44
<211>88
<212>dna
<213>人工序列
<220>
<223>krt19与vim链2
<400>44
cgagtgctgcgtatgacaagggctagcgttatgctacgagcgacctcccggttcaattct60
atgctacgtccaggaagcgcaccttgtc88
<210>45
<211>88
<212>dna
<213>人工序列
<220>
<223>krt19或vim门
<400>45
cgagtgctgcgtatgacaagggctagcgttatgctacgtccaggaagcgcaccttgtcat60
gctacgagcgacctcccggttcaattct88
<210>46
<211>30
<212>dna
<213>人工序列
<220>
<223>krt19或vim输出
<400>46
aacgctagcccttgtcatacgcagcactcg30
<210>47
<211>20
<212>dna
<213>人工序列
<220>
<223>vimf1
<400>47
gacaaggtgcgcttcctgga20
<210>48
<211>22
<212>dna
<213>人工序列
<220>
<223>krt19f1
<400>48
agaattgaaccgggaggtcgct22
<210>49
<211>60
<212>dna
<213>人工序列
<220>
<223>krt19转导子2门
<400>49
ctgctctcacggaggcgcaccggtaagggtcatcgatgagcgacctcccggttcaattct60
<210>50
<211>58
<212>dna
<213>人工序列
<220>
<223>vim转导子2门
<400>50
ctgctctcacggaggcgcaccggtaagggtcatcgatgtccaggaagcgcaccttgtc58
<210>51
<211>35
<212>dna
<213>人工序列
<220>
<223>krt19/vim转导子2输出
<400>51
cgatgacccttaccggtgcgcctccgtgagagcag35
<210>52
<211>45
<212>dna
<213>人工序列
<220>
<223>krt19与vim门
<400>52
cgagtgctgcgtatgacaagggctagcgttatgctgctctcacgg45
<210>53
<211>30
<212>dna
<213>人工序列
<220>
<223>krt19与vim输出
<400>53
aacgctagcccttgtcatacgcagcactcg30
<210>54
<211>50
<212>dna
<213>人工序列
<220>
<223>krt19与vim阈值
<400>54
ccgctggtgatcactctgctctcacggaggcgcaccggtaagggtcatcg50
<210>55
<211>60
<212>dna
<213>人工序列
<220>
<223>krt19转导子3门
<400>55
cgcgatccgagtgctgcgtatgacaagggctagcgtttgccggaagcgacctcccggttc60
<210>56
<211>60
<212>dna
<213>人工序列
<220>
<223>vim转导子3门
<400>56
cgcgatccgagtgctgcgtatgacaagggctagcgtttgccggatccaggaagcgcacct60
<210>57
<211>44
<212>dna
<213>人工序列
<220>
<223>krt19/vim转导子3输出
<400>57
tccggcaaacgctagcccttgtcatacgcagcactcggatcgcg44
<210>58
<211>60
<212>dna
<213>人工序列
<220>
<223>vim转导子4门
<400>58
ccatcgcggagacacggacatcgttaaggcagcctgtaggcagcctccaggaagcgcacc60
<210>59
<211>60
<212>dna
<213>人工序列
<220>
<223>krt19转导子4门
<400>59
gtgtctccgcgatggcgagtgctgcgtatgacaagggctagcgttagcgacctcccggtt60
<210>60
<211>45
<212>dna
<213>人工序列
<220>
<223>krt19与非vim抑制剂
<400>60
ggctgcctacaggctgccttaacgatgtccgtgtctccgcgatgg45
<210>61
<211>45
<212>dna
<213>人工序列
<220>
<223>krt19与非vim输出
<400>61
aacgctagcccttgtcatacgcagcactcgccatcgcggagacac45
<210>62
<211>60
<212>dna
<213>人工序列
<220>
<223>krt19->rep2转导子门
<400>62
gtgtctccgcgatggcgccgcgtcctgatctaactgactgactgcagcgacctcccggtt60
<210>63
<211>45
<212>dna
<213>人工序列
<220>
<223>krt19->rep2转导子输出
<400>63
gcagtcagtcagttagatcaggacgcggcgccatcgcggagacac45
<210>64
<211>55
<212>dna
<213>人工序列
<220>
<223>ck19感应子
<400>64
gagttaccagcctggagttctcaatggtggcctggtaactcactgaccgagctaa55
<210>65
<211>67
<212>dna
<213>人工序列
<220>
<223>寡核苷酸h1
<400>65
cgacatctaacctagctcactgaccgagctaagctgttctcgattagctcggtcagtgag60
ttaccag67
<210>66
<211>46
<212>dna
<213>人工序列
<220>
<223>寡核苷酸h2
<400>66
gctgttctcgatcactgaccgagctaatcgagaacagcttagctcg46
<210>67
<211>67
<212>dna
<213>人工序列
<220>
<223>寡核苷酸h3
<400>67
gtcagtgagctaggttagatgtcgccatgtgtagacgacatctaacctagcccttgtcat60
agagcac67
<210>68
<211>46
<212>dna
<213>人工序列
<220>
<223>寡核苷酸h4
<400>68
agatgtcgtctacacatggcgacatctaacctagcccatgtgtaga46
<210>69
<211>27
<212>dna
<213>人工序列
<220>
<223>寡核苷酸repf-cha
<400>69
cgagtgctctatgacaagggctaggtt27
<210>70
<211>20
<212>dna
<213>人工序列
<220>
<223>寡核苷酸repq-cha
<400>70
cccttgtcatagagcactcg20
<210>71
<211>21
<212>dna
<213>人工序列
<220>
<223>寡核苷酸ck19输入
<400>71
gccaccattgagaactccagg21
<210>72
<211>1496
<212>dna
<213>人工序列
<220>
<223>krt19gblock
<400>72
caggtctcgtatgagatatccgcccctgacaccattcctcccttcccccctccaccggcc60
gcgggcataaaaggcgccaggtgagggcctcgccgctcctcccgcgaatcgcagcttctg120
agaccagggttgctccgtccgtgctccgcctcgccatgacttcctacagctatcgccagt180
cgtcggccacgtcgtccttcggaggcctgggcggcggctccgtgcgttttgggccggggg240
tcgcctttcgcgcgcccagcattcacgggggctccggcggccgcggcgtatccgtgtcct300
ccgcccgctttgtgtcctcgtcctcctcgggggcctacggcggcggctacggcggcgtcc360
tgaccgcgtccgacgggctgctggcgggcaacgagaagctaaccatgcagaacctcaacg420
accgcctggcctcctacctggacaaggtgcgcgccctggaggcggccaacggcgagctag480
aggtgaagatccgcgactggtaccagaagcaggggcctgggccctcccgcgactacagcc540
actactacacgaccatccaggacctgcgggacaagattcttggtgccaccattgagaact600
ccaggattgtcctgcagatcgacaatgcccgtctggctgcagatgacttccgaaccaagt660
ttgagacggaacaggctctgcgcatgagcgtggaggccgacatcaacggcctgcgcaggg720
tgctggatgagctgaccctggccaggaccgacctggagatgcagatcgaaggcctgaagg780
aagagctggcctacctgaagaagaaccatgaggaggaaatcagtacgctgaggggccaag840
tgggaggccaggtcagtgtggaggtggattccgctccgggcaccgatctcgccaagatcc900
tgagtgacatgcgaagccaatatgaggtcatggccgagcagaaccggaaggatgctgaag960
cctggttcaccagccggactgaagaattgaaccgggaggtcgctggccacacggagcagc1020
tccagatgagcaggtccgaggttactgacctgcggcgcacccttcagggtcttgagattg1080
agctgcagtcacagctgagcatgaaagctgccttggaagacacactggcagaaacggagg1140
cgcgctttggagcccagctggcgcatatccaggcgctgatcagcggtattgaagcccagc1200
tgggcgatgtgcgagctgatagtgagcggcagaatcaggagtaccagcggctcatggaca1260
tcaagtcgcggctggagcaggagattgccacctaccgcagcctgctcgagggacaggaag1320
atcactacaacaatttgtctgcctccaaggtcctctgaggcagcaggctctggggcttct1380
gctgtcctttggagggtgtcttctgggtagagggatgggaaggaagggacccttaccccc1440
ggctcttctcctgacctgccaataaaaatttatggtccaagggtgagcgagaccac1496
<210>73
<211>706
<212>dna
<213>人工序列
<220>
<223>vimgblock
<400>73
caggtctcgtatgccacccacacccaccgcgccctcgttcgcctcttctccgggagccag60
tccgcgccaccgccgccgcccaggccatcgccaccctccgcagccatgtccaccaggtcc120
gtgtcctcgtcctcctaccgcaggatgttcggcggcccgggcaccgcgagccggccgagc180
tccagccggagctacgtgactacgtccacccgcacctacagcctgggcagcgcgctgcgc240
cccagcaccagccgcagcctctacgcctcgtccccgggcggcgtgtatgccacgcgctcc300
tctgccgtgcgcctgcggagcagcgtgcccggggtgcggctcctgcaggactcggtggac360
ttctcgctggccgacgccatcaacaccgagttcaagaacacccgcaccaacgagaaggtg420
gagctgcaggagctgaatgaccgcttcgccaactacatcgacaaggtgcgcttcctggag480
cagcagaataagatcctgctggccgagctcgagcagctcaagggccaaggcaagtcgcgc540
ctgggggacctctacgaggaggagatgcgggagctgcgccggcaggtggaccagctaacc600
aacgacaaagcccgcgtcgaggtggagcgcgacaacctggccgaggacatcatgcgcctc660
cgggagaaattgcaggaggagatgcttcagagatgagcgagaccac706
- 还没有人留言评论。精彩留言会获得点赞!