双特异性和多特异性生物制剂的区室化测定法的制作方法
对相关申请的交叉引用
本国际申请要求享有于2018年12月21日提交的美国临时专利申请序列号67/784,171和于2018年10月8日提交的美国临时专利申请序列号67,742/837的优先权权益,其内容通过引用以其整体并入本文。
本公开涉及基于区室化纳米体积的生物测定法的各种实施方案,更具体地,涉及用于一般应用(特别是治疗用途)的双特异性和多特异性生物制剂的基于微流体液滴或微室的测定法。
发明背景
双特异性和多特异性生物制剂是能够与包括配体和受体在内的相同或不同靶标的至少两个分子位点接合的单一生物分子。实例包括双特异性抗体(bsabs),免疫细胞因子(即,抗体部分与细胞因子部分的融合物)和嵌合细胞因子,作为用于双重或多价靶向策略的新颖且日益重要的方法。一些bsab可能对疾病治疗有用。
通常,可使用多步骤方法通过两个或更多个功能部分(或亚基)的合理或随机配对或组装来筛选双特异性或多特异性生物制剂,其中生物制剂的单个部分在细胞中或体外共表达和组装,分别体外测试所得到的各自代表生物制剂变体的单个组装体的靶标结合或功能活性。可选择地,将单个组装体展示在细胞表面上并进行结合测定法,其中阳性结合物经选择、克隆、进一步表达并用功能验证测定法进行筛选。
随着临床开发的进展,对创新而稳健的平台技术存在日益增长的需求,以能够高效筛选功能活性的双特异性抗体,以及更广泛的双特异性和多特异性生物制剂。
发明概述
以下
技术实现要素:
仅是说明性的,而无意于以任何方式进行限制。换言之,提供以下概述以介绍本文所述的系统、方法、技术和设备的新颖且非显而易见的实施方案的概念、重点、益处和优点。下面的详细描述中进一步描述选择的实现。因此,以下概述既不旨在标识所要求保护主题的必要特征,也不旨在用于确定所要求保护主题的范围。
一些实施方案利用结合细胞工程和生物学测定法的微流体技术。根据一些实施方案,本文提供的方法避免了在常规测定方法中对双特异性或多特异性生物制剂的单个部分的偏向选择的问题。纳米体积液滴或微室的使用还允许从大量候选物中更深入且有效地在单细胞水平筛选功能性生物制剂,而无需大的样品体积。
在一些实施方案中,本文提供了用于在区室化纳米体积中筛选双特异性或多特异性生物制剂的方法。在一些实施方案中,给各个区室化纳米体积基本上提供了至少两种不同类型细胞,其中工程化改造第一类型细胞以表达所述生物制剂的每个细胞的单一变体,其中选择第二细胞以在功能性双特异性或多特异性生物制剂触发时产生报告物信号,其中所述第一细胞和第二细胞中至少一种伴随表达所述生物制剂的一个或多个不同细胞表面靶标。功能性生物制剂的适当表达、组装和分泌及其与意图分子靶标的相互作用在纳米体积内产生阳性报告物信号,从而允许检测和回收表达生物制剂的细胞,并随后遗传鉴定所述生物制剂的相应功能性变体。
如本文所公开,一些实施方案涉及用于在区室化纳米体积中进行测定法以筛选功能性双特异性或多特异性生物制剂的方法。在一些实施方案中,该方法包括提供多个至少两种不同类型细胞,其中工程化改造两个或更多个第一类型细胞以基本上以分泌形式表达双特异性或多特异性生物制剂的每个细胞的单一遗传变体,其中选择或工程化改造两个或更多个第二类型细胞以产生阳性报告物信号分子,该阳性报告物信号分子由第一类型细胞表达的所述生物制剂的功能性变体触发,从而提供了多个区室化纳米体积,其中给两个或更多个纳米体积各自基本上提供一个第一类型细胞和一个或多个第二类型细胞,在一段时间内温育所述纳米体积以允许所述生物制剂在所述纳米体积内表达和分泌,收集代表由所述纳米体积内分泌的生物制剂触发的阳性报告物信号分子的数据。在一些实施方案中,该方法进一步包括从具有阳性报告物信号分子的纳米体积中回收细胞,并提取代表生物制剂的相应功能性变体的遗传信息。
在一些实施方案中,区室化纳米体积是具有约0.03nl至约100nl的均一或接近均一尺寸的微室或微滴。在一些实施方案中,尺寸(如,体积)在约0.1nl至约4nl的范围内。在其他实施方案中,体积可在约0.03至约100nl的范围内,包括在所列出的那些之间(并且包括所列出的那些)的任何体积。
在一些实例中,双特异性或多特异性生物制剂包括至少两个不同的靶标结合部分。取决于实施方案,靶标结合部分可以是igg重链、igg轻链、scfv、fab、fab'、f(ab')2、单结构域抗体、vhh抗体、纳米抗体、非抗体替代支架、细胞表面蛋白的细胞外片段、趋化因子或趋化因子样分子、细胞因子或细胞因子样分子,以及前述分子的组合或衍生物。
在一些实施方案中,所述生物制剂的靶标结合部分彼此连接。例如,在一些实施方案中,它们通过至少一个非靶标结合部分连接,所述非靶标结合部分选自异源二聚化结构域、异源三聚化结构域、长度为约2个至约30个氨基酸或约10个至约50个氨基酸的接头肽。在使用多特异性结合部分的实施方案中,接头可以是相同类型(如,结构域和/或长度)或者类型和/或长度可变化。
在一些实施方案中,双特异性生物制剂是包括共同igg轻链加上两个不同igg重链的抗体。在一些实施方案中,双特异性生物制剂是包括共同igg重链加上两个不同igg轻链的抗体。
在一些实施方案中,双特异性生物制剂是包括两个不同部分的抗体。例如,在一些实施方案中,部分(个别)选自scfv、fab、vhh和单结构域抗体。在一些实施方案中,部分通过约2个至约30个氨基酸的接头肽融合为单一嵌合多肽。
在一些实施方案中,双特异性生物制剂是免疫细胞因子,其包括与细胞因子或其细胞因子样多肽融合的抗体或抗体衍生物或抗体样分子。
在一些实施方案中,双特异性生物制剂是包括至少两种不同细胞因子或其细胞因子样多肽的嵌合融合蛋白。
在一些实施方案中,第一类型细胞用整合到第一类型细胞基因组的一个或多个不同表达盒或媒介物进行工程化改造。因此,第一类型细胞表达来自整合的表达盒或媒介物的所述生物制剂的单一遗传变体。
在一些实施方案中,双特异性或多特异性生物制剂靶向由区室化纳米体积提供的至少一个细胞表达的细胞表面靶标上或者两个或更多个不同细胞表面靶标上的两个或更多个不同位置。
在一些实施方案中,第二类型细胞中的阳性报告物信号分子是荧光蛋白,致荧光性分子或荧光分子或复合物。在一些实施方案中,第二细胞的阳性报告物信号分子是萤光素酶,致发光性分子或复合物。在一些实施方案中,阳性报告物信号分子由整合到第二类型细胞基因组的一个或多个表达盒进行遗传编码。
在一些实施方案中,阳性报告物信号分子是第二类型细胞中的细胞表面靶标下游的效应分子,其中由第一类型细胞表达的功能性生物制剂的靶标结合触发所述效应分子的累积,从而产生代表由第一细胞表达的生物制剂与第二细胞的靶标已成功地相互作用的可检测信号。
在一些实施方案中,阳性报告物信号分子是分别与所述生物制剂的两个不同靶标缀合的配对的fret供体和受体对。
在一些实施方案中,阳性报告物信号分子通过连接聚合酶链式反应(pcr),然后对连接pcr产物进行遗传测序来进行遗传检测,所述连接聚合酶链式反应(pcr)将编码报告物的序列与代表所述生物制剂的序列连接。
在一些实施方案中,提供了三种不同类型细胞,其中工程化改造第一类型细胞以表达所述生物制剂的单一变体,选择或工程化改造第二类型细胞以充当报告细胞,以及选择第三类型细胞作为表达靶标的细胞。
在一些实施方案中,通过使用光学检测装置检测源自报告物的光信号来收集代表阳性报告物信号分子激活的数据。在一些实施方案中,通过测序连接的核酸序列来收集代表阳性报告物信号分子激活的数据,该核酸序列在一部分中代表报告物基因转录物,而在另一部分中代表所述生物制剂。
在一些实施方案中,至少两种不同类型细胞是哺乳动物细胞,或哺乳动物细胞的衍生物或工程化形式。在一些实施方案中,至少两种不同类型细胞包括哺乳动物细胞,并且另一种是酵母或真菌细胞。在一些实施方案中,两种或更多种第一类型细胞是二倍体酵母细胞,并且其中两种或更多种第二类型细胞是哺乳动物细胞。在一些实施方案中,二倍体酵母细胞源自相反交配型的两个单倍体菌株之间的交配,其中工程化改造第一单倍体菌株以基本上表达各自编码所述生物制剂的至少一个部分的单一遗传变体,以及工程化改造第二单倍体菌株以基本上表达编码所述生物制剂的一个或多个其余部分的单一遗传变体。
一些方面涉及用于在区室化纳米体积中进行测定法以筛选功能性双特异性或多特异性生物制剂的方法,该方法包括提供多个区室化纳米体积,其中给两个或更多个纳米体积各自基本上提供单个二倍体酵母细胞和至少一个哺乳动物细胞,其中工程化改造所述酵母细胞以分泌形式表达双特异性或多特异性生物制剂的单一遗传变体,其中选择所述哺乳动物细胞以产生由酵母细胞表达的所述生物制剂的功能性变体触发的报告物信号,在一段时间内温育区室化纳米体积以允许生物制剂在所述纳米体积内表达和分泌,收集代表由纳米体积内分泌的功能性生物制剂触发的阳性报告物信号,以及从具有阳性报告物信号的纳米体积中回收细胞。在一些实施方案中,该方法进一步包括提取代表生物制剂的相应功能性变体的遗传信息。
在一些实施方案中,二倍体酵母细胞源自相反交配型的两个单倍体菌株之间的交配,其中工程化改造第一单倍体菌株以基本上表达各自编码所述生物制剂的至少一个部分的单一遗传变体,以及工程化改造第二单倍体菌株以基本上表达编码所述生物制剂的一个或多个其余部分的单一遗传变体。
在一些实例中,区室化纳米体积是具有约0.03nl至约100nl,或约0.1nl至约4nl的均一或近似均一尺寸的微流体微室或液滴。
在一些实例中,双特异性或多特异性生物制剂包括至少两个功能不同的靶标结合部分,所述结合部分选自igg重链,igg轻链,scfv,fab,fab',f(ab')2,单结构域抗体,vhh结构域抗体,纳米抗体,非抗体替代支架,细胞因子或细胞因子样多肽,细胞表面蛋白的细胞外片段,趋化因子或趋化因子样分子,及前述分子的其组合或衍生物。
在一些实例中,所述生物制剂的靶标结合部分通过所述生物制剂的至少一个非靶标结合部分连接,所述非靶标结合部分选自异源二聚化结构域,异源三聚化结构域,具有约2个至约30个氨基酸或约10个至约50个氨基酸长度的接头肽,或前述结构域和接头的组合。
在一些实例中,双特异性生物制剂是包括共同igg轻链加上两个不同igg重链的抗体,或者是包括共同igg重链加上两个不同igg轻链的抗体。
在一些实例中,双特异性生物制剂是免疫细胞因子,其包括抗体或抗体衍生物或抗体样分子和细胞因子或细胞因子样分子。
在一些实例中,双特异性生物制剂是单一嵌合融合蛋白或包含至少两种不同的细胞因子或细胞因子样分子的复合物。
一些方面涉及用于筛选多特异性生物制剂的功能性变体的系统,其包括:
多个液滴或微室,每个液滴或微室包括:
第一细胞,其包含编码多特异性生物制剂的第一组分的遗传变体的核酸序列,并且包含编码多特异性生物制剂的第二组分的遗传变体的核酸序列;
第二细胞,其包含编码报告物分子的核酸序列;
其中第一细胞或第二细胞包含用于第一组分的第一靶标,并且其中第二细胞包含用于第二组分的第二靶标;
并且其中当第一组分结合第一靶标且第二组分结合第二靶标时转录报告物,表明多特异性生物制剂的第一组分和第二组分的遗传变体编码多特异性生物制剂的功能形式。
在一些实例中,多特异性生物制剂包括双特异性或三特异性生物制剂。
在一些实例中,生物制剂包括抗体、细胞因子或免疫细胞因子。
一些方面涉及用于直接筛选包括双特异性抗体、细胞因子或免疫细胞因子的功能性变体的组分的适当配对的区室化系统,该系统包括多个液滴或微室,每个液滴或微室包括第一哺乳动物细胞和第二哺乳动物细胞,所述第一哺乳动物细胞包含编码双特异性抗体、细胞因子或免疫细胞因子的第一组分的遗传变体的核酸和编码双特异性抗体、细胞因子或免疫细胞因子的第二组分的遗传变体的核酸,所述第二哺乳动物细胞包含第一靶标、第二靶标和编码报告物分子的核酸,其中功能性双特异性抗体、细胞因子或免疫细胞因子激活第一靶标和第二靶标时转录报告物,其中如果双特异性抗体、细胞因子或免疫细胞因子的第一组分和第二组分的遗传变体是功能性变体且结合在一起形成双特异性抗体、细胞因子或免疫细胞因子,则双特异性抗体、细胞因子或免疫细胞因子的第一组分和第二组分是功能性的且与第一靶标和第二靶标结合。
一些方面涉及用于筛选多特异性生物制剂的功能性变体的方法,其包括提供第一dna文库,所述第一dna文库包括多特异性生物制剂的第一组分的遗传变体文库,提供第二dna文库,所述第二dna文库包括多特异性生物制剂的第二组分的遗传变体文库,将第一dna文库和第二dna文库引入多个细胞以获得细胞文库,其中细胞文库的细胞表达第一组分和第二组分的变体,将细胞文库的细胞引入液滴(或微室),其中至少两个液滴各自基本上包含细胞文库的单个细胞,将报告细胞引入液滴中,其中至少两个液滴各自包含一个或多个报告细胞,温育液滴,检测由报告细胞产生的信号;以及基于检测信号,鉴定哪些液滴包括多特异性生物制剂的功能性变体。
一些方面涉及用于直接筛选包括双特异性抗体、细胞因子或免疫细胞因子的功能性变体的组分的适当配对的方法,该方法包括提供第一dna文库,该第一dna文库包括双特异性抗体、细胞因子或免疫细胞因子的第一组分的遗传变体文库,提供第二(或进一步)dna文库,该第二(或进一步)dna文库包括双特异性抗体、细胞因子或免疫细胞因子的第二组分的遗传变体文库,将第一dna文库和第二(和/或进一步)dna文库引入多个细胞以获得细胞文库,其中细胞文库的每个细胞基本上表达相对于细胞文库的每个其他细胞的第一组分的不同变体和第二组分的不同变体,将细胞文库的细胞引入液滴中,其中至少两个液滴各自基本上包含细胞文库的单个细胞,将多个报告细胞引入液滴中,其中每个液滴还包括报告细胞,该报告细胞包含第一靶标、第二靶标和编码报告物分子的核酸,其中功能性双特异性抗体、细胞因子或免疫细胞因子激活第一靶标和第二靶标时转录报告物分子,从而产生报告物信号,温育液滴以允许每个微滴中双特异性抗体、细胞因子或免疫细胞因子的第一组分和第二组分转录和组装,其中如果双特异性抗体、细胞因子或免疫细胞因子的第一组分和第二组分的遗传变体是功能性变体且结合在一起形成双特异性抗体、细胞因子或免疫细胞因子,则每个微滴中双特异性抗体、细胞因子或免疫细胞因子的第一组分和第二组分是功能性的且与第一靶标和第二靶标结合,以及检测报告物信号。在一些实施方案中,该方法进一步包括基于检测的报告物信号,鉴定哪些液滴包括双特异性抗体、细胞因子或免疫细胞因子的功能性变体。
在一些实例中,细胞文库的每个细胞包括第一组分的个别变体和第二组分的个别变体。
在一些实例中,多特异性生物制剂包括双特异性生物制剂或三特异性生物制剂。
在一些实例中,生物制剂包括抗体、细胞因子或免疫细胞因子。
在一些实例中,鉴定哪些液滴包括多特异性生物制剂的功能性变体包括测序液滴中细胞的核酸。
一些方面涉及用于在区室化纳米体积中进行测定法以筛选功能性双特异性或多特异性生物制剂的方法,其包括:提供多个至少两种不同类型细胞,其中两个或更多个第一类型细胞(1)工程化改造为基本上以分泌形式表达双特异性或多特异性生物制剂的每个细胞的单一遗传变体,(2)工程化改造或选择为表达意图用于生物制剂的至少一个靶标,并且(3)工程化改造或选择为产生阳性报告物信号分子,该阳性报告物信号分子由所述生物制剂的功能性变体触发,所述生物制剂的功能性变体将第一类型细胞与至少表达意图用于所述生物制剂的另一种不同靶标的不同第二类型细胞接合,提供多个区室化纳米体积,其中给两个或更多个纳米体积各自基本上提供一个第一类型细胞和一个或多个第二类型细胞,在一段时间内温育所述纳米体积以允许所述生物制剂在所述纳米体积内的表达和分泌,收集代表由所述纳米体积内分泌的生物制剂触发的阳性报告物信号分子的数据,以及从具有阳性报告物信号分子的纳米体积中回收细胞,并提取代表生物制剂的相应功能性变体的遗传信息。
附图简述
包括附图以提供对本公开的进一步理解,并且将附图并入本说明书中并构成本说明书的一部分。附图示出了本公开的实施方案,并且与说明书一起用于解释本公开的原理。为了更好地呈现所示出的主题的某些特征,附图不一定按比例绘制。除非另有说明,否则各个附图中的相似注释符号指示相似元素。
图1示出用于双靶标结合双特异性生物制剂的基于区室化纳米体积的测定法的一些实施方案的一般原理和特征,所述双靶标结合双特异性生物制剂包含具有两个靶标结合部分和一个非靶标结合部分的单一嵌合蛋白(图1a),或包含两个亚基,每个亚基具有靶标结合部分和非靶标结合部分(图1b)。
图2(a)和(b)描绘了用于双靶标结合双特异性生物制剂的基于区室化纳米体积的测定法的一些实施方案的一般原理和特征。
图3是示意图,示出用于双靶标双特异性生物制剂的利用三种不同类型细胞的基于区室化纳米体积的测定法的一些实施方案的一般原理和特征。
图4(a)和(b)是示意图,示出用于一靶标-二位置结合的双特异性生物制剂的基于区室化纳米体积的测定法的一些实施方案的一般原理和特征。
图5(a)和(b)描绘了用于三靶标结合的多特异性生物制剂的基于区室化纳米体积的测定的一些实施方案的一般原理和特征。
图6(a)和(b)描绘了用于包含三个或四个部分的双靶标结合的双特异性生物制剂的利用三种不同类型细胞的基于区室化纳米体积的测定的一些实施方案的一般原理和特征。
图7(a)和(b)是示出用于三靶标多特异性生物制剂的基于区室化纳米体积的测定法的一些实施方案的一般原理和特征的示意图。
图8(a)和(b)描绘了用于三靶标多特异性生物制剂的基于区室化纳米体积的测定法的一些实施方案的一般原理和特征。
图9描绘了筛选功能性共同轻链双特异性抗体(bsab)的基于液滴的测定法的非限制性实例。
图10描绘了筛选共同轻链bsab的基于微室的测定法的非限制性实例。
图11(a)和(b)描绘了筛选双特异性scfv融合蛋白的基于液滴的测定法的非限制性实例。
图12描绘了筛选双特异性免疫细胞因子(抗体和细胞因子的嵌合融合蛋白)的基于液滴的测定法的非限制性实例。
图13描绘了筛选液滴中双特异性免疫细胞因子(抗体和细胞因子的嵌合融合物)的区室化测定法的非限制性实例。
图14描绘了筛选液滴中三特异性细胞因子融合物(三种不同细胞因子的嵌合蛋白)的区室化测定法的非限制性实例。
图15描绘了筛选靶向细胞表面上相同gpcr靶标上的两个位置的激动性共同轻链bsab的基于液滴的测定法的非限制性实例。
图16描绘了筛选靶向细胞表面上相同离子通道靶标上的两个位置的激动性共同轻链bsab的基于液滴的测定法的非限制性实例。
图17(a)和(b)描绘了通过基于fret的报告物筛选两个不同细胞表面靶标的共同轻链bsab的基于液滴的测定法的非限制性实例。
图18描绘了基于抗体依赖性细胞介导的细胞毒性(adcc),利用三种不同类型细胞筛选靶向癌细胞上的两个分子靶标的共同轻链bsab的液滴测定法的实例。
图19(a)描绘了液滴测定法的实例,显示了靶标细胞(第一细胞)和t细胞(第二细胞)上bite(抗cd3xcd19bite)的作用机理;(b)细胞图像;(c)报告物gfp强度(±raji细胞)。
图20的图示出用于在区室化纳米体积中对功能性双特异性或多特异性生物制剂进行测定法的非限制性工作流程和过程。
图21的图示出在区室化纳米体积中对功能性双特异性或多特异性生物制剂进行测定法的工作流程和过程的非限制性示例。
图22的图示出在区室化纳米体积中对功能性双特异性或多特异性生物制剂进行筛选测定法的工作流程的非限制性示例,所述测定法涉及使用表达生物制剂的单一变体的酵母细胞。
图23.包括nanopenstm微室的半封闭微室装置(如,berkeleylights公司,optoselecttm装置)。
图24.由薄膜或塑料层封闭的半封闭微室装置(如,singlecelltechnologies的微流体装置(usa))。
图25.编码亚基的替代设计。编码生物制剂的全部组分(亚基)都整合到细胞-2中。
图26描绘了通过使用3d打印机用可生物降解的软固体聚合物材料打印的替代微室样装置。
发明详述
本文公开了要求保护主题的详细实施方案。然而,应当理解,所公开的实施方案仅是可以以各种形式体现的所要求保护主题的示例。然而,本公开可以以许多不同的形式来体现,并且不应解释为限于本文示出的示例性实施方案。相反,提供这些示例性实施方案是为了使本公开的描述透彻和完整,并将向本领域技术人员充分传达本公开的范围。在下面的描述中,可省略众所周知的特征和技术的细节,以避免不必要地混淆所呈现的实施方案。
概述
本文所述系统和方法的一些实施方案涉及在区室化纳米体积中的生物学测定法,包括用于在微流体装置中的多个区室化纳米体积中从双特异性或多特异性生物制剂的工程化文库直接快速筛选功能性单一变体的一般测定原理、方案、组分和方法。如本文所用,纳米体积应指具有范围为约0.03nl至约100nl(又称为纳升)的均一或接近均一体积的纳升和纳升以下的微流体液滴或微室。在一些实施方案中,体积范围为约0.05至约10nl。在一些实例中,纳米体积为约0.1nl、0.2nl、0.3nl、0.4nl、0.5nl、0.6nl、0.7nl、0.8nl、0.9nl、1nl、2nl、3nl、4nl、5nl、6nl、7nl、8nl、9nl、10nl、11nl、12nl、13nl、14nl、15nl、16nl、17nl、18nl、19nl、20nl、21nl、22nl、23nl、24nl、25nl、26nl、27nl、28nl、29nl、30nl、31nl、32nl、33nl、34nl、35nl、36nl、37nl、38nl、39nl、40nl、41nl、42nl、43nl、44nl、45nl、46nl、47nl、48nl、49nl、50nl、51nl、52nl、53nl、54nl、55nl、56nl、57nl、58nl、59nl、60nl、61nl、62nl、63nl、64nl、65nl、66nl、67nl、68nl、69nl、70nl、71nl、72nl、73nl、74nl、75nl、76nl、77nl、78nl、79nl、80nl、81nl、82nl、83nl、84nl、85nl、86nl、87nl、88nl、89nl、90nl、91nl、92nl、93nl、94nl、95nl、96nl、97nl、98nl、99nl或100nl。在一些实施方案中,体积范围为约0.1nl至约4nl,约0.1nl至约1nl或约5nl至约10nl。
在一些实施方案中,区室化纳米体积包括液滴。在其他实施方案中,区室化纳米体积包括于封闭或半封闭的装置内。
如本文所用,液滴应给予其通常含义,并且是指油包水乳剂,例如一定体积的离散水性微区室,其包囊由互不相溶的油相包围的水性液体。如本文所用,微室应给予其通常的含义,并且通常是指用于含有单相水性液体的一定体积的微流体室或微孔。如本领域技术人员将理解,微室可具有代表选自立方体、长方体、圆柱体、梯形、球体和椭圆体的一个或多个多面体的几何结构、特征或形状。
如本文所用,双特异性生物制剂应给予其通常含义,并且是指包含至少两个靶标结合部分的整个单分子或复合物,所述靶标结合部分选自蛋白或其蛋白片段、肽、糖或核酸或这些任何物质的其任何复合组合,其中所述生物制剂旨在结合同一靶标分子上或者两个不同靶标分子上的两个分子位点。
如本文所用,多特异性生物制剂应给予其通常含义,并且应指包含至少三个靶标结合部分的整个单分子或复合物,所述靶标结合部分选自蛋白或其蛋白片段、肽、糖或核酸或这些任何物质的其任何复合组合,其中所述生物制剂旨在结合同一靶标分子上或者两个或三个不同靶标分子上的三个或更多个分子位点。
在一些实施方案中,双特异性或多特异性生物制剂包含的优选靶标结合部分是蛋白、蛋白片段、肽或这些物质的其组合。在一些实施方案中,更优选的靶标结合部分是:(1)抗体和抗体样分子,以及这些所述分子的其他衍生物或工程化形式;(2)细胞因子或细胞因子样分子,包括细胞因子、生长因子、趋化因子、细胞膜的细胞外结构域或诸如受体的表面蛋白,以及这些分子的进一步衍生物或工程化形式;(3)非抗体替代支架;(4)以上(1)、(2)和(3)与抗体-细胞因子融合物或免疫细胞因子以及它们的衍生物和修饰的各种形式的示例性实例的组合或对。
一方面,技术人员应理解,代表抗体衍生物的部分可选自scfv(即,单链可变片段)、fab、fab'、f(ab')2、单结构域抗体、crossmab、vhh结构域抗体、纳米抗体、igg重链、igg轻链、以及这些抗体衍生物分子的工程化形式或组合物。在一些实施方案中,优选的抗体衍生物是单链(igg重链或轻链)、scfv、fab、crossmab、vhh结构域抗体和纳米抗体。另一方面,本领域技术人员还应理解,非抗体替代支架可选自affibody、affilin、alphabody、knottin、darpin、anticalin、kunitz域肽、fn3支架、fynomer、cys-knots、单体、affimer和凝集素域。
如本领域技术人员将理解,代表细胞因子或细胞因子样分子的部分可选自细胞因子、趋化因子、生长因子、细胞膜蛋白的细胞外结构域和这些所述细胞因子或细胞因子样分子的衍生物或工程化形式,由以下组成的列表代表:il-1、il-1、il-2、il-2-样、cd132、il-4、il-5、il-6、il-6样、il-8、il-9、il-10、il-10-样、lif、osm、il-12、il-13、il-15、il-17、il-23、il-25、il-27、il35、il-38、g-csf、gm-csf、ifn、ifn、tgf、tnf、tnf、tnf超家族成员、cd154、lt-β、tnf-α、tnf-β、4-1bbl、april、cd70、cd153、cd178、girtl、light、ox40l、tall-1、trail、tweak、trance、m-csf、scf、msp、epo、tpo、flt-3l、以及细胞因子受体的胞外域,例如tgfβ-受体和il-15受体的胞外域。
本领域技术人员应理解,在一些实施方案中,除了靶标结合部分之外,还包括非靶标结合部分作为双特异性或多特异性生物制剂的组成部分。在一些实施方案中,非靶标结合部分用于将两个或更多个靶标结合部分物理连接在一起以形成单一嵌合多肽或生物制剂的亚基。在一些实施方案中,非靶标结合部分为“附件”或化学修饰,其用于为生物制剂提供有利的药物或药理特性。非靶标结合部分的组成、长度、刚度、方向和形式通常对于双特异性或多特异性生物制剂的适当组装和功能活性至关重要。
在一些实施方案中,非靶标结合部分是共价连接单一嵌合多肽中的两个靶标结合部分的肽接头。在一些实施方案中,肽接头是:(1)具有约1个至约49个氨基酸,优选2个至30个氨基酸长度的柔性接头,其由富含g/s的接头如(g)n,(sg)n,(gs)n,(gsg)n,(ggs)n,(gggs)n,(ggsg)n,(ggggs)n,(ggsgg)n,(gkpgs)n,(gkpggs)n,(gkpgggs)n代表,其中n是1至9之间的整数;(2)具有约1个至约49个氨基酸,优选约2个至30个氨基酸长度的刚性接头,其由富含e/a/p的接头如a(eaaak)na和t(a4t)naaa代表,其中n是1至8之间的整数;(3)源自天然蛋白的肽接头,其由fnrgec和epsgp(源自igg上铰链区),lggc和vepkec(源自igg的κ轻链的c末端)和psgqagaaaseslfvsnhay(源自来自人肌肉醛缩酶)代表;(4)由以下代表的肽序列:akttpkleegefsear,akttpkleegefsearv,akttpklgg,sakttpklgg,akttpkleegefsearv,sakttp,sakttpklgg,radaap,radaaptvs,radaaaaggpgs,radaaaa(ggagsap,qapfapap,apapfsapap,tvapfsapap,aptvfsapap,aptvfsapap,apagfsapap,qagpsafptv,aptvfsapap,apagfsapap,tvagpsapap,apadafsapap,qagpsafptvap,aptvfsapap,qagpsapapap,qagpsafptv,aptvapap,apadafsapap,qtvasfapap,qtvapstvapap,apadapapapap,qadaptvapap,apadasakttpp,akttppsvtplap,akttap,akttapsvyplap,gpakeltplkeakvs,astkgp,astkgpsvfplap,genkveyapalmals,ghaaaavmqvqypas和veggsggsggsgsggsggvd;(4)以上(1)、(2)、(3)和(4)具有各种组成或生物物理性质的肽接头之间的组合。在一些实施方案中,非靶标结合部分是在单一嵌合融合蛋白中共价连接两个靶标结合部分的化学接头。示例性的化学接头是聚乙二醇(peg)、聚乳酸-乙醇酸共聚物(plga)、聚乳酸(pla)和聚(ε-己内酯)(pcl)。在一些实施方案中,优选的非靶标结合部分是具有约2个至30个氨基酸长度的肽接头。
在一些实施方案中,双特异性或多特异性生物制剂所包含的非靶标结合部分是异源二聚化或多聚化结构域,由igg的fc或fc衍生的结构域和dock-and-lock(dnl)结构域(如,源自camp依赖性蛋白激酶(pka)和a型激酶锚定蛋白(akap)的亮氨酸拉链)代表。在一些实施方案中,优选的异二聚化结构域是工程化改造为改善双特异性或多特异性生物制剂的稳定性的fc或fc结构域的衍生物,由突变为具有由所谓的“突出-入-空穴(knobs-in-holes)”,“静电操纵”,
技术人员应理解,可进一步修饰双特异性或多特异性生物制剂的靶标结合或非靶标结合部分,以实现有利的药物和药理学性质。在一个实施方案中,可在双特异性生物制剂中包含白蛋白或生物相容性聚合物分子(如,peg、聚乙二醇),以延长生物制剂的血清半衰期(即,更好的药代动力学特征)。在另一个实施方案中,可将毒性分子(如,多柔比星或其他治疗剂)与双特异性抗体连接,以改善其靶标杀伤活性(如,更好的功效)。在另一个实施方案中,可将点突变(包括影响fc某些残基上糖基化的那些突变)引入igg的fc区中,其中突变可减少、消除或增强fc与fcγr的结合,与降低或增强的双特异性抗体adcc活性有关,这主要是由nk(自然杀伤细胞)或nk样细胞通过其fcγr-iii受体介导的。再举例而言,il-2是已知与三种不同il-2受体亚基(cd25、cd122和cd132)同时结合的细胞因子,其可在某些氨基酸残基处突变或聚乙二醇化以获得il-2-样多特异性生物制剂,其在自身免疫相关的治疗应用中具有改善的cd25特异性偏向,或在癌症适应症中可选择地偏向于其低亲和力靶标cd122。
双特异性或多特异性生物制剂包含的两个或更多个部分可靶向单个靶标分子上或者两个或更多个相同或不同靶标分子上的不同分子位点。通过将两个或更多个功能上不同的部分结合在一起形成完整的生物制剂,可实现双重靶向或多重靶向,以实现改善(如,协同)靶向特异性、功效或两者,这有利于治疗应用。例如,可通过整合选自抗体和抗体样分子的列表中的两个不同靶标结合部分来组装代表双特异性抗体的生物制剂,所述两个不同靶标结合部分旨在与细胞上的同一靶标分子上或两个不同分子上的两个不同分子位点结合。类似地,可通过整合选自抗体和抗体样分子列表中的三个不同靶标结合部分来形成三特异性(又称为“三重特异性”)抗体,所述抗体和抗体样分子旨在靶向单个细胞或不同细胞上的相同或不同靶标分子上的三个不同分子位点。可以理解,通过将抗体和抗体样分子的可用通用形式组合或配对,可形成超过100种不同bsab或多特异性抗体。例如,catumaxomab是首个被批准用于治疗恶性腹水的双特异性生物制剂药物,其靶向cd3(t细胞靶标)和epcam(癌细胞靶标);emicizumab是靶向因子ixa和x的双特异性igg4样抗体,已获批准用于常规预防具有因子viii抑制剂的a型血友病患者的出血事件;靶向cd3和cd19的blinatumomab被批准用于治疗某些形式的白血病。临床开发中代表性的双特异性生物制剂是:cd3xcd20双重靶向bsab,其与cd3+t细胞和cd20+癌细胞接合;cd3xbcma双重靶向bsab,其与cd3+t细胞和bcma+癌细胞接合;her2xher2双重靶向bsab,其与癌细胞的her2分子的两个分子位点接合;pd-l1xtgfβ双重靶向免疫细胞因子,其靶向肿瘤细胞上的pd-l1和肿瘤微环境中的tgfβ;il-2rxp53双重靶向生物制剂,其包括il-2和p53特异性单分子tcr(t细胞受体)。
本领域技术人员应理解,两个或更多个相同或几乎相同的生物制剂部分拷贝可包含于单一生物制剂分子中。在一些实施方案中,增加的拷贝数提高了所述生物制剂的靶标结合效价或亲合力,这对于治疗应用可能是有利的。
根据一些实施方案,可从遗传上组合或配对靶标结合部分和非靶标结合部分(如,源自抗原未处理的动物和抗原免疫的动物及人受试者的先导抗体候选物的结构域)的池(pool)工程化改造编码双特异性或多特异性生物制剂的基因材料的文库,所述遗传材料各自编码所述生物制剂的单一遗传变体和共同编码所述生物制剂的多样化变体池。遗传文库还可通过直接dna合成,易错或简约聚合酶链式反应(pcr),遗传编辑或通过重组方法如dna改组和gibson组装,使用预先存在的生物制剂表达dna作为种子模板来生成或进一步多样化。例如,在双特异性抗体的情况下,此类种子模板可源自本领域技术人员对一抗的常规筛选方法。
在一些实施方案中,可工程化改造选择的细胞类型,以表达双特异性或多特异性生物制剂的多样化文库,其中各个个别细胞表达所述生物制剂的单一变体,并且这些细胞共同构成表达生物制剂的细胞文库。应当理解,本领域技术人员可经由逆转录病毒或慢病毒介导的将所述生物制剂的遗传文库基因组整合到所述选择类型的细胞中而产生表达单一变体的细胞文库。在一些实施方案中,为了确保单一变体整合到细胞基因组中,使用低病毒感染复数(moi),例如,使用低的病毒与细胞比率进行细胞感染,其中moi低于例如1或0.5。使用逆转录病毒或慢病毒方法,通常可实现高效的基因组整合(效率高达95%)。在一些实施方案中,基于crispr或重组酶(如,整合酶或转座子)的遗传工程方法或者瞬时转染和选择可用于介导表达生物制剂的dna材料的单次插入。在一些实施方案中,利用基于crispr或重组酶的方法,可实现相当高的基因组整合效率,特别是对于那些转染相容的细胞,如cho、293和hela细胞(效率高达约30%)。如本文所用,术语“单一变体”,“单一-变体”和“单一遗传变体”可互换使用,其通常是指给定单细胞中单一遗传编码序列或代表同一变体的相同遗传编码序列的两个或更多个拷贝。
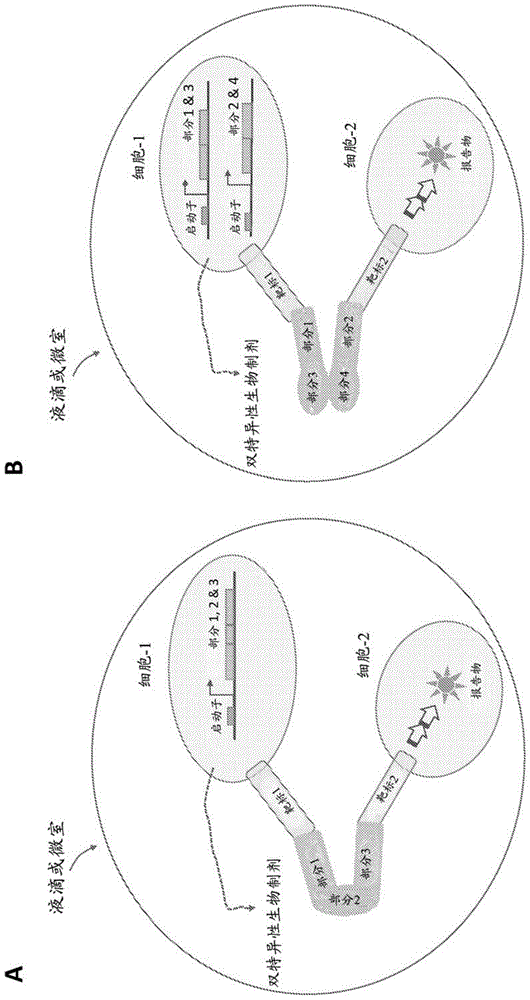
在一些实施方案中,将双特异性或多特异性生物制剂的全部必要部分整合到由单个基因表达盒编码的单一人工融合蛋白中。因此,单个基因组整合事件足以产生表达生物制剂的细胞。在一些实施方案中,将生物制剂的部分散布到两个或更多个不同表达盒中。所述表达盒可进一步组装成单一表达媒介物,并随后整合到所选细胞类型的单个基因组基因座中。在一些实施方案中,可将盒通过两个或更多个重组事件分别插入到两个或更多个不同的基因组基因座中。在一些实施方案中,如图1和图2所示,应当将盒插入不超过两个不同的基因组基因座中。
如本文所用,术语“基因组整合”可互换地用作基因组插入或重组。如本文所用,术语“基因表达盒”应给予其通常含义,并且一般指包含基因启动子、基因编码开放阅读框、终止密码子和聚腺苷酸化信号元件以及一种或多种任选的调控dna元件的dna构建体。任选地,以单一表达盒的形式,可将两个或更多个开放阅读框(各自编码至少一个生物学制剂部分)经由ires(内部核糖体进入位点)或自切割序列(如,p2a、f2a、e2a和t2a肽)串联,但仍在单个基因启动子的控制下。如本文所用,术语“表达媒介物”通常是指包含两个或更多个表达盒的dna构建体,包括编码生物制剂部分和任选地选择标志物的那些。
可通过使用选择标志物来富集表达生物制剂的细胞文库,其中使阴性群体(未整合表达生物制剂的遗传物质的那些)最小化或去除。
通常可理解,选择用于表达生物制剂的细胞类型可以是人细胞,动物细胞,融合的杂交细胞,杂交瘤细胞,真菌细胞,酵母细胞,工程化真核细胞,病毒感染的细胞,转染的细胞,昆虫细胞或药物处理的细胞。在一些实施方案中,利用酵母表达系统来创建具有通过异源二聚化或三聚化连接的至少两个多肽亚基的生物制剂的大文库(具有至多108个克隆多样性)。例如,一方面,通过转化多个各自代表一个亚基的遗传变体来产生具有交配型a的单倍体酵母菌株的第一文库,并且通过转化多个各自代表一个或多个其余亚基的遗传变体来产生具有交配型α的单倍体酵母菌株的第二文库。具有相反交配型的两个所述酵母文库的交配可产生组合的二倍体酵母文库,其中每个二倍体酵母细胞基本上表达所述生物制剂的单一变体。
在一些实施方案中,给双特异性或多特异性生物制剂所包含的至少一个部分提供分泌信号,例如在其n-末端。如本文所用,分泌信号可互换地是指前导序列,前导肽,信号肽或信号序列,其用于将个别生物制剂部分或整体上适当组装的生物制剂的分泌引导到细胞外空间。在一些实施方案中,双特异性或多特异性生物制剂所包含的至少一个部分提供有膜锚定结构域,其可通过外显子跳跃或渗漏终止密码子机制去除,其中条件性去除膜锚定结构域时,给定细胞中生物制剂的一部分将栓系到细胞表面膜,与此同时,另一部分将分泌到细胞外空间。
在一些实施方案中在区室化测定法中提供一个或多个报告细胞以及表达和分泌双特异性或多特异性生物制剂的某个单一变体的第一类型细胞。所述报告细胞部分地基于其稳定表达足够量的用于所述生物制剂的至少一种意图靶标分子的固有能力来选择,或遗传工程化改造以稳定表达足够量的用于所述生物制剂的至少一种意图靶标分子。在一些实施方案中,所述第一细胞还可表达不同的靶标分子;所述第一细胞和第二细胞一起表达所述生物制剂的全部意图靶标分子,例如如图1至图8所示。在一些实施方案中,报告细胞应是人细胞,动物细胞,融合的杂交细胞,病毒感染的细胞,转染的细胞,药物处理的细胞,昆虫细胞,酵母细胞或这些所述细胞的衍生物或工程化形式。
在一些实施方案中,如图25所示,选择报告细胞以工程化改造为具有每个细胞的单个双特异性或多特异性生物制剂变体的所有部分,并且同时第二类型细胞表达所述生物制剂的全部意图靶标或至少一个意图靶标。
在一些实施方案中,在测定法中提供至少一个第二类型细胞(如,报告细胞)以及表达和分泌双特异性或多特异性生物制剂的某个单一变体的单一细胞。所述报告细胞部分地基于其稳定表达足够量的用于所述生物制剂的至少一种意图靶标分子的固有能力来选择,或遗传工程化改造以稳定表达足够量的用于所述生物制剂的至少一种意图靶标分子。在一些实施方案中,所述第一细胞还可表达不同的靶标分子;所述第一细胞和第二细胞一起表达所述生物制剂的全部意图靶标分子,例如如图1至图8所示。在一些实施方案中,报告细胞应是人细胞,动物细胞,融合杂合细胞,病毒感染的细胞,转染的细胞,药物处理的细胞,昆虫细胞,酵母细胞或这些所述细胞的衍生物或工程化形式。
在一些实施方案中,在区室化测定法中提供三种不同类型细胞,其中工程化改造第一细胞以表达双特异性或多特异性生物制剂的单一变体,选择或工程化改造第二类型的一个或多个细胞以充当报告细胞,并且选择或工程化改造第三类型的一个或多个细胞作为靶标表达细胞,其表达所述生物制剂的至少一种不同类型的意图靶标。例如,nk(或nk样)细胞可与表达靶标的癌细胞和表达共同轻链bsab的细胞一起包含于液滴中,以表明分泌的bsab针对癌细胞的nk依赖性adcc活性(抗体依赖性细胞的细胞毒性)。
在一些实施方案中,报告细胞基于由适当组装的功能性生物制剂特异性结合和功能调节时其产生报告物信号的能力选择或工程化改造以由适当组装的功能性生物制剂特异性结合和功能调节时产生报告物信号。如本文所用,功能调节通常是指意图靶标分子的中和,阻断,激活,聚簇,内吞作用或降解;在较小程度上,功能调节可指所获得的新生物学功能,或所述报告细胞的编程死亡。如本文所用,报告物信号通常是指细胞内,细胞表面或细胞外分子或信号,其丰度受所述生物制剂的直接或间接调节,并且使用已建立的方法和选择工具检测其强度或存在。
在一些实施方案中,报告物信号源自遗传驱动的报告物基因,其中所述报告物基因的转录激活受启动子和响应元件控制,所述响应元件响应于生物制剂对靶标的功能调节。在一些实施方案中,报告物信号是通过所述生物制剂在转录后或翻译水平调节其丰度的细胞因子。在一些实施方案中,报告物信号是小分子,如camp、cgmp和钙,其中其丰度受所述生物制剂的功能活性影响。
在一些实施方案中,报告物基因编码转录驱动的光学检测的荧光蛋白,其中所述报告物基因受启动子和响应元件控制,所述响应元件响应于双特异性或多特异性生物制剂的功能活性。示例性荧光蛋白是蓝色荧光蛋白,如bfp和mtagbfp,青色荧光蛋白如ecfp和tagcfp,绿色荧光蛋白如egfp和zsgreen,黄色荧光蛋白如eyfp和zsyellow1,红色荧光蛋白如mrfp和mcherry,远红外蛋白如e2-crimson,荧光蛋白的衍生物或工程化形式,以及可切割的荧光嵌合蛋白,其可在由功能性生物制剂诱导的酶切割时产生成熟的荧光多肽。应理解,前述荧光蛋白和致荧光性蛋白的编码序列可由本领域技术人员公开获得或可从各种商业来源获得。
在一些实施方案中,报告物基因编码荧光蛋白,其在催化提供的合适致荧光性底物时可产生荧光信号,其中所述报告物基因受启动子和响应元件控制,所述响应元件响应于双特异性或多特异性生物制剂的功能活性。示例性致荧光性蛋白是某种形式的β-半乳糖苷酶,磷酸酶,肽酶或蛋白酶。用于β-半乳糖苷酶的示例性致荧光性底物是荧光素双半乳糖苷,试卤灵半乳糖苷和二甲基吖啶酮(ddao)半乳糖苷。用于磷酸酶的示例性致荧光性底物是荧光素二磷酸,ddao磷酸和甲基伞形酮磷酸酯(mup)。用于肽酶或蛋白酶的示例性致荧光性底物是基于7-氨基香豆素骨架的化学物质,例如7-氨基-4-甲基香豆素,以及基于罗丹明-110骨架的那些,例如双-(cbz-arg)-r110。应当理解,以上所述致荧光性蛋白的编码序列和相关致荧光性底物易于本领域技术人员获得,或广泛地购自各种商业供应商,或者可由本领域技术人员在化学实验室中制备。
在一些实施方案中,报告物基因编码发光蛋白,其中所述基因受启动子和响应元件控制,所述响应元件响应于双特异性或多特异性生物制剂的功能活性。示例性发光蛋白是fireflytm萤光素酶,renillatm萤光素酶,nanobittm萤光素酶,以及萤光素酶的衍生物或工程化形式。
在一些实施方案中,报告物基因编码致发光性蛋白,其中所述基因受启动子和响应元件控制,所述响应元件响应于双特异性或多特异性生物制剂的功能活性。示例性致发光性蛋白是细胞色素p450或n-乙酰转移酶-2(nat2)的某些同种型,其中相应的致发光性蛋白是萤光素原(pro-luciferin)。
在一些实施方案中,报告物信号是用于细胞代谢产物或用于离子(如,钙、锌和镁)的荧光传感器染料,其中所述细胞代谢物的水平或细胞中所述离子的通量可受双特异性或多特异性生物制剂在意图的细胞表面靶标(如离子通道)上的功能活性调节。在一些实施方案中,示例性离子是钙,其中使用荧光传感器染料如fura-2、furaredam,fluo-4direct和indol-1am可光学检测通过离子通道靶标的钙通量。
在一些实施方案中,报告物信号是用于效应分子或信使分子(如camp和cgmp)的荧光传感器染料,其中所述效应分子的细胞水平响应于g蛋白偶联受体(gpcr,极具吸引力的一类治疗靶标)的功能状态。
在一些实施方案中,报告物信号源自配对的供体和受体对,其能够进行foster共振能量转移(fret)或基于
应当理解,本领域技术人员可通过各种方法容易地建立包含靶标-响应启动子和报告物编码基因的报告表达盒,所述方法包括病毒整合,crispr介导的重组,着陆垫(landing-pad)介导的位点特异性重组和随机整合。
在一些实施方案中,报告物是位于意图用于双特异性或多特异性生物制剂的靶标分子下游的生物调节途径中的效应基因。通过所述生物制剂激活此类报告物,可例如通过连接pcr进行遗传检测,其中提供共同寡dna引物以从以下至少两个遗传区域引发pcr:(a)代表双特异性或多特异性生物制剂的部分或全部的遗传序列,和(b)代表响应于适当组装的功能性生物制剂的功能活性的效应基因的遗传序列。示例性效应基因是编码效应细胞因子的那些,例如il-2,il-6,il-10,tnf1,ifn1和诸如穿孔蛋白和粒酶的效应酶,其中所述效应物的上调可由功能性双特异性抗体诱导,所述功能性双特异性抗体在一个臂中靶向t细胞受体且在另一个臂中靶向肿瘤抗原。
在一些实施方案中,在工程化改造为包括双特异性或多特异性生物制剂的个别部分的随机多样组合或配对的遗传文库中,大多数组合或配对不会有效导致具有适当功能活性的生物制剂。本领域完全理解,在一些实施方案中,仅小部分(0.3%或更低)的生物制剂变体适当组装并显示功能活性。传统上,基于微量滴定孔板形式,那些稀有功能克隆的测定法很大程度上依赖于多轮筛选,这通常是冗长、极度低效和昂贵的。可选择地,可选择在细胞表面上显示双特异性或多特异性生物制剂的个别变体,然后进行多轮流式细胞术筛查和功能验证。这些替代方案是类似低效的,部分是因为它筛选结合剂而非功能活性。如本文所用,克隆可与变体互换使用。因此,单一变体应指单个克隆。
在一些实施方案中,将多个区室化纳米体积,特别是微室和油包水液滴,用作生物测定法的微反应器系统,以超高通量的方式直接快速筛选来自双特异性或多特异性生物制剂的工程化文库的功能性单一变体。在一些实施方案中,区室化纳米体积的通量为约10,000至约8亿,约40,000至约1亿,或约100,000至约2000万。
在一些实施方案中,区室化纳米体积包括第一细胞和充当报告细胞的至少第二细胞,所述第一细胞工程化改造为表达双特异性或多特异性生物制剂的各自和全部必需部分的单一变体,所述报告细胞产生指示由所述第一细胞表达和分泌的功能性生物制剂的报告物信号。
一些实施方案包括使用微流体。一方面,微流体允许将异质样品的批量池分配至许多隔离的小体积区室中,以快速增加有效的分析物浓度,并同时减少来自相同批量样品中存在的无关物质的干扰。另一方面,它结合区室化的能力、流体操纵的灵活性以及以单细胞水平超高通量筛选的能力。
本领域技术人员可容易地产生多个微流体微室或液滴。例如,液滴用一个或多个细胞快速(每秒多达数以千计的液滴)包囊,通过使用注射器或压力泵,具有流聚焦或t接合几何形状的微流体芯片和补充有生物相容性表面活性剂的生物相容性油如3mtmnovec-7500tm和fluorinerttmfc40油进行,所有这些都可通过商业供应商获得或在适当装备的机械或生物医学工程实验室或微机电系统(mems)核心设备中获得。
在一些实施方案中,区室化纳米体积具有纳升以下或纳升尺寸,范围为约0.05nl至约10nl,约0.03n1至约100ng,约0.1n1至约4nl,约0.1nl至约1nl或约5nl至约10nl。在一些实例中,纳米体积为约0.1n1、0.2n1、0.3n1、0.4nl、0.5nl、0.6ng、0.7nl、0.8nl、0.9nl、1nl、2nl、3nl、4nl、5nl、6nl、7nl、8nl、9nl、10nl、11nl、12nl、13nl、14nl、15nl、16nl、17nl、18nl、19nl、20nl、21nl、22nl、23nl、24nl、25nl、26nl、27nl、28nl、29nl、30nl、31nl、32nl、33nl、34nl、35nl、36nl、37nl、38nl、39nl、40nl、41nl、42nl、43nl、44nl、45nl、46nl、47nl、48nl、49nl、50nl、51nl、52nl、53nl、54nl、55nl、56nl、57nl、58nl、59nl、60nl、61nl、62nl、63nl、64nl、65nl、66nl、67nl、68nl、69nl、70nl、71nl、72nl、73nl、74nl、75nl、76nl、77nl、78nl、79nl、80nl、81nl、82nl、83nl、84nl、85nl、86nl、87nl、88nl、89nl、90nl、91nl、92nl、93nl、94nl、95nl、96nl、97nl、98nl、99nl或100nl。
在一些实施方案中,区室化纳米体积可进一步包括用于标记报告物信号以实现光学检测的检测试剂。例如,可将camp或钙特异性荧光传感器染料与表达生物制剂的细胞和报告细胞共同包囊到液滴中。在假定的gpcr或离子通道靶标上表达的生物制剂克隆的阳性双靶向功能将触发camp或钙的细胞累积,其然后通过光学检测模块进行光学检测。
在一些实施方案中,双特异性或多特异性制剂的意图靶标分子可主要表达在工程化以表达所述生物制剂的第一细胞表面上,或主要表达在充当报告细胞的第二细胞上,或主要表达第三细胞上,所述第三细胞是靶标阳性细胞或用于伴随充当另一个不同报告细胞。在一些实施方案中,靶标分子分别在所述第一细胞、第二细胞和第三细胞的两个或三个上分布,如图1至图8所示。所述第一细胞、第二细胞和第三细胞可根据在其细胞表面上表达靶标的固有能力来选择或工程化以稳定表达所述靶标,这可使用基因组整合方法诸如慢病毒或逆转录病毒方法、crispr/cas9介导的遗传编辑方法和重组酶介导的方法来实现。
在一些实施方案中,使用液滴产生装置将一个或多个不同类型细胞共同包囊到液滴中。在随机分配的情况下,精确包含单细胞的液滴的百分比通常遵循一定的泊松统计,使得具有一个单细胞的液滴为低百分比(约32%),并且具有两种类型细胞的液滴具有甚至更低的丰度(约10%)。在一些实施方案中,为了改善含有两个或更多个不同类型的配对细胞的液滴的百分比,可在共同包囊到液滴的步骤之前经由惯性微流体流动方法分别排序多个各细胞类型。在一些实施方案中,将第一细胞包囊在第一液滴中,第二细胞分开包囊在第二液滴中,然后将所述两个第一液滴和第二液滴合并变成单个较大的液滴(即,两个液滴合并为一个)。
在一些实施方案中,在区室化纳米体积中提供合适的培养基,以促进所述液滴中细胞的存活和功能性。可进一步改良这种培养基以与区室化环境更加相容。例如,可包括额外的牛胎儿血清,非必需氨基酸,谷氨酰胺和谷氨酸加上一些抗氧化剂化学物质(如,β-巯基乙醇),以利于细胞在液滴或微室中的存活。可以理解,本领域技术人员可通过商业供应商容易地获得前述培养基组分。
在一些实施方案中,含有所提供的活细胞的区室化纳米体积可在微流体装置(如,在线装置)或容器、腔室、小瓶或管(如,离线装置)中在一段时间内温育,在从由以下组成的列表中选择的一个或多个环境控制模块的存在下:温度控制模块(具有例如约4℃至约37℃的温度范围),氧气控制模块(具有例如约0.0001%至约20%的o2水平),二氧化碳控制模块(具有例如约0.1%至约20%的co2水平),以及湿度控制模块(具有例如约40%至约99%的湿度水平)。
在一些实施方案中,含有活细胞的区室化纳米体积可通过使用适当的报告物信号检测器来检测。示例性检测器是用于检测诸如荧光和发光信号的光信号的光学检测器。示例性光学检测器是检测模块,其部分地包括光子传感器和信号放大单元,其可以选自:电荷耦合器件(ccd)摄像机,互补金属氧化物半导体(cmos)传感器,光电倍增管(pmt)和雪崩光电二极管(apd)。检测模块可连接到信号采集和处理板,其可与配备有过程控制或用户界面软件的计算机集成。可通过收集由功能性生物制剂触发的报告物累积产生的光学信号来进行收集代表阳性报告物信号的数据。
在一些实施方案中,收集代表阳性报告物信号的数据在一个时间点或两个、三个或更多个时间点时进行。在一些实施方案中,报告物检测和数据处理是以实时或非实时模式进行,其中阳性报告物信号的存在将触发下游的分选步骤,以从具有阳性报告物信号的纳米体积中回收表达生物制剂的细胞。
在一些实施方案中,液滴的分选使用基于介电泳(dep),声学,微型阀,压电体,动态流偏转或电力电容机构的分选模块来进行。在一些实施方案中,分选使用基于dep或声学的分选模块进行。在一些实施方案中,微室中的细胞回收使用微量移液器模块进行。如本文所用,在从区室化纳米体积中分离一个或多个细胞的背景下术语“分选”通常与以受控制的方式“取回”或“回收”可互换地使用。
在一些实施方案中,分选的细胞使用常用裂解缓冲液裂解,然后进行逆转录(rt)和一轮或多轮pcr以扩增代表生物制剂编码序列的dna。然后,对扩增的dna进行dna测序和必要的遗传分析。应理解,这些rt-pcr,测序和遗传分析步骤通常是本领域技术人员已知的。
在一些实施方案中,如本文所提供的制造产品与数字通信和计算机或移动设备应用同步或集成。在一些实施方案中,如本文所提供的制造产品用于以单重、双重或多重测定形式检测和定量化学制品、生物制品或单细胞的测定法。
在一些实施方案中,细胞是人细胞,动物细胞,融合的杂交细胞,杂交瘤细胞,真菌细胞,酵母细胞,工程化真核细胞,病毒感染的细胞,转染的细胞或药物处理的细胞。可选地,可将选择类型的异质细胞池划分为个别液滴或微室,并在单细胞水平表征、成像、操纵和分选。可选地,多个区室化纳米体积可不仅包含1比1完全配对的两种不同类型细胞,而且还包含零个细胞,单个细胞或相同或不同类型的两个或更多个细胞。
非限制性和说明性实施方案
图1(a)示出用于双特异性单一融合蛋白的基于纳米体积(微流体液滴或微室)的测定法的一些实施方案的一般概念和方案,其中工程化改造提供的第一细胞以通过单个整合的基因组基因座表达所述生物制剂的三个部分,其中选择或工程化改造提供的第二细胞以产生由所述生物制剂触发的报告物信号,其中所述生物制剂在以功能性形式在细胞外空间适当组装和分泌时意图靶向所述第一细胞表面上表达的第一靶标和所述报告细胞上表达的第二且不同靶标。图1(b)示出与图1(a)类似的测定原理和特征,只是双特异性生物制剂包括散布在插入到两个基因组基因座的两个不同亚基的四个功能性部分,其中两个非靶标结合部分(部分-3和部分-4)作为异源二聚化结构域提供。
图2(a)示出用于包含四个不同部分的双特异性生物制剂的基于纳米体积(液滴或微室)的测定法的一些实施方案的一般概念和方案,其具有与图1(b)相似的测定原理和特征,只是将生物制剂表达媒介物插入单个基因组基因座。图2(b)示出与图2(a)类似的测定原理和特征,只是双特异性生物制剂包含一个另外的部分(部分-5),其中所述部分-5由插入不同基因组基因座的表达盒表达;部分-5还部分地通过分别与部分-1和部分-2直接相互作用而参与靶标结合。
图3描绘了用于双特异性生物制剂的基于纳米体积(液滴或微室)的测定法的一些实施方案的一般概念和方案,其中提供了第一细胞,其经工程化改造以通过两个整合的基因组基因座表达所述生物制剂的五个部分,其中提供第二细胞,其经选择或工程化改造以产生由所述生物制剂触发的报告物信号,其中所述生物制剂如果以功能形式适当组装并分泌,则它意图靶向所述第一细胞和第二细胞上分别表达的两种不同类型靶标,其中还提供了第三细胞,以引发或促进生物制剂功能,或充当与第二细胞具有不同报告物的报告细胞。
图4(a)示出用于双特异性生物制剂的基于纳米体积(液滴或微室)的测定法的一些实施方案的一般概念和方案,其具有与图1(a)相似的测定原理和特征,只是所述生物制剂靶向报告细胞上表达的同一靶标分子上的两个不同分子位点。图4(b)示出与图1(b)类似的测定原理和特征,只是所述生物制剂靶向报告细胞上表达的同一靶标分子上的两个不同分子位点。
图5(a)示出用于双特异性生物制剂的基于纳米体积(液滴或微室)的测定法的一些实施方案的一般概念和方案,其具有与图2(a)相似的测定原理和特征,只是所述生物制剂靶向报告细胞上表达的同一靶标分子上的两个不同分子位点。图5(b)示出与图2(b)相似的测定原理和特征,只是所述生物制剂靶向报告细胞上表达的同一靶标分子上的两个不同分子位点。
图6(a)描绘了用于双特异性生物制剂的基于纳米体积(液滴或微室)的测定法的一些实施方案的一般概念和方案,其中提供了第一细胞,其经工程化改造以通过两个整合基因组基因座表达所述生物制剂的五个部分,其中提供了第二细胞,其经选择或工程化改造以产生由所述生物制剂触发的报告物信号,其中所述生物制剂如果以功能性形式适当组装并分泌,则它意图靶向第二细胞上表达的两个不同靶标,其中还提供了第三细胞以引发或促进生物制剂功能,或充当与第二细胞具有不同报告物的另一报告细胞。
图6(b)描绘了用于双特异性生物制剂的基于纳米体积(液滴或微室)的测定法的一些实施方案的一般概念和方案,其中提供了第一细胞,其经工程化改造以通过两个整合的基因组基因座表达所述生物制剂的五个部分,其中所述部分构成生物制剂的三个单一融合蛋白亚基,其中提供了第二细胞,其经选择或工程化改造以产生由所述生物制剂触发的报告物信号,其中所述生物制剂如果以功能形式适当组装并分泌,则它意图靶向第二细胞上表达的两个不同靶标。
图7(a)示出用于作为单一嵌合蛋白的三特异性生物制剂的基于纳米体积(液滴或微室)的测定法的一些实施方案的一般概念和方案,其中提供了第一细胞,其经工程化改造以通过整合在基因组基因座中的单个表达盒表达所述生物制剂的五个部分,其中提供了第二细胞,其经选择或工程化改造以产生由所述生物制剂触发的报告物信号,其中所述生物制剂如果以功能形式适当组装和分泌,则它意图靶向分别在所述第一细胞和第二细胞表面上表达的三个不同的假定靶标。图7(b)示出与图7(a)类似的测定原理和特征,只是所有三种不同类型靶标分子主要或仅仅在第二细胞(即,报告细胞)上表达。
图8(a)描绘了用于三特异性生物制剂的基于纳米体积(液滴或微室)的测定法的一些实施方案的一般概念和方案,其中提供了第一细胞,其经工程改造以表达所述生物制剂的五个部分,它们散布到由分别整合到两个不同基因组基因座的两个表达盒表达的两个非对称异源二聚化亚基中,其中提供了第二细胞,其经选择或工程化改造以产生由所述生物制剂触发的报告物信号,其中所述生物制剂如果以功能形式适当组装并分泌,则它意图靶向所述第一细胞和第二细胞表面上表达的三种不同假定的靶标类型。图8(b)示出与图8(a)类似的测定原理和特征,只是三特异性生物制剂包含共享相同部分-3的两个异源二聚化亚基,其中两个部分-3拷贝都参与结合第一细胞上表达的靶标-1。
非限制性和说明性实施例
实施例1:筛选与单细胞上的两个不同靶标结合的共同轻链双特异性抗体
图9示出来自多个变体的功能性共同轻链双特异性抗体的基于液滴的筛选测定法的实施方案,每个变体包含由单个哺乳动物细胞(细胞-1)的两个基因组整合的表达盒表达的三个不同部分(共同轻链,第一重轻链和第二重链),其中共同轻链和第一重链由具有通过ires元件连接的两个开放阅读框的单个表达盒编码。在表达、适当组装并分泌到细胞外空间后,功能性双特异性抗体与报告细胞上的两个细胞表面靶标结合,从而导致报告物基因(gfp)的转录激活。累积的gfp信号由激光和基于pmt的检测模块进行光学检测。然后可通过液滴分选模块分选gfp阳性液滴,并进一步进行细胞裂解、rt-pcr和个别变体的遗传鉴定,所述变体各自编码所述双特异性抗体的功能性组装体。
作为与图9中所述相似的另一个例子,应当理解,在这里可使用不同形式的bsab,例如具有两个不同靶标结合scfv的单一融合蛋白来代替上述的共同轻链bsab形式。
实施例2:筛选与两个相邻细胞接合的共同轻链双特异性抗体
图10描绘了来自多个变体的功能性共同轻链双特异性抗体的基于微室的筛选测定法的实施方案,每个变体包含由单个哺乳动物细胞(细胞-1)中两个基因组整合的表达盒表达的三个不同部分(共同轻链、第一重链和第二重链)。在表达、适当组装并分泌到细胞外空间后,功能性双特异性抗体与细胞-1上的一个细胞表面靶标和细胞-2(报告细胞)上的另一个细胞表面靶标结合,从而导致报告物基因(rfp)的转录激活。累积的rfp信号在荧光显微镜下进行光学检测。然后可通过显微术引导的微量移液管分别回收rfp阳性微室内的细胞-1,并进一步进行细胞裂解、rt-pcr和个别变体的遗传鉴定,所述变体各自编码所述双特异性抗体的功能性组装体。
实施例3:筛选与两个相邻细胞接合的功能性嵌合scfv融合蛋白
图11(a)显示了来自多个遗传变体的功能性嵌合scfv融合蛋白的基于液滴的筛选测定法的实施方案,每个遗传变体编码包含由哺乳动物细胞(细胞-1)中单个基因组整合的表达盒表达的三个不同部分(意图用于靶标-1的第一scfv,意图用于靶标-2的第二scfv和连接两个scfv的短肽接头)的单一融合蛋白。在表达、适当组装并分泌到细胞外空间后,功能性scfv融合蛋白与细胞-1上的一个细胞表面靶标和细胞-2(报告细胞)上的另一个细胞表面靶标结合,从而导致报告物基因(gfp)的转录激活。累积的gfp信号通过激光和基于pmt的检测模块进行光学检测。然后通过液滴分选模块对gfp阳性液滴进行分选,并进一步进行细胞裂解、rt-pcr和个别变体的遗传鉴定,所述变体各自编码功能性嵌合scfv融合物。
图11(b)显示来自多个遗传变体的功能性双特异性嵌合vhh融合蛋白的基于液滴的筛选测定法的实施方案,每个遗传变体编码包含由哺乳动物细胞(细胞-1)中单一基因组整合的表达盒表达的三个不同部分(意图用于靶标-1的第一vhh,意图用于靶标-2(cd3)的第二vhh和连接两个vhh的短肽接头)的单一融合蛋白。在表达、适当组装并分泌到细胞外空间后,功能性双特异性vhh融合蛋白与细胞-1上的一个细胞表面靶标和细胞-2(报告细胞)上的另一个细胞表面靶标(cd3)结合,从而导致nfat响应元件控制下的报告物基因(gfp)的转录激活。累积的gfp信号由激光和光学检测模块进行光学检测。然后可通过液滴分选模块对gfp阳性液滴进行分选,并进一步进行细胞裂解、rt-pcr和个别变体的遗传鉴定,所述变体各自编码功能性嵌合vhh融合物。
实施例4:筛选靶向细胞类型上的两个不同靶标的双特异性免疫细胞因子
图12显示来自多个变体的功能性双特异性免疫细胞因子的基于液滴的筛选测定法的实施方案,每个变体包含由单个哺乳动物(细胞-1)中两个基因组整合的表达盒表达的三个不同部分(轻链,重链和细胞因子)。在表达、适当组装并分泌到细胞外空间后,功能性双特异性免疫细胞因子与报告细胞(细胞-2)的细胞表面上的抗体靶标和细胞因子受体结合,从而导致报告物基因(gfp)的转录激活。累积的gfp信号由激光和基于pmt的检测模块进行光学检测。然后可通过液滴分选模块对gfp阳性液滴进行分选,并且进一步进行细胞裂解、rt-pcr和个别变体的遗传鉴定,所述变体各自编码所述双特异性免疫细胞因子的功能性组装体。
实施例5:筛选与两个相邻细胞接合的双特异性免疫细胞因子
图13描绘了来自多个变体的功能性双特异性免疫细胞因子的基于液滴的筛选测定法的实施方案,每个变体包含由单个哺乳动物细胞(细胞-1)中两个基因组整合的表达盒表达的三个不同部分(轻链、重链和细胞因子)组装的抗体和细胞因子。在表达、适当组装并分泌到细胞外空间后,功能性双特异性免疫细胞因子与报告细胞(细胞-2)上的抗体靶标和第一细胞(细胞-1)上的细胞因子受体结合,从而导致报告物基因(gfp)的转录激活。累积的gfp信号由激光和基于pmt的检测模块进行光学检测。然后可通过液滴分选模块对gfp阳性液滴进行分选,并且进一步进行细胞裂解、rt-pcr和个别变体的遗传鉴定,所述变体各自编码所述双特异性免疫细胞因子的功能性组装体。
实施例6:筛选靶向单细胞上的三个不同受体靶标的三特异性细胞因子样生物制剂
以高亲和力的il-2受体(其包含cd25(il-2rα),cd122和cd132亚基)和il-15受体(其包含il-15rα,cd122和cd132亚基)为代表的许多细胞因子受体,被称为异源三聚体复合物,其中全部三个亚基都与单个关联细胞因子分子接合。工程化改造il-2或il-15样细胞因子或具有三特异性靶向活性的生物制剂可能会发现重要的治疗应用。
作为非限制性实例(图14),使用基于液滴的筛选测定法从多个变体中筛选三特异性细胞因子样融合蛋白,每个变体包含三个不同的靶标结合部分加上两个接头肽。由单个哺乳动物细胞(细胞-1)中基因组整合的表达盒表达所述细胞因子样蛋白的单一变体。在表达、适当组装并分泌到细胞外空间后,功能性三特异性变体与报告细胞(细胞-2)上的三个不同受体结合,从而导致报告物基因(gfp)的转录激活。累积的gfp信号由激光和基于pmt的检测模块进行光学检测。然后可通过液滴分选模块对gfp阳性液滴进行分选,接着进一步进行细胞裂解、rt-pcr和个别变体的遗传鉴定,所述变体各自编码功能性三特异性细胞因子样分子。
实施例7:筛选用于gpcr靶标的共同重链双特异性抗体
图15示出来自多个变体的功能性共同重链双特异性抗体的基于液滴的筛选测定法的实施方案,每个变体包含由单个哺乳动物细胞(细胞-1)中两个基因组整合的表达盒表达的三个不同部分(共同重链、第一轻链和第二轻链)。在表达、适当组装并分泌到细胞外空间后,功能性双特异性抗体与报告细胞上的单个gpcr靶标的两个不同分子位点结合,从而导致信号激活和下游效应分子camp(报告物信号)积累。累积的camp与提供的camp特异性荧光传感器染料结合,所述染料随后由激光和基于pmt的检测模块进行检测。然后可通过液滴分选模块对传感器阳性的液滴进行分选,并进一步进行细胞裂解、rt-pcr以及个别变体的遗传鉴定,所述变体各自编码所述双特异性抗体的功能性组装体。
实施例8:筛选拮抗离子通道的双特异性单结构域抗体(sdab)融合蛋白
图16显示来自多个变体的功能性双特异性sdab融合蛋白的基于液滴的筛选测定法的实例,每个变体包含由单个哺乳动物细胞(细胞-1)中单个基因组整合的表达盒表达的三个不同部分(第一sdab,第二sdab和肽接头)。在表达、适当组装并分泌到细胞外空间后,功能性双特异性sdab融合蛋白与报告细胞上的单个钙通道靶标的两个不同分子位点结合,从而导致报告细胞中钙通量和累积。累积的钙离子与提供的荧光钙传感器染料结合,所述染料随后由激光和基于pmt的检测模块进行检测。然后可通过液滴分选模块对传感器阳性的液滴进行分选,并进一步进行细胞裂解、rt-pcr和个别变体的遗传鉴定,所述变体各自编码所述双特异性sdab融合蛋白的功能性组装体。
实施例9:筛选靶向细胞上的两个不同靶标的共同轻链双特异性抗体
图17(a)显示来自多个变体的功能性共同轻链双特异性抗体的基于液滴的筛选测定法的实施方案,每个变体包含由单个哺乳动物细胞(细胞-1)中两个基因组整合的表达盒表达的三个不同部分(共同轻链,第一重轻链和第二重链)。在表达、适当组装并分泌到细胞外空间后,功能性共同轻链双特异性抗体与报告细胞上的两个不同细胞表面靶标结合,其中两个表达的靶标分别用细胞外snaptm和cliptm标签进行工程化改造。snap标签与提供的寡dna共价自连接,该寡dna的一端用o6-苄基鸟嘌呤标记且另一端则用fret供体标记;clip标签与另一个提供的寡dna共价自连接,该寡dna的一端用o2-苄基胞嘧啶标记且另一端用fret受体标记。功能性共同轻链抗体的双特异性靶向使供体和受体紧密相邻(即,在有效的foster半径之内),从而由适当的激光波长激发后导致fret信号。fret信号由基于pmt的fret相容检测模块进行光学检测。然后可通过液滴分选模块对fret阳性液滴进行分选,并且进一步进行细胞裂解、rt-pcr和个别变体的遗传鉴定,所述变体各自编码所述双特异性抗体的功能性组装体。
图17(b)显示来自多个变体的功能性共同轻链双特异性抗体的基于液滴的筛选测定法的实施方案,每个变体包含由单个哺乳动物细胞(细胞-1)中基因组整合的表达盒表达的三个不同部分(共同轻链、第一重轻链和第二重链)。在表达、适当组装并分泌到细胞外空间后,功能性共同轻链双特异性抗体与细胞(细胞-2)上表达的靶标-1结合,或与捕获珠(或颗粒或聚合物基质)缀合。所述共同轻链双特异性抗体还结合在液滴中作为荧光标记的可溶分子提供的靶标-2。双特异性抗体/标记的靶标-2复合物的累积导致荧光焦点形成,其可被光学检测。然后可通过液滴分选模块对荧光焦点阳性的液滴进行分选,并且进一步进行细胞裂解、rt-pcr和个别变体的遗传鉴定,所述变体各自编码所述双特异性抗体的功能性组装体。
实施例10:筛选具有适当adcc活性的共同轻链双特异性抗体
图18显示来自多个变体的功能性共同轻链bsab的基于液滴的筛选测定法的实施方案,每个变体包含由单个哺乳动物细胞(细胞-1)中两个基因组整合的表达盒表达的三个不同亚基(共同轻链、第一重轻链和第二重链)。在表达、适当组装并分泌到细胞外空间后,功能性双特异性抗体与第二细胞(癌细胞)上的两个细胞表面靶结合,同时,bsab的fc区与提供的第三细胞(nk或nk样细胞)上的fcγr-iii受体结合,从而导致第三细胞的激活并随后释放adcc相关效应物(如,穿孔蛋白和粒酶)。然后使用提供的致荧光性底物,通过光学检测器(如,pmt或ccd)检测累积的效应物。接着可通过液滴分选模块对荧光阳性液滴进行分选,并进一步进行细胞裂解、rt-pcr和个别变体的遗传鉴定,所述变体各自编码所述双特异性抗体的功能性组装体。
实施例11:液滴中抗cd3xcd19双特异性t细胞衔接器(bite)的功能测定法
图19(a)示出bite(如,抗cd3xcd19bite)、r.e.、启动子响应元件的作用机理;(b)在液滴中存在raji细胞(cd19+淋巴瘤细胞系)和重组抗cd3xcd19bite的情况下未激活(0小时)和已激活(6小时)jurkat-d1报告物t细胞的显微图像;比例尺,100μm。绿色,gfp报告物信号;红色,针对raji预先标记的celltracking染料;(c)在液滴中共包囊后9小时的时间段内,raji细胞存在或不存在的情况下,添加有10ng/ml所述抗cd3xcd19bite的jurkat-d1细胞中的动力学gfp信号强度变化。
非限制性和说明性过程
图20示出根据本公开的实施方式的示例过程1000。过程1000可代表实现所提出的概念和方案的方面,例如以上参照图1至图18描述的各种方案、概念和示例中的一个或多个。更具体地,过程1000可代表提出的概念和方案的方面,涉及基于区室化纳米体积的测定法以超高通量的方式从双特异性或多特异性生物制剂的工程化文库中直接且快速地筛选功能性单一变体。过程1000可包括一个或多个操作、动作或功能,如框1010、1020、1030、1040、1050、1060、1070、1080和1090中的一个或多个所示。尽管以分开的框示出,但是取决于期望的实现方式,过程1000的各个框可分为附加的框,组合为更少的框或消除。此外,过程1000的框可以图20所示的顺序或可选地以不同顺序执行。此外,过程1000的框可以反复地执行。过程1000可从框1010开始。
在1010,过程1000可涉及提供遗传变体dna文库1,其中每个变体在单个表达构建体中编码由双特异性或多特异性生物制剂所包含的至少一个部分。过程1000可从1010进行到1020。
在1020,过程1000可涉及将文库1引入多个选择类型细胞的单个基因组基因座中以获得工程化细胞文库1,其中每个个别细胞基本上表达由所述遗传变体文库1编码的所述部分的单一变体。过程1000可从1020进行到1040。
在可与1010和1020平行地进行的1030,过程1000可涉及提供遗传变体dna文库2,其中每个变体以单个表达构建体编码其余部分,其未被遗传变体dna文库1编码,但在其它方面被双特异性或多特异性生物制剂包含。过程1000可从1030进行到1040。
在1040,过程1000可涉及将dna文库2引入在1020工程化改造的细胞文库1中,以获得表达生物制剂的细胞文库2,其中每个细胞基本上表达和分泌完整生物制剂的每个部分的单一变体。过程1000可从1040进行到1060。
在可与1040平行地进行的1050,过程1000可涉及提供多个报告细胞。过程1000可从1050进行到1060。
在1060,过程1000可涉及获得多个纳米体积(液滴或微室),所述纳米体积区室化为基本上具有来自工程化细胞文库2的1个表达生物制剂的细胞,并且在1050提供≥1个报告细胞。过程1000可以从1060进行到1070。
在1070,过程1000可涉及进行样品温育和报告物信号的光学检测。过程1000可从1070进行到1080。
在1080,过程1000可涉及处理信号检测数据和回收报告物阳性细胞样品。过程1000可从1080进行到1090。
在1090,过程1000可涉及从回收的样品中鉴定个别生物制剂变体的遗传序列。
图21示出根据本公开的实施方式的示例过程1100。过程1100可代表实现所提出的概念和方案的方面,例如以上参照图1至图19描述的各种方案、概念和示例中的一个或多个。更具体地,过程1100可代表提出的概念和方案的方面,涉及基于区室化纳米体积的测定法,以超高通量的方式从双特异性或多特异性生物制剂的工程化文库中直接且快速地筛选功能性单一变体。过程1100可包括一个或多个操作、动作或功能,如框1110、1120、1130、1140、1150、1160和1170中的一个或多个所示。尽管以分开的框示出,但是取决于期望的实现方式,过程1100的各个框可分为附加的框,组合为更少的框或消除。此外,过程1000的框可以图21所示的顺序或可选地以不同顺序执行。此外,过程1000的框可以反复地执行。过程1000可从框1110开始。
在1110,过程1100可涉及提供遗传变体dna文库,其中每个变体编码双特异性或多特异性生物制剂的全部必要部分。过程1100可从1110进行到1120。
在1120,过程1100可涉及将来自1110的dna文库引入多个选择细胞类型,以获得工程化表达生物制剂的细胞文库,其中每个细胞基本上表达和分泌所述生物制剂的每个部分的单一变体。
图22示出根据本公开的实施方式的示例过程1200。过程1200可代表实现所提出的概念和方案的方面,例如以上参照图1至图18描述的各种方案、概念和示例中的一个或多个。更具体地,过程1200可代表所提出的概念和方案的方面,涉及基于区室化纳米体积的测定法,以超高通量的方式从双特异性或多特异性生物制剂的工程化文库中直接且快速地筛选功能性单一变体。过程1200可包括一个或多个操作、动作或功能,如框1210、1220、1230、1240、1250、1260、1270、1280、1290和1295中的一个或多个所示。根据期望的实现,可将过程1200的各个框划分为附加的框,组合为更少的框或消除。此外,过程1200的框可以图22所示的顺序执行或可选地不同顺序排列。此外,过程1200的框可反复地执行。过程1200可从框1210开始。
在1210,过程1200可涉及提供遗传变体dna文库1,其中每个变体编码双特异性或多特异性生物制剂的至少一个或多个部分。过程1200可从1210进行到1230。
在可与1210平行地进行的1220,过程1200可涉及提供遗传变体dna文库2,其中各个变体编码双特异性或多特异性生物制剂的全部其余的必需部分。过程1200可从1220进行到1240。
在1230,过程1200可涉及将在1210获得的dna库1转化为多个具有交配a基因型的单倍体酵母细胞,以获得单倍体酵母文库1。过程1200可从1230进行到1250。
在1240,过程1200可涉及将在1220获得的dna文库2转化为多个具有交配α基因型的单倍体酵母细胞,以获得单倍体酵母文库2。过程1200可从1230进行到1250。
在1250,过程1200可涉及使互补交配型酵母文库1和2交配以获得二倍体酵母文库,其中各个二倍体酵母细胞基本上表达和分泌所述生物制剂的单一变体。过程1200可从1250进行到1270。
在1270,过程1200可涉及获得多个纳米体积(液滴或微室),所述纳米体积区室化为基本上具有来自工程化细胞文库2的1个表达生物制剂的二倍体酵母细胞,并且平行地在框1260提供≥1个报告细胞。过程1200可从1270进行到1280。
在1280,过程1200可涉及进行样品温育和报告物信号的光学检测。过程1000可从1280进行到1290。
在1290,过程1200可涉及处理信号检测数据并回收报告物阳性酵母细胞。过程1000可从1290进行到1295。
在1295,过程1200可涉及从回收的二倍体酵母细胞中鉴定个别生物制剂变体的遗传序列。
非限制性和说明性过程
一些实施方案利用基于液滴的区室化平台。一些实施方案利用半封闭的微室形式。例如,图23中示出半封闭的微室装置。在berkeleylights公司的optoselecttm装置(参阅万维网berkeleylights.com)中,每个装置都具有含有几千或更多个半封闭式微室的平台(称为nanopenstm)。各个个别细胞都可通过受控的激光精确地“移动”进入/离开nanopenstm。对细胞进行克隆并在个别500pl或1nlnanopenstm中进行分析。每个栏(pen)比微孔小约100,000倍。
其他装置由万维网abcellera.com的abcellerabiologics(canada),万维网xcellabio.com的xcellabiosciences(usa)和singlecelltechnologies(usa)提供。在这些装置中,每个装置都具有约20,000、30,000、40,000、50,000或更多个也为半封闭的微室或“微孔”(参见图24),每个室的体积为约0.5nl至约4nl,其中设备的顶部是薄膜,一层聚合物塑料或一层疏水油。个别细胞随机或以受控方式流入并充满室,并且可通过已建立的方法进行回收,例如,通过从装置顶部薄膜直接应用针吸出细胞。
可选择的细胞文库设计
在一些实施方案中,将编码生物制剂的所有组分(亚基)整合到细胞-1中(参见例如图1)。在一些实施方案中,将编码生物制剂的全部组分(亚基)整合到细胞-1中(参见图25)。
在一些实施方案中,报告细胞包含可被功能性生物制剂(双特异性或多特异性)激活的遗传工程化荧光蛋白/复合物或萤光素酶或致发光性蛋白。
在一些实施方案中,遗传工程化效应蛋白通过使用与效应分子结合的荧光探针(如,模块化传感器蛋白(基于细胞外、细胞内或细胞表面))进行光学检测。
在一些实施方案中,内源性效应分子可通过功能性生物制剂激活或上调。效应分子可通过使用荧光探针进行光学检测。此类效应分子可在细胞表面上或细胞内表达,例如,可激活内源性gpcr,从而导致包括第二信使(camp和钙)的效应分子上调。这些效应分子(“报告物分子”)可使用荧光或致发光性分子进行光学检测。
在其他报告细胞实施方案中,可采用多步检测方案,例如:(1)检测生物制剂与≥2个靶标的结合(类似于流式细胞术),(2)细胞回收,和(3)通过连接pcr和测序进行分析。
在另一个实施方案中,图26描绘了通过使用3d打印机用可生物降解的软固体聚合物材料打印的替代微室样装置。该装置包含数千个圆柱形微孔(高度:100μmx直径100μm),该微孔可选地用一层矿物油或薄膜封闭,其中多个此类微孔基本上提供有靶细胞(cd19+白血病细胞,raji)和一个或多个报告细胞(jurkat衍生的报告t细胞),加上blinatumomab,cd3xcd19双特异性分子(或bite)。cd3和cd19之间通过cd3xcd19双特异性分子的功能性交联激活报告物分子的转录和表达,该报告物分子是由nfat应答调控元件驱动的zsgreen荧光蛋白。raji细胞用celltraceviolet染色(蓝色荧光),jurkat细胞用celltracefarred染色(红色荧光)。作为对照,没有靶细胞的微室孔中的报告细胞未被激活。
尽管以上公开了一些实施方案,但是它们并不旨在限制本公开的范围。对于本领域技术人员将显而易见的是,在不脱离本公开的范围或精神的情况下,可对本公开的实施方案进行各种修改和变型。鉴于前述内容,本公开的范围应由所附权利要求书及其等同物限定。
尽管本说明书阐述了各种实施方案的具体细节,但是应当理解,该说明书仅是说明性的,而不应以任何方式解释为限制性的。此外,本领域技术人员可以想到的这些实施方案及其变型的各种应用也被本文描述的一般概念所涵盖。只要在此描述的所有特征以及两个或更多个此类特征的所有结合不相互矛盾,则此类结合中包括的特征包括在本发明的范围内。
以上引用的所有附图、表格和附录以及专利、申请和出版物均通过引用并入本文。
已经结合附图描述了一些实施方案。但是,应当理解,附图未按比例绘制。距离、角度等仅是示例性的,不一定与所示设备的实际尺寸和布局具有确切的关系。可以添加、删除和/或重新排列组件。此外,结合各种实施方案的任何特定特征、方面、方法、特性、特征、质量、属性、元素等的本文公开内容可在本文阐述的所有其他实施方案中使用。另外,应当认识到,可使用适合于执行所列举步骤的任何设备来实践本文所述的任何方法。
为了本公开的目的,本文描述了某些方面、优点和新颖特征。应当理解,根据任何特定实施方案,不一定可实现所有这些优点。因此,例如,本领域的技术人员将认识到,本公开可以实现本文所教导的一个优点或一组优点的方式来体现或执行,而不必实现本文所教导或暗示的其他优点。
尽管已在某些优选实施方案和实施例的上下文中公开了本文公开的本发明的实施方案,但是本领域技术人员将理解,本发明将具体公开的实施方案延伸至各种发明的其他替代实施方案和/或应用以及显而易见的修改及其等同方案。另外,虽然已详细示出和描述了本发明的几种变型,但是基于本公开,对于本领域技术人员而言,在这些发明的范围内的其他修改对于本领域技术人员将是显而易见的。还可设想,可对实施方案的特定特征和方面进行各种组合或亚组合,并且仍然落入本发明的范围内。应当理解,所公开的实施方案的各种特征和方面可以彼此组合或替代,以便形成所公开的发明的各种模式。此外,可以任何方式修改所公开的过程和方法的操作,包括通过对操作重新排序和/或插入附加操作和/或删除操作。因此,意图是本文所公开的至少一些本发明的范围不应受到上述特定公开的实施方案的限制。权利要求中的限制应基于权利要求中使用的语言来广义地解释,并且不限于在本说明书中或在本申请进行过程中描述的实施例,这些实施例应解释为非排他性的。
- 还没有人留言评论。精彩留言会获得点赞!
- 与CD56分子特异性结合的多肽及其应用的制造方法与工艺
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 避免信号干扰的肌原纤维蛋白丝氨酸磷酸化水平的测定方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 活化人CD40的抗体和针对人PD‑L1的抗体的组合疗法的制造方法与工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺