肿瘤血管生成模型及其制备方法和应用与流程
本发明属于生物三维打印领域或肿瘤模型领域,具体涉及一种肿瘤血管生成模型及其制备方法。
背景技术:
传统的体外研究肿瘤血管发生的方法主要是在2d培养皿中培养肿瘤细胞和/或内皮细胞,体内研究则主要依赖动物模型。
首先,2d培养具有操作简便、培养条件可控等优点,但2d培养的细胞呈单层生长,缺乏细胞-细胞及细胞-细胞外基质之间的相互作用,无法模拟体内肿瘤组织微环境所具有的三维结构,而细胞之间的相互作用和三维微环境对肿瘤的生长和血管的生成至关重要。其次,2d培养的细胞具有充足的氧气和营养物质,这与体内实体肿瘤中存在低氧环境和生物因子浓度梯度不符。因此2d模型可能会产生误导结果,为未来的临床试验提供错误的指导。再者,2d培养的细胞所分泌的细胞因子扩散在培养基中,无法达到有效的生物学浓度,不利于细胞发挥旁分泌和自分泌功能,从而在蛋白表达、细胞信号传导、细胞活性以及对药物的反应方面显示出与体内肿瘤细胞的不同。
动物模型由于存在种属差异和部分实验动物缺乏免疫反应,致使异种移植瘤的生长速度比人类肿瘤更快,导致移植瘤内未成熟的血管无法与人体内已建立较长时间的致瘤血管相比,致使动物实验结果不能准确预测在人体内的治疗效果,同时受到动物体内自身干扰因素较多以及可控性差,这些都不利于肿瘤血管生成机制的研究。鉴于上述2d培养和动物模型存在的局限性,越来越多的学者开始使用3d模型来研究肿瘤血管的发生发展机制。
3d培养为肿瘤细胞提供了体内细胞生长所需的几何结构和微环境,促进了细胞与细胞及细胞外基质之间的相互作用,在细胞增殖、迁移、侵袭、细胞信号传导和基因表达等方面更接近于体内组织。3d培养结合了2d单层培养和动物体内实验的优点,不仅具有体外细胞培养的直观性和条件可控性等优势,还可以获得类似于体内实验的生物表型。
目前研究肿瘤血管生成的3d模型大多是将肿瘤细胞和内皮细胞共培养在一个三维环境中,利用肿瘤细胞自身分泌的血管生长因子或通过添加外源性血管生长因子来促进内皮细胞出芽或成管。在这些模型中,由于肿瘤细胞和/或血管生长因子的存在是促进内皮细胞血管化的必要条件,这也造成了这些模型还存在一些缺陷。
具体来说,向共培养的三维微环境中添加外源性血管生长因子改变了微环境中固有的血管生长因子浓度,不利于肿瘤细胞和内皮细胞的旁分泌和自分泌功能发挥。直接将肿瘤细胞和内皮细胞混合在三维环境中容易造成两种细胞在生长的过程中产生接触抑制,且不符合体内肿瘤细胞的分布规律。将肿瘤细胞种植在含有内皮细胞的3d模型上可以更好的观察和分析肿瘤细胞对内皮细胞的形态结构影响,但由于是人工种植,容易造成肿瘤细胞在材料上的分布不均匀,且肿瘤细胞自身处于二维微环境中,这不利于肿瘤细胞生物学功能的发挥。
由此,在构建的3d肿瘤血管生成模型时,如何更好的发挥共培养体系中肿瘤细胞的生物学功能,对于研究内皮细胞血管化至关重要,因为肿瘤细胞不仅可以通过直接转分化成内皮细胞来参与肿瘤血管生成,更重要的是肿瘤细胞可以通过自身分泌血管生长因子来招募和影响周围内皮细胞参与肿瘤新生血管的形成。
引用文献1公开了一种微囊化肿瘤细胞与内皮细胞共培养模型,并具体公开了:取肿瘤细胞混匀于2%海藻酸钠溶液中,通过微囊发生器将细胞混悬液喷入100mmol/l氯化钙溶液内胶化,生理盐水洗涤,与0.1%多聚赖氨酸溶液反应,生理盐水洗涤,再与0.15%海藻酸钠溶液反应后,生理盐水洗涤,用55mmol/l柠檬酸钠溶液液化微囊核心,在co2培养箱中培养,微囊化肿瘤细胞直接用于共培养,或冻存,取内皮细胞贴壁培养或三维生长,加入微囊化肿瘤细胞于同一培养液中,共培养,分离肿瘤细胞与内皮细胞,行基因和蛋白检测及培养液细胞因子检测。
引用文献2公开了一种肿瘤细胞共培养三维模型及其构建方法和应用,并具体公开了:采用海藻酸盐与钙盐进行交联制备微球作为细胞支架,提供细胞附着的锚点,通过将肿瘤细胞与成纤维细胞三维共培养,再通过transwell装置将内皮细胞与混合细胞微球进行细胞共培养,构建三维共培养肿瘤-血管体外模型。
上述引用文献中均采用共培养的方式进行培养构建三维模型,容易造成两种细胞在生长的过程中产生接触抑制,且不符合体内肿瘤细胞的分布规律。肿瘤细胞在材料上的分布不均匀,且肿瘤细胞自身处于二维微环境中,这不利于肿瘤细胞生物学功能的发挥。
综上所述,虽然现有技术中既公开了用2d培养方式构建的肿瘤血管生成模型,也公开了3d培养的方式构建的肿瘤血管生成模型,但是现有技术中的肿瘤血管生成模型仍存在缺陷。因此,需要构建一个能最大程度地发挥肿瘤细胞固有生物学性能的模型,是研究肿瘤血管生成的关键。
引用文献:
引用文献1:cn101157908a
引用文献2:cn110129262a
技术实现要素:
发明要解决的问题
针对现有技术中肿瘤血管生成模型中存在的缺陷,本发明的目的之一在于提供一种能最大程度地发挥肿瘤细胞固有生物学性能的肿瘤血管生成模型。
本发明的另一目的在于,提供一种原料易于获取,制备步骤简单易行的肿瘤血管生成模型的制备方法。
本发明的又一目的在于,提供一种前述肿瘤血管生成模型的用途。
用于解决问题的方案
本公开涉及的技术方案如下:
[1]、一种肿瘤血管生成模型,其中,所述肿瘤血管生成模型包括水凝胶微纤维,所述水凝胶微纤维呈柱形体的结构,
所述水凝胶微纤维具有相接触的壳结构和芯结构,且所述壳结构位于所述芯结构的径向外侧;其中,
所述壳结构源自于第一水凝胶材料,所述第一水凝胶材料负载有肿瘤细胞;
所述芯结构源自于第二水凝胶材料。
根据上述[1]所述的肿瘤血管生成模型,其中,利用生物打印技术得到所述水凝胶微纤维;所述壳结构包裹于整个所述芯结构的径向外侧;优选地,所述生物打印技术为3d同轴打印技术。
根据上述[1]或[2]所述的肿瘤血管生成模型,其中,所述第一水凝胶材料和/或第二水凝胶材料包括天然高分子化合物中的一种或两种以上的组合;
优选地,所述天然高分子化合物包括选自由海藻酸钠、明胶、胶原蛋白、壳聚糖、透明质酸所组成的组中的一种或两种以上的组合。
根据上述[1]-[3]任一项所述的肿瘤血管生成模型,其中,所述第二水凝胶材料中负载有内皮细胞;
优选地,所述肿瘤细胞和/或内皮细胞表达荧光蛋白。
[5]、一种肿瘤血管生成模型的制备方法,其中,所述肿瘤血管生成模型包括水凝胶微纤维,所述水凝胶微纤维呈柱形体的结构,其中,所述水凝胶微纤维的制备方法包括如下步骤:
原料制备步骤:分别配制第一水凝胶溶液和第二水凝胶溶液,其中,所述第一水凝胶溶液中含有第一水凝胶材料,所述第一水凝胶材料负载有肿瘤细胞;所述第二水凝胶溶液中含有第二水凝胶材料;
打印步骤:利用生物打印技术将所述第一水凝胶溶液打印为壳结构,将所述第二水凝胶溶液打印为芯结构,所述壳结构与所述芯结构相接触,且所述壳结构位于所述芯结构的径向外侧,得到成型体。
[6]、根据上述[5]所述的肿瘤血管生成模型的制备方法,其中,所述生物打印技术为3d同轴打印技术,使在形成所述壳结构的同时形成所述芯结构。
[7]、根据上述[5]或[6]所述的肿瘤血管生成模型的制备方法,其中,所述第一水凝胶溶液中,第一水凝胶材料的质量体积比为10mg/ml~40mg/ml;所述肿瘤细胞的含量为0.5×106个/ml~10×106个/ml;和/或
所述第二水凝胶溶液中,第二水凝胶材料的质量体积比为1mg/ml~5mg/ml;任选存在地,所述第二水凝胶溶液中负载有内皮细胞,所述内皮细胞的含量为0.1×106个/ml~1×106个/ml。
[8]、根据上述[7]所述的肿瘤血管生成模型的制备方法,其中,所述制备方法还包括,将荧光蛋白基因导入所述肿瘤细胞和/或所述内皮细胞中的步骤,优选地,通过病毒或脂质体将荧光蛋白基因导入到所述肿瘤细胞和/或所述内皮细胞中。
[9]、根据上述[5]-[8]任一项所述的肿瘤血管生成模型的制备方法,其中,所述制备方法还包括,利用交联剂对所述成型体进行交联的步骤,优选地,所述交联剂包括含钙离子的溶液;和/或
将所述成型体置于培养箱中进行培养的步骤。
[10]、根据上述[5]-[9]任一项所述的肿瘤血管生成模型的制备方法,其中,所述制备方法还包括,对所述肿瘤血管生成模型中的与肿瘤血管生成相关的因子和/或人源蛋白进行检测;
优选的,所述与肿瘤血管生成相关的因子包括vegfa、bfgf、cd105中的一种或两种以上的组合;和/或,所述人源蛋白包括vwf、gfap中的一种或两种。
[11]、一种根据上述[1]-[4]任一项所述的肿瘤血管生成模型或权利要求[5]-[10]任一项所述的制备方法制备得到的肿瘤血管生成模型在制备用于体内研究和/或体外研究的模型中的应用;可选的,所述体内研究和/或体外研究包括肿瘤血管发生和/或发展机制的研究。
发明的效果
在本发明的一个实施方式中,本发明的肿瘤血管生成模型能够模拟体内肿瘤组织微环境所具有的三维结构,有利于肿瘤细胞和内皮细胞的旁分泌和自分泌功能发挥。并且,两种细胞在生长的过程中不会产生接触抑制,且符合体内肿瘤细胞的分布规律。
在本发明的另一个实施方式中,本发明涉及的肿瘤血管生成模型可以最大程度地发挥肿瘤细胞固有生物学性能。
在本发明的另一个实施方式中,本发明涉及的肿瘤血管生成模型可以用于同步构建肿瘤细胞与内皮细胞共培养三维微环境。
在本发明的另一个实施方式中,本发明涉及的肿瘤血管生成模型可以为研究肿瘤细胞对内皮细胞的增殖、趋化迁移和管腔样结构形成提供理想的体外模型。
在本发明的另一个实施方式中,本发明涉及的肿瘤血管生成模型可以为研究肿瘤细胞对宿主血管内皮细胞的招募作用,以及肿瘤细胞参与肿瘤血管发生的作用提供理想的体内模型。
附图说明
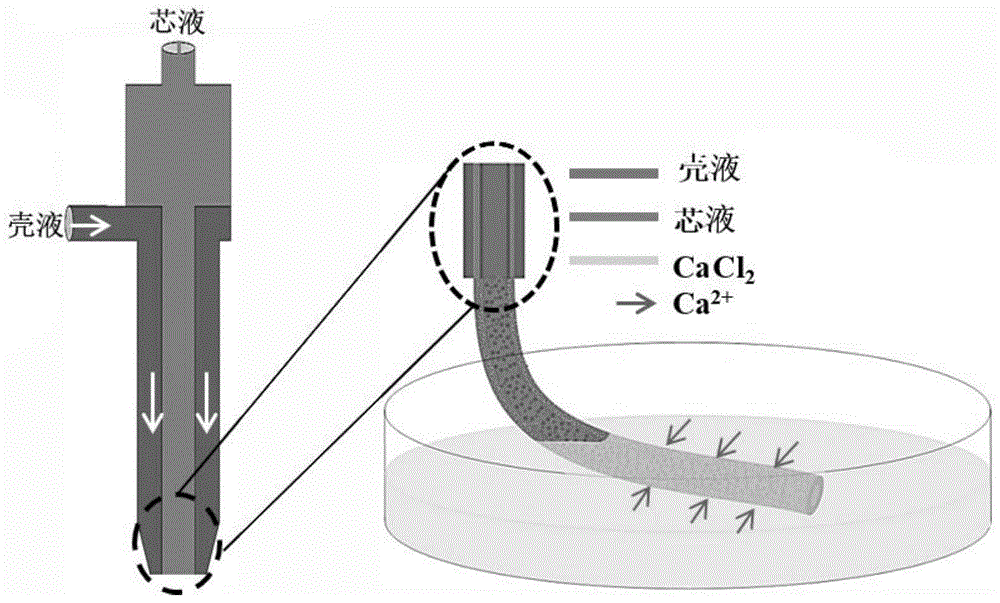
图1示出了本发明3d同轴打印装置(左)和本发明的实施例1的交联步骤(右)的示意图。
图2示出了本发明实施例1构建的壳-u87-rfp/芯-huvec-gfp水凝胶微纤维三维模型在荧光显微镜下的图片(其中,绿色:huvec-gfp;红色:u87-rfp)。
图3a示出了本发明实施例1构建的壳-u87-rfp/芯-huvec-gfp组、实施例4构建的壳-u87-rfp/芯组和对比例1构建的壳/芯-huvec-gfp组,在培养的第1、3、5、7、9天时bfgf的分泌量的折线图。
图3b示出了本发明实施例1构建的壳-u87-rfp/芯-huvec-gfp组、实施例4构建的壳-u87-rfp/芯组和对比例1构建的壳/芯-huvec-gfp组,在培养的第1、3、5、7、9天时vegfa的分泌量的折线图。
图3c示出了本发明实施例1构建的壳-u87-rfp/芯-huvec-gfp组、实施例4构建的壳-u87-rfp/芯组和对比例1构建的壳/芯-huvec-gfp组的细胞增殖情况的折线图。
图4a示出了本发明实施例1构建的壳-u87-rfp/芯-huvec-gfp水凝胶微纤维三维模型扫描电镜图(培养第1天),壳结构中分布的肿瘤细胞u87(黑色箭头),芯结构中分布的内皮细胞huvec(白色箭头)。
图4b示出了本发明实施例1构建的壳-u87-rfp/芯-huvec-gfp水凝胶微纤维三维模型扫描电镜图(培养第7天),壳结构中均匀分布的增殖的肿瘤细胞u87(黑色箭头),芯结构中分布的内皮细胞huvec(白色箭头)。
图5示出了本发明实施例1构建的壳-u87-rfp/芯-huvec-gfp水凝胶微纤维三维模型体外培养第7天,在荧光显微镜下拍摄的照片;其中芯结构中的内皮细胞huvec形成的管腔样结构(绿色:huvec-gfp;红色:u87-rfp)。
图6示出了本发明实施例1构建的壳-u87-rfp/芯-huvec-gfp水凝胶微纤维三维模型于体外培养第7天,壳-u87-rfp/芯-huvec-gfp水凝胶微纤维三维模型中内皮细胞huvec-gfp形成的管腔样结构数量示意图。
图7示出了对比例1构建的壳/芯-huvec-gfp(壳结构中不含肿瘤细胞)体外培养第7天,在荧光显微镜下拍摄的照片;其中,芯结构中的内皮细胞huvec未形成管腔样结构(绿色:huvec-gfp)。
图8示出了对比例2采用传统2d培养内皮细胞huvec-gfp,体外培养第7天时在荧光显微镜下拍摄的照片,其中未见内皮细胞huvec形成管腔样结构。
图9a示出了对比例3采用直接混合人神经胶质瘤细胞u87-rfp与人脐静脉内皮细胞huvec-gfp形成的3d模型,体外培养第7天,在荧光显微镜下拍摄的照片,其中未见内皮细胞huvec形成管腔样结构(绿色:huvec-gfp;红色:u87-rfp)。
图9b示出了对比例4的种植的u87-rfp/huvec-gfp的水凝胶维纤维三维模型,即:将人神经胶质瘤细胞u87-rfp种植到含有人脐静脉内皮细胞huvec-gfp的3d模型上形成的三维模型。体外培养第7天,在荧光显微镜下拍摄的照片,其中未见内皮细胞huvec形成明显的管腔样结构(绿色:huvec-gfp;红色:u87-rfp)。
图10示出了实施例1构建的壳-u87-rfp/芯-huvec-gfp水凝胶微纤维三维模型在体外培养第7天的he染色图。壳结构中分布的肿瘤细胞u87(红色箭头),芯结构中分布的内皮细胞huvec(黑色箭头)。
图11示出了本发明中将实施例4制备得到的壳-u87-rfp/芯水凝胶微纤维三维模型(黑色箭头)植入裸鼠皮下的实验操作照片。
图12示出了本发明实施例4构建的壳-u87-rfp/芯水凝胶微纤维三维模型体外培养7天的壳结构的扫描电镜图,其中可见壳结构中分布的肿瘤细胞u87(黑色箭头)。
图13示出了本发明实施例4构建的壳-u87-rfp/芯水凝胶微纤维三维模型培养7天后,(a)荧光显微镜下壳结构中的肿瘤细胞u87的照片,(b)光镜下壳结构中的肿瘤细胞u87的照片,(c)a和b的合并照片。
图14示出了本发明实施例4构建的壳-u87-rfp/芯水凝胶微纤维三维模型植入裸鼠皮下形成的异种移植瘤he染色照片;其中,肿瘤细胞u87(黑色箭头),未被完全吸收的第一水凝胶材料或第二水凝胶材料(红色圆圈内)。
图15示出了本发明实施例4构建的壳-u87-rfp/芯水凝胶微纤维三维模型植入裸鼠皮下形成的异种移植瘤免疫组化染色照片;其中,棕色染色的是cd105阳性内皮细胞。
图16示出了异种移植瘤中人源性cd105阳性细胞(记作:hcd105)和小鼠源性cd105(记作:mcd105)阳性细胞各自占两者总阳性细胞的比例。
图17示出了异种移植瘤中的人vwf和人gfap的表达。图17中的(a)-(c)用抗人vwf(绿色)和抗人gfap(红色)标记的肿瘤双重免疫荧光染色;细胞核被复染为蓝色。
具体实施方式
本申请的其他目的、特征和优点将从以下详细描述中变得明显。但是,应当理解的是,详细描述和具体实施例(虽然表示本公开的具体实施方式)仅为解释性目的而给出,因为在阅读该详细说明后,在本公开的精神和范围内所作出的各种改变和修饰,对于本领域技术人员来说将变得显而易见。
另外,为了更好地说明本发明,在下文的具体实施方式中给出了众多的具体细节。本领域技术人员应当理解,没有某些具体细节,本发明同样可以实施。在另外一些实例中,对于本领域技术人员熟知的方法、手段、器材和步骤未作详细描述,以便于凸显本发明的主旨。
本说明书中,使用“数值a~数值b”表示的数值范围是指包含端点数值a、b的范围。
本说明书中,术语“三维”与“3d”具有相同的含义,三维是指在平面二维系中又加入了一个方向向量构成的空间系。
本说明书中,术语“2d”与“二维”具有相同的含义,指在一个平面上的内容。
本说明书中,术语“21g”和“16g”中的“g”是指同轴打印装置喷嘴的打印头针管的外径,与注射器针头的国际g号码对照尺寸标准相同。
本说明书中,术语“vegfa”表示血管内皮生长因子a(vascularendothelialgrowthfactora,vegfa),对于生理和病理性血管生成都是必需的。
本说明书中,术语“bfgf”表示碱性成纤维细胞生长因子(basicfibroblastgrowthfactor,bfgf),可作为一种血管生长因子。
本说明书中,术语“cd105”又名endoglin,cd105参与血管生成,是新生血管标志。
本说明书中,术语“vwf”表示血管性血友病因子(vonwillebrandfactor,vwf)。
本说明书中,术语“gfap”表示胶质纤维酸性蛋白(glialfibrillaryacidicprotein,gfap)。
本说明书中,术语“u87”表示“人神经胶质瘤细胞系u87”,是一种肿瘤细胞。
本说明书中,术语“mcf-7”表示“人乳腺癌细胞系mcf-7”,是一种肿瘤细胞。
本说明书中,术语“huvec”表示“人脐静脉内皮细胞(humanumbilicalveinendothelialcells,huvec)”,是一种内皮细胞。
本说明书中,术语“hbmec”表示“人脑微血管内皮细胞(humanbrainmicrovascularendothelialcell,hbmec)”,是一种内皮细胞。
本说明书中,“壳-肿瘤细胞-rfp/芯-内皮细胞-gfp”表示在壳结构中含有携带rfp基因的肿瘤细胞,芯结构中含有携带gfp基因的内皮细胞。
本说明书中,“壳-u87-rfp/芯-huvec-gfp”表示在壳结构中含有携带rfp基因的u87细胞,芯结构中含有携带gfp基因的huvec细胞,可记作u87-rfp/huvec-gfp。
本说明书中,“壳-u118-rfp/芯-hbmec-gfp”表示在壳结构中含有携带rfp基因的u118细胞,芯结构中含有携带gfp基因的hbmec细胞,可记作u118-rfp/hbmec-gfp。
本说明书中,“壳-mcf-7-rfp/芯-huvec-gfp”表示在壳结构中含有携带rfp基因的mcf-7细胞,芯结构中含有携带gfp基因的huvec细胞,可记作mcf-7-rfp/huvec-gfp。
本说明书中,“壳/芯-内皮细胞-gfp”表示在壳结构中仅有水凝胶材料,芯结构中含有携带gfp基因的内皮细胞;“壳/芯-huvec-gfp”表示在壳结构中仅有第一水凝胶材料,芯结构中含有携带gfp基因的huvec细胞,可记作huvec-gfp。
本说明书中,“壳-肿瘤细胞-rfp/芯”表示在壳结构中含有携带rfp基因的肿瘤细胞,芯结构中仅有第二水凝胶材料;“壳-u87-rfp/芯”表示在壳结构中含有携带rfp基因的u87细胞,芯结构中仅有第二水凝胶材料,可记作u87-rfp。
<第一方面>
本发明在<第一方面>提供了一种肿瘤血管生成模型,所述肿瘤血管生成模型包括水凝胶微纤维,所述水凝胶微纤维呈柱形体的结构,
所述水凝胶微纤维具有相接触的壳结构和芯结构,且所述壳结构位于所述芯结构的径向外侧;其中,
所述壳结构源自于第一水凝胶材料,所述第一水凝胶材料负载有肿瘤细胞;
所述芯结构源自于第二水凝胶材料。
本发明的肿瘤血管生成模型能够模拟体内肿瘤组织微环境所具有的三维结构,可以不添加外源性血管生长因子,不会改变微环境中固有的血管生长因子浓度,有利于肿瘤细胞和内皮细胞在三维环境下的旁分泌和自分泌功能的发挥。并且,两种细胞在生长的过程中不会产生接触抑制,且符合体内肿瘤细胞的分布规律。进一步,本发明肿瘤血管生成模型中的肿瘤细胞和内皮细胞各自携带不同颜色的荧光蛋白,有利于更加直观的去观察和研究肿瘤细胞与内皮细胞在三维共培养环境下的相互作用以及生物学行为的变化。
具体而言,本发明的肿瘤血管生成模型包含如下结构:
<壳结构>
在本发明中,所述肿瘤血管生成模型主要包括水凝胶微纤维,所述水凝胶微纤维具有相接触的壳结构和芯结构,且所述壳结构位于所述芯结构的径向外侧,优选地,所述壳结构包裹于整个所述芯结构的径向外侧。
具体地,本发明的壳结构源自于第一水凝胶材料。本发明的第一水凝胶材料可以是本领域中各种常用的水凝胶原料。举例而言,本发明的第一水凝胶材料可以选自天然高分子化合物中的一种或两种以上的组合。具体地,该天然高分子聚合物可以是海藻酸钠、明胶、胶原蛋白、壳聚糖、透明质酸等中的一种或两种以上的组合。
本发明以上的第一水凝胶材料具有良好的生物相容性、亲水性和可降解性,在化学交联后具有良好的机械性能,用于制备本发明的壳结构时,具有较好的支撑作用。
作为优选,第一水凝胶材料可以选用海藻酸钠,使用海藻酸钠不仅有利于细胞的粘附和生长,而且交联后可以使水凝胶获得良好的机械性能。
进一步,本发明的第一水凝胶材料负载有肿瘤细胞。肿瘤细胞在第一水凝胶材料中能够良好生长,且肿瘤细胞自身处于三维微环境中,有利于肿瘤细胞生物学功能的发挥。在本发明中,对于肿瘤细胞的种类不作特定限定。举例而言,所述肿瘤细胞可以是:胶质瘤细胞、胶质瘤干细胞、乳腺癌细胞、肺癌细胞、肝癌细胞、宫颈癌细胞等。优选的,所述肿瘤细胞为人源肿瘤细胞。
在一些具体的实施方式中,本发明的肿瘤细胞可以表达荧光蛋白。本发明对荧光蛋白不作特别限定,可以是本领域常用一些荧光蛋白。举例而言:所述荧光蛋白可以是红色荧光蛋白(rgf)、绿色荧光蛋白(gfp)、增强型绿色荧光蛋白(egfp)、黄色荧光蛋白(yfp)、蓝色荧光蛋白(bfp)、青色荧光蛋白(cfp)等。作为优选,本发明的所述荧光蛋白选自绿色荧光蛋白(gfp)、红色荧光蛋白(rfp)。
在另一些具体的实施方式中,在获得本发明的壳结构后,可以对壳结构进行交联处理,作为优选,可以用含钙离子的溶液进行交联处理。例如:利用氯化钙溶液进行交联处理。通过交联处理可以增强水凝胶的机械强度,能够进一步促使交联后的壳结构包裹在芯结构的径向外侧,这样不仅可以得到与真实血管壁相仿的解剖学结构,还可以避免管腔内部的内皮细胞丢失,保证内皮细胞的浓度,从而更加直观的观察和研究肿瘤细胞和内皮细胞在三维共培养环境下的相互作用。
另外,在本发明中,壳结构的厚度可以是1000μm-2000μm。具体地,当壳液的挤出速度为15ml/h时,壳结构的厚度为1200μm-1800μm,优选1400μm-1600μm。
本发明中所述的“交联”与“交联改性”具有相同或相似的含义,在“交联”的过程中,可以附带有“改性”的一些特点,本发明中为了简便,可以使用“交联”代替“交联改性”。
<芯结构>
本发明的芯结构位于所述壳结构的径向内侧。在本发明中,所述芯结构源自于第二水凝胶材料。
本发明的第二水凝胶材料可以是本领域中各种常用的水凝胶原料,该第二水凝胶材料与第一水凝胶材料可以相同也可以不同。举例而言,本发明的第二水凝胶材料同样可以选自天然高分子化合物中的一种或两种以上的组合。天然高分子聚合物可以是海藻酸钠、明胶、胶原蛋白、壳聚糖、透明质酸中的一种或两种以上的组合等。
作为优选,第二水凝胶材料可以选用胶原蛋白,使用胶原蛋白不仅有利于细胞的粘附和生长,而且有利于内皮细胞形成血管腔样结构。
在一些具体的实施方式中,所述第二水凝胶材料可以负载有内皮细胞。在含有内皮细胞时,本发明的肿瘤血管生成模型可以用于同步构建肿瘤细胞与内皮细胞共培养的三维微环境,从而为进一步研究肿瘤细胞对内皮细胞的增殖、趋化迁移和管腔样结构形成提供理想的体外模型。
在另一些具体的实施方式中,所述第二水凝胶材料不负载内皮细胞,将构建的壳-肿瘤细胞/芯-水凝胶材料植入动物体内进行体内模型的构建。
本发明的肿瘤细胞不仅可以通过直接转分化成内皮细胞来参与肿瘤血管生成,更重要的是肿瘤细胞可以通过自身分泌血管生长因子来招募和影响周围内皮细胞参与肿瘤新生血管的形成。
另外,在本发明中,芯结构的厚度可以是300μm-1000μm。具体地,当芯液的挤出速度为5ml/h时,芯结构的厚度为400μm-800μm,优选500μm-700μm。
具体地,在本发明中,对于内皮细胞的种类不作特别限定,可以是本领域常用的一些内皮细胞。举例而言,所述内皮细胞可以是:脐静脉内皮细胞、脑微血管内皮细胞、动脉血管内皮细胞等。优选的,所述内皮细胞为人源内皮细胞。
在一些具体的实施方式中,本发明的内皮细胞可以表达荧光蛋白。本发明对荧光蛋白不作特别限定,可以是本领域常用一些荧光蛋白。举例而言:所述荧光蛋白可以是红色荧光蛋白(rgf)、绿色荧光蛋白(gfp)、增强型绿色荧光蛋白(egfp)、黄色荧光蛋白(yfp)、蓝色荧光蛋白(bfp)、青色荧光蛋白(cfp)等。作为优选,该荧光蛋白可以选自绿色荧光蛋白(gfp)、红色荧光蛋白(rfp)。
在本发明中,肿瘤细胞表达的荧光蛋白与内皮细胞表达的荧光蛋白可以相同也可以不同,优选地,肿瘤细胞表达的荧光蛋白与内皮细胞表达的荧光蛋白不相同,从而方便观察肿瘤细胞和内皮细胞的生长情况。举例而言,使肿瘤细胞表达红色荧光蛋白(rfp),使内皮细胞表达绿色荧光蛋白(gfp)。采用荧光显微镜观察时,当光源处于红色荧光蛋白(rfp)激发波长范围内时,表达红色荧光蛋白(rfp)的肿瘤细胞呈现红色;当光源处于绿色荧光蛋白(gfp)激发波长范围内时,表达绿色荧光蛋白(gfp)的内皮细胞呈现绿色,这样能直观方便的观察这两种细胞的生长情况。
生物打印技术
在一些具体的实施方式中,本发明利用生物打印技术得到所述水凝胶微纤维;通过使用生物打印技术,可以使所述壳结构包裹于整个所述芯结构的径向外侧。优选地,所述生物打印技术为3d同轴打印技术。3d同轴打印又称同轴挤出式生物打印,其是构建模拟细胞三维微环境的一种新颖方法。基于同轴通道的多样性,可以同时制造出含有多种材料和多种细胞的线样结构。在这种打印技术的帮助下,构建的载细胞壳-芯结构已经用于组织工程、药物筛选和组织器官体外模拟的研究。经典的“壳-芯”结构由生物材料支撑的壳和填充细胞的芯组成,壳内的细胞和芯内的细胞都处于三维微环境下,有利于发挥细胞固有的生物学功能。
本发明的肿瘤血管生成模型同步构建了肿瘤细胞与内皮细胞共培养的三维微环境,最大程度地发挥肿瘤细胞和内皮细胞固有生物学性能,为研究肿瘤细胞对内皮细胞的增殖、趋化迁移和管腔样结构形成提供理想的体外模型。进一步,该模型为研究肿瘤细胞对宿主血管内皮细胞的招募作用,以及肿瘤细胞参与肿瘤血管发生的作用机制提供理想的体内模型。
<第二方面>
本发明在<第二方面>还提供了一种根据<第一方面>所述的肿瘤血管生成模型的制备方法,所述肿瘤血管生成模型包括水凝胶微纤维,所述水凝胶微纤维呈柱形体的结构,其中,所述水凝胶微纤维的制备方法包括如下步骤:
原料制备步骤:分别配制第一水凝胶溶液和第二水凝胶溶液,其中,所述第一水凝胶溶液中含有第一水凝胶材料,所述第一水凝胶材料负载有肿瘤细胞;所述第二水凝胶溶液中含有第二水凝胶材料;
打印步骤:利用生物打印技术将第一水凝胶溶液打印为壳结构,将第二水凝胶溶液打印为芯结构,所述壳结构与所述芯结构相接触,且所述壳结构位于所述芯结构的径向外侧。
其中,所述第一水凝胶溶液为利用<第一方面>中的第一水凝胶材料配制得到;所述第二水凝胶溶液为利用<第一方面>的第二水凝胶材料配制得到。
具体地,所述第一水凝胶溶液中,第一水凝胶材料的质量体积比为10mg/ml~40mg/ml。所述第一水凝胶溶液可以是将第一水凝胶材料溶于氯化钠溶液中制备得到。该氯化钠溶液的质量浓度范围可以是0.5~2%。进一步,所述第一水凝胶溶液中含有肿瘤细胞,所述肿瘤细胞的含量为0.5×106个/ml~10×106个/ml。
所述第二水凝胶溶液中,第二水凝胶材料的质量体积比为1mg/ml~5mg/ml。具体地,当第二水凝胶材料为胶原蛋白时,所述第二水凝胶溶液按照胶原蛋白胶凝程序操作说明进行配制。本发明可以根据实验需要构建肿瘤血管生成模型,其中,第二水凝胶溶液中可以不添加内皮细胞,仅含有第二水凝胶材料。
具体地,所述胶原蛋白胶凝程序操作说明如下:
1)在冰上放置以下物品:胶原蛋白i、无菌10×pbs、无菌蒸馏水、无菌1mol/lnaoh。
2)确定胶原蛋白i待使用溶液所需的最终浓度的体积。
3)在冰上放置无菌管以收存胶原蛋白i。
4)在无菌条件下执行以下步骤:
4.1加入10×pbs(终体积/10)ml;
4.2计算要使用的胶原蛋白i的体积(不要添加到管中直到步骤4.6为止)
终体积×终胶原蛋白i浓度(mg/ml)=要加入的胶原蛋白量
瓶标签上具体浓度(见具体批号);
4.3向10×pbs溶液中加入(要加入的胶原体积×0.023)ml的无菌冰冷1mol/lnaoh;
4.4向4.3溶液中加入下述体积的无菌冰冷蒸馏水:
添加蒸馏水体积=v(终)-v(胶原蛋白)-v(10×pbs)-v(1mol/lnaoh);
4.5混合管中的物质并放入冰中;
4.6加入胶原蛋白i并计算体积,混匀,冰上备用。
5)胶原蛋白i溶液可立即使用或在冰上放置2-3小时。
在一些具体的实施方式中,当所述第二水凝胶溶液中含有内皮细胞时,所述内皮细胞的含量为0.1×106个/ml~1×106个/ml。
在一些具体的实施方式中,本发明的肿瘤血管生成模型的制备方法还包括将荧光蛋白基因导入所述肿瘤细胞和/或所述内皮细胞中的步骤,以使得肿瘤细胞和/或内皮细胞表达荧光蛋白。所述荧光蛋白为第一方面中记载的荧光蛋白。具体地,可以通过病毒或脂质体将荧光蛋白基因导入到所述肿瘤细胞和/或所述内皮细胞中,优选地,所述病毒为慢病毒。通过导入荧光蛋白基因,可以方便观察细胞的生长情况。
进一步地,对于肿瘤细胞和/或内皮细胞的获取,本发明不作特别限定,可通过常规方法培养所述肿瘤细胞和/或内皮细胞至对数生长期后,收集细胞用于转染实验。
具体而言,可用完全培养基制备3×104/ml~5×104/ml的细胞悬液,根据每种细胞的生长速度,向24孔板每孔中加入1×104/ml~3×104个细胞,37℃培养16~24小时。优选地,待细胞汇合度为20~30%时,向每孔加入2~3μl1×108tu/ml介导rfp或gfp基因的病毒感染液,37℃培养12~16小时,更换培养基继续培养。
感染48~96小时后,用荧光显微镜观察感染效率,向培养基中加入工作浓度为2~5μg/ml的嘌呤霉素,每3~4天更换一次含嘌呤霉素的培养液,直至未感染病毒的细胞被嘌呤霉素杀光,将嘌呤霉素浓度降至维持浓度(工作浓度的1/2~1/4),继续对感染后的细胞进行筛选、扩增和培养。
具体地,本发明的完全培养基可以是dmem高糖培养基中添加胎牛血清,以所述完全培养基的总质量计,所述胎牛血清的加入量可以是5-20%。
在一些具体的实施方式中,所述生物打印技术为3d同轴打印技术,使在形成所述壳结构的同时形成所述芯结构。从而可以同步构建肿瘤血管生成模型的壳结构和芯结构,可以最大程度地发挥肿瘤细胞固有生物学性能。
本发明的同轴打印技术是利用同轴打印装置(图1中的左侧部分)实现的。同轴打印装置由外鞘和内芯两部分组成,外鞘的直径为1.0~6.5mm,内芯的直径为0.5~5.8mm,实际使用的外鞘和内芯的直径随嵌入的基体的直径可以进行选择调整。具体地,在进行打印时,在外鞘中加入壳液,在内芯中加入芯液。其中,壳液为第一水凝胶溶液,芯液为第二水凝胶溶液。外接微量注射泵,将内芯缓慢旋入外鞘,进行打印,以获得本发明的水凝胶微纤维。
举例而言,同轴打印装置主要由一个易安装和拆卸的鞘芯同轴喷嘴组成,打印头由一对21g和16g针管构成。打印时将上述配制好的壳液和芯液分别装入到两个5ml注射器内,注射器头端外接延长管并与同轴装置的外鞘通道和内芯通道相连接,注射器置于微量注射泵上,将内芯缓慢旋入外鞘,进行打印。具体地,壳液的挤出速度是5~30ml/h,芯液的挤出速度是1~10ml/h。
在一些具体的实施方式中,本发明的肿瘤血管生成模型的制备方法还包括利用交联剂对所述成型体进行交联的步骤。优选地,所述交联剂包括含钙离子的溶液。其中所述含钙离子的溶液优选为氯化钙溶液(例如:氯化钙水溶液);更优选地,所述氯化钙溶液中,所述氯化钙的质量体积比为10~50mg/ml,交联的时间为1~5分钟。
交联后,可以采用缓冲液对交联后的成型体进行洗涤,所述缓冲液可以是磷酸盐缓冲液,所述磷酸盐例如可以是磷酸二氢钾和/或磷酸二氢钠等,所述缓冲液的ph呈弱碱性,例如ph为7.2-7.5。
通过交联处理可以增强水凝胶的机械强度,能够进一步促使交联后的壳结构包裹在芯结构的径向外侧,这样不仅可以得到与真实血管壁相仿的解剖学结构,还可以避免管腔内部的内皮细胞丢失,保证内皮细胞的浓度,从而更加直观的观察和研究肿瘤细胞和内皮细胞在三维共培养环境下的相互作用。
在一些具体的实施方式中,本发明的肿瘤血管生成模型的制备方法还包括将所述成型体置于培养箱中进行培养的步骤;优选地,将交联后的成型体置于培养箱中进行培养。
具体地,可以将所述成型体置于37℃,5%co2的培养箱中培养,每隔3-4天更换一次培养基,该培养基是前述完全培养基。通过细胞培养后,可以使本发明肿瘤血管生成模型中的肿瘤细胞以及任选存在地内皮细胞获得良好的增殖,更有利于肿瘤细胞生物学功能的发挥。
在本发明中,可以采用可见光显微镜、荧光显微镜、扫描电镜等中的一种或多种显微镜观察所述水凝胶微纤维中所述肿瘤细胞、内皮细胞和/或水凝胶材料的形态和分布。
在本发明的一些具体的实施方案中,当选用可见光显微镜进行观察时可以对水凝胶微纤维进行he染色,以便于进行观察。
当所述肿瘤细胞和/或所述内皮细胞携带有荧光蛋白基因时,可采用上述荧光蛋白的激发波长范围的光源激发使产生荧光,以便于进行观察。
在本发明的一些具体的实施方案中,当采用扫描电镜观察时可以用2.5%戊二醛4℃固定过夜,再分别使用70%、80%、90%、95%、100%和100%梯度乙醇对样品进行脱水,二氧化碳临界点干燥后扫描电镜观察本发明的肿瘤血管生成模型中的肿瘤细胞以及任选存在内皮细胞和水凝胶材料的形态、结构及分布的变化。
在本发明中,本发明还可以对所述肿瘤血管生成模型中的与肿瘤血管生成相关的因子和/或人源蛋白进行检测;可选的,所述与肿瘤血管生成相关的因子包括vegfa、bfgf、cd105中的一种或两种以上的组合;可选的,所述人源蛋白包括vwf、gfap中的一种或两种。
具体地,可以采用elisa的方法检测水凝胶微纤维中的vegfa、bfgf;采用免疫荧光染色法检测vwf、gfap;采用免疫组化染色法检测cd105。
<第三方面>
本发明在<第三方面>还提供了一种根据<第一方面>所述的肿瘤血管生成模型或<第二方面>所述的肿瘤血管生成模型的制备方法制备得到的肿瘤血管生成模型在用于制备体内研究和/或体外研究的模型中的应用;可选的,所述体内研究和/或体外研究包括肿瘤血管发生和/或发展机制的研究。
具体地,本发明涉及的肿瘤血管生成模型可以用于同步构建肿瘤细胞与内皮细胞共培养三维微环境,从而分析壳-肿瘤细胞对芯-内皮细胞的细胞增殖、趋化迁移、管腔样结构形成和血管新生相关标记物表达的影响。
本发明涉及的肿瘤血管生成模型可以为研究肿瘤细胞对内皮细胞的增殖、趋化迁移和管腔样结构形成提供理想的体外模型。
本发明涉及的肿瘤血管生成模型可以为研究肿瘤细胞对宿主血管内皮细胞的招募作用,以及肿瘤细胞参与肿瘤血管发生的作用机制提供理想的体内模型。
实施例
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
在实施例中,具体使用的材料和仪器的厂家及型号或来源如下:
肿瘤细胞:人神经胶质瘤细胞u87、人神经胶质瘤细胞u118、人乳腺癌细胞mcf-7,购自于中国科学院细胞库(中国上海)。
内皮细胞:人脐静脉内皮细胞huvec、人脑微血管内皮细胞hbmec,购自于中国科学院细胞库(中国上海)。
完全培养基(dmem高糖培养基+10%胎牛血清):
dmem高糖培养基,厂家:gibco,货号:c11995500bt;
胎牛血清,厂家:gibco,货号:12664025。
阿尔玛蓝试剂盒:厂家:北京赛驰生物科技有限公司,货号:130012-a。
he染色试剂盒:厂家:北京索莱宝科技有限公司,货号:g1120。
oct包埋剂:厂家:上海鑫乐生物科技有限公司,货号:4853。
抗cd105抗体:厂家:abcam公司,货号:ab11414。
抗vwf抗体:厂家:abcam公司,货号:ab194405。
抗gfap抗体:厂家:abcam公司,货号:ab10062。
vegfaelisa试剂盒:厂家:无锡市东林科技发展有限责任公司,货号:dl-vegfa-hu。
bfgfelisa试剂盒:厂家:上海远慕生物科技有限公司,货号:ym-sx0150。
实施例1
将人神经胶质瘤细胞u87和人脐静脉内皮细胞huvec分别培养在完全培养基中,待两种细胞分别处于对数生长期时收集用于转染实验。用完全培养基制备3×104/ml的细胞悬液,根据每种细胞的生长速度,向24孔板每孔中加入1×104个细胞,37℃培养24小时,待细胞汇合度为30%时,向每孔中加入2μl1×108tu/ml介导rfp或gfp基因的病毒感染液,其中,向人神经胶质瘤细胞u87中加入介导rfp基因的病毒感染液;向人脐静脉内皮细胞huvec中加入介导gfp基因的病毒感染液,37℃培养16小时,更换培养基继续培养;分别得到人神经胶质瘤细胞u87-rfp细胞悬液和人脐静脉内皮细胞huvec-gfp细胞悬液。
感染72小时后荧光显微镜观察感染效率,向培养基中加入工作浓度为5μg/ml的嘌呤霉素,每3~4天更换一次含嘌呤霉素的培养液,直至未感染病毒的细胞被嘌呤霉素杀光,将嘌呤霉素浓度降至维持浓度(工作浓度的1/2),继续对感染后的细胞进行筛选、扩增和培养。
打印前称取一定量的海藻酸钠溶于质量浓度为0.9%氯化钠溶液中,配制质量体积比为20mg/ml海藻酸钠溶液,高温高压灭菌。
对于壳-u87-rfp/芯-huvec-gfp水凝胶微纤维的构建,将收集到的人神经胶质瘤细胞u87-rfp细胞悬液重悬于配制好的无菌20mg/ml海藻酸钠溶液中,得到细胞浓度为1×106/ml的同轴打印所需的壳液。按照本发明上述胶原蛋白胶凝程序操作说明配制浓度为2mg/ml胶原蛋白溶液,将2×105/ml的人脐静脉内皮细胞huvec-gfp细胞悬液与上述胶原蛋白溶液按体积比1:1均匀混合,得到细胞浓度为1×105/ml,胶原蛋白终浓度为1mg/ml的芯液。
同轴打印装置由一个易安装和拆卸的鞘芯同轴喷嘴组成,打印头由一对21g和16g针管构成。打印时将上述配制好的壳液和芯液分别装入到两个5ml注射器内,注射器头端外接延长管并与同轴装置的外壳通道和内芯通道相连接,注射器置于微量注射泵上,设定微量泵壳流的挤出速度为15ml/h,芯流的挤出速度是5ml/h。按照本发明图1所示的同轴打印装置(左)进行同轴生物打印,打印结束后,得到载有细胞的成型体。用装有质量体积比为30mg/mlcacl2溶液的培养皿作为打印接收平台(交联步骤示意图(右)),以对成型体进行交联2分钟。
同轴生物打印后,用磷酸盐缓冲液(1x)(所用的磷酸盐缓冲液含有磷酸二氢钾、氯化钠和磷酸氢二钠,ph值:7.2±0.1)轻轻洗涤该交联后的成型体中残留的交联剂。随后,采用上述完全培养基,将洗涤后的成型体放置在37℃,5%co2的培养箱中培养,每隔3-4天更换一次培养基。如图2所示,图2示出了本发明实施例1构建的壳-u87-rfp/芯-huvec-gfp水凝胶微纤维三维模型在荧光显微镜下的图片(绿色:huvec-gfp;红色:u87-rfp)。实施例1的壳-u87-rfp/芯-huvec-gfp水凝胶微纤维三维模型即可以称为本发明的肿瘤血管生成模型。
实施例2
将人神经胶质瘤细胞u118和人脑微血管内皮细胞hbmec分别培养在完全培养基中,待两种细胞分别处于对数生长期时收集用于转染实验。用完全培养基制备4×104/ml的细胞悬液,根据每种细胞的生长速度,向24孔板每孔中加入2×104个细胞,37℃培养24小时,待细胞汇合度为20%时,向每孔中加入3μl1×108tu/ml介导rfp或gfp基因的病毒感染液,其中,向人神经胶质瘤细胞u118中加入介导rfp基因的病毒感染液;向人脑微血管内皮细胞hbmec中加入介导gfp基因的病毒感染液,37℃培养14小时,更换培养基继续培养;分别得到人神经胶质瘤细胞u118-rfp细胞悬液和人脑微血管内皮细胞hbmec-gfp细胞悬液。
感染72小时后荧光显微镜观察感染效率,向培养基中加入工作浓度为4μg/ml的嘌呤霉素,每3~4天更换一次含嘌呤霉素的培养液,直至未感染病毒的细胞被嘌呤霉素杀光,将嘌呤霉素浓度降至维持浓度(工作浓度的1/3),继续对感染后的细胞进行筛选、扩增和培养。
打印前称取一定量的海藻酸钠溶于质量浓度为0.9%氯化钠溶液中,配制质量体积比为30mg/ml海藻酸钠溶液,高温高压灭菌。
对于壳-u118-rfp/芯-hbmec-gfp水凝胶微纤维的构建,将收集到的人神经胶质瘤细胞u118-rfp细胞悬液重悬于配制好的无菌30mg/ml海藻酸钠溶液中,得到细胞浓度为2×106/ml的同轴打印所需的壳液。按照上述胶原蛋白胶凝程序操作说明配制浓度为4mg/ml胶原蛋白溶液,将4×105/ml的人脑微血管内皮细胞hbmec-gfp细胞悬液与上述胶原蛋白溶液按体积比1:1均匀混合,得到细胞浓度为2×105/ml,胶原蛋白终浓度为2mg/ml的芯液。
同轴打印装置由一个易安装和拆卸的鞘芯同轴喷嘴组成,打印头由一对21g和16g针管构成。打印时将上述配制好的壳液和芯液分别装入到两个5ml注射器内,注射器头端外接延长管并与同轴装置的外壳通道和内芯通道相连接,注射器置于微量注射泵上,设定微量泵壳流的挤出速度为10ml/h,芯流的挤出速度是7ml/h。按照本发明图1所示的同轴打印装置(左)进行同轴生物打印,打印结束后,得到载有细胞的成型体。用装有质量体积比为20mg/mlcacl2溶液的培养皿作为打印接收平台(交联步骤示意图(右)),以进行交联3分钟。
同轴生物打印后,用磷酸盐缓冲液(所用的磷酸盐缓冲液含有磷酸二氢钾、氯化钠和磷酸氢二钠,ph值:7.2±0.1)轻轻洗涤该交联后的成型体中残留的交联剂。随后,采用上述完全培养基,将上述洗涤后的成型体放置在37℃,5%co2的培养箱中培养,每隔3-4天更换一次培养基,得到壳-u118-rfp/芯-hbmec-gfp水凝胶微纤维三维模型。实施例2的壳-u118-rfp/芯-hbmec-gfp水凝胶微纤维三维模型即可以称为本发明的肿瘤血管生成模型。
实施例3
将人乳腺癌细胞mcf-7和人脐静脉内皮细胞huvec分别培养在完全培养基中,待两种细胞分别处于对数生长期时收集用于转染实验。用完全培养基制备5×104/ml的细胞悬液,根据每种细胞的生长速度,向24孔板每孔中加入3×104个细胞,37℃培养24小时,待细胞汇合度为20%时,向每孔中加入2μl1×108tu/ml介导rfp或gfp基因的病毒感染液,其中,向人乳腺癌细胞mcf-7中加入介导rfp基因的病毒感染液,向人脐静脉内皮细胞huvec中加入介导gfp基因的病毒感染液,37℃培养15小时,更换培养基继续培养;分别得到人乳腺癌细胞mcf-7-rfp细胞悬液和人脐静脉内皮细胞huvec-gfp细胞悬液。
感染72小时后荧光显微镜观察感染效率,向培养基中加入工作浓度为5μg/ml的嘌呤霉素,每3~4天更换一次含嘌呤霉素的培养液,直至未感染病毒的细胞被嘌呤霉素杀光,将嘌呤霉素浓度降至维持浓度(工作浓度的1/4),继续对感染后的细胞进行筛选、扩增和培养。
打印前称取一定量的海藻酸钠溶于质量浓度为0.9%氯化钠溶液中,配制质量体积比为20mg/ml海藻酸钠溶液,高温高压灭菌。
对于壳-mcf-7-rfp/芯-huvec-gfp水凝胶微纤维的构建,将收集到的人乳腺癌细胞mcf-7-rfp细胞悬液重悬于配制好的无菌20mg/ml海藻酸钠溶液中,得到细胞浓度为4×106/ml的同轴打印所需的壳液。按照上述胶原蛋白胶凝程序操作说明配制浓度为3mg/ml胶原蛋白溶液,将6×105/ml的人脐静脉内皮细胞huvec-gfp细胞悬液与上述胶原蛋白溶液按体积比1:1均匀混合,得到细胞浓度为3×105/ml,胶原蛋白终浓度为1.5mg/ml的芯液。
同轴打印装置由一个易安装和拆卸的鞘芯同轴喷嘴组成,打印头由一对21g和16g针管构成。打印时将上述配制好的壳液和芯液分别装入到两个5ml注射器内,注射器头端外接延长管并与同轴装置的外壳通道和内芯通道相连接,注射器置于微量注射泵上,设定微量泵壳流的挤出速度为12ml/h,芯流的挤出速度是6ml/h。按照本发明图1所示的同轴打印装置(左)进行同轴生物打印,打印结束后,得到载有细胞的成型体。用装有质量体积比为30mg/mlcacl2溶液的培养皿作为打印接收平台(交联步骤示意图(右)),以进行交联3分钟。
同轴生物打印后,用磷酸盐缓冲液(所用的磷酸盐缓冲液含有磷酸二氢钾、氯化钠和磷酸氢二钠,ph值:7.2±0.1)轻轻洗涤该交联后的成型体中残留的交联剂。随后,采用上述完全培养基,将上述洗涤后的成型体放置在37℃,5%co2的培养箱中培养,每隔3-4天更换一次培养基,得到壳-mcf-7-rfp/芯-huvec-gfp水凝胶微纤维三维模型。实施例3的壳-mcf-7-rfp/芯-huvec-gfp水凝胶微纤维三维模型即可以称为本发明的肿瘤血管生成模型。
实施例4
将人神经胶质瘤细胞u87培养在完全培养基中,待细胞处于对数生长期时收集用于转染实验。用完全培养基制备3×104/ml的细胞悬液,根据细胞的生长速度,向24孔板每孔中加入1×104个细胞,37℃培养24小时,待细胞汇合度为30%时,向每孔中加入2μl1×108tu/ml介导rfp基因的病毒感染液,37℃培养16小时,更换培养基继续培养,得到人神经胶质瘤细胞u87-rfp细胞悬液。
感染72小时后荧光显微镜观察感染效率,向培养基中加入工作浓度为5μg/ml的嘌呤霉素,每3~4天更换一次含嘌呤霉素的培养液,直至未感染病毒的细胞被嘌呤霉素杀光,将嘌呤霉素浓度降至维持浓度(工作浓度的1/2),继续对感染后的细胞进行筛选、扩增和培养。
打印前称取一定量的海藻酸钠溶于质量浓度为0.9%氯化钠溶液中,配制质量体积比为20mg/ml海藻酸钠溶液,高温高压灭菌。
对于壳-u87-rfp/芯水凝胶微纤维的构建,将收集到的人神经胶质瘤细胞u87-rfp细胞悬液重悬于配制好的无菌20mg/ml海藻酸钠溶液中,得到细胞浓度为1×106/ml的同轴打印所需的壳液。按照上述胶原蛋白胶凝程序操作说明配制浓度为2mg/ml胶原蛋白溶液(芯液)。
同轴打印装置由一个易安装和拆卸的鞘芯同轴喷嘴组成,打印头由一对21g和16g针管构成。打印时将上述配制好的壳液和芯液分别装入到两个5ml注射器内,注射器头端外接延长管并与同轴装置的外壳通道和内芯通道相连接,注射器置于微量注射泵上,设定微量泵壳流的挤出速度为15ml/h,芯流的挤出速度是5ml/h。按照本发明图1所示的同轴打印装置(左)进行同轴生物打印,打印结束后,得到载有细胞的成型体。用装有质量体积比为30mg/mlcacl2溶液的培养皿作为打印接收平台(交联步骤示意图(右)),以进行交联2分钟。
同轴生物打印后,用磷酸盐缓冲液(所用的磷酸盐缓冲液含有磷酸二氢钾、氯化钠和磷酸氢二钠,ph值:7.2±0.1)轻轻洗涤该交联后的成型体中残留的交联剂。随后,采用上述完全培养基,将洗涤后的成型体放置于在37℃,5%co2的培养箱中培养,每隔3-4天更换一次培养基,得到壳-u87-rfp/芯水凝胶微纤维三维模型。实施例4的壳-u87-rfp/芯水凝胶微纤维三维模型即可以称为本发明的肿瘤血管生成模型。
对比例1
对比例1与实施例1的区别仅在于,在壳液中不添加人神经胶质瘤细胞u87,然后按照与实施例1完全相同的方法,构建壳/芯-huvec-gfp三维模型。
将人脐静脉内皮细胞huvec培养在培养基中,待细胞处于对数生长期时收集用于转染实验。用完全培养基制备3×104/ml的细胞悬液,根据细胞的生长速度,向24孔板每孔中加入1×104个细胞,37℃培养24小时,待细胞汇合度为30%时,向每孔中加入2μl1×108tu/ml介导gfp基因的病毒感染液,37℃培养16小时,更换培养基继续培养;得到人脐静脉内皮细胞huvec-gfp细胞悬液。
感染72小时后荧光显微镜观察感染效率,向培养基中加入工作浓度为5μg/ml的嘌呤霉素,每3~4天更换一次含嘌呤霉素的培养液,直至未感染病毒的细胞被嘌呤霉素杀光,将嘌呤霉素浓度降至维持浓度(工作浓度的1/2),继续对感染后的细胞进行筛选、扩增和培养。
打印前称取一定量的海藻酸钠溶于质量浓度为0.9%氯化钠溶液中,配制质量体积比为20mg/ml海藻酸钠溶液,高温高压灭菌。
对于壳/芯-huvec-gfp水凝胶微纤维的构建,将配制好的无菌20mg/ml海藻酸钠溶液用作同轴打印所需的壳液。按照上述胶原蛋白胶凝程序操作说明配制浓度为2mg/ml胶原蛋白溶液,将2×105/ml的人脐静脉内皮细胞huvec-gfp细胞悬液与上述胶原蛋白溶液按体积比1:1均匀混合,得到细胞浓度为1×105/ml,胶原蛋白终浓度为1mg/ml的芯液。
同轴打印装置由一个易安装和拆卸的鞘芯同轴喷嘴组成,打印头由一对21g和16g针管构成。打印时将上述配制好的壳液和芯液分别装入到两个5ml注射器内,注射器头端外接延长管并与同轴装置的外壳通道和内芯通道相连接,注射器置于微量注射泵上,设定微量泵壳流的挤出速度为15ml/h,芯流的挤出速度是5ml/h。按照本发明图1所示的同轴打印装置(左)进行同轴生物打印,打印结束后,得到载有细胞的成型体。用装有质量体积比为30mg/mlcacl2溶液的培养皿作为打印接收平台(交联步骤示意图(右)),以进行交联2分钟。
同轴生物打印后,用磷酸盐缓冲液(所用的磷酸盐缓冲液含有磷酸二氢钾、氯化钠和磷酸氢二钠,ph值:7.2±0.1)轻轻洗涤壳-芯水凝胶微纤维中残留的交联剂。随后,采用上述完全培养基,将洗涤后的成型体放置在37℃,5%co2的培养箱中培养,每隔3-4天更换一次培养基,得到壳/芯-huvec-gfp水凝胶微纤维三维模型。
对比例2(传统2d培养内皮细胞-gfp的具体制备步骤)
将人脐静脉内皮细胞huvec培养在完全培养基中,待细胞处于对数生长期时收集用于转染实验。用完全培养基制备4×104/ml的细胞悬液,根据细胞的生长速度,向24孔板每孔中加入2×104个细胞,37℃培养24小时,待细胞汇合度为30%时,向每孔中加入2μl1×108tu/ml介导gfp基因的病毒感染液,37℃培养16小时,更换培养基继续培养。
感染72小时后荧光显微镜观察感染效率,向完全培养基中加入工作浓度为4μg/ml的嘌呤霉素,每3~4天更换一次含嘌呤霉素的培养液,直至未感染病毒的细胞被嘌呤霉素杀光,将嘌呤霉素浓度降至维持浓度(工作浓度的1/2),继续对感染后的人脐静脉内皮细胞huvec进行筛选、扩增和2d培养,得到2d培养的人脐静脉内皮细胞huvec-gfp。
对比例3(直接混合肿瘤细胞-rfp与内皮细胞-gfp形成3d模型的具体制备步骤)
将人神经胶质瘤细胞u87和人脐静脉内皮细胞huvec分别培养在完全培养基中,待两种细胞分别处于对数生长期时收集用于转染实验。用完全培养基制备4×104/ml的细胞悬液,根据每种细胞的生长速度,向24孔板每孔中加入2×104个细胞,37℃培养24小时,待细胞汇合度为30%时,向每孔中加入3μl1×108tu/ml介导rfp或gfp基因的病毒感染液,其中,向人胶质瘤细胞u87中加入介导rfp基因的病毒感染液,向人脐静脉内皮细胞huvec中加入介导gfp基因的病毒感染液,37℃培养14小时,更换培养基继续培养。
感染72小时后荧光显微镜观察感染效率,向完全培养基中加入工作浓度为4μg/ml的嘌呤霉素,每3~4天更换一次含嘌呤霉素的培养液,直至未感染病毒的细胞被嘌呤霉素杀光,将嘌呤霉素浓度降至维持浓度(工作浓度的1/3),继续对感染后的细胞进行筛选、扩增和培养。
称取一定量的海藻酸钠溶于0.9%氯化钠溶液中,配制质量体积比为20mg/ml海藻酸钠溶液,高温高压灭菌。对于混合人神经胶质瘤细胞u87-rfp与人脐静脉内皮细胞huvec-gfp形成的3d模型构建,将收集到的人胶质瘤细胞u87-rfp细胞悬液重悬于配制好的无菌20mg/ml海藻酸钠溶液中,得到细胞浓度为2×106/ml的混合所需的细胞溶液。按照上述胶原蛋白胶凝程序操作说明配制浓度为2mg/ml胶原蛋白溶液,将4×105/ml的人脐静脉内皮细胞huvec-gfp细胞悬液与上述胶原蛋白溶液按体积比1:1均匀混合,得到细胞浓度为2×105/ml,胶原蛋白终浓度为2mg/ml的混合所需溶液。
将上述配制好的含有人神经胶质瘤细胞u87-rfp的海藻酸钠溶液与含有人脐静脉内皮细胞huvec-gfp的胶原蛋白溶液按体积比3:1均匀混合,再用质量体积比为20mg/mlcacl2溶液对混合后的水凝胶进行交联3分钟。
混合交联后,用磷酸盐缓冲液(所用的磷酸盐缓冲液含有磷酸二氢钾、氯化钠和磷酸氢二钠,ph值:7.2±0.1)轻轻洗涤该3d水凝胶模型中残留的交联剂。随后,将载有细胞的3d水凝胶模型在37℃,5%co2的培养箱中培养,每隔3-4天更换一次培养基,得到混合人神经胶质瘤细胞u87-rfp与人脐静脉内皮细胞huvec-gfp形成的3d模型。
对比例4(将肿瘤细胞-rfp种植到含有内皮细胞-gfp的3d模型的具体制备步骤)
将人神经胶质瘤细胞u87和人脐静脉内皮细胞huvec分别培养在完全培养基中,待两种细胞分别处于对数生长期时收集用于转染实验。用完全培养基制备4×104/ml的细胞悬液,根据每种细胞的生长速度,向24孔板每孔中加入2×104个细胞,37℃培养24小时,待细胞汇合度为30%时,向每孔中加入3μl1×108tu/ml介导rfp或gfp基因的病毒感染液,其中,向人神经胶质瘤细胞u87中加入介导rfp基因的病毒感染液,向人脐静脉内皮细胞huvec中加入介导gfp基因的病毒感染液,37℃培养14小时,更换培养基继续培养。
感染72小时后荧光显微镜观察感染效率,向完全培养基中加入工作浓度为4μg/ml的嘌呤霉素,每3~4天更换一次含嘌呤霉素的培养液,直至未感染病毒的细胞被嘌呤霉素杀光,将嘌呤霉素浓度降至维持浓度(工作浓度的1/3),继续对感染后的细胞进行筛选、扩增和培养。
按照上述胶原蛋白胶凝程序操作说明配制浓度为2mg/ml胶原蛋白溶液,将4×105/ml人脐静脉内皮细胞huvec-gfp细胞悬液与上述胶原蛋白溶液按体积比1:1均匀混合,得到细胞浓度为2×105/ml,胶原蛋白终浓度为2mg/ml的溶液。将配制好的含有人脐静脉内皮细胞huvec-gfp的胶原蛋白溶液加入到细胞培养皿中37℃凝胶30min。收集人神经胶质瘤细胞u87-rfp细胞,并以完全培养基重悬得到细胞浓度为2×106/ml的人神经胶质瘤细胞u87-rfp细胞溶液,以微量移液管将上述配制好的u87-rfp细胞溶液种植到人脐静脉内皮细胞huvec-gfp胶原蛋白凝胶表面。
将载有细胞的3d水凝胶模型在37℃,5%co2的培养箱中培养,每隔3-4天更换一次培养基,得到种植的u87-rfp/huvec-gfp的水凝胶维纤维三维模型。
体外实验验证
1、细胞增殖能力验证
为了评价本发明的壳-芯水凝胶微纤维三维模型中的壳-肿瘤细胞-rfp和芯-内皮细胞-gfp在3d水凝胶微环境下的细胞增殖能力,在各组载细胞水凝胶微纤维(具体为实施例1构建的壳-u87-rfp/芯-huvec-gfp组(记作:u87-rfp/huvec-gfp)、实施例4构建的壳-u87-rfp/芯组(记作:u87-rfp)以及对比例1构建的壳/芯-huvec-gfp组(记作:huvec-gfp))在上述实施例或对比例中的培养箱中培养的第1、3、5、7、9天使用阿尔玛蓝试剂来检测细胞的增殖变化。
参照阿尔玛蓝试剂盒说明书来配制试剂的工作液,向每组样品中加入新鲜培养基配制的工作液,37℃下避光孵育2小时,将孵育后的检测溶液转移至96孔板中,每孔100μl,并在570nm和630nm波长下读取光密度(od)值,每组的od值均标准化至第1天以便于绘图和统计学分析。在各组载细胞水凝胶微纤维培养的第1、3、5、7、9天取培养基上清液,根据elisa试剂盒操作说明书分别测定vegfa和bfgf的分泌量变化。其中,vegfa与bfgf是促进内皮细胞血管化的两个重要蛋白,分泌量越多,内皮细胞越容易血管化,实验结果如图3a-图3c所示:
图3a示出了本发明实施例1构建的壳-u87-rfp/芯-huvec-gfp组、实施例4构建的壳-u87-rfp/芯组和对比例1构建的壳/芯-huvec-gfp组,在培养的第1、3、5、7、9天时bfgf的分泌量的折线图。
图3b示出了本发明实施例1构建的壳-u87-rfp/芯-huvec-gfp组、实施例4构建的壳-u87-rfp/芯组和对比例1壳/芯-huvec-gfp组,在培养的第1、3、5、7、9天时vegfa的分泌量的折线图。
图3c示出了本发明实施例1构建的壳-u87-rfp/芯-huvec-gfp组、实施例4构建的壳-u87-rfp/芯组和对比例1构建的壳/芯-huvec-gfp组的细胞增殖情况的折线图。
由图3a及图3b可以看出,本发明实施例1构建的壳-u87-rfp/芯-huvec-gfp组的bfgf和vegfa分泌量大,提示内皮细胞容易血管化。由图3a可以看出,在培养的第5、7、9天,特别是第7天,本发明实施例1构建的壳-u87-rfp/芯-huvec-gfp组和实施例4构建的壳-u87-rfp/芯组分泌bfgf的量明显高于壳/芯-huvec-gfp组。由图3b可以看出,在培养的第5、7、9天,本发明实施例1构建的壳-u87-rfp/芯-huvec-gfp组和实施例4构建的壳-u87-rfp/芯组分泌vegfa的量明显高于壳/芯-huvec-gfp组。
另外,由图3c可以看出,本发明实施例1构建的壳-u87-rfp/芯-huvec-gfp组、实施例4构建的壳-u87-rfp/芯组相比对比例1构建的壳/芯-huvec-gfp组中的细胞增殖(细胞相对增殖)更好。
2、荧光显微镜观察内皮细胞-gfp的形态变化
在上述实施例或对比例中的培养箱中培养的第7天的实施例1构建的壳-u87-rfp/芯-huvec-gfp水凝胶微纤维三维模型、实施例4构建的壳-u87-rfp/芯水凝胶微纤维三维模型、对比例1的壳/芯-huvec-gfp水凝胶微纤维三维模型、对比例2的采用传统2d培养的内皮细胞huvec-gfp、对比例3采用直接混合人神经胶质瘤细胞u87-rfp与人脐静脉内皮细胞huvec-gfp形成的3d模型以及对比例4的将人神经胶质瘤细胞u87-rfp种植到含有人脐静脉内皮细胞huvec-gfp的3d模型上得到的三维模型的荧光显微镜观察结果:
如图5所示,图5示出了本发明实施例1构建的壳-u87-rfp/芯-huvec-gfp水凝胶微纤维三维模型体外培养第7天,在荧光显微镜下拍摄的照片;其中芯结构中的内皮细胞huvec形成的管腔样结构(绿色:huvec-gfp;红色:u87-rfp)。
如图13所示,图13为本发明实施例4构建的壳-u87-rfp/芯水凝胶微纤维三维模型体外培养7天后,(a)荧光显微镜下壳结构中的肿瘤细胞u87的照片,(b)光镜下壳结构中的肿瘤细胞u87的照片,(c)a和b的合并图。
另外,在培养的第7天使用倒置荧光显微镜观察记录实施例1的壳-u87-rfp/芯-huvec-gfp水凝胶微纤维三维模型中内皮细胞huvec-gfp的形态变化,有无趋化迁移现象及管腔样结构形成。并用激光共聚焦显微镜采集图像。为了量化管腔样结构的形成,以细胞组成的闭合环来表示管状结构,使用imagej图像分析软件来分析管腔样结构形成的数量,结果如图6所示,由图6可以看出,培养第7天,壳-u87-rfp/芯-huvec-gfp水凝胶微纤维三维模型中内皮细胞huvec-gfp形成的管腔样结构的数量为9.67±3.52个。
如图7所示,图7示出了对比例1的壳/芯-huvec-gfp水凝胶微纤维三维模型(壳结构中不含肿瘤细胞)体外培养第7天,在荧光显微镜下拍摄的照片;其中,芯结构中的内皮细胞huvec未形成管腔样结构(绿色:huvec-gfp)。
如图8所示,图8为对比例2的采用传统2d培养内皮细胞huvec-gfp,体外培养第7天时在荧光显微镜下拍摄的照片,其中未见内皮细胞huvec形成管腔样结构。
如图9a所示,图9a示出了对比例3采用直接混合肿瘤细胞u87-rfp与内皮细胞huvec-gfp形成3d模型后体外培养第7天,在荧光显微镜下拍摄的照片,其中未见内皮细胞huvec形成管腔样结构(绿色:huvec-gfp;红色:u87-rfp)。
如图9b所示,图9b示出了对比例4的将肿瘤细胞u87-rfp种植到含有内皮细胞huvec-gfp的3d模型上,体外培养第7天,在荧光显微镜下拍摄的照片,其中未见内皮细胞huvec形成明显的管腔样结构(绿色:huvec-gfp;红色:u87-rfp)。
3、he染色观察内皮细胞huvec-gfp的分布特点
在上述实施例1的培养箱中培养的第7天,将实施例1的壳-u87-rfp/芯-huvec-gfp水凝胶微纤维三维模型用质量体积比为40mg/ml的多聚甲醛室温固定1小时,再分别置于质量体积比为200mg/ml和300mg/ml的蔗糖溶液中逐级脱水直至沉底,样品以oct包埋后于冰冻切片机内切片,厚度为6-8μm。将载有样品的玻片置于恒温烘箱内适当烘干,以增加样品与玻片的粘附。按照试剂盒说明书常规行he染色,观察和记录实施例1构建的壳-u87-rfp/芯-huvec-gfp水凝胶微纤维三维模型中u87-rfp和huvec-gfp的分布特点结果如图10所示。图10示出了实施例1构建的壳-u87-rfp/芯-huvec-gfp水凝胶微纤维三维模型在体外培养第7天的he染色图。壳结构中分布的肿瘤细胞u87(红色箭头),芯结构中分布的内皮细胞huvec(黑色箭头)。由图10可以看出,实施例1构建的壳-u87-rfp/芯-huvec-gfp水凝胶微纤维三维模型中u87-rfp和huvec-gfp的分布均匀。
4、扫描电镜观察壳-u87-rfp/芯-huvec-gfp水凝胶微纤维三维模型形态结构及分布的变化
在上述实施例1的培养箱中培养的第1和第7天将实施例1的壳-u87-rfp/芯-huvec-gfp水凝胶微纤维三维模型用质量体积比为25mg/ml的戊二醛4℃固定过夜,再分别使用浓度为70%、80%、90%、95%、100%和100%梯度乙醇对样品进行脱水,在二氧化碳临界点干燥后扫描电镜观察壳-u87-rfp/芯-huvec-gfp水凝胶微纤维三维模型中的形态结构及分布的变化。
如图4a所示,图4a为实施例1构建的壳-u87-rfp/芯-huvec-gfp水凝胶微纤维三维模型扫描电镜图(培养第1天)。壳结构中分布的肿瘤细胞u87(黑色箭头),芯结构中分布的内皮细胞huvec(白色箭头)。
如图4b所示,图4b为实施例1构建的壳-u87-rfp/芯-huvec-gfp水凝胶微纤维三维模型扫描电镜图(培养第7天);其中可见壳结构中均匀分布增殖的肿瘤细胞u87(黑色箭头),芯结构中均匀分布内皮细胞huvec(白色箭头)。
如图12所示,图12为本发明实施例4构建的壳-u87-rfp/芯水凝胶微纤维三维模型体外培养7天的壳结构的扫描电镜图,其中可见壳结构中分布的人胶质瘤细胞u87-rfp(黑色箭头),且人胶质瘤细胞u87-rfp分布均匀。
体内实验验证
准备5只balb/c裸鼠(雄性,4周龄),所有动物实验均按照皖南医学院弋矶山医院动物保护和伦理委员会批准的程序进行。用1%戊巴比妥钠溶液腹腔注射麻醉balb/c裸鼠(30mg/kg),麻醉成功后,背部皮肤常规消毒铺巾,无菌条件下切开皮肤,游离皮下疏松结缔组织,如图11所示,将体外培养第7天的壳-u87-rfp/芯水凝胶微纤维三维模型植入裸鼠皮下,确定移植物放置稳定后用可吸收线缝合皮肤切口,切口消毒等待裸鼠麻醉苏醒。术后裸鼠分笼饲养,定期对手术切口进行消毒。
于动物实验术后第6周取出所有裸鼠皮下移植物,肉眼观察移植物的大体形态和质地,将移植物用质量体积比为40mg/ml多聚甲醛4℃固定过夜,脱水后石蜡包埋,标本切成5μm厚的切片,按照试剂盒说明书常规行he染色和免疫组织化学染色(cd105),其中通过he染色来分析移植物的内部是否有水凝胶的存在,以及壳-芯结构是否消失和水凝胶中是否有胶质瘤细胞。判断同轴打印的三维结构体内移植6周后,第一水凝胶材料、第二水凝胶材料是否被吸收,以及壳-u87-rfp/芯组中原有的肿瘤细胞是否还存在。只有存在人神经胶质瘤细胞u87,才能证明成功构建了肿瘤体内模型。
如图14所示,图14为本发明实施例4构建的壳-u87-rfp/芯水凝胶微纤维三维模型植入裸鼠皮下形成的异种移植瘤he染色图;其中,人神经胶质瘤细胞u87(黑色箭头),未被完全吸收的第一水凝胶材料或第二水凝胶材料(红色圆圈内)。
cd105的免疫组化染色分析移植物中是否有新生血管的形成。如图15所示,图15为本发明实施例4构建的壳-u87-rfp/芯水凝胶微纤维三维模型植入裸鼠皮下形成的异种移植瘤免疫组化染色图;其中,棕色染色的是cd105阳性内皮细胞。
本发明分别选择种属反应性仅为人的抗cd105抗体和种属反应性是人和小鼠的抗cd105抗体作为一抗,对移植物进行免疫组化染色,染色后先在低倍视野(40倍和100倍放大率)下寻找新生血管形成最多的区域,然后在200倍视野下拍照,使用imagej图像分析软件来计算单个微血管数,其中任何棕色染色的内皮细胞或内皮细胞簇被认为是单一的可计数微血管,选择五个不同的视野来计数cd105阳性细胞或细胞簇,5个不同的视野(200倍)可以从一张低倍(40倍)的免疫组化图中选取。微血管密度(mvd)=计数微血管个数/200倍视野下实际视场面积(0.74mm2),即每200倍显微镜视野下所计数得到的微血管个数。利用微血管密度来分析移植物中人源性cd105阳性细胞和小鼠源性cd105阳性细胞各自所占两者总阳性细胞的比例。如图16所示,移植物中人源性cd105阳性细胞占25.63±4.29%,小鼠源性cd105阳性细胞占74.37±3.35%。
对于免疫荧光染色,先将移植物用质量体积比为40mg/ml多聚甲醛4℃固定过夜,再依次置于质量体积比为200mg/ml的蔗糖溶液中逐级脱水直至沉底,标本以oct包埋剂包埋后于冰冻切片机内切片,厚度为6-8μm。将载有标本的玻片置于恒温烘箱内适当烘干,以增加标本与玻片的粘附,按照试剂盒说明书常规行vwf和gfap的双重免疫荧光染色,其中选择抗vwf抗体和抗gfap抗体的种属反应性均仅为人,以进一步证实和评价移植物内部的新生血管是否有来源于人源性肿瘤细胞,结果如图17所示。图17表明移植物内部肿瘤组织中存在内皮细胞共表达人gfap和人vwf,提示移植物内部的新生血管有一部分来源于人源性肿瘤细胞,进一步证实肿瘤细胞可以转分化成内皮细胞,在肿瘤血管生成的过程中发挥着重要作用。
本发明进一步通过利用3d同轴打印技术制备得到的肿瘤血管生成模型,并同步构建与内皮细胞共培养的三维微环境,在此基础上证实本发明的肿瘤血管生成模型中,肿瘤细胞能够对共培养内皮细胞的增殖、趋化迁移和管腔样结构形成产生影响。
通过建立本发明的肿瘤血管生成模型的动物体内实验,验证了本发明的肿瘤血管生成模型中的肿瘤细胞能够对宿主血管内皮细胞产生招募作用并自身参与新生肿瘤的血管生成。
本发明的上述实施例仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!