一种检测PRRSV和PCV的引物组合物、试剂盒及方法与流程
本申请涉及病毒检测技术领域,具体而言,涉及一种检测prrsv和pcv的引物组合物、试剂盒及方法。
背景技术:
猪繁殖与呼吸障碍综合症(porcinereproductiveandrespiratorysyndrome,prrs)是由猪繁殖与呼吸障碍综合症病毒(porcinereproductiveandrespiratorysyndromeviruses,prrsv)引起的一种猪急性传染病,俗称猪蓝耳病,病猪表现为食欲不振,体温升高,以耳根和腹部发红为明显特征,发病率和死亡率极高,该病对猪的危害性极大,引起极大的经济损失。
猪圆环病毒病(porcinecircovirusdisease,pcvd))是由猪圆环病毒ⅱ型(porcinecircovirus2,pcv-2)引起的一种猪传染病,病猪以早期淋巴结肿大,食欲不振,呼吸困难,腹泻,早产及死胎等为特征,发病率20%-60%和死亡率5%-35%。
prrsv和pcv-2引起的prrs和pcvd是猪两种很常见的疫病,临床上还常常有prrsv和pcv混合感染的报道,而且两种病引起猪的临床症状有时很相似,共同的症状表现为体温升高、急性死亡、怀孕母猪流产或死胎等,单靠临床诊断很难作出判断,需要借助实验室才能进行确诊。
目前实验室诊断这两种病的方法常见的有病原分离鉴定、pcr方法、荧光定量pcr方法、elisa方法、lamp方法和gexp方法等,但是这些方法都各有优点与缺点。病原分离鉴定耗时长、繁琐,pcr方法需要电泳才能得结果,elisa方法检病原不够敏感,荧光定量pcr方法和gexp方法需要昂贵的仪器设备,而单重lamp方法也只能检一种病原体。
技术实现要素:
本发明提供了一种检测prrsv和pcv的引物组合物,该引物组合物包括2组特异性引物和探针,其中第一组特异性引物和探针包括pcv-f3,pcv-b3,pcv-fip,pcv-bip,以及pcv-probe,第二组特异性引物和探针包括prrsv-f3,prrsv-b3,prrsv-fip,prrsv-bip,以及prrsv-probe,第一组和第二组特异性引物和探针依次为序列表中seqidno.1至seqidno.10所示核苷酸序列,或为将序列表中seqidno.1至seqidno.10所示的核苷酸序列经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列表中所示的核苷酸序列具有相同功能的核苷酸序列;pcv-probe的5’端标记cy5.5荧光基团,3’端标记bhq2淬灭基团,该cy5.5荧光基团在690nm波长下呈红色;prrsv-probe的5’端标记fam荧光基团,3’端标记bhq1淬灭基团,该fam荧光基团在520nm波长下呈绿色。
本发明还提供了一种检测prrsv和pcv的试剂盒,该试剂盒包括前述的引物组合物。
进一步的,试剂盒中内引物(prrsv-fip、prrsv-bip、pcv-fip、pcv-bip),外引物(prrsv-f3、prrsv-b3、pcv-b3、pcv-f3)和探针probe(prrsv-probe、pcv-probe)的浓度比为80:10:1。
进一步的,本发明试剂盒的每25ul反应体系中包括模板rna/dna2μl,2×缓冲液12.5μl,bst3.0dna聚合酶320u,内引物prrsv-fip、prrsv-bip、pcv-fip和pcv-bip各40pmol,外引物prrsv-f3、prrsv-b3、pcv-b3和pcv-f3各5pmol,探针prrsv-probe和pcv-probe各0.5pmol,加双蒸水补足至25μl;所述2×缓冲液成分为100mmkcl,200mmph8.8的tris–hcl,100mm(nh4)2so4,80mmmgso4,8mbetaine,1%tween-20,14mmdntps。
本发明还提供一种检测prrsv和pcv的方法,该方法采用前述的引物组合物或试剂盒进行环介导等温扩增反应。
进一步的,环介导等温扩增反应的反应体系中内引物(prrsv-fip、prrsv-bip、pcv-fip、pcv-bip),外引物(prrsv-f3、prrsv-b3、pcv-b3、pcv-f3)和探针probe(prrsv-probe、pcv-probe)的浓度比为80:10:1。
进一步的,环介导等温扩增反应反应体系每25ul反应体系中包括模板rna/dna2μl,2×缓冲液12.5μl,bst3.0dna聚合酶320u,内引物prrsv-fip、prrsv-bip、pcv-fip和pcv-bip各40pmol,外引物prrsv-f3、prrsv-b3、pcv-b3和pcv-f3各5pmol,探针prrsv-probe和pcv-probe各0.5pmol,加双蒸水补足至25μl;所述2×缓冲液成分为100mmkcl,200mmph8.8的tris–hcl,100mm(nh4)2so4,80mmmgso4,8mbetaine,1%tween-20,14mmdntps。
进一步的,环介导等温扩增反应的反应过程包括62℃反应90分钟,85℃5分钟。
本发明还提供一种前述的检测prrsv和pcv的引物组合物、试剂盒及检测方法在同时检测猪蓝耳病和猪圆环病毒病中的应用。
本发明的有益效果包括:采用本发明提供的检测prrsv和pcv的引物组合物、试剂盒,检测特异性好,敏感性较高,方便快捷,在荧光下直接通过反应产物颜色判断结果,结果准确直观,可用于临床样品的检测,为临床快速检测区分prrsv和pcv提供了多一种选择方法。
本发明的二重lamp,只需要2条外引物、2条内引物和1条带荧光基团的环引物,而单重常规lamp则需要六条引物包括2条外引物、2条内引物和2条环引物。本发明的环引物上带有不同的发光荧光基团和淬灭基团,反应前荧光基团与淬灭基因紧密相邻,此时探针中的荧光基团不发光,二重lamp反应中,探针分子杂交到靶序列上,引物延伸,使探针断裂,荧光基团与淬灭基团分开,荧光基团发光。结果通过不同的颜色一次能检测鉴别2种病原体,且快捷。
本发明采用bst3.0dna聚合酶进行二重荧光lamp扩增,与采用bst2.0dna聚合酶和bstdna聚合酶大片段的二重荧光lamp相比,具有更佳的的延伸能力活性、更强的逆转录活性以及强烈的链置换活性。以本发明的引物组及用该酶组建的检测试剂盒,一次加模板就能完成lamp扩增,不需要预先对rna模板单独进行逆转为cdna,尤其是对dna和rna(或含有二级复杂结构的rna)混合模板检测特别方便。对有二级复杂结构的rna模板,采用bst2.0dna聚合酶或bstdna聚合酶大片段进行二重荧光lamp则无法进行扩增。
附图说明
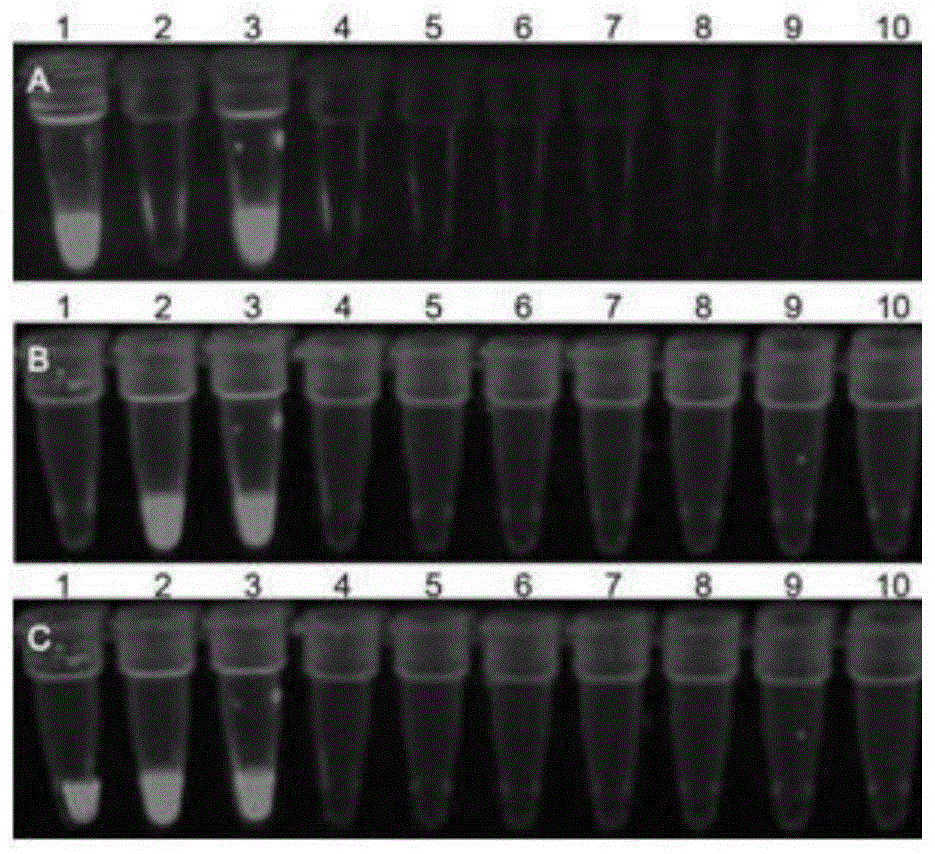
图1为二重荧光lamp特异性检测结果图,其中a为520nm荧光通道图,b为690nm荧光通道图,c为520nm和690nm荧光双通道图;图1a-1c中的1为prrsvch1r,2为pcv-2bh5,3为prrsvch1r和pcv-2bh5,4为csfvc株,5为fmdvo型,6为ppv,7为jev,8为prv,9为bs2,10为ss2;
图2为二重荧光lamp敏感性检测结果图,其中a为520nm荧光通道图,b为690nm荧光通道图,c为520nm和690nm荧光双通道图;图2a-2c中的1-8依次为107~100拷贝/μlcsfv和prrsvrna混合模板标准品;
图3为二重荧光lam干扰性检测结果图,其中a为520nm荧光通道图,b为690nm荧光通道图,c为520nm和690nm荧光双通道图;图3a-3c中的1-7依次为样品1-7。
具体实施方式
下面结合实施例对本发明进行进一步说明和描述,但所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明和实施例中,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他发明和实施例,都属于本发明保护的范围。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。其中,loopamp度仪为日本荣研公司产品,型号loopampla-320c;核酸测定仪为美国thermofisherscientific公司产品,型号nanodrop
2000;多色荧光成像分析系统为美国bio-rad公司产品;rt-lamp试剂盒购自日本荣研公司;rna/dna共提试剂盒和质粒小量提取试剂盒购自北京全式金生物技术有限公司;premixtaqpcr试剂盒和pmd-20t载体购自大连宝生物公司,bst3.0dna聚合酶购自neb公司。
猪繁殖与呼吸障碍综合症毒株ch-1r(美洲型)购自哈尔滨维科生物技术开发公司;猪圆环病毒-2bh5株(pcv-2bh5)由广西壮族自治区兽医研究所保存提供。对照用毒株:猪口蹄疫o型灭活疫苗(fmdvo型)购自兰州兽医研究所;猪细小病毒(ppv)、猪日本乙型脑炎病毒(jev)、猪伪狂犬病病毒(prv)、猪布氏杆菌2号(bs2)、猪链球菌2型(ss2)由广西壮族自治区兽医研究所保存提供;猪瘟兔化弱毒株(c株)(csfvc)由广西丽原生物股份有限公司提供;猪瘟毒株:石门株(f114)购自中国兽医药品监察所。
下述实施例中未作具体说明的分子生物学实验方法,均参照《分子克隆实验指南》(第三版)j.萨姆布鲁克一书中所列的具体方法进行,或者按照试剂盒和产品说明书进行。
实施例1、引物组合物的设计
根据genebank上发表的猪繁殖与呼吸障碍综合症病毒nsp2基因(登录号:mf772778.1)和猪圆环病毒orf2基因(登录号:ky947578.1)序列保守区域,通过mega5.0在线比对分析,然后用primerpremier5.0和primerexplorev4软件分别设计了2套用于lamp特异性扩增的引物及探针组成引物组合物。每套引物组合物包括4条引物和1条探针:外引物f3和b3,内引物fip(fip=f1c+f2)和bip(bip=b1c+b2),探针probe。设计的探针probe序列介于f1c和b1c之间,并且在探针probe的两端分别标记荧光基团和淬灭基团。探针prrsv-probe的5’端标记荧光基团fam,3’端标记了淬灭基团bhq1,在520nm波长通道下,游离的fam荧光基团会激发出绿色荧光。探针pcv-probe的5’端标记荧光基团cy5.5,3’端标记淬灭基团bhq2,在690nm上下波长通道下,游离的cy5.5荧光基团会激发出红色。引物由大连宝生物公司合成,hplc级纯化,引物组合物中的各条引物的序列见表1。
表1引物序列
实施例2、prrsv和pcv二重荧光lamp检测方法的验证试验
1.病原核酸提取
按照rna/dna共提试剂盒说明书要求步骤进行病原核酸的提取,首先吸取250μl病毒液或经处理的临床样品上清液放到1.5ml离心管中,加入病毒裂解液200μl混合,然后按步骤进行病原rna/dna提取,最后加te洗脱缓冲液25μl离心洗脱rna/dna,分装放-80℃保存备用。
2.反应标准模板的制备
将提取prrsvch-1r的rna反转录成cdna,然后用prrsv外引物(prrsv-b3,prrsv-f3)扩增反转录后的cdna模板,扩增产物片断大小约为228bp。用pcv外引物(pcv-f3,pcv-b3)扩增pcv的dna模板,扩增产物片断大小约为324bp。pcr产物经琼脂糖凝胶电泳切胶回收,与pmd-20t载体连接转化感受态细胞dh5α,经pcr和双酶切鉴定重组菌,用质粒小量试剂盒提取培养的阳性重组菌中的质粒。用nanodrop2000测定提取质粒的浓度,然后按公式计算换为拷贝数:拷贝数(copies/μl-1)=6.02×1023/660×3000×10-9×质粒浓度(g/μl-1)。将等量的两种模板按不同浓度进行配比或按梯度进行稀释,制备标准模板保存于-70℃备用或直接应用。
3.二重荧光lamp反应体系和反应条件的优化
将提取prrsvch-1r的rna模板与pcv的dna模板一起建立二重荧光lamp反应体系,并对反应体系中引物浓度、探针浓度及退火延伸温度范围进行优化,优化的引物浓度、探针浓度及温度范围如下:内引物5-60pmol/μl,外引物1-20pmol/μl,探针0.1-1pmol/μl,退火和延伸温度范围60-68℃。
经优化后的最佳反应体系如下:2×lampbuffer12.5μl(日本sigmatokyo公司产品,内含100mmkcl,200mmph8.8的tris–hcl,100mm(nh4)2so4,80mmmgso4,8mbetaine,1%(v/v)tween-20,14mmdntps),bst3.0dna聚合酶320u,40pmol/μl内引物(prrsv-fip、prrsv-bip、pcv-fip和pcv-bip)各1μl(工作终浓度分别为1.6pmol/μl),5pmol/μl外引物(prrsv-f3、prrsv-b3、pcv-b3和pcv-f3)各1μl(工作终浓度分别为0.2pmol/μl),0.5pmol/μl探针probe(prrsv-probe和pcv-probe)各1μl(工作终浓度分别为0.02pmol/μl),模板rna/dna2μl,用灭菌超纯水补足25μl。将各试剂轻轻混合,然后置loopamp浊度仪或恒温水浴锅。
经优化后最佳的退火延伸温度为62℃,反应90分钟,85℃5分钟结束反应。
4.二重荧光lamp反应结果判定
将根据步骤3中优化的反应体系和反应条件获得的反应产物取出,置多色荧光成像分析系统中。
选择520nm和690nm通道下显色,在520nm通道下含有阳性对照的prrsv样品呈绿色,pcv样品和阴性对照样品为无色,在690nm通道下含有阳性对照的pcv样品呈红色,prrsv和阴性对照样品为无色,在520nm和690nm共同通道下同时含有阳性对照的prrsv和pcv混合样品呈黄色,阴性对照样品为无色。在标准阳性和阴性样品成立的情况下,根据颜色判断检测样品结果,结果直观准确,容易判断。
5.二重lamp特异性测试
提取prrsvch-1r的rna和pcv-2bh5的dna,同时提取对照毒株csfvc、fmdvo型、ppv、jev、prv、bs2、ss2的rna或dna,并测定其浓度,用步骤3建立的优化反应条件和方法对这些提取的rna或dna进行二重荧光lamp扩增检测,验证本方法的特异性。
如图1所示,采用本发明的二重荧光lamp检测方法只能扩增出prrsv和pcv毒株,参试的对照毒株csfvc、fmdvo型、ppv、jev、prv、bs2、ss2没有呈现任何颜色,即对照毒株没有扩增。prrsv与pcv毒株间没有交叉颜色变化,具有良好的特异性。
6.二重lamp敏感性和干扰性测试
将步骤2制备的prrsch-1r和pcv-2bh5毒株的标准模板测定浓度,根据浓度换算为拷贝数,然后作10倍梯度稀释为1×107~1拷贝/μl,将各梯度相同拷贝浓度的csfv和pcv核酸等体积混合,利用本实验步骤3建立的二重荧光lamp方法对prrsv和pcv混合模板进行测试,检验本方法的最低检出的拷贝数。
如图2所示,采用本发明的二重荧光lamp方法最低能检测出100个拷贝的prrsv和pcv混合模板浓度。
将csfv和prrsv标准模板按不同浓度等体积混合,制备不同模板浓度的混合样品,利用本发明建立的二重荧光lamp方法对prrsv和pcv混合模板进行测试,检验不同的模板浓度对本方法的干扰性。不同模板浓度的混合样品如下:样品1(107prrsv+101pcv),样品2(106prrsv+102pcv),样品3(105prrsv+103pcv)样品4(104prrsv+104pcv),样品5(103prrsv+105pcv),样品6(102prrsv+106pcv),样品7(101prrsv+107pcv)。
如图3所示,当两个模板浓度不同时,尤其是一个模板浓度高,另一个模板浓度低时,本方法仍然可鉴别检测到不同的两个模板,即不同的模板浓度对本方法干扰性小。
7.临床样品验证
采集来自广西不同地区不同猪场的患病猪的临床样品93份,这些样品包括肺组织41份和淋巴结52份。提取肺组织及淋巴结组织中病毒核酸:取适量的肺组织、淋巴结分别进行研磨,按1:5加入灭菌的磷酸盐缓冲溶液(pbs)继续研磨匀浆,吸取1.5ml匀浆放入到2mlep管中,-70℃反复冻融3次,3000r/min离心5min,吸取上清液250μl按rna/dna共提试剂盒提取核酸。然后用本实验步骤3建立的二重荧光lamp进行扩增检测,同时用已建立的prrsv和pcv荧光定量pcr方法作对比检测,对扩增阳性的产物送生物公司进行测序测定,以验证本方法建立的二重荧光lamp的准确性。
用本发明建立的二重荧光lamp方法对临床样品93份进行检测,检测结果prrsv检测阳性样品12份,检测阳性率为10.7%,pcv检测阳性样品8份,检测阳性率为7.14%。检测结果prrsv和pcv同时为阳性的样品5份,该样品为混合感染样品,混合感染率为5.38%,这一结果与荧光定量pcr方法检测结果一致。检测的所有阳性样品产物送生物公司测序,测序结果经序列比对分析全为对应病毒。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种荧光定量PCR技术检测意大利蜜蜂王浆主蛋白MRJP 2基因表达的方法与流程
- 一种用于对不同银杏进行基因分型的SNP引物及检测方法与流程
- 用于基因甲基化检测的引物和探针、采样方法、试剂盒与流程
- 一种基于荧光PCR检测ESR1基因突变的引物及探针的制造方法与工艺
- 转基因甜菜GTSB77品系特异性实时荧光PCR检测引物、探针、方法和试剂盒与流程
- 一种基于单核苷酸多态性的葡萄球菌种水平鉴定和菌株分型一体化方法与流程
- 一套毛花猕猴桃和中华猕猴桃物种间杂交子代的鉴定引物的制造方法与工艺
- 检测黄杉大小蠹的引物、试剂盒及检测方法与流程
- 环介导等温扩增技术检测铜绿假单胞菌的引物和试剂盒的制造方法与工艺
- 一种用于鉴定浙贝母的引物对及其应用的制造方法与工艺