一种牡丹籽粕ACE抑制肽及其制备方法与应用与流程
本发明涉及一种牡丹籽粕ace抑制肽及其制备方法和应用,属于食品生物技术领域。
背景技术:
高血压是一种心血管病综合征,也是危及人们心血管疾病的主要因素之一,其常伴随其他病症,如动脉粥样硬化、心肌梗死和中风等。高血压发病的原因一般是遗传和环境因素,当代在饮食习惯、作息规律、精神压力等因素的影响下,高血压病愈发普遍。
血管紧张素转换酶(ace)是一类含锌的二肽羧基肽酶,它主要存在于肺和一些器官中,如脑、心、肝、肾、肠和胎盘中。此外,肺内皮细胞、吸收上皮细胞、神经上皮细胞和附睾细胞等几种细胞中也含有ace。血管紧张素转换酶在参与高血压调节起到重要的作用,参与肾素-血管紧张素系统(ras)和激肽释放酶-激肽系统(kks)。ace抑制肽的作用原理就是通过抑制或降低ace酶活性达到降低血管紧张素ii(angii)的生成和避免激肽、缓激肽的失活,起到调节血压的目的。常见的ace抑制剂药物有卡托普利、苯那普利、依那普利、培哚普利等,但是临床上显示长期服用降压药,会有咳嗽、血管性水肿、头痛等不良反应。因此,目前食源的降压肽研究得到重视,因其具有天然、安全性高、易吸收、无副作用的特点而备受关注。
牡丹籽经榨油后的籽粕大多丢弃或者作为动物饲料,其生物利用率低。牡丹籽蛋白含量为18%-35%,具有很高的营养价值。牡丹籽ace抑制肽生产制备和保存方面的研究开发,能够达到牡丹籽粕蛋白的有效利用的目的,提高牡丹籽的附加价值,实现资源的综合利用。
技术实现要素:
本发明的目的是提供一种牡丹籽粕ace抑制肽及其制备方法和应用,提高牡丹籽的附加价值,实现资源的综合利用。
为实现上述目的,采用以下技术方案:
本发明提供一种ace抑制肽,其氨基酸序列为val-leu-ser-gly-phe,缩写为vlsgf,即由缬氨酸-亮氨酸-丝氨酸-甘氨酸-苯丙氨酸5个氨基酸残基构成。
进一步,所述ace抑制肽可以来自于牡丹籽粕天然提取或人工氨基酸合成。
本发明提供一种所述ace抑制肽的制备方法,包括如下步骤,
1)牡丹籽粕蛋白酶解产物的制备:牡丹籽粕经粉碎后,经石油醚脱脂干燥后过筛备用。采用碱提酸沉法得到牡丹籽粕蛋白,采用中性蛋白酶将其在以下酶解条件下酶解:底物浓度2%(w/v)、ph7.50、酶添加量7200u/g、温度43℃,酶解时间2h,酶解后沸水浴10min灭活,冷却后调节ph至中性,4℃条件下10000rpm离心20min,取上清液冷冻干燥,即为牡丹籽粕蛋白质酶解产物。
2)牡丹籽粕蛋白的酶解产物利用sephadexg-25凝胶色谱进行分离,以去离子水为洗脱液,流速0.3ml/min,测量洗脱组分在214nm波长处的吸光值;收集具有最佳ace抑制活性的峰,利用反相高效液相色谱rp-hplc进一步分离;rp-hplc的洗脱梯度为0-3min,5%(v/v)乙腈(含0.1%三氟乙酸);3-43min,5%-40%(v/v)乙腈(含0.1%三氟乙酸);43-53min,40%(v/v)乙腈(含0.1%三氟乙酸);流速为2.0ml/min,检测波长214nm,收集洗脱时间为32-34min的洗脱峰,真空冷冻干燥即得所述ace抑制肽。
所述ace抑制肽鉴定是通过lc-ms/ms对活性肽进行氨基酸序列鉴定。
本发明的优点在于:
所述牡丹籽粕ace抑制肽vlsgf具有较强的ace抑制活性,其ic50值为0.328mg/ml。该ace抑制肽在细胞水平上无毒副作用,能够提高细胞no的释放量,且具有分子量小、安全、稳定和容易吸收等特点。该ace抑制肽可用于制备高血压治疗/预防药物,或作为功能食品添加剂,供高血压患者长期保健使用。
附图说明
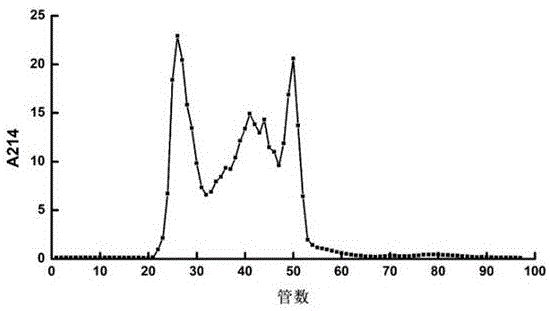
图1:牡丹籽粗蛋白酶解产物sephedexg-25凝胶过滤色谱图。
图2:凝胶色谱洗脱组分f4反相高效液相色谱图。
图3:ace抑制肽鉴定的质谱图。
图4:ace抑制肽的活性测定。
图5:ace抑制肽分子对接图。
图6:ace抑制肽细胞毒性结果图。
图7:ace抑制肽对huvec细胞ros水平的影响结果图。
图8:ace抑制肽对huvec细胞no释放量的影响结果图。
具体实施方式
本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和过程,但本发明的保护范围不仅限于下述的实施实例。
实施例1
本发明所述ace抑制肽的分离纯化包括sephadexg-25凝胶过滤色谱和反相高效液相色谱(rp-hplc)两个步骤。
牡丹籽粕蛋白酶解产物的制备:牡丹籽粕经粉碎后,经石油醚脱脂干燥后过筛备用。采用碱提酸沉法,加入naoh溶液从脱脂处理后的牡丹籽粕中提取蛋白,提取工艺条件为:料液比1:25(w/v),浸提ph9.25,提取温度53℃,提取时间70min;将提取液4℃条件下10000r/min离心15min,取上清并调节ph为4.0进行使蛋白酸沉,在4℃条件下10000r/min离心15min后取沉淀,沉淀用水复溶,调节ph为中性,冷冻干燥备用。采用中性蛋白酶将其在最佳酶解条件:底物浓度2%(w/v)、ph7.50、酶添加量7200u/g、温度43℃,酶解2h,酶解后沸水浴10min灭活,经10000rpm离心20min,取上清液冷冻干燥,即为牡丹籽粕蛋白质酶解产物。
sephadexg-25凝胶过滤色谱:将牡丹籽粕蛋白质酶解产物冻干粉,溶解于去离子水中,于4℃下,10000rpm离心10min。取上清液用0.22μm微滤膜过滤除杂后上样。sephadexg-25凝胶柱(1.6cm×100cm)用去离子水平衡,将已过滤的样品上柱。用去离子水洗脱,流速0.3ml/min,于214nm波长处检测洗脱液吸光值,绘制洗脱曲线,如图1所示。收集各组分进行ace抑制活性测定,以检测ace抑制肽不同分子量的组分的ace抑制活性情况。收集洗脱组分f4,真空冷冻干燥,-20℃低温保存备用。
高效液相色谱:去离子水溶解上述组分f4干粉,采用高效液相色谱柱gemini5μc18(250mm×10mm)(phenomenex,uk)进行进一步分离纯化,用水和乙腈(含0.1%的三氟乙酸)构成的洗脱系统进行梯度洗脱。rp-hplc的洗脱梯度为0-3min,5%(v/v)乙腈;3-43min,5%-40%(v/v)乙腈;43-53min,40%(v/v)乙腈。流速为2.0ml/min,检测波长214nm,洗脱曲线如图2所示,收集洗脱时间为32-34min的洗脱峰,真空冷冻干燥即得所述抗ace抑制肽。
将收集到的ace抑制肽组分冷冻干燥,采用高效液相色谱进行二次纯化,检验组分纯度。经检测,该抗氧化肽组分纯度达到95%。
用液相色谱与质谱连用(lc-ms/ms)方法测定氨基酸序列(图3),得到该ace抑制肽的氨基酸序列vlsgf。
实施例2
对分离纯化获得的ace抑制肽活性进行活性检测。在96孔板上添加0.1u/ml的ace酶10μl,1mmol/l底物fapgg50μl,一定浓度的样品40μl,用酶标仪在340nm下测吸光值,记为a1。在37℃下继续反应30min,再次测定吸光值,记为a2,平行实验3次,结果取平均值。其中fapgg溶解于100mmol/l的硼酸缓冲液中(ph8.3,含300mmol/lnacl),以去离子水作为空白对照。∆a(∆a=a1-a2)表示单位时间内ace酶活性的变化,ace抑制活性计算公式如下:
式中,∆as为加入样品时30min内ace活性的变化,∆ab为空白组30min内吸光值的变化。
从图4可以看出,ace抑制肽vlsgf的ace抑制活性ic50为0.328mg/ml。
实施例3
ace抑制肽与ace的分子对接。从rcsb蛋白数据库中(http://www.rcsb.org/pdb/home/home.do)下载ace蛋白的三维结构文件(pdbid:1o8a),用autodocktool4.0与autodockvina软件进行蛋白及ace抑制肽的准备及对接,根据预测的结合能,选择与ace的最佳结合方式,并确定了ace抑制肽与ace之间的相互作用方式。
vlsgf与ace最低结合能为-8.6kcal/mol,vlsgf与ace之间的相互作用力包括范德华力、氢键结合作用,同时还与金属离子作用有关。从图5可以看出,vlsgf与不仅与ace蛋白分子的活性口袋s1的三个氨基酸ala354、glu384和tyr523都形成了氢键,同时与活性位点口袋s2的his353和his513也形成了氢键,说明vlsgf与活性口袋s1和s2结合,发挥抑制活性。
实施例4
ace抑制肽对huvec细胞毒性试验。将huvec细胞用胰酶消化成细胞悬液,以1×105个/ml的密度接种于96孔板中,培养箱培养1天贴壁后,弃培养基,加入配制好的不同浓度ace抑制肽(0.125、0.25、0.5mg/ml)继续培养,对照组不添加多肽。培养24h后,弃培养基,加入新的dmem培养液和10%的cck-8试剂,于37℃条件下继续孵育1h,用酶标仪测定其在450nm处的吸光值,计算细胞存活率。
由图6可知,随着ace抑制肽浓度的增加,vlsgf使得细胞活力有下降的趋势,但在浓度达到1.00mg/ml时,细胞的存活率仍在90%以上。从此结果可以看出,ace抑制肽vlsgf无细胞毒性,可用于制备高血压的治理或预防药物,或作为功能食品添加剂,供高血压患者治疗保健使用。
实施例5
ace抑制肽对huvec细胞毒性试验。将huvec细胞用消化为细胞悬液,使细胞以1×105个/ml的密度接种于96孔板中,培养1天贴壁后,弃培养基,加入新鲜的培养基。实验设置为3组,分别为对照组、angⅱ刺激组和多肽+angⅱ组,其中angⅱ+多肽组先加入含有不同浓度的多肽(0.125、0.25和0.5mg/ml)预处理2h后,在angⅱ刺激组和多肽+angⅱ组中加入0.01mg/ml的angⅱ,对照组不做任何处理。培养24h后取培养液测定no含量。
从图7可以看出,vlsgf浓度达到0.5mg/ml时,对比angii刺激组,no释放量显著升高(p<0.05),说明在高剂量下多肽vlsgf能够促进内皮细胞no的释放,保护细胞减少血管收缩剂angii对细胞的影响,起到一定的降血压的作用。
实施例6
ace抑制肽对细胞ros水平的影响。细胞内活性氧(ros)水平过高与很多心血管疾病的发病机制有关,图8可得,angii高压刺激下,细胞的ros水平显著提高(p<0.05),说明在angii高压刺激下使得细胞发生氧化应激反应。在有ace抑制肽vlsgf存在的情况下,细胞的ros水平显著降低(p<0.001)。说明多肽vlsgf还能够抑制angii诱导的细胞氧化应激,对于内皮细胞有保护作用,进而可能保护心血管,减少高血压病症的发生。
尽管上面已经描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在不脱离本发明的原理和宗旨的情况下在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
sequencelisting
<110>福州大学
<120>一种牡丹籽粕ace抑制肽及其制备方法与应用
<130>1
<160>1
<170>patentinversion3.3
<210>1
<211>5
<212>prt
<213>人工序列
<400>1
valleuserglyphe
15
- 还没有人留言评论。精彩留言会获得点赞!