FRT细胞株在制备筛选CFTR调节剂的制剂或试剂盒中的应用的制作方法
frt细胞株在制备筛选cftr调节剂的制剂或试剂盒中的应用
技术领域
[0001]
本发明涉及生物医药领域,特别涉及frt细胞株在制备筛选cftr调节剂的制剂或试剂盒中的应用。
背景技术:
[0002]
第二信使是细胞内的信号转导的启动组成部件之一,主要包括:环腺苷酸(camp)、环磷酸鸟苷(cgmp)、钙离子(ca
2+
)、肌醇三磷酸(ip3)、甘油二酯(dag)等。camp作为胞浆内重要的第二信使,可调控细胞内诸多重要的生理过程,如参与细胞的增值与分化、激素的合成与分泌、基因表达、信号转导、神经节突触传递的调节等。胞浆内camp也参与许多病理过程,是治疗心脏病、急性白血病、慢性呼吸道疾病、某些肿瘤等疾病的潜在靶点。因此,胞浆内第二信使camp一直是科研领域的研究热点。目前,检测胞浆内camp的方法主要有报告基因检测法、竞争法、放射性标记法等。报告基因检测法缺点是蛋白的半衰期较短,常规分析的重复性差。竞争法缺点是操作繁琐,试剂耗费高。放射性标记法缺点是需要特定的仪器设备,对操作人员技术要求高,对操作人员可能有潜在风险。
技术实现要素:
[0003]
有鉴于此,本发明建立了一种基于cftr可敏感检测胞浆内第二信使camp的细胞模型。
[0004]
为了实现上述发明目的,本发明提供以下技术方案:
[0005]
本发明还提供了frt细胞株在检测胞浆内camp浓度的应用;所述frt细胞株中ano1和yfp-h148q/i152l共表达;
[0006]
其中,相对荧光强度变化值/slope值/斜率值与细胞内camp浓度呈现良好的正相关;
[0007]
所述相对荧光强度变化值/slope值/斜率值计算如下:
[0008][0009]
0s~1.4s的相对荧光值的平均值;
[0010]
y:2.4s~14.8s与0.6s~13s做线性回归分析所得到的线性回归的结果。
[0011]
本发明还提供了frt细胞株在制备检测胞浆内camp浓度的制剂或试剂盒中的应用;所述frt细胞株中ano1和yfp-h148q/i152l共表达;
[0012]
其中,相对荧光强度变化值/slope值/斜率值与细胞内camp浓度呈现良好的正相关;
[0013]
所述相对荧光强度变化值/slope值/斜率值计算如下:
[0014][0015]
0s~1.4s的相对荧光值的平均值;
[0016]
y:2.4s~14.8s与0.6s~13s做线性回归分析所得到的线性回归的结果。
[0017]
本发明还提供了frt细胞株在制备预防和/或治疗与胞浆内camp相关疾病的药物中的应用;所述frt细胞株中ano1和yfp-h148q/i152l共表达;
[0018]
其中,相对荧光强度变化值/slope值/斜率值与细胞内camp浓度呈现良好的正相关;
[0019]
所述相对荧光强度变化值/slope值/斜率值计算如下:
[0020][0021]
0s~1.4s的相对荧光值的平均值;
[0022]
y:2.4s~14.8s与0.6s~13s做线性回归分析所得到的线性回归的结果。
[0023]
在本发明的一些具体实施方案中,所述与胞浆内camp相关疾病包括心脏病、急性白血病、慢性呼吸道疾病、肿瘤中的一种或多种。
[0024]
本发明还提供了检测胞浆内camp浓度的制剂或试剂盒,包括frt细胞株以及可接受的助剂;所述frt细胞株中ano1和yfp-h148q/i152l共表达;
[0025]
其中,相对荧光强度变化值/slope值/斜率值与细胞内camp浓度呈现良好的正相关;
[0026]
所述相对荧光强度变化值/slope值/斜率值计算如下:
[0027][0028]
0s~1.4s的相对荧光值的平均值;
[0029]
y:2.4s~14.8s与0.6s~13s做线性回归分析所得到的线性回归的结果。
[0030]
本发明提供了frt细胞株在制备筛选cftr调节剂的制剂或试剂盒中的应用;所述frt细胞株中ano1和yfp-h148q/i152l共表达;
[0031]
所述frt细胞株通过荧光信号反应细胞内camp浓度的变化进而筛选cftr调节剂;
[0032]
所述荧光信号为相对荧光强度变化值/slope值/斜率值,所述相对荧光强度变化值/slope值/斜率值与cftr调节剂浓度成剂量依赖关系;
[0033]
其中,相对荧光强度变化值/slope值/斜率值与细胞内camp浓度呈现良好的正相关;
[0034]
所述相对荧光强度变化值/slope值/斜率值计算如下:
[0035][0036]
0s~1.4s的相对荧光值的平均值;
[0037]
y:2.4s~14.8s与0.6s~13s做线性回归分析所得到的线性回归的结果。
[0038]
囊性纤维化跨膜传导调节因子(cystic fibrosis transmembrane conductance regulator,cftr)是一种具有门控性的camp依赖的氯离子通道蛋白,它可以反映细胞内第二信使camp的浓度改变,当胞浆内camp浓度升高,可敏感激活cftr通道,使cftr通道开放。yfp-h148q/i152l是对卤族元素敏感的黄色荧光蛋白双突变体,具有遇到i-会发生淬灭的特性。当胞浆内camp浓度升高时,cftr通道开放,可将细胞外i-转运到胞浆内,使黄色荧光蛋白的荧光发生淬灭,因此yfp-h148q/i152l相当于一个可检测cftr是否开放的生物传感器。本研究利用此原理构建稳定共转染cftr和yfp-h148q/i152l的fischer大鼠甲状腺滤泡上皮(fischer rat thyroid,frt)细胞模型作为基于cftr的胞浆内第二信使camp检测方
法,测定原理如图1所示。该模型可敏感检测胞浆内camp浓度的变化,通过荧光斜率值反映细胞内camp浓度的变化,具有灵敏度高、重复性好、适用性广等特点。本研究解决了以往检测camp方法价格昂贵、重复性差、操作繁琐等问题,具有检测灵敏、操作简便、试剂耗费低的优点。本研究不仅可以简便快速地检测胞浆内camp浓度,还为基于cftr信号通路的第二信使camp相关靶点提供了筛选平台,为第二信使camp信号转导途径的研究奠定了良好的基础。
[0039]
在本发明的一些具体实施方案中,所述frt细胞株的构建方法为:构建钙激活氯离子通道ano1和对卤族元素敏感的黄色荧光蛋白双突变体yfp-h148q/i152l真核表达载体,经脂质体转染、抗生素筛选和稀释,获取共表达ano1和yfp-h148q/i152l的frt细胞。
[0040]
在本发明的一些具体实施方案中,所述cftr调节剂包括激活剂或抑制剂;所述激活剂包括imperatorin、genistein、forskolin或ibmx中的一种或多种;所述抑制剂包括gly h101或cftrinh-172。
[0041]
本发明还提供了筛选cftr调节剂的制剂或试剂盒,包括frt细胞株以及可接受的助剂;所述frt细胞株中ano1和yfp-h148q/i152l共表达;
[0042]
所述frt细胞株通过荧光信号反应细胞内camp浓度的变化进而筛选cftr调节剂;
[0043]
所述荧光信号为相对荧光强度变化值/slope值/斜率值,所述相对荧光强度变化值/slope值/斜率值与cftr调节剂浓度成剂量依赖关系;
[0044]
其中,相对荧光强度变化值/slope值/斜率值与细胞内camp浓度呈现良好的正相关;
[0045]
所述相对荧光强度变化值/slope值/斜率值计算如下:
[0046][0047]
0s~1.4s的相对荧光值的平均值;
[0048]
y:2.4s~14.8s与0.6s~13s做线性回归分析所得到的线性回归的结果。
[0049]
本发明还提供了预防和/或治疗与cftr相关疾病的药物,采用frt细胞株筛选获得;所述frt细胞株中ano1和yfp-h148q/i152l共表达;
[0050]
所述frt细胞株通过荧光信号反应细胞内camp浓度的变化进而筛选cftr调节剂;
[0051]
所述荧光信号为相对荧光强度变化值/slope值/斜率值,所述相对荧光强度变化值/slope值/斜率值与cftr调节剂浓度成剂量依赖关系;
[0052]
其中,相对荧光强度变化值/slope值/斜率值与细胞内camp浓度呈现良好的正相关;
[0053]
所述相对荧光强度变化值/slope值/斜率值计算如下:
[0054][0055]
0s~1.4s的相对荧光值的平均值;
[0056]
y:2.4s~14.8s与0.6s~13s做线性回归分析所得到的线性回归的结果。
[0057]
本发明构建cftr和yfp-h148q/i152l真核表达载体,应用脂质体转染法构建共表达cftr和yfp-h148q/i152l的frt细胞,倒置荧光显微镜观察其表达情况,流式细胞仪检测细胞纯度;荧光淬灭动力学实验验证细胞模型的有效性;荧光淬灭动力学实验验证细胞模
型可筛选cftr调节剂;放射免疫法检测加入cftr激活剂后细胞内的camp浓度。
[0058]
倒置荧光显微镜下观察到cftr表达在细胞膜上,yfp-h148q/i152l表达于胞浆中;成功构建共表达cftr和yfp-h148q/i152l的frt细胞模型;荧光变化斜率值与cftr调节剂浓度成剂量依赖关系,该模型可筛选cftr调节剂;荧光变化斜率值可反映胞浆内camp浓度,该模型可敏感检测胞浆内camp浓度。
[0059]
此细胞模型可以高效敏感检测胞浆内第二信使camp浓度,为camp信号相关靶点的研究提供了一种简便快捷的方法。
附图说明
[0060]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
[0061]
图1示基于cftr的胞浆内第二信使camp检测方法的测定原理;
[0062]
图2示重组质粒测序图;
[0063]
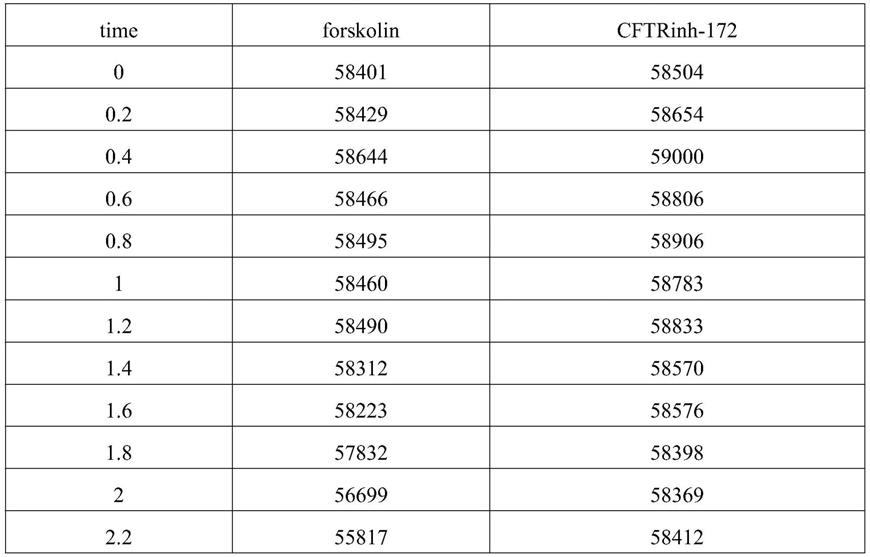
图3示共表达cftr和yfp-h148q/i152l细胞模型的构建结果;其中,a:cftr表达在细胞膜上;b:yfp-h148q/i152l表达在胞浆中;c:未转染的frt细胞;d:共转染cftr-yfp-h148q/i152l的frt细胞;
[0064]
图4示荧光淬灭动力学实验鉴定模型有效性结果;
[0065]
图5示荧光淬灭动力学实验鉴定模型可筛选cftr调节剂结果;其中,a:荧光淬灭动力学实验结果;b:荧光斜率值结果;(mean
±
sd,n=3)**p<0.001;
[0066]
图6示cftr激活剂及抑制剂的剂量依赖曲线;其中,a:cftr激活剂的剂量依赖曲线;b:cftr抑制剂的剂量依赖曲线;
[0067]
图7示camp浓度与荧光斜率值的关系;其中,a:荧光斜率值与激活剂浓度的剂量依赖关系;b:camp浓度与激活剂浓度的剂量依赖关系;c:camp浓度与荧光斜率值的关系。
具体实施方式
[0068]
本发明公开了frt细胞株在制备筛选cftr调节剂的制剂或试剂盒中的应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
[0069]
本发明首次提出了相对荧光强度变化值/slope值/斜率值的概念:
[0070]
本方法通过动态检测相对荧光强度的变化,并进一步量化相对荧光强度的变化,
[0071]
每一个荧光强度变化值(也称作slope值/斜率值)对应一个细胞内的ca
2+
浓度,结果显示相对荧光强度变化值/slope值/斜率值与细胞内ca
2+
浓度呈现良好的正相关。
[0072]
具体相对荧光强度变化值/slope值/斜率值计算如下:
[0073][0074]
0s~1.4s的相对荧光值的平均值。
[0075]
y:2.4s~14.8s与0.6s~13s做线性回归分析所得到的线性回归的结果。
[0076]
如图5a量化结果如图5b所示。
[0077]
camp作为第二信使学说是萨瑟兰于1965年首先提出的,他认为人体内各种含氮激素都是通过细胞内的camp而发挥作用的,首次把camp叫做第二信使。camp不但参与细胞的增值分化、激素的合成分泌、基因的表达、信号的转导、神经节突触传递的调节等生理过程,还参与心脏病、急性白血病、慢性呼吸道疾病、某些肿瘤等病理过程。因此,第二信使camp是一种在生命活动中具有重要作用的小分子化合物,胞浆内第二信使camp的研究在科研领域的扮演中重要的角色。本研究构建了一种新的胞浆内第二信使camp的检测方法,利用稳定共表达的cftr和对卤族元素敏感的黄色荧光蛋白双突变体yfp-h148q/i152l的frt细胞模型检测胞浆内camp的浓度。
[0078]
本研究利用cftr通道可以转运离子和yfp-h148q/i152l遇到碘离子淬灭的特性,构建了基于cftr的胞浆内第二信使camp的细胞模型。当胞浆内camp浓度升高时,cftr通道开放,细胞外i-转运至胞浆内,细胞内黄色荧光蛋白双突变体yfp-h148q/i152l遇到i-发生荧光淬灭,荧光信号显著下降,利用荧光变化的斜率值来反映胞浆内camp浓度。本研究不但采用荧光倒置显微镜观察转染后的frt细胞中cftr和yfp-h148q/i152l的表达情况,还采用流式细胞术对稳定共转染cftr和yfp-h148q/i152l细胞进行纯度检测。利用荧光淬灭动力学原理对卤族元素敏感的黄色荧光蛋白双突变体yfp-h148q/i152l进行有效性检测,同时,利用cftr的调节剂检测细胞模型功能。
[0079]
本研究利用荧光斜率值来反映胞浆内camp浓度升高情况,解决了以往直接检测camp浓度的方法的操作复杂、试剂昂贵、周期长等问题,本方法具有操作简便、经济快速,检测周期短的优点。本研究采用不同的cftr激活剂和抑制剂验证细胞模型的可以筛选cftr的调节剂,其调节剂浓度与荧光斜率值呈剂量依赖关系且方差较小,因此具有良好的重复性。采用放射免疫法检测胞浆内camp浓度,荧光变化斜率值表征胞浆内camp浓度,因此本模型可敏感检测胞浆内camp浓度的变化。整个胞浆内第二信使camp浓度的测定方法可在2h之内完成,与传统方法比较,大大缩减了检测时间。此外,本模型经过反复传代至25代以上,仍然保持其良好特性和稳定状态,具有良好的稳定性。
[0080]
综上所述,本研究构建的基于cftr可敏感检测胞浆内第二信使camp的细胞模型,可以简单快速地检测胞浆内camp浓度,为基于cftr信号通路的第二信使camp相关靶点提供了筛选方法,同时为第二信使camp信号转导途径的深入研究奠定了良好的基础。
[0081]
数据分析
[0082]
各实验数据均经过三次重复试验,采用graphpad prism8软件对调节剂的剂量依赖关系进行非线性曲线拟合分析及计算半数有效浓度ec
50
、半数抑制浓度ic
50
值,统计学分析采用t检验,以p<0.05为差异有统计学意义。
[0083]
实验仪器
[0084]
fluo star多功能酶标仪(bmg公司)、倒置荧光显微镜(nikon公司)、co2培养箱(thermo公司)、流式细胞仪(bd公司)。
[0085]
实验试剂
[0086]
frt细胞本实验室保存;pcdna3.1由麻彤辉教授馈赠;yfp-h148q/i152l真核表达载体由本实验室前期构建;lipofectamine 3000脂质体、zeocin抗生素、g418抗生素、
ionomycin、calcimycin购自invitrogen公司;f-12营养培养基、三羟基黄酮(genistein)、欧前胡素(imperatorin)、毛喉素(forskolin)、3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine,ibmx)、gly h101、cftrinh-172均购自sigma公司,放射免疫试剂盒购自上海中医药大学。
[0087]
本发明提供的frt细胞株在制备筛选cftr调节剂的制剂或试剂盒中的应用,所用原料及试剂均可由市场购得。
[0088]
下面结合实施例,进一步阐述本发明:
[0089]
实施例1 cftr真核表达载体的构建
[0090]
将cftr和pcdna3.1载体为模板,进行pcr扩增。pcr反应体系:10μm forward primer,1μl;10μm reverse primer,1ul;模板,1μl;2
×
easytaq
@
pcr supermix,25μl;ddh2o,22μl。反应程序:94℃,5min;(94℃,30s;55℃,30s;72℃,1min)x30;72℃,5min。琼脂糖凝胶电泳,分别用nhe i和bamh i双酶切pcr产物,酶切产物经琼脂糖凝胶电泳后切胶回收。利用t4连接酶将载体pcdna3.1和目的基因cftr于4℃连接反应12h。将cftr-pcdna3.1进行转化,并提取质粒,琼脂糖凝胶电泳后送于上海生工生物公司测序。
[0091]
实施例2共表达cftr和yfp-h148q/i152l细胞模型的构建
[0092]
1构建共表达cftr和yfp-h148q/i152l细胞株
[0093]
按照lipofectamine 3000说明书将cftr质粒瞬时转染到frt细胞中,利用zeocin抗生素进行筛选,两周后利用倒置荧光显微镜观察,挑取细胞膜上可见绿色荧光的细胞进行有限稀释,对得到的阳性克隆的细胞株进行扩大培养,经过两次传代仍表达cftr的细胞则为稳定表达cftr的frt细胞株。按照lipofectamine 3000说明书将yfp-h148q/i152质粒转染到已稳定表达cftr的frt细胞中,利用g418抗生素进行筛选,两周后利用倒置荧光显微镜观察,挑取胞浆中可见绿色荧光的细胞进行有限稀释,对得到的阳性克隆的细胞株进行扩大培养,经过两次传代仍表达yfp-h148q/i152的细胞则为稳定共表达cftr-yfp-h148q/i152l的frt细胞株。
[0094]
2流式细胞仪检测细胞纯度
[0095]
将稳定共表达cftr-yfp-h148q/i152l的frt细胞用1ml的0.25%的4000u/g的胰酶在37℃消化15min,800g离心5min,弃上清,加入pbs缓冲液,重悬细胞后上机进行检测。以未转染的frt细胞作为阴性对照,选择fl2通道,激发光波长488nm,检测光波长575nm,每管收集50000个细胞。阴性对照所检测到的荧光强度范围进行设门,该门内的细胞表示未转染上的细胞,将大于该范围的荧光强度表示为转染成功的细胞。
[0096]
实施例3荧光淬灭动力学实验鉴定细胞模型的有效性
[0097]
将培养在黑壁透明底的96孔板中的稳定共转染
[0098]
cftr-yfp-h148q/i152l的frt细胞分为两组:实验组和对照组,每组3个复孔。以含钙镁离子的pbs缓冲液洗涤两组细胞3次,加入50μl含钙镁pbs缓冲液,向实验组加入120μl含有forskolin(cftr激活剂)的碘化钠pbs缓冲液,对照组加入cftrinh-172(cftr特异性抑制剂)孵育10min,采用fluostar多功能酶标仪检测相对荧光强度动态变化。具体设置如下:发射光波长540nm,激发光波长500nm。以5点/s的速度动态检测14s,其中前2s为基线,2s后以180μl/s的速度向实验组组孔中加入120μl含有forskolin的碘化钠pbs缓冲液。
[0099]
放射性免疫方法检测细胞camp的含量
[0100]
细胞内camp的检测,将96孔板培养的细胞用pbs洗三次,每次100μl,加入不同浓度的forskolin的pbs孵育15min,然后将溶液弃掉,每孔加入200μl醋酸缓冲液,立即用超声细胞破碎仪破碎细胞,将细胞破碎液全部收集到有800μl醋酸缓冲液的1.5毫升ep管中混匀,3000转离心15分钟,吸取上清液100μl用于camp含量的测定;按照说明书进行操作,最后用液闪仪(检测放射性含量,根据标准曲线计算得到camp的含量。
[0101]
实施例4验证细胞模型功能
[0102]
为了验证cftr细胞模型可筛选cftr调节剂,将细胞分为5组(实验组4组,对照组1组),每组3个复孔,其中实验组4组分别加入imperatorin、genistein、forskolin、ibmx四种激活剂,另外对照组用钙镁pbs缓冲液洗涤细胞3次后,吸出液体后加入50μlpbs缓冲液,加入cftr抑制剂gly h101,孵育10min,采用多功能酶标仪进行检测,加入碘化钠pbs缓冲液120μl,记录相对荧光强度动态变化。
[0103]
为了验证cftr细胞模型的功能活性,将细胞分为6组,每组3个复孔,以800μmol/l作为初始浓度,采用倍比稀释的方法获得不同浓度的激活剂和抑制剂。其中4组分别加入不同浓度的imperatorin、genistein、forskolin、ibmx四种激活剂,采用多功能酶标仪进行检测,加入碘化钠pbs缓冲液120μl,记录相对荧光强度动态变化。另外2组加入不同浓度的gly h101、cftrinh-172两种抑制剂,孵育10min,同样采用多功能酶标仪进行检测,加入含有forskolin的碘化钠pbs缓冲液120μl,记录相对荧光强度动态变化。利用excel软件对原始数据进行宏计算,求出斜率值(slope),绘制细胞模型的剂量依赖曲线。
[0104]
实施例5放射免疫法的检测camp的变化
[0105]
利用放射免疫试剂盒测定细胞内camp浓度,将培养在黑壁透明底的96孔板中稳定共转染cftr和yfp-h148q/i152l的frt细胞采用无钙镁pbs缓冲液洗涤细胞3次,加入含有forskolin的pbs缓冲液孵育15min,弃去溶液。加入200μl醋酸缓冲液后立即将细胞超声破碎,将细胞破碎液收集到含有800μl醋酸缓冲液的ep管中,3000r/min离心15min,吸取100μl进行camp测定。按照说明书进行操作,检测放射性含量,根据标准曲线进行camp含量的计算。
[0106]
效果例1
[0107]
1cftr真核表达载体的构建
[0108]
结果表明所构建重组质粒上连有目的基因cftr,酶切位点分别是nhei和bamhi,证实成功构建cftr真核表达载体。
[0109]
2共表达cftr和yfp-h148q/i152l细胞模型的构建
[0110]
转染cftr的frt细胞共挑出5个单克隆细胞团,在倒置荧光显微镜下可见细胞膜呈绿色荧光,取表达量最高的单克隆细胞团进行扩大培养。稳定表达cftr的frt细胞镜下可见绿色荧光在细胞膜上均匀分布,结果表明cftr表达在细胞膜上,如图3a所示;共转染cftr-yfp-h148q/i152l的frt细胞共挑出6个单克隆细胞团,在倒置荧光显微镜下可见胞浆呈绿色荧光,同样取表达量最高的进行扩大培养。镜下可见绿色荧光在胞浆内均匀分布,结果表明yfp-h148q/i152l表达在胞浆中,如图3b所示。结果表明,成功获得稳定共表达cftr和yfp-h148q/i152l的frt细胞株。流式细胞仪检测结果表明,稳定转染的细胞纯度达到96.3%,如图3c、d。
[0111]
3荧光淬灭动力学实验鉴定细胞模型的有效性
[0112]
酶标仪结果显示,实验组加入forskolin后,细胞相对荧光强度显著下降,对照组在cftrinh-172孵育后,细胞相对荧光强度无明显变化,见图4。forskolin可迅速升高胞浆内camp浓度,camp浓度的升高可引起cftr通道的开放,cftr具有转运碘离子特性,细胞外碘离子转运至胞浆内引起yfp-h148q/i152l迅速淬灭,导致荧光强度显著下降。而加入cftrinh-172可抑制cftr通道的开放,荧光强度无明显变化。结果表明,共表达cftr-yfp-h148q/i152l的frt细胞具有cftr通道特性,细胞模型构建成功。
[0113]
表1图4数据
[0114]
[0115]
[0116][0117]
4验证细胞模型功能
[0118]
加入cftr激活剂genistein、imperatorin、forskolin、ibmx后,荧光迅速淬灭。而加入cftr抑制剂gly h101后,荧光不淬灭,如图5a。各实验组荧光斜率值显著高于对照组,各实验组与对照组具有显著性差异(p<0.001),如图5b,说明模型可以筛选cftr调节剂。
[0119]
表2图5a数据
[0120]
[0121]
[0122][0123]
表3图5b数据
[0124][0125]
在加入不同浓度的cftr激活剂后,荧光信号呈现不同的变化。随着激活剂浓度的增加,荧光斜率不断增强,呈现剂量-效应依赖关系。结果采用graphpad prism8软件分析,见图6a,genistein、imperatorin、forskolin、ibmx的ec
50
分别为28.87μmol/l、67.38μmol/l、106.9μmol/l、174.5μmol/l。在加入含有激活剂的碘化钠pbs缓冲液后,随着抑制剂浓度的增加,荧光信号不断减弱,即抑制剂浓度越大其抑制作用越强,呈现剂量-效应依赖关系。结果同样采用graphpad prism 8软件分析,见图6b,cftrinh-172、gly h101的ic
50
分别为23.58μmol/l、54.62μmol/l。
[0126]
表4图6a数据
[0127][0128]
表5图6b数据
[0129][0130][0131]
5放射免疫法的检测camp的变化
[0132]
加入不同浓度的forskolin后,相对荧光强度产生不同程度的下降,激活剂浓度的越大,相对荧光强度下降的幅度越大,荧光斜率值越大,如图7a所示,结果表明荧光斜率值与激活剂浓度呈剂量依赖关系。同时细胞内camp浓度瞬时升高,随着激活剂浓度的升高,胞浆内camp浓度越高,其浓度与激活剂浓度呈剂量依赖关系,如图7b所示。分析结果表明,荧光斜率值随着胞浆内camp浓度增加而增加,camp浓度越大,荧光斜率值越大,如图7c所示。结果表明,通过荧光变化的斜率值可反映细胞内camp浓度,因此该细胞模型可敏感检测细胞内camp浓度的变化。
[0133]
表6图7a数据
[0134][0135]
表7图7b数据
[0136][0137]
表8图7c数据
[0138][0139]
效果例2检测细胞内camp浓度的检测方法(cftr法)优点
[0140]
表14
[0141][0142]
本发明提供的检测方法具有灵敏度高的原因:
[0143]
(1)细胞内camp浓度仅仅为nm级别或者μm级别,很少能达到mm级别,也就是说细胞内camp浓度的微量性决定了其直接检测的难度;
[0144]
(2)本发明提供的检测方法是通过yfp双突变体的相对荧光信号的变化间接反映细胞内camp浓度,yfp双突变体具有极强的碘离子敏感的特性;单个通道在氯离子依次通过的情况下,每秒钟可转运106个氯离子;而且通过稳定转染,本细胞模型具有高表达的特性;此外yfp的荧光信号强(yfp的荧光强度是普通荧光信号如gfp即绿色荧光蛋白的数倍)。
[0145]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1