一种维持体外培养CHODG44细胞后期活率的培养基及其应用的制作方法
一种维持体外培养cho dg44细胞后期活率的培养基及其应用
[0001]
技术领域
[0002]
本发明涉及细胞培养领域,更特别地,涉及一种用于培养cho dg44细胞的无血清培养基及其应用,所述培养基可用于cho细胞工业化大规模悬浮培养,细胞不易结团,维持体外培养cho dg44细胞后期活率,目标蛋白表达量高。
[0003]
背景技术:
[0004]
过去几十年中,哺乳动物细胞培养技术取得了较大成就。已上市的治疗性生物技术药物,用哺乳动物细胞生产的占 50%以上,其中,尤以中华仓鼠卵巢(chinese hamster ovary,cho)细胞的使用最为广泛。基于大规模生物反应器的哺乳动物细胞(特别是 cho 细胞)培养技术已逐渐成为生产单抗药物的核心技术。cho细胞能够生产高质量的生物制剂,其与人相似的翻译后修饰水平能够达到克级。此外,相较于其他细胞类型,cho细胞具有(1)能在化学成分限定和无血清悬浮培养中稳定生长,(2)在人类致病病毒应答方面表现出合理的安全性,(3)能够表达与人相似的翻译后修饰等优点。因此,cho细胞成为当前重组蛋白工业化生产的主要宿主细胞。cho细胞已经成为需要复杂翻译后修饰的治疗性蛋白生产的主要工具。目前,有两种主要的cho表达系统被广泛应用,基于二氢叶酸还原酶(dhfr)的甲氨蝶呤(mtx)选择体系和基于谷氨酰胺合成酶(gs)的甲硫氨酸硫氧胺(msx)选择体系。
[0005]
相对于动物细胞贴壁培养而言,单个细胞悬浮培养具有细胞生长均一性好、传质效率高、容易实现规模放大和过程控制的特点。哺乳动物细胞的悬浮培养己成为目前动物细胞培养的理想模式和动物细胞表达产品工业化生产的首要选择,超过80%的哺乳动物细胞表达生物技术药物采用动物细胞悬浮培养为其生产工艺。对于cho细胞悬浮培养而言,要在规模化的培养中获取好的培养结果,设计出适宜细胞悬浮生长的培养基是至关重要的。无血清培养基的优势很大程度上体现在避免了血清的缺点,此外它还具有血清培养难以比拟的优点,如保存和应用方便;使用该种培养基制备的产品易于纯化,提高回收率;成分明确,有利于研究细胞的生理调节机制;可根据不同细胞株设计和优化出适合其高密度生长或高水平目的产物表达的培养基等。因此,近年来许多科研工作者致力于开发适用于cho细胞大规模培养的无血清培养基。
[0006]
在无血清培养基中悬浮培养cho细胞时,常常发生结团现象,降低了细胞的活性,蛋白表达受到影响,但迄今细胞结团的原因还不甚清楚。有研究认为结团可能是由于dna从死亡的细胞间释放后,在细胞与细胞之间架桥引起的,若在培养基中添加脱氧核糖核酸酶ⅰ(dnaseⅰ)可以避免结团现象发生。但是dee等则认为通过添加肝素、硫酸葡聚糖、硫酸戊糖等高度磺化硫酸聚阴离子物质,可成功地解决bti-tn5b1-4昆虫细胞的结团问题,使蛋白表达量提高了倍2-4。有专利文献(cn101724600a,公开日期20100609)公开了一种支持cho细胞大规模高密度悬浮培养的无血清培养基,其中使用了嵌段式聚醚f-68 (pluronic f-68) :
300-1000;甘氨酸 5-50;组氨酸 25-100;异亮氨酸 50-200;亮氨酸 100-200;赖氨酸 100-250;蛋氨酸 25-50;苯丙氨酸 15-100;脯氨酸 5-15;丝氨酸 5-50;苏氨酸 15-200;色氨酸 5-50;酪氨酸 20-150;缬氨酸 50-250;牛磺酸 5-25。
[0013]
在一个优选实施方案中,所述维生素组分为:单位为mg/l,维生素h 0.001-1;氯化胆碱 1-200;泛酸钙 0.2-2;叶酸 1-10;肌醇 2-20;烟酰胺 0.1-1;吡哆醇(维生素b6) 0.1-2.5;核黄素 0.02-1;硫胺素(维生素b1) 0.1-5;维生素b12 0.05-2;硫酸葡聚糖 5-250。
[0014]
在一个优选实施方案中,所述无机盐组分为:单位为mg/l,氯化钙 5-50;硝酸铁0.25-1.5;氯化钾 10-100;氯化镁 25-150;硫酸镁 5-25;氯化锰 0.00001-0.005;氯化钠 3000-5000;碳酸氢钠 100-2000;磷酸氢二钠 10-750;亚硒酸钠 0.0000005-0.0002;矾酸铵 0.00005-0.002;硫酸锌 0.001-0.15。
[0015]
在一个优选实施方案中,所述cho无血清培养基由如下组分组成:各组分按所述培养基的总体积计,单位为mg/l,所述添加物为:乙醇胺 0.5-4;d-葡萄糖 2500-6000;4-羟乙基哌嗪乙磺酸(hepes)500-2000;胰岛素 2-5;亚油酸 0.01-3;硫辛酸 0.2-10;苯酚红 0.5-10;腐胺 0.01-1;n乙酰半胱氨酸:10-500;丙酮酸钠 10-200;转铁蛋白 5-7;igf-1 10-20;aeo-9 100-200;丙氨酸 10-100;精氨酸 200-400;天冬酰胺 5-100;天冬氨酸 10-300;半胱氨酸 15-100;谷氨酸 5-50;谷氨酰胺 300-1000;甘氨酸 5-50;组氨酸 25-100;异亮氨酸 50-200;亮氨酸 100-200;赖氨酸 100-250;蛋氨酸 25-50;苯丙氨酸 15-100;脯氨酸 5-15;丝氨酸 5-50;苏氨酸 15-200;色氨酸 5-50;酪氨酸 20-150;缬氨酸 50-250;牛磺酸 5-25。
[0016]
维生素h 0.001-1;氯化胆碱 1-200;泛酸钙 0.2-2;叶酸 1-10;肌醇 2-20;烟酰胺 0.1-1;吡哆醇(维生素b6) 0.1-2.5;核黄素 0.02-1;硫胺素(维生素b1) 0.1-5;维生素b12 0.05-2;硫酸葡聚糖 5-250。
[0017]
氯化钙 5-50;硝酸铁0.25-1.5;氯化钾 10-100;氯化镁 25-150;硫酸镁 5-25;氯化锰 0.00001-0.005;氯化钠 3000-5000;碳酸氢钠 100-2000;磷酸氢二钠 10-750;亚硒酸钠 0.0000005-0.0002;矾酸铵 0.00005-0.002;硫酸锌 0.001-0.15。
[0018]
在一个优选实施方案中,所述cho无血清培养基由如下组分组成:各组分按所述培养基的总体积计,单位为mg/l,所述添加物为:乙醇胺 1;
d-葡萄糖 4000;4-羟乙基哌嗪乙磺酸(hepes)1000;胰岛素 3;亚油酸 1;硫辛酸 5;苯酚红 2.5;腐胺 0.1;n乙酰半胱氨酸:100;丙酮酸钠 50;转铁蛋白 6;igf-1 15;aeo-9 150;丙氨酸 50;精氨酸 300;天冬酰胺 50;天冬氨酸 100;半胱氨酸 75;谷氨酸 30;谷氨酰胺 400;甘氨酸 25;组氨酸 35;异亮氨酸 75;亮氨酸 120;赖氨酸 150;蛋氨酸 40;苯丙氨酸 56;脯氨酸 10;丝氨酸 27;苏氨酸 80;色氨酸 25;酪氨酸 65;缬氨酸 85;牛磺酸 10;维生素h 0.2;氯化胆碱 10;泛酸钙 1;叶酸 5;肌醇 10;烟酰胺 0.5;吡哆醇(维生素b6) 0.5;核黄素 0.35;硫胺素(维生素b1) 0.25;维生素b12 0.15;硫酸葡聚糖 50。
[0019]
氯化钙 10;硝酸铁1;氯化钾 12;氯化镁 50;硫酸镁 10;氯化锰 0.003;氯化钠 4000;碳酸氢钠 1000;磷酸氢二钠 200;亚硒酸钠 0.0001;矾酸铵 0.001;硫酸锌 0.1。
[0020]
在本发明的第二方面,提供了本发明所述培养基的用途,它被用于培养cho细胞。
[0021]
在一个优选实施方案中,所述cho细胞是dhfr基因缺失的cho-dg44。
[0022]
在本发明的第三方面,还提供了一种培养cho细胞的方法,包括步骤:在本发明所述培养基中接种cho细胞,然后在适合生长的条件下(如37
±
2 ℃,5
±
1%二氧化碳下)培养cho细胞一定时间,至所需细胞量。
[0023]
在本发明的第四方面,还提供了一种维持体外培养cho dg44细胞后期活率的方法,包括如下步骤:s1:将冻存的cho dg44细胞在本发明所述的培养基里复苏,将cho dg44细胞在摇床中培养;s2:每2-3天进行一次传代操作,保持细胞处于早期对数生长期,细胞接种密度为0.5~1.0
ꢀ×ꢀ
106cells/ ml;s3:当细胞密度达到1.5
×
106~4.5
×
106cells/ml,细胞活率≥95%,间隔2~3天时,再次传代;s4:按照s2和s3方法传代2~4次,细胞群体倍增时间稳定后开始接种,5l搅拌罐式生物反应器中进行培养;s5:培养后使用本发明所述的培养基作为补料培养基进行批次补料;s6:细胞活率低于70%或培养第16天收获,检测蛋白浓度。
[0024]
进一步地,在步骤(s1)中,所述的摇床的转速为130
±
20 rpm,培养箱中co2浓度设置为5%~10%。
[0025]
进一步地,在步骤(s4)中,pdt稳定后偏差<3h。
[0026]
优选地,在步骤(s4)中,所述接种密度在0.5
×
106~1.0
×
106cells/ ml。
[0027]
进一步地,在步骤(s5)中,补料1~7%,至培养结束前1~2天停止补料。
[0028]
优选地,所述蛋白为抗体,更优选地,所述抗体为cd20单抗。
[0029]
在本发明的第五方面,还提供了本发明所述培养基的制备方法,其特征在于,(1)按量获取培养基各组分;(2)将各组分按照其溶解特性溶解;(3)将制备获得的培养基过0.22um滤膜滤过除菌。
[0030]
本发明的有益效果:(1)本发明提供的用于培养cho细胞的无血清培养基成分简单、低成本、低蛋白。
[0031]
(2)本发明的无血清培养基无血清低蛋白,利于cho表达的目标蛋白,尤其是单抗的后续纯化。
[0032]
(3)培养基中添加aeo-9可有效改善悬浮培养cho细胞时的结团现象,且相对于嵌段式聚醚f-68具有更好的效果。
[0033]
(4)在培养后期,采用本发明无血清培养基从第8天开始细胞密度有稍微下降之后又在第11天有所上升,此后维持高细胞密度一直到第14天才开始下降。而采用商业化的cho无血清培养基的细胞密度从第8天开始持续下降,没有上升过程。可见,本发明的cho细胞的无血清培养基可保持培养后期的高细胞密度,进而维持体外培养cho dg44细胞后期活率。
[0034]
(5)采用本发明无血清培养基培养的cho dg44细胞存活率一直高于90%,尤其是培养后期,即第8天之后,仍能维持存活率在91.2-97.4%之间。
[0035]
(6)用本发明的无血清培养培养16天,表达cd20单抗的cho dg44 细胞株表达获得的cd20单抗蛋白浓度可达1500-1800 mg/l。
[0036]
附图说明
[0037]
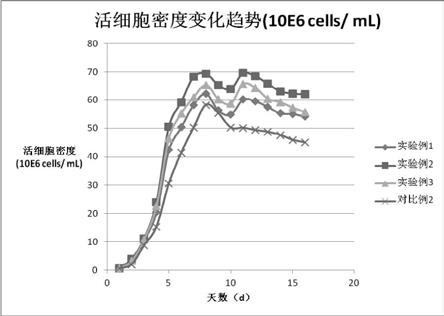
图1 活细胞密度变化趋势(106cells/ ml)。
[0038]
图2 细胞存活率变化趋势(%)。
[0039]
图3 表7hplc法检测cd20单抗蛋白浓度(mg/l)。
[0040]
图4 使用实验例2培养基培养的cho细胞显微镜图。
[0041]
图5 使用对比例1培养基培养的cho细胞显微镜图。
[0042]
具体实施方式
[0043]
以下结合实例对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。下列实施例中未注明具体条件的试验方法,通常按照常规条件,或者按照各制造商所建议的条件。当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术
人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
[0044]
实施例1、培养基的制备以及细胞株培养基中各组分均可从sigma, gibco公司等处购买获得。
[0045]
配制3种不同浓度配比的本发明的用于培养cho细胞的无血清培养基,其各组分终浓度如下表1-4(实验例1、实验例2和实验例3同时包含表1-表4所示的成分)所示。
[0046]
表1使用的培养cho细胞的无血清培养基实验例包含的部分物质浓度组分,浓度mg/l实验例1实验例2实验例3乙醇胺0.512d-葡萄糖2500400050004-羟乙基哌嗪乙磺酸(hepes)75010001500胰岛素234亚油酸0.512硫辛酸258苯酚红0.52.54腐胺0.050.10.5n乙酰半胱氨酸50100200丙酮酸钠2050100转铁蛋白567igf-1101520aeo-9100150200表2使用的培养cho细胞的无血清培养基实验例包含的氨基酸组份浓度组分,浓度mg/l实验例1实验例2实验例3丙氨酸2050100精氨酸200300400天冬酰胺205075天冬氨酸50100200半胱氨酸1575100谷氨酸203040谷氨酰胺300400600甘氨酸152550组氨酸253555异亮氨酸5075150亮氨酸100120160赖氨酸100150200蛋氨酸254050苯丙氨酸305675脯氨酸51015
丝氨酸102750苏氨酸40080150色氨酸152545酪氨酸4065125缬氨酸5085180牛磺酸51020表3使用的培养cho细胞的无血清培养基实验例包含的维生素组份浓度组分,浓度mg/l实验例1实验例2实验例3维生素h0.10.20.5氯化胆碱51030泛酸钙0.512叶酸258肌醇51015烟酰胺0.20.50.8吡哆醇(维生素b6)0.20.51.5核黄素0.20.350.8硫胺素(维生素b1)0.10.251维生素b120.10.151硫酸葡聚糖2550150表4使用的培养cho细胞的无血清培养基实验例包含的无机盐组份浓度组分,浓度mg/l实验例1实验例2实验例3氯化钙51025硝酸铁0.511.5氯化钾101250氯化镁255075硫酸镁51025氯化锰0.0010.0030.005氯化钠300040005000碳酸氢钠50010001500磷酸氢二钠100200500亚硒酸钠0.000050.00010.0002矾酸铵0.00050.0010.002硫酸锌0.050.10.15对比例1:除了将150mg/l的aeo-9替换为150mg/l的嵌段式聚醚f-68以外,其他组分、浓度与实验例2相同。
[0047]
对比例2:市售瑞士lonza 公司的无血清培养基procho5。
[0048]
cho dg44 细胞株:购于美国 invitrogen 公司。
[0049]
表达cd20单抗的cho dg44 细胞株:按照文献(“重组抗cd20单克隆抗体工程细胞珠的构建”,沙海涛,《吉林大学硕士论文》,2016年度)的方法制备获得稳定表达cd20单抗的
cho dg44细胞株。
[0050]
cho野生型细胞株:cho-k1 atcc cat.no.ccl-61。
[0051]
实施例2、5升搅拌罐式生物反应器中批次悬浮培养cho dg44细胞s1:将冻存的表达cd20单抗的cho dg44 细胞分别在实验例1、实验例2、实验例3、对比例2的培养基里复苏,将cho dg44细胞在摇床中培养,所述摇床转速为130
±
20 rpm,培养箱中co2浓度设置为5%;s2:每2天进行一次传代操作,保持细胞处于早期对数生长期,细胞接种密度为0.8
×ꢀ
106cells/ ml;s3:当细胞密度达到2.5
×
106cells/ml,细胞活率≥95%,间隔2天时,再次传代;s4:按照s2和s3方法传代3次,细胞群体倍增时间稳定后开始接种,培养时间为d0,接种密度在0.5
×
106cells/ ml,pdt稳定后偏差<3h,5l搅拌罐式生物反应器中进行培养。温度设置为37℃,溶解氧浓度控制在30-50%,ph控制在7.1-7.2,搅拌速度设置为60-70r/min,每天取样,用血球计数板点样计数细胞,每样计数3次,取平均值,用台盼蓝染色法确定细胞的存活率;s5:培养后分别使用实验例1、实验例2、实验例3、对比例2的培养基作为补料培养基进行批次补料,补料5%,至培养结束前1~2天停止补料;s6:培养第16天(d16)收获,hplc法检测cd20单抗蛋白浓度;使用上述4种培养基的不同结果如下表5、表6、表7以及图1、图2、图3:表5活细胞密度变化趋势(106cells/ ml)培养时间/天实验例1实验例2实验例3对比例210.60.60.60.523.74.03.22.0310.511.110.88.7420.423.922.615.3542.350.646.330.6650.359.355.241.3758.368.260.950.2862.369.365.358.3956.365.360.355.31054.963.958.750.21160.269.565.650.11259.668.464.249.31357.665.760.448.71455.363.159.247.61555.162.357.345.91654.262.055.745.0表6细胞存活率变化趋势(%)培养时间/天实验例1实验例2实验例3对比例2199.799.999.599.1
299.599.899.599.0399.099.399.098.0498.299.098.596.4597.398.397.495.4696.897.596.994.3796.597.496.893.6896.397.496.592.4996.097.196.291.51095.196.595.690.41195.096.495.588.91295.096.195.387.51394.295.394.585.61493.194.293.682.61592.693.892.780.01691.293.091.779.1表7 hplc法检测cd20单抗蛋白浓度(mg/l) 实验例1实验例2实验例3对比例2cd20单抗蛋白浓度(mg/l)150018001650800表5和图1的结果表明,cho第8天细胞密度达到相对峰值,实验例2的培养基效果最佳,达到69.3
×
106/ml,实验例1、2分别为62.3
×
106/ml、65.3
×
106/ml,而相应的商业化cho无血清培养基对比例2的细胞密度最高仅58.3
×
106/ml。通过图1可知,在培养的1-16天中,对比例2的生长曲线一直低于实验例1-3。可见,在细胞生长、密度方面,本发明的cho细胞的无血清培养基显著优于商业化的cd cho培养基。并且,在培养后期,实验例1-3从第8天开始细胞密度有稍微下降之后又再第11天有所上升,此后维持高细胞密度一直到第14天才开始下降。而对比例2的细胞密度从第8天开始持续下降,没有上升过程。可见,本发明的cho细胞的无血清培养基可保持培养后期的高细胞密度,进而维持体外培养cho dg44细胞后期活率。
[0052]
表6和图2的结果表明,在培养的1-16天,实验例1、实验例2、实验例3的细胞存活率一直高于90%,尤其是培养后期,即第8天之后,仍能维持存活率在91.2-97.4%之间。而对比例2在培养的第11天,即下降至90%以下,到第16天,细胞存活率已降至79.1%。可见,在细胞存活方面,本发明的cho细胞的无血清培养基显著优于商业化的cd cho 培养基,并且可维持体外培养cho dg44细胞后期活率。
[0053]
表7和图3的结果表明,采用本发明的无血清培养基(即实验例1-3)培养16天,所述表达cd20单抗的cho dg44 细胞株表达获得的cd20单抗蛋白浓度可达1500-1800 mg/l,而采用市售的cho无血清培养基表达获得的cd20单抗蛋白浓度为800 mg/l,仅为采用本发明无血清培养基的蛋白浓度一半左右。
[0054]
实施例3 野生型cho细胞悬浮培养重复实施例2中的实验例2、对比例2,不同点在于用野生型的cho细胞,即cho-k1 atcc cat.no.ccl-61,替换表达cd20单抗的cho dg44 细胞。实验结果显示,使用实验例2的培养基,野生型cho细胞第8天达到最大细胞密度65.9
×
106/ml,对比例2同样在第8天达到最大
细胞密度,但仅有55.1
×
106/ml。并且使用实验例2的培养基,野生型cho细胞在培养的第8-13天,细胞密度均可维持在55
×
106/ml以上,而使用对比例2的培养基,细胞密度从第8天开始持续下降,在培养的第13天,细胞密度下降至45
×
106/ml。对于细胞存活率,使用实验例2的培养基,野生型cho细胞至培养的第16天,仍可以达到90%的细胞存活率,而使用对比例2的培养基,野生型cho细胞至培养的第16天存活率已经下降到75%。由此可见,使用本发明的无血清培养基培养表达cd20单抗的cho dg44 细胞或野生型cho细胞,均可取得较佳效果,相对于市售的cho无血清培养基具有更高的细胞密度、更好的存活率。
[0055]
实施例4 培养基中aeo-9组分的降低细胞成团效果重复实施例2中的细胞悬浮培养实验,区别在于分别采用实验例2、对比例1,对比例1除了将150mg/l的aeo-9替换为150mg/l的嵌段式聚醚f-68以外,其他组分、浓度与实验例2相同。培养至第10天,使用实验例2培养基培养的细胞,在显微镜下观察,形态饱满,单个细胞清晰可见,无结团现象,细胞结团现象得到了明显改善,具体见图4。使用对比例1培养基培养的细胞,仍然有轻微结团现象,具体见图5。由此可见,本发明包含aeo-9组分的无血清培养基,可以明显改善悬浮培养cho细胞的结团问题,且相对于嵌段式聚醚f-68组分具有更好的效果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1