一种双特异性单链抗体及应用的制作方法
[0001]
本发明涉及生物技术领域,具体地指一种双特异性单链抗体及应用。
背景技术:
[0002]
bites(bispecific t cell engagers)是一种以t细胞作为效应细胞的双特异性单链抗体,它具有两个抗原结合臂,可以同时和t细胞及靶细胞结合,并激活细胞毒性t细胞杀伤病变细胞。和其它双特异性抗体相比,bites的分子柔韧性更好,能更好地促进cd3复合体和肿瘤靶标的连接,并且它不受t细胞受体和靶细胞上mhc i类分子的约束,不需要共刺激分子的参与,是一种极具应用潜力的抗体形式。
技术实现要素:
[0003]
本发明的目的在于提供一种效果较好的双特异性单链抗体及应用。
[0004]
为实现上述目的,首先,本发明所设计的双特异性单链抗体,它是由cd3抗体与pd-l1抗体偶联得到,简称为bites-pd-l1。
[0005]
上述方案中,双特异性单链抗体的氨基酸序列如seq id no.1所示。
[0006]
其次,本发明提供了上述双特异性单链抗体在制备抗肿瘤药物中的应用。
[0007]
再次,本发明还提供了一种携带上述双特异性单链抗体的基因的重组溶瘤病毒,所述重组溶瘤病毒包含作为载体的ii型单纯疱疹病毒,载体内整合有所述双特异性单链抗体的编码基因。
[0008]
上述方案中,所述重组溶瘤病毒为ii型单纯疱疹病毒hg52dicp47d34.5-bites-pdl-1,其保藏编号为cctcc no:v202053。已于2020年9月8日在武汉大学的中国典型培养物保藏中心保藏。
[0009]
所使用病毒骨架为敲除icp34.5和icp47区域的重组ⅱ型单纯疱疹病毒,bites-pd-l1基因利用phg52d34.5-cmv-bites-pd-l1载体通过同源重组的方式整合到已敲除的icp34.5区域。通过将双特异性单链抗体基因整合至溶瘤病毒内,使双特异性单链抗体在体内的能长期表达,最长可达7天。
[0010]
本发明的有益效果:
[0011]
发明提供的bites-pd-l1是一种能够同时结合cd3和肿瘤细胞表面pd-l1的双特异性抗体,当bites-pd-l1进入体内与t细胞结合后,可以有效激活t细胞,并引导t细胞对肿瘤细胞进行杀伤。当bites-pd-l1与肿瘤细胞结合后,可以将肿瘤细胞暴露出来,吸引t细胞对其进行杀伤,同时可以解除pd-1/pd-l1的免疫抑制,延缓t细胞的耗竭。基于bites-pd-l1的技术构思和其产生的效果,本发明还利用bites-pd-l1开发出了一种溶瘤病毒ohsv2-bites-pd-l1,携带bites-pd-l1基因的溶瘤病毒能够特异性的在肿瘤细胞内部增殖,具有安全性高,制备工艺简单的特点,提高了bites-pd-l1在机体内存留的半衰期,缩短了给药次数和给药剂量。
附图说明
[0012]
图1为bites-pd-l1的电泳纯化图。
[0013]
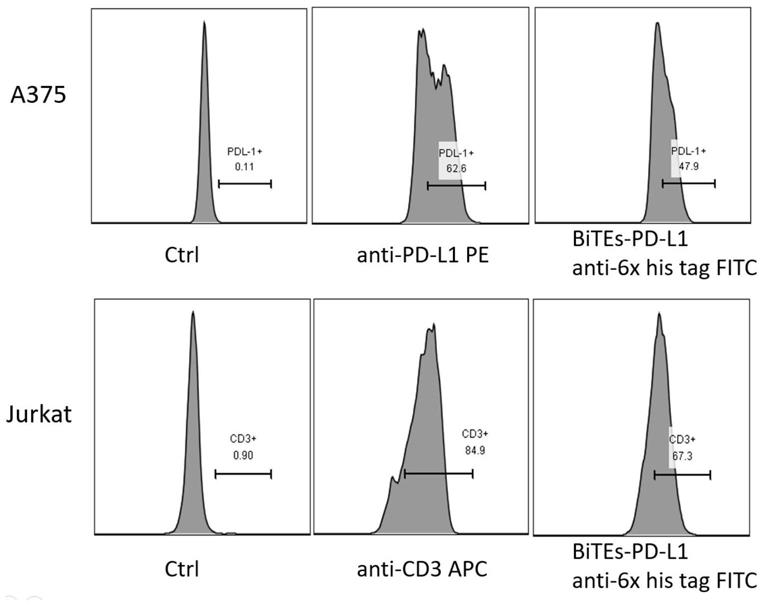
图2为bites-pd-l1细胞结合实验中的流式检测图。
[0014]
图3为肿瘤细胞pd-l1表达检测实验中的流式检测图。
[0015]
图4为bites-pd-l1介导的pbmc激活实验中的流式检测图。
[0016]
图5为bites-pd-l1介导的pbmc激活实验中ifn-γ检测结果。
[0017]
图6为bites-pd-l1介导的pbmc杀伤bgc823细胞实验结果的效果比较图。
[0018]
图7为bites-pd-l1介导的pbmc杀伤huh-7细胞实验结果的效果比较图。
[0019]
图8为bites-pd-l1介导的pbmc杀伤a375细胞实验结果的效果比较图。
[0020]
图9为ohsv2-bites-pd-l1联合pbmc杀伤实验中高通量实时成像观测图。
[0021]
图10为ohsv2-bites-pd-l1联合pbmc杀伤的数据比较图。
具体实施方式
[0022]
以下结合附图和具体实施例对本发明作进一步的详细描述。以下实施例是在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
[0023]
实施例1
[0024]
请在此处补充bites-pd-l1的制备过程
[0025]
使用磷酸钙转染试剂将phg52d34.5-cmv-bites-pd-l1质粒转染进hek-293t内,48h和72h后收集上清,使用ni-nta亲和层析介质(akta)对上清中的bites-pd-l1进行吸附。利用洗涤缓冲液(50mm na2hpo4,0.3m nacl,10mm imidazole ph=8.0)和洗脱缓冲液(50mm na2hpo4,0.3m nacl,250mm imidazole ph=8.0)将bites-pd-l1从介质上洗脱。将得到的产物使用20kda的透析卡进行透析,置换于pbs缓冲液,冻存于-70℃。
[0026]
实施例2
[0027]
bites-pd-l1 western鉴定
[0028]
1)将收集的蛋白样品与4
×
sds-page蛋白上样缓冲液混匀,煮沸10min。
[0029]
2)配置sds-page凝胶,12%的分离胶,分别在点样孔中加入5μl的蛋白marker和6μl的样品,开始电泳,上层胶电压为80v,下层胶电压为120v,当溴酚蓝跑至底部时停止电泳。结果如图1所示,1泳道为阴性对照样品,2泳道为bites-pd-l1样品(55kda)。
[0030]
3)电泳结束进行切胶,切除上层胶以及多余的胶,同时切掉底端溴酚蓝的部分。
[0031]
4)剪裁滤纸和nc膜,nc膜的大小与凝胶的大小相等,小滤纸稍稍小于胶,将nc膜,蛋白胶和滤纸浸没于转膜缓冲液中。在转膜仪上依次放上大滤纸,nc膜,蛋白胶和小滤纸(滤纸不能相互接触,不要有气泡),转膜15min,15v。
[0032]
5)当转膜完成后,使用pbst(pbs+0.05%tween 20)洗涤3次,每次10min。
[0033]
6)封闭:使用封闭液(5g脱脂奶粉+100ml pbst),37℃封闭2h。封闭结束后,将样品置于摇床上,使用pbst清洗3次,每次10min。
[0034]
7)加入mouse 6
×
his抗体孵育:稀释比例为1:2000,取5μl一抗到10ml pbst中,室温置于摇床上孵育2h(或4℃过夜)。孵育完毕后,将样品置于摇床上,使用pbst清洗3次,每次10min。
[0035]
8)加入rabbit anti-mouse-hpr抗体孵育:稀释比例为1:2000,取5μl的二抗到10ml的pbst中,室温置于摇床上孵育1h。孵育完毕后,将样品置于摇床上,使用pbst清洗3次,每次10min。
[0036]
9)最后一次洗涤完成后进行显色,ecl显色液a,b等体积混合,一共1ml。使用1ml的移液枪吸取染色液滴加于nc膜上,避光显色5min,使用纯水终止显色,将nc膜晾干避光保存。
[0037]
实施例3
[0038]
bites-pd-l1细胞结合实验
[0039]
将1
×
106个jurkat细胞和a375细胞分别重悬于100μl pbs缓冲液中,将a375细胞分别与1μg人源的pd-l1抗体和500μl bites-pd-l1上清孵育,将jurkat细胞分别与1μg人源的cd3抗体和500μl bites-pd-l1上清孵育,4℃孵育25min,加入pbs清洗两次,将bites-pd-l1孵育组加入1μg 6
×
his-fitc抗体,4℃孵育25min,使用pbs清洗两次,上流式检测,结果如图2所示。
[0040]
实施例4
[0041]
1)肿瘤细胞pd-l1表达检测
[0042]
将2
×
104个huh-7,panc-1,bgc823,a549,a375细胞铺于96孔板中,37℃,5%co2的细胞培养箱中过夜培养。隔天按2:1的效靶比加入pbmc,37℃,5%co2的细胞培养箱培养48h。去上清,加入pbs清洗两次。使用胰酶将肿瘤细胞消化下来,使用pbs将肿瘤细胞清洗两次。与1μg人源的pd-l1抗体,4℃孵育25min,使用pbs清洗两次,上流式检测,结果如图3所示。
[0043]
2)bites-pd-l1介导的pbmc激活
[0044]
将2
×
104个panc-1,bgc823,a549细胞铺于96孔板中,37℃,5%co2的细胞培养箱中过夜培养。隔天按2:1的效靶比分别加入mock pbmc和bites-pd-l1孵育的pbmc,37℃,5%co2的细胞培养箱培养48h。取上清中的pbmc,使用pbs将清洗两次,与1μg人源的cd4,cd8,cd25抗体4℃孵育25min,使用pbs清洗两次,上流式检测,结果如图4所示。
[0045]
将2
×
104个huh-7,panc-1,bgc823,a549,a375细胞铺于96孔板中,37℃,5%co2的细胞培养箱中过夜培养。隔天按2:1的效靶比分别加入mock pbmc和bites-pd-l1孵育的pbmc,37℃,5%co2的细胞培养箱培养48h。取上清,离心去除细胞。使用elisa试剂盒对上清中的ifn-γ进行检测,结果如图5所示。
[0046]
3)bites-pd-l1介导的pbmc杀伤
[0047]
将2
×
104个huh-7,bgc823,a375细胞铺于96孔板中,37℃,5%co2的细胞培养箱中过夜培养。隔天按2:1的效靶比分别加入mock pbmc和bites-pd-l1孵育的pbmc,37℃,5%co2的细胞培养箱培养48h,显微镜下观察杀伤情况,结果如图6~8所示。
[0048]
实施例5
[0049]
请补充ohsv2-bites-pd-l1的详细制备过程
[0050]
1)将4
×
105个icp4细胞接种于6孔板中,在37℃,5%co2环境中培养。隔天使用磷酸钙转染试剂将ohsv2-gfp的基因组和phg52d34.5-cmv-bites-pd-l1质粒一同转染进icp4细胞内,24~48h后观察是否形成噬毒斑。
[0051]
2)将生成噬毒斑的细胞孔进行冻融,5min,2000g离心收集上清,100倍,1000倍,
10000倍稀释后感染icp4细胞。在荧光显微镜下挑选出不带绿色荧光的噬毒斑,进一步感染icp4细胞,重复挑选出不带绿色荧光的噬毒斑,直至孔板的噬毒斑均不带绿色荧光,即得到ohsv2-bites-pd-l1。进一步提取病毒基因组,使用pcr对病毒进行鉴定。
[0052]
实施例6
[0053]
ohsv2-bites-pd-l1联合pbmc杀伤
[0054]
将2
×
104个bgc823-gfp细胞铺于96孔板中,37℃,5%co2的细胞培养箱中过夜培养。隔天按2:1的效靶比分别加入pbmc,同时按moi=0.1加入ohsv2-hgm-csf和ohsv2-bites-pd-l1,组别如下表1,使用高通量实时成像系统对细胞进行观察,结果如图9~图10所示。
[0055]
表1.ohsv2-bites-pd-l1联合pbmc杀伤实验分组
[0056]
组别杀伤率pbmc0%ohsv2-hgm-csf23.33%ohsv2-bites-pd-l17.756%ohsv2-hgm-csf+pbmc44.20%ohsv2-bites-pd-l1+pbmc93.77%
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1