用于纯化含蛋白质的溶液的聚酰胺介质及其制造方法与流程
1.本发明涉及用于纯化含蛋白质的溶液的聚酰胺介质的制造方法、含蛋白质的溶液的纯化方法和用于纯化含蛋白质的溶液的聚酰胺介质。
背景技术:
2.近年来,在药品中应用了蛋白质的生物药品备受关注。
3.其中,尤其受到关注的是免疫球蛋白、即抗体,其在药品、诊断药或对应的抗原蛋白的分离纯化材料等用途中的利用价值正在提高。
4.抗体是影响免疫反应的生理活性物质,其由已免疫的动物的血液、具备抗体产生能力的细胞的细胞培养液或动物的腹水培养液获得。
5.需要说明的是,这些含有抗体的血液、细胞培养液和腹水培养液中包含除抗体之外的蛋白质或源自细胞培养所使用的原料液的复杂的夹杂成分(以下有时将它们记作夹杂物),历经多阶段的工序来去除夹杂物。
6.作为从前述血液、细胞培养液和腹水培养液中去除夹杂物的方法,一直以来提出了利用吸附机理并采用离子交换柱的方法、使用疏水凝胶的方法(例如参照下述非专利文献1);以及使用含聚酰胺的成形体的方法(例如参照下述专利文献1)等。
7.此外,作为前述夹杂物的去除方法的其它形态,提出了使用尺寸排阻柱的方法(例如参照下述专利文献2)、使用纳米过滤器进行过滤的方法等根据尺寸排阻的机理来去除夹杂物的方法。
8.现有技术文献
9.专利文献
10.专利文献1:日本特许第6455851号公报
11.专利文献2:日本特许第2638680号公报
12.非专利文献
13.非专利文献1:hlc mailgram,东曹公司,2003年8月25日,第97卷,第3号,p.10
技术实现要素:
14.发明要解决的问题
15.然而,上述利用吸附机理来去除夹杂物的方法和根据尺寸排阻的机理来去除夹杂物的方法均会发生目标蛋白质的吸附,因此,存在目标蛋白质的回收率降低的问题点。
16.因而,本发明的课题在于,提供目标蛋白质的回收率更高的用于纯化含蛋白质的溶液的聚酰胺介质的制造方法、以及用于纯化含蛋白质的溶液的聚酰胺介质。
17.此外,作为其它课题,提供即便在酸或碱处理后也可维持其强度的用于纯化含蛋白质的溶液的聚酰胺介质的制造方法、以及用于纯化含蛋白质的溶液的聚酰胺介质。
18.进而,作为其它课题,提供使用前述聚酰胺介质来纯化含蛋白质的溶液的方法。
19.用于解决问题的方案
20.本发明人等为了解决前述课题而进行了深入研究,结果发现:通过对聚酰胺介质进行规定处理,从而可得到能够解决上述现有技术课题的用于纯化含蛋白质的溶液的聚酰胺介质,由此完成了本发明。
21.即,本发明如下所示。
22.〔1〕一种用于纯化含蛋白质的溶液的聚酰胺介质的制造方法,其具有:
23.对于用酸性或碱性水溶液处理前的聚酰胺介质,利用酸性或碱性水溶液进行处理的工序。
24.〔2〕根据前述〔1〕所述的用于纯化含蛋白质的溶液的聚酰胺介质的制造方法,其中,前述聚酰胺介质为多孔体。
25.〔3〕根据前述〔2〕所述的用于纯化含蛋白质的溶液的聚酰胺介质的制造方法,其中,前述多孔体为膜状的多孔体。
26.〔4〕根据前述〔1〕~〔3〕中任一项所述的用于纯化含蛋白质的溶液的聚酰胺介质的制造方法,其中,前述酸性或碱性水溶液为ph5以下的酸性水溶液。
27.〔5〕根据前述〔1〕~〔3〕中任一项所述的用于纯化含蛋白质的溶液的聚酰胺介质的制造方法,其中,前述酸性或碱性水溶液为ph10以上的碱性水溶液。
28.〔6〕根据前述〔1〕~〔5〕中任一项所述的用于纯化含蛋白质的溶液的聚酰胺介质的制造方法,其中,前述含蛋白质的溶液为含抗体的溶液。
29.〔7〕一种含蛋白质的溶液的纯化方法,其具有:使含蛋白质的溶液接触用酸性或碱性水溶液进行了处理的用于纯化含蛋白质的溶液的聚酰胺介质的工序。
30.〔7
‑
1〕一种含蛋白质的溶液的纯化方法,其具有:使含蛋白质的溶液接触聚酰胺介质的工序,所述聚酰胺介质是通过前述〔1〕~〔6〕中任一项所述的用于纯化含蛋白质的溶液的聚酰胺介质的制造方法而得到的,其用酸性或碱性水溶液进行了处理,且用于纯化含蛋白质的溶液。
31.〔8〕根据前述〔7〕或〔7
‑
1〕所述的含蛋白质的溶液的纯化方法,其中,使含蛋白质的溶液接触前述聚酰胺介质的工序是利用前述聚酰胺介质来过滤含蛋白质的溶液的工序。
32.〔9〕一种含蛋白质的溶液的纯化方法,其具有:
33.利用ph10以上的碱性水溶液,在4℃以上且100℃以下、5分钟以上且70小时以下的条件下,对碱处理前的聚酰胺介质进行处理的工序;
34.对前述聚酰胺介质进行清洗的工序;以及
35.使含蛋白质的溶液接触前述清洗后的聚酰胺介质的工序。
36.〔9
‑
1〕一种含蛋白质的溶液的纯化方法,其具有:
37.利用ph13以上的碱性水溶液,在10℃以上且30℃以下、0.5小时以上且40小时以下的条件下,对碱处理前的聚酰胺介质进行处理的工序;
38.对前述聚酰胺介质进行清洗的工序;以及
39.使含蛋白质的溶液接触前述聚酰胺介质的工序。
40.〔10〕一种用于纯化含蛋白质的溶液的聚酰胺介质,其中,
41.该聚酰胺介质的表面的氨基与羧基之和比前述聚酰胺介质的内部的氨基与羧基之和多1.01倍以上。
42.〔10
‑
1〕一种用于纯化含蛋白质的溶液的聚酰胺介质,其是通过前述〔1〕~〔6〕中任
一项所述的用于纯化含蛋白质的溶液的聚酰胺介质的制造方法而得到的,且用于纯化含蛋白质的溶液,
43.该聚酰胺介质的表面的氨基与羧基之和比前述聚酰胺介质的内部的氨基与羧基之和多1.01倍以上。
44.〔11〕一种用于纯化含蛋白质的溶液的聚酰胺介质,其中,
45.该聚酰胺介质的表面的聚合物的数均分子量mn(s)与前述聚酰胺介质的内部的聚合物的数均分子量mn(i)用下述式表示。
46.mn(s)/mn(i)≤0.99
47.〔11
‑
1〕一种用于纯化含蛋白质的溶液的聚酰胺介质,其是通过前述〔1〕~〔6〕中任一项所述的用于纯化含蛋白质的溶液的聚酰胺介质的制造方法而得到的,且用于纯化含蛋白质的溶液,
48.该聚酰胺介质的表面的聚合物的数均分子量mn(s)与前述聚酰胺介质的内部的聚合物的数均分子量mn(i)用下述式表示。
49.mn(s)/mn(i)≤0.99
50.〔12〕一种含蛋白质的溶液的纯化方法,其具有:使含蛋白质的溶液接触前述〔10〕、〔10
‑
1〕、〔11〕或〔11
‑
1〕所述的用于纯化含蛋白质的溶液的聚酰胺介质的工序。
51.〔13〕根据前述〔12〕所述的含蛋白质的溶液的纯化方法,其中,使含蛋白质的溶液接触前述用于纯化含蛋白质的溶液的聚酰胺介质的工序为利用前述聚酰胺介质来过滤含蛋白质的溶液的工序。
52.〔14〕一种用于去除抗体聚集体的聚酰胺介质的制造方法,其具有:
53.将浸渍于碱性水溶液之前的聚酰胺介质在ph5以下的酸性水溶液或ph10以上的碱性水溶液中浸渍5分钟以上的工序。
54.〔15〕根据前述〔14〕所述的用于去除抗体聚集体的聚酰胺介质的制造方法,其中,前述聚酰胺介质为多孔体。
55.〔16〕根据前述〔15〕所述的用于去除抗体聚集体的聚酰胺介质的制造方法,其中,前述多孔体为膜状的多孔体。
56.〔17〕根据前述〔14〕~〔16〕中任一项所述的用于去除抗体聚集体的聚酰胺介质的制造方法,其中,前述碱性水溶液为氢氧化钠水溶液或氢氧化钾水溶液。
57.〔18〕根据前述〔14〕~〔17〕中任一项所述的用于去除抗体聚集体的聚酰胺介质的制造方法,其中,前述抗体聚集体为单克隆抗体的聚集体。
58.〔19〕一种提高了抗体单体的纯度的抗体溶液的回收方法,其具有:
59.使包含抗体聚集体的抗体溶液接触用酸性或碱性水溶液进行了处理的聚酰胺介质的工序。
60.〔19
‑
1〕一种提高了抗体单体的纯度的抗体溶液的回收方法,其具有:
61.使包含抗体聚集体的抗体溶液接触聚酰胺介质的工序,所述聚酰胺介质是通过前述〔14〕~〔18〕中任一项所述的用于去除抗体聚集体的聚酰胺介质的制造方法而得到的。
62.〔20〕一种从抗体溶液中去除抗体聚集体的方法,其具有:
63.使包含抗体聚集体的抗体溶液接触用酸性或碱性水溶液进行了处理的聚酰胺介质的工序。
64.〔20
‑
1〕一种从抗体溶液中去除抗体聚集体的方法,其具有:
65.使包含抗体聚集体的抗体溶液接触聚酰胺介质的工序,所述聚酰胺介质是通过前述〔14〕~〔18〕中任一项所述的用于去除抗体聚集体的聚酰胺介质的制造方法而得到的。
66.〔21〕根据前述〔19〕或〔19
‑
1〕所述的提高了抗体单体的纯度的抗体溶液的回收方法,其中,前述抗体为单克隆抗体。
67.〔22〕根据前述〔20〕或〔20
‑
1〕所述的从抗体溶液中去除抗体聚集体的方法,其中,前述抗体为单克隆抗体。
68.〔23〕一种用于去除抗体聚集体的聚酰胺介质,其中,
69.该聚酰胺介质的表面的氨基与羧基之和比前述聚酰胺介质的内部的氨基与羧基之和多1.01倍以上。
70.〔23
‑
1〕一种用于去除抗体聚集体的聚酰胺介质,其是通过前述〔14〕~〔18〕中任一项所述的用于去除抗体聚集体的聚酰胺介质的制造方法而得到的,且用于去除抗体聚集体,
71.该聚酰胺介质的表面的氨基与羧基之和比前述聚酰胺介质的内部的氨基与羧基之和多1.01倍以上。
72.〔24〕一种用于去除抗体聚集体的聚酰胺介质,其中,
73.该聚酰胺介质的表面的聚合物的数均分子量mn(s)与前述聚酰胺介质的内部的聚合物的数均分子量mn(i)用下述式表示。
74.mn(s)/mn(i)≤0.99
75.〔24
‑
1〕一种用于去除抗体聚集体的聚酰胺介质,其是通过前述〔14〕~〔18〕中任一项所述的用于去除抗体聚集体的聚酰胺介质的制造方法而得到的,且用于去除抗体聚集体,
76.该聚酰胺介质的表面的聚合物的数均分子量mn(s)与前述聚酰胺介质的内部的聚合物的数均分子量mn(i)用下述式表示。
77.mn(s)/mn(i)≤0.99
78.〔25〕一种提高了纯度的抗体溶液的回收方法,其具有:
79.使前述〔23〕、〔23
‑
1〕、〔24〕或〔24
‑
1〕所述的用于去除抗体聚集体的聚酰胺介质与包含抗体聚集体的抗体溶液接触的工序。
80.〔26〕一种从抗体溶液中去除抗体聚集体的方法,其具有:
81.使前述〔23〕、〔23
‑
1〕、〔24〕或〔24
‑
1〕所述的用于去除抗体聚集体的聚酰胺介质与包含抗体聚集体的抗体溶液接触的工序。
82.发明的效果
83.根据本发明,在一个方式中能够提供目标蛋白质的回收率高的用于纯化含蛋白质的溶液的聚酰胺介质的制造方法。此外,在一个方式中能够提供使用通过该制造方法而得到的聚酰胺介质来纯化含蛋白质的溶液的方法。进而,在一个方式中能够提供用于纯化含蛋白质的溶液的聚酰胺介质。
附图说明
84.图1示出实施例1的包含抗体单体和抗体聚集体的含抗体的溶液的色谱图。
85.图2示出图1的色谱图的峰部的放大图。
86.图3示出实施例10、比较例10的ft
‑
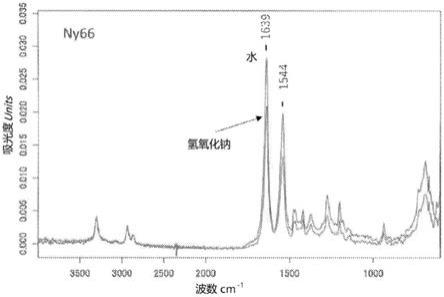
ir的光谱。1639cm
‑1、1544cm
‑1的峰大(记作“水”)者表示比较例10的测定结果,前述峰小(记作“氢氧化钠”)者表示实施例10的测定结果。
具体实施方式
87.以下,针对本具体实施方式(以下也记作“本实施方式”)进行详细说明。
88.需要说明的是,以下的本实施方式是用于说明本发明的例示,并不是指本发明限定于以下的内容。本发明可以在其主旨范围内进行各种变形来实施。
89.〔用于纯化含蛋白质的溶液的聚酰胺介质的制造方法〕
90.本实施方式的用于纯化含蛋白质的溶液的聚酰胺介质的制造方法具有利用酸性或碱性水溶液对聚酰胺原料进行处理的工序。
91.通过具有上述构成,从而得到目标蛋白质的回收率高的聚酰胺介质。
92.此处,聚酰胺原料、即利用酸性或碱性水溶液进行处理前的聚酰胺介质是指实施利用酸性或碱性水溶液进行处理这一工序的前阶段的、未处理的聚酰胺介质。聚酰胺原料可以为仅包含聚酰胺的介质,也可以为包含除聚酰胺之外的化合物的介质。
93.通过使用利用本实施方式的制造方法而得到的用于纯化含蛋白质的溶液的聚酰胺介质对含蛋白质的溶液进行纯化,从而能够降低目标蛋白质对聚酰胺介质的吸附量,能够以高回收率来回收目标蛋白质。
94.作为产生能够以高回收率来回收目标蛋白质这一效果的机理之一,可以认为:通过利用酸性或碱性水溶液对处理前的聚酰胺介质进行处理,从而聚酰胺表面上的酰胺键发生水解,出现作为亲水性官能团的羧基或氨基,由此实现蛋白质对聚酰胺介质的吸附的降低化,但本发明不局限于该机理。
95.此外,优选方式是:通过本实施方式的制造方法而得到的用于纯化含蛋白质的溶液的聚酰胺介质维持了利用酸性或碱性水溶液进行处理之前的状态的强度。
96.即,通过本实施方式的制造方法而得到的用于纯化含蛋白质的溶液的聚酰胺介质的优选方式是:目标蛋白质对聚酰胺介质的吸附量降低,且与利用酸性或碱性水溶液进行处理之前的状态相比,其强度得以维持。
97.(用于去除抗体聚集体的聚酰胺介质的制造方法)
98.通过本实施方式的制造方法而得到的用于纯化含蛋白质的溶液的聚酰胺介质可以是用于去除抗体聚集体的聚酰胺介质。
99.即,本实施方式的用于纯化含蛋白质的溶液的聚酰胺介质可以是抗体溶液纯化用的聚酰胺介质。详细而言,成为纯化对象的含抗体的溶液在包含抗体单体的基础上还包含抗体聚集体时,可以利用聚酰胺介质来去除聚集体。
100.将本实施方式的用于纯化含蛋白质的溶液的聚酰胺介质的制造方法作为用于去除抗体聚集体的聚酰胺介质的制造方法时,该制造方法中具有:将在碱性水溶液中浸渍之前的聚酰胺介质在ph5以下的酸性水溶液或ph10以上的碱性水溶液中浸渍5分钟以上的工序。由此,可获得能够有效去除抗体聚集体的聚酰胺介质。
101.(蛋白质和抗体)
102.本实施方式中,作为成为纯化对象的含蛋白质的溶液中包含的蛋白质,只要是能够利用通过本实施方式的制造方法而得到的聚酰胺介质以高回收率来回收目标蛋白质的蛋白质,就没有特别限定。虽不限定于以下,但可列举出例如白蛋白、球蛋白或纤维蛋白原等。
103.此外,作为成为纯化对象的含蛋白质的溶液中包含的蛋白质,可列举出抗体作为优选例。即,作为成为纯化对象的含蛋白质的溶液的适合例,可列举出含抗体的溶液。
104.通过使利用本实施方式的制造方法而得到的用于纯化含蛋白质的溶液的聚酰胺介质与包含蛋白质聚集体的规定的含蛋白质的溶液接触,从而高选择性地去除蛋白质聚集体,能够以高回收率回收提高了蛋白质单体的纯度的蛋白质溶液。
105.即,通过使包含抗体聚集体的抗体溶液接触通过本实施方式的制造方法而得到的聚酰胺介质,从而从抗体溶液中去除抗体聚集体,能够以高回收率回收提高了抗体单体的纯度的抗体溶液。
106.作为抗体,如生化学中的一般定义所示,可列举出作为脊椎动物的感染防御机理的b淋巴细胞产生的糖蛋白分子(也被称为γ
‑
球蛋白或免疫球蛋白)。
107.例如,通过本实施方式进行纯化的抗体溶液中的抗体可以用作人的药品,在该情况下,具有与作为给药对象的人的体内存在的抗体实质相同的结构。
108.抗体可以是人抗体,也可以是源自除人之外的牛和小鼠等哺乳动物的抗体蛋白。
109.此外,抗体可以是与人igg形成的嵌合抗体蛋白、人源化抗体。
110.前述与人igg形成的嵌合抗体是指:可变区源自小鼠等除人之外的生物,但其它恒定区被置换成源自人的免疫球蛋白而得的抗体。
111.前述人源化抗体是指:可变区之中,互补性决定区(complementarity
‑
determining region:cdr)源自除人之外的生物,但其它构架区(framework region:fr)源自人的抗体。人源化抗体与嵌合抗体相比,免疫原性进一步降低。
112.本实施方式中,抗体的类(同种型)和亚类没有特别限定。例如,抗体根据恒定区的结构差异而被分类为igg、iga、igm、igd和ige的5个种类。但是,将通过本实施方式的制造方法而得到的用于纯化含蛋白质的溶液的聚酰胺介质用于抗体聚集体去除用途来去除抗体聚集体而得到抗体单体的纯度高的抗体溶液时,作为纯化对象的抗体溶液中包含的抗体可以为5个种类中的任一种。
113.此外,对于人抗体而言,igg存在igg1~igg4的4个亚类,iga存在iga1~iga2的2个亚类。但是,本实施方式中,抗体的亚类可以为任一种。需要说明的是,fc区域结合有蛋白质的fc融合蛋白质等抗体相关蛋白质在本实施方式中也可包括在作为纯化对象的抗体中。
114.进而,抗体还可以根据来源进行分类。但是,本实施方式中,作为纯化对象的抗体可以是天然的人抗体、通过基因重组技术而制造的重组人抗体、单克隆抗体或多克隆抗体中的任一者。
115.这些抗体之中,作为在本实施方式中成为纯化对象的抗体,从作为抗体药物的需要性、重要性的观点出发,适合为单克隆抗体,但本实施方式不限定于此。
116.此外,作为抗体,可列举出包含igm、igd、igg、iga或ige中任一者的单克隆抗体或多克隆抗体。进而,抗体可以源自血浆产物,或者,也可以源自细胞培养液。
117.通过细胞培养来获得抗体时,作为细胞,可以使用动物细胞或微生物。
118.作为动物细胞,种类没有特别限定,可列举出cho细胞、sp2/0细胞、ns0细胞、vero细胞、per.c6细胞等。
119.作为微生物,种类没有特别限定,可列举出大肠杆菌、酵母等。
120.(抗体聚集体)
121.使用通过本实施方式而制造的用于纯化含蛋白质的溶液的聚酰胺介质进行纯化的溶液为抗体溶液,抗体溶液包含聚集体时,作为属于去除对象的抗体聚集体,可列举出目标抗体的单体聚集两个而成的二聚体、目标抗体的单体聚集三个而成的三聚体、或者目标抗体的单体聚集四个以上而成的多聚物、或者其混合物。
122.需要说明的是,多聚物有时同时包含二聚体和三聚体。
123.此外,抗体聚集体有时还包含除目标抗体之外的蛋白质。
124.进而,蛋白质的聚集体可以是不可逆性的聚集体,也可以是可逆性的聚集体。
125.(聚酰胺介质)
126.本实施方式的用于纯化含蛋白质的溶液的聚酰胺介质的制造方法或者用于去除抗体聚集体的聚酰胺介质的制造方法中使用的、构成用酸性或碱性水溶液进行处理前的聚酰胺介质的聚酰胺可以是由包含酰胺键的重复单元构成的聚合物,且单体单元为脂肪族聚酰胺、芳香族聚酰胺中的任一者,也可以是其混合物,还可以由多种脂肪族单体和芳香族单体形成。
127.作为聚酰胺,不限定于以下物质,可列举出例如通过ε
‑
己内酰胺、十一内酰胺、月桂内酰胺的缩聚反应而得到的尼龙6、尼龙11、尼龙12;通过六亚甲基二胺与己二酸的共缩聚反应而得到的尼龙66;通过六亚甲基二胺与癸二酸的共缩聚反应而得到的尼龙610;通过六亚甲基二胺与对苯二甲酸的共缩聚反应而得到的尼龙6t;通过六亚甲基二胺与间苯二甲酸的共缩聚反应而得到的尼龙6i;通过壬二胺与对苯二甲酸的共缩聚反应而得到的尼龙9t;通过甲基戊二胺与对苯二甲酸的共缩聚反应而得到的尼龙m5t;通过ε
‑
己内酰胺与月桂内酰胺的共缩聚反应而得到的尼龙612;通过对苯二胺与对苯二甲酸的共聚反应而得到的聚酰胺;通过间苯二胺与间苯二甲酸的共聚反应而得到的聚酰胺等。
128.作为前述用酸性或碱性水溶液进行处理前的聚酰胺介质,没有特别限定,可例示出例如聚酰胺介质(其中不包括具有接枝链的聚酰胺介质)。此外,作为其它方式,可例示出不具有接枝链的聚酰胺介质。
129.本实施方式的用于纯化含蛋白质的溶液的聚酰胺介质的制造方法或者用于去除抗体聚集体的聚酰胺介质的制造方法中使用的、构成用酸性或碱性水溶液进行处理前的聚酰胺介质的聚酰胺的重均分子量没有特别限定,从聚酰胺介质的强度的观点出发,优选更大。具体而言,从聚酰胺介质的强度的观点出发,优选为2000以上,更优选为5000以上、10000以上、50000以上、60000以上、70000以上、80000以上,进一步优选为90000以上、95000以上、100000以上。
130.此外,从聚酰胺介质为纤维时的纺丝性和末端官能团量的观点出发,优选为2000000以下,更优选为1000000以下,进一步优选为500000以下、300000以下、200000以下。
131.聚酰胺的重均分子量可利用例如gpc(凝胶渗透色谱、gel permeation chromatography)之类的公知方法进行测定。
132.本实施方式的用于纯化含蛋白质的溶液的聚酰胺介质的制造方法或者用于去除
抗体聚集体的聚酰胺介质的制造方法中使用的、构成用酸性或碱性水溶液进行处理前的聚酰胺介质的聚酰胺的数均分子量没有特别限定,从聚酰胺介质的强度的观点出发,优选更大。具体而言,优选为1000以上,更优选为5000以上、6000以上、7000以上、8000以上、9000以上、10000以上,进一步优选为20000以上、25000以上、30000以上。
133.此外,从聚酰胺介质为纤维时的纺丝性和末端官能团量的观点出发,优选为1000000以下,更优选为500000以下,进一步优选为100000以下、50000以下、40000以下、30000以下。
134.聚酰胺的数均分子量可利用例如gpc(凝胶渗透色谱、gel permeation chromatography)之类的公知方法进行测定。
135.<用于纯化含蛋白质的溶液的聚酰胺介质的制造方法的处理条件>
136.本实施方式的用于纯化含蛋白质的溶液的聚酰胺介质的制造方法中,具有利用酸性或碱性水溶液对作为原料的规定处理前的聚酰胺介质进行处理的工序。
137.本实施方式的聚酰胺介质的制造方法中,作为原料的聚酰胺发生的变化没有特别限定,可列举出水解、官能团的导入等。作为前述要导入的官能团,可列举出例如羟基、羧基、氨基、磺基、醛基、羰基、硝基。
138.作为处理方法,可以为浸渍,为多孔体时,可以进行通液。
139.利用酸性水溶液进行处理时,关于酸性水溶液的ph,作为上限,从水解的进行速度的观点出发,优选为5以下,更优选为4以下、3以下、2以下、1.5以下等。此外,作为下限,从聚酰胺介质的强度的观点出发,可例示出1.0以上。
140.作为酸性水溶液,可列举出例如盐酸、硫酸、硝酸等无机酸、三氟乙酸等有机酸的水溶液。酸性水溶液中可以包含除前述无机酸或有机酸之外的化合物。
141.关于在酸性水溶液中进行浸渍来作为处理方法时的浸渍时间,从作为原料的规定处理前的聚酰胺介质的表面的酰胺键的分解的观点出发,作为下限,优选为5分钟以上,更优选为10分钟以上、20分钟以上、30分钟以上、40分钟以上、50分钟以上、55分钟以上,进一步优选根据聚酰胺介质的种类、形态、应用的抗体种类而依次适当选择1小时以上、2小时以上、3小时以上、5小时以上、10小时以上、15小时以上、20小时以上、40小时以上、70小时以上。
142.此外,作为上限,从聚酰胺介质的强度的观点出发,可适当选择70小时以下、40小时以下、20小时以下、15小时以下、10小时以下、5小时以下、3小时以下、2小时以下、1小时以下、30分钟以下、20分钟以下、10分钟以下。
143.关于在酸性水溶液中进行浸渍来作为处理方法时的浸渍温度,从作为原料的处理前的聚酰胺介质的表面的酰胺键的分解进行速度的观点出发,作为下限,优选为4℃以上,更优选为10℃以上、15℃以上,进一步优选为20℃以上。
144.此外,作为上限,从聚酰胺介质的强度的观点出发,优选为100℃以下、80℃以下、50℃以下,更优选为40℃以下,进一步优选为30℃以下。
145.关于进行酸性水溶液的通液来作为处理方法时的通液时间,从作为原料的规定处理前的聚酰胺介质的表面的酰胺键的分解的观点出发,作为下限,优选为5分钟以上,更优选为10分钟以上、20分钟以上、30分钟以上、40分钟以上、50分钟以上、55分钟以上,进一步优选根据聚酰胺介质的种类、形态、应用的抗体种类而依次适当选择1小时以上、2小时以
上、3小时以上、5小时以上、10小时以上、15小时以上、20小时以上、40小时以上、70小时以上等。
146.此外,作为上限,可根据聚酰胺介质的种类、形态、应用的抗体种类而适当选择70小时以下、40小时以下、20小时以下、15小时以下、10小时以下、5小时以下、3小时以下、2小时以下、1小时以下、30分钟以下、20分钟以下、10分钟以下等。
147.关于进行酸性水溶液的通液来作为处理方法时的通液温度,从作为原料的规定处理前的聚酰胺介质的表面的酰胺键的分解进行速度的观点出发,作为下限,优选为4℃以上,更优选为10℃以上、15℃以上,进一步优选为20℃以上。
148.此外,作为上限,从聚酰胺介质的强度的观点出发,优选为100℃以下、80℃以下、50℃以下,更优选为40℃以下,进一步优选为30℃以下。
149.利用碱性水溶液对聚酰胺介质进行处理时,关于碱性水溶液的ph,从聚酰胺介质表面的酰胺键的分解效率的观点出发,作为下限,优选为ph10.0以上,更优选为11.0以上、进一步优选为12.0以上、更进一步优选为12.5以上、再进一步优选为13.0以上、特别优选为13.5以上。
150.此外,作为上限,从聚酰胺介质的强度的观点出发,优选为14.0以下,更优选为13.5以下。
151.作为碱性水溶液,可列举出例如氢氧化钠水溶液、氢氧化钾水溶液、氢氧化锂水溶液等,从获取成本的观点出发,优选为氢氧化钠水溶液或氢氧化钾水溶液。
152.聚酰胺介质处理用的碱性水溶液中可以包含除氢氧化钠、氢氧化钾、氢氧化锂之外的化合物。
153.关于将聚酰胺介质浸渍于碱性水溶液来作为处理方法时的浸渍时间,从使作为原料的规定处理前的聚酰胺介质的表面的酰胺键充分发生水解的观点出发,作为下限,优选为5分钟以上,更优选为10分钟以上、20分钟以上、30分钟以上,进一步优选为40分钟以上、50分钟以上、55分钟以上,可根据聚酰胺介质的种类、形态、应用的蛋白质种类而依次适当选择1小时以上、2小时以上、3小时以上、5小时以上、10小时以上、15小时以上、20小时以上、40小时以上、70小时以上等。
154.此外,作为上限,从聚酰胺介质的强度的观点出发,可适当选择70小时以下、40小时以下、20小时以下、15小时以下、10小时以下、5小时以下、3小时以下、2小时以下、1小时以下、30分钟以下、20分钟以下、10分钟以下等。
155.关于将聚酰胺介质浸渍于碱性水溶液来作为处理方法时的浸渍温度,从作为原料的规定处理前的聚酰胺介质的表面的酰胺键的分解进行速度的观点出发,作为下限,优选为4℃以上,更优选为10℃以上、15℃以上,进一步优选为20℃以上。此外,作为上限,从聚酰胺介质的强度的观点出发,可例示出100℃以下、80℃以下、50℃以下,更优选为40℃以下、进一步优选为30℃以下。
156.关于对聚酰胺介质进行碱性水溶液的通液来作为处理方法时的通液时间,从作为原料的规定处理前的聚酰胺介质的表面的酰胺键的分解的观点出发,作为下限,优选为5分钟以上,更优选为10分钟以上、20分钟以上、30分钟以上、40分钟以上、50分钟以上、55分钟以上,进一步优选根据聚酰胺介质的种类、形态、应用的抗体种类而依次适当选择1小时以上、2小时以上、3小时以上、5小时以上、10小时以上、15小时以上、20小时以上、40小时以上、
70小时以上。
157.此外,作为上限,从聚酰胺介质的强度的观点出发,可适当选择70小时以下、40小时以下、20小时以下、15小时以下、10小时以下、5小时以下、3小时以下、2小时以下、1小时以下、30分钟以下、20分钟以下、10分钟以下等。
158.关于对聚酰胺介质进行碱性水溶液的通液来作为处理方法时的通液温度,从作为原料的规定处理前的聚酰胺介质的表面的酰胺键的分解进行速度的观点出发,作为下限,优选为4℃以上,更优选为10℃以上、15℃以上,进一步优选为20℃以上。此外,作为上限,从聚酰胺介质的强度的观点出发,为100℃以下、80℃以下、50℃以下,更优选为40℃以下,进一步优选为30℃以下。
159.本实施方式的含蛋白质的溶液的纯化方法中,优选具有如下工序:利用ph10以上的碱性水溶液,在4℃以上且100℃以下、5分钟以上且70小时以下的条件下,对碱处理前的聚酰胺介质进行处理的工序;对前述聚酰胺介质进行清洗的工序;以及使含蛋白质的溶液接触前述清洗后的聚酰胺介质的工序。
160.此外,进一步优选具有如下工序:利用ph13以上的碱性水溶液,在10℃以上且30℃以下、0.5小时以上且40小时以下的条件下,对碱处理前的聚酰胺介质进行处理的工序;对前述聚酰胺介质进行清洗的工序;以及,使含蛋白质的溶液接触前述聚酰胺介质的工序。
161.由此,能够高效且以充分的速度发生作为原料的规定处理前的聚酰胺介质的表面的酰胺键的水解,通过使用该处理后的聚酰胺介质对含蛋白质的溶液进行纯化,从而能够降低目标蛋白质对聚酰胺介质的吸附量,能够以高回收率来回收目标蛋白质。
162.<用于去除抗体聚集体的聚酰胺介质的制造方法的处理条件>
163.本实施方式的聚酰胺介质的制造方法尤其是用于去除抗体聚集体的聚酰胺介质的制造方法时,将成为原料的规定处理前的聚酰胺介质在ph5以下的酸性水溶液中浸渍5分钟以上或者在ph10以上的碱性水溶液中浸渍10分钟以上。
164.本实施方式的聚酰胺介质的制造方法中,作为原料的聚酰胺发生的变化没有特别限定,可列举出水解、官能团的导入等。作为前述要导入的官能团,可列举出例如羟基、羧基、氨基、磺基、醛基、羰基、硝基。
165.利用酸性水溶液进行处理时,关于酸性水溶液的ph,作为上限,从作为原料的规定处理前的聚酰胺介质的表面的酰胺键的分解进行速度的观点出发,优选为5以下,更优选为4以下、3以下、2以下、1.5以下。此外,作为下限,从聚酰胺介质的强度的观点出发,优选为1.0以上。
166.作为酸性水溶液,可列举出例如盐酸、硫酸、硝酸等无机酸;三氟乙酸等有机酸的水溶液。酸性水溶液中可以包含除前述无机酸或有机酸之外的化合物。
167.关于在酸性水溶液中进行浸渍来作为处理方法时的浸渍时间,从作为原料的规定处理前的聚酰胺介质的表面的酰胺键的分解的观点出发,作为下限,优选为5分钟以上,更优选为10分钟以上、20分钟以上、30分钟以上、40分钟以上、50分钟以上、55分钟以上,进一步优选根据聚酰胺介质的种类、形态、应用的抗体种类而依次适当选择1小时以上、2小时以上、3小时以上、5小时以上、10小时以上、15小时以上、20小时以上、40小时以上、70小时以上等。
168.此外,作为上限,从聚酰胺介质的强度的观点出发,可适当选择70小时以下、40小
时以下、20小时以下、15小时以下、10小时以下、5小时以下、3小时以下、2小时以下、1小时以下、30分钟以下、20分钟以下或10分钟以下等。
169.关于在酸性水溶液中进行浸渍来作为处理方法时的浸渍温度,从作为原料的规定处理前的聚酰胺介质的表面的酰胺键的分解进行速度的观点出发,作为下限,优选为4℃以上,更优选为10℃以上、15℃以上,进一步优选为20℃以上。
170.此外,作为上限,从聚酰胺介质的强度的观点出发,优选为100℃以下、80℃以下、50℃以下,更优选为40℃以下,进一步优选为30℃以下。
171.关于进行酸性水溶液的通液来作为处理方法时的通液时间,从作为原料的规定处理前的聚酰胺介质的表面的酰胺键的分解的观点出发,作为下限,优选为5分钟以上,更优选为10分钟以上、20分钟以上、30分钟以上、40分钟以上、50分钟以上、55分钟以上,进一步优选根据聚酰胺介质的种类、形态、应用的抗体种类而依次适当选择1小时以上、2小时以上、3小时以上、5小时以上、10小时以上、15小时以上、20小时以上、40小时以上、70小时以上。
172.此外,作为上限,可根据聚酰胺介质的种类、形态、应用的抗体种类而适当选择70小时以下、40小时以下、20小时以下、15小时以下、10小时以下、5小时以下、3小时以下、2小时以下、1小时以下、30分钟以下、20分钟以下、10分钟以下。
173.关于进行酸性水溶液的通液来作为处理方法时的通液温度,从作为原料的规定处理前的聚酰胺介质的表面的酰胺键的分解进行速度的观点出发,作为下限,优选为4℃以上,更优选为10℃以上、15℃以上,进一步优选为20℃以上。
174.此外,作为上限,从聚酰胺介质的强度的观点出发,优选为100℃以下、80℃以下、50℃以下,更优选为40℃以下,进一步优选为30℃以下。
175.利用碱性水溶液对聚酰胺介质进行处理时,关于碱性水溶液的ph,从聚酰胺介质表面的酰胺键的分解效率的观点出发,作为下限,优选为ph10.0以上、更优选为11.0以上、进一步优选为12.0以上、更进一步优选为12.5以上、再进一步优选为13.0以上、特别优选为13.5以上。
176.此外,作为上限,从聚酰胺介质的强度的观点出发,优选为14以下、更优选为13.5以下。
177.作为碱性水溶液,可列举出例如氢氧化钠水溶液、氢氧化钾水溶液、氢氧化锂水溶液作为优选例。
178.碱性水溶液中可以包含除氢氧化钠、氢氧化钾、氢氧化锂之外的化合物。
179.关于将聚酰胺介质浸渍于碱性水溶液来作为处理方法时的浸渍时间,从作为原料的聚酰胺介质表面的酰胺键充分发生水解的观点出发,作为下限,优选为5分钟以上,更优选为10分钟以上,进一步优选为20分钟以上,更进一步优选为30分钟以上、40分钟以上、50分钟以上、55分钟以上,再进一步优选根据聚酰胺介质的种类、形态、应用的抗体种类而依次适当选择1小时以上、2小时以上、3小时以上、5小时以上、10小时以上、15小时以上、20小时以上、40小时以上等。
180.此外,作为上限,从聚酰胺介质的强度的观点出发,可适当选择40小时以下、20小时以下、15小时以下、10小时以下、5小时以下、3小时以下、2小时以下、1小时以下、30分钟以下、20分钟以下、10分钟以下等。
181.关于将聚酰胺介质浸渍于碱性水溶液来作为处理方法时的浸渍温度,从作为原料的规定处理前的聚酰胺介质的表面的酰胺键的分解进行速度的观点出发,作为下限,优选为4℃以上,更优选为10℃以上,进一步优选为15℃以上,更进一步优选为20℃以上。
182.此外,作为上限,从聚酰胺介质的强度的观点出发,优选为100℃以下、80℃以下、50℃以下,更优选为40℃以下,进一步优选为30℃以下。
183.关于对聚酰胺介质进行碱性水溶液的通液来作为处理方法时的通液时间,从作为原料的规定处理前的聚酰胺介质的表面的酰胺键的分解的观点出发,作为下限,优选为5分钟以上,更优选为10分钟以上、20分钟以上、30分钟以上、40分钟以上、50分钟以上、55分钟以上,进一步优选根据聚酰胺介质的种类、形态、应用的抗体种类而依次适当选择1小时以上、2小时以上、3小时以上、5小时以上、10小时以上、15小时以上、20小时以上、40小时以上、70小时以上等。
184.此外,作为上限,从聚酰胺介质的强度的观点出发,可适当选择70小时以下、40小时以下、20小时以下、15小时以下、10小时以下、5小时以下、3小时以下、2小时以下、1小时以下、30分钟以下、20分钟以下、10分钟以下等。
185.关于对聚酰胺介质进行碱性水溶液的通液来作为处理方法时的通液温度,从作为原料的规定处理前的聚酰胺介质的表面的酰胺键的分解进行速度的观点出发,作为下限,优选为4℃以上、更优选为10℃以上、进一步优选为15℃以上、更进一步优选为20℃以上。
186.此外,作为上限,从聚酰胺介质的强度的观点出发,优选为100℃以下、80℃以下、50℃以下,更优选为40℃以下,进一步优选为30℃以下。
187.通过本实施方式的制造方法而得到的聚酰胺介质在用于纯化含蛋白质的溶液、用于去除抗体聚集体中,在通过吸附来去除夹杂物的情况下,从表面积大小的观点出发,均优选为多孔体。此外,在通过尺寸排阻来去除夹杂物的情况下,也优选为多孔体。
188.作为多孔体的形态,可列举出例如膜状、颗粒状、单块、毛细管、烧结体等,具体而言,可列举出微多孔中空纤维膜、微多孔平膜、无纺布、织布。通过使多孔体为膜状,从而得到能够利用含蛋白质的溶液的通液而以高速对含蛋白质的溶液进行纯化的效果,故而优选。
189.聚酰胺介质为多孔膜时,从通过吸附或尺寸排阻来去除夹杂物的观点出发,多孔膜的孔径优选较小。关于聚酰胺多孔膜的平均孔径,作为上限,优选为1000nm以下、更优选为500nm以下、进一步优选为400nm以下、更进一步优选为300nm以下。此外,作为下限,从过滤速度的观点出发,优选为1nm以上、5nm以上、10nm以上、20nm以上、30nm以上。
190.〔含蛋白质的溶液的纯化方法〕
191.本实施方式的含蛋白质的溶液的纯化方法具有:使含蛋白质的溶液接触用酸性或碱性水溶液进行了处理的聚酰胺介质的工序。
192.具体而言,具有使含蛋白质的溶液接触通过上述本实施方式的用于纯化含蛋白质的溶液的聚酰胺介质的制造方法而得到的用于纯化含蛋白质的溶液的聚酰胺介质的工序。
193.使含蛋白质的溶液接触前述聚酰胺介质的工序包括:例如后述那样,使含蛋白质的溶液通过聚酰胺介质的工序、将聚酰胺介质浸渍在蛋白质溶液中的工序等。此外,作为使含蛋白质的溶液通过聚酰胺介质的工序,可例示出利用聚酰胺介质来过滤含蛋白质的溶液的工序。
194.由此,能够得到提高了纯度的含蛋白质的溶液。
195.作为通过使含蛋白质的溶液接触前述聚酰胺介质而能够去除的夹杂物,可列举出蛋白质聚集体、抗体聚集体、生物药品制造工序中的源自细胞宿主的蛋白质(hcp;host cell proteins)、病毒粒子等。病毒粒子可以具有外膜。
196.〔抗体溶液的回收方法、从抗体溶液中去除抗体聚集体的方法〕
197.此外,本实施方式的抗体溶液的回收方法和从抗体溶液中去除抗体聚集体的方法具有:使包含抗体聚集体的抗体溶液接触用酸性或碱性水溶液进行了处理的聚酰胺介质的工序。
198.具体而言,具有使通过上述本实施方式的用于去除抗体聚集体的聚酰胺介质的制造方法而得到的用于去除抗体聚集体的聚酰胺介质与包含抗体聚集体的抗体溶液接触的工序。
199.使前述聚酰胺介质与包含抗体聚集体的抗体溶液相接触的工序包括:例如后述那样,使抗体溶液通过聚酰胺介质的工序、将聚酰胺介质浸渍在抗体溶液中的工序等。此外,作为使含蛋白质的溶液通过聚酰胺介质的工序,可例示出利用聚酰胺介质来过滤含蛋白质的溶液的工序。
200.由此,能够从抗体溶液中有效地去除抗体聚集体,能够得到提高了纯度的抗体溶液。
201.本实施方式中,含蛋白质的溶液可以为抗体溶液,该抗体溶液可以包含抗体聚集体。此时,如上所述,能够从抗体溶液中去除抗体聚集体,以高回收率获得提高了抗体单体的纯度的抗体溶液。
202.本实施方式中使用的含蛋白质的溶液为抗体溶液时,该抗体溶液是指溶解有目标抗体的溶液。
203.抗体溶液中使用的溶剂可以为纯水,也可以为缓冲液。
204.能够作为溶液使用的缓冲液的种类不限定于以下,可列举出例如溶解有tris盐、乙酸盐、吐温、山梨糖醇、麦芽糖、甘氨酸、精氨酸、赖氨酸、组氨酸、磺酸盐、磷酸盐、柠檬酸或氯化钠的缓冲液。
205.作为本实施方式中使用的抗体溶液的浓度,只要抗体溶解于溶液,就没有特别限定。
206.作为抗体溶液的浓度的下限值,可例示出0.01mg/ml以上,作为其它方式,可例示出0.05mg/ml以上,此外,作为其它方式,可例示出0.1mg/ml以上,进而作为其它方式,可例示出0.5mg/ml以上,进而作为其它方式,可例示出1.0mg/ml以上,进而作为其它方式,可例示出5.0mg/ml以上。
207.作为抗体溶液的浓度的上限值,可例示出100mg/ml以下,作为其它方式,可例示出90mg/ml以下,此外,作为其它方式,可例示出80mg/ml以下,进而作为其它方式,可例示出70mg/ml以下,进而作为其它方式,可例示出60mg/ml以下,此外,作为其它方式,可例示出50mg/ml以下,进而作为其它方式,可例示出40mg/ml以下,进而作为其它方式,可例示出30mg/ml以下,进而作为其它方式,可例示出25mg/ml以下,进而作为其它方式,可例示出20mg/ml以下。
208.关于前述缓冲液的浓度,只要溶解有上述规定的溶解物,就没有特别限定。
209.作为缓冲液的浓度的下限值,根据缓冲液的种类,可例示出0mmol/l以上,作为其它方式,可例示出0.5mmol/l以上,此外,作为其它方式,可例示出1.0mmol/l以上,进而作为其它方式,可例示出5mmol/l以上,进而作为其它方式,可例示出10mmol/l以上,进而作为其它方式,可例示出15mmol/l以上,进而作为其它方式,可例示出25mmol/l以上。
210.前述缓冲液的ph没有特别限定,根据缓冲液的种类,作为ph的下限值,可例示出4.0以上,作为其它方式,可例示出4.5以上,此外,作为其它方式,可例示出5.0以上,进而作为其它方式,可例示出5.5以上,进而作为其它方式,可例示出6.0以上。作为ph的上限值,可例示出10.0以下,作为其它方式,可例示出9.0以下,此外,作为其它方式,可例示出8.0以下,进而作为其它方式,可例示出8.5以下,进而作为其它方式,可例示出8.0以下,进而作为其它方式,可例示出7.5以下,进而作为其它方式,可例示出7.0以下。
211.前述缓冲液的电导率没有特别限定,作为电导率的下限值,根据缓冲液的种类,可例示出0ms/cm以上,作为其它方式,可例示出1ms/cm以上,此外,作为其它方式,可例示出2ms/cm以上,进而作为其它方式,可例示出3ms/cm以上,进而作为其它方式,可例示出4ms/cm以上,进而作为其它方式,可例示出5ms/cm以上。
212.作为电导率的上限值,可例示出100ms/cm以下,作为其它方式,可例示出90ms/cm以下,此外,作为其它方式,可例示出80ms/cm以下,进而作为其它方式,可例示出70ms/cm以下,进而作为其它方式,可例示出60ms/cm以下,进而作为其它方式,可例示出50ms/cm以下,进而作为其它方式,可例示出40ms/cm以下。
213.本实施方式的含蛋白质的溶液的纯化方法中,应用抗体溶液作为该含蛋白质的溶液,从抗体溶液中去除抗体聚集体,回收提高了抗体单体的纯度的抗体溶液时,如上所述,使聚酰胺介质与包含抗体聚集体的抗体溶液接触。
214.关于聚酰胺介质与抗体溶液的接触方法,只要能够使抗体溶液与聚酰胺介质接触,就没有特别限定,如上所述,可列举出使抗体溶液通过聚酰胺介质的方法、将聚酰胺介质浸渍在抗体溶液中的方法等。此外,作为使含蛋白质的溶液通过聚酰胺介质的方法,可例示出利用聚酰胺介质来过滤含蛋白质的溶液的方法。
215.作为使抗体溶液通过聚酰胺介质的方法,可列举出利用注射器或泵等使抗体溶液通过聚酰胺介质的方法。作为使抗体溶液通过聚酰胺介质的方法,只要朝向聚酰胺介质的规定部分流通的抗体溶液能够通过聚酰胺介质,并从聚酰胺介质的其它部分回收抗体溶液即可。此外,在使抗体溶液通过聚酰胺介质的前后,可以使与抗体溶液不同的缓冲液通过聚酰胺介质。作为使含蛋白质的溶液通过聚酰胺介质的方法,可列举出利用聚酰胺介质来过滤含蛋白质的溶液的方法作为优选例。
216.回收抗体溶液时,可以将通过了聚酰胺介质的抗体溶液全部回收,也可以每隔一定体积获取级分。
217.通过将如上操作而进行了纯化的含有抗体的级分收集并汇总在一起,从而能够回收经纯化的抗体。
218.此外,作为使抗体溶液通过聚酰胺介质的流速,没有特别限定,根据抗体溶液的种类,作为下限值,可例示出相对于聚酰胺介质1ml为0.1ml/min以上,作为其它方式,可例示出0.5ml/min以上,此外,作为其它方式,可例示出1.0ml/min以上,进而作为其它方式,可例示出5ml/min以上。
219.〔用于纯化含蛋白质的溶液的聚酰胺介质、用于去除抗体聚集体的聚酰胺介质〕
220.本实施方式的用于纯化含蛋白质的溶液的聚酰胺介质和本实施方式的用于去除抗体聚集体的聚酰胺介质中,聚酰胺介质的表面的聚合物的氨基与羧基之和(总数)优选比聚酰胺介质的内部的聚合物的氨基与羧基之和(总数)多1.01倍以上。
221.由此,能够得到蛋白质聚集体、例如抗体聚集体的去除选择性高且强度特性也优异的聚酰胺介质。
222.上述那样的聚酰胺介质通过上述本实施方式的用于纯化含蛋白质的溶液的聚酰胺介质的制造方法和本实施方式的用于去除抗体聚集体的聚酰胺介质的制造方法而得到,但只要满足上述氨基与羧基之和的条件,就能够任意地选择聚酰胺的制造工序,不限定于上述本实施方式的制造方法。
223.需要说明的是,聚酰胺介质为多孔体时,表面还包括孔的表面。
224.此外,聚酰胺介质的表面的聚合物是指:适当根据所使用的酸性或碱性水溶液的种类、浓度、浸渍时间、抗体的种类、聚酰胺介质的种类、形态等,存在于自表面起10nm或5nm、3nm、2nm、1nm的介质中的聚合物。
225.聚酰胺介质内部的聚合物是指通过上述而定义的聚酰胺介质的表面之外的聚合物。
226.本实施方式的用于纯化含蛋白质的溶液的聚酰胺介质和用于去除抗体聚集体的聚酰胺介质为聚酰胺,因此,在聚合物末端具有氨基和羧基的官能团。
227.存在聚酰胺介质的表面的氨基与羧基的官能团之和不同于聚酰胺介质内部的官能团之和的倾向,从兼顾蛋白质聚集体、例如抗体聚集体的去除选择性和聚酰胺介质的强度的观点出发,表面的氨基与羧基之和优选为内部的氨基与羧基之和的1.01倍以上,更优选为1.02倍以上,进一步优选为1.03倍以上,更进一步优选为1.04倍以上、1.05倍以上、1.06倍以上、1.07倍以上、1.08倍以上、1.09倍以上、1.1倍以上、1.15倍以上、1.2倍以上、1.3倍以上、1.4倍以上、1.5倍以上、2.0倍以上、2.5倍以上、3.0倍以上、3.5倍以上、4.0倍以上、4.5倍以上、5.0倍以上、6.0倍以上、7.0倍以上、8.0倍以上、9.0倍以上、10.0倍以上、15倍以上、20倍以上、30倍以上、40倍以上、50倍以上、100倍以上。
228.氨基与羧基的官能团之和只要分别测定氨基和羧基,并算出其总数即可。此外,参照通过聚酰胺介质中的酰胺键的水解一比一地生成氨基和羧基的机理,可以通过测定氨基或羧基中任一者的量并将该量乘以2倍而算出和。
229.本实施方式的用于纯化含蛋白质的溶液的聚酰胺介质和抗体去除用的聚酰胺介质中,通过适当设定酸性或碱性水溶液的ph、调整在碱性水溶液中的浸渍时间、适当设定浸渍温度等,从而能够控制表面的氨基与羧基之和以上述所示的倍率多于内部的氨基与羧基之和。
230.聚酰胺介质的规定官能团的比例可通过单位质量的官能团密度来求出。
231.聚酰胺介质整体的官能团量可通过例如nmr等进行定量。
232.此外,聚酰胺介质的表面的官能团量可利用例如xps(x射线光电子能谱分析)那样的公知方法进行分析。
233.本实施方式的用于纯化含蛋白质的溶液的聚酰胺介质和用于去除抗体聚集体的聚酰胺介质中,聚酰胺介质的表面的聚合物的数均分子量与聚酰胺介质内部的聚合物的数
均分子量可以不同,优选内部的更大。
234.需要说明的是,聚酰胺介质为多孔状时,表面还包括孔的表面。
235.此外,聚酰胺介质的表面的聚合物是指:适当根据所使用的酸性或碱性水溶液的种类、浓度、浸渍时间、抗体的种类、聚酰胺介质的种类、形态等,存在于自表面起10nm或5nm、3nm、2nm、1nm的介质中的聚合物。
236.聚酰胺介质内部的聚合物是指聚酰胺介质的除表面之外的聚合物。
237.将聚酰胺介质的表面的聚合物的数均分子量记作mn(s),并将内部的聚合物的数均分子量记作mn(i)时,此时的数均分子量的比率可以用mn(s)/mn(i)来表示,从兼顾蛋白质聚集体、例如抗体聚集体的选择性和强度的观点出发,mn(s)/mn(i)的值优选为0.99以下。即,优选为mn(s)/mn(i)≤0.99。
238.更优选为0.98以下,进一步优选为0.97以下,更进一步优选为0.96以下,再进一步优选为0.95以下、0.94以下、0.93以下、0.92以下、0.91以下、0.90以下、0.88以下、0.86以下、0.84以下、0.82以下、0.80以下、0.75以下、0.70以下、0.60以下、0.50以下。
239.聚酰胺介质的数均分子量可通过公知方法的凝胶渗透色谱等来求出,此时成为标准物质的换算分子量。
240.上述那样的表面的聚合物与内部的聚合物的数均分子量之比(mn(s)/mn(i))为0.99以下的本实施方式的聚酰胺介质是通过上述的本实施方式的用于纯化含蛋白质的溶液的聚酰胺介质的制造方法和本实施方式的用于去除抗体聚集体的聚酰胺介质的制造方法而得到的。具体而言,通过利用酸性或碱性水溶液对聚酰胺介质进行处理,从而使表面聚合物的一部分键合链发生断裂,由此存在内部的数均分子量变大的倾向。
241.需要说明的是,只要满足上述数均分子量之比的条件,聚酰胺的制造工序就可以任意选择,不限定于上述本实施方式的制造方法。具体而言,本实施方式的用于纯化含蛋白质的溶液的聚酰胺介质和用于去除抗体聚集体的聚酰胺介质通过调整酸性或碱性水溶液的ph、在碱性水溶液中的浸渍时间、适当设定浸渍温度等,从而能够将表面的聚合物的数均分子量与内部的聚合物的数均分子量之比控制至上述所示的数值。
242.实施例
243.以下,使用具体的实施例和比较例,针对本实施方式进行更详细的说明,本实施方式完全不限定于以下的实施例和比较例。
244.〔实施例1〕
245.(1)作为聚酰胺介质的聚酰胺膜的碱性水溶液浸渍
246.将直径2.5cm的圆形且膜厚160μm、平均孔径0.2μm的作为多孔聚酰胺介质的聚酰胺膜(whatman(注册商标):7402
‑
002、ge healthcare公司制、材质:聚酰胺66)在1.0mol/l的氢氧化钠溶液(ph14)中以室温浸渍24小时。
247.接着,用纯水清洗5次,完全去除氢氧化钠。
248.将两片所得聚酰胺膜安装于不锈钢支架ks
‑
25(advantech公司制、有效膜面积为3.8cm2),作为聚酰胺膜1。
249.需要说明的是,聚酰胺膜的膜厚利用数显指示器id
‑
c112xbs(mitutoyo公司制)进行测定。
250.(2)作为含蛋白质的溶液的含抗体的溶液的制备
251.准备包含由cho细胞crl12445表达的单克隆抗体(以下有时简写为crl12445抗体)0.74g/l的培养液上清。
252.将包含由crl12445表达的单克隆抗体生产细胞的培养液用过滤膜(旭化成医疗公司制、商品名biooptimal(注册商标)mf
‑
sl)进行过滤,获得包含杂质和抗体的含抗体的溶液(培养上清)。
253.(3)基于亲和柱的含抗体的溶液的纯化
254.向利用磷酸缓冲液(20mmol/l磷酸钠+150mmol/l nacl(ph8.0))进行了平衡化的蛋白质a柱(gehealthcare bio
‑
science公司制、填充有mabselect sure的柱)中添加通过前述(2)而获取的含抗体的溶液(培养上清),使抗体吸附于蛋白质a。
255.接着,向柱中通入磷酸缓冲液(20mmol/l的磷酸钠+150mmol/l nacl(ph8.0))进行清洗后,向柱中通入洗脱缓冲液(100mmol/l柠檬酸钠(ph3.6)),使抗体从蛋白质a柱中洗脱,回收一定程度上降低了杂质的含抗体的溶液。
256.需要说明的是,通过下述(8)中记载的方法对该抗体蛋白质进行测定时,仅确认到作为单体的抗体蛋白质的峰(下述(8)中记载的、图2中的(3)的峰),确认不到图2中示出的、三聚体以上的聚集体(1)、作为二聚体的聚集体(2)的峰。
257.此外,缓冲液的ph测定中使用ph计hm
‑
30r(东亚dkk公司制)。下述缓冲液的ph也同样进行测定。
258.(4)包含大量抗体聚集体的含抗体的溶液的制备
259.向通过前述((3)基于亲和柱的抗体的纯化)得到的一定程度上降低了杂质的含抗体的溶液的一部分中添加盐酸,调整至ph2.5,维持一小时。
260.其后,使用氢氧化钠水溶液进行中和,制备包含大量抗体聚集体的含抗体的溶液。
261.(5)包含抗体聚集体的含抗体的溶液的制备
262.以任意的比例混合将通过前述((3)基于亲和柱的抗体的纯化)而得到的一定程度上降低了杂质的含抗体的溶液用任意量的包含氯化钠的15mmol/l tris
‑
hcl缓冲液(ph7.0、5ms/cm)进行缓冲交换而得到的溶液和将通过前述((4)包含大量抗体聚集体的含抗体的溶液的制备)中得到的包含大量聚集体的含抗体的溶液用任意量的包含氯化钠的15mmol/l tris
‑
hcl缓冲液(ph7.0、5ms/cm)进行缓冲交换而得到的溶液,制备包含抗体聚集体和抗体单体的含抗体的溶液(以下有时简写为“sm”)。
263.前述缓冲液的电导率使用电导率计cm
‑
40s(东亚dkk公司制)进行测定。
264.(6)对聚酰胺膜通液含抗体的溶液
265.使通过前述((5)包含聚集体的含抗体的溶液的制备)而制作的包含抗体聚集体和抗体单体的含抗体的溶液(sm)通过前述((1)聚酰胺膜的碱性水溶液浸渍)中得到的聚酰胺膜1。
266.含抗体的溶液的通过中,使用分离/纯化装置akta purifier(ge healthcare公司制),使含抗体的溶液通过,并回收含抗体的溶液。
267.添加量为13ml(浓度为4.8mg/ml、抗体的总量为62.7mg)、流速为3.9ml/分钟。
268.(7)聚集体去除性能的评价
269.聚集体去除性能通过抗体聚集体去除量和抗体单体的回收量来评价。
270.(8)聚集体去除性能的具体评价方法
271.通过下述条件,使用尺寸排阻色谱(sec:size exclusion chromatography)装置,对前述((6)对聚酰胺膜通液含抗体的溶液)中回收的含抗体的溶液和前述((5)包含聚集体的含抗体的溶液的制备)中制作的包含抗体聚集体和抗体单体的含抗体的溶液(sm)进行测定。
272.将测定结果示于下述〔表1〕,图1中示出包含抗体聚集体和抗体单体的含抗体的溶液的色谱图。图2是图1的色谱图的放大图。
273.柱:acquity uplc beh200 sec1.7μm(waters公司制)
274.柱温度:30℃系统:acquity uplc h class(waters公司制)
275.流动相:0.1mol/l磷酸氢二钠+0.2mol/l l(+)
‑
精氨酸水溶液(用盐酸调整至ph6.7)
276.如图1和图2所示那样,被分成抗体单体(峰(3))、二聚体(峰(2))、三聚体以上(峰(1))的聚集体。
277.(9)抗体单体回收率的计算
278.抗体单体的回收率根据使用分光光度计;spectramax plus384(molecular devices公司制)得到的抗体浓度和尺寸排阻色谱的结果来计算。
279.具体而言,将通过聚酰胺膜1前的含抗体的溶液浓度记作c0,将含抗体的溶液量记作v0,将由尺寸排阻色谱求出的抗体单体比率记作r0,同样地,将通过聚酰胺膜1后的含抗体的溶液的浓度记作c1,将含抗体的溶液量记作v1,将抗体单体比率记作r1,通过下式(1)来求出。
280.将计算结果示于下述〔表1〕。
281.抗体单体回收率(%)=c1v1r1/c0v0r0
···
(式(1))
282.〔比较例1〕
283.除了未将聚酰胺膜浸渍于氢氧化钠水溶液之外,使用在与前述聚酰胺膜1相同的条件下制作的聚酰胺膜2。
284.需要说明的是,比较例1中,浸渍于水中。
285.关于其它条件,与实施例1相同地进行操作。
286.将通过聚酰胺膜2后的基于尺寸排阻色谱的分析结果和抗体单体回收率示于下述〔表1〕。
287.[表1]
[0288][0289]
将实施例1与比较例1的结果进行对比时可知:通过进行将聚酰胺膜浸渍于氢氧化钠水溶液的处理,从而在维持抗体聚集体去除量的同时,抗体单体回收率提高。
[0290]
〔实施例2〕
[0291]
(1)作为聚酰胺介质的聚酰胺膜的碱性水溶液处理
[0292]
通过变更在氢氧化钠溶液中的浸渍溶液和浸渍时间,且其它条件与前述〔实施例1〕中的“(1)作为聚酰胺介质的聚酰胺膜的碱性水溶液浸渍)”相同的方法,制作聚酰胺膜3~6和聚酰胺膜8。
[0293]
关于聚酰胺膜7,将两片与前述〔实施例1〕相同的聚酰胺膜(whatman(注册商标):7402
‑
002、ge healthcare公司制、材质:聚酰胺66)与前述〔实施例1〕同样地设置于不锈钢支架ks
‑
25(advantech公司制、有效膜面积为3.8cm2),接着,使用分离/纯化装置akta purifier(ge healthcare公司制),将0.5mol/l的氢氧化钠溶液以1.1ml/min的流速在室温下通液1小时后,通入纯水,完全去除氢氧化钠来制作。
[0294]
将制作的聚酰胺膜示于下述〔表2〕。
[0295]
[表2]
[0296][0297]
(2)对聚酰胺膜通液含抗体的溶液
[0298]
将前述〔实施例1〕的((2)含抗体的溶液的制备)和((3)基于亲和柱的含抗体的溶液的纯化)中得到的溶液用15mmol/l tris
‑
hcl缓冲液(ph7.0、5ms/cm)进行缓冲交换,得到
含抗体的溶液。
[0299]
对于前述〔实施例2〕的通过((1)作为聚酰胺介质的聚酰胺膜的碱性水溶液处理)而得到的聚酰胺膜3~7,使用akta purifier,使前述含抗体的溶液以0.6ml/min的流速通过,回收含抗体的溶液。
[0300]
需要说明的是,使含抗体的溶液通过前述中得到的聚酰胺膜3~7之前,使15mmol/l tris
‑
hcl缓冲液(ph7.0、5ms/cm)通液,针对所回收的液体,利用分光光度计;nanodrop one(thermo fisher scientific公司制)进行分析时,未确认到通常的蛋白质等具有苯环的化合物发生吸收的波长280nm的光吸收。
[0301]
因此可确定:未从使含抗体的溶液通过之前的聚酰胺膜中洗脱会吸收波长280nm的光那样的化合物,使含抗体的溶液通过聚酰胺膜并回收得到的溶液的光吸收源自抗体。
[0302]
(3)抗体单体回收率的评价
[0303]
测定在前述〔实施例2〕的(2)中制备的含抗体的溶液和在〔实施例2〕的(2)中通过聚酰胺膜并回收得到的含抗体的溶液的聚集体比例和抗体浓度。
[0304]
由所得测定值计算所制备的含抗体的溶液和吸附于各聚酰胺膜的抗体单体质量、抗体单体的回收率。
[0305]
具体而言,所制备的含抗体的溶液和吸附于各聚酰胺膜的抗体单体质量通过下式(2)、(3)来求出。
[0306]
下述(2)、(3)中,将通过聚酰胺膜3~8前的含抗体的溶液浓度记作c2,将含抗体的溶液量记作v2,将由尺寸排阻色谱求出的抗体单体比率记作r2,同样地,将通过聚酰胺膜3~8后的含抗体的溶液的浓度记作c3,将含抗体的溶液量记作v3,将抗体单体比率记作r3。
[0307]
抗体单体的回收率通过与前述〔实施例1〕的((9)抗体单体回收率的计算)相同的方法来计算。
[0308]
将计算结果示于下述〔表3〕。
[0309]
制备含抗体的溶液中的抗体单体的质量(mg)=c2v2r2
···
(式(2))
[0310]
吸附于聚酰胺膜的抗体单体质量(mg)=c2v2r2
‑
c3v3r3
···
(式(3))
[0311]
作为含抗体的溶液中的聚集体比例和抗体浓度的测定方法,前者利用与前述〔实施例1〕的((8)聚集体去除性能的具体评价)相同的方法进行测定,后者使用分光光度计;nanodrop one(thermo fisher scientific公司制)进行测定。
[0312]
〔比较例2〕
[0313]
除了未将聚酰胺膜浸渍于氢氧化钠水溶液之外,利用与前述聚酰胺膜3相同的方法,制作聚酰胺膜α。
[0314]
需要说明的是,比较例2中,浸渍于水中。
[0315]
将聚酰胺膜α的制作条件示于前述〔表2〕。
[0316]
对于聚酰胺膜α,进行与前述〔实施例2〕相同的操作。
[0317]
将抗体单体回收率示于下述〔表3〕。
[0318]
[表3]
[0319][0320]
将实施例2与比较例2的结果进行对比时可知:通过将聚酰胺膜浸渍于氢氧化钠水溶液,从而抗体单体回收率提高。
[0321]
聚酰胺膜3~6、聚酰胺膜8与聚酰胺膜α相比,抗体单体回收率均高,因此可明确:本发明的聚酰胺介质的提高抗体单体回收率的效果与碱溶液的ph、浸渍时间无关。
[0322]
此外,聚酰胺膜7中也获得相同的效果,因此示出:本发明的聚酰胺介质的提高抗体单体回收率的效果与碱溶液的处理方法无关。
[0323]
〔实施例3〕
[0324]
对于聚酰胺膜3~5、聚酰胺膜8,进行变更含抗体的溶液的ph、电导率和缓冲液,且其它条件与前述〔实施例2〕相同的实验。
[0325]
针对含抗体的溶液,将前述〔实施例1〕的((2)含抗体的溶液的制备)、((3)基于亲和柱的含抗体的溶液的纯化)中得到的含抗体的溶液用15mmol/l乙酸缓冲液(ph5.5、15ms/cm)进行缓冲交换,得到含抗体的溶液。
[0326]
将抗体单体回收率的计算结果示于下述〔表4〕。
[0327]
〔比较例3〕
[0328]
对于前述〔比较例2〕中制作的聚酰胺膜α,进行与前述〔实施例3〕相同的操作。
[0329]
将抗体单体回收率的计算结果示于下述〔表4〕。
[0330]
[表4]
[0331][0332]
将实施例3与比较例3的结果进行对比时可知:通过将聚酰胺膜浸渍于氢氧化钠水溶液,从而抗体单体回收率提高。
[0333]
通过将实施例2、3与比较例2、3的结果进行对比而可知:无论含抗体的溶液的液性如何,均能够获得通过将聚酰胺膜浸渍于氢氧化钠水溶液而使抗体单体回收量增加的效果。
[0334]
〔实施例4〕
[0335]
进行变更含抗体的溶液的抗体种类且其它与前述〔实施例3〕相同的实验。
[0336]
将evolocumab(astellas pharma公司制)用15mmol/l乙酸缓冲液(ph5.5、15ms/cm)进行缓冲交换,得到含抗体的溶液。
[0337]
将抗体单体回收率的计算结果示于下述〔表5〕。
[0338]
〔比较例4〕
[0339]
对于前述〔比较例2〕中制作的聚酰胺膜α,进行与前述〔实施例4〕相同的操作。
[0340]
将抗体单体回收率的计算结果示于下述〔表5〕。
[0341]
[表5]
[0342][0343]
将实施例4与比较例4的结果进行对比时可知:通过将聚酰胺膜浸渍于氢氧化钠水溶液,从而抗体单体回收率提高。
[0344]
通过实施例3、4与比较例3、4的结果对比可知:无论抗体种类如何,均能够获得通过将聚酰胺膜浸渍于氢氧化钠水溶液来提高抗体单体回收量的效果。
[0345]
〔实施例5〕
[0346]
进行变更聚酰胺膜的制作方法且其它与前述〔实施例4〕相同的实验。
[0347]
具体而言,通过变更浸渍溶液和浸渍时间且其它与前述(〔实施例1〕作为聚酰胺介质的聚酰胺膜的碱性水溶液处理)相同的方法,制作聚酰胺膜9~11。
[0348]
将聚酰胺膜的制作条件示于下述〔表6〕。
[0349]
此外,将抗体单体回收率的计算结果示于下述〔表7〕。
[0350]
[表6]
[0351] 聚酰胺膜9聚酰胺膜10聚酰胺膜11聚酰胺膜α浸渍溶液0.01m naoh0.5m naoh1m hcl水浸渍时间16h0.5h16h16h温度20℃20℃20℃20℃
[0352]
〔比较例5〕
[0353]
使用除了未将聚酰胺膜浸渍于氢氧化钠水溶液之外,利用与前述〔实施例5〕中的聚酰胺膜9~11相同的条件制作的聚酰胺膜α。
[0354]
需要说明的是,比较例5中,浸渍于水中。
[0355]
对于聚酰胺膜α,进行与前述〔实施例5〕相同的操作。将聚酰胺膜的制作条件示于前述〔表6〕。
[0356]
此外,将抗体单体回收率示于下述〔表7〕。
[0357]
[表7]
[0358][0359]
将实施例5与比较例5的结果进行对比时可知:通过将聚酰胺膜浸渍于氢氧化钠水溶液,从而抗体单体回收率提高。
[0360]
由此可知:本发明中,无论聚酰胺介质的处理中使用的溶液为酸性水溶液、碱性水溶液中的哪一者,均能够得到提高抗体单体回收率的效果,浸渍的溶液浓度、浸渍时间也没有限定。
[0361]
〔实施例6〕
[0362]
进行仅变更聚酰胺膜的制作方法且其它条件与前述〔实施例4〕相同的实验。
[0363]
仅变更浸渍温度,通过与前述〔实施例1〕的((1)作为聚酰胺介质的聚酰胺膜的碱性水溶液浸渍)相同的方法,制作聚酰胺膜12。
[0364]
将聚酰胺膜的制作条件示于下述〔表8〕。
[0365]
此外,将抗体单体回收率的计算结果示于下述〔表9〕。
[0366]
[表8]
[0367] 聚酰胺膜12聚酰胺膜β浸渍溶液1m naoh水浸渍时间16h16h温度4℃4℃
[0368]
〔比较例6〕
[0369]
使用除了未将聚酰胺膜浸渍于氢氧化钠水溶液之外,利用与前述聚酰胺膜12相同的条件制作的聚酰胺膜β。
[0370]
需要说明的是,比较例6中,浸渍于水中。
[0371]
对于聚酰胺膜β,进行与前述〔实施例6〕相同的操作。
[0372]
将聚酰胺膜的制作条件示于前述〔表8〕。
[0373]
此外,将抗体单体回收率示于下述〔表9〕。
[0374]
[表9]
[0375][0376]
将实施例6与比较例6的结果进行对比时可知:通过将聚酰胺膜浸渍于氢氧化钠水溶液,从而抗体单体回收率提高。
[0377]
由此可知:本发明中,基于氢氧化钠水溶液的处理温度没有限定,能够获得期望的效果。
[0378]
〔实施例7〕
[0379]
(1)聚酰胺膜的碱性水溶液浸渍
[0380]
将直径9.0cm的圆形且膜厚170μm、平均孔径0.2μm的作为多孔聚酰胺介质的聚酰胺膜(whatman(注册商标):7402
‑
009、ge healthcare公司制、材质:聚酰胺66)在1.0mol/l的氢氧化钠溶液(ph14)中以室温浸渍1小时。
[0381]
接着,用纯水清洗5次,完全去除氢氧化钠。
[0382]
将所得聚酰胺膜用甲醇进行置换,并通过真空干燥来完全去除溶剂,将由此得到的膜作为聚酰胺膜13。
[0383]
此外,变更浸渍时间,利用与上述相同的条件,制作聚酰胺膜14、15。
[0384]
将聚酰胺膜的制作条件示于下述〔表10〕。
[0385]
(2)聚酰胺膜的拉伸强度评价
[0386]
将前述得到的聚酰胺膜以形成2.0cm
×
7.0cm的长方形的方式制作切片。
[0387]
使用拉伸压缩试验机;tg
‑
1kn(minebea公司制),对所制作的切片的拉伸强度进行评价。
[0388]
在该评价中,关于测定房间的环境,温度为22.5℃、湿度为35~40%,关于测定条件,拉伸速度为10mm/min、初始长度为6.0cm。
[0389]
将测定结果示于下述〔表11〕。需要说明的是,各参数的数值表示进行6次试验后的平均值和标准误差。
[0390]
杨氏模量表示采用施加于试样的应力和应变的描点时的弹性区域中的斜率,最大应力表示从试验开始起至试样发生断裂为止的期间内施加于试样的应力的最大值。
[0391]
[表10]
[0392] 聚酰胺膜13聚酰胺膜14聚酰胺膜15聚酰胺膜γ浸渍溶液1m naoh1m naoh1m naoh水浸渍时间1h16h40h16h温度20℃20℃20℃20℃
[0393]
〔比较例7〕
[0394]
使用除了未将聚酰胺膜浸渍于氢氧化钠水溶液之外,利用与前述聚酰胺膜13相同的条件制作的聚酰胺膜γ。
[0395]
需要说明的是,比较例7中,浸渍于水中。
[0396]
关于其它的条件,与前述〔实施例7〕同样地进行操作。
[0397]
将聚酰胺膜γ的制作条件示于前述〔表10〕。
[0398]
将测定结果示于下述〔表11〕。
[0399]
[表11]
[0400][0401]
将实施例7与比较例7的结果进行对比时可知:无论是否在氢氧化钠水溶液中浸渍,聚酰胺膜的杨氏模量和最大应力均不变。
[0402]
即可知:根据本发明,能够维持在实用上充分的机械强度。
[0403]
在抗体药品等蛋白质制剂的制造工序中,尤其在病毒去除过滤器及其预过滤器中,作为性质,要求即便对膜施加压力也不易变形,且即便对膜施加高压力也不易破损。从该观点出发可知:即便在碱性水溶液中浸渍,杨氏模量、最大应力也均不变,作为蛋白质纯化过滤器能够维持膜强度,在实用上是优选的。
[0404]
〔实施例8〕
[0405]
(1)聚酰胺膜的碱性水溶液浸渍
[0406]
将直径2.5cm的圆形且膜厚160μm、平均孔径0.2μm的作为多孔聚酰胺介质的聚酰胺膜(whatman(注册商标):7402
‑
002、ge healthcare公司制)在1.0mol/l的氢氧化钠溶液(ph14)中以室温浸渍1小时。
[0407]
接着,用纯水清洗5次,完全去除氢氧化钠。
[0408]
将所得聚酰胺膜用甲醇进行置换,并通过真空干燥来完全去除溶剂,得到聚酰胺膜16。将聚酰胺膜的制作条件示于下述〔表12〕。
[0409]
[表12]
[0410] 聚酰胺膜16聚酰胺膜δ浸渍溶液1m naoh水浸渍时间1h1h温度20℃20℃
[0411]
(2)聚酰胺膜的重均分子量和数均分子量的测定
[0412]
将前述(1)中得到的聚酰胺膜作为试样,使用凝胶渗透色谱(gpc:gel permeation chromatography)来测定其分子量。
[0413]
采集聚酰胺膜约5mg,向其中添加5ml三氟乙酸钠(hfip)5mmol/l后,静置一晚。
[0414]
确认前述试样完全溶解后,使用0.45μm(聚四氟乙烯、ptfe)的过滤器进行过滤,将由此得到的物质作为测定用试样。
[0415]
将测定结果记载于下述〔表13〕。(mw:重均分子量、mn:数均分子量)。
[0416]
<测定条件>
[0417]
测定装置:hlc
‑
8320gpc(东曹公司制)
[0418]
柱:tskgel gmh
hr
‑
h(s)
×
3根(4.6mmi.d.
×
15cm)
[0419]
柱温度:40℃
[0420]
洗脱液:三氟乙酸钠5mmol/l
[0421]
校正曲线:聚甲基丙烯酸甲酯(polymethyl methacrylate)(12点)
[0422]
〔比较例8〕
[0423]
使用除了未将聚酰胺膜浸渍于氢氧化钠水溶液之外,利用与前述聚酰胺膜16相同的条件制作的聚酰胺膜δ。
[0424]
需要说明的是,比较例8中,浸渍于水中。
[0425]
关于其它条件,与前述〔实施例8〕同样地进行操作。
[0426]
将聚酰胺膜的制作条件示于前述〔表12〕。
[0427]
将测定结果示于下述〔表13〕。
[0428]
[表13]
[0429][0430]
将实施例8与比较例8的结果进行对比时可知:即便将聚酰胺膜浸渍于氢氧化钠水溶液,也不会对重均分子量和数均分子量造成影响。这意味着:基于碱浸渍的水解未进行至聚酰胺膜的内部。并且,由实施例1~6、比较例1~6的结果示出:抗体对聚酰胺膜的吸附行为因是否利用碱性水溶液进行处理而发生变化,因此,聚酰胺膜的表面性质发生了变化。
[0431]
因而,由实施例1~6、实施例8和比较例1~6、比较例8的结果可知:基于碱性水溶液的处理会使聚酰胺膜的表面性质发生变化,但不会对内部性质造成影响。
[0432]
〔实施例9〕
[0433]
(1)聚酰胺膜的碱性水溶液浸渍
[0434]
除了将氢氧化钠水溶液的浸渍时间设为40小时之外,利用与前述〔实施例8〕的((1)聚酰胺膜的碱性水溶液浸渍)相同的方法,制作聚酰胺膜17。
[0435]
将聚酰胺膜17的制作条件示于下述〔表14〕。
[0436]
[表14]
[0437] 聚酰胺膜17聚酰胺膜ε浸渍溶液1m naoh水浸渍时间40h40h温度20℃20℃
[0438]
(2)聚酰胺膜的xps测定
[0439]
从通过前述(1)得到的聚酰胺膜中切出约2mm见方的小片,在0.5
×
10
‑4mol/dm3的rb2co3水溶液60ml中浸渍2小时。
[0440]
转移至1.5ml样品管(有脱脂棉的垫底),以10000rpm进行10分钟的离心分离,实施xps测定。将测定结果示于下述〔表15〕。
[0441]
使用设备:phi5000versa probe ii(ulvac
‑
phi公司制)
[0442]
激发源:mono.alkα20kv
×
5ma 100w
[0443]
分析尺寸:100μm
×
1.4mm(读取数据时,使100μmφ的mono.alkα以1.4mm的幅度进行振动)
[0444]
光电子取出角:45
°
[0445]
读取区域:rb 3d
[0446]
通能(pass energy):93.9ev
[0447]
〔比较例9〕
[0448]
使用除了未将聚酰胺膜浸渍于氢氧化钠水溶液之外,利用与前述聚酰胺膜17相同的条件制作的聚酰胺膜ε。
[0449]
需要说明的是,比较例9中,浸渍于水中。
[0450]
关于其它条件,与前述〔实施例9〕同样地进行操作。
[0451]
将聚酰胺膜ε的制作条件示于前述〔表14〕。
[0452]
将测定结果示于下述〔表15〕。
[0453]
[表15]
[0454][0455]
将实施例9与比较例9的结果进行对比时可知:通过用碱性水溶液对聚酰胺膜进行处理,从而聚酰胺膜的表面的铷浓度增加。由此可知:通过用碱性水溶液对聚酰胺膜进行处理,从而表面的羧基量增加。即可知:通过用碱性水溶液进行处理,从而聚酰胺膜的表面发生亲水化,有助于目标蛋白质的回收量增加。
[0456]
〔实施例10〕
[0457]
(1)聚酰胺片的碱性水溶液浸渍
[0458]
将66尼龙片(型号:107
‑
14301、厚度:0.3mm、kokugo公司制)在1.0mol/l的氢氧化钠水溶液(ph14)中以室温浸渍13天。
[0459]
接着,用纯水清洗5次,完全去除氢氧化钠。
[0460]
使所得片在0.001mol/l的盐酸溶液中浸渍1小时后,用蒸馏水进行清洗,使其风干,得到聚酰胺片(1)。
[0461]
将聚酰胺片(1)的制作条件示于下述〔表16〕。
[0462]
[表16]
[0463] 聚酰胺片(1)聚酰胺片(2)浸渍溶液1m naoh水浸渍时间13天13天温度20℃20℃
[0464]
(2)聚酰胺片的ft
‑
ir测定
[0465]
将前述(1)中得到的聚酰胺片(1)作为测定用试样,利用下述条件对该试样进行傅立叶变换红外光谱法(ft
‑
ir)测定。
[0466]
将测定结果示于图3。
[0467]
<测定条件>
[0468]
测定装置:alpha(bruker公司)
[0469]
测定方法:atr法(晶体:ge)
[0470]
分辨率:4cm
‑1[0471]
累积次数:16scans
[0472]
〔比较例10〕
[0473]
除了未将聚酰胺片浸渍于氢氧化钠水溶液之外,利用与前述〔实施例10〕的聚酰胺片(1)相同的条件,制作聚酰胺片(2),作为测定用试样来使用。
[0474]
需要说明的是,比较例10中,浸渍于水中。
[0475]
关于其它条件,与前述〔实施例10〕同样地进行操作。
[0476]
将聚酰胺片(2)的制作条件示于前述〔表16〕。
[0477]
将测定结果示于图3。
[0478]
图3中,“氢氧化钠”表示利用氢氧化钠水溶液进行了浸渍处理的聚酰胺片(1)的测定结果,图3中,“水”表示未利用氢氧化钠水溶液进行浸渍处理,而是利用水进行了浸渍处理的聚酰胺片(2)的测定结果。
[0479]
将实施例10与比较例10的结果进行对比时可知:通过用碱性水溶液对聚酰胺片进行处理,从而1639cm
‑1、1544cm
‑1的峰强度减少。由此可知:通过聚酰胺片的碱性水溶液处理,表面的酰胺键减少。
[0480]
将实施例8、比较例8的结果合并时可知:通过利用碱性水溶液进行处理,从而在聚酰胺片的表面发生了水解。
[0481]
本技术基于2019年4月8日向日本特许厅申请的日本专利申请(日本特愿2019
‑
073514)、2019年11月6日向日本特许厅申请的日本专利申请(日本特愿2019
‑
201725),并将其内容作为参考而援引至此。
[0482]
产业上的可利用性
[0483]
本发明的用于纯化含蛋白质的溶液的聚酰胺介质的制造方法在使抗体聚集体的去除选择性提高的含抗体的溶液的制造技术领域中具有产业上的可利用性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1