通过使用捕获前的絮凝改善免疫球蛋白的亲和色谱的制作方法
通过使用捕获前的絮凝改善免疫球蛋白的亲和色谱
发明领域
1.本发明涉及用于防止来自细胞培养物衍生的成分在抗体的亲和色谱过程中沉淀的方法,该方法使用在亲和捕获色谱之前的絮凝和过滤步骤以及在捕获步骤之后的进一步精制步骤以纯化抗体来进行。
2.发明背景
3.选择用于纯化重组dna技术产生的多肽的高效且经济的下游工序是开发预期用于治疗用途的每种新生物药物的关键步骤。近来,由于单克隆抗体(mab)在医疗应用中具有极高的治疗剂量,因此对单克隆抗体(mab)的大规模纯化方法的需求随着改进的细胞培养方法的应用得到进一步加强,所述改进的细胞培养方法导致更高的细胞密度、更高的表达率和由此更高的滴度,例如大于10g/l的目标重组抗体。产品和污染物在培养液中的浓度不断增加对捕获色谱、在其之前的样品澄清步骤以及随后的精制色谱提出了更高的要求。整个下游工艺必须:(i)管理增加的产品量,(ii)有效去除增加的工艺相关和产品相关的杂质,使其低于规定的可接受标准,(iii)维持经济产量,以及(iv)确保足够的mab质量。通常,下游工艺占治疗性抗体的总制造成本的主要部分。
4.通常,粗流分中的mab与杂质相关,例如宿主细胞蛋白(hcp)、宿主细胞dna(hcdna)、内毒素、胰岛素、病毒、聚集物、其他不期望的产物变体和来自加工材料的各种浸出液。这些杂质的存在是患者的潜在健康风险,因此使其从终产品中消失是监管机构的要求。仅容许极低的残留量。
5.纯化细胞培养物衍生的多肽的典型方法遵循捕获
‑
中间
‑
精制色谱的顺序,并伴随着在下游工序不同位置的过滤、浓缩或透析步骤。近年来,平台方法已在mab纯化领域成功建立。由于mab是一类定义明确的糖蛋白,具有共同的物理化学特性,因此使用通用平台方法是合理的(kelly b 2009)。这种具有或多或少的产品特异性调整的通用方法可以应用于许多mab,特别是对于相同类别或亚类的那些免疫球蛋白,例如igg1或igg2。
6.mab纯化中最常用的捕获步骤之一为使用蛋白质a的亲和色谱。这种捕获为带有fc的分子提供了卓越的选择性,从而在单一步骤中去除了99.5%以上的污染物。但是,除它的优点之外,还应该提到两个缺点。一个缺点在于不期望的蛋白质a或蛋白质a片段的浸出,它们已知是有毒性的(gagnon p 1996)。另一个缺点在于这种类型的树脂成本高,特别是在工业规模上纯化足够量治疗性抗体时所必需。蛋白质a树脂比离子交换树脂贵约30倍。据计算,对于10m3细胞培养物的下游处理,蛋白质a亲和色谱的成本约为400万
‑
500万美元(farid ss 2009)。
7.在许多情况下,捕获步骤使用粗的输入(上样)材料进行,这会导致亲和柱树脂的污染(杂质蓄积)。在没有适当的再生步骤存在时,这会妨碍捕获树脂的成功再利用。粗培养液中的污染物,如脂质、氧化剂、宿主细胞蛋白(hcp)、宿主细胞dna(hcdna)、聚集物或颗粒、金属离子和其他物质会促进树脂结垢,并在低ph洗脱期间产生沉淀和混浊(shukla aa 2005)。除了对结合部分的直接影响外,基质也可被不可逆地污染。结果是增加了反压力并降低每次运行的容量和流速。这个问题不限于蛋白质a树脂:色谱树脂在其使用寿命内的结
垢是商业生物制品分离的普遍重大问题。用于疏水相互作用色谱和混合模式色谱的疏水配体在用作细胞培养衍生的免疫球蛋白的捕获步骤时,特别容易从培养液中捕获亲脂性污染物。尽管对运行后的清洗步骤存在复杂的方案,但捕获柱的寿命是有限的并且取决于循环次数、运行和清洗的操作条件以及样品的组成和纯度。
8.为了澄清和预清洗严重污染的培养液,已采用机械分离步骤去除大部分细胞碎片和聚集物。离心和过滤处理是在将样品加载到捕获树脂之前进行的最常见的预处理步骤。对于大体积,通过使用细胞分离器进行连续离心,然后使用深层过滤器和/或微孔过滤器进行过滤步骤。然后将所得培养液称作“澄清的细胞培养物上清液”(liu hf 2010)。尽管将收获的培养液直接加载到蛋白质a树脂上是一种常见方法的选择(fahrner rl 2001),但其他平台技术利用了各种澄清步骤,即离心、深层过滤和/或微孔过滤(liu hf 2010、wo9522389、wo2001150110)以保护捕获柱。这减少了固体和颗粒对树脂的污染,并改善了捕获洗脱液中抗体的纯度。除了离心/过滤步骤外,以流穿(flow
‑
through)模式进行的捕获前的色谱已成功证明可用于免疫球蛋白的大规模纯化(wo2015135884)。已经发现,通过在捕获色谱上游加入额外的阴离子交换色谱步骤,可以显著降低纯化过程的总费用。捕获前的阴离子交换流穿色谱步骤减少了成本密集型捕获色谱材料暴露于杂质的负担。
9.在用蛋白质a色谱通过酸性ph洗脱mab期间,混浊的洗脱池和高的柱反压力是常见的。研究将这种现象与由蛋白质自缔合导致的液
‑
液相分离联系起来。多种因素,包括ph、温度、离子强度和蛋白质浓度都会影响这种效果。在蛋白质a洗脱过程中谨慎选择工艺参数,包括温度、流速、缓冲液和盐,可以降低浊度和柱反压力(luo h 2017)。已经采取了类似的策略来避免聚集和颗粒形成的问题,这些问题体现在蛋白质a洗脱池中的浊度(shukla aa 2005)。建议将稳定物质(如盐、尿素和氨基酸)添加到洗脱缓冲液中,降低温度,调整洗涤和洗脱缓冲液的ph值,或对细胞培养收获物进行预处理以去除某些可能在低ph下沉淀的杂质。预处理方法包括阴离子交换色谱、过滤和污染物的酸沉淀(shukla aa2005)。
10.絮凝是一种在化学和食品工业以及废水处理中广泛实施的方法。沉淀和絮凝都成功地用于使细胞培养液澄清。沉淀依赖于降低目标溶质的溶解度以产生固体颗粒,但絮凝是由絮凝剂诱导的桥接效应引起的颗粒(哺乳动物细胞培养物中的细胞、细胞碎片或胶体)的聚集。絮凝剂通过使分散的颗粒粘附成较大尺寸的簇来触发生物胶体悬浮液的不稳定,从而导致平均粒径分布的增加。(felo m2015,singh n 2016)。絮凝方法可分为阴离子絮凝、阳离子絮凝和混合模式絮凝(singh n 2016)。
11.具体地,已经评估了絮凝剂,例如简单的酸、二价阳离子、聚阳离子聚合物、辛酸和刺激响应聚合物,它们增强细胞培养物的澄清和降低dna、宿主细胞蛋白(hcp)和病毒水平的能力(felo m 2015)。大约十年以来,絮凝方法也因其在单克隆抗体的大规模生产中的有用性而得到深入研究。
12.在细胞存在下,无论是否调节ph,使用各种阳离子和阴离子的组合进行絮凝已成功应用于单克隆抗体的纯化(wo2007035283)。最优选ca
2+
和磷酸根的组合。强调了与非絮凝对照相比,蛋白质a洗脱峰中hcp和浊度的显著降低。
13.其他方法利用聚电解质,例如聚乙烯磺酸、聚乙烯磺酸盐、聚苯乙烯磺酸、聚丙烯酸、聚赖氨酸或聚精氨酸来沉淀收获的细胞培养液中的杂质(wo2008091740)。开发了一种使用辛酸作为絮凝剂来沉淀污染物的类似方法(wo2010151632)。
14.杂质的沉淀或絮凝通常需要额外的ph操控。对此已经公开了使用二价阳离子(例如co
2+
或ni
2+
)沉淀(wo2008127305)和使用葡聚糖沉淀(wo2016153983)。
15.研发了另一种使用称作刺激响应聚合物的苄基化的聚(烯丙基胺)的絮凝方法,用于从cho细胞培养物中纯化单克隆igg1。通过添加磷酸钠来设置刺激(kang yk 2013)。在使抗体的细胞培养收获物澄清中充当刺激响应聚合物的其他化合物是已知的(wo2011146394)。
16.将尿囊素添加到含有细胞的收获物中、然后添加依沙吖啶的絮凝步骤被描述为在随后的吸附和色谱步骤之前的一种预处理方法(wo2014133459)。
17.另一种絮凝方法利用c7‑
c
10
脂肪酸组合其他功能性物质来澄清细胞培养收获物(wo2014196926)。采用了基于c7‑
c
10
脂肪酸和尿囊素组合的类似方法(wo2015130222)。
18.公开了一种通过将尿囊素、阳离子聚合物和脂肪酸组合用于去除含细胞的收获物中的污染物的更复杂的絮凝方法。尿囊素、壳聚糖和辛酸三种絮凝剂的混合物最为成功(wo2017217930)。
19.描述了抗体或其他目标分子的完整纯化方法,其包含(i)用于去除污染物的沉淀步骤,(ii)蛋白质a色谱,然后是(iii)一次或两次流穿色谱(wo2014004281)。将沉淀剂添加到细胞培养收获物中,并且也包含絮凝剂,含有或不含有额外的刺激响应成分。
20.研究了一种阳离子水溶性聚合物聚(二烯丙基二甲基氯化铵),用于澄清生产mab的cho细胞培养物的收获物(mcnerney t 2015)。作者将絮凝剂直接添加到培养液中。省略离心,而是采用过滤处理。经证实,在后续的蛋白质a捕获色谱后,毒性的聚(二烯丙基二甲基氯化铵)已降至检测不到的水平。
21.开发了一种大规模细胞培养物收获方法,该方法包括在细胞存在下和基于聚(二烯丙基甲基氯化铵)的初始絮凝步骤(wo2013090820)。优选的絮凝方法利用进一步的絮凝增强剂,即聚乙二醇和triton x
‑
100。
22.发明概述
23.本发明涉及防止亲和捕获色谱介质在免疫球蛋白从细胞培养物中的低ph洗脱期间沉淀。本发明进一步提供了以有效且成本有利的方式并且具有令人满意的纯度和收率来纯化免疫球蛋白的方法。特别地,本发明的目的在于改善从捕获色谱树脂洗脱的免疫球蛋白溶液的纯度,且由此提高终产品的质量。
24.此外,本发明解决了成本密集型色谱材料的再利用方面,特别是下游过程的捕获步骤中使用的亲和色谱材料的寿命问题、以及如何增加寿命、同时减少纯化过程的技术复杂性的问题。
25.用于从细胞培养液中纯化免疫球蛋白的常规下游色谱工艺通常以亲和捕获色谱步骤开始,其中必须从包含免疫球蛋白和杂质的样品中捕获免疫球蛋白。免疫球蛋白与杂质分离主要是因为免疫球蛋白与捕获色谱树脂的亲和配体选择性结合,而杂质不与树脂结合并因此在流穿中获得,而免疫球蛋白在洗脱液中得到。
26.亲和捕获色谱通常是免疫球蛋白纯化中最昂贵的步骤,在使用蛋白质a亲和色谱的情况下,占整个下游工艺成本的40%
‑
50%。这同样适用于其他的亲和色谱柱,其可用作免疫球蛋白纯化中的捕获色谱步骤。
27.一直需要从大体积的细胞培养液和发酵液以及来源于这些流体或液体的澄清样
品中经济有效地纯化免疫球蛋白。尤其是,需要成本有利的且在纯度和收率方面仍然有效和令人满意的简单纯化方法。
28.已经发现,通过在捕获色谱上游加入额外的色谱步骤,可以显著降低纯化工艺的总费用。这种额外的色谱步骤减少了成本密集型捕获色谱材料暴露于杂质的负担。这种所谓的“预清洗”步骤使用阴离子交换或混合模式色谱材料进行,与后续捕获步骤中使用的色谱材料相比,其更低廉、更稳定且易于再生(wo2015135884)。为了使纯化过程尽可能简单,预清洗色谱采用流穿模式进行,即,待纯化的免疫球蛋白不与树脂结合,由此在流穿部分中获得,而杂质大部分保留在树脂上且由此与免疫球蛋白分离。预清洗阴离子交换柱与蛋白质a捕获柱直接连接,使得预清洗步骤的流穿液不是暂时储存在收集容器中,而是立即通过捕获色谱树脂,这进一步简化了该方法(wo2015135884)。
29.尽管如此,这种阴离子交换流穿色谱方法用作捕获前的澄清步骤,虽然在大规模生产中成功建立,但仍有待进一步改进。阴离子交换色谱主要耗尽带负电荷的物质,例如hcdna和hcp,以及被柱子保留的非特异性吸附的细胞碎片、聚集物、脂质等。但是,大部分带正电的hcp和不带电的分子可以通过预清洗柱。这可导致蛋白质a洗脱峰出现不期望的混浊。此外,由于高细胞密度、复杂培养基进料策略和本领域的哺乳动物细胞培养的高表达率引起的需求不断增加,因此需要具有大尺寸的预清洗柱作为蛋白质a柱的有效保护柱。这将提高成本。最终,阴离子交换树脂必须经过苛刻且耗时的清洗和再生程序。这在常规生产中是不受欢迎的,常规生产优选以连续批次的方式进行。
30.本发明研究了絮凝步骤用作捕获前的步骤以克服色谱预清洗的上述问题的可行性。为了达到预期用于治疗用途的免疫球蛋白所需的高纯度,在絮凝步骤和捕获色谱步骤之后进行两个或更多个色谱精制步骤。
31.本发明的基本问题通过提供一种用于从细胞培养液中纯化免疫球蛋白的方法来解决,该方法包含按以下顺序的下列步骤:
32.(a)将诱导絮凝的化合物添加至细胞培养液中;
33.(b)深层过滤步骤(a)的混合物;
34.(c)将步骤(b)中获得的滤液暴露于亲和色谱,其中免疫球蛋白与亲和色谱介质结合;
35.(d)使用具有ph值为5
‑
9且离子强度为0.1
‑
5.0mol/l的洗涤缓冲液洗涤亲和色谱介质;和
36.(e)使用具有ph值为2.5
‑
4.5的洗脱缓冲液从亲和色谱树脂上洗脱免疫球蛋白。
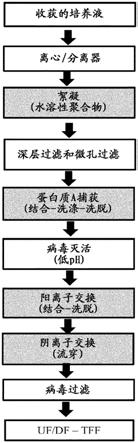
37.在一些实施方案中,步骤(a)包含下列步骤:
38.‑
离心和/或过滤细胞培养液;
39.‑
将诱导絮凝的化合物添加至上清液或滤液。
40.絮凝可以通过添加阳离子化合物作为絮凝剂来进行。阳离子化合物可以选自二价金属离子盐、水溶性有机聚合物和水不溶性有机聚合物。
41.在一些实施方案中,二价金属离子盐为cacl2。
42.在一些实施方案中,水溶性有机聚合物为聚(二烯丙基二甲基氯化铵)。在其他实施方案中,水不溶性有机聚合物是壳聚糖。
43.在具体的实施方案中,以聚(二烯丙基二甲基氯化铵)为絮凝剂进行絮凝。更具体
地,所述聚(二烯丙基二甲基氯化铵)具有10kda
‑
10000kda的分子量。
44.典型地,以0.01
‑
1.0%(w/v)的终浓度加入聚(二烯丙基二甲基氯化铵,优选0.02
‑
0.1%(w/v)的终浓度,更优选0.03
‑
0.08%(w/v)的终浓度。
45.在一些实施方案中,除了聚(二烯丙基二甲基氯化铵)外,不添加其他物质来进行絮凝。
46.在一些实施方案中,使用聚(二烯丙基二甲基氯化铵)的絮凝在不进一步调整ph或电导率的情况下进行。
47.在具体的实施方案中,絮凝在室温下搅拌进行至少5min,优选至少15min。
48.在优选的实施方案中,亲和色谱是蛋白质a色谱。蛋白质a色谱介质可以包含耐碱的蛋白质a衍生物作为配体,优选蛋白质a的结构域b的碱稳定的四聚体变体,其结合至交联的琼脂糖基质。
49.在一些实施方案中,在深层过滤后进行微孔过滤。
50.典型地,亲和色谱在深层过滤后至多8小时进行,优选在深层过滤后至多3小时进行。
51.在一些实施方案中,细胞培养液来自表达免疫球蛋白的重组cho细胞。优选地,免疫球蛋白为igg1或igg2。更优选地,igg1或igg2的fc部分为人的。
52.本文所述的方法可以包含如前述实施方案中任一项所定义的步骤并且包含一个或多个在亲和色谱之后的选自病毒灭活、离子交换色谱、混合模式色谱、纳滤和超滤/渗滤的另外的步骤。
53.优选地,上述方法进一步包含下列步骤:
54.(f)将步骤(e)的洗脱液在2.5
‑
4.5的低ph值下温育至少10分钟用于病毒灭活;
55.(g)进行阳离子交换色谱;
56.(h)进行混合模式色谱或阴离子交换色谱;
57.(i)将步骤(h)的洗脱液或由其衍生的并且在步骤(h)之后进行的一个或多个进一步处理步骤后获得的组合物暴露于纳滤;和
58.(j)将步骤(i)的滤液或由其衍生的并且在步骤(i)之后进行的一个或多个进一步处理步骤后获得的组合物暴露于超滤/渗滤。
59.进一步优选的方法包含以下顺序的下列步骤:
60.(a)将诱导絮凝的化合物添加至细胞培养液中;
61.(b)深层过滤步骤(a)的混合物;
62.(c)将步骤(b)中获得的滤液暴露于亲和色谱,其中免疫球蛋白与亲和色谱介质结合;
63.(d)使用具有ph值为5
‑
9且离子强度为0.1
‑
5.0mol/l的洗涤缓冲液洗涤亲和色谱介质;和
64.(e)使用具有ph值为2.5
‑
4.5的洗脱缓冲液从亲和色谱树脂上洗脱免疫球蛋白。
65.(f)将步骤(e)的洗脱液在2.5
‑
4.5的低ph值下温育至少10分钟用于病毒灭活;
66.(g)进行阳离子交换色谱;
67.(h)进行混合模式色谱或阴离子交换色谱;
68.(i)将步骤(h)的洗脱液或由其衍生的并且在步骤(h)之后进行的一个或多个进一
步处理步骤后获得的组合物暴露于纳滤;和
69.(j)将步骤(i)的滤液或由其衍生的并且在步骤(i)之后进行的一个或多个进一步处理步骤后获得的组合物暴露于超滤/渗滤;
70.其中步骤g)以结合
‑
洗脱模式进行,且步骤h)以结合
‑
洗脱模式或流穿模式进行。
71.本发明进一步解决了免疫球蛋白生产过程中提高病毒安全性的问题。
72.附图简述
73.图1:免疫球蛋白常规纯化方法的工艺方案
74.图1a显示了从大体积的细胞培养物中纯化免疫球蛋白的通用工艺方案。该工艺从收获的培养液离心和/或过滤后获得的澄清的批量材料开始,包括蛋白质a捕获步骤和两个后续的精制步骤。该方案也包括两个典型的病毒安全性步骤。病毒灭活步骤是通过将蛋白质a洗脱液保持在低ph值下来进行,并在最后一个精制步骤之后进行去除病毒的纳滤步骤。最终步骤通常是切向流超滤和/或渗滤(uf/df
‑
tff),以设定期望的免疫球蛋白浓度和制剂成分的浓度。
75.图1b显示了从大体积的细胞培养物中纯化免疫球蛋白的典型工艺方案,包括三种色谱(例如,根据fahrner r.l.2001或kelly b.2009)。它与图1a中的工艺相同,不同之处在于所公开的精制步骤为阳离子交换色谱(精制步骤1),然后是阴离子交换色谱(精制步骤2)。必须强调,阳离子交换色谱以结合模式进行,而阴离子交换色谱以流穿模式进行。应当提及,这种典型方案的广泛应用的等效变通方案是简单改变精制步骤1和2的顺序。
76.图2:使用预清洗步骤的本发明的示例性工艺方案
77.图2a显示了在细胞存在下直接在收获物中进行捕获前的絮凝步骤的大规模工艺方案。絮凝的物质然后通过离心、随后是深层过滤和微孔过滤去除。絮凝步骤通过添加阳离子化合物进行。将澄清的培养液加载到捕获色谱柱上,其为蛋白质a。两个精制步骤是阳离子交换色谱(精制步骤1)、然后是混合模式色谱(精制步骤2)。阳离子交换色谱以结合和洗脱模式进行。混合模式树脂具有带正电荷的配体,并且可以以结合和洗脱模式或流穿(ft)模式进行。中间的病毒安全性步骤和最终uf/df
‑
tff如图1a中所述。
78.图2b显示了替代的大规模工艺方案,它类似于图2a的工艺,不同之处在于絮凝步骤在细胞分离之后在无细胞存在下进行。所有其他步骤如图2a所述。
79.图2c显示了另一种替代的大规模工艺方案,它类似于图2b的工艺,不同之处在于最终的精制色谱为流穿(ft)模式的阴离子交换色谱。所有其他步骤如图2b和图2a中所述。
80.发明详述
81.如本文所用,术语“细胞培养液”是指收获的细胞培养液、细胞培养物上清液或预处理的细胞培养物上清液。细胞培养液可以直接得自产生免疫球蛋白的宿主细胞或生物体。可以通过离心和/或过滤部分净化或纯化细胞培养液,例如微孔过滤、渗滤、超滤和深层过滤。
82.如本文所用,术语“预处理的”是指例如已经为用于本发明方法的色谱步骤制备的细胞培养物上清液,例如通过对样品进行一种或多种调整,包括缓冲液交换、稀释、添加盐、洗涤剂、离液序列高的物质或有机化合物、ph滴定或过滤以调节ph和/或电导率范围和/或缓冲容量,从而实现期望的色谱性能并稳定免疫球蛋白。因为哺乳动物细胞表达的免疫球蛋白通常在培养过程中分泌到细胞培养液中,因此,培养过程结束时的产物收获通过将细
胞培养液与细胞分离来进行。细胞分离方法应当温和,以尽量减少细胞破坏,避免细胞碎片的增加以及蛋白酶和其他可能影响免疫球蛋白产品质量的分子的释放。通常,来自哺乳动物细胞培养物的收获物经过离心、随后过滤。膨胀床吸附色谱为一种避免离心/过滤方法的替代方法。在通过色谱步骤纯化之前对样品进行的其他处理可以是将细胞培养物上清液浓缩和/或渗滤到特定的免疫球蛋白浓度、ph范围、电导率和缓冲物质浓度。
83.如本文所用,术语“絮凝”(同义词“聚沉”和“聚集”)包含簇集反应,其中流体中的悬浮固体与絮凝诱导剂相互作用,导致形成较大尺寸的聚集物或絮凝物。在本文中可互换使用的术语“絮凝剂”和“絮凝诱导剂”可以为阳离子或阴离子化合物。优选地,絮凝剂为阳离子化合物。更优选地,絮凝剂为阳离子水溶性聚合物。作为本发明中应用的“絮凝步骤”用作捕获色谱上游的预清洗步骤。絮凝可以在细胞存在下进行,这意味着在培养结束时将絮凝剂直接添加到细胞培养液中,并通过离心和/或过滤从细胞培养液中去除包括细胞在内的絮凝物,或者在通过离心去除细胞后向细胞培养液中加入絮凝剂,然后通过过滤去除絮凝物。
84.如本文所用,术语“阳离子化合物”包含金属离子和阳离子聚合物(聚阳离子)。“阳离子聚合物”可以为水溶性聚合物或水不溶性聚合物。“水溶性聚合物”包含溶于水并因此改变水性体系物理特性的有机物质。“水不溶性聚合物”在水中具有有限的溶解度。它们在水中分散或溶胀,且优选包含亲水性聚合物,其在水性悬浮液中作为絮凝剂起作用。水不溶性聚合物可以在极低或极高的ph下变得溶于水。用作絮凝剂的阳离子化合物在水性介质中具有多种功能。水溶性或水不溶性有机聚合物包含多种来源于天然来源或化学合成的物质。天然的水溶性或水不溶性有机聚合物的实例为多糖(例如果胶、葡聚糖、淀粉、壳聚糖和透明质酸)、黄原胶、角叉菜胶等。化学合成的有机聚合物的实例为聚乙二醇(peg)、聚乙烯吡咯烷酮(pvp)、聚乙烯醇(pva)、聚丙烯酸(ppa)、聚丙烯酰胺等(有关综述参见kadajii vg 2011)。在本发明的过程中,水溶性聚合物用作最优选的絮凝剂。
85.术语“杂质”和“污染物”在本文中可互换使用,并且是指与目标免疫球蛋白不同的任何物质。实例可以为细胞培养基成分、细胞碎片、宿主细胞蛋白、内毒素、病毒、脂质、dna、rna、来自加工材料的浸出物以及其聚集物或片段。与产物相关的物质也被视为杂质,例如聚集物、电荷变体、错误折叠的分子或待纯化的目标免疫球蛋白的片段。
86.术语“沉淀”是指杂质,其为不溶性的和/或处于不溶状态。沉淀可以导致样品混浊。
87.如本文所用,术语“色谱介质”应当理解为以珠、板、晶体、整料、膜、纤维、纤维网状结构或任何其他固相的形式的色谱材料或介质。“介质”带有官能团,称作“配体”,其直接或通过间隔基结合至称作“基质”的骨架。一个例外是用于尺寸排阻色谱的凝胶色谱树脂,其为典型的没有任何连接的配体的树脂。术语“介质”不将本发明的方法限于仅使用色谱树脂的柱色谱,而且还包括其他类型的色谱,例如使用膜吸附器的膜色谱。特别地,在离子交换色谱中,本发明包括离子色谱交换树脂或离子交换色谱膜吸附器二者。
[0088]“树脂”是指以珠形式的任何色谱材料或介质,其包含具有结合官能团(配体)的基质,所述官能团(配体)可与蛋白质或至少一种污染物相互作用。一个例外是用于尺寸排阻色谱的凝胶色谱树脂,其为典型的没有任何连接的配体的树脂。树脂可以作为不同尺寸的珠提供并被充填在柱中。或者,可以购买预装柱。
[0089]
术语“基质”或“固相”是指配体可以连接的非水基质。本文关注的基质通常是这样的基质,其包含玻璃、陶瓷、二氧化硅、纤维素、琼脂糖、甲基丙烯酸酯聚合物或聚苯乙烯。
[0090]
所谓“配体”是指任意官能团,其与蛋白质或至少一种污染物发生相互作用,并且其共价结合至“基质”。
[0091]
术语“结合模式”或“结合和洗脱模式”是指将包含待纯化免疫球蛋白的样品施加到色谱介质的色谱条件,其中免疫球蛋白与色谱介质结合。因此,免疫球蛋白保留在色谱介质上,而样品的杂质可能存在于非结合流分中,也称作流穿部分。当以结合模式进行色谱步骤时,可以在免疫球蛋白结合色谱介质之后和从介质洗脱免疫球蛋白之前进行一个或多个洗涤步骤。为了获得免疫球蛋白,随后洗脱并在洗脱液中获得免疫球蛋白,然后在需要时,可以在进一步的色谱步骤中进一步纯化。免疫球蛋白的洗脱可以使用允许污染物在免疫球蛋白被洗脱时保持与介质结合的选择性条件来进行。
[0092]
以“结合模式”进行色谱步骤并不一定意味着结合了100%的目标免疫球蛋白。在本发明的上下文中,“与色谱树脂结合”或“与色谱介质结合”是指至少50%的免疫球蛋白、优选至少75%的免疫球蛋白、更优选至少85%的免疫球蛋白、最优选95%以上的免疫球蛋白与树脂或介质结合。
[0093]
在本发明的上下文中,应当理解,捕获色谱步骤和中间的阳离子交换色谱步骤均以结合模式进行,其中捕获步骤被视为第一色谱步骤,其在结合模式下进行。本发明的最终精制的混合模式色谱步骤以结合和洗脱模式或以流穿模式进行。还应理解,可以使用流穿模式的阴离子交换色谱替代混合模式色谱作为最后的精制步骤。
[0094]
术语“流穿模式”是指将含有目标免疫球蛋白的样品施加到色谱树脂或介质上的色谱条件,其中免疫球蛋白不与色谱树脂结合,而主要存在于未与树脂或介质结合的流分中,因此包含在流穿液中。本发明开发的中间色谱不使用流穿模式。然而,本发明的方法可以补充流穿模式的额外的精制色谱。在这种模式下,杂质可以与树脂或介质结合。
[0095]“洗涤步骤”是在样品上样到色谱柱之后、但在蛋白质从柱上洗脱之前以结合模式色谱进行的步骤。洗涤步骤另外去除了与基质、免疫球蛋白和/或配体较不紧密或非特异性结合的污染物,而不会从树脂上显著地洗脱目标免疫球蛋白。在洗涤步骤中,用所需的洗涤缓冲液洗涤树脂(例如,洗涤缓冲液通过色谱柱直到在柱的出口处测量的uv吸收恢复至基线)。
[0096]
术语“洗脱”应理解为这样一种工艺,它通过改变溶液条件使缓冲剂成分与目标分子竞争色谱树脂上的配体位点,从而从色谱树脂上解吸目标免疫球蛋白。另一种洗脱模式发生在亲和色谱中,例如使用蛋白质a。在这种情况下,洗脱缓冲液可以改变配体或免疫球蛋白的构象,从而放松结合。通过改变围绕离子交换材料的缓冲液的离子强度,使得流动相中的缓冲离子与分子竞争离子交换树脂的带电离子位点,可以从离子交换树脂上洗脱目标免疫球蛋白。或者,ph的改变会影响两性蛋白质,并且ph增加到高于蛋白质的pi时,由此阻止其与阳离子交换树脂的结合,使蛋白质洗脱。当ph降低到蛋白质的pi以下时,阴离子交换色谱树脂也会产生同样的效果。如本文所理解的,术语“洗脱”包含等度洗脱、单步洗脱和梯度洗脱,具有或没有在先的洗涤步骤。目标免疫球蛋白的洗脱可以通过增加流动相中的离子强度或电导率来进行,其受到增加缓冲溶液中盐浓度的影响。或者,ph值的增加或减少可能是合适的。可以采用不连续的分步梯度、线性梯度、非线性梯度或这类梯度的适当组合。
[0097]
适合于洗涤和洗脱的缓冲液可以选自乙酸盐、柠檬酸盐、琥珀酸盐、马来酸盐、丙二酸盐、tris
‑
hcl、tris
‑
乙酸盐、tris
‑
甘氨酸、磷酸盐、琥珀酸盐、丙二酸盐、mes、mops、pipes、phepes、bistris、甘氨酸和其他适合的缓冲液,其中添加了例如磷酸盐、硫酸盐或氯化物例如nacl或kcl这样的盐。实现洗脱的离子强度和盐浓度取决于缓冲溶液的ph值和蛋白质的pi。洗涤缓冲液还可以包含洗涤剂(例如聚山梨酯)、溶剂(例如己二醇、异丙醇或乙醇)或聚合物(例如聚乙二醇)。此外,洗涤缓冲液可以包括离液序列高的试剂(例如尿素或精氨酸)和/或蛋白酶抑制剂(例如edta)。
[0098]
如本文所用,术语“缓冲液”是指通过酸
‑
碱共轭成分的作用抵抗ph值变化的溶液。
[0099]
术语“免疫球蛋白”和“抗体”在本文中可互换使用。免疫球蛋白可以为单克隆抗体、多克隆抗体、多特异性抗体(例如双特异性抗体)及其表现出期望的抗原结合活性的片段。天然存在的抗体为具有可变结构的分子。例如,天然igg抗体为约150,000道尔顿的异四聚化糖蛋白,由通过二硫键连接的两条相同的轻链和两条相同的重链组成。从n
‑
到c
‑
末端,每条重链具有可变结构域(vh),也称作可变重结构域或重链可变结构域,随后是三个或四个恒定结构域(ch1、ch2、ch3和任选的ch4)。类似地,从n
‑
到c
‑
末端,每条轻链具有可变结构域(vl),也称作可变轻结构域或轻链可变域,随后是恒定轻链(cl)结构域。基于其恒定结构域的氨基酸序列,抗体的轻链可以被归为称作κ和λ的两种类型之一。
[0100]“抗体片段”包含全长抗体的一部分,通常是其抗原结合区或可变区。抗体片段的实例包括fab、fab'、f(ab')2和fv片段;单链抗体分子;双抗体;直链抗体;和由抗体片段形成的多特异性抗体。
[0101]
优选地,免疫球蛋白为单克隆抗体。本文使用的术语“单克隆抗体”是指从基本上同源的抗体群体得到的抗体,即,除了可能少量存在的天然存在的突变外,构成群体的各个抗体是相同的。与传统的(多克隆)抗体制剂(其通常包括针对不同决定簇(表位)的不同抗体)相反,每个单克隆抗体定向于抗原上的单个决定簇。修饰语“单克隆”表示从基本上同源的抗体群体中得到的抗体的特征,且不应解释为需要通过任何特定方法产生抗体。
[0102]
免疫球蛋白可以是鼠类igg1、igg2a、igg2b、igm、iga、igd或ige,人igg1、igg2、igg3、igg4、igm、iga1、iga2、igd或ige,或它们的组合或片段。
[0103]
免疫球蛋白可以识别任何一种蛋白质或蛋白质组合,包括但不限于以下抗原:cd2、cd3、cd4、cd8、cd11a、cd14、cd18、cd19、cd20、cd22、cd23、cd25、cd33、cd40、cd44、cd52、cd80(b7.1)、cd79b、cd86(b7.2)、cd147、cd152、il
‑
1a、il
‑
1β、il
‑
1、il
‑
2、il
‑
3、il
‑
7、il
‑
4、il
‑
5、il
‑
8、il
‑
10、il
‑
12、il
‑
13、il
‑
23、il23a、il
‑
2受体、il
‑
4受体、il
‑
6受体、il
‑
12受体、il
‑
13受体、il
‑
18受体亚单位、pdgf
‑
β及其类似物、plgf、vegf、tgf、tgf
‑
β2、tgf
‑
p1、egf受体、plgf受体、vegf受体、血小板受体gpiib/iiia、血小板生成素受体、细胞凋亡受体pd
‑
1、肝细胞生长因子、骨保护素配体、干扰素α、干扰素β、干扰素γ、b淋巴细胞刺激物blys、t
‑
细胞活化调节物ctla
‑
4、c5补体、ige、肿瘤抗原ca125、肿瘤抗原muc1、pem抗原、erbb2/her
‑
2、在患者血清中以升高水平存在的肿瘤相关表位,在乳腺癌、结肠癌、鳞状细胞、前列腺癌、胰腺癌、肺癌和/或肾癌细胞和/或黑素瘤、神经胶质瘤或神经母细胞瘤细胞上表达的癌症相关表位或蛋白质,肿瘤的坏死核心、整联蛋白α4β7、整联蛋白vla
‑
4、b2整联蛋白、α4β1和α4β7整联蛋白、trail受体1、2、3和4、rank、rank配体(rankl)、tnf
‑
α、粘附分子vap
‑
1、上皮细胞粘附分子(epcam)、胞间粘附分子
‑
3(icam
‑
3)、白细胞整合素粘附素、血小板糖蛋白gp iib/
iiia、心肌肌球蛋白重链、甲状旁腺激素、硬骨素(sclerostin)、mhc i、癌胚抗原(cea)、降钙素基因相关肽(cgrp)、甲胎蛋白(afp)、肿瘤坏死因子(tnf)、fc
‑
y
‑
1受体、hla
‑
dr 10β、hla
‑
dr抗原、l
‑
选择蛋白、激肽释放酶、克利宁和ifn
‑
γ。
[0104]
免疫球蛋白可以是例如阿非莫单抗、阿昔单抗、阿达木单抗、恩美曲妥珠单抗(adotrastuzumab)、阿杜那单抗(aducanumab)、阿仑单抗、alirocumab、anifrolumab、阿西莫单抗、阿特珠单抗、阿维单抗、巴利昔单抗、贝利木单抗(belimumab)、贝那利珠单抗(benralizumab)、贝伐珠单抗、贝洛托舒单抗(bezlotoxumab)、博纳吐单抗(blinatumomab)、bocozizumab、brazikumab、brentuximab、brodalumab、brolucizumab、canakinumab、卡帕珠单抗(caplacizumab)、卡罗单抗、塞米普利单抗(cemiplimab)、赛妥珠单抗(certolizumab)、西妥昔单抗、克立昔单抗、claudiximab、crizalizumab、达克珠单抗、达雷木单抗(daratumumab)、地诺单抗(denosumab)、达妥昔单抗(dinutuximab)、度匹鲁单抗、德鲁瓦单抗、依库丽单抗(eculizumab)、依决洛单抗(edrecolomab)、埃罗妥珠单抗(elotuzumab)、艾米珠单抗(emicizumab)、eptinezumab、厄瑞努单抗(erenumab)、依维苏单抗(evinacumab)、依洛尤单抗(evolocumab)、fremanezumab、福拉韦单抗(foravirumab)、galcanezumab、加利昔单抗、吉妥珠单抗、戈利单抗(golimumab)、古塞库单抗(guselkumab)、伊巴组单抗(ibalizumab)、替伊莫单抗、英西单抗、艾达赛珠单抗(idarucizumab)、inebilizumab、英利昔单抗、奥英妥珠单抗(inotuzumab)、伊匹单抗、ixekizumab、凯利昔单抗、拉那鲁单抗(lanadelumab)、来瑞组单抗、来沙木单抗、mavrilimumab、美泊利单抗、mirikizumab、mogamulizumab、mosunetuzumab、莫罗单抗
‑
cd3、那他珠单抗、耐昔妥珠单抗(necitumumab)、纳武单抗、若莫单抗、奥滨尤妥珠单抗(obinutuzumab)、奥瑞组单抗(ocrelizumab)、奥法单抗(ofatumumab)、奥拉木单抗(olaratumab)、奥马珠单抗、帕利珠单抗、帕尼单抗、帕博利珠单抗(pembrolizumab)、帕妥株单抗(pertuzumab)、polatuzumab、雷莫芦单抗(ramucirumab)、兰尼单抗(ranibizumab)、雷夫利珠单抗(ravulizumab)、restizumab、risankizumab、利妥昔单抗、罗莫珠单抗(romosozumab)、洛伐妥珠单抗(rovalpituzumab)、沙西妥珠单抗(sacituzumab)、sarilumab、萨特利珠单抗(satralizumab)、苏金单抗(secukinumab)、sirukumab、tanecumab、特折鲁单抗(tezepelumab)、阿特珠单抗(tezolizumab)、塔西单抗(tocilizumab)、托西莫单抗(tositumomab)、曲罗芦单抗(tralokinumab)、曲妥珠单抗、替西木单抗、乌妥昔单抗(ublituximab)、乌司奴单抗(ustekinumab)和维多珠单抗(vedolizumab)。
[0105]
本发明的免疫球蛋白优选地为igg分子,例如igg1、igg2、igg3或igg4分子。更优选地,免疫球蛋白为igg1或igg2。甚至更优选地,免疫球蛋白为igg1或igg2,其中至少fc部分是人的。免疫球蛋白可以为鼠
‑
人嵌合igg1,其中igg1的fc部分是人的。最优选地,嵌合免疫球蛋白为利妥昔单抗或英利昔单抗。
[0106]
利妥昔单抗为嵌合的抗
‑
cd20抗体,其详细描述于例如wo9411026中。
[0107]
英利昔单抗为嵌合的抗
‑
tnfα抗体,其详细描述于例如wo9216553中。
[0108]
免疫球蛋白可以为来自鼠先祖细胞的人源化igg1。最优选地,所述人源化抗体为曲妥珠单抗或贝伐珠单抗。
[0109]
曲妥珠单抗为人源化抗
‑
her2抗体,其详细描述于例如wo9222653中。
[0110]
贝伐珠单抗为人源化抗
‑
vegf抗体,其详细描述于例如wo9845331中。
[0111]
免疫球蛋白可以为完全的人igg1或igg2抗体。最优选地,人抗体为阿达木单抗(igg1)或地诺单抗(denosumab)(igg2)。
[0112]
阿达木单抗为人抗
‑
tnfα抗体,其详细描述于例如wo9729131中
[0113]
地诺单抗为人抗
‑
rankl抗体,其详细描述于例如wo03002713中。
[0114]
在一个实施方案中,免疫球蛋白为贝伐珠单抗、曲妥珠单抗或地诺单抗。
[0115]
本文的单克隆抗体具体包括“嵌合”抗体(免疫球蛋白),其中重链和/或轻链的一部分与衍生自特定物种或属于特定抗体类别或亚类的抗体中的相应序列相同或同源,而链的其余部分与衍生自另一物种或属于另一抗体类别或亚类的抗体以及此类抗体的片段中的相应序列相同或同源,只要它们表现出期望的生物活性。
[0116]
此外,本文的单克隆抗体还包括“人源化”抗体。此类抗体通过非人(例如鼠)抗体的“人源化”得到并且仅包含来源于动物免疫球蛋白的最少序列。分子的大部分是人序列。来自人受者抗体的高变区的残基被来自具有所需结合特性的非人供体抗体的高变区的残基替代。
[0117]
最终,本文的单克隆抗体还包括完全人抗体,其可以通过人抗体基因文库筛选获得。
[0118]
在一个优选的实施方案中,样品来自细胞培养物液,其得自重组cho细胞培养物。优选地,细胞培养液得自处于生长期的重组细胞培养物。
[0119]
本发明的方法可以用于小规模和大规模的免疫球蛋白纯化。优选地,该方法以大规模实施。
[0120]“小规模”也称作“实验室规模”,是指含有小于50g免疫球蛋白、小于10g免疫球蛋白或小于1g免疫球蛋白的样品的纯化。“小规模”也是指从捕获步骤的柱上洗脱的蛋白质达到少于50g免疫球蛋白、少于10g免疫球蛋白或少于1g免疫球蛋白的纯化过程。
[0121]“大规模”也称作“生产规模”或“制造规模”或“商业规模”,是指含有50g以上的免疫球蛋白、100g以上的免疫球蛋白、200g以上的免疫球蛋白或300g以上的免疫球蛋白的样品的纯化。“大规模”还指从捕获步骤的柱上洗脱的蛋白质达到50g以上的免疫球蛋白、100g以上的免疫球蛋白、200g以上的免疫球蛋白或300g以上的免疫球蛋白。
[0122]
术语“进一步处理步骤”是指通常在蛋白质纯化方案中应用的任何步骤,例如过滤、透析、病毒灭活、稀释、浓缩、ph调整、电导率调整、中间色谱步骤或用于任何目的的保持步骤。可以在本发明的所有色谱步骤之间应用进一步的处理步骤。可以在任何色谱步骤之间应用中间色谱步骤。特别地,术语“进一步处理步骤”是指在捕获色谱与阳离子交换色谱之间应用的中间色谱步骤。中间色谱步骤可以用任何色谱介质以任何模式进行。中间色谱步骤可以采用任何色谱类型,包括柱色谱和膜色谱。
[0123]
作为进一步的中间步骤或精制步骤,也可以使用其他色谱类型。例如,阴离子交换柱色谱和阴离子交换膜色谱可以用作精制步骤,最优选流穿模式。另一种可能性在于应用羟基磷灰石色谱,特别是结合模式的陶瓷羟基磷灰石。
[0124]
本发明的第一个方面涉及一种在来自细胞培养液的免疫球蛋白的捕获亲和色谱过程中防止沉淀的方法,该方法包含按以下顺序的下列步骤:
[0125]
(a)将诱导絮凝的化合物添加至细胞培养液;
[0126]
(b)深层过滤步骤(a)的混合物;
[0127]
(c)将步骤(b)中获得的滤液暴露于亲和色谱,其中免疫球蛋白与亲和色谱介质结合;
[0128]
(d)使用具有ph值为5
‑
9且离子强度为0.1
‑
5.0mol/l的洗涤缓冲液洗涤亲和色谱介质;和
[0129]
(e)使用具有ph值为2.5
‑
4.5的洗脱缓冲液从亲和色谱树脂上洗脱免疫球蛋白。
[0130]
预清洗步骤:絮凝
[0131]
在导致本发明的实验中,观察到无细胞的收获材料(澄清的上清液)仍然含有几种物质,这些物质与待纯化的免疫球蛋白一起与捕获树脂强结合。这会影响树脂的再利用和从捕获树脂洗脱后免疫球蛋白的质量。这可以通过额外的基于流穿模式的阴离子交换色谱的预清洗色谱得到改善(wo2015135884)。尽管hcdna和hcp水平显著降低,但仍需要进一步改进。观察到蛋白质a洗脱液仍趋于混浊,这是由杂质引起的,而不是由免疫球蛋白本身引起的。洗脱所需的低ph、杂质的相对含量和高蛋白质浓度浓度促进了混浊。除了混浊的洗脱池,还观察到柱反压力增加。增加的粘度最好地解释了这一点。此外,预清洗阴离子交换色谱柱是一个不受欢迎的成本因素,因为非常高的污染物负载需要相对较大的尺寸。后者通过更高的mab滴度和由此在成本上有利的生产所需的延长发酵而得到增强。由于阴离子交换树脂的过滤效果主要限于保留带负电荷的分子,并且一些导致混浊的杂质仍然会漏出,因此需要一种更简单、更有效的捕获前的澄清策略。根据本发明的结果,插入一种适合的预清洗絮凝方法令人惊讶地代表了对收获的培养液进行快速和简单纯化的良好解决方案。通过去除更多杂质,开发的絮凝方法改善了样品的纯度,减少了关键污染(这在捕获介质的低ph洗脱过程中会增加浊度),并保护昂贵的亲和柱。本发明的絮凝方法简单、快速、不损耗产品且成本合理。此外,结果证明絮凝方法可以在以下两种情况下进行:(i)在从细胞培养液中除去细胞之前,这意味着存在细胞,或者(ii)在从细胞培养液中除去细胞后,这意味着不存在细胞。两种方法在蛋白质a步骤之前和之后的免疫球蛋白纯度相当。通过前一种方法,包含细胞的絮凝材料通过离心分离并且上清液通过过滤系统进一步得到澄清。在后一种方法中,细胞通过离心沉淀,且上清液发生絮凝。然后过滤系统去除絮凝的材料。在最简单的模式下,过滤系统由深层过滤器组成。然而,更优选深层过滤器和微孔过滤器串联。在放大到全规模生产的过程中,细胞分离后的絮凝是首选方法。当絮凝直接在细胞培养物中进行时,从发酵罐和分离器中去除包含整个细胞物质的絮凝物是极为耗时的。
[0132]
使用不同絮凝剂的大量的不同絮凝方法是已知的,并且实验证明在使表达单克隆抗体的哺乳动物细胞培养物澄清中是有效的。大部分方法需要物质的组合和/或培养液的进一步操作,例如ph调整。此外,许多已公布的方法利用絮凝替代离心步骤。相反,本发明按以下顺序组合了三种用于培养液的最佳澄清的方法:1)通过离心或过滤的细胞分离,2)絮凝,和3)深层过滤。
[0133]
当培养液的ph小于待纯化抗体的pi时,抗体携带净正电荷。在这些条件下,阳离子电解质可能会使杂质、残留细胞和细胞碎片絮凝或沉淀,并使抗体保留在溶液中。然后可以通过离心和/或深层过滤去除絮凝物,任选地随后进行微孔过滤。
[0134]
本发明利用单一阳离子化合物,例如二价金属离子、水溶性有机聚合物或水不溶性有机聚合物来诱导絮凝。进行本发明的絮凝步骤不需要其他物质,例如刺激响应聚合物
或盐。同样,本发明的絮凝方法无需进一步调节ph或电导率即可进行。
[0135]
术语“按以下顺序”应理解为表示所提及的方法步骤按所列顺序进行。可以在所列方法步骤之前、之后和之间加入进一步的工艺步骤。
[0136]
色谱介质可以是一次性的或可重复使用的。在一个实施方案中,色谱树脂为可重复使用的。在一个具体实施方案中,步骤(b)、(c)和(d)的色谱树脂为可重复使用的。
[0137]
与配置为一次性使用的色谱介质相比,可重复使用的色谱介质更具有成本效益。特别地,对于捕获色谱,使用大体积的色谱介质。因此,使用可重复使用的色谱介质,例如频繁重复使用的亲和色谱树脂对于捕获步骤是特别有利的。本发明的预清洗步骤的应用允许对昂贵的亲和捕获柱进行一定程度的缩小并且延长寿命,从而降低商品的总成本。
[0138]
术语“可重复使用”在本文中是指介质或树脂被配置为重复使用一个以上的纯化循环,即至少2、5、10、50、100、200、300、400、500个或更多个纯化循环。在每个循环之间,色谱介质或树脂可被洗涤和/或再生和/或灭菌和/或储存。
[0139]
在一个优选的实施方案中,用作絮凝剂的阳离子化合物选自二价金属离子盐、水溶性有机聚合物和水不溶性有机聚合物。更优选水溶性有机聚合物。
[0140]
二价金属离子盐可以为例如cacl2。水溶性有机聚合物可以为例如聚(二烯丙基二甲基氯化铵)。水不溶性有机聚合物可以为例如壳聚糖。甚至更优选地,絮凝剂为聚(二烯丙基二甲基氯化铵)。
[0141]
在一个实施方案中,水溶性有机聚合物以0.01
‑
1.0%(w/v)、优选0.02
‑
0.15%(w/v)、更优选0.025
‑
0.090%(w/v)的终浓度应用。在一个优选的实施方案中,水溶性有机聚合物以终浓度为0.0375
‑
0.075%(w/v)加入。在进一步优选的实施方案中,水溶性有机聚合物以0.015
‑
0.05%(w/v)的终浓度加入。
[0142]
在一个优选的实施方案中,用于诱导絮凝的水溶性有机聚合物为聚(二烯丙基二甲基氯化铵),其分子量为10kda
‑
10000kda。在另一个优选的实施方案中,絮凝步骤在搅拌下、在室温下进行至少10min、至少15min或至少20min,优选地,至少30min。本发明中的室温是指15
‑
25℃或20
‑
25℃、优选18
‑
22℃。搅拌是指使用适合的机械装置进行连续搅拌和/或搅拌。
[0143]
在进一步优选的实施方案中,添加到培养液中用于诱导絮凝的聚(二烯丙基二甲基氯化铵)起始溶液的浓度为5
‑
15%(w/v),优选9
‑
11%(w/v),更优选10%(w/v)。最优选中性ph溶液,其具有小于0.1%的二烯丙基氯化铵、具有小于10cfu/ml的微生物计数并且不含氯化钠。
[0144]
在本发明的一个实施方案中,通过在培养期结束时将絮凝剂直接加到发酵罐中,在从细胞培养液中去除细胞之前进行絮凝步骤。换言之,在这类实施方案中,在絮凝步骤之前不进行进一步的离心和/或过滤步骤。然后,将包括细胞在内的絮状物在离心机中通过沉降去除,优选在适合于大体积的盘式堆叠离心机中进行。所得上清液可通过深层过滤进一步澄清,任选地随后进行微孔过滤。
[0145]
在另外的实施方案中,步骤(a)包含下列步骤:
[0146]
(a1)离心和/或过滤细胞培养液;和
[0147]
(a2)向步骤(a1)中获得的上清液或滤液中加入诱导絮凝的化合物。
[0148]
换句话说,通过在进行离心和/或过滤步骤后将絮凝剂添加到上清液中,在从细胞
培养液中去除细胞之后进行絮凝步骤。
[0149]
因此,在具体的实施方案中,本发明的方法包含按以下顺序的下列步骤:
[0150]
(a1)离心和/或过滤细胞培养液;
[0151]
(a2)将诱导絮凝的化合物添加至在步骤(a1)中得到的上清液或滤液;
[0152]
(b)深层过滤步骤(a2)的混合物;
[0153]
(c)将步骤(b)中获得的滤液暴露于亲和色谱,其中免疫球蛋白与亲和色谱介质结合;
[0154]
(d)使用具有ph值为5
‑
9且离子强度为0.1
‑
5.0mol/l的洗涤缓冲液洗涤亲和色谱介质;和
[0155]
(e)使用具有ph值为2.5
‑
4.5的洗脱缓冲液从亲和色谱树脂上洗脱免疫球蛋白。
[0156]
优选地,通过深层过滤去除步骤(a2)的絮凝物,任选地随后进行微孔过滤。
[0157]
优选地,除了聚(二烯丙基二甲基氯化铵)外,无需添加其他物质来进行絮凝。换句话说,在步骤(a)中,除聚(二烯丙基二甲基氯化铵)外,没有进一步添加诱导絮凝的化合物。
[0158]
优选地,使用聚(二烯丙基二甲基氯化铵)进行絮凝时无需进一步调节ph或电导率。这意味着在亲和色谱之前的絮凝步骤和随后的过滤步骤中,特别是在絮凝步骤(a2)中,不调节ph或电导率。
[0159]
因此,在一个具体的实施方案中,本发明的方法包含以下顺序的下列步骤:
[0160]
(a1)离心和/或过滤细胞培养液;
[0161]
(a2)将诱导絮凝的化合物添加至在步骤(a1)中得到的上清液或滤液;
[0162]
(b)深层过滤步骤(a2)的混合物;
[0163]
(c)将步骤(b)中获得的滤液暴露于亲和色谱,其中免疫球蛋白与亲和色谱介质结合;
[0164]
(d)使用具有ph值为5
‑
9且离子强度为0.1
‑
5.0mol/l的洗涤缓冲液洗涤亲和色谱介质;和
[0165]
(e)使用具有ph值为2.5
‑
4.5的洗脱缓冲液从亲和色谱树脂上洗脱免疫球蛋白;
[0166]
其中除了聚(二烯丙基二甲基氯化铵)外,不添加其他物质进行絮凝;和
[0167]
其中使用聚(二烯丙基二甲基氯化铵)絮凝在不进一步调节ph或电导率的情况下进行。
[0168]
亲和捕获色谱步骤:蛋白质a色谱
[0169]
术语“捕获步骤”被理解为以结合模式进行的第一色谱步骤。从培养液中纯化免疫球蛋白的捕获步骤通常作为亲和色谱步骤进行。蛋白质a或其衍生物或类似物主要用作亲和捕获。根据本发明,亲和色谱成功地用于捕获免疫球蛋白。本发明的术语“亲和色谱”是指一种基于配体与免疫球蛋白之间高度特异性相互作用从培养液中选择性结合免疫球蛋白的方法。
[0170]
如本文所用,术语“免疫球蛋白结合蛋白/肽亲和色谱”是使用微生物来源的重组蛋白作为配体的亲和色谱(例如金黄色葡萄球菌(staphylococcus aureus)、链球菌属(streptococcus)、大消化链球菌(peptostreptococcus magnus))或其衍生的变体,或具有与免疫球蛋白结合能力的微生物来源的合成肽。示例性的免疫球蛋白结合蛋白可以为蛋白质a、蛋白质g、蛋白质l或蛋白质a/g。除此之外,来自微生物来源的蛋白质的结合蛋白或衍
生自fcγa受体的肽(fcr
‑
iiia)也是示例性的亲和配体。优选地,免疫球蛋白结合蛋白或肽是蛋白质a。配体可以包含蛋白质a的结构域e、d、a、b和c中的一个或多个。更优选地,配体包含蛋白质a或改造的蛋白质z的结构域b。使用用酿酒酵母菌(saccharomyces cerevisiae)重组生产的14kd肽作为配体的示例性树脂为igselect(ge healthcare)。这种未提供进一步信息的配体是专门设计用于对人igg
‑
fc的所有亚类具有高亲和力。
[0171]
通过在预清洗絮凝步骤之后使用蛋白质a亲和色谱步骤作为捕获步骤,本发明的方法提供了一种具有成本效益的免疫球蛋白纯化方法,同时利用了蛋白质a亲和色谱在免疫球蛋白纯化中显著的结合特异性。
[0172]
在一个优选的实施方案中,本发明提供了一种从包含免疫球蛋白和至少一种杂质的样品中纯化免疫球蛋白的方法,该方法包含按以下顺序的下列步骤:
[0173]
(a)将诱导絮凝的化合物添加至细胞培养液;
[0174]
(b)深层过滤步骤(a)的混合物;
[0175]
(c)将步骤(b)中得到的滤液暴露于蛋白质a色谱,其中免疫球蛋白与蛋白质a色谱介质结合;
[0176]
(d)使用具有ph值为5
‑
9且离子强度为0.1
‑
5.0mol/l的洗涤缓冲液洗涤蛋白质a色谱介质;和
[0177]
(e)使用具有ph值为2.5
‑
4.5的洗脱缓冲液从亲和色谱树脂上洗脱免疫球蛋白。
[0178]
在一个优选的实施方案中,用于捕获步骤的蛋白质a色谱树脂包含耐碱衍生物作为配体,其与高度交联的琼脂糖结合。在一个更优选的实施方案中,耐碱蛋白质a衍生物为蛋白质a的结构域b的碱稳定的四聚体。
[0179]
为了使蛋白质a亲和色谱树脂更能耐受严格的清洗条件并防止运行间的交叉污染影响,如今通常使用改进的蛋白质a亲和树脂,其带有专门改造的配体以确保耐碱、高结合能力和低配体渗漏。然而,这些改进树脂的一个主要缺点在于它们比传统的蛋白质a树脂要昂贵得多。本发明方法的重要优点在于既可以使用常规的蛋白质a树脂,也可以使用最近的新一代蛋白质a树脂产品。由于蛋白质a树脂暴露在更低的杂质负荷下,因此,传统的和更廉价的蛋白质a树脂变得可以接受,虽然它们受限于相当温和的再生条件。然而,由于本发明的预清洗步骤并且不依赖于所选择的蛋白质a树脂,常规树脂和新一代树脂都可以在更长的寿命内使用。而且,由于蛋白质a柱的清洗变得更容易,因此,该方法也变得更加经济。
[0180]
可以用于本发明目的的常见蛋白质a树脂的实例可以包括但不限于:unosphere supra(bio
‑
rad),protein a ceramic hyperd f(pall corporation),poros mabcapture a(applied biosystems),prosep hc,prosep ultra,和prosep ultra plus(emd millipore),protein a sepharose ff,rprotein asepharose ff,rmp protein a sepharose ff,igselect,mabselect,mabselect sure,mabselect sure lx,mabselect xtra,mabselect prisma(ge healthcare),praesto a,praesto ap,praesto apc,praesto jetted a50(purolite life sciences)和toyopearl rprotein a(tosoh bioscience)。
[0181]
当本文使用时,术语“蛋白质a”包括从其天然来源回收的蛋白质a、通过合成或生物合成方式产生的蛋白质a(例如通过肽合成或通过重组技术)及其变体,所述变体保留结合具有ch2/ch3和/或fc区的蛋白质的能力。优选地,可以使用具有高结合能力和/或碱稳定性的树脂。例如,可使用蛋白质a、蛋白质a衍生物或碱稳定的蛋白质a衍生的亲和介质。优选
地,可以使用碱稳定的蛋白质a衍生的(大肠杆菌(e.coli)、酿酒酵母(saccharomyces cerevisiae))配体。碱稳定的蛋白质a衍生的配体可以与高度交联的优选用化学稳定的硫醚键固定的琼脂糖基质偶联。一个实例为来自ge healthcare life sciences的mabselect sure,其可以在运行后使用至多0.5m naoh进行快速有效地清洗。mabselect sure的碱稳定配体来源于蛋白质a的b结构域,且必须缺乏导致更高的洗脱ph的vh3结合域。优选产品为mabselect sure lx,其具有比mabselect sure更高的结合容量。
[0182]
样品加载到蛋白质a亲和柱和从蛋白质a柱洗脱免疫球蛋白之间可以包括一个或几个使用特殊的洗涤缓冲液的洗涤步骤。洗涤缓冲液是用于从蛋白质a树脂中去除杂质、但不会去除大量与蛋白质a结合的目标免疫球蛋白的缓冲液。洗涤缓冲液可以包含盐和洗涤剂(例如聚山梨酯);盐和溶剂(例如己二醇);高浓度盐(例如高摩尔浓度tris缓冲液);或盐和聚合物(例如聚乙二醇)。此外,洗涤缓冲液可以包括离液序列高的试剂(尿素或精氨酸)和/或蛋白酶抑制剂(例如edta)。最终,洗涤缓冲液可以具有较低的ph作为加样缓冲液和/或较高ph作为洗脱缓冲液。
[0183]
为了从蛋白质a柱上洗脱目标免疫球蛋白,使用洗脱缓冲液。优选地,洗脱缓冲液具有低ph,从而通过改变蛋白质构象来破坏蛋白质a与目标免疫球蛋白之间的相互作用。优选地,低ph洗脱缓冲液具有约2至约5的ph,最优选在约3至约4。将ph控制在该范围内的缓冲液的实例包括磷酸盐、乙酸盐、柠檬酸盐、甘氨酸和铵缓冲液,以及这些的组合。
[0184]
优选的缓冲液是柠檬酸盐和乙酸盐缓冲液,最优选柠檬酸钠或乙酸钠缓冲液。也考虑其他洗脱缓冲液,包括高ph缓冲液(例如具有9或更高ph的那些)或包含化合物或组合物例如mgci2(2mm)的缓冲液,用于洗脱目标免疫球蛋白。
[0185]
蛋白质a亲和色谱树脂可以使用0.1
‑
0.5naoh再生,优选在柱内再生(原位清洗)。
[0186]
中间/精制色谱步骤:阳离子交换色谱
[0187]
如本文所述的方法还可以包含阳离子交换色谱步骤。
[0188]
阳离子交换色谱依赖于样品中蛋白质与固定在树脂上的电荷之间的电荷
‑
电荷相互作用。在阳离子交换色谱中,待结合的分子带正电荷,而固定的官能团(配体)带负电荷。常用的阳离子交换树脂为s
‑
树脂(磺酸盐)、sp树脂(磺丙基)、sib树脂(磺基异丁基)、se树脂(磺乙基)和cm树脂(羧甲基)。
[0189]
然而,通常阳离子交换色谱步骤可以用所有常见的商购阳离子交换树脂或膜进行。阳离子交换树脂可以以预装柱或膜的形式使用,官能团例如磺酸固定在其上。或者,树脂可以作为散装材料购买,色谱柱则由用户充填。除了通常的柱之外,对柱的容量和尺寸没有特别限制。本领域技术人员知晓使用的阳离子交换树脂的量和柱的尺寸。这取决于方法的总体规模。
[0190]
典型的商购产品包括例如macro
‑
prep high s、macro
‑
prep cm、unosphere rapid s、unosphere rapid s40、nuvia s和nuvia hr
‑
s(bio
‑
rad,california,usa),toyopearl cm,toyopearl sp,toyopearl sulfate 650f和toyopearl gigacap s(tosoh bioscience,德国),millipore prores s,fractogel emd coo
‑
,fractogel emd so3
‑
,fractogel emd se hicap,eshmuno cpx(merck kgaa,德国),biosepra cm ceramic hyperd,biosepra s ceramic hyperd,s hypercel(pall corperation,new york,usa),poros hs,poros xs(applied biosystems,德国),biopro iex smartsep s,biopro iex s75(ymc欧洲),
praesto sp,praesto jetted sp35(purolite life sciences,欧洲),cm
‑
sepharose ff、sp
‑
sepharose ff、s
‑
sepharose ff、sp
‑
sepharose hp、sp
‑
sepharose xl、sp
‑
sepharose big beads、cm
‑
sephadex、capto s、capto sp impres和source s(全部来自ge healthcare,德国)。
[0191]
通常,阳离子交换色谱使用ph值4
‑
7的缓冲液进行。
[0192]
本发明优选的阳离子交换树脂是使用磺酸盐、磺丙基或磺基异丁基配体的强阳离子交换剂。最优选与刚性基质连接的磺酸盐或磺丙基配体,例如高度交联的琼脂糖,例如nuvia hr
‑
s,或聚(苯乙烯乙烯基苯),例如poros 50hs,或聚甲基丙烯酸酯,例如fractogel emd so3
‑
。最优选的阳离子交换树脂为具有与交联聚(苯乙烯二乙烯基苯)基质结合的磺丙基(
‑
ch2ch2ch2so3‑
)配体的poros hs 50。
[0193]
阳离子交换色谱可以用具有约ph4至约ph 8的ph的缓冲液平衡。缓冲液浓度可以为10mm
‑
100mm,优选20mm
‑
50mm。
[0194]
用于阳离子交换色谱的缓冲液的实例为柠檬酸、乳酸、琥珀酸、甲酸、丁二酸、乙酸、丙二酸、甘氨酸、mes、pipes、磷酸盐、bistris或其混合物。
[0195]
阳离子交换色谱步骤可以分离免疫球蛋白的电荷变体,并且可以减少残留的宿主细胞蛋白质、dna、聚集物、片段、病毒、内毒素、絮凝剂和浸出的蛋白质a。
[0196]
免疫球蛋白可以在低于免疫球蛋白等电点(pi)的ph值和低电导率下与树脂结合。
[0197]
蛋白质的等电点或pi是指蛋白质具有的净总电荷等于零时的ph,即蛋白质的正和负电荷数量相等时的ph。pi的确定可以根据现有技术中建立的技术来完成,例如等电聚焦。
[0198]
低电导率是指低于2ms/cm。
[0199]
对于洗脱,可以使用洗脱缓冲液的离子强度增加,通过单一步骤或梯度提供。用于阳离子交换色谱洗脱的示例性盐为氯化物盐、硫酸盐、磷酸盐、柠檬酸盐、甲酸盐或乙酸盐。优选使用nacl或kcl。离子强度可增加到至多1m。
[0200]
或者,可以使用洗脱缓冲液的ph增加,通过单一步骤或梯度提供。
[0201]
进行阳离子交换色谱的一个优选实施方案是ph工作范围在4
‑
6,更优选ph在4.5
‑
5.5。可以使用碳酸或氨基酸作为缓冲物质,最优选柠檬酸或甘氨酸。
[0202]
在另一个优选的实施方案中,结合至阳离子交换树脂上的免疫球蛋白的洗脱通过改变ph值,即增加ph值来进行。这可以通过混合两种不同缓冲溶液提供的从低ph到高ph的梯度来实现。优选柠檬酸盐缓冲液用于低ph和磷酸盐缓冲液用于高ph。在一个优选的实施方案中,ph梯度通过将约ph 5
‑
6的柠檬酸盐缓冲液与约ph 7
‑
9的磷酸盐缓冲液混合而形成。缓冲液可以通过使用浓度为10
‑
50mm的酸的钠盐来制备。ph梯度的优选范围在5.0
‑
7.5。在另一个优选的实施方案中,ph梯度通过混合ph 8.7和ph 10.5的甘氨酸缓冲液形成。任选地,在加载到最终色谱柱之前,用例如乙酸调节洗脱池的ph。
[0203]
或者,对于洗脱,可使用洗脱缓冲液的ph和离子强度的增加,通过单一步骤或梯度提供。
[0204]
在一个实施方案中,将蛋白质a色谱的洗脱液暴露于阳离子交换色谱。
[0205]
典型地,将蛋白质a色谱的洗脱液暴露于病毒灭活步骤,然后进行阳离子交换色谱。
[0206]
因此,在一些实施方案中,本发明的方法包含以下顺序的下列步骤:
[0207]
(a)将诱导絮凝的化合物添加至细胞培养液;
[0208]
(b)深层过滤步骤(a)的混合物;
[0209]
(c)将步骤(b)中获得的滤液暴露于亲和色谱,其中免疫球蛋白与亲和色谱介质结合;
[0210]
(d)使用具有ph值为5
‑
9且离子强度为0.1
‑
5.0mol/l的洗涤缓冲液洗涤亲和色谱介质;
[0211]
(e)使用具有ph值为2.5
‑
4.5的洗脱缓冲液从亲和色谱树脂上洗脱免疫球蛋白;
[0212]
(f)将步骤(e)的洗脱液在2.5
‑
4.5的低ph值下温育至少10分钟用于病毒灭活;和
[0213]
(g)进行阳离子交换色谱。
[0214]
阳离子交换色谱树脂可用1m nacl再生3
‑
5个柱体积。而且,可以应用原位方法清洗,包含以下步骤:(a)用1
‑
5个柱体积的1m naoh、1m nacl洗涤,(b)用1
‑
5个柱体积的1m乙酸或tfa洗涤,(c)再平衡。
[0215]
精制色谱步骤:混合模式色谱
[0216]
本发明的方法可以进一步包含混合模式色谱步骤作为精制步骤,即,它在亲和色谱之后按顺序(作为单个步骤或作为几个步骤之一)进行。
[0217]
称作混合模式介质或树脂的介质为具有由带电疏水性离子交换配体或结晶矿物(例如羟基磷灰石或氟磷灰石)组成的官能团的色谱介质。有时会使用术语“多模态色谱”或与特定方法相关的“疏水电荷诱导色谱”来代替“混合模式色谱”一词。混合模式色谱是至少两个原理的相互作用,疏水相互作用和离子交换或者金属亲和相互作用和离子交换。混合模式色谱提供了较少的可预测的选择性,其无法通过单一模式色谱方法(例如离子交换或疏水相互作用色谱)分别重现。带正电荷的疏水配体属于阴离子交换剂混合模式(例如captoadhere),而带负电荷的配体属于阳离子交换剂混合模式组(例如capto mmc)。一些混合模式介质具有两性离子特性(例如bakerbond abx)。其他混合模式介质具有疏水性配体,所述配体可离子化并通过降低ph值从不带电荷转变为带正电荷(例如mep hypercel)。最后,羟基磷灰石和氟磷灰石介质通过具有带正电荷的钙离子和带负电荷的磷酸根基团而具有更复杂的混合模式功能。
[0218]
在一个优选的实施方案中,用作精制步骤的混合模式色谱利用具有疏水和阴离子交换功能的树脂。更优选包含带正电荷的n
‑
苄基
‑
n
‑
甲基乙醇胺配体的混合模式树脂,所述配体与高度交联的琼脂糖基质结合。
[0219]
在一些实施方案中,该方法包含以下顺序的下列步骤:
[0220]
(a)将诱导絮凝的化合物添加至细胞培养液;
[0221]
(b)深层过滤步骤(a)的混合物;
[0222]
(c)将步骤(b)中获得的滤液暴露于亲和色谱,其中免疫球蛋白与亲和色谱介质结合;
[0223]
(d)使用具有ph值为5
‑
9且离子强度为0.1
‑
5.0mol/l的洗涤缓冲液洗涤亲和色谱介质;
[0224]
(e)使用ph值为2.5
‑
4.5的洗脱缓冲液从亲和色谱树脂上洗脱免疫球蛋白;
[0225]
(f)将步骤(e)的洗脱液在2.5
‑
4.5的低ph值下温育至少10分钟用于病毒灭活;
[0226]
(g)进行阳离子交换色谱;和
[0227]
(h)进行混合模式色谱。
[0228]
优选地,混合模式色谱步骤在阳离子交换色谱之后。更优选地,在阳离子交换色谱之后的混合模式色谱步骤使用包含带正电荷的配体的介质进行。更优选地,所述带正电荷的配体为n
‑
苄基
‑
n
‑
甲基乙醇胺,且该配体与高度交联的琼脂糖结合。
[0229]
当以结合和洗脱模式加载带正电荷的混合模式色谱树脂时,可以应用以下条件:ph 6至ph 9,优选地,ph 7.0
‑
8.5;电导率0.5
‑
10ms/cm,优选1
‑
4ms/cm。可以使用一个或多个洗涤步骤。条件取决于免疫球蛋白的pi,并且可以根据所需的分离进行具体调整。
[0230]
用于精制步骤(d)的最优选的混合模式树脂为captoadhere(ge healthcare life science)。
[0231]
结合模式的captoadhere色谱的优选加载条件可以如下:用0.5m磷酸钠、ph 8.2,然后20mm磷酸钠、ph 8.2平衡树脂。将样品(阳离子交换池)调节至ph 8.0
‑
8.5和1
‑
4ms/cm的电导率并上柱。用平衡缓冲液20mm磷酸钠、ph 8.2洗涤后,可以从captoadhere树脂上洗脱目标免疫球蛋白,例如用20mm磷酸钠、ph 5
‑
7,优选ph 5.5
‑
6.5。
[0232]
或者,captoadhere色谱可以在流穿模式下进行。因此,必须以下述方式调节ph和离子强度:其使免疫球蛋白不与混合模式配体结合,而待清除的残留污染物(dna、聚集物、浸出的蛋白质a、宿主细胞蛋白质)保持结合。所述条件取决于免疫球蛋白的pi。优选地,使用磷酸盐或tris缓冲液,ph范围为6.5
‑
8.5,更优选ph 7
‑
8。用盐例如nacl或缓冲液浓度调节电导率。最优选的是浓度范围为10
‑
50mm的磷酸钠缓冲液,其中补充有浓度范围为50
‑
200mm的nacl。必须考虑,高盐浓度虽然解吸附离子相互作用,但促进与配体的疏水相互作用。
[0233]
混合模式树脂的再生(原位清洗)可以在低ph、高盐和高ph条件下进行,例如使用10
‑
200mm柠檬酸、0.5
‑
2m nacl和10mm
‑
1m naoh。
[0234]
优选的再生方法通过用溶液a至d连续洗涤进行:溶液a:100mm柠檬酸、2m nacl;溶液b:2m nacl;溶液 c:1m naoh;溶液d:10mm naoh。可以在溶液d中进行树脂的储存。
[0235]
在进一步优选的实施方案中,本发明的方法包含以下顺序的下列步骤:
[0236]
‑
将诱导絮凝的化合物添加至细胞培养液;
[0237]
‑
深层过滤;
[0238]
‑
亲和色谱,其中免疫球蛋白与亲和色谱介质结合;
[0239]
‑
使用具有ph值为5
‑
9且离子强度为0.1
‑
5.0mol/l的洗涤缓冲液洗涤亲和色谱介质;
[0240]
‑
使用具有ph值为2.5
‑
4.5的洗脱缓冲液从亲和色谱树脂上洗脱免疫球蛋白;和
[0241]
‑
强阳离子交换色谱,其中免疫球蛋白与强阳离子交换色谱树脂结合,并且通过从强阳离子交换色谱树脂上解吸免疫球蛋白而得到洗脱液中的免疫球蛋白;和
[0242]
‑
带正电荷的混合模式色谱;其中树脂用ph 8
‑
8.5的磷酸盐缓冲液平衡,免疫球蛋白与带正电荷的混合模式色谱树脂结合,并且用ph 5
‑
7的磷酸盐缓冲液进行免疫球蛋白的洗脱。
[0243]
精制色谱步骤:阴离子交换色谱
[0244]
本发明的方法可以进一步包含作为精制步骤的阴离子交换色谱步骤,即,它在亲和色谱之后按顺序(作为单个步骤或作为几个步骤之一)进行。
[0245]
称作阴离子交换介质或树脂的介质是具有由带正电荷的离子交换配体组成的官能团的色谱介质。阴离子交换色谱介质可以为强或弱的阴离子交换色谱介质,包括阴离子交换膜。
[0246]
在阴离子交换色谱中,待结合的分子带负电,且固定的官能团(配体)带正电。常用的阴离子交换色谱介质为q介质(季胺配体)、tmae树脂(三甲氨基乙基配体)和deae树脂(二乙氨基乙基配体)。然而,通常阴离子交换色谱步骤可以使用所有常见的商购阴离子交换介质进行。阴离子交换介质可以以预装柱或膜的形式使用。或者,树脂可以作为散装材料购买,而色谱柱则由用户充填。除了通常的柱之外,对柱的容量和尺寸没有特别限制。本领域技术人员知晓所要用的阴离子交换色谱介质的量和柱的尺寸。这取决于工艺的总体规模。
[0247]
具体而言,已发现强阴离子交换色谱介质可有效去除残留杂质。
[0248]
优选地,使用包含选自季氨乙基(qae)部分、季铵部分和三甲基铵部分的配体的强阴离子交换色谱介质。
[0249]
可以用于本发明目的的典型强阴离子交换色谱包含官能团,例如:季氨乙基(qae)部分,树脂包括例如toyopearl qae(购自tosoh bioscience,德国)、selectacel qae(纤维素的季氨乙基衍生物,购自polysciences inc.,pennsylvania usa)、qae sephadex(购自ge healthcare,德国)等;季铵(q)部分,树脂包括例如q sepharose xl、q sepharose ff、q sepharose hp、q sepharose cl
‑
4b、q sepharose big beads、source q、resource q、capto q、capto q impres(全部购自ge healthcare,德国)、poros hq(applied biosystems,德国)、qhypercel、biosepra q ceramic hyperd(购自pall,new york,usa)macro prep high q(bio
‑
rad,california,usa)、toyopearl super q(购自tosoh bioscience,德国)、unosphere q(购自bio
‑
rad,california,usa)、biopro iex smartsep q(ymc欧洲)、praesto q、praesto jetted q35(purolite life sciences,欧洲),三甲基铵乙基(tmae),包括例如fractogel emd tmae(merck kgaa,德国),和三甲基铵树脂,包括例如nuvia q(购自bio
‑
rad,california,usa)。
[0250]
更优选地,阴离子交换色谱可以为强阴离子交换色谱,其使用强阴离子交换色谱树脂进行,该树脂具有与高度交联的琼脂糖结合的
–
n(ch3)
3+
(三甲基铵)(例如capto q,购自ge health care,德国),或具有类似特性的介质。
[0251]
在一些实施方案中,该方法包含以下顺序的下列步骤:
[0252]
(a)将诱导絮凝的化合物添加至细胞培养液;
[0253]
(b)深层过滤步骤(a)的混合物;
[0254]
(c)将步骤(b)中获得的滤液暴露于亲和色谱,其中免疫球蛋白与亲和色谱介质结合;
[0255]
(d)使用具有ph值为5
‑
9且离子强度为0.1
‑
5.0mol/l的洗涤缓冲液洗涤亲和色谱介质;
[0256]
(e)使用ph值为2.5
‑
4.5的洗脱缓冲液从亲和色谱树脂上洗脱免疫球蛋白;
[0257]
(f)将步骤(e)的洗脱液在2.5
‑
4.5的低ph值下温育至少10分钟用于病毒灭活;
[0258]
(g)进行阳离子交换色谱;和
[0259]
(h)进行阴离子交换色谱。
[0260]
另一个优选的实施方案包含在结合模式的阳离子交换色谱步骤之后的流穿模式
的阴离子交换色谱。
[0261]
因此,本发明的优选实施方案提供了一种具有以下顺序的下列步骤的方法:
[0262]
‑
将诱导絮凝的化合物添加至细胞培养液;
[0263]
‑
深层过滤;
[0264]
‑
亲和色谱,其中免疫球蛋白与亲和色谱介质结合;
[0265]
‑
使用具有ph值为5
‑
9且离子强度为0.1
‑
5.0mol/l的洗涤缓冲液洗涤亲和色谱介质;
[0266]
‑
使用具有ph值为2.5
‑
4.5的洗脱缓冲液从亲和色谱树脂上洗脱免疫球蛋白;和
[0267]
‑
强阳离子交换色谱,其中免疫球蛋白与强阳离子交换色谱树脂结合,并且通过从强阳离子交换色谱树脂上解吸免疫球蛋白而得到洗脱液中的免疫球蛋白;和
[0268]
‑
强阴离子交换色谱;其中免疫球蛋白不与强阴离子交换色谱树脂结合,并且得到流穿中的免疫球蛋白。
[0269]
最优选的阴离子交换色谱树脂为capto q(ge health care,德国)。流穿模式的capto q色谱的优选加载条件可以如下:用25mm tris缓冲液ph 8平衡树脂,并且使用相同的缓冲液进行色谱。
[0270]
优选的再生方法通过用溶液a至c连续洗涤来进行:溶液a:2m nacl;溶液b:1m naoh;溶液c:10mm naoh。可以在溶液c中进行树脂的储存。
[0271]
深层过滤
[0272]
此外,本发明的方法可以包含一个或多个深层过滤步骤。与通过将颗粒保留在膜表面上而进行分离的膜过滤器不同,深层过滤器由纤维或珠的基质组成,其中分离发生在整个基质中而不是在其表面上。
[0273]
深层过滤器的实例包括但不限于:pall sxl系列(例如sxlp700416和sxlpde2408sp囊形过滤器,pall hp系列(例如pdd1、pde2、pdh4、pdk5、pekm)(pall corporation),millistak系列(例如xohc,fohc、dohc、alhc和blhc pod过滤器),hc
‑
pro系列,clarisolve系列(例如40ms)(emd millipore),或zeta plus系列(90zb08、30za/60za、60zn90za、delipid、vr07和vr05囊形过滤器)(3m)。
[0274]
优选地,深层过滤器由预先提取的无机助滤剂、纤维素和赋予过滤器基质强正电荷的树脂系统组成,例如来自英国3m的zeta plus。
[0275]
另一个优选的过滤器模块为emphaze aex混合纯化器(3m),其为具有阴离子交换功能的深层过滤器。
[0276]
用于本发明的最优选的深层过滤器是来自pall corporation的pde2、pdh4和p700系列的囊形过滤器。
[0277]
进行深层过滤的工艺参数包含100
‑
2000l/m2、优选200
‑
1500l/m2、更优选低于1200l/m2且最优选400
‑
1000l/m2的容量负荷,0.2
‑
2.0巴、优选0.4
‑
0.6巴的压力和室温。
[0278]
在另一个实施方案中,纯化可以包括在第一色谱步骤之前的一个或多个过滤步骤。在一个优选的实施方案中,纯化可以包括一个离心步骤和一个或多个过滤步骤。在另一个优选的实施方案中,第一色谱步骤之前是深层过滤和微孔过滤步骤,它们在絮凝后进行。在更优选的实施方案中,第一色谱步骤之前是细胞分离步骤、絮凝步骤、深层过滤步骤和微孔过滤步骤。使用带正电和/或带负电的膜的额外过滤步骤可以包括在过滤操作中,从而在
絮凝之后和捕获色谱步骤之前使样品澄清。组合了带电和不带电的不同材料的过滤器模块也包括在优选实施方案中。
[0279]
优选地,所述深层过滤器包含一个以上的层。例如,深层过滤可使用双层过滤器。
[0280]
超滤、病毒过滤、微孔过滤
[0281]
此外,本发明的方法可以包含一个或多个微孔过滤、超滤和/或纳滤步骤。超滤是一种膜过滤形式,其中压力迫使液体通过半透膜。悬浮的固体和高分子量溶质被截留,而水和低分子量溶质通过膜。超滤是一种常用的分离、纯化和浓缩大分子溶液,尤其是蛋白质溶液的方法。超滤可以与渗滤组合。此模式适用于缓冲液交换,通过重复或连续的稀释和重新浓缩从溶液中去除盐和其他微物质。超滤可以在切向流过滤或交叉流过滤系统(tff或tf
‑
uf)中使用堆叠的膜进行,特别是对于处理大样品体积。或者,中空纤维系统通常用于超滤。膜截留尺寸的范围约为1
‑
300kd。对于免疫球蛋白,超滤膜的典型截留值为10
‑
100kd。在本发明的框架内,uf膜的30或50kd的截留分子量是优选的。
[0282]
微孔过滤是一种使用0.1
‑
10μm孔径的膜的颗粒过滤方法。对于对环境有特殊要求的无菌过滤而言,使用孔径约为0.2μm的无菌微孔过滤器。使用具有更大孔径(0.45μm,3μm)的另外的预过滤器是常见的。这阻止了由于快速堵塞小孔径过滤器而导致流量减小。
[0283]
最后,在生物药品生产中,纳滤主要用于病毒过滤,并且是哺乳动物细胞培养物中生产的治疗性蛋白质的安全性所必需的。纳滤步骤通常在下游末期接近于装填大量纯化的免疫球蛋白时进行。常用的纳滤器孔径为15
‑
35nm(planova,asahi kasei,日本;或viresolve,emd
‑
millipore,德国)。
[0284]
在本发明范围内,术语“纳滤”和“病毒过滤”可以以同义的方式使用。
[0285]
本发明提供了一种从包含免疫球蛋白和至少一种杂质的细胞培养液中纯化免疫球蛋白的方法,该方法包含按以下顺序的下列步骤:
[0286]
‑
离心和/或过滤细胞培养液;
[0287]
‑
向上清液或滤液中加入诱导絮凝的化合物;
[0288]
‑
深层过滤;
[0289]
‑
微孔过滤;
[0290]
‑
亲和色谱,其中免疫球蛋白与亲和色谱介质结合;
[0291]
‑
使用具有ph值为5
‑
9且离子强度为0.1
‑
5.0mol/l的洗涤缓冲液洗涤亲和色谱介质;和
[0292]
‑
使用具有ph值为2.5
‑
4.5的洗脱缓冲液从亲和色谱树脂上洗脱免疫球蛋白。
[0293]
在本发明的一个优选的实施方案中,纯化方法包含一个或多个超滤/渗滤和/或纳滤步骤。这些过滤步骤可以使用商购的过滤装置进行,例如购自pall corporation、ge healthcare、emd
‑
millipore或sartorius的装置。
[0294]
在另一个实施方案中,该方法包含以下的进一步的步骤:将从亲和色谱或精制步骤获得的洗脱液或由其衍生并在所述色谱步骤之后进行的一个或多个进一步处理步骤之后获得的组合物暴露于纳滤。优选地,能够截留细小病毒属的过滤器(最优选具有15
‑
35nm孔径)可用于纳滤。
[0295]
在一些实施方案中,本发明提供了一种从包含免疫球蛋白和至少一种杂质的细胞培养液中纯化免疫球蛋白的方法,该方法包含按以下顺序的下列步骤:
[0296]
‑
将诱导絮凝的化合物添加至细胞培养液;
[0297]
‑
深层过滤;
[0298]
‑
亲和色谱,其中免疫球蛋白与亲和色谱介质结合;
[0299]
‑
使用具有ph值为5
‑
9且离子强度为0.1
‑
5.0mol/l的洗涤缓冲液洗涤亲和色谱介质;
[0300]
‑
使用具有ph值为2.5
‑
4.5的洗脱缓冲液从亲和色谱树脂上洗脱免疫球蛋白;
[0301]
‑
阳离子交换色谱,其中免疫球蛋白与阳离子结合色谱树脂结合,并且通过从阳离子交换色谱树脂上解吸免疫球蛋白而得到洗脱液中的免疫球蛋白;
[0302]
‑
混合模式色谱,其中免疫球蛋白与混合模式色谱树脂结合,并且通过从混合模式色谱树脂上解吸蛋白质而得到洗脱液中的免疫球蛋白,或者免疫球蛋白不与混合模式色谱树脂结合并且在流穿中得到免疫球蛋白;和
[0303]
‑
通过病毒过滤器过滤洗脱液,随后任选地进行超滤/渗滤步骤。
[0304]
在另外的实施方案中,本发明提供了一种从包含免疫球蛋白和至少一种杂质的细胞培养液中纯化免疫球蛋白的方法,该方法包含按以下顺序的下列步骤:
[0305]
‑
将诱导絮凝的化合物添加至细胞培养液;
[0306]
‑
深层过滤;
[0307]
‑
亲和色谱,其中免疫球蛋白与亲和色谱介质结合;
[0308]
‑
使用具有ph值为5
‑
9且离子强度为0.1
‑
5.0mol/l的洗涤缓冲液洗涤亲和色谱介质;
[0309]
‑
使用具有ph值为2.5
‑
4.5的洗脱缓冲液从亲和色谱树脂上洗脱免疫球蛋白;
[0310]
‑
阳离子交换色谱,其中免疫球蛋白与阳离子交换色谱树脂结合,并且通过从阳离子交换色谱树脂上解吸免疫球蛋白而得到洗脱液中的免疫球蛋白;
[0311]
‑
阴离子交换色谱,其中免疫球蛋白不与阴离子交换色谱树脂结合,并且在流穿中得到免疫球蛋白;和
[0312]
‑
通过病毒过滤器过滤洗脱液,随后任选地为超滤/渗滤步骤。
[0313]
在一个优选的实施方案中,本发明提供了一种从包含免疫球蛋白和至少一种杂质的细胞培养液中纯化免疫球蛋白的方法,该方法包含按以下顺序的下列步骤:
[0314]
‑
将诱导絮凝的化合物添加至细胞培养液;
[0315]
‑
深层过滤该混合物;
[0316]
‑
使滤液暴露于亲和色谱,其中免疫球蛋白与亲和色谱介质结合;
[0317]
‑
使用具有ph值为5
‑
9且离子强度为0.1
‑
5.0mol/l的洗涤缓冲液洗涤亲和色谱介质;
[0318]
‑
使用具有ph值为2.5
‑
4.5的洗脱缓冲液从亲和色谱树脂上洗脱免疫球蛋白;
[0319]
‑
阳离子交换色谱,其中免疫球蛋白与阳离子结合色谱树脂结合,并且通过从阳离子交换色谱树脂上解吸蛋白质而得到洗脱液中的免疫球蛋白;
[0320]
‑
混合模式色谱。其中免疫球蛋白与混合模式色谱树脂结合,并且通过从混合模式色谱树脂上解吸蛋白质而得到洗脱液中的免疫球蛋白;
[0321]
‑
纳滤;和
[0322]
‑
超滤/渗滤。
[0323]
在进一步优选的实施方案中,本发明提供了一种从包含免疫球蛋白和至少一种杂质的细胞培养液中纯化免疫球蛋白的方法,该方法包含按以下顺序的下列步骤:
[0324]
‑
将诱导絮凝的化合物添加至细胞培养液;
[0325]
‑
深层过滤;
[0326]
‑
亲和色谱,其中免疫球蛋白与亲和色谱介质结合;
[0327]
‑
使用具有ph值为5
‑
9且离子强度为0.1
‑
5.0mol/l的洗涤缓冲液洗涤亲和色谱介质;
[0328]
‑
使用具有ph值为2.5
‑
4.5的洗脱缓冲液从亲和色谱树脂上洗脱免疫球蛋白;
[0329]
‑
阳离子交换色谱,其中免疫球蛋白与阳离子结合色谱树脂结合,并且通过从阳离子交换色谱树脂上解吸免疫球蛋白而得到洗脱液中的免疫球蛋白;
[0330]
‑
阴离子交换色谱,其中免疫球蛋白不与阴离子交换色谱树脂结合,并且在流穿中得到免疫球蛋白;和
[0331]
‑
纳滤;和
[0332]
‑
超滤/渗滤。
[0333]
病毒灭活
[0334]
通过细胞培养生产的重组蛋白质药物、例如单克隆抗体的生产过程需要去除病毒和/或灭活,因为担心会意外地污染来自原材料或生产步骤中的病毒。因此,对产生来自细胞培养物的生物治疗蛋白质的每个制造方法的病毒安全性都有相当的监管要求。
[0335]
在亲和捕获色谱之后,通过将洗脱液保持在低ph值进行病毒灭活步骤。优点在于从亲和基质中的低ph洗脱。在这样的酸性水溶液环境中,许多病毒、尤其是包膜型病毒不稳定并且分解。
[0336]
低ph是指2
‑
5的ph值,优选2.5
‑
4.5,更优选3
‑
4。
[0337]
在一个优选的实施方案中,用于病毒灭活的温育时间为10min至2小时,更优选30min至90min,最优选45min至75min。
[0338]
在一个优选的实施方案中,病毒灭活在室温下搅拌进行,温育后ph升高。
[0339]
本发明提供了一种从包含免疫球蛋白和至少一种杂质的细胞培养液中纯化免疫球蛋白的方法,该方法包含按以下顺序的下列步骤:
[0340]
(a1)通过沉降使细胞与细胞培养液分离;
[0341]
(a)将诱导絮凝的化合物添加至细胞培养液;
[0342]
(b)深层过滤步骤(a)的混合物;
[0343]
(c)将步骤(b)中获得的滤液暴露于亲和色谱,其中免疫球蛋白与亲和色谱介质结合;
[0344]
(d)使用具有ph值为5
‑
9、离子强度为0.1
‑
5.0mol/l的洗涤缓冲液洗涤亲和色谱介质;
[0345]
(e)使用具有ph值为2.5
‑
4.5的洗脱缓冲液从亲和色谱树脂上洗脱免疫球蛋白;
[0346]
(f)将步骤(e)的洗脱液在2.5
‑
4.5的低ph下温育至少10分钟用于病毒灭活;
[0347]
(g)将步骤(f)中病毒失活后的洗脱液,或由其衍生的并且在步骤(f)之后进行的一个或多个进一步处理步骤后获得的组合物暴露于阳离子交换色谱,其中免疫球蛋白与阳离子交换碎片树脂结合,并且通过从阳离子交换色谱树脂上解吸蛋白质而得到洗脱液中的
免疫球蛋白;
[0348]
(h)将在步骤(g)中获得的洗脱液,或由其衍生的并且在步骤(g)之后进行的一个或多个进一步处理步骤后获得的组合物暴露于混合模式色谱,其中免疫球蛋白与混合模式色谱树脂结合,并且通过从混合模式色谱树脂中解吸蛋白质获得洗脱液中的免疫球蛋白;
[0349]
(i)将在步骤(h)中获得的洗脱液,或由其衍生的并且在步骤(h)之后进行的一个或多个进一步处理步骤后获得的组合物暴露于纳滤;和
[0350]
(j)将步骤(i)的滤液,或由其衍生的并且在步骤(i)之后进行的一个或多个进一步处理步骤后获得的组合物暴露于超滤/渗滤。
[0351]
在另外的实施方案中,步骤h)如下:
[0352]
(h)将在步骤(g)中获得的洗脱液,或由其衍生的并且在步骤(g)之后进行的一个或多个进一步处理步骤后获得的组合物暴露于混合模式色谱,其中免疫球蛋白不与混合模式色谱树脂结合,并且从混合模式色谱树脂的流穿中获得免疫球蛋白。
[0353]
或者,可以使用阴离子交换色谱替代混合模式色谱,并且步骤h)如下:
[0354]
(h)将在步骤(g)中获得的洗脱液,或由其衍生的并且在步骤(g)之后进行的一个或多个进一步处理步骤后获得的组合物暴露于阴离子交换色谱,其中免疫球蛋白不与阴离子交换色谱树脂结合,并且从阴离子交换色谱树脂的流穿中获得免疫球蛋白。
[0355]
在一个优选的实施方案中,所述超滤/渗滤是免疫球蛋白纯化的最后一步,且步骤(c)、(g)和(h)没有进行另外的色谱操作。
实施例
[0356]
参考以下实施例支持和示例本发明纯化免疫球蛋白的方法。必须强调,这些实施例不应当被解释为以任何方式限制本发明的范围。
[0357]
实施例1:免疫球蛋白和细胞培养物
[0358]
本发明的方法既不依赖于特异性抗体,也不依赖于用于表达免疫球蛋白的特定宿主细胞。表达模式和选择的培养条件也是如此,这些条件经过优化以在收获时获得最大收率。在本发明方法的开发过程中使用了不同的单克隆抗体。根据本发明的方法,它们以各种规模成功地纯化。表中列出的大多数选定实验使用贝伐珠单抗进行,贝伐珠单抗是一种人源化的抗
‑
vegf的igg1抗体。此外,还使用曲妥珠单抗(一种人源化抗
‑
her2的igg1抗体)和地诺单抗(一种完全人抗
‑
rankl的igg2抗体)进行一些其他实验。所有三种抗体都在cho细胞中重组表达,cho细胞在不同规模的补料分批培养中繁殖。开发阶段的大部分絮凝实验均使用实验室规模的10l或中试规模的100l或200l的培养液进行。实施例中使用的生产规模和最大培养体积为5000l。一些实验使用1000l的较小生产规模进行。除非另有说明,否则规模始终是指培养物体积。
[0359]
实施例2:比较不同絮凝剂(表1
‑
3)
[0360]
使用产生igg1亚类人源化抗体(贝伐珠单抗)的cho细胞的中试规模(100l)培养物以不同系列进行表1
‑
3的絮凝实验。抗体的滴度在1.16
‑
1.52g/l。在发酵结束时,在细胞分离之前,将絮凝剂加入到20ml细胞培养液的等分试样中。以不同的浓度测试三种不同的阳离子物质。1)pdadmac=聚(二烯丙基二甲基氯化铵),2)壳聚糖,和3)氯化钙。pdadmac作为10%(w/v)溶液购买(emd millipore)。壳聚糖作为固体物质购买(sigma),以1%(w/v)溶解
在0.1m乙酸中。壳聚糖的ph操作范围约为4.5
‑
5.0。使用储备水溶液添加氯化钙。
[0361]
实验按照以下步骤顺序进行:
[0362]
‑
从发酵液中采集20ml的等分试样
[0363]
‑
加入絮凝剂
[0364]
‑
在室温在搅拌下温育15min
[0365]
‑
以4600rpm/10min离心(thermo scientific台式离心机)
[0366]
‑
微孔过滤(pvdf,0.2μm,emd millipore)
[0367]
‑
浊度、hcdna和hcp分析
[0368]
为了评估不同浓度的不同絮凝剂的直接影响,没有进行深层过滤。离心步骤去除絮状物、细胞和细胞碎片。随后的微孔过滤去除剩余的颗粒。对于对照(零值),不添加絮凝剂且不进行温育。然而,样品在分析之前被离心和过滤。基于蛋白质a的hplc方法测定抗体浓度。
[0369]
表1a:使用pdadmac絮凝对降低hcdna和浊度的影响
[0370][0371]
表1b:使用壳聚糖絮凝对降低hcdna和浊度的影响
[0372][0373]
表1c: 使用cacl2絮凝对hcdna和浊度的影响
[0374][0375]
表1a
‑
1c显示了使用三种不同絮凝剂的絮凝对hcdna和浊度降低的结果。hcdna由quant
‑
it
tm
高灵敏度dsdna检测试剂盒(thermo fisher)和qpcr(prepseq
tm
残留dna样品制备试剂盒和resdnaseq
tm
定量cho dna试剂盒,thermo fisher)测定。浊度测量在hach turbidimeter 2100q中进行并表示为formazin浊度单位(fnu)。该仪器测量来自与入射红外光成90度角的样品的散射光。
[0376]
表1a显示至多0.09%(w/v)的pdadmac的效果。使用最低浓度(0.025%w/v)时,hcdna已经几乎完全去除(减少99.9%,三个数量级)。使用0.075%(w/v)pdadmac可以达到浊度降低87%。在本实验中,更高的pdadmac浓度无法达到进一步的浊度降低。
[0377]
表1b显示的壳聚糖结果表明有效的hcdna去除,但是是在比pdadmac所需浓度更高的浓度下。在0.4%(w/v)下获得了约91.5%的减少。关于浊度的降低,测定到不超过19%的降低。
[0378]
cacl2实验的结果如表1c所示。同样对于这种絮凝剂,获得了非常有效的hcdna减少。在70mm下测定99%的减少,在120mm cacl2测定99.9%的减少。浊度的降低与壳聚糖相比更大,但与pdadmac相比更低。在120mm时可达到约63%的减少。没有测试更高的cacl2浓度。
[0379]
结论(表1a
‑
c):hcdna的初始浓度(即无絮凝的对照)分别为62.9μg/ml细胞培养物上清液和51.1mg/g igg。对于所有测试的絮凝剂和浓度均未检测到总蛋白质或抗体的损耗。同样,未观察到絮凝导致的细胞破裂增加。令人惊奇地,很明显hcdna对浊度几乎没有影响(如果有的话)。例如,使用0.4%(w/v)壳聚糖时,约91.5%的hcdna被絮凝并去除,而浊度几乎没有降低,并且保持为对照的82%(表1b)。对于降低hcdna和浊度二者而言,絮凝剂pdadmac更优。
[0380]
表2a:使用pdadmac絮凝对hcp减少的影响
[0381][0382]
表2b: 使用壳聚糖絮凝对hcp减少的影响
[0383][0384]
表2c:使用氯化钙絮凝对hcp减少的影响
[0385][0386]
表2a
‑
2c显示了使用三种不同絮凝剂的絮凝对hcp减少的结果。hcp通过使用cho hcp elisa试剂盒3g(cygnus technologies)测量。
[0387]
表2a显示pdadmac对hcp去除的影响。即使应用测试的最高浓度(0.09%w/v),也仅减少了约10.8%。
[0388]
如表2b中所示,壳聚糖作为絮凝剂对hcp减少的影响不显著。在0.2%(w/v)时,测定最佳减少约为8.1%。
[0389]
如表2c中所示,在cacl2实验中获得了更好的hcp减少。在70mm时测定减少29.1%。较高的浓度可能会导致更好的减少,但未进行测试。
[0390]
结论(表2a
‑
c):hcp的初始浓度为1.4
‑
2.3mg/ml。按质量计,这比hcdna的载量高约20
‑
40倍。此外,很明显,hcp对浊度几乎没有贡献。例如0.075%(w/v)pdadmac将浊度降低约87%(表1a),而hcp仅降低约9%(表2a)。对于通过絮凝减少hcp而言,cacl2是更优的。下表3a
‑
3c概括了为降低hcdna、浊度和hcp测试的三种絮凝剂的有利浓度。
[0391]
表3a: 用于减少hcdna的不同絮凝剂的有利浓度
[0392]
絮凝剂浓度减少
pdadmac0.025%w/v99.9%壳聚糖0.400%w/v91.5%cacl270mm99.1%
[0393]
表3b:用于降低浊度的不同絮凝剂的有利浓度
[0394]
絮凝剂浓度降低pdadmac0.075%w/v87.2%壳聚糖0.200%w/v19.1%cacl2120mm62.8%
[0395]
表3c:用于减少hcp的不同絮凝剂的有利浓度
[0396]
絮凝剂浓度减少pdadmac0.090%w/v10.8%壳聚糖0.200%w/v8.1%cacl270mm29.1%
[0397]
由于其阳离子性质,所有三种絮凝剂都能够有效去除hcdna。由于本发明的最初问题主要与在蛋白质a洗脱池中观察到的浊度有关,因此选择pdadmac作为最适合的絮凝剂。这种聚合物可以在较低浓度下使用,并且出人意料地导致在已经测试的最低浓度下几乎完全去除hcdna。
[0398]
实施例3:使用pdadmac的进一步絮凝实验(表4
‑
6)
[0399]
在随后的更广泛的测试系列中,使用来自表达贝伐珠单抗的六种不同细胞培养物的样品,在平行实验中研究了pdadmac对hcdna和浊度降低的影响。测试方法与实施例2所述相同。未絮凝的上清液(对照)的范围为44.3
‑
62.9μg/ml hcdna、19.9
‑
29.1fnu浊度和1.24
‑
2.14mg/ml hcp。抗体滴度为1.16
‑
1.52mg/ml。测试了五种不同的pdadmac浓度,并计算了减少%的平均值。
[0400]
表4a:pdadmac浓度对不同细胞培养物批次中hcdna减少的影响
[0401][0402]
表4a中的结果再次证实了阳离子聚合物pdadmac对hcdna絮凝的高潜力。已经通过测试的最低浓度(0.025%w/v)在所有六种细胞培养物中获得了几乎100%的减少。在下游处理的早期步骤中几乎定量地去除hcdna非常有利,并且减轻了后续过滤和捕获色谱的负担。
[0403]
降低浊度是开发预清洗步骤的最重要需求。对于表达igg1或igg2抗体(例如贝伐珠单抗、曲妥珠单抗和地诺单抗)的几种细胞培养物,从捕获色谱柱洗脱的浓缩溶液中出现混浊。在本发明的实验中观察到,如果工艺步骤不间断地进行,则预清洗步骤中浊度的降低也防止了捕获色谱之后的混浊。没有观察到蛋白质a洗脱池中再次出现混浊。
[0404]
表4b:pdadmac浓度对不同细胞培养物批次浊度降低的影响
[0405][0406]
表4b中显示的结果支持使用pdadmac作为絮凝剂。使用0.05%(w/v),细胞培养物的平均降低超过80%。浓度为0.075%(w/v)时,平均降低约88%。更高的浓度(0.09%w/v)没有获得进一步增加。
[0407]
在另一项研究中,对pdadmac絮凝(无后续深层过滤)进行了评估,用于高密度细胞培养物进料流的初步澄清。与在先的实验相反,细胞培养物样品是选定的1000l发酵规模(细胞密度9.3x 106细胞/ml)的等分试样,其表达贝伐珠单抗。
[0408]
根据下列步骤顺序进行实验:
[0409]
‑
从发酵液中收集40ml的等分试样(50ml试管)
[0410]
‑
加入不同浓度的絮凝剂
[0411]
‑
在室温在适度搅拌下温育15min
[0412]
‑
以3000rpm/2000g/5min离心
[0413]
‑
微孔过滤(millex filter,0.2μm,emd millipore)
[0414]
‑
立刻分析浊度
[0415]
‑
对mab浓度、hcdna和hcp进行后续分析
[0416]
表5概括了本研究的结果。浊度使用hach turbidimeter 2100q测量,并且与之前
的实验不同,表示为比浊法浊度单位(ntu)。该仪器测量来自与入射白光成90度角的样品的散射光。
[0417]
表5:pdadmac的剂量测定
[0418][0419]
表5中显示的结果证实了先前关于hcdna、浊度和hcp降低的发现(参见表1a、2a、4a和4b)。将pdadmac的最佳剂量定义为导致上清液浊度显著降低的聚合物的最小浓度。添加更高浓度的pdadmac可能并无益处。较高的浓度可能仅导致略低的浊度水平(参见表5,0.1%w/v pdadmac),或可能导致上清液中目标产物的浓度略有降低(直到0.1%w/v pdadmac才观察到),或促进更快的浊度恢复(参见表6)。较高的浓度还可能导致产生一些较小的絮凝物,其可能会穿透深层过滤器。最佳pdadmac浓度范围在0.0375
‑
0.075%(w/v)。这是指在本实验条件下约40
‑
80pg/细胞。在此范围内,hcdna降低100%,浊度降低约92
‑
97%,且hcp降低7
‑
8%。必须强调的是,絮凝没有造成可检测到的mab损耗。
[0420]
使用与表5的实验相同的起始材料进行进一步的实验,其中监测进行絮凝、离心和微孔过滤后的浊度稳定性。采用与实施例1中所述相同的方法。在与三种浓度的pdadmac(0.0375%w/v、0.075%w/v和0.09%w/v)絮凝后,将无菌过滤的上清液的浊度在室温下测量24小时。平行研究结果表明,离心和微孔过滤不能去除残留的游离pdadmac。相反,色谱步骤(例如蛋白质a)定量去除了该聚合物。表6显示了稳定性实验的结果和混浊重新出现的动力学。
[0421]
表6:用pdadmac絮凝后过滤的培养液的稳定性
[0422][0423]
令人惊奇地,3小时后浊度水平增加,表明正在发生沉淀。效果很大程度上取决于pdadmac浓度。对于0.0375%(w/v),3小时后浊度增加25%,然而,对于0.09%(w/v),增加约78%。24小时后,在最高pdadmac浓度下的浊度达到无絮凝(对照)值(参见表4b)。最初通过絮凝降低浊度的方法被废止。
[0424]
从这些结果可以得出结论:1)絮凝和过滤后的上清液需要快速进一步处理(深层过滤、蛋白质a色谱)和2)必须选择最低有效量的pdadmac。与0.075%(w/v)相比,0.0375%(w/v)的上清液的稳定性要好得多,多达8小时几乎没有增加。这是常规生产可接受的时间窗口。
[0425]
实施例4:使用和不使用絮凝的深层过滤实验
[0426]
在大规模(5,000l)发酵液中使用0.0375
‑
0.075%(w/v)pdadmac进行絮凝时,细胞分离器(其随后去除絮状物和细胞)的负载很高,且运行后的清洗变得相当耗时。发酵罐也是如此,必须去除残留的絮凝物。因此,进一步的实验测试了替代的预清洗策略以克服这一缺点。
[0427]
首先,研究是否可以省略絮凝步骤并且用不同设置的深层过滤器替代,包括两步深层过滤。虽然对包括预滤器在内的几种成熟的过滤系统进行了多种组合测试,但结果并不令人满意,即,对于最佳过滤器设置,细胞分离和深层过滤后的浊度仍然保持在10fnu左右,且随后在蛋白质a洗脱池中出现沉淀,显示浊度约30fnu。此外,深层过滤器不会减少hcdna和hcp。
[0428]
其次,研究了仅使用深层过滤器时是否可以省略絮凝后的分离器。事实上,一些过滤器设置以足够的方式使絮凝的细胞培养液澄清,并具有可接受的低流穿浊度(1
‑
2fnu)。虽然这种策略产生了富有希望的清除,但所需的过滤器尺寸相当大和处理时间相当长,成为一个重要的经济因素。因此没有采取这种策略。
[0429]
实施例5:使用无细胞的培养物上清液的絮凝实验
[0430]
在本实施例中详细阐述了一种优选的预清洗策略。预清洗步骤的顺序如下(另外参见图2b):
[0431]
‑
收获细胞培养液
[0432]
‑
细胞分离/离心
[0433]
‑
使用pdadmac(0.0375%w/v
–
0.075%w/v)进行絮凝
[0434]
‑
深层过滤
[0435]
‑
微孔过滤(0.2μm)
[0436]
‑
蛋白质a色谱(mabselect sure lx)
[0437]
与实施例2和3相比,在细胞分离/离心之后进行絮凝,然后进行深层过滤。该方法使用1l、10l、100l和5000l培养液(贝伐珠单抗)进行,并对深层过滤的几个参数进行比较和优化。对于5000l规模,絮凝前上清液的浊度在30
‑
100fnu的范围内。
[0438]
研究如下类型的深层过滤器:
[0439]
‑
pall supercap 50pdh4
[0440]
‑
pall supercap 50pde2
[0441]
‑
pall supercap 50pdd1
[0442]
‑
pall supercap 50pekm
[0443]
‑
pall supercap 50pekx
[0444]
‑
3m bc25 90zb08a
[0445]
‑
3m bv8emphaze aex混合纯化器
[0446]
再次分析hcdna、浊度、hcp和mab浓度(方法参见上述实施例),根据结果,pekm、pdd1和pde2最适合以可接受的速率澄清絮凝的上清液。由于它们的双层配置,pdd1和pde2表现出比pekm(单层)更稳定的处理能力,因此是去除絮状物的优选深层过滤器。通过深层过滤器后的流穿浊度为1
‑
2fnu。在250
‑
500l/m2载量下,过滤时间为80
‑
240min。pdd1和pde2滤液在24小时时间内仅显示出轻微的浊度增加,并且两种滤液均被视为足够稳定以进行蛋白质a上的进一步处理。
[0447]
结论:用无细胞的上清液(分离/离心后)絮凝显示出优选的预清洗策略,并且非常适合大规模生产免疫球蛋白。具有浊度为30
‑
100fnu的絮凝后的上清液可以通过双层的深层过滤器如pdd1和pde2成功处理。这些类型的过滤器可加载至少500l/m2。对于浊度较高(>100fnu)的上清液,可以增加有效过滤面积以避免延长处理时间。最终选择的pdadmac浓度为0.0375%(w/v),其与在细胞存在下且无深层过滤的小规模絮凝实验(实施例1
‑
3)完全一致。
[0448]
实施例6:使用不同pdadmac浓度的具有较高igg浓度的细胞培养上清液的絮凝(表7)
[0449]
在本实验中,比较了两种不同的小规模细胞培养物,它们蓄积了不同量的igg2抗体(地诺单抗)。培养物体积为10l,并且将两种10l培养物合并作为起始材料。分别在8天和10天后收获培养物。汇总的8天培养物具有3.86mg/ml igg、42.4μg/ml hcdna和0.454mg/ml hcp。10天培养物具有5.79mg/ml igg(+50%)、85.μg/ml hcdna(+102%)和0.506mg/ml hcp(+11%)。如实施例1中所述,将细胞培养物上清液离心(4600rpm进行10min)并絮凝(15min温育)。
[0450]
表7:不同原料对pdadmac絮凝减少杂质的比较
50pde2。
[0455]
表8:通过在先的pdadmac絮凝减少蛋白质a洗脱液中的杂质
[0456][0457]
无絮凝的对照的蛋白质a洗脱液中的igg浓度为20.36mg/ml,而有絮凝过程的igg浓度为23.32mg/ml。在对照工艺中不进行絮凝,而将离心后的上清液直接深层过滤并进行蛋白质a色谱。就对照中约43fnu的浊度而言,蛋白质a洗脱池显示出显著的沉淀。相反,在使用pdadmac絮凝的工艺中,浊度大幅降低约80%。hcdna减少90%以上,降至0.076ppm的极低水平,几乎无法检测到。残留hcp更为突出,即204ppm,反映了起始材料中2
‑
3个数量级的更高负载。与对照相比,其浓度大约减半。这些结果清楚地证明pdadmac絮凝作用对蛋白质a洗脱液中的产品纯度的显著积极影响。
[0458]
在下表9a和9b中,两个生产批次(5000l贝伐珠单抗)的常规过程控制数据进一步证明了在蛋白质a色谱之前和之后的杂质的令人惊奇地显著减少。为了减少昂贵树脂的柱体积,以总体积的50%连续进行两次蛋白质a色谱。病毒灭活的后续温育如实施例9.3中所述进行。
[0459]
表9a:使用pdadmac絮凝的大规模工艺:hcdna浓度
[0460][0461]
*以两次连续运行进行蛋白质a色谱,每次运行使用总体积的50%
[0462]
n.d.:=不可检测,低于测试方法的检测限
[0463]
表9b:使用pdadmac絮凝的大规模工艺:hcp浓度
[0464]
[0465][0466]
在絮凝后几乎检测不到hcdna,并且在后续步骤中低于检测限(表9a)。絮凝和深层过滤将hcp仅减少约15%(表9b)。然而,由于对igg
‑
fc的高选择性,蛋白质a色谱将hcp杂质减少了99.9%以上。尽管如此,但在蛋白质a色谱后160
‑
270ppm的残留hcp浓度表明需要进一步的精制步骤,至少在用于人的治疗性抗体的情况下如此。
[0467]
表10:不同方法的浸出的蛋白质a的比较
[0468]
在下表10中的实验中,对三种不同方法的蛋白质a洗脱池中的浸出的蛋白质a进行了比较。方法c是本发明的方法,其在与实施例7/表8(200l曲妥珠单抗)中所述的相同条件下利用pdadmac絮凝。将两次运行的结果与先前建立的利用阴离子交换流穿色谱(nuvia q)、然后实施蛋白质a步骤的方法(方法b)进行比较。方法a是另一对照,无预清洗步骤(离心和过滤除外)。wo2015135884中描述了方法a和b。所有方法均在室温下进行。如实施例8.2中所述进行蛋白质a色谱。
[0469][0470]
方法a:细胞分离
→
深层过滤
→
微孔过滤
→
蛋白质a
[0471]
方法b:细胞分离
→
深层过滤
→
微孔过滤
→
阴离子交换色谱(nuvia q,流穿)
→
蛋白质a(如wo2015135884中所述)
[0472]
方法c:细胞分离
→
絮凝(pdadmac)
→
深层过滤
→
微孔过滤
→
蛋白质a
[0473]
方法c的浸出蛋白质a显著低于方法b,而方法b与对照方法a相比已经是降低浸出蛋白质a的有价值的改进。方法c中浸出的蛋白质与方法b相比减少约48%,与方法a相比减少约79%。因此,除了显著降低hcdna和浊度外,pdadmac絮凝还显著减少了浸出的蛋白质a。
[0474]
实施例8:下游工艺
–
从预清洗的培养物上清液中纯化免疫球蛋白
[0475]
在以下方法描述了小规模开发并首先应用于贝伐珠单抗(igg1)的100l中试规模
工艺。仅进行了少量调整,相同的工艺随后成功扩大到5000l。经过进一步的适度调整后,建立该工艺也适用于曲妥珠单抗(igg1)和地诺单抗(igg2)。
[0476]
实施例8.1:色谱树脂的选择(表11)
[0477]
继wo2015135884中公开的用于捕获、中间和精制步骤的常用色谱介质的扩展筛选之后,选择以下色谱树脂用于免疫球蛋白的下游工艺(表11):
[0478]
表11:优选的色谱树脂
[0479]
方法步骤树脂类型配体供应商捕获mabselect sure lx亲和碱稳定的蛋白质a衍生物ge healthcare中间poros 50hscex磺丙基(sp)applied biosystems精制capto qaex三甲基铵ge healthcare精制captoadheremmcn
‑
苄基
‑
n
‑
甲基乙醇胺ge healthcare
[0480]
cex=阳离子交换色谱法;aex=阴离子交换色谱法;mmc=混合模式色谱法
[0481]
色谱运行在室温下使用purifier system(ge healthcare)进行。
[0482]
实施例8.2:蛋白质a色谱
[0483]
使用mabselect sure lx(表11)进行蛋白质a捕获色谱。如实施例5中所述,在对絮凝的上清液进行深层过滤和微孔过滤后采集样品。柱尺寸为20cm直径x 10.4cm床高(填充体积约3.3l)。用20mm tris
‑
乙酸盐缓冲液(ph 7.2)平衡蛋白质a柱。将产物溶液(约49.5l)以15.8
‑
40.6蛋白质/l树脂上柱。用平衡缓冲液(2cv),然后用40mm磷酸钠、1.5m nacl、2m尿素、10mm edta,ph 7.4洗涤柱。用100mm柠檬酸钠,ph 3.5进行洗脱。流速为210cm/h。mabselect sure lx树脂的再生通过用(i)0.2m naoh(2cv)、(ii)wfi(2cv)、3.5%乙酸、100mm硫酸钠(2cv)和(iii)wfi(2cv)反向连续洗涤来进行。为下一次运行重新平衡色谱柱或储存在20%乙醇中。收率为94
‑
98%。
[0484]
实施例8.3:病毒灭活
[0485]
正如图1和2中所示,病毒灭活步骤发生在蛋白质a亲和色谱之后。优点在于从亲和基质中的低ph洗脱。在这样的酸性水溶液环境中,许多病毒、尤其是包膜型病毒会不稳定和分解。为本发明开发的蛋白质a方法产生具有ph为3.5的洗脱液(参见实施例8.2.)。将单克隆抗体在100mm柠檬酸钠缓冲液(ph 3.5)中从蛋白质a柱直接洗脱入病毒灭活罐a中。在罐a中通过wfi将洗脱液直接稀释约2倍。如果必要,控制溶液的ph并用100mm柠檬酸重新调节至3.5,随后将溶液转移到病毒灭活罐b中,其中以65rpm在20
‑
24℃的温度下搅拌60分钟。然后用100mm naoh将溶液的ph调节至4.5,为后续的阳离子交换色谱步骤提供起始条件。
[0486]
实施例8.4:使用poros 50hs的阳离子交换色谱
[0487]
使用磺丙基(sp)配体(表11)作为中间步骤,通过强阳离子交换色谱分离污染物,例如hcp和浸出的蛋白质a,以及产物相关物质,例如电荷变体和聚集物。通过(i)wfi(注射用水,2cv)和(ii)20mm柠檬酸钠、ph 4.9(2cv)连续平衡带有poros 50hs树脂的填充柱(尺寸=14cm直径x 41cm床高,填充体积约6.3l)。将如实施例8.3中所述病毒灭活和样品调整(ph 4.5)后得到的产物溶液加载到具有约7.3
‑
17.1g蛋白质/l树脂的柱上,由此通过0.45μm kleenpak nova预滤器(pall corporation)。在进行梯度洗脱之前,用wfi(1cv)和平衡缓冲液(2cv)洗涤柱。梯度由具有不同斜率的两部分组成。通过按以下比例和顺序混合20mm柠檬酸钠ph 4.9(缓冲液a)和40mm磷酸钠ph 7.2(缓冲液b)形成梯度:(i)100%a(0.2cv),
(ii)线性梯度至40%a+60%b(2cv);(iii)线性梯度至100%b(10cv);(iv)100%b(2cv)。在梯度过程中流速为75cm/h,其余为150cm/h。洗脱液被分成几个流分以允许特定的合并。当a
280
升高>0.1au的值时,开始在梯度洗脱期间收集流分。流分体积约为2l。总计收集约20个流分。poros 50hs树脂的再生通过用(i)1m nacl(2cv)和(ii)1m naoh(2cv)连续洗涤来进行。随后将该柱储存在10mm naoh中。由于大量的产品相关杂质的减少,所选的合并池中的收率约为62
‑
68%。
[0488]
实施例8.5:使用captoadhere的混合模式色谱
[0489]
最终的精制步骤使用captoadhere混合模式树脂进行,该树脂利用了配体n
‑
苄基
‑
n
‑
甲基乙醇胺(表11)。该配体带有带正电荷的基团,且由此除了疏水相互作用外,还提供阴离子交换剂功能。该色谱能够减少残留的痕量污染物,例如hcdna、hcp和基本电荷变体。通过该步骤也可以去除残留的浸出蛋白质a、产物聚集物体和产物碎片。captoadhere精制步骤在结合模式下进行,其提供了将缓冲液交换为选定的最终缓冲液的优势。
[0490]
在实施例8.4中所述的方法之后获得的poros 50hs池的ph通过添加100mm naoh调节至ph 7.2。填充柱的尺寸为14cm直径x 23cm床高(填充体积约3.5l)。用50.48mm磷酸钠ph 7.2(3cv)平衡树脂。将产物溶液加载到具有6.3
‑
17.8g蛋白质/l树脂的柱上,然后加入平衡缓冲液(3cv)。用50.48mm磷酸钠ph 5.0进行洗脱。流速为240cm/h。收率范围在87%
‑
98%。用2m nacl+100mm柠檬酸(2cv)和1m naoh(2cv)反向流动再生该柱。
[0491]
实施例8.6:使用captoq的阴离子交换色谱
[0492]
capto q阴离子交换色谱替代混合模式色谱作为本实施例中的最终精制步骤进行。阴离子交换色谱以流穿模式进行。在上柱之前,将阳离子交换色谱的合并流分用乙酸进行ph调节至ph 8.0。capto q柱用25mm tris缓冲液ph 8.0平衡。上样后,使用相同的缓冲液进行色谱。免疫球蛋白不与色谱树脂结合并在流穿中获得。
[0493]
实施例8.7:病毒过滤
[0494]
纳滤构成了最终病毒清除步骤,并且也是最严格和最可靠的病毒清除方法,其操作基于纳米范围内的尺寸排阻。在使用实施例8.5的captoadhere洗脱池或实施例8.6的capto q流穿池在使用磷酸钠将ph调节至6.2或使用乙酸将ph调节至5,0后,将病毒过滤直接置于混合模式色谱之后。病毒去除过滤在室温下使用viresolve pro modus 1.1装置(emd millipore),使用quattroflow 150隔膜泵进行。将孔径为0.1μm的opticap xl 150pes过滤器(emd millipore)放置在病毒过滤器之前,以避免聚集物堵塞病毒过滤器。过滤器用1.5l制剂缓冲液调节,例如50.48mm磷酸钠缓冲液ph 6.2或18mm乙酸钠缓冲液ph 5,2。在过滤过程中,将压力设定点为2
±
0.2巴。在以约500
‑
600l/m2加载后,使用约0.5
‑
1l体积的制剂缓冲液,例如50.48mm磷酸钠缓冲液ph 6.2从串联过滤器中洗出残留的mab。病毒过滤器在3.4巴的压力和1min的测试持续时间下进行了完整性测试。
[0495]
实施例8.8:切向流超滤/渗滤(tf
‑
uf/df)
[0496]
最终的超滤/渗滤步骤的作用在于调整蛋白质溶液的浓度,且如果需要,还可以将缓冲液交换到药物产品散装制剂中。如果最终的精制步骤为结合模式下的混合模式色谱,则缓冲液交换已经在结合模式启用的混合模式色谱水平上进行(参见实施例8.5)。此外,除缓冲剂之外,最终批量制剂的其他成分例如表面活性剂、稳定剂和/或冷冻保存剂可以通过渗滤导入。或者,浓mab溶液直接补充有这些物质。
[0497]
将实施例8.7的纳滤产品溶液采集在uf/df滑动罐中,并使用omega centrasette膜盒(pall corporation,30kd截止值)浓缩至约40+/
‑
2g/l。进料压力由quattroflow 150隔膜泵提供。将跨膜压力设定至1巴,进料和滞留压力分别为1.0和0.6巴。在该步骤过程中没有mab损失。浓缩的产物溶液补充有聚山梨醇酯20和海藻糖或山梨醇。将mab的最终体积浓度调整至例如30+/
‑
2g/l或80+/
‑
5g/l。使用0.2μm mini kleenpak过滤囊(pall corporation)进行最终微孔过滤(无菌过滤)。
[0498]
参考文献
[0499]
1.r.l.fahrner et al.,2001“industrial purification of pharmaceutical antibodies:development,operation,and validation of chromatography processes”,biotechnology and genetic engineering reviews 18,301
‑
327
[0500]
2.s.s.farid,2009“economic drivers and trade
‑
offs in antibody purification processes:the future of therapeutic mabs lies in the development of economically feasible downstream processes”,biopharm int.supplements,october 2,2009
[0501]
3.m.felo et al.,2015“industrial application of impurity flocculation to streamline antibody purification processes”pharm..bioprocess 3(2),115
‑
125
[0502]
4.p.gagnon,1996“purification tools for monoclonal antibodies”,validated biosystems,inc.,1
‑
253
[0503]
5.v.g.kadajji and g.v.betageri,2011“water soluble polymers for pharmaceutical applications”,polymers 3,1972
‑
2009
[0504]
6.y(k)kang et al.,2013“development of a novel and efficient cell culture flocculation process using a stimulus responsive polymer to streamline antibody purification processes”,biotechnol.bioeng.110(11),2928
‑
2937
[0505]
7.b.kelly et al.,2009“downstream processing of monoclonal antibodies:current practices and future opportunities”,in:process scale purification of antibodies,edited by u.gottschalk ,john wiley&sons,inc.
[0506]
8.h.f.liu,2010“recovery and purification process development for monoclonal antibody production”,mabs landes biosciences2(5),480
‑
499
[0507]
9.h.luo et al.,2017“liquid
‑
liquid phase separation causes high turbidity and pressure during low ph elution process in protein a chromatography”,j.chromatogr.a,1488,57
‑
67.
[0508]
10.t.mcnerney et al.,2015,“pdadmac flocculation of chinese hamster ovary cells:enabling a centrifuge
‑
less harvest process for monoclonal antibodies”mab(amgen)7(2),413
‑
427
[0509]
11.a.a.shukla et al.,2005,“strategies to address aggregation during protein achromatography”bioprocess international,may2005,36
‑
44.
[0510]
12.n.singh et al.,2016,“clarification technologies for monoclonal antibody manufacturing processes:current state and future perspectives”,
eur.j.biochem.192,767
‑
775
[0511]
13.wo03002713
[0512]
14.wo2001150110
[0513]
15.wo2007035283
[0514]
16.wo2008091740
[0515]
17.wo2008127305
[0516]
18.wo2010151632
[0517]
19.wo2011146394
[0518]
20.wo2013090820
[0519]
21.wo2014004281
[0520]
22.wo2014133459
[0521]
23.wo2014196926
[0522]
24.wo2015130222
[0523]
25.wo2015135884
[0524]
26.wo2016153983
[0525]
27.wo2017217930
[0526]
28.wo9216553
[0527]
29.wo9222653
[0528]
30.wo9411026
[0529]
31.wo9522389
[0530]
32.wo9729131
[0531]
33.wo9845331
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1