一种抗癌活性增加的自然杀伤细胞以及其免疫治疗用途的制作方法
1.本发明涉及一种抗癌活性增加的自然杀伤细胞以及其免疫治疗用途。
背景技术:
2.用于免疫细胞治疗法的自然杀伤细胞(natural killer cell,也称为“nk细胞”)为形态学上在细胞质中具有大颗粒的细胞,约占血液中淋巴细胞的5%至15%。迄今为止已发现的自然杀伤细胞的主要功能包括杀死肿瘤细胞的能力、对病毒感染细胞的细胞毒性以及杀死细菌和真菌的能力等。因此自然杀伤细胞有望在抗肿瘤、免疫和对微生物的保护性免疫中发挥重要作用。
3.自然杀伤细胞具有作为免疫受体(immune receptor)的表面受体。由于自然杀伤细胞没有如b细胞的bcr、t细胞的t细胞受体(t cell receptor,tcr)等显性受体,因此预计存在与其他免疫细胞不同的激活机制。此外,已知自然杀伤细胞为具有非特异性杀死癌症能力的细胞。这些自然杀伤细胞的杀伤能力通过与淋巴因子激活的杀伤细胞(lymphokine activated killer cell,lak)和肿瘤浸润淋巴细胞(tumor infiltration lymphocytes,til)一起用于实体癌治疗,或通过供体淋巴细胞输注(donor lymphocyte infusion)进行免疫治疗(tilden.a.b.et al.,j.
4.immunol.,136),可作为一种新的细胞治疗法应用以防止骨髓移植或器官移植过程中发生的排斥反应。
5.另一方面,胶质瘤(glioma)占原发性脑肿瘤(primary brain tumor)的60%,是迄今为止除放射治疗外没有特殊治疗方法的恶性肿瘤。此外,与其他癌症相比,被归类为恶性的胶质母细胞瘤(glioblastoma)对放射治疗和抗癌剂治疗具有非常高的抵抗性,一旦确诊,预计生存时间仅为一年。恶性胶质母细胞瘤占所有脑肿瘤的12%至15%,是大脑中最常见的单一肿瘤。
6.尽管有针对包括胶质母细胞瘤在内的癌症患者的现有治疗选择,但正在研究提高疗效和克服自我耐受的治疗方法,为此,需要开发特定免疫受体活性增加的自然杀伤细胞。
技术实现要素:
7.技术问题
8.本发明一方面提供一种抗癌活性增加的自然杀伤细胞,其具有特定范围的相对平均荧光强度值的受体表达特性。
9.本发明另一方面提供一种细胞治疗剂或药物组合物,其含有所述自然杀伤细胞或其群体作为有效成分。
10.本发明另一方面还提供一种治疗癌症的方法,其包括:向有需要的受试者施用有效量的所述自然杀伤细胞或其群体。
11.技术方案
12.本发明一方面提供一种抗癌活性增加的自然杀伤细胞,其具有特定范围的相对平
均荧光强度值的受体表达特性。
13.如本文所用,术语“自然杀伤细胞(natural killer cells)”或“nk细胞”为一种构成先天性免疫系统的主要成分的细胞毒性淋巴细胞,被定义为大颗粒淋巴细胞(large granular lymphocyte,lgl),并且构成从产生b和t淋巴细胞的共同淋巴样祖细胞(common lymphoid progenitor,clp)分化的第三种细胞。所述“自然杀伤细胞”或“nk细胞”包括源自任何组织来源(source)的未经进一步变形的自然杀伤细胞,其不仅可以包括成熟的自然杀伤细胞,还可以包括自然杀伤祖细胞。所述自然杀伤细胞响应干扰素或巨噬细胞衍生的细胞因子而被激活,自然杀伤细胞包括可控制细胞的细胞毒性活性的两种类型的表面受体,标记为“激活受体”和“抑制性受体”。自然杀伤细胞可以从任何来源,例如胎盘组织、胎盘灌注液、脐带血、胎盘血、外周血、脾脏、肝脏等的造血细胞,例如造血干细胞或前体、胎盘或脐带衍生的干细胞、诱导多能干细胞或由其分化的细胞产生。
14.所述自然杀伤细胞可以源自例如外周血单核细胞。术语“外周血单核细胞(peripheral blood mononuclear cells,pbmc)”是指从哺乳动物,优选人的外周血中分离的单核细胞,主要包括免疫细胞如b细胞、t细胞、自然杀伤细胞和粒细胞如嗜碱性粒细胞(basophil),嗜酸性粒细胞(eosinophil)和嗜中性粒细胞(neutrophil)等。所述外周血单核细胞可以通过常规制备方法从体内采集的外周血来制备。优选地,可以使用ficoll比重离心分离法从外周血中分离所述外周血单核细胞。
15.另外,可以通过从白细胞去除术(leukapheresis)的产物中去除红细胞来获得自然杀伤细胞,所述白细胞去除术将白细胞从血液中分离出来。
16.根据一具体实施例,本说明书的自然杀伤细胞可以具有选自以下(a)至(e)中的至少一种特征:
17.(a)与外周血单核细胞培养第0天相比,nkg2d的相对平均荧光强度值增加1.2倍至12倍、2倍至12倍、4倍至12倍、2倍至10倍、2倍至8倍、4倍至8倍、3倍至6倍或3.5倍至4.5倍;
18.(b)与外周血单核细胞培养第0天相比,nkp30的相对平均荧光强度值增加1.5倍至15倍、1.5倍至12倍、2倍至12倍、4倍至10倍、2倍至10倍、4倍至8倍、3倍至6倍或4倍至6倍;
19.(c)与外周血单核细胞培养第0天相比,培养第14天的nkp44的相对平均荧光强度值增加12倍至22倍、12倍至20倍、14倍至22倍、16倍至22倍、16倍至20倍、12倍至18倍、14倍至18倍或16倍至18倍;
20.(d)与外周血单核细胞培养第0天相比,itga1的相对平均荧光强度值增加1.8倍至25倍、2倍至25倍、4倍至22倍、4倍至18倍、6倍至16倍、6倍至10倍或6倍至8.5倍;以及
21.(e)与外周血单核细胞培养第0天相比,itga2的相对平均荧光强度值增加1.4倍至6倍、1.8倍至6倍、1.8倍至5倍、2倍至5.5倍、2倍至5倍、2倍至4倍或2.5倍至3.5倍。
22.所述相对平均荧光强度值可以为与外周血单核细胞的培养第0天相比的培养第14天的相对平均荧光强度值。
23.如本文所用,术语“相对平均荧光强度(relative mean fluorescence intensity)”是指与同种型相比阳性细胞的表达强度的值,并且由以下数学式1定义。
24.【数学式1】
25.相对平均荧光强度=受体相对平均荧光强度/同种型相对平均荧光强度
26.相对平均荧光强度为一种不同于表达比率的概念,所述表达比率测量与同种型相
比的阳性细胞的表达比率,即使具有相同百分比的表达比率,每个受体功能的强度根据平均荧光强度值也不同,只有相对平均荧光强度值高时,才可以理解为实际功能有所提升。
27.本说明书提供一种新型自然杀伤细胞,其在培养来自外周血单核细胞的自然杀伤细胞时用新物质,例如pdgf
‑
aa、pdgf
‑
bb、pdgf
‑
cc、pdgf
‑
dd或pdgf
‑
ab处理。所述新型自然杀伤细胞的制备方法与已知的其他自然杀伤细胞的制备方法不同,在所述新型自然杀伤细胞中,与外周血单核细胞培养之前相比,与抗癌活性和自然杀伤细胞的激活相关的因子nkg2d、nkp30、nkp44、itga1和itga2的相对平均荧光强度值增加少至1.2倍至多至30倍。
28.在另一具体实施例中,本说明书的自然杀伤细胞可以进一步具有选自以下中的至少一种特征:
29.平均荧光强度值为8至140、10至140、8至40、15至30、80至140、100至140或110至130的cd16;平均荧光强度值为20至160、30至160、30至150、20至60、25至50、120至160或135至150的lfa
‑
1;平均荧光强度值为2至30、5至30、5至25、6至15、12至30或14至25的nkg2d;平均荧光强度值为2至25、5至25、5至20、2至14、7至20或10至18的nkp30;平均荧光强度值为10至40、12至30、12至25、14至22、12至18或18至22的nkp44;平均荧光强度值为2至30、4至25、4至22、2至16、4至12、10至25或14至25的itga1;平均荧光强度值为1至10、1.5至10、2至10、1.6至4、2至8、4至8或4至6的itga2;平均荧光强度值为20至180的cd2;平均荧光强度值为0.1至1.5的cd27;平均荧光强度值为1至10的cd69;平均荧光强度值为2至12的cd226;平均荧光强度值为2至8的nkp46;平均荧光强度值为0.1至4的cd160;平均荧光强度值为0.1至4的kir2dl1;平均荧光强度值为0.1至5的kr2dl3;平均荧光强度值为0.1至4的kir3dl1;平均荧光强度值为0.4至16的nkg2a;平均荧光强度值为0.2至12的cd161;平均荧光强度值为0.3至3的ccr3;平均荧光强度值为0.5至4的ccr5;平均荧光强度值为0.8至6的ccr6;平均荧光强度值为0.4至5的cxcr3;平均荧光强度值为0.4至5的cxcr1;平均荧光强度值为0.1至3的cxcr2以及平均荧光强度值为1至16的itgb7。
30.在另一具体实施例中,自然杀伤细胞可以进一步具有以下(f)的特征:
31.(f)与外周血单核细胞培养第0天相比,培养第14天的kir2ds4基因的表达量至少为10倍以上,详细地,10至60倍、10至50倍、20至40倍、20至45倍或25至40倍。
32.在另一具体实施例中,自然杀伤细胞可以进一步具有以下(g)或(h)的特征:
33.(g)与外周血单核细胞培养第0天相比,培养第14天的cd16的相对平均荧光强度(mean fluorescence intensity)值减少0.02倍至0.85倍、0.04倍至0.8倍、0.08倍至0.8倍、0.1倍至0.6倍、0.1倍至0.4倍或0.12倍至0.3倍;或
34.(h)与外周血单核细胞培养第0天相比,培养第14天的lfa
‑
1的相对平均荧光强度值减少0.08倍至0.8倍、0.1倍至0.8倍、0.1倍至0.7倍、0.1倍至0.6倍、0.2倍至0.6倍、0.4倍至0.6倍或0.2倍至0.5倍。
35.在另一具体实施例中,所述自然杀伤细胞可以表达选自nkg2d、nkp30、nkp44、cd16、lfa
‑
1、itga1、itga2、kir2ds1、kir2ds2、kir2ds3、kirds4、cxcr1、cxcr2、cxcr3、ccr3、ccr5、ccr6、psa
‑
ncam、巢蛋白(nestin)、酪氨酸羟化酶(tyrosine hydroxylase)、cd147、cd127、cd15、cd31、cd146、cd49c、cd107a、nkg2a、cd45、cd140a和cd11b中的任何一种受体。
36.自然杀伤细胞的激活受体主要识别靶细胞处于异常状态时表达增加的配体,并引起细胞毒性作用以去除靶细胞。
37.所述psa
‑
ncam为神经细胞的分化潜能标志物,并且可以为在胚胎发育过程中与神经系统中的神经元发育突触形成有关的指示因子,酪氨酸羟化酶可以为合成神经递质激素所需的酶,cd147为与胚胎大脑发育有关的因素,可以在大脑内皮中具有整合素介导的粘附(integrin
‑
mediated adhesion)功能。所述s100b可以提高血脑屏障渗透性。所述cd15可以具有与趋化性(chemotaxis)、吞噬作用(phagocytosis)和/或杀菌活性(bactericidal activity)相关的功能,cd31可与cd38结合以治愈伤口或参与血管新生和细胞迁移。另外,所述cd146可以作为在激活的t细胞、间充质干细胞等中表达的细胞表面标志物参与白细胞的血管外渗(extravasation),cd49c可以参与神经迁移或者在细胞
‑
细胞和细胞
‑
基质之间起到粘附作用。
38.nkg2d通过检测作为在dna损伤、癌症发生和病毒感染时增加表达的细胞内分子的ul16结合蛋白(ulbps)和mic a/b、rae1、h60和mult1来提供细胞毒活性。
39.nkp30为一种通过结合包括bag6和ncr3lg1、b7
‑
h6在内的细胞外配体而激活的受体,其通过与这些配体结合来刺激细胞毒性。
40.nkp44将细胞表面的糖蛋白和蛋白聚糖、可暴露于细胞外的核蛋白(nuclear proteins)以及释放到细胞外空间或迁移到细胞外囊泡(vesicle)的分子识别为配体。最近有报道称,nkp44识别细胞外基质(ecm)衍生的糖蛋白或如生长因子(growth factors)的可溶性血浆蛋白(例如,pdgf
‑
dd)(cell.2018january 25;172(3):534
‑
548.e19.,front immunol.2019;10:719.)。
41.kir2ds4与包括癌症、妊娠障碍和hiv耐药性在内的许多疾病有关,尽管尚未确定正确的配体,但通过识别由hla
‑
c*05:01呈递的肽(例如,重组肽:hla
‑
c复合物)来激活自然杀伤细胞,激活的自然杀伤细胞产生tnf
‑
α和ifn
‑
γ并脱颗粒。因此,kir2ds4可以为具有高度肽特异性的激活受体,在免疫防御中发挥足够的作用(j immunol may 1,2019,202(1supplement)177.24;)。
42.itga1为层粘连蛋白和胶原蛋白的受体,参与细胞
‑
细胞之间的粘附。其识别胶原蛋白的一些序列以参与egf刺激的细胞生长的负性调控。
43.itga2为层粘连蛋白、胶原蛋白、胶原蛋白c
‑
前肽、纤连蛋白和e
‑
钙粘蛋白的受体,其负责与血小板和其他细胞的粘附、胶原蛋白的调节以及合成的细胞外基质的构建。
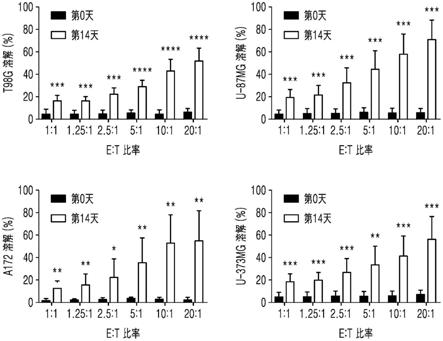
44.在所述自然杀伤细胞中,至少50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或约99%,或50%至100%、50%至90%、60%至90%、60%至80%或60%至70%的细胞群可以表达nkg2d、nkp30、nkp44、cd16、lfa
‑
1、itga1、itga2、kir2ds1、kir2ds2、kir2ds3、kirds4、cxcr1、cxcr2、cxcr3、ccr3、ccr5、ccr6、psa
‑
ncam、巢蛋白(nestin)、酪氨酸羟化酶(tyrosine hydroxylase)、cd147、cd127、cd15、cd31、cd146、cd49c、cd107a、nkg2a、cd45、cd140a或cd11b。
45.另外,在自然杀伤细胞中,至少50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或约99%,或50%至100%、50%至90%、60%至90%、60%至80%或60%至70%的细胞群可以表现出选kir2ds1
+
、kir2ds2
+
、kir2ds3
+
、kir2ds4
+
、cxcr1
+
、cxcr2
+
、cxcr3
+
、ccr3
+
、ccr5
+
、ccr6
+
、psa
‑
ncam
+
、巢蛋白
+
(nestin
+
)、cd127
+
、cd15
+
、cd31
+
、cd146
+
、cd49c
+
、cd107a
+
、nkg2a
+
、cd45
+
、cd140a
+
和cd11b
+
中的任何一种特性。
46.另外,在自然杀伤细胞中,至少40%、45%、50%、55%、60%、65%、70%、75%、
80%、85%、90%、95%、98%或约99%,或50%至100%、50%至90%、60%至90%或60%至80%的细胞群可以表现出选cd87
‑
、cd10
‑
和cd80
‑
中的任何一种特性。
47.本文所用的术语“阳性”或“+”与细胞标记有关,可以是指与以该标记为参照的其他细胞相比,该标记以更大的量或以更高的浓度存在。即,对细胞而言,由于在细胞内部或表面都存在标记,因此如果该标记可用于将该细胞与一种或多种其他细胞类型区分开,则该细胞对该标记呈阳性。另外,这可以意味着该细胞以大于背景值的信号,例如足以从细胞测量装置发射信号的量具有该标记。例如,可以用对nkp44具有特异性的抗体可检测地标记细胞,并且如果来自该抗体的信号可检测地大于对照组(例如,背景值),则该细胞为“nkp44
+”。本文所用的术语“阴性”或
“‑”
是指即使使用对特定细胞表面标记具有特异性的抗体,与背景值相比也无法检测到该标记。例如,如果不能使用对cd87
‑
具有特异性的抗体来可检测低标记细胞,该细胞为“cd87
‑”。
48.根据一具体实施例,所述自然杀伤细胞可以是指与亲本细胞,例如造血细胞或自然杀伤祖细胞相比,细胞毒性或自然杀伤细胞本身的免疫调节能力被激活,或者如上所述的免疫受体的表达增加的细胞。在一具体实施方案中,自然杀伤细胞为cd3
‑
cd56+。在一具体实施方案中,激活的自然杀伤细胞为cd3
‑
cd56+cd16+。在另一具体实施方案中,激活的自然杀伤细胞进一步为cd94+cd117+。在另一具体实施方案中,激活的自然杀伤细胞进一步为cd161
‑
。在另一具体实施方案中,激活的自然杀伤细胞进一步为nkg2d+。在另一具体实施方案中,激活的自然杀伤细胞进一步为nkp46+。在另一具体实施方案中,激活的自然杀伤细胞进一步为cd226+。在特定实施方案中,超过50%、60%、70%、80%、90%、92%、94%、96%、98%的所述激活的自然杀伤细胞为cd56+和cd16
‑
。在另一特定实施方案中,超过50%、60%、70%、80%、82%、84%、86%、88%或90%的所述激活的自然杀伤细胞为cd3
‑
和cd56+。在其他实施方案中,至少50%、52%、54%、56%、58%或60%的所述激活的自然杀伤细胞为nkg2d+。在其他实施方案中,所述细胞的30%、20%、10%、9%、8%、7%、6%、5%、4%或3%为nkb1+。在其他特定实施方案中,小于30%、20%、10%、8%、6%、4%或2%的所述激活的自然杀伤细胞为nkat2+。在更具体的实施方案中,至少10%、20%、25%、30%、35%、40%、50%、55%、60%、65%、70%、75%、80%或85%的所述cd3
‑
、cd56+激活的自然杀伤细胞为nkp46+。在更具体的其他实施方案中,至少10%、20%、25%、30%、35%、40%、50%、55%、60%、65%、70%、75%、80%或85%的所述cd3
‑
、cd56+激活的自然杀伤细胞为cd117+。在更具体的其他实施方案中,至少10%、20%、25%、30%、35%、40%、45%或50%的所述cd3
‑
、cd56+激活的自然杀伤细胞为cd94+。在更具体的其他实施方案中,至少10%、20%、25%、30%、35%、40%、45%或50%的cd3
‑
、cd56+激活的自然杀伤细胞为cd161
‑
。在更具体的其他实施方案中,至少10%、20%、25%、30%、35%、40%、50%、55%、60%、65%、70%、75%、80%、85%或95%的所述cd3
‑
、cd56+激活的自然杀伤细胞为cd226+。在更具体的其他实施方案中,至少20%、25%、30%、35%或40%的所述cd3
‑
、cd56+激活的自然杀伤细胞为cd7+。在更具体的实施方案中,至少30%、35%、40%、45%、50%、55%或60%的所述cd3
‑
、cd56+激活的自然杀伤细胞为cd5+。
49.根据一具体实施例,激活的自然杀伤细胞或富含(enriched)激活的自然杀伤细胞的群体可以通过检测一种以上的功能相关的标志物,例如cd94、cd161、dnam
‑
1、2b4、nkp46、kir和激活受体的nkg2家族(例如nkg2d)来评估。
50.根据一具体实施例,激活的自然杀伤细胞可以从上述造血细胞产生。在特定实施方案中,激活的自然杀伤细胞可以从增殖的造血细胞,例如造血干细胞和/或造血祖细胞获得。在一具体实施方案中,造血细胞在第一培养基中连续增殖和分化,而不使用营养细胞。此后,在营养细胞存在的情况下,在第二培养基中培养细胞。这种分离(隔离)、增殖和分化可以在中心设施进行,其在使用地点,例如医院等处提供用于增殖和分化的已增殖的造血细胞。
51.根据一具体实施例,产生激活的自然杀伤细胞包括增殖造血细胞群的步骤。在细胞增殖过程中,造血细胞群中的多个造血细胞分化为自然杀伤细胞。
52.如本文所用,术语“自然杀伤祖细胞”或“nk祖细胞”或其细胞群可以是指,例如由一种以上的表型标志物(marker),例如cd56、cd16和kir的表达水平所示的,包括尚未发育成成熟自然杀伤细胞的自然杀伤细胞谱系的细胞的细胞或其群体。在一实施方案中,自然杀伤祖细胞群包括具有低cd16和高cd56的细胞。例如,自然杀伤祖细胞群包括约5%、10%、15%、20%、25%、30%、35%、40%、45%或50%的cd3
‑
cd56+细胞。在另一具体实施例中,所述自然杀伤祖细胞群包括约5%、10%、15%、20%、25%、30%、35%、40%、45%或50%以下的cd3
‑
cd56+细胞。在另一具体的实施方案中,所述自然杀伤祖细胞群包括0%至5%、5%至10%、10%至15%、15%至20%、20%至25%、25%至30%、30%至35%、35%至40%、40%至45%或45%至50%的cd3
‑
cd56+细胞。
53.根据一具体实施例,所述自然杀伤祖细胞群中的所述cd3
‑
cd56+细胞进一步为cd117+。在一具体实施方案中,所述自然杀伤祖细胞群中约65%、70%、75%、80%、85%、90%、95%、98%或99%的所述cd3
‑
cd56+细胞为cd117+。在另一具体实施方案中,所述自然杀伤祖细胞群中65%、70%、75%、80%、85%、90%、95%、98%或99%以上的所述cd3
‑
cd56+细胞为cd117+。在另一具体实施方案中,所述自然杀伤祖细胞群中65%至70%、70%至75%、75%至80%、80%至85%、85%至90%、90%至95%或95%至99%的所述cd3
‑
cd56+细胞为cd117+。
54.在另一具体实施例中,自然杀伤祖细胞群中的所述cd3
‑
cd56+细胞进一步为cd161+。在一具体实施方案中,所述自然杀伤祖细胞群中约40%、45%、50%、55%、60%、65%、70%或75%的所述cd3
‑
cd56+细胞为cd161+。在另一具体实施方案中,所述自然杀伤祖细胞群中40%、45%、50%、55%、60%、65%、70%或75%以上的所述cd3
‑
cd56+细胞为cd161+。在另一具体实施方案中,所述自然杀伤祖细胞群中40%至45%、45%至50%、50%至55%、55%至60%、60%至65%、65%至70%或70%至75%的所述cd3
‑
cd56+细胞为cd161+。
55.在另一具体实施例中,所述自然杀伤祖细胞群中的所述cd3
‑
cd56+细胞进一步为nkp46+。在一具体实施方案中,所述自然杀伤祖细胞群中约25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或其以上的cd3
‑
cd56+细胞为nkp46+。在另一具体实施方案中,所述自然杀伤祖细胞群中约25%、30%、35%、40%、45%、50%或55%的所述cd3
‑
cd56+细胞为nkp46+。在另一具体实施方案中,所述自然杀伤祖细胞群中25%、30%、35%、40%、45%、50%或55%以下的所述cd3
‑
cd56+细胞为nkp46+。在另一具体实施方案中,所述自然杀伤祖细胞群中25%至30%、30%至35%、35%至40%、40%至45%、45%至50%、50%至55%、55%至60%、60%至65%、65%至70%、70%至75%、75%至80%、85%至90%或其以上的所述cd3
‑
cd56+细胞为nkp46+。在更具体的实施方案中,所述自然杀
伤祖细胞群中25%至30%、30%至35%、35%至40%、40%至45%、45%至50%或50%至55%的所述cd3
‑
cd56+细胞为nkp46+。
56.另外,例如,对于cd52+、cd16+、cd244+、cd94+或cd94+,所述自然杀伤祖细胞群如上所述。
57.在本说明书中,所述自然杀伤细胞可以被培养或基因工程化以表达上述受体或增加其表达或活性。
58.在本说明书中,所述培养可以是指从任何来源,例如胎盘组织、胎盘灌注液、脐带血、胎盘血、外周血、脾脏、肝脏等的造血细胞,例如造血干细胞或前体培养以增加上述受体的表达或活性。
59.如本文所用,“基因工程(genetic engineering)”或“基因工程化(genetically engineered)”是指将一种以上的基因修饰(genetic modification)引入细胞或由其产生的细胞。
60.如本文所用,术语“活性增加(increase in activity)”或“增加的活性
61.(increased activity)”可以是指蛋白质或酶的活性的可检测增加。“活性增加(increase in activity)”或“增加的活性(increased activity)”意味着与给定的亲本细胞或野生型细胞或培养前细胞(例如,外周血单核细胞)相比,蛋白质或酶的活性水平更高。
62.在另一具体实施例中,所述自然杀伤细胞可以被基因修饰或基因工程化。可以对所述自然杀伤细胞进行基因修饰以提高其目标特异性和/或归巢特异性。
63.在另一具体实施例中,所述自然杀伤细胞可以分泌穿孔素、颗粒酶或干扰素。
64.所述颗粒酶可以选自颗粒酶a(granzyme a)、颗粒酶b、颗粒酶h、颗粒酶k和颗粒酶m中的至少一种。
65.所述干扰素可以为1型干扰素(例如,干扰素
‑
α、干扰素
‑
β、干扰素
‑
κ、干扰素
‑
ω)、2型干扰素(例如,干扰素
‑
γ)或3型干扰素。
66.本发明另一方面提供一种细胞治疗剂或药物组合物,其包括所述免疫细胞或其细胞群作为有效成分。
67.所述细胞治疗剂或药物组合物可用于预防或治疗癌症或传染病。
68.本发明另一方面提供一种所述自然杀伤细胞或其细胞群用于制备药物的用途。
69.本发明另一方面提供一种治疗疾病的方法,其包括向受试者施用所述自然杀伤细胞或其细胞群的步骤。
70.如本文所用,术语“疾病”可以指一种病理状况,特别是癌症、传染病、炎性疾病、代谢性疾病、自身免疫性疾病、退行性疾病、细胞凋亡相关疾病和移植排斥。
71.如本文所用,术语“治疗”可以是指或包括减轻、抑制进展或预防疾病、障碍或病症或其至少一种症状,并且“有效成分”或“药学有效量”可以是用于本文提供的本发明的实践中的组合物的任何量,其足以减轻、抑制进展或预防疾病、障碍或病症,或其至少一种症状。
72.如本文所用,术语“施用”、“引入”和“植入”可互换使用并且可以是指通过一种方法或途径将根据一具体实施例的组合物放置到受试者体内,该方法或途径导致根据一具体实施例的组合物至少部分地定位到所需位点。根据一具体实施例的组合物可以通过任何合适的途径施用,该途径将至少一部分细胞或细胞成分递送至存活受试者体内的所需位置。施用于受试者后细胞的存活期可以短至数小时,例如从24小时至数天或长至数年。
73.所述施用可以与另外的抗癌剂组合施用。另外的抗癌剂的实例可以包括烷化剂(alkylating agent)、抗代谢物、纺锤体抑制剂植物生物碱、细胞障碍性/抗肿瘤抗生素、拓扑异构酶抑制剂、抗体、光敏剂和激酶抑制剂。所述抗癌剂的实例可以包括用于靶向治疗和现有化学疗法的化合物。此外,抗体的实例可以包括阿仑单抗(alemtuzumab)、阿泊珠单抗(apolizumab)、阿塞珠单抗(aselizumab)、托珠单抗(atlizumab)、巴匹珠单抗(bapineuzumab)、贝伐单抗(bevacizumab)、比伐单抗美坦辛(bivatuzumab mertansine)、美坎珠单抗美坦辛(cantuzumab mertansine)、西利珠单抗(cedelizumab)、培舍珠单抗(certolizumab pegol)、西弗斯妥珠单抗(cidfusituzumab)、西妥珠单抗(cidtuzumab)、达克珠单抗(daclizumab)、依库珠单抗(eculizumab)、依法利珠单抗(efalizumab)、依帕珠单抗(epratuzumab)、厄利珠单抗(erlizumab)、非维珠单抗(felvizumab)、芳妥珠单抗(fontolizumab)、吉姆单抗奥佐米星(gemtuzumab ozogamicin)、伊珠单抗奥佐米星(inotuzumab ozogamicin)、伊匹木单抗(ipilimumab)、拉贝珠单抗(labetuzumab)、林妥珠单抗(lintuzumab)、马妥珠单抗(matuzumab)、美泊利单抗(mepolizumab)、莫他珠单抗(motavizumab)、莫妥维珠单抗(motovizumab)、那他珠单抗(natalizumab)、尼妥珠单抗(nimotuzumab)、诺洛维珠单抗(nolovizumab)、努马维珠单抗(numavizumab)、奥瑞珠单抗(ocrelizumab)、奥马珠单抗(omalizumab)、帕利珠单抗(palivizumab)、帕考珠单抗(pascolizumab)、帕氟珠单抗(pecfusituzumab)、培妥珠单抗(pectuzumab)、帕妥珠单抗(pertuzumab)、培克珠单抗(pexelizumab)、拉维珠单抗(ralivizumab)、雷珠单抗(ranibizumab)、瑞利伟珠单抗(reslivizumab)、瑞利珠单抗(reslizumab)、热西维珠单抗(resyvizumab)、罗维珠单抗(rovelizumab)、鲁利单抗(ruplizumab)、西罗珠单抗(sibrotuzumab)、西利珠单抗(siplizumab)、松妥珠单抗(sontuzumab)、他珠单抗(tacatuzumab tetraxetan)、他度珠单抗(tadocizumab)、他利珠单抗(talizumab)、特非珠单抗(tefibazumab)、托珠单抗(tocilizumab)、托利珠单抗(toralizumab)、曲妥单抗(trastuzumab)、西莫白介素单抗(tucotuzumabcelmoleukin)、土库西妥珠单抗(tucusituzumab)、乌马维珠单抗(umavizumab)、乌珠单抗(urtoxazumab)和维西珠单抗(visilizumab)。
74.如本文所用,术语“分离的细胞”,例如“分离的自然杀伤细胞”等是指从细胞起源的组织,例如外周血中基本上分离的细胞。
75.本发明的组合物可用于治疗或预防源自新生物的肿瘤或癌症。新生物可以为恶性的的或良性的,癌症可以为原发性的或转移性的,并且新生物或癌症可以为早期的或晚期的。可治疗的新生物或癌症的非限制性实例可以包括选自肺癌、喉癌、胃癌、大肠癌、直肠癌、肝癌、胆囊癌、胰腺癌、乳腺癌、卵巢癌、子宫癌、宫颈癌、前列腺癌、肾癌、皮肤癌、骨癌、肌肉癌、脂肪癌、成纤维细胞癌、血癌、白血病、淋巴瘤、多发性骨髓瘤和神经胶质瘤中的至少一种。
76.另外,所述神经胶质瘤可以为星形细胞肿瘤(astrocytic tumours)、少突胶质细胞肿瘤(oligodendroglial tumours)、混合性神经胶质瘤(mixed gliomas)或室管膜肿瘤(ependymal tumours)。更具体地,所述星形细胞肿瘤可以为胶质母细胞瘤、抗癌剂耐药性的胶质母细胞瘤或复发性胶质母细胞瘤。
77.不受特定理论的限制,已经报道了从胶质母细胞瘤分泌的pdgf
‑
dd与自然杀伤细
胞的nkp44之间的相互作用。另外,不受特定理论的限制,已经报道了从胶质母细胞瘤表达的mica和自然杀伤细胞中nkg2d之间的相互作用。此外,不受特定理论的限制,已经报道了kir2ds2阳性自然杀伤细胞与胶质母细胞瘤之间的关系。
78.因此,根据一具体实施例的自然杀伤细胞可以对分泌或表达mica(mhc class ipolypeptide
‑
related sequence a,mhc i类多肽相关序列a)或pdfg
‑
dd(platelet
‑
derived growth factor
‑
dd,血小板衍化生长因子
‑
dd)的癌症(例如,神经胶质瘤、胶质母细胞瘤等)更有效。
79.此外,根据一具体实施例的自然杀伤细胞可以抑制自我耐受。因此,根据一具体实施例的自然杀伤细胞可以活化免疫,渗透血脑屏障,促进细胞迁移,或者抑制自我耐受。
80.在一具体例中,药物组合物的施用方法没有特别限制,但根据所需的方法,可以非口服施用或口服施用,例如静脉内、皮下、腹腔内、吸引或局部施用。施用剂量根据患者的体重、年龄、性別、健康状态、饮食、给药时间、给药方法、排泄率及疾病严重程度而范围不同。日剂量是指根据一方面的治疗物质的量足以治疗通过施用于有需要的受试者而改善的疾病状态。治疗物质的有效量将取决于特定化合物、疾病状态及其严重程度以及需要治疗的受试者,这可由本领域普通技术人员常规确定。作为非限制性实例,根据一方面的组合物对人体的剂量可根据患者的年龄、体重、性别、剂型、健康状况和疾病程度而不同。以体重70公斤的成年患者为基准,例如约1,000至10,000个细胞/次、1,000至100,000个细胞/次、1,000至1000,000个细胞/次、1,000至10,000,000个细胞/次、1,000至100,000,000个细胞/次、1,000至1,000,000,000个细胞/次、1,000至10,000,000,000个细胞/次或1,000至100,000,000,000个细胞/次,可以每天一次施用或几次以固定时间间隔分次施用,或者可以以固定时间间隔多次施用。
81.术语“受试者”是指需要治疗疾病的对象,更具体地是指哺乳动物,例如人或非人灵长类动物、小鼠(mouse)、大鼠(rat)、狗、猫、马和牛等。
82.根据一具体实施例,药物组合物可以包括药学上可接受的载体和/或添加物。例如,可以包括灭菌水、生理盐水、常规缓冲液(磷酸、柠檬酸、其他有机酸等)、稳定剂、盐、抗氧化剂(抗坏血酸等)、表面活性剂、悬浮液、等渗剂或保存剂等。为了局部施用,还可以包括将其与如生物聚合物(biopolymer)等的有机物质、如羟基磷灰石等的无机物、具体地,胶原基质、聚乳酸聚合物或共聚物、聚乙二醇聚合物或共聚物以及其化学衍生物等结合。当根据一具体实施例的药物组合物制备成适合于注射的剂型时,免疫细胞或增加其活性的物质可以溶解在药学上可接受的载体中或冷冻成已溶解的溶解溶液状态。
83.如果需要,根据其施用方法或机型,根据一具体实施例的药物组合物可以适当地包括悬浮剂、溶解助剂、稳定剂、等渗剂、保存剂、吸附抑制剂、表面活性剂、稀释剂、赋形剂、ph调节剂、无痛化剂、缓冲剂、还原剂、抗氧化剂等。包括所述实例的适用于本发明的药学上可接受的载体和制剂在文献(remington's pharmaceutical sciences,19th ed.,1995)中有详细描述。根据本领域技术人员可容易进行的方法,根据一具体实施例的药物组合物可以通过与药学上可接受的载体和/或赋形剂配制并以单位剂量形式或以装入多剂量容器中的方式来制备。此时,机型可以为油性或水性介质中的溶液、悬浮液或乳化液的形式,或者可以为粉末、颗粒、片剂或胶囊的形式。
84.有益效果
85.根据一方面的自然杀伤细胞表现出,对包括胶质母细胞瘤在内的癌症具有显着的特定受体的相对平均荧光强度增加,从而可以有效地进行抗癌免疫治疗。
附图说明
86.图1为显示自然杀伤细胞的每个培养期的表型分析的散点图(a:cd3cd56;b:cd3cd19,cd14ssc;c:cd3ssc,cd4cd8)。
87.图2为显示图1中7名培养评价结果的图表及存活率和自然杀伤细胞的增殖倍数的图表(a:cd3+cd56+、cd3
‑
cd56+、cd3+cd56
‑
细胞的比例;b:cd19+细胞的比例;c:cd14+细胞的比例;d:cd4+、cd8+细胞的比例;e:自然杀伤细胞的比率增殖;f:细胞的存活率)。
88.图3为根据一具体实施例的自然杀伤细胞与培养前外周血单核细胞的免疫受体的表达变化的散点图结果。
89.图4为根据一具体实施例的自然杀伤细胞与培养前外周血单核细胞的免疫受体的表达变化的图表结果(a:nkg2d+、dnam1+、cd69+、nkp30+;b:nkp44+、nkp46+、cd2+、cd16+;c:kir2dl1+、kir2dl3+、kirdl1+、nkg2a+)。
90.图5为在用根据一具体实施例的自然杀伤细胞培养之前将外周血单核细胞中抗癌物质(颗粒酶b、穿孔素以及干扰素
‑
γ)的表达用流式细胞仪显示为散点图和图表的结果。
91.图6为在用根据一具体实施例的自然杀伤细胞培养之前将外周血单核细胞中cd107a的脱颗粒化的表达显示为散点图和图表的结果。
92.图7为将根据一具体实施例的自然杀伤细胞的胶质母细胞瘤细胞系的配体表达显示为散点图的结果(a:t98g细胞;b:u
‑
87mg细胞;c:a172细胞;d:u
‑
373mg细胞)。
93.图8为显示根据一具体实施例自然杀伤细胞对血癌细胞系k562的根据e:t比率的细胞杀伤能力的结果。
94.图9为显示根据一具体实施例自然杀伤细胞对胶质母细胞瘤细胞系a172、u
‑
87mg、u
‑
373mg、t98g的根据e:t比率的细胞杀伤能力的结果。
95.图10为确认在阻断根据一具体实施例的自然杀伤细胞中的特定受体后,其自然杀伤细胞对癌细胞系的细胞毒性的图表。
96.图11为观察向卵巢癌动物模型施用根据一具体实施例的自然杀伤细胞后肿瘤重量减少的图表(箭头表示给药时间)。
97.图12为观察向胃癌动物模型施用根据一具体实施例的自然杀伤细胞后肿瘤重量减少的图表(箭头表示给药时间)。
98.图13为观察向胶质母细胞瘤动物模型施用根据一具体实施例的自然杀伤细胞后肿瘤重量减少的图表。
具体实施方式
99.以下将参考实施例更详细地描述本发明。然而,这些实施例仅是为了示例性地描述本发明,而本发明的范围不限于这些实施例。
100.实施例、免疫受体活性增加的自然杀伤细胞的制备
101.为了制备表达显着胶质母细胞瘤免疫受体的自然杀伤细胞,如下培养自然杀伤细胞。
102.1、外周血单核细胞的制备
103.1.1、从血液中分离外周血单核细胞(pbmc)和血浆
104.血液通过从正常人的静脉中收集血液来准备。此时,将含有肝素抗凝的采血管用作采血容器。将从患者收集的血液小心地转移到两个含有ficoll(#17
‑
1440
‑
02,ge healthcare或同等以上)的试管(#352070,bd或同等以上)中,每管30毫升。将含有血液的试管在断开(break off)状态下以2500rpm离心分离10分钟后,将上层的血浆部分转移到新试管中。将所转移的血浆在加热块(heat block)中失活30分钟,然后以4000rpm离心分离5分钟。将所离心分离的管中的上清液转移到新管中,标记为血浆,并在2℃至8℃下保存。
105.从所述放入血液和ficoll并离心分离的管中收集血浆,将下层剩余的淡黄色层转移到新管中,此时注意不要与红细胞层混合,然后添加不含ca/mg的杜尔贝科磷酸盐缓冲盐水(dulbecco's phosphate
‑
buffered saline,dpbs)(#14190,gibco)。然后,在1500rpm离心分离5分钟后,去除上清液。将去除上清液后剩余的沉淀细胞悬浮在5ml的rbc溶解缓冲液(red blood cell lysis buffer)中。此后,将细胞悬液以1500rpm离心分离5分钟以除去上清液,将不含ca/mg的dpbs加入到除去上清液的管中,并再次以1500rpm离心分离5分钟。将去除上清液后剩余的沉淀细胞悬浮在1ml的alys505nk
‑
ex(#01410p10,csti)培养基中。
106.从所述用alys505nk
‑
ex悬浮的细胞悬液中取出少量,用不含ca/mg的dpbs稀释至所述量的100倍,然后取少量稀释液与等体积台盼蓝(trypan blue)混合,并置于血球计数器上测定细胞数和存活率。
107.1.2、外周血单核细胞的冻结
108.将所述实施例1.1中获得的所有细胞悬液以1500rpm离心分离5分钟,然后去除上清液。将细胞悬浮在2℃至8℃保存的cryostor cs10或alys505nk
‑
ex+albumin+dmso混合物中,使细胞数为1至100
×
106个细胞/ml。将1ml的悬浮细胞分配到每个2ml冻存管(cryogenic vial)中,使用程控降温仪(controlled rate freezers,crf)在0℃下10分钟至15分钟、
‑
12℃下5分钟至10分钟和
‑
42℃下0.5分钟至1分钟的条件下进行第一冻结步骤,第一冻结步骤后,在
‑
25℃下1分钟至3分钟和
‑
15℃下1分钟至3分钟的条件下进行冻结,第二冻结步骤后,在
‑
42℃下20分钟至40分钟和
‑
120℃下20分钟至50分钟的条件下进行冻结,或者在4℃至
‑
40℃范围内以3℃/m进行第一冻结步骤,第一冻结步骤后,在
‑
40℃至
‑
90℃范围内以5℃/m进行第二冻结步骤,第二冻结步骤后,在
‑
90℃至
‑
120℃范围内以5℃/m的条件下进行冻结。将所冻结的细胞转移到ln2罐中并保存(
‑
130℃以下)。
109.1.3、已冻结的外周血单核细胞的解冻
110.加热块设置为37℃,并将含有10%血浆(plasma)的培养液加入t烧瓶中。根据细胞浓度,培养基的体积可以不同地调整为例如4ml、6ml、8ml或10ml。将所述实施例2.2中冻结的冻存管放入加热块中以解冻所冻结的外周血单核细胞。当所冻结的外周血单核细胞大约解冻一半时,将其转移到含有培养液的t烧瓶中。接下来,将其置于37℃的5%co2培养箱中培养1天。将所培养的外周血单核细胞收集到试管中后,加入不含ca/mg的dpbs,以1500rpm离心分离5分钟,然后除去上清液。将离心分离后的细胞悬浮于少量培养基后,测定细胞数。表1显示将冻结保存的细胞解冻后的存活率。从表1中可以看出,93%以上的根据本发明冻结保存后解冻的pbmc存活,证实维持高存活率。
111.【表1】
112.解冻后外周血单核细胞存活率
113.来源存活率(%)供体198.07供体293供体397.4
114.2、自然杀伤细胞的培养2.1、涂有纤连蛋白和γ
‑
球蛋白的培养烧瓶的准备(第一次)
115.在15ml管中加入0.01ml的纤连蛋白(#fc
‑
010,millipore)和0.121ml的γ
‑
球蛋白(#020a1004,绿十字)溶液,然后加入9.859ml的不含ca/mg的dpbs。使用移液管将所制备的涂层液放入t75烧瓶(#156499,nunc)中并在2℃至8℃下反应16小时以上。在细胞培养之前,用不含ca/mg的dpbs洗涤残留的涂层液,然后去除。
116.2.2、自然杀伤细胞的第一次培养
117.取实施例1中准备的细胞悬液,放入所述实施例2.1中制备的涂层烧瓶中,加入1.5ml的自体血浆、0.075ml的il
‑
18(#b003
‑
2,r&d)、0.075ml的pdgf
‑
dd(1159
‑
sb,r&d)、0.03ml的抗
‑
nkp46(#mab1850,r&d)和13.4625ml的alys505nk
‑
ex
118.(#01410p10,csti),并在co2培养箱中培养2天至3天。然后,向烧瓶中加入1.5ml的自体血浆和13.5ml的alys505nk
‑
ex,并在co2培养箱中培养1天至2天。
119.2.3、涂有纤连蛋白和γ
‑
球蛋白的培养烧瓶的准备(第二次)
120.在50ml管中加入0.025ml的纤连蛋白(#fc
‑
010,millipore)和0.303ml的γ
‑
球蛋白(#020a1004,绿十字)溶液,然后加入24.647ml的不含ca/mg的dpbs。使用移液管将所制备的涂层液放入t175烧瓶(#159910,nunc)中并在2℃至8℃下反应16小时以上。在细胞培养之前,用不含ca/mg的dpbs洗涤残留的涂层液,然后去除。
121.2.4、自然杀伤细胞的第二次培养和功能增强新物质的处理
122.实施例2.2的第一次培养后,从培养箱中取出正在培养细胞的t75烧瓶并收集细胞,然后转移到t175烧瓶(#159910,nunc)中。将3ml的血浆、0.06ml的抗
‑
nkp46(#mab1850,r&d)和27ml的alys505nk
‑
ex(#01410p10,csti)添加到t175烧瓶中,并在co2培养箱中培养1天至2天。然后,加入剩余的血浆和0.12ml的抗
‑
nkp46溶液、0.03ml的il
‑
18、0.03ml的pdgf
‑
dd(1159
‑
sb,r&d)、53.85ml的alys505nk
‑
ex
123.(#01410p10,csti),以及作为功能增强新物质的50ng/ml的pdgf
‑
aa、pdgf
‑
bb、pdgf
‑
cc、pdgf
‑
dd(1159
‑
sb,r&d)和pdgf
‑
ab中的一个或两个以上,然后在co2培养箱中再次培养1天至2天。
124.2.5、自然杀伤细胞的第三次培养
125.将所述实施例2.4中培养的t175烧瓶的细胞和血浆置于含有2000iu/ml的il
‑
2的培养液,并在co2培养箱中培养。2天至3天后,将新的等体积培养液(含有2000iu/ml的il
‑
2的培养液)与正在培养细胞的细胞悬液混合,然后在co2培养箱中培养。
126.在所述培养(包括第一次培养、第二次培养和第三次培养)中,还可以通过分别将预定量的il
‑
2添加到未添加il
‑
2的免疫细胞培养液中来使用,而不使用已添加il
‑
2的培养液。
127.3、自然杀伤细胞按培养期的表型分析
128.在根据所述实施例的培养方法培养的激活自然杀伤细胞中,在从培养前的外周血单核细胞到分化和扩增为自然杀伤细胞的培养期间第0天、第6天、第10天和第14天分析细胞的特征。
129.为了分析细胞的特征,将cd3、cd56、cd19、cd16、cd14、cd4和cd8确认为主要标志物。在培养期间,cd3
‑
cd56+nk细胞比例增加,在培养后第14天,nk细胞作为主要成分占85.5%(4.92)。另外,cd3+cd56
‑
t细胞在培养第14天下降到10%,cd3+cd56+nkt细胞以5%的恒定比率存在。单核细胞和b细胞为0%,未发现。此外,培养后的t细胞中cd8+细胞的比例高于cd4+细胞。
130.图1显示与培养前相比高纯度自然杀伤细胞的分布。
131.图2为显示图1中7名培养评价图表的结果。(a,b,c,d)
132.根据图2中e和f的结果,第14天的培养均保持90%以上的高存活率,并表现出1259倍的自然杀伤细胞增殖能力。
133.4、培养前(d0)和培养后(d14)nk细胞受体表达的相对平均荧光强度值
134.测定了根据所述实施例的培养方法培养的激活自然杀伤细胞的相对平均荧光强度值。
135.相对平均荧光强度是指与同种型相比阳性细胞的表达强度值,并由以下数学式1定义。
136.【数学式1】
137.相对平均荧光强度=受体相对平均荧光强度/同种型相对平均荧光强度
138.相对平均荧光强度为一种不同于表达比率的概念,所述表达比率测量与同种型相比的阳性细胞的表达比率,即使具有相同百分比的表达比率,每个受体功能的强度根据平均荧光强度值也不同,只有相对平均荧光强度值高时,才可以理解为实际功能有所提升。
139.在本实施例中,与所述2.5一样,通过处理新物质来制备了功能增强的新型自然杀伤细胞,并且通过测量其特定受体的平均荧光强度值,定义了新型自然杀伤细胞的特征。
140.为了测量相对平均荧光强度,首先回收培养前后的细胞以准备1
×
107个细胞,以1500rpm离心分离5分钟,然后去除上清液,并且用facs缓冲液(含2%胎牛血清(fbs)的磷酸盐缓冲盐水)稀释至2ml。对于下表2中记载的物质,将含有荧光物质的抗体按条件放入5ml的facs管中,并将每100μl稀释的细胞溶液分配并在冷藏状态下染色30分钟。染色后,分别加入500μl的磷酸盐缓冲盐水,以3200rpm离心分离3分钟,然后去除上清液。在所染色的细胞团块中加入500μl的1%多聚甲醛以固定后,使用流式细胞仪(bechman coulter,美国)分析细胞免疫受体的表达,并根据所述数学式1测量相对平均荧光强度值。
141.相对平均荧光强度值的结果如下表2所示。
142.【表2】
143.自然杀伤细胞受体的相对平均荧光强度(n=4~5)
144.[0145][0146]
如所述表2所示,发现与抗癌活性和自然杀伤细胞激活相关的因子nkg2d、nkp30、nkp44、itga1和itga2的相对平均荧光强度值从低至1.5倍增加到多至25倍。上述结果表明,根据一具体实施例的经新型物质处理的自然杀伤细胞为具有特定平均荧光强度值的新型自然杀伤细胞,并且抗癌活性和细胞本身的活性均增加。
[0147]
5、免疫受体的表达对比分析
[0148]
比较分析根据所述实施例培养方法培养的激活自然杀伤细胞与培养前外周血单核细胞之间免疫受体的表达情况。
[0149]
具体地以与所述4相同的方式,使用含有针对下表3所示物质的荧光物质的抗体来分析细胞中免疫受体的表达,其结果示于图3和图4中。
[0150]
【表3】
[0151] fitcpeapc1iggiggigg2cd3cd16cd563cd3cd69cd564cd3nkg2dcd56
5cd3nkp30cd566cd3nkp44cd567cd3nkp46cd568cd3cd226(dnam
‑
1)cd569cd3cd158b(kir2dl3)cd5610cd3nkb1(kir3d1)cd5611cd3nkg2a(cd159a)cd5612cd3cd158a(kir2dl1)cd5613cd3cd2cd56
[0152]
图3为比较根据一具体实施例的自然杀伤细胞与培养前外周血单核细胞的免疫受体的表达的散点图结果。图4是为根据一具体实施例的自然杀伤细胞与培养前外周血单核细胞的免疫受体的表达变化的图表结果。
[0153]
如图3和图4所示,可以看出,在根据一具体实施例的自然杀伤细胞中,nkg2d、dman
‑
1、cd69、cd2、nkp30、nkg2a和nkp44的表达增加了,并且与培养前外周血单核细胞相比,nkp46、cd16、kir2dl1、kir2dl2/3和kir3dl1的表达量几乎没有变化。
[0154]
6、激活自然杀伤细胞的脑组织、血脑屏障渗透性或细胞迁移促进相关因子的表达分析
[0155]
比较分析根据所述实施例培养方法培养的激活自然杀伤细胞的脑组织、血脑屏障渗透性或细胞迁移促进相关因子的表达情况。
[0156]
具体地,除了使用针对下表4所示物质的含有荧光物质的抗体以外,均采用与所述4相同的方法进行,并且对细胞脑组织、血脑屏障渗透性或细胞迁移促进相关因子的表达进行了分析,其结果见表4。
[0157]
【表4】
[0158] 表达标志物表达(%)1psa
‑
ncam99.82巢蛋白99.43s100b96.94酪氨酸激酶89.75cd1471006cd291007cd49c99.98cd14655.39cd1599.110cd3157.2
[0159]
7、激活自然杀伤细胞的kir2ds4的表达分析
[0160]
对根据所述实施例的培养方法培养的激活自然杀伤细胞的kir2ds4的mrna表达模式与培养前外周血单核细胞的mrna表达模式进行比较。
[0161]
具体地,通过trizol分离法从培养前细胞和培养后细胞中提取rna,并进行总rna测序以确认mrna的表达模式。所述结果如下表5所示。
[0162]
【表5】
[0163]
id基因符号倍数变化(p14自然杀伤细胞/p0外周血单核细胞)9513kir2ds432.562
[0164]
如所述表5所示,在根据一具体实施例的自然杀伤细胞中,可以发现与培养前外周血单核细胞相比,kir2ds4的表达增加了约32倍。
[0165]
实验例1、抗癌物质的表达分析
[0166]
比较分析根据所述实施例的培养方法培养的激活自然杀伤细胞与培养前外周血单核细胞的抗癌物质(颗粒酶b、穿孔素、干扰素
‑
γ和cd107a)的表达。
[0167]
首先,如下分析颗粒酶b和穿孔素。
[0168]
为每个样品准备5
×
105个细胞,以1500rpm离心分离5分钟后,除去上清液,从而得到细胞团块。每个细胞团块用facs缓冲液稀释100μl,并加入抗
‑
igg1k
‑
fitc(ebioscience,11
‑
4714
‑
42)、抗
‑
igg1k
‑
apc(ebioscience,17
‑
4714
‑
42)和抗
‑
cd3
‑
fitc(ebioscience,11
‑
0038
‑
42)和抗
‑
cd56
‑
apc(ebioscience,17
‑
0567
‑
42)的抗体,在室温下将表面抗原染色15分钟,然后分别加入500μl的磷酸盐缓冲盐水并以6000rpm离心分离3分钟。为了进行细胞内染色,使用了固定/透化溶液试剂盒(bd,554714),并且加入固定/透化溶液,在冷藏状态下反应20分钟,加入perm/wash缓冲液,以6000rpm离心分离3分钟两次。通过去除上清液而获得的细胞团块分别用100μl的perm/wash缓冲液稀释,以用抗
‑
igg1k
‑
pe(ebioscience,12
‑
4714
‑
42)、抗
‑
perforin
‑
pe(ebioscience,12
‑
9994
‑
42)和抗
‑
granzymeb
‑
pe(ebioscience,12
‑
8899
‑
41)的抗体,在冷藏状态下进行细胞内染色30分钟。染色后,分别向细胞溶液中加入500μl的磷酸盐缓冲盐水以进行离心分离,并且用1%多聚甲醛固定后,使用流式细胞仪进行分析。
[0169]
以与上述相同的方法获得细胞团块后,使用在不含酚红的rpmi培养基中添加有10%胎牛血清和1%青霉素的培养液稀释,并分别将500μl分配到24孔板中。然后,处理0.5μl的pma/离子霉素(biolegend)和0.5μl的golgiplugtm(bd bioscience,美国)并在37℃的5%co2培养箱中反应4小时。反应4小时后,收获细胞,以6000rpm离心分离3分钟并去除上清液。使用抗
‑
igg1k
‑
fitc(ebioscience,11
‑
4714
‑
42)、抗
‑
igg1k
‑
apc(ebioscience,17
‑
4714
‑
42)、抗
‑
cd3
‑
fitc(ebioscience,11
‑
0038
‑
42)和抗
‑
cd56
‑
apc(ebioscience,17
‑
0567
‑
42)的抗体对细胞团块进行表面抗原染色,并进行细胞内染色。细胞内染色用抗
‑
igg1k
‑
pe(ebioscience,12
‑
4714
‑
42)和抗
‑
inf
‑
γ
‑
pe(ebioscience,12
‑
8899
‑
41)的抗体进行染色,用1%多聚甲醛固定,并使用流式细胞仪进行分析。
[0170]
所述颗粒酶b、穿孔素和干扰素γ的结果如图5所示。
[0171]
图5为在用根据一具体实施例的自然杀伤细胞培养之前将外周血单核细胞中抗癌物质(颗粒酶b、穿孔素以及干扰素
‑
γ)的表达用流式细胞仪显示为散点图和图表的结果。
[0172]
如图5所示,可以发现根据一具体实施例的自然杀伤细胞表达至少80%以上的抗癌物质颗粒酶b、穿孔素和干扰素γ。与培养前外周血单核细胞相比,这至少增加了4倍。
[0173]
另外,为了比较根据一具体实施例的自然杀伤细胞与培养前外周血单核细胞之间cd107a的脱颗粒化的表达,将从慢性粒细胞白血病患者的骨髓提取的淋巴母细胞k562作为靶细胞进行反应,并分析cd107a的表达水平。
[0174]
具体地,靶细胞k562细胞按条件准备1
×
105个细胞,以1500rpm离心分离5分钟,然
后去除上清液以获得团块。通过分别加入250μl的在不含酚红的rpmi培养基中添加有10%胎牛血清和1%青霉素
‑
链霉素(10000u/ml)(gibco,15140122)的培养液来稀释细胞团块。为了以5:1的比例准备激活自然杀伤细胞和靶细胞,自然杀伤细胞按条件准备5
×
105个细胞。将所准备的细胞离心分离后,去除上清液,并添加250μl的与稀释靶细胞的培养液相同的培养液以进行悬浮。此后,将所准备的激活自然杀伤细胞和靶细胞按5:1的比例放入24孔板中,然后添加抗
‑
igg1k
‑
pe(ebioscience)和抗
‑
cd107a
‑
pe
[0175]
(ebioscience)抗体并在37℃、5%co2条件的培养箱中反应4小时。4小时反应完成后,收获细胞,并且用具有抗
‑
igg1k
‑
fitc(ebioscience)、抗
‑
igg1k
‑
apc(ebioscience)、抗
‑
cd3
‑
fitc(ebioscience)和抗
‑
cd56
‑
apc的荧光物质的抗体进行染色以仅区分自然杀伤细胞。染色后,分别加入500μl的磷酸盐缓冲盐水以进行离心分离并洗涤细胞,1%的多聚甲醛固定后,使用流式细胞仪分析,其结果如图6所示。
[0176]
图6为在用根据一具体实施例的自然杀伤细胞培养之前将外周血单核细胞中cd107a的脱颗粒化的表达显示为散点图和图表的结果。
[0177]
如图6所示,可以发现根据一具体实施例的自然杀伤细胞表达至少60%以上的cd107a,比培养前外周血单核细胞相比,这至少增加了3倍。
[0178]
实验例2、胶质母细胞瘤细胞系中配体与激活自然杀伤细胞的相互作用分析
[0179]
分析了胶质母细胞瘤细胞系的配体和根据一具体实施例的自然杀伤细胞的相互作用。
[0180]
首先,作为胶质母细胞瘤细胞系的u
‑
87mg和t98g细胞在添加有10%胎牛血清和1%青霉素
‑
链霉素(10000u/ml)的dmem培养基中培养,作为另一种胶质母细胞瘤细胞系的u
‑
[0181]
373mg和a172细胞在添加有10%胎牛血清和1%青霉素
‑
链霉素(10000u/ml)的rpmi培养基中培养。然后,对于作为胶质母细胞瘤细胞系的t98g、u
‑
87mg、a172和u
‑
373mg,通过染色作为自然杀伤细胞的配体的hla
‑
abc、hla
‑
e、mica、micb、ulbp1、ulbp2、ulbp3、ulbp4、pvr、icam
‑
1、icam
‑
2、icam
‑
3、lfa
‑
3、b7
‑
h6、pvr和nectin
‑
2的抗体来分析细胞的表达水平。
[0182]
具体地,在t75培养烧瓶培养的每个癌细胞株中加入0.25%胰蛋白酶
‑
edta(1x)和酚红,在37℃的5%co2培养箱中反应3分钟至5分钟后,悬浮细胞,并且用含10%胎牛血清的培养液失活酶以回收细胞。回收的细胞通过测定细胞数以准备8.5
×
106个细胞,以1500rpm离心分离5分钟后,除去上清液并用facs缓冲液(含2%胎牛血清的磷酸盐缓冲盐水)稀释至1.7ml。接下来,将含有下表6中记载的荧光物质的抗体按条件放入5ml的facs管中,并将每100μl稀释的细胞溶液分配并在室温染色15分钟。所染色的细胞中分别加入500μl的1%多聚甲醛以进行固定,然后使用流式细胞仪(bechman coulter,美国)进行分析,其结果如图7所示。
[0183]
【表6】
[0184] fitcpeapc1iggiggigg2 mica 3
ꢀꢀ
micb
4 ulbp
‑
1 5 ulbp
‑
2 6 ulbp
‑
3 7 ulbp
‑
4 8
ꢀꢀ
b7
‑
h69 pvr(cd155) 10 nectin
‑
2(cd112) 11
ꢀꢀ
lfa
‑
3(cd56)12 icam
‑
1(cd54) 13 icam
‑
2(cd102) 14icam
‑
3(cd50)
ꢀꢀ
15 hla
‑
e 16
ꢀꢀ
hla
‑
abc
[0185]
图7为将根据一具体实施例的自然杀伤细胞的胶质母细胞瘤细胞系的配体表达显示为散点图的结果。
[0186]
如图7所示,t98g为具有替莫唑胺耐药性的胶质母细胞瘤细胞,u
‑
373mg和u
‑
87mg分别为3级和4级胶质母细胞瘤细胞系。通过配体对细胞的分析,可以期待通过与自然杀伤细胞的主要受体相互作用的杀伤能力。尤其,可以预期在t98g(rmfi24.8)和u
‑
87mg(rmfi30.5)中获得更显着的结果,其中,hla
‑
abc表达较低,而nk配体表达较高。
[0187]
实验例3、对胶质母细胞瘤细胞系的细胞杀伤能力的确认
[0188]
为了确认根据一具体实施例的自然杀伤细胞的直接细胞杀伤能力,对自然杀伤细胞高度敏感的血癌细胞系k562和胶质母细胞瘤细胞系的a172、u
‑
87mg、u
‑
373mg和t98g细胞进行细胞杀伤能力评估。
[0189]
回收靶癌细胞(k562、u
‑
87mg、u
‑
373mg、a172、t98g),以1500rpm离心分离5分钟并去除上清液。然后用dpbs稀释并洗涤,通过使用不含酚红的rpmi培养基中添加10%胎牛血清的培养液来悬浮洗涤后的细胞团块。按条件准备1
×
105个细胞,并通过在5%的co2条件下以5μm浓度的cfse(life technologies)在培养箱中静置10分钟来染色。用dpbs洗涤两次后,用不含酚红的rpmi培养基中添加有10%胎牛血清的培养液稀释。激活自然杀伤细胞与靶细胞按e:t比例(1:1、1.25:1、2.5:1、5:1、10:1、20:1)准备,并将细胞与靶细胞一起分配在24孔板中并混合。反应进行4小时,并在反应完成前20分钟处理7aad(7
‑
氨基放线菌素d)。反应完成后,将细胞回收到5ml的facs管中,并通过流式细胞仪分析细胞杀伤能力,其结果如图8和图9所示。
[0190]
图8为显示根据一具体实施例自然杀伤细胞对血癌细胞系k562的根据e:t比率的细胞杀伤能力的结果。
[0191]
图9为显示根据一具体实施例自然杀伤细胞对胶质母细胞瘤细胞系a172、u
‑
87mg、u
‑
373mg、t98g的根据e:t比率的细胞杀伤能力的结果。
[0192]
如图8和图9所示,可以确认,对培养前外周血单核细胞而言,对胶质母细胞瘤的抗癌活性不显着,但根据一具体实施例的自然杀伤细胞在血液癌细胞系和胶质母细胞瘤细胞系中具有显着的抗癌活性。
[0193]
上述结果表明,根据一具体实施例的新型自然杀伤细胞不仅显着表达针对胶质母细胞瘤的免疫受体,而且表达能够克服自我耐受的免疫受体,其具有可有效用于治疗血癌和胶质母细胞瘤等的效果。
[0194]
实验例4、自然杀伤细胞的阻断试验
[0195]
当根据一具体实施例的自然杀伤细胞中特定因子的表达被抑制时,确认了对癌细胞的细胞毒性是否被抑制。
[0196]
具体地,使用针对nkp30的抗体、针对nkp44的抗体和针对nkg2d的抗体,制备了这些受体的活性被阻断的自然杀伤细胞。然后,与所述实验例3相同的方法确认了针对u
‑
87mg、u
‑
373mg、a172、t98g的细胞毒性,其结果如图10所示。
[0197]
图10为确认在阻断根据一具体实施例的自然杀伤细胞中的特定受体后,其自然杀伤细胞对癌细胞系的细胞毒性的图表。
[0198]
如图10所示,当在根据一具体实施例的自然杀伤细胞中抑制nkp30、nkp44或nkg2d的活性时,可以发现细胞毒性显着降低。尤其,当抑制nkg2d的活性时,或者当均抑制3种受体的活性时,可以发现细胞毒效果被显着抑制。
[0199]
这些结果表明,在根据一具体实施例的自然杀伤细胞中,nkp30、nkp44和/或nkg2d的活性为细胞毒性的主要因素,并且具有特定平均荧光强度值的nkp30、nkp44和/或nkg2d的根据一具体实施例的自然杀伤细胞为抗癌活性显着增强的细胞。
[0200]
实验例5、自然杀伤细胞的抗癌活性分析
[0201]
5.1、卵巢癌动物模型中的抗癌活性分析
[0202]
根据一具体实施例的自然杀伤细胞的抗癌活性在体内得到证实。
[0203]
首先,将卵巢癌细胞系ovcar3以每只1
×
107个细胞皮下注射给nod
‑
scid小鼠,以制备异种移植动物模型。此后,如下表7所示设置实验组。
[0204]
【表7】
[0205][0206]
作为阴性对照组的g1空白对照组以5%白蛋白:葡聚糖=1:1的比例制备,并以100μl静脉内给药。作为阳性对照组的g2顺铂组给予顺铂1.5mg/kg。作为自然杀伤细胞给药组的g3新鲜型自然杀伤细胞组和g4冻结型自然杀伤细胞组在新鲜型和冻结型方面存在差异,在g4冻结型自然杀伤细胞组中,解冻冻结的自然杀伤细胞并每只动物给予1
×
107个细胞,
而在g3新鲜型自然杀伤细胞组中,在培养过程中回收细胞并每只动物给予1
×
107个细胞。给药组每周给药2次,共给药6次。在试验期间,观察小鼠的存活率、肿瘤大小和症状,并监测78天。78天后,处死动物以测量提取肿瘤的重量,其结果见下表8和图11。
[0207]
【表8】
[0208]
组别肿瘤重量(平均,g)g11.74
±
0.27g21.15
±
0.10g30.49
±
0.07g40.57
±
0.09
[0209]
图11为观察向卵巢癌动物模型施用根据一具体实施例的自然杀伤细胞后肿瘤重量减少的图表(箭头表示给药时间)。
[0210]
如表8和图11所示,当施用根据一具体实施例的自然杀伤细胞时,可以确认与阳性对照组相比,肿瘤的重量减少了约50%至60%。尤其可见,在阳性对照组中,50天后肿瘤生长加速,肿瘤体积迅速增大,而在根据一具体实施例的自然杀伤细胞给药组中,在监测期间肿瘤生长显着延迟。
[0211]
5.2、胃癌动物模型中的抗癌活性分析
[0212]
根据一具体实施例的自然杀伤细胞的抗癌活性在体内得到证实。
[0213]
首先,将胃癌细胞系nci
‑
n87以每只1
×
106个细胞注射给nod
‑
scid小鼠,以制备异种移植动物模型。肿瘤移植后第6天,设置如表9所示的试验组。
[0214]
【表9】
[0215][0216]
作为阴性对照组的g1空白对照组以5%白蛋白:葡聚糖=1:1的比例制备,并以200μl静脉内给药。作为阳性对照组的g2 her2组每周2次静脉给予赫赛汀1mg/kg,共6次。作为
单独使用自然杀伤细胞的组,g3新鲜型自然杀伤细胞组和g4冻结型自然杀伤细胞组每周两次以每只1
×
107细胞静脉内给药,共6次。在g3新鲜型自然杀伤细胞组中,给予通过在培养过程中回收细胞而获得的细胞,在g4冻结型自然杀伤细胞组中,解冻所冻结的自然杀伤细胞并每只小鼠给予1
×
107个细胞。作为自然杀伤细胞和赫赛汀的联合给药组,g5新鲜型自然杀伤细胞+赫赛汀组和g6冻结型自然杀伤细胞+赫赛汀组为将1mg/kg赫赛汀联合施用于与自然杀伤细胞单独给药组相同的细胞的组,每周静脉注射两次,共计6次。
[0217]
在试验期间,观察小鼠的存活率、肿瘤大小和症状,并监测52天。52天后,处死动物以测量提取肿瘤的重量,其结果见下表10和图12。
[0218]
【表10】
[0219][0220]
图12为观察向胃癌动物模型施用根据一具体实施例的自然杀伤细胞后肿瘤重量减少的图表。
[0221]
如表10和图12所示,当施用根据一具体实施例的自然杀伤细胞时,可以确认与阳性对照组相比,肿瘤的重量减少了约60%至70%。尤其可见,在阳性对照组中,28天后肿瘤生长加速,肿瘤体积迅速增大,而在根据一具体实施例的自然杀伤细胞给药组中,在监测期间肿瘤生长显着延迟。
[0222]
另外可以确认,在联合施用赫赛汀和自然杀伤细胞的组中,与单独施用自然杀伤细胞的组相比,肿瘤重量减少了约17%至20%。这意味着当应用自然杀伤细胞与赫赛汀联合施用的抗体依赖性细胞毒性(antibody
‑
dependent cell cytotoxicity,adcc)时,可以获得较高的肿瘤生长抑制效果和抗癌药效维持期。
[0223]
5.3、胶质母细胞瘤动物模型中的抗癌活性分析
[0224]
根据一具体实施例的自然杀伤细胞的抗癌活性在体内得到证实。
[0225]
首先,在7周龄的nog雌性小鼠中,将1
×
104个u87mg
‑
luci细胞移植到小鼠模型的右侧大脑半球颅骨(brain cerebral hemisphere skull)中,以建立实验原位移植动物模型,其中所述u87mg
‑
luci为荧光素酶基因被转导到人脑胶质母细胞瘤细胞系u87mg中的细
胞。细胞移植一段时间后,使用ivis生物成像设备(perkinelmer,美国)测量肿瘤的光学图像生物荧光(bioluminescence,bli),选择受试者使得bli值在移植后第7天具有平均值。所选择的动物按试验组划分,如下表11所示。
[0226]
【表11】
[0227][0228]
作为阴性对照组的g1空白对照组以5%白蛋白:葡聚糖=1:1的比例制备,并每只以200μl静脉内给药。试验组g2自然杀伤细胞组每只动物静脉注射1
×
106自然杀伤细胞,每周给药2次,共给药6次。在监测期间每周两次使用ivis生物成像设备(perkinelmer,美国)测量肿瘤体积。为了测量肿瘤体积,以10ml/kg腹膜内施用150mg/kg剂量的荧光素(luciferin)(promega),并且10分钟后,使用吸入麻醉剂依次麻醉每个给药的受试者。使用ivis设备依次测量完全麻醉的受试者的肿瘤光学图像生物荧光(bioluminescence,bli),并且根据委托woojung bio研究所的内部标准阈值分析所测量的感兴趣区(region of interest,roi)的光学图像值。所述结果如下表12和表13所示。
[0229]
【表12】
[0230][0231]
每个数字表示平均值+s.e.(n=5)。s.e.:标准误差,n:动物数量
[0232]
图13为观察向胃癌动物模型施用根据一具体实施例的自然杀伤细胞后肿瘤重量减少的图表。
[0233]
如表12和图13所示,在阴性对照组(g1)中,观察到给药后长达16天的实验期间肿
瘤体积的波动持续增加,即从4.28.e+08p/sec/cm2/sr增加到1.09.e+10p/sec/cm2/sr。另一方面,当施用根根据一具体实施例的自然杀伤细胞时,在实验期间几乎不显着地从3.19.e+08p/sec/cm2/sr增加到1.78.e+09p/sec/cm2/sr,并且第16天可以发现,与阴性对照组相比,肿瘤重量的差异约为5倍以上。这意味着根据一具体实施例的自然杀伤细胞对胶质母细胞瘤中的肿瘤生长具有高度抑制效果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1