使用了小片多孔膜的细胞培养法的制作方法
1.本发明涉及细胞培养和物质产生系统,更具体而言,涉及使用了小片聚合物多孔膜的细胞培养法。另外,涉及具备小片聚合物多孔膜的细胞培养装置和试剂盒。
背景技术:
2.细胞培养
3.细胞通常以具有三维结构的群体形式存在于生物体内。另一方面,在人工环境中培养细胞时,通常使用如下方法:以细胞呈单层状贴附于培养容器底部的方式进行二维培养的经典平面培养法、在使细胞分散于液体培养液中的状态下进行培养的悬浮培养法。对于用于平面培养法的细胞而言,粘附性相对较高的细胞是适合的,但即使在使用了适合的细胞的情况下,细胞的性质有时也会由于培养环境的差异而发生较大改变。对于悬浮培养法而言,也存在适合的细胞和不适合的细胞。
4.随着对疫苗、酶、激素、抗体、细胞因子等用于医疗用途的生物体内蛋白质等的需求的日益增大,利用细胞培养来大量产生生物体内蛋白质等变得越来越重要。另外,随着再生医学中的细胞移植等转向实用化的趋势,高效且简便地培养大量细胞的方法论正引起人们的关注。进而,最近还可见用于高效地产生已实现作为诊断标记物、药物递送载体和生物药物的利用的、能作为生理活性物质发挥作用的外泌体的细胞培养系统的例子。
5.对于大肠杆菌等悬浮细胞,研究了在大型培养槽中进行大量培养的技术。使用了大型培养槽的悬浮细胞的大量培养中,需要大量的培养液和搅拌装置。另一方面,使用粘附细胞进行物质产生的研究也随着所使用的细胞的研究进展而受到人们关注。若想大量培养粘附细胞,经典的平面培养法的情况下,由于只能以二维方式使细胞展开而需要很大的培养面积。
6.作为在立体环境中培养大量的细胞的方法,报道了使用生物反应器、细胞培养载体的方法(非专利文献1、专利文献1)。作为使用生物反应器的方法,有:将玻璃纤维等纤维状物质堆积在柱内,在该空间内连续培养细胞而产生物质的方法(专利文献2)。另外,作为代表性的细胞培养用载体,作为能够附着培育出细胞的小颗粒的微载体成为被广泛研究的对象(专利文献3、4)。
7.如专利文献4中以产生为例所示,为了通过使用微载体的细胞培养法来增加产物的量并提高效率,最重要的课题在于实现在高密度下的细胞培养。另外,如何使细胞高效且简便地增殖、如何能将细胞移植/接种在作为载体的微载体上也成为重要的课题。关于这点,在使用微载体的细胞培养系统中,为了使微载体彼此不聚集,需要充分地搅拌/扩散。因此,需要足矣充分地搅拌/扩散分散有微载体的培养液的体积,因此能培养的细胞密度存在上限。另一方面,为了通过搅拌而实现充分的营养供给,细胞不会容易地被剥离变得尤为重要,因此对剪切力的耐受性成为不可欠缺的特性。进而,为了将微载体和培养液分离,需要用能够分离较细的颗粒的过滤器进行分离等,在量和效率方面仍存在课题。另外,已经创造出很多三维培养技术,但如水凝胶、球状体法等大多数是临时培养技术或面向评价的技术,
实际上尚没有报道能够长期产生物质的培养方法。为了生物药品、生理活性稀缺物质或外泌体之类的物质的稳定生产,需要稳定的长期培养技术。与此相关,包括间充质干细胞在内的原代细胞的长期培养已有很多报道(非专利文献2;非专利文献3),但其无法作为细胞培养系统的制造方法。
8.认为外泌体所具有的生理活性受到被受外泌体来源细胞控制的核酸、蛋白质的构成的支配,在细胞培养中的诱导期、对数生长期、静止期和死亡期的各阶段中所产生的外泌体的品质发生变化。因此,在考虑以工业规模生产外泌体时,外泌体的特性随着培养时间而发生变化在品质管理方面是不优选的,要求在已建立的生产系统中能够长期产生品质均一的外泌体。在现有的使用培养细胞的外泌体产生技术中,这样的细胞培养系统的随时间经过所导致的外泌体的品质变化的问题尚未得到充分解决,成为阻碍品质稳定的外泌体的供给、建立工业规模的外泌体产生系统的技术壁垒。
9.另外,从细胞培养中的供氧的观点出发,细胞培养中,无论是否使用细胞培养用载体,另外,无论是悬浮细胞还是粘附细胞,除厌氧细菌外供氧是细胞健康生长的重要课题。例如,使用培养盘、孔板或腔室对粘附细胞进行平面培养时,对于培养容器的面积而言,培养基量的合适范围存在限制。因此,在使用不必要的大量培养基时,无法向细胞供给充足的氧气,也有可能会出现由低氧所引起的损伤的情况、导致细胞死亡的情况。另外,已知:细胞群形成球状体时,若其尺寸变得过大,则内部的细胞就会陷于缺氧状态(非专利文献4)。针对这样的供氧课题,尝试了通过利用微泡来提高氧气浓度(专利文献5)、微载体培养时均匀的供氧方法(专利文献6)等。另一方面,已知:间充质干细胞的培养中,该细胞更适宜在低氧环境中生息、增殖,因此需要根据细胞的种类在细胞培养时增减供氧这样繁杂的操作。因此,一直在寻求开发和构建一种细胞培养法,该方法能够通过简便且适合自动化的工艺容易地调节所提供的氧气量,进而能够培养大量的细胞。
10.本发明人等已经提供了使用聚合物多孔膜的细胞培养法和细胞培养装置,但为了防止膜状的聚合物多孔膜的连续形态变化,将在壳体(外壳)中收纳聚合物多孔膜而成的细胞培养模块应用于细胞培养容器、细胞培养装置、或细胞培养系统(专利文献7:“细胞培养模块”)。由此,可防止对在聚合物多孔膜内生长的细胞所施加的应激,凋亡等得到抑制,能够稳定培养大量的细胞。然而,使用细胞培养模块的细胞培养法中,需要用于收纳聚合物多孔膜的壳体,并且用于放入该壳体的细胞培养容器本身的大小、强度是受限的。
11.《聚酰亚胺多孔膜》
12.聚酰亚胺多孔膜在本技术之前已被用于过滤器、低介电常数膜、燃料电池用电解质膜等主要与电池相关的用途中。专利文献8~10中,特别记载了一种聚酰亚胺多孔膜,气体等物质透过性优异,孔隙率高、两表面的平滑性优异、强度相对较高、具有大量的尽管孔隙率高但对膜厚度方向的压缩应力的耐力优异的大孔隙。它们均是经由酰胺酸而制作的聚酰亚胺多孔膜。
13.现有技术文献
14.专利文献
15.专利文献1:日本特开昭62-065681号公报
16.专利文献2:国际公开第2008/084857号
17.专利文献3:日本特开平7-313151号公报
18.专利文献4:国际公开第2003/054174号
19.专利文献5:日本专利第5549209号公报
20.专利文献6:日本专利第5460241号公报
21.专利文献7:国际公开第2018/021368号
22.专利文献8:国际公开第2010/038873号
23.专利文献9:日本特开2011-219585号公报
24.专利文献10:日本特开2011-219586号公报
25.非专利文献
26.非专利文献1:ogata et al.,journal of fermentation and bioengineering vol.77,no.1,p.46-51 1994
27.非专利文献2:dosh,r.h.,et al.,science reports,volume 9,article number:1812(2019)
28.非专利文献3:m.mirbagheri,et al.,mater.horiz.,6,45-71(2019)
29.非专利文献4:黑泽寻,生物工学第91卷、第11号、646-653页、2013年
技术实现要素:
30.发明要解决的问题
31.为了大量培养粘附性的动物细胞,如果是培养盘、培养皿之类的平面形态,则大面积是必不可少的,因此创造出了层叠形态的培养装置。另一方面,也开发出很多将能悬浮的载体悬浮于培养基中进行培养的微载体等方法,还构建并利用了以悬浮细胞那样的方式培养大量的粘附细胞的方法。这些方法被充分用于在一定期间内使细胞增殖、或产生病毒、蛋白质等物质,但尚未发现在不损害细胞的特性的情况下长期稳定地培养细胞的方法论。
32.另外,为了培养大量的动物细胞,需要在培养基中连续地溶解有大量的氧气。作为使氧气溶解在培养基中的方法,有:搅拌培养基的方法、鼓泡方法。然而,大多数动物细胞不耐剪切力,利用搅拌培养方法时存在杀死细胞的问题。另外,通常的组合了磁力搅拌器和搅拌子的搅拌培养方法中,在培养容器与搅拌子的接触部分,细胞被磨碎,难以大量培养细胞。另外,进行鼓泡的培养方法存在在鼓泡时所产生的泡沫杀死细胞的问题。另一方面,适宜生息在低氧环境中的间充质干细胞等细胞中,培养基中连续溶解有大量的氧气是不适合的。这种细胞的培养需要加装用于降低培养箱内的氧气浓度的装置。
33.用于解决问题的方案
34.发明人等重新审视了使用聚酰亚胺多孔膜的细胞培养技术,通过将现有的用于细胞培养的多孔膜片的尺寸设为一边为1mm左右的小尺寸,从而能够创造出完全无需特殊设备的静置型长期大量细胞培养系统。通过将多孔膜制成小片,从而能够将大量的片大量地设置在极小的空间内,并通过供给营养,从而能够稳定且节约操作地培养大量的细胞。另外,一直以来显示出难以高效地从聚酰亚胺多孔膜中回收细胞的倾向,但是本方法的情况下已经明确了在一定程度上也有效促进了细胞回收。另外,通过制成小片而使在分散状态、层叠状态下的培养基等的流通性良好,因此小片培养法在细胞的生长、外泌体的产生量等方面显示出高效率。由于小片特性,能够形成系统可视性也优异、用于产生抗体、病毒或外泌体等各种物质的优异的系统。取样也容易,即使取出极少量的样品作为代表,也能够准确
地执行固定/染色/鉴定/评价等。另外,也可以与溢流反应器等连续培养法组合使用,且能够长期静态培养大量的细胞。特别是发现了:在外泌体的产生中,利用使用本发明的小片聚合物多孔膜的细胞培养法能够长期产生具有稳定的产生量和品质的外泌体。
35.本发明通过将聚合物多孔膜制成小片,从而可以提供能够大量培养细胞的最佳的空间,而无需特殊的细胞培养设备、细胞培养容器上也无需应用搅拌机或使用旋转瓶。进而发现:在培养液中小片聚合物多孔膜分散和/或小片聚合物多孔膜彼此多层地相互堆积,以在细胞培养容器的底部进行分散和/或层叠的状态下沉,且能够维持该状态,因此能够容易地调节细胞培养液的液量(深度),而且能够简便地调节培养液中的溶解氧量(供氧状态),以至完成了本发明。即,本发明包括以下的方式,但没有特别限定。
36.[1]一种细胞培养法,其包括:将细胞应用于小片聚合物多孔膜并进行培养,且该方法无需搅拌,
[0037]
其中,前述小片聚合物多孔膜是具备具有多个孔的表面层a和表面层b、及夹持于前述表面层a和表面层b之间的大孔隙层的三层结构的小片聚合物多孔膜,其中,存在于前述表面层a的孔的平均孔径小于存在于前述表面层b的孔的平均孔径,前述大孔隙层具有与前述表面层a和b结合的隔壁、及被该隔壁以及前述表面层a和b包围的多个大孔隙,前述表面层a和b中的孔与前述大孔隙连通,
[0038]
前述表面层a或表面层b的面积为4mm2以下,
[0039]
在培养液中前述小片聚合物多孔膜分散和/或小片聚合物多孔膜彼此多层地堆积,在细胞培养容器的底部进行分散和/或层叠。
[0040]
[2]根据[1]所述的细胞培养法,其中,通过间歇地或连续地更换培养基来进行长期培养。
[0041]
[3]根据[1]或[2]所述的细胞培养法,其中,使粘附于前述小片聚合物多孔膜上的细胞增殖后,通过酶处理将细胞剥离,将未粘附细胞的小片聚合物多孔膜添加至细胞培养容器中,由此使细胞传代来进行大量培养。
[0042]
[4]根据[1]~[3]中任一项所述的细胞培养法,其中,前述小片聚合物多孔膜具有平均孔径0.01~100μm的多个细孔。
[0043]
[5]根据[1]~[4]中任一项所述的细胞培养法,其中,前述表面层a的平均孔径为0.01~50μm。
[0044]
[6]根据[1]~[5]中任一项所述的细胞培养法,其中,前述表面层b的平均孔径为20~100μm。
[0045]
[7]根据[1]~[6]中任一项所述的细胞培养法,其中,前述小片聚合物多孔膜的总膜厚为5~500μm。
[0046]
[8]根据[1]~[7]中任一项所述的细胞培养法,其中,前述小片聚合物多孔膜为小片聚酰亚胺多孔膜。
[0047]
[9]根据[8]所述的细胞培养法,其中,前述小片聚酰亚胺多孔膜是包含由四羧酸二酐和二胺得到的聚酰亚胺的小片聚酰亚胺多孔膜。
[0048]
[10]根据[8]或[9]所述的细胞培养法,其中,前述小片聚酰亚胺多孔膜是:通过将包含由四羧酸二酐和二胺得到的聚酰胺酸溶液及着色前体的聚酰胺酸溶液组合物成型后,以250℃以上进行热处理而得到的经着色的小片聚酰亚胺多孔膜。
[0049]
[11]根据[1]~[10]中任一项所述的细胞培养法,其包括:由细胞产生外泌体。
[0050]
[12]一种细胞培养装置,用于[1]~[11]中任一项所述的细胞培养法,包含小片聚合物多孔膜。
[0051]
[13]一种试剂盒,用于[1]~[11]中任一项所述的细胞培养法,包含小片聚合物多孔膜。
[0052]
[14]一种外泌体,其通过[1]~[11]中任一项所述的方法而获得。
[0053]
发明的效果
[0054]
本发明能够在下述状态下进行细胞培养:在培养液中小片聚合物多孔膜分散和/或小片聚合物多孔膜彼此多层地堆积,在细胞培养容器的底部,小片聚合物多孔膜进行分散和/或层叠,因此能够进行放置而无需基于搅拌机等的搅拌,因此与现有的利用具备壳体的模块化聚合物多孔膜的情况不同,细胞培养容器的尺寸、原材料、强度等没有限定,而且无需设置搅拌机等,因此能够利用非常宽广范围的细胞培养容器。但是,本发明的细胞培养法只是无需搅拌,但是不排斥搅拌条件。因此,根据本发明,可以对这样的细胞培养法施加微弱的振动或流动条件。另外,将细胞接种于小片聚合物多孔膜并进行培养后,在不回收细胞的情况下追加小片聚合物多孔膜,由此也能使细胞量增加(内部放大)。进而,通过使用小片聚合物多孔膜,从而能够稳定且长期地产生物质。与现有的聚酰亚胺多孔膜相比,使用了小片聚合物多孔膜的培养中,细胞的增殖显著增高,另外,细胞回收效率也得到显著改善,如上所述还能够进行内部放大,因此使更长期地连续培养细胞变得容易。进而,具有能够在将细胞负载于小片聚合物多孔膜内的状态下将小片构件冷冻、保存这样的优点。
附图说明
[0055]
图1是示出使用小片聚酰亚胺多孔膜(1mm见方)和非小片聚酰亚胺多孔膜(1cm见方)进行培养时的人间充质干细胞的葡萄糖消耗的经时变化的图。
[0056]
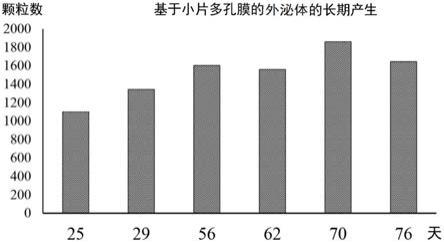
图2是示出由使用小片聚酰亚胺多孔膜所培养的人间充质干细胞长期产生外泌体的图。
[0057]
图3是示出人间充质干细胞的经时细胞数变化的图。
[0058]
图4是示出使用小片聚酰亚胺多孔膜所培养的人间充质干细胞的干细胞性验证的结果的图(左:脂肪细胞的分化诱导(左侧);右:向成骨细胞的分化诱导和石灰化)。
[0059]
图5是示出使用小片聚酰亚胺多孔膜所培养的人皮肤成纤维细胞的经时细胞数变化的图。
[0060]
图6是示出例示的溢流型生物反应器的图。
[0061]
图7是示出例示的溢流型生物反应器的图和图像。
[0062]
图8是示出例示的溢流型生物反应器的图。
[0063]
图9是示出使用小片聚酰亚胺多孔膜所培养的软骨细胞的经时细胞行为(细胞密度和细胞行为)的变化的图。
具体实施方式
[0064]
以下,根据需要边参照附图边对本发明的实施方式进行说明。实施方式的构成是例示,本发明的构成不限定于实施方式的具体的构成。
[0065]
a.小片聚合物多孔膜
[0066]
1.小片聚合物多孔膜的制作
[0067]
小片聚合物多孔膜可以通过将后述的聚合物多孔膜成型为期望的大小而制作。成型可以使用各种加工用单元来进行。例如,没有限定,可以通过使用了峰形简易冲压机的蚀刻刀模(pinnacle die)冲切聚合物多孔膜(例如,聚酰亚胺多孔膜、聚醚砜(pes)多孔膜)而得到期望的形状的小片聚合物多孔膜。
[0068]
2.聚合物多孔膜
[0069]
本发明中使用的聚合物多孔膜中的表面层a(以下也称为“a面”或“网面”)中存在的孔的平均孔径没有特别限定,例如为0.01μm以上且低于200μm、0.01~150μm、0.01~100μm、0.01~50μm、0.01μm~40μm、0.01μm~30μm、0.01μm~25μm、0.01μm~20μm或0.01μm~15μm,优选为0.01μm~25μm。
[0070]
本发明中使用的聚合物多孔膜中的表面层b(以下也称为“b面”或“大孔面”)中存在的孔的平均孔径只要大于表面层a中存在的孔的平均孔径就没有特别限定,例如超过5μm且为200μm以下、20μm~100μm、25μm~100μm、30μm~100μm、35μm~100μm、40μm~100μm、50μm~100μm或60μm~100μm,优选为30μm~100μm。
[0071]
本说明书中,聚合物多孔膜表面的平均孔径是面积平均孔径。面积平均孔径可以依据以下的(1)和(2)而求出。需要说明的是,聚合物多孔膜表面以外的部位的平均孔径也可以同样地求出。
[0072]
(1)从多孔膜表面的扫描型电子显微镜照片中,对200个以上的开孔部测定孔面积s,假设该孔面积为正圆基于式i求出各自的孔径d。
[0073][0074]
(2)将通过上述式i而求出的全部孔径应用于以下的式ii,求出孔的形状为正圆时的面积平均孔径da。
[0075]
面积平均孔径da=∑(d3)/∑(d2)
ꢀꢀꢀꢀꢀ
式ii
[0076]
表面层a和b的厚度没有特别限定,例如为0.01~50μm,优选为0.01~20μm。
[0077]
聚合物多孔膜中的大孔隙层中的大孔隙的膜平面方向的平均孔径没有特别限定,例如为10~500μm,优选为10~100μm,更优选为10~80μm。另外,该大孔隙层中的隔壁的厚度没有特别限定,例如为0.01~50μm,优选为0.01~20μm。一实施方式中,该大孔隙层中的至少1个隔壁具有1个或多个与邻接的大孔隙彼此连通的、平均孔径0.01~100μm、优选为0.01~50μm的孔。其它实施方式中,该大孔隙层中的隔壁不具有孔。
[0078]
本发明中使用的聚合物多孔膜表面的总膜厚没有特别限定,可以为5μm以上、10μm以上、20μm以上或25μm以上,可以为500μm以下、300μm以下、100μm以下、75μm以下或50μm以下。优选为5~500μm,更优选为25~75μm。
[0079]
本发明中使用的聚合物多孔膜的膜厚的测定可以利用接触式的厚度计来进行。
[0080]
本发明中使用的聚合物多孔膜的孔隙率没有特别限定,例如为40%以上且低于95%。
[0081]
本发明中使用的聚合物多孔膜的孔隙率可以通过测定切成规定大小的多孔膜的膜厚和质量,并基于单位面积质量根据下式iii而求出。
[0082]
孔隙率(%)=(1-w/(s
×d×
d))
×
100
ꢀꢀꢀꢀ
式iii
[0083]
(式中,s是指多孔膜的面积,d是指总膜厚,w是指测得的质量,d是指聚合物的密度。聚合物为聚酰亚胺时,密度为1.34g/cm3。)
[0084]
本发明中使用的聚合物多孔膜优选为具备具有多个孔的表面层a和表面层b、及夹持于前述表面层a和表面层b之间的大孔隙层的三层结构的聚合物多孔膜,其中,存在于前述表面层a的孔的平均孔径为0.01μm~25μm,存在于前述表面层b的孔的平均孔径为30μm~100μm,前述大孔隙层具有与前述表面层a和b结合的隔壁、及被该隔壁以及前述表面层a和b包围的多个大孔隙,前述大孔隙层的隔壁、以及前述表面层a和b的厚度为0.01~20μm,前述表面层a和b中的孔与大孔隙连通,总膜厚为5~500μm,孔隙率为40%以上且低于95%。一实施方式中,大孔隙层中的至少1个隔壁具有1个或多个与邻接的大孔隙彼此连通的、平均孔径0.01~100μm、优选为0.01~50μm的孔。其它实施方式中,隔壁不具有这样的孔。
[0085]
本发明中使用的聚合物多孔膜优选经灭菌。作为灭菌处理,没有特别限定,可列举出干热灭菌、蒸汽灭菌、基于乙醇等消毒剂的灭菌、紫外线或γ射线等电磁波灭菌等任意的灭菌处理等。
[0086]
本发明中使用的小片聚合物多孔膜只要具备上述的结构特征就没有特别限定,优选为小片聚酰亚胺多孔膜、或小片聚醚砜(pes)多孔膜。以下对小片聚合物多孔质的制作中使用的聚酰亚胺多孔膜和聚醚砜(pes)多孔膜进行说明。
[0087]
2-1.聚酰亚胺多孔膜
[0088]
聚酰亚胺是重复单元中包含酰亚胺键的高分子的总称,通常是指芳香族化合物通过酰亚胺键直接连接的芳香族聚酰亚胺。芳香族聚酰亚胺中,芳香族与芳香族之间借助酰亚胺键而具有共轭结构,因此具有刚直而坚固的分子结构,并且酰亚胺键具有较强的分子间力,因此具有非常高水平的热、机械、化学性质。
[0089]
本发明中可以使用的聚酰亚胺多孔膜优选为包含由四羧酸二酐和二胺得到的聚酰亚胺(作为主要成分)的聚酰亚胺多孔膜,更优选为由利用四羧酸二酐和二胺得到的聚酰亚胺构成的聚酰亚胺多孔膜。“包含
……
作为主要成分”是指:作为聚酰亚胺多孔膜的构成分分,可以实质上不含除由四羧酸二酐和二胺得到的聚酰亚胺以外的成分,或者虽然包含除由四羧酸二酐和二胺得到的聚酰亚胺以外的成分但是为对由四羧酸二酐和二胺得到的聚酰亚胺的性质不产生影响的附加成分。
[0090]
一实施方式中,本发明中可以使用的聚酰亚胺多孔膜还包括:将包含由四羧酸成分和二胺成分得到的聚酰胺酸溶液、及着色前体的聚酰胺酸溶液组合物成型后,以250℃以上进行热处理而得到的着色的聚酰亚胺多孔膜。
[0091]
聚酰胺酸可以通过使四羧酸成分和二胺成分聚合而得到的。聚酰胺酸是能够通过热酰亚胺化或化学酰亚胺化闭环而形成聚酰亚胺的聚酰亚胺前体。
[0092]
对于聚酰胺酸,即使酰胺酸的一部分被酰亚胺化,只要是不对本发明产生影响的范围就也可以使用。即,聚酰胺酸可以被部分热酰亚胺化或化学酰亚胺化。
[0093]
将聚酰胺酸热酰亚胺化时,根据需要可以在聚酰胺酸溶液中添加酰亚胺化催化剂、含有机磷化合物、无机微粒、有机微粒等微粒等。另外,将聚酰胺酸化学酰亚胺化时,根据需要可以在聚酰胺酸溶液中添加化学酰亚胺化剂、脱水剂、无机微粒、有机微粒等微粒等。优选在即使向聚酰胺酸溶液中配混前述成分也不析出着色前体的条件下进行。
[0094]
本说明书中,“着色前体”是指:通过250℃以上的热处理使一部分或全部碳化而生成着色产物的前体。
[0095]
作为上述聚酰亚胺多孔膜的制造中可以使用的着色前体,优选:均匀地溶解或分散于聚酰胺酸溶液或聚酰亚胺溶液中,通过250℃以上、优选为260℃以上、进一步优选为280℃以上、更优选为300℃以上的热处理、优选为空气等氧气存在下的250℃以上、优选为260℃以上、进一步优选为280℃以上、更优选为300℃以上的热处理使其热分解、碳化而生成着色产物者,更优选生成黑色系的着色产物者,更优选碳系着色前体。
[0096]
着色前体在逐渐加热时乍看像是碳化物,但在组织结构上包含除碳以外的不同元素,具有层结构、芳香族交联结构、包含四面体碳的无序结构。
[0097]
碳系着色前体没有特别限制,例如可列举出石油焦油、石油沥青、煤焦油、煤沥青等焦油或沥青、焦炭、由包含丙烯腈的单体得到的聚合物、二茂铁化合物(二茂铁和二茂铁衍生物)等。这些当中,优选由包含丙烯腈的单体得到的聚合物和/或二茂铁化合物,作为由包含丙烯腈的单体得到的聚合物,优选聚丙烯腈。
[0098]
另外,其它实施方式中,本发明中可以使用的聚酰亚胺多孔膜还包括:在不使用上述的着色前体的情况下将由四羧酸成分和二胺成分得到的聚酰胺酸溶液成型后进行热处理而得到的聚酰亚胺多孔膜。
[0099]
未使用着色前体而制造的聚酰亚胺多孔膜例如可以通过如下方式制造:将包含特性粘度数为1.0~3.0的聚酰胺酸3~60质量%和有机极性溶剂40~97质量%的聚酰胺酸溶液流延成膜状,在以水作为必须成分的凝固溶剂中浸渍或使其接触,制作聚酰胺酸的多孔膜,然后对该聚酰胺酸的多孔膜进行热处理使其酰亚胺化,从而制造。该方法中,以水作为必须成分的凝固溶剂可以为水、或为5质量%以上且低于100质量%的水与超过0质量%且为95质量%以下的有机极性溶剂的混合液。另外,上述酰亚胺化之后,可以对得到的多孔聚酰亚胺膜的至少单面实施等离子体处理。
[0100]
上述聚酰亚胺多孔膜的制造中可使用的四羧酸二酐可以使用任意的四羧酸二酐,可以根据期望的特性等进行适宜选择。作为四羧酸二酐的具体例,可以列举出均苯四酸二酐、3,3’,4,4
’‑
联苯四羧酸二酐(s-bpda)、2,3,3’,4
’‑
联苯四羧酸二酐(a-bpda)等联苯四羧酸二酐、氧基二邻苯二甲酸二酐、二苯基砜-3,4,3’,4
’‑
四羧酸二酐、双(3,4-二羧基苯基)硫醚二酐、2,2-双(3,4-二羧基苯基)-1,1,1,3,3,3-六氟丙烷二酐、2,3,3’,4
’‑
二苯甲酮四羧酸二酐、3,3’,4,4
’‑
二苯甲酮四羧酸二酐、双(3,4-二羧基苯基)甲烷二酐、2,2-双(3,4-二羧基苯基)丙烷二酐、对亚苯基双(偏苯三酸单酯酸酐)、对联苯撑双(偏苯三酸单酯酸酐)、间三联苯-3,4,3’,4
’‑
四羧酸二酐、对三联苯-3,4,3’,4
’‑
四羧酸二酐、1,3-双(3,4-二羧基苯氧基)苯二酐、1,4-双(3,4-二羧基苯氧基)苯二酐、1,4-双(3,4-二羧基苯氧基)联苯基二酐、2,2-双〔(3,4-二羧基苯氧基)苯基〕丙烷二酐、2,3,6,7-萘四羧酸二酐、1,4,5,8-萘四羧酸二酐、4,4
’‑
(2,2-六氟异亚丙基)二邻苯二甲酸二酐等。另外,也优选使用2,3,3’,4
’‑
二苯基砜四羧酸等芳香族四羧酸。这些可以单独使用,也可以组合使用2种以上。
[0101]
其中,特别优选选自由联苯四羧酸二酐和均苯四酸二酐组成的组中的至少一种芳香族四羧酸二酐。作为联苯四羧酸二酐,可以适宜使用3,3’,4,4
’‑
联苯四羧酸二酐。
[0102]
上述聚酰亚胺多孔膜的制造中可以使用的二胺可以使用任意的二胺。作为二胺的具体例,可以列举出以下的二胺。
[0103]
1)1,4-二氨基苯(对苯二胺)、1,3-二氨基苯、2,4-二氨基甲苯、2,6-二氨基甲苯等1个苯核的苯二胺;
[0104]
2)4,4
’‑
二氨基二苯醚、3,4
’‑
二氨基二苯醚等二氨基二苯醚、4,4
’‑
二氨基二苯甲烷、3,3
’‑
二甲基-4,4
’‑
二氨基联苯、2,2
’‑
二甲基-4,4
’‑
二氨基联苯、2,2
’‑
双(三氟甲基)-4,4
’‑
二氨基联苯、3,3
’‑
二甲基-4,4
’‑
二氨基二苯甲烷、3,3
’‑
二羧基-4,4
’‑
二氨基二苯甲烷、3,3’,5,5
’‑
四甲基-4,4
’‑
二氨基二苯甲烷、双(4-氨基苯基)硫醚、4,4
’‑
二氨基苯甲酰苯胺、3,3
’‑
二氯联苯胺、3,3
’‑
二甲基联苯胺、2,2
’‑
二甲基联苯胺、3,3
’‑
二甲氧基联苯胺、2,2
’‑
二甲氧基联苯胺、3,3
’‑
二氨基二苯醚、3,4
’‑
二氨基二苯醚、4,4
’‑
二氨基二苯醚、3,3
’‑
二氨基二苯基硫醚、3,4
’‑
二氨基二苯基硫醚、4,4
’‑
二氨基二苯基硫醚、3,3
’‑
二氨基二苯基砜、3,4
’‑
二氨基二苯基砜、4,4
’‑
二氨基二苯基砜、3,3
’‑
二氨基二苯甲酮、3,3
’‑
二氨基-4,4
’‑
二氯二苯甲酮、3,3
’‑
二氨基-4,4
’‑
二甲氧基二苯甲酮、3,3
’‑
二氨基二苯甲烷、3,4
’‑
二氨基二苯甲烷、4,4
’‑
二氨基二苯甲烷、2,2-双(3-氨基苯基)丙烷、2,2-双(4-氨基苯基)丙烷、2,2-双(3-氨基苯基)-1,1,1,3,3,3-六氟丙烷、2,2-双(4-氨基苯基)-1,1,1,3,3,3-六氟丙烷、3,3
’‑
二氨基二苯基亚砜、3,4
’‑
二氨基二苯基亚砜、4,4
’‑
二氨基二苯基亚砜等2个苯核的二胺;
[0105]
3)1,3-双(3-氨基苯基)苯、1,3-双(4-氨基苯基)苯、1,4-双(3-氨基苯基)苯、1,4-双(4-氨基苯基)苯、1,3-双(4-氨基苯氧基)苯、1,4-双(3-氨基苯氧基)苯、1,4-双(4-氨基苯氧基)苯、1,3-双(3-氨基苯氧基)-4-三氟甲苯、3,3
’‑
二氨基-4-(4-苯基)苯氧基二苯甲酮、3,3
’‑
二氨基-4,4
’‑
二(4-苯基苯氧基)二苯甲酮、1,3-双(3-氨基苯基硫醚)苯、1,3-双(4-氨基苯基硫醚)苯、1,4-双(4-氨基苯基硫醚)苯、1,3-双(3-氨基苯基砜)苯、1,3-双(4-氨基苯基砜)苯、1,4-双(4-氨基苯基砜)苯、1,3-双〔2-(4-氨基苯基)异丙基〕苯、1,4-双〔2-(3-氨基苯基)异丙基〕苯、1,4-双〔2-(4-氨基苯基)异丙基〕苯等3个苯核的二胺;
[0106]
4)3,3
’‑
双(3-氨基苯氧基)联苯、3,3
’‑
双(4-氨基苯氧基)联苯、4,4
’‑
双(3-氨基苯氧基)联苯、4,4
’‑
双(4-氨基苯氧基)联苯、双〔3-(3-氨基苯氧基)苯基〕醚、双〔3-(4-氨基苯氧基)苯基〕醚、双〔4-(3-氨基苯氧基)苯基〕醚、双〔4-(4-氨基苯氧基)苯基〕醚、双〔3-(3-氨基苯氧基)苯基〕酮、双〔3-(4-氨基苯氧基)苯基〕酮、双〔4-(3-氨基苯氧基)苯基〕酮、双〔4-(4-氨基苯氧基)苯基〕酮、双〔3-(3-氨基苯氧基)苯基〕硫醚、双〔3-(4-氨基苯氧基)苯基〕硫醚、双〔4-(3-氨基苯氧基)苯基〕硫醚、双〔4-(4-氨基苯氧基)苯基〕硫醚、双〔3-(3-氨基苯氧基)苯基〕砜、双〔3-(4-氨基苯氧基)苯基〕砜、双〔4-(3-氨基苯氧基)苯基〕砜、双〔4-(4-氨基苯氧基)苯基〕砜、双〔3-(3-氨基苯氧基)苯基〕甲烷、双〔3-(4-氨基苯氧基)苯基〕甲烷、双〔4-(3-氨基苯氧基)苯基〕甲烷、双〔4-(4-氨基苯氧基)苯基〕甲烷、2,2-双〔3-(3-氨基苯氧基)苯基〕丙烷、2,2-双〔3-(4-氨基苯氧基)苯基〕丙烷、2,2-双〔4-(3-氨基苯氧基)苯基〕丙烷、2,2-双〔4-(4-氨基苯氧基)苯基〕丙烷、2,2-双〔3-(3-氨基苯氧基)苯基〕-1,1,1,3,3,3-六氟丙烷、2,2-双〔3-(4-氨基苯氧基)苯基〕-1,1,1,3,3,3-六氟丙烷、2,2-双〔4-(3-氨基苯氧基)苯基〕-1,1,1,3,3,3-六氟丙烷、2,2-双〔4-(4-氨基苯氧基)苯基〕-1,1,1,3,3,3-六氟丙烷等4个苯核的二胺。
[0107]
这些可以单独使用,也可以混合2种以上而使用。所使用的二胺可以根据期望的特性等进行适宜选择。
[0108]
其中,优选芳香族二胺化合物,可以适宜使用3,3
’‑
二氨基二苯醚、3,4
’‑
二氨基二
苯醚、4,4
’‑
二氨基二苯醚和对苯二胺、1,3-双(3-氨基苯基)苯、1,3-双(4-氨基苯基)苯、1,4-双(3-氨基苯基)苯、1,4-双(4-氨基苯基)苯、1,3-双(4-氨基苯氧基)苯、1,4-双(3-氨基苯氧基)苯。特别优选选自由苯二胺、二氨基二苯醚和双(氨基苯氧基)苯基组成的组中的至少一种二胺。
[0109]
对于本发明中可以使用的聚酰亚胺多孔膜,从耐热性、高温下的尺寸稳定性的观点出发,优选由玻璃化转变温度为240℃以上或在300℃以上没有明确的转变点的将四羧酸二酐与二胺组合而得到的聚酰亚胺形成。
[0110]
对于本发明中可以使用的聚酰亚胺多孔膜,从耐热性、高温下的尺寸稳定性的观点出发,优选由以下的芳香族聚酰亚胺构成的聚酰亚胺多孔膜。
[0111]
(i)由选自由联苯四羧酸单元和均苯四酸单元组成的组中的至少一种四羧酸单元与芳香族二胺单元形成的芳香族聚酰亚胺、
[0112]
(ii)由四羧酸单元与选自由苯二胺单元、二氨基二苯醚单元和双(氨基苯氧基)苯单元组成的组中的至少一种芳香族二胺单元形成的芳香族聚酰亚胺、和/或
[0113]
(iii)由选自由联苯四羧酸单元和均苯四酸单元组成的组中的至少一种四羧酸单元与选自由苯二胺单元、二氨基二苯醚单元和双(氨基苯氧基)苯单元组成的组中的至少一种芳香族二胺单元形成的芳香族聚酰亚胺。
[0114]
本发明中使用的聚酰亚胺多孔膜优选为具备具有多个孔的表面层a和表面层b、及夹持于前述表面层a和表面层b之间的大孔隙层的三层结构的聚酰亚胺多孔膜,其中,存在于前述表面层a的孔的平均孔径为0.01μm~25μm,存在于前述表面层b的孔的平均孔径为30μm~100μm,前述大孔隙层具有与前述表面层a和b结合的隔壁、及被该隔壁以及前述表面层a和b包围的多个大孔隙,前述大孔隙层的隔壁、以及前述表面层a和b的厚度为0.01~20μm,前述表面层a和b中的孔与大孔隙连通,总膜厚为5~500μm,孔隙率为40%以上且低于95%。其中,大孔隙层中的至少1个隔壁具有1个或多个与邻接的大孔隙彼此连通的、平均孔径0.01~100μm、优选为0.01~50μm的孔。
[0115]
例如,国际公开第2010/038873号、日本特开2011-219585号公报、或日本特开2011-219586号公报中记载的聚酰亚胺多孔膜也可以用于本发明。
[0116]
2-2.聚醚砜(pes)多孔膜
[0117]
本发明中可以使用的pes多孔膜包含聚醚砜,典型的是实质上由聚醚砜构成。聚醚砜可以是本领域技术人员利用公知的方法合成的,例如可以利用如下方法制造:使二元酚、碱金属化合物和二卤代二苯基化合物在有机极性溶剂中进行缩聚反应的方法;预先合成二元酚的碱金属二盐并使其与二卤代二苯基化合物在有机极性溶剂中进行缩聚反应的方法等。
[0118]
作为碱金属化合物,可列举出碱金属碳酸盐、碱金属氢氧化物、碱金属氢化物、碱金属醇盐等。特别优选碳酸钠和碳酸钾。
[0119]
作为二元酚化合物,可列举出对苯二酚、邻苯二酚、间苯二酚、4,4
’‑
联苯酚、双(羟基苯基)烷烃类(例如2,2-双(羟基苯基)丙烷、和2,2-双(羟基苯基)甲烷)、二羟基二苯基砜类、二羟基二苯醚类、或这些苯环的至少1个氢被甲基、乙基、丙基等低级烷基、或甲氧基、乙氧基等低级烷氧基取代而成者。作为二元酚化合物,可以将上述的化合物混合两种以上而使用。
[0120]
聚醚砜可以为市售品。作为市售品的例子,可列举出sumika excel 7600p、sumika excel 5900p(以上、住友化学株式会社制)等。
[0121]
从良好地形成多孔聚醚砜膜的大孔隙的观点出发,聚醚砜的对数粘度优选为0.5以上、更优选为0.55以上,从聚醚砜多孔膜的制造容易性的观点出发,优选为1.0以下、更优选为0.9以下、进一步优选为0.8以下、特别优选为0.75以下。
[0122]
另外,从耐热性、高温下的尺寸稳定性的观点出发,pes多孔膜、或作为其原料的聚醚砜的玻璃化转变温度优选为200℃以上或观察不到明确的玻璃化转变温度。
[0123]
本发明中可以使用的pes多孔膜的制造方法没有特别限定,例如可以通过包括如下工序的方法而制造:
[0124]
将包含对数粘度0.5~1.0的聚醚砜0.3质量%~60质量%和有机极性溶剂40质量%~99.7质量%的聚醚砜溶液流延成膜状,在以聚醚砜的不良溶剂或非溶剂作为必须成分的凝固溶剂中浸渍或使进行接触,制作具有孔隙的凝固膜的工序;及
[0125]
对前述工序中得到的具有孔隙的凝固膜进行热处理而使前述孔隙粗大化,得到pes多孔膜的工序,
[0126]
前述热处理包括使前述具有孔隙的凝固膜升温至前述聚醚砜的玻璃化转变温度以上或240℃以上。
[0127]
本发明中可以使用的pes多孔膜优选为具有表面层a、表面层b、及夹设于前述表面层a与前述表面层b之间的大孔隙层的pes多孔膜,
[0128]
前述大孔隙层具有:与前述表面层a和b结合的隔壁及被该隔壁以及前述表面层a和b包围的、膜平面方向的平均孔径为10μm~500μm的多个大孔隙,
[0129]
前述大孔隙层的隔壁的厚度为0.1μm~50μm,
[0130]
前述表面层a和b的厚度分别为0.1μm~50μm,
[0131]
前述表面层a和b中,一者具有平均孔径超过5μm且为200μm以下的多个细孔,且另一者具有平均孔径0.01μm以上且低于200μm的多个细孔,
[0132]
表面层a和表面层b中的一者的表面开口率为15%以上,另一表面层的表面开口率为10%以上,
[0133]
前述表面层a和前述表面层b的前述细孔与前述大孔隙连通,
[0134]
前述pes多孔膜的总膜厚为5μm~500μm,且孔隙率为50%~95%。
[0135]
本发明的细胞培养装置中使用的、作为细胞培养载体的上述的聚合物多孔膜具有微亲水性的多孔特性,因此在聚合物多孔膜内稳定地保持液体,且保持耐干燥的湿润环境。因此,与现有的使用细胞培养载体的细胞培养装置相比,即使在极少量的培养基中也能够实现细胞的存活和增殖。另外,接种于聚合物多孔膜中的细胞能够在细胞不被剪切力、泡沫而杀死的情况下进行培养,能够对细胞高效地供给氧气、营养,能够培养大量的细胞。
[0136]
根据本发明,能够充分地对细胞进行供氧。
[0137]
2-3.细胞培养法中使用的小片聚合物多孔膜的实施方式
[0138]
本发明的实施方式中使用的小片聚合物多孔膜可以添加至任意的细胞培养溶液中使用,而无需如现有技术那样将聚合物多孔膜收纳于壳体(外壳)内。一实施方式中,本发明的细胞培养法中使用的小片聚合物多孔膜的特征在于,表面层a或表面层b的面积为4mm2以下、优选为3mm2以下、更优选为2mm2以下、最优选为1mm2。表面层a或表面层b的面积的下限
例如可以为0.01mm2以上,可以为0.04mm2以上,可以为0.09mm2以上,也可以为0.16mm2以上。作为小片聚合物多孔膜的形状,例如可以为多边形(例如,三角形、四边形(例如长方形)、五边形、六边形
…
n边形(n为任意的整数))、大致圆形、大致椭圆形、包括曲线和直线的形状。一实施方式中,对于应用于细胞培养装置1a中的聚合物多孔膜200a,例如表面层a或表面层b的最长直径/最短直径之比为0.5~1、优选为0.75~1、更优选为0.9~1。本说明书中,“直径”是指:表面层a或表面层b的外周的任意两点之间的长度。本说明书中,“最长直径”是指:表面层a或表面层b的外周的任意两点之间的长度中最长的长度。本说明书中,“最短直径”是指:表面层a或表面层b的外周的任意两点之间的长度中最短的长度。一实施方式中,应用于本发明的细胞培养方法的小片聚合物多孔膜为四边形、例如长方形时,最长直径为2
×2^
(1/2)mm以下、和最短直径为2
×2^
(1/2)mm以下、优选最长直径为1.5
×2^
(1/2)mm以下、和最短直径为1.5
×2^
(1/2)mm以下、更优选最长直径为1
×2^
(1/2)mm以下、和最短直径为1
×2^
(1/2)mm以下。其它方式中,应用于本发明的细胞培养方法的聚合物多孔膜为大致圆形或大致椭圆形时,最长直径为2mm以下和最短直径为2mm以下、优选最长直径为1.5mm以下和最短直径为1.5mm以下、更优选最长直径为1.2mm以下和最短直径为1.2mm以下。另外,可以得到如下效果:能够对负载于小片聚合物多孔膜的细胞高效地供给氧气、营养,细胞增殖也变得良好,产生任意的蛋白质等外泌体物质的活性也显著提高。另外,通过将小片聚合物多孔膜大量应用于培养基中,从而小片聚合物多孔膜会堆积,可以提供负载于任意的小片聚合物多孔膜的细胞移动至其它小片聚合物多孔膜或者在跨越两者而粘附的状态下生长的培养环境。因此,将小片聚合物多孔膜应用于细胞培养容器时,优选在不振荡细胞培养容器的情况下进行静置培养。小片聚合物多孔膜在静置时,会在培养基中沉淀,因此在进行适于低氧条件的细胞的培养时,仅通过增加培养基量而增加深度就能够执行低氧培养系统,而无需使用特殊的装置。
[0139]
另外,添加至细胞培养容器中的小片聚合物多孔膜的数量没有限定,但优选添加后在培养液中小片聚合物多孔膜彼此处于多层堆积的状态。优选1个小片聚合物多孔膜与其它小片聚合物多孔膜部分或整体重叠,具体而言,重叠的部分可以为每个小片聚合物多孔膜的1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%、40%、50%、60%、70%、80%、90%、95%、98%、99%、100%的区域。
[0140]
根据本发明,使用了小片聚合物多孔膜的细胞培养中,有采用以多个小片聚合物多孔膜的各边在垂直方向上对齐的方式层叠的现有的聚合物多孔膜的整形方式的多重结构,也有小片聚合物多孔膜形成不定形或不均匀的层叠状态的情况。作为后者那样的层叠状态,例如,用2张小片聚合物多孔膜进行简单说明,可以是一张膜的一边与另一张膜的一边或面接触而形成v字结构、t字结构、y字(小写)结构等微小的空间的情况,可以不是膜彼此的面与面进行部分或整体重叠的结构。针对这样的结构,所接种的细胞在其移动、增殖的过程中,集中于膜彼此重叠时所形成的微小空间部分、例如若为v字结构则集中于v底的部分、或面彼此重叠所形成的阶梯(膜厚或膜的高度)而不限于膜的平面,在小片聚酰亚胺多孔膜上具有支架且细胞彼此进一步聚集而细胞本身形成不是球状体的立体空间,由此能够长期存活。从产生外泌体这样的观点考虑时,能够实现产生稳定且品质均一的外泌体依赖于长期维持稳定的恒定数的细胞聚集状态的环境,而并不是在增殖、死亡之类的剧烈变化的情况下实现。关于小片多孔膜和在其中生长的细胞所形成的聚集结构,后述的实施例2
中,如示出人间充质干细胞的干细胞性验证的结果时的图4的照片可以看出,脂肪细胞在膜彼此为倒v字结构的顶上部(与v字结构的底部相对)上堆积而存活,另一方面,成骨细胞趋向于在通过膜彼此层叠而形成的阶梯部分立体地形成细胞聚集体,而不是在膜的平面部。
[0141]
作为现有技术的使用了微载体的细胞培养法中,除了存在实现高密度培养和细胞增殖这样的课题之外,还存在如何将细胞移植和接种在微载体上这样的课题。需要通过搅拌和扩散手段来防止微载体相互聚集、即不形成聚集体是公知的事实,可以说这也是细胞培养中的不利因素。另一方面,本发明中,将小片聚合物多孔膜用于细胞培养时,如上所述,可以是分散状态、彼此堆积的状态,使用小片聚合物多孔膜时的聚集体形成不会成为任何问题。
[0142]
另外,在培养液中、细胞培养容器的底部进行分散、多层堆积的、即沉淀停止的小片聚合物多孔膜,由于小片本身重量轻,因此可能处于一小片的顶点、边或面与细胞培养容器的底面或侧面、或其它小片的顶点、边或面接触、且例如由于培养基的流动而摇摆的状态。根据本发明,如上所述,由于小片聚合物多孔膜摇摆且立体地分散和多层地堆积、进而由于聚合物多孔膜具有透液性,因此对于负载于小片聚合物多孔膜上的细胞而言,来自培养基中的营养和氧气不会枯竭(具有优异的流通性),因此能够静置地培养细胞而无需进行振荡。
[0143]
一直以来已知:在使未经小片化的聚合物多孔膜连续发生形态变化的状态下培养细胞时,在聚合物多孔膜内生长的细胞受到应激、因凋亡等而死亡(wo2018/021367)。其中,记载了:通过使用纵0.5cm
×
横5cm(纵横比1:10)的容易自变形的长条型的膜作为聚合物多孔膜,从而可显著诱导细胞死亡。假设,即使在以与上述聚合物多孔膜相同的纵横比制作本发明的小片聚合物多孔膜的情况下,小片聚合物多孔膜的厚度也与上述聚合物多孔膜的厚度相同,因此对两者的三维形状进行比较时,不难想象小片聚合物多孔膜的刚性更高,其自变形效率降低。这不仅适用于长条型的膜,也适用于各种方式的小片聚合物多孔膜。例如,如后述的比较例1中所证实的那样,将“1cm见方的聚酰亚胺多孔膜”和“1mm见方的小片聚酰亚胺多孔膜”用于人间充质干细胞的培养,结果使用了小片聚合物多孔膜在整个培养期间进行了较高的葡萄糖消耗,因此从细胞增殖、物质产生、和长期培养的观点出发,可以说与现有的聚合物多孔膜中的细胞培养法相比,使用了本发明的小片聚合物多孔膜的细胞培养法是提供了细胞容易生息的环境的方法。
[0144]
b.细胞培养容器
[0145]
根据本发明,本发明的细胞培养法是将悬浮的细胞注入小片聚合物多孔膜并静置来进行细胞培养的方法,细胞培养容器无需使用搅拌机也无需使用旋转瓶。如上所述,小片聚合物多孔膜具有分散和/或相互多层地堆积并以该状态下沉到细胞培养容器的底部这样的性质,只要是在培养基中能够实现这种状态的细胞培养容器和细胞培养装置就没有特别限定。因此,不限定于通常细胞培养中使用的培养盘、培养皿、孔板、孔、瓶、袋等,而且对于原材料、例如塑料制、玻璃制等没有限定,可以利用任意的容器。另外,使用细胞培养装置时,细胞培养容器可以是装备在装置内的培养槽的形态。
[0146]
进而,小片聚合物多孔膜具有分散和/或相互多层地堆积并下沉到细胞培养容器的底部这样的性质,另外,由于无需搅拌等,因此若使用具有间歇或连续地更换培养基的单元的细胞培养装置则能够进行长期的细胞培养。作为这种细胞培养装置的例子,没有限定,
可列举出溢流型生物反应器、间歇型生物反应器(wo2018/021359)等。
[0147]
关于溢流型生物反应器的细胞培养装置,将例示性的该细胞培养装置示于图6。具体而言,溢流型生物反应器是图6中的细胞培养装置1a,其具备以下:
[0148]
要应用细胞的小片聚合物多孔膜200a;
[0149]
收纳前述小片聚合物多孔膜200a的培养槽10;
[0150]
设置于前述培养槽10、供给培养基的培养基供给口113;
[0151]
设置于前述培养槽10的侧部、使前述培养基排出的培养基排出口101;
[0152]
与前述培养基供给口113连通、设置于前述培养槽10的外部的培养基供给槽40;及
[0153]
与前述培养基排出口101连通、回收从前述培养基排出口101排出的前述培养基的培养基回收槽60,
[0154]
前述培养基排出口101的特征在于使前述培养基溢流而排出。若使用这样的细胞培养装置,则能够连续地供给新鲜的培养基,另一方面,能够根据所供给的培养基的量从设置于培养槽的培养基排出口连续地回收细胞培养后的培养基,能够实现长期的细胞培养。另外,可防止如现有的培养基更换那样使细胞产生的细胞增殖等所需的蛋白质的浓度发生剧烈变化的情况,可连续地供给因培养而被消耗的培养基中的营养成分(例如,葡萄糖等),能够维持适合的细胞培养环境。
[0155]
上述例示的溢流型生物反应器(图6)中,特征在于使培养基从培养基排出口101溢流而排出,但也可通过在所连接的培养基排出管50上具备泵32而能够强制回收细胞培养后的培养基(参照图8),所述培养基排出管是为了将从排出口连接器104排出的培养基回收至培养基回收槽60中而连接的。
[0156]
另一实施方式中提供下述溢流型生物反应器:在构成如图6和图8所示那样的培养槽主体100的侧部102不设置培养基排出口101,在细胞培养液的上表面具备能够使培养基排出管51(例如,内径1mm外径2mm的管)贯通内部且能保持的引导件52(图7)。在该生物反应器中,通过从上侧排出细胞培养后的培养基,从而能够调整培养基的高度。
[0157]
c.使用了小片聚合物多孔膜的细胞培养法
[0158]
本发明的细胞培养法是特征在于将细胞应用于小片聚合物多孔膜并进行培养的、无需进行基于搅拌等的振荡的方法。进而,能够在不回收细胞本身或负载有细胞的小片聚合物多孔膜的情况下、供给新鲜的培养基、及简便地回收培养后的培养基,能够在静态下进行长期培养。本说明书中,“培养基”是指:用于培养细胞、特别是动物细胞的细胞培养基。培养基以与细胞培养液相同的含义使用。因此,本发明中使用的培养基是指液体培养基。培养基的种类可以使用通常使用的培养基,可根据要培养的细胞种类进行适宜确定。
[0159]
根据本发明,细胞在小片聚合物多孔膜上的应用的具体工序没有特别限定。可以采用本说明书中记载的工序、或适于将细胞应用于小片聚合物多孔膜的任意的方法。没有特别限定,本发明的方法中,细胞在小片聚合物多孔膜上的应用例如包括以下的方式。
[0160]
(a)将细胞悬浮液注入已添加至细胞培养容器的小片聚合物多孔膜上的方式;
[0161]
(b)将小片聚合物多孔膜添加至已注入细胞培养容器中的细胞悬浮液中的方式。
[0162]
接种在聚合物多孔膜的表面的细胞粘附于小片聚合物多孔膜,进入多孔的内部。优选地,即使不特意地从外部施加物理或化学力,细胞也粘附于小片聚合物多孔膜。接种在小片聚合物多孔膜的表面的细胞能够在膜的表面和/或内部稳定地生长/增殖。细胞可以根
据生长/增殖的膜的位置采用各种不同的形态。另外,也可以预先用细胞培养液或经灭菌的液体将要使用的小片聚合物多孔膜湿润。
[0163]
没有特别限定,优选地,活细胞选择性地停留在小片聚合物多孔膜上。因此,本发明的方法的优选的实施方式中,活细胞停留在前述小片聚合物多孔膜内,死细胞残留在细胞悬浮液中,通过使培养基流动或更换培养基,从而能够去除死细胞。
[0164]
上述经灭菌的液体没有特别限定,为经灭菌的缓冲液或灭菌水。缓冲液例如为(+)和(-)dulbecco’s pbs、(+)和(-)hank
′
s平衡盐溶液等。将缓冲液的例子示于以下的表1。
[0165]
[表1]
[0166]
成分浓度(mmol/l)浓度(g/l)nacl1378.00kcl2.70.20na2hpo4101.44kh2po41.760.24ph(-)7.47.4
[0167]
本发明的方法中,细胞在小片聚合物多孔膜上的应用包括:通过使处于悬浮状态的粘附性细胞与小片聚合物多孔膜悬浮地共存而将细胞附着于膜上的方式(缠结)。细胞培养基为液体时,聚合物多孔膜可以处于悬浮于细胞培养基中的状态,但附着有细胞的小片聚合物多孔膜在培养基中迅速下沉且相互多层地堆积,下沉到细胞培养容器的底部,能够维持该状态。
[0168]
另外,由于能够容易地调节收纳有小片聚合物多孔膜的细胞培养容器(例如,上述细胞培养装置的培养槽)中的培养基的高度(培养基水平),例如,通过提高培养基水平而能够提高喜好低氧环境的间充质干细胞的培养效率。
[0169]
对于本发明的细胞培养法,由于无需用搅拌机等使培养基主动地振荡、及小片聚合物多孔膜能够以分散和/或多层地堆积的状态下沉到细胞培养容器的底部,因此例如在使用溢流型生物反应器的培养系统中,能够连续地供给新鲜的培养基,另一方面,能够根据所供给的培养基的量从设置于培养槽的培养基排出口连续地回收细胞培养后的培养基,能够实现长期的细胞培养。使用间歇型生物反应器的情况也是同样,能够以规定时间间隔供给新鲜的培养基并定期回收细胞培养后的培养基,能够进行长期的细胞培养。
[0170]
另外,通过一边连续进行细胞培养,一边向细胞培养容器中注入未负载细胞的新鲜的小片聚合物多孔膜,从而细胞能够移动和粘附于新注入的小片聚合物多孔膜上并进一步增殖(扩大培养)。
[0171]
如此,本发明的细胞培养法中,通过使用小片聚合物多孔膜,从而使培养基的流通性变得良好,能够培养大量的细胞。与此相伴,能够增大期望的物质(蛋白质、外泌体等)的产生。如后述的实施例1所示,可知接种在小片聚合物多孔膜上的人间充质干细胞顺利地增殖,如实施例2所示,可知在长期培养该细胞时,从该细胞长期稳定地产生外泌体。
[0172]
d.用于细胞培养法的试剂盒
[0173]
本发明还提供包含小片聚合物多孔膜的、用于细胞培养法的试剂盒。本发明的试剂盒除了小片聚合物多孔膜之外,可以适宜包含细胞培养所需的构成要素。例如包含应用于小片聚合物多孔膜的细胞、细胞培养基、细胞培养装置、试剂盒的操作说明书等。没有特
别限定,作为一方式,包括:包含如下形态的包装体:在透明袋内保存经灭菌的小片聚合物多孔膜、并且能够以该状态用于细胞培养;或者膜/液体一体型试剂盒,其是与小片聚合物多孔膜一起将灭菌液体封入该袋内而成的,能够高效吸入接种。
[0174]
定义
[0175]
本说明书中,“悬浮的细胞”例如包括:通过胰蛋白酶等蛋白水解酶使粘附细胞强制悬浮、悬浮于培养基中而得到的细胞;通过公知的驯化工序而能够在培养基中进行悬浮培养的粘附细胞等。
[0176]
可用于本发明的细胞的种类例如选自由动物细胞、昆虫细胞、植物细胞、酵母菌和细菌组成的组中。动物细胞大致分为属于脊椎动物门的动物来源的细胞和无脊椎动物(除属于脊椎动物门的动物以外的动物)来源的细胞。本说明书中的动物细胞的来源没有特别限定。优选是指属于脊椎动物门的动物来源的细胞。脊椎动物门包括无颌类和有颌类,有颌类包括哺乳纲、鸟纲、两栖纲、爬行纲等。优选为通常被称为哺乳动物的属于哺乳动物的动物来源的细胞。哺乳动物没有特别限定,优选为小鼠、大鼠、人、猴子、猪、狗、绵羊、山羊等。
[0177]
可用于本发明的动物细胞的种类没有特别限定,优选选自由多能干细胞、组织干细胞、体细胞、和生殖细胞组成的组。
[0178]
本说明书中“多能干细胞”是指:具有分化为任何组织细胞的能力(分化多能性)的干细胞的总称。没有特别限定,多能干细胞包括胚胎干细胞(es细胞)、诱导多能干细胞(ips细胞)、胚胎生殖干细胞(eg细胞)、生殖干细胞(gs细胞)等。优选为es细胞或ips细胞。ips细胞由于没有伦理性问题等原因而特别优选。作为多能干细胞,可以使用公知的任意的多能干细胞,例如可以使用国际公开第2009/123349号(pct/jp2009/057041)中记载的多能干细胞。
[0179]“组织干细胞”是指:能分化的细胞谱系仅限于特定的组织,但具有能分化为多种细胞类型的能力(分化多能性)的干细胞。例如骨髄中的造血干细胞是血细胞的来源,神经干细胞分化为神经细胞。除此以外有制造肝脏的肝干细胞、成为皮肤组织的皮肤干细胞等各种种类。组织干细胞优选选自间充质干细胞、肝干细胞、胰腺干细胞、神经干细胞、皮肤干细胞、或造血干细胞。
[0180]“体细胞”是指:构成多细胞生物的细胞中除生殖细胞以外的细胞。有性生殖中无法传递给下一代。体细胞优选选自肝细胞、胰腺细胞、肌细胞、骨细胞、成骨细胞、破骨细胞、软骨细胞、脂肪细胞、皮肤细胞、成纤维细胞、胰腺细胞、肾细胞、肺细胞、或淋巴细胞、红细胞、白细胞、单核细胞、巨噬细胞或巨核细胞之类的血细胞。
[0181]“生殖细胞”是指:具有在生殖中将遗传信息传递给下一代的作用的细胞。例如包括用于有性生殖的配子、即卵子、卵细胞、精子、精细胞、用于无性生殖的孢子等。
[0182]
细胞可以选自由肉瘤细胞、已建立细胞系的细胞和转化细胞组成的组。“肉瘤”是指:在骨、软骨、脂肪、肌肉、血液等非上皮性细胞来源的结缔组织细胞中发生的癌,包括软组织肉瘤、恶性骨肿瘤等。肉瘤细胞是源自肉瘤的细胞。“已建立细胞系的细胞”是指:长期在体外维持,具有一定稳定的性质、能够进行半永久性传代培养的培养细胞。存在pc12细胞(大鼠肾上腺髄质来源)、cho细胞(中国仓鼠卵巢来源)、hek293细胞(人胚肾来源)、hl-60细胞(人白细胞来源)、hela细胞(人宫颈癌来源)、vero细胞(非洲绿猴肾脏上皮细胞来源)、mdck细胞(狗肾脏肾小管上皮细胞来源)、hepg2细胞(人肝癌来源细胞株)、bhk细胞(新生仓
鼠肾脏细胞)、nih3t3细胞(小鼠胎儿成纤维细胞来源)等源自包括人在内的各种生物物种的各种组织的细胞株。“转化细胞”是指从细胞外部导入核酸(dna等)而改变了遗传性质的细胞。
[0183]
本说明书中,“粘附细胞”通常是需要将自身粘附于适合的表面以进行增殖的细胞,也被称为粘附细胞或支架依赖性细胞。本发明的一些实施方式中,所使用的细胞是粘附细胞。本发明中使用的细胞为粘附细胞,更优选为在悬浮于培养基中的状态下也能进行培养的细胞。能悬浮培养的粘附细胞可以通过利用公知的方法使粘附细胞驯化为适应悬浮培养的状态而得到,例如可列举出cho细胞、hek293细胞、vero细胞、nih3t3细胞等以及由这些细胞衍生而得到的细胞株。
[0184]
本发明的细胞培养法中,通过将细胞应用于小片聚合物多孔膜并进行培养,从而大量的细胞在小片聚合物多孔膜所具有的内部的多面连通多孔部分和表面生长,能够简便地培养大量的细胞。另外,对于本发明中使用的、接种在小片聚合物多孔膜上的细胞,提供即使以往会死亡那样的搅拌条件下也能够生长的环境,能够大量地培养细胞。
[0185]
本说明书中,将不包含细胞的小片聚合物多孔膜的、连同其内部间隙的体积在内在空间中所占有的体积称为“表观上小片聚合物多孔膜体积”。此外,将细胞应用于小片聚合物多孔膜,在细胞被负载于小片聚合物多孔膜的表面和内部的状态下,将小片聚合物多孔膜、细胞、和浸润至小片聚合物多孔膜内部的培养基作为整体,将其在空间中所占有的体积称为“包括细胞存活区域在内的小片聚合物多孔膜体积”。膜厚25μm的小片聚合物多孔膜的情况下,包括细胞存活区域在内的小片聚合物多孔膜体积是比表观上聚合物小片聚合物多孔膜最多大50%左右的值。本发明的方法中,能够在1个细胞培养容器中收纳多个(至少2个、例如3、4、5、10、20、30、40、50、100、500、1
×
103、2
×
103、3
×
103、4
×
103、5
×
103、7
×
103、1
×
104、2
×
104、3
×
104、5
×
104、7
×
104、1
×
105、2
×
105、3
×
105、5
×
105、7
×
105、1
×
106、2
×
106、3
×
106、5
×
106、7
×
106、1
×
107个、或超过这些)小片聚合物多孔膜并进行培养,在此情况下,有时将每个负载有细胞的多个小片聚合物多孔膜中的包括细胞存活区域在内的小片聚合物多孔膜体积的总和简称为“包括细胞存活区域在内的小片聚合物多孔膜体积的总和”。
[0186]
通过使用本发明的方法,从而即使在细胞培养容器中包含的细胞培养基的总体积为包括细胞存活区域在内的小片聚合物多孔膜体积的总和的10000倍或少于其的条件下,也能够长期良好地培养细胞。另外,即使在细胞培养容器中包含的细胞培养基的总体积为包括细胞存活区域在内的小片聚合物多孔膜体积的总和的1000倍或少于其的条件下也能够长期良好地培养细胞。进而,即使细胞培养容器中包含的细胞培养基的总体积为包括细胞存活区域在内的小片聚合物多孔膜体积的总和的100倍或少于其的条件下也能够长期良好地培养细胞。此外,即使在细胞培养容器中包含的细胞培养基的总体积为包括细胞存活区域在内的小片聚合物多孔膜体积的总和的10倍或少于其的条件下也能够长期良好地培养细胞。
[0187]
即,根据本发明,与现有的进行二维培养的细胞培养装置相比,能使进行细胞培养的空间(容器)缩小到极限。另外,若想增加要培养的细胞数时,能够通过增加所层叠的小片聚合物多孔膜的张数等简便的操作灵活地增加进行细胞培养的体积。若为本发明中使用的具备小片聚合物多孔膜的细胞培养装置,则能够将培养细胞的空间(容器)与储存细胞培养
基的空间(容器)分离,能够根据要培养的细胞数来准备所需量的细胞培养基。储存细胞培养基的空间(容器)可以根据目的而大型化或小型化,或可以为能更换的容器,没有特别限定。
[0188]
本说明书中,细胞的“大量培养”例如是指:假设所有细胞均匀地分散在细胞培养容器中包含的细胞培养基中,使用了小片聚合物多孔膜培养后细胞培养容器中包含的细胞数量被培养至每1毫升培养基中为1.0
×
105个以上、1.0
×
106个以上、2.0
×
106个以上、5.0
×
106个以上、1.0
×
107个以上、2.0
×
107个以上、5.0
×
107个以上、1.0
×
108个以上、2.0
×
108个以上、5.0
×
108个以上、1.0
×
109个以上、2.0
×
109个以上或5.0
×
109个以上。
[0189]
需要说明的是,作为测量培养中或培养后的细胞数的方法,可以使用各种公知的方法。例如,作为假设所有细胞均匀地分散在细胞培养容器中包含的细胞培养基中时,测量使用了小片聚合物多孔膜培养后细胞培养容器中包含的细胞数的方法,可以适宜使用公知的方法。例如,可以适宜使用利用cck8(参照下文)的细胞数测量法。具体而言,使用cell countinig kit8;同仁化学研究所制溶液试剂(以下记为“cck8”。),测量未使用小片聚合物多孔膜的通常的培养中的细胞数,求出吸光度与实际上的细胞数的相关系数。然后,将应用细胞并进行了培养的小片聚合物多孔膜移至包含cck8的培养基中,在培养箱内保存1~3小时,去除上清液并通过460nm的波长测定吸光度,基于之前求出的相关系数计算出细胞数。
[0190]
另外,从其它的观点出发,细胞的“大量培养”例如是指:使用小片聚合物多孔膜进行培养后每1平方毫米小片聚合物多孔膜中包含的细胞数被培养至1.0
×
103个以上、2.0
×
103个以上、1.0
×
104个以上、2.0
×
104个以上、5.0
×
104个以上、1.0
×
105个以上、2.0
×
105个以上、5.0
×
105个以上、1.0
×
106个以上、2.0
×
106个以上或5.0
×
106个以上。每1平方厘米小片聚合物多孔膜中包含的细胞数可以使用上述的cck8等公知的方法进行适宜测量。
[0191]
本说明书中所提及的全部文献通过引用将其全部内容并入本说明书中。
[0192]
以下说明的本发明的实施例仅用于例示,并非用于限定本发明的技术范围。本发明的技术范围仅通过权利要求书来限定。在不脱离本发明的主旨的情况下,可以进行本发明的变更、例如本发明的构成特征的追加、删除和置换。
[0193]
实施例
[0194]
以下基于实施例对本发明进行更具体地说明。需要说明的是,本发明并不限定于这些实施例。本领域技术人员可以基于本说明书的记载容易地对本发明施加修饰/变更,这些包括在本发明的技术范围内。
[0195]
以下的实施例中用于制作小片聚合物多孔膜的聚酰亚胺多孔膜通过如下方式而制备:将包含由作为四羧酸成分的3,3’,4,4
’‑
联苯四羧酸二酐(s-bpda)和作为二胺成分的4,4
’‑
二氨基二苯醚(oda)得到的聚酰胺酸溶液及作为着色前体的聚丙烯酰胺的聚酰胺酸溶液组合物成型后,以250℃以上进行热处理,由此制备。得到的聚酰亚胺多孔膜是具备具有多个孔的表面层a和表面层b、及夹持于该表面层a和表面层b之间的大孔隙层的三层结构的聚酰亚胺多孔膜,表面层a中存在的孔的平均孔径为19μm,表面层b中存在的孔的平均孔径为42μm,膜厚为25μm,孔隙率为74%。
[0196]
实施例1:人间充质干细胞的使用了小片聚合物多孔膜的培养法和外泌体产生
[0197]
(1)小片聚酰亚胺多孔膜的制作
[0198]
准备tsukatani thailand co.,ltd.制挠性蚀刻刀模ap型平冲用;1mm
×
1mm(刀的
规格参照下文),用磁力固定在磁铁板上,使用简易式冲压机(rdc fb类型)对宇部兴产制聚酰亚胺多孔膜(25μm厚)进行切断加工,由此准备了1mm
×
1mm的小片聚酰亚胺多孔膜。
[0199]
刀规格
[0200]
刀高度0.8mm
[0201]
刀深度0.4mm
[0202]
蚀刻深度0.6mm
[0203]
底座厚度0.2mm
[0204]
刀角度40
°
[0205]
(2)间充质干细胞的准备及向小片聚酰亚胺多孔膜上的接种
[0206]
将lonza公司制人间充质干细胞(poietics(商标))在iwaki制i型胶原蛋白涂层培养皿中进行2次传代,进行胰蛋白酶处理将细胞(4.0
×
106个细胞)悬浮于培养基(kohjin bio co.,ltd.制无异源培养基;adsc-4 4ml)中。在corning公司制150ml灭菌瓶内,向事先用相同培养基50ml以无菌操作进行湿润并在培养箱内振荡悬浮30分钟的聚酰亚胺多孔膜小片(200cm2)注入上述细胞培养。注入后,摇动数次后在co2培养箱内开始进行静置培养。
[0207]
(3)培养的延续
[0208]
以每2天或3天1次的频率用向上述培养基(adsc-4)中加入1000mg/l的葡萄糖的培养基50ml进行更换,连续培养18天。在培养过程中,连续地测定葡萄糖消耗量和乳酸产生量,确认了顺利的细胞增殖(图1)。
[0209]
(4)小片聚酰亚胺多孔膜上的细胞数确认及从小片多孔膜上的细胞回收
[0210]
自培养开始起18天后,利用基于同仁化学研究所制cell counting kit-8的呈色反应,验证在小片聚酰亚胺多孔膜上生长的细胞数,结果生长的总细胞数为4.6
×
106个细胞。在生长该细胞的片上注入thermo fisher scientific公司制tryple(商标)25ml,在培养箱内放置50分钟后回收悬浮液,进而用tryple(商标)10ml清洗小片并执行细胞回收。回收的细胞数为2.3
×
106个细胞(细胞回收率50%)。回收的细胞可以在胶原蛋白涂层培养皿中进行培养。
[0211]
(5)外泌体数的测定
[0212]
使用高速冷却离心机(久保田商事株式会社制、model 6000)在4℃下以30分钟、10000g对回收的细胞培养液进行离心分离,去除碎片(制备液1)。使用通过利用了0.025μm的过滤器(merck公司制、制品名:mf-millipore滤膜、型号:vswp04700)的抽滤去除微粒后的pbs(-)(fujifilm wako pure chemical corporation制、销售商编号:166-23555),将“制备液1”稀释至规定的浓度(制备液2)。接着,使用0.2μm的针式滤器(sartorius公司制、制品名:minisart、型号:16534k)从“制备液2”中去除了200nm以上的颗粒(制备液3)。使用zeta电位/粒径分布测定装置(microtec co.,ltd.制、zeecom zc-3000),基于布朗运动轨迹解析测定“制备液3”中包含的颗粒的粒径分布和外泌体级分的颗粒数。通过以下所示的“式1”计算出每天的外泌体产生量。
[0213]
式1:颗粒数
×
样品稀释倍率
×
150nm以下的颗粒的比例/培养基储存天数实施例2
[0214]
(1)使用小片聚酰亚胺多孔膜的长期培养
[0215]
使用与实施例1同样的方法,进行人间充质干细胞的长期培养,经时地回收培养基而获得外泌体。在整个培养期间能够稳定获得外泌体(图2)。培养开始后76天的总细胞数为
4.82
×
106个细胞。将实验期间的细胞数变化示于图3。
[0216]
(2)小片聚酰亚胺多孔膜上的细胞的干细胞性验证
[0217]
为了验证用小片聚酰亚胺多孔膜培养的人间充质干细胞的干细胞性,回收了一部分培养期间不同的培养样品,实施了向脂肪细胞和成骨细胞的分化诱导。将结果示于图4。确认了在整个培养期间维持了干细胞性。
[0218]
比较例1:人间充质干细胞的使用了聚合物多孔膜的培养法
[0219]
(1)使用1cm见方的聚酰亚胺多孔膜时的培养
[0220]
代替实施例1中记载的1mm见方的小片聚酰亚胺多孔膜而准备1cm见方的200张聚酰亚胺多孔膜,以相同细胞密度接种与实施例1的实验相同的细胞并实施了比较实验。18天后的培养总细胞数为3.0
×
106个细胞。
[0221]
(2)从1cm见方的聚酰亚胺多孔膜中的间充质干细胞回收
[0222]
与实施例1同样地进行使用tryple(商标)的细胞回收实验,结果游离回收的细胞数为1.0
×
106个细胞(细胞回收率33%)。
[0223]
(3)代谢方面的比较
[0224]
将实施例1和比较例1的葡萄糖消耗的比较数据示于图1。确认了:在整个培养期间,在小片聚酰亚胺多孔膜上的培养中进行了较高的葡萄糖消耗。
[0225]
实施例3:人皮肤成纤维细胞的使用了小片聚酰亚胺多孔膜的培养法
[0226]
(1)皮肤成纤维细胞的准备和细胞接种
[0227]
使用胰蛋白酶将在60cm2培养盘中培养的成人皮肤成纤维细胞剥离/回收,加入lifeline公司制无异源培养基fibrolife 3ml而准备了细胞悬浮液(3.0
×
106个细胞)。向事先用相同培养基25ml以无菌操作进行湿润并在培养箱内振荡悬浮30分钟的聚酰亚胺多孔膜小片(300cm2)注入上述细胞培养。注入后,摇动数次后在co2培养箱内开始进行静置培养。
[0228]
(2)皮肤成纤维细胞的小片聚酰亚胺多孔膜培养
[0229]
每2天或3天进行培养基更换,15天之后每天实施了培养基更换。将基于使用了cck8的呈色的总细胞数的变化示于图5。观察到稳定的细胞生长。
[0230]
实施例4:杂交瘤的使用了小片聚酰亚胺多孔膜的间歇式培养法
[0231]
(1)杂交瘤的准备和在小片多孔膜上的接种
[0232]
对于jcrb cell bank制杂交瘤(sc78.h81.c81.a9),在corning公司制细胞培养皿(falcon(商标))和thermo fisher scientfic公司制125ml锥形瓶中传代8次(用在fujifilm wako pure chemical corporation制rpmi-1640中添加了gibco(商标)制es cell fbs 10%的培养基进行4次传代后,用在thermo fisher scientfic公司制无血清培养基cd hybridoma中添加了thermo fisher scientfic公司制glutamax(商标)8mm的培养基进一步进行4次传代),准备了活细胞密度1.17
×
106个细胞/ml(活细胞率:87%)的悬浮细胞液。向thermo fisher scientfic公司制125ml锥形瓶(型号;4115-0125)中以无菌操作转移用纯化水湿润的1
×
1mm小片多孔膜120cm2的γ射线灭菌体,注入上述培养基(添加8mm glutamax(商标)的cd hybridoma)10ml并在co2培养箱内振荡30分钟,而完成了膜的湿润。然后,排出去除上述培养基,完成了在锥形烧瓶槽内的湿润膜准备。向槽内注入细胞悬浮液20ml并摇动数次后,在co2培养箱内静置1天,完成了细胞的小片多孔膜吸附工序。将层中残
留液体部分全部排出除去,注入上述培养基(添加8mm glutamax(商标)的cd hybridoma)20ml后,在co2培养箱内开始进行静置培养。
[0233]
(2)代谢物和抗体产生量的测定
[0234]
培养开始后,在第2天和第6天对细胞培养液进行少量取样,使用roche公司制cedexbio测定培养液中的葡萄糖浓度、乳酸浓度和抗体产生量,验证了代谢情况。确认了良好的细胞的存活和增殖(表2),另外,确认了有效地进行了抗体产生。说明能够用小片多孔膜培养杂交瘤、且可用于连续的抗体产生。
[0235]
[表2]
[0236]
培养期间(天)glc(mg/l)lac(mg/l)mgg(mg/l)233571264.7662162149727.53
[0237]
(3)小片多孔膜的细胞数测定
[0238]
用fujifilm wako pure chemical corporation制ham’s f-12培养基(含有谷氨酰胺/酚红)10ml对培养天数第6天的小片多孔膜清洗2次,去除悬浮细胞后,通过使用了株式会社同仁化学研究所制的cell counting kit-8的呈色反应来测定粘附于小片多孔膜上的活细胞密度,为1.64
×
103个细胞/cm2的细胞密度,观察到总数为1.97
×
105个细胞的活细胞。确认了不易通过清洗而剥离的细胞粘附/存活在小片多孔膜上。
[0239]
实施例5:杂交瘤的使用了小片聚酰亚胺多孔膜的间歇式培养法
[0240]
(1)杂交瘤的准备和在小片多孔膜上的接种
[0241]
利用与实施例新1同样的方法准备细胞和小片多孔膜,注入培养槽后,在co2培养箱内在thermo fisher scientfic公司制摇床(maxq 200 co2plus)上以50rpm振荡24小时,然后转移至静置培养。转移后通过与实施例4同样的操作执行了培养。
[0242]
(2)代谢物和抗体产生量的测定
[0243]
利用与实施例4同样的方法获得样品,进行代谢物和所产生的抗体量的测定,确认了细胞的存活和良好的增殖。确认了优异的抗体产生力(表3)。通过经历使用运动条件的细胞吸附过程,从而更高效地实施小片多孔膜培养,确认能够适于高效的抗体产生等。
[0244]
[表3]
[0245]
培养期间(天)glc(mg/l)lac(mg/l)migg(mg/l)233051925.3861682197243.43
[0246]
(3)小片多孔膜的细胞数测定
[0247]
利用与实施例4同样的方法测定粘附于小片多孔膜上的活细胞密度,结果为1.41
×
103个细胞/cm2的细胞密度,观察到总数为1.70
×
105个细胞的活细胞。确认了:杂交瘤以经过多次清洗也不易剥离的状态粘附/存活于小片多孔膜上。
[0248]
实施例6:小片聚酰亚胺多孔膜连续培养法杂交瘤
[0249]
(1)杂交瘤的准备和在小片多孔膜上的接种
[0250]
对于jcrb cell bank制杂交瘤(sc78.h81.c81.a9),在corning公司制细胞培养皿(falcon(商标))和thermo fisher scientfic公司制125ml锥形瓶中进行10次传代(用添加fbs 10%的rpmi-1640培养基进行4次传代后,用添加8mm glutamax(商标)的cd hybridoma
培养基进行6次传代)悬浮细胞培养,准备了活细胞密度1.11
×
106个细胞/ml(活细胞率:78%)的悬浮细胞液。在填充有用纯化水湿润的1
×
1mm小片多孔膜120cm2的灭菌体的图7所示的溢流反应器中注入上述细胞悬浮液20ml。注入后,将培养槽部分摇动数次后,在co2培养箱内静置30分钟而开始进行培养。另外,也可以同样地使用图8所示的装置。
[0251]
(2)连续培养的实施
[0252]
以每天约20ml的频率将上述培养基(添加8mm glutamax(商标)的cd hybridoma)连续地供给至反应器内,利用抽取泵(as one corporation制管泵)来控制液面高度,边将培养槽内的培养基量保持恒定边连续地进行培养基回收。
[0253]
同样地,在使用图8的装置时,具有附图右侧的泵时,作为排出泵,如果没有(图6)则自然流出,通过以同样的液面控制而为恒定量的槽内培养基,能够保持稳定的培养环境。
[0254]
(3)代谢物的测定
[0255]
以每天1次的频率回收抽取的培养液,使用roche公司制cedexbio测定了回收液中的葡萄糖浓度、乳酸浓度和抗体产生量。将结果示于表4。确认了:在整个培养期间,稳定且高效地进行了葡萄糖消耗/乳酸产生,同时稳定且连续地实施了良好的抗体产生。
[0256]
[表4]
[0257]
培养期间(天)回收液量glc(mg/l)lac(mg/l)mlgg(mg/l)1252029136526.102122338124021.99324274891816.05415268399517.925152565112621.04
[0258]
(4)小片多孔膜的细胞数测定
[0259]
在培养天数第5天去除反应器内的培养基,用fujifilm wako pure chemical corporation制ham’s f-12培养基(含有谷氨酰胺/酚红)10ml对残留的小片多孔膜进行2次清洗而从表面去除能脱离的悬浮细胞后,通过使用了株式会社同仁化学研究所制的cell counting kit-8的呈色反应实施了细胞数测定。利用该方法测定细胞密度,结果为1.46
×
103个细胞/cm2,确认了总数为1.75
×
105个细胞的活细胞以即使清洗也不易剥离的状态粘附/存活于小片多孔膜上。
[0260]
实施例7:在小片聚酰亚胺多孔膜上的基于皮肤成纤维细胞的细胞培养和蛋白产生
[0261]
(1)小片多孔膜准备和细胞培养
[0262]
将人皮肤成纤维细胞(lonza公司制;lot.no.18tl215675)在corning公司制细胞培养falcon培养皿中进行5次传代,进行胰蛋白酶处理而使细胞(1.2
×
106个细胞)悬浮于培养基(lonza公司制fgm-2bulletkit 1.2ml)中。在corning公司制125ml灭菌瓶内,在co2培养箱内事先用d-pbs(fujifilm wako pure chemical corporation)50ml将聚酰亚胺小片多孔膜(120cm2)以无菌操作湿润,去除d-pbs后,注入上述的培养基(lonza公司制fgm-2 bulletkit)10ml。将包含该多孔膜的培养基在相同培养箱内进一步放置30分钟后,注入上述的细胞悬浮液1.2ml。注入后,摇动数次后,在相同培养箱内静置一夜,第二天,注入上述的培养基(lonza公司制fgm-2bulletkit)20ml,开始进行长期培养。
[0263]
(2)培养的延续
[0264]
以每周1次的频率更换上述的培养基(fgm-2bulletkit)30ml,连续进行18天培养。在培养过程中,测定葡萄糖消耗量和乳酸产生量,确认了顺利的细胞增殖。
[0265]
(3)纤维连接蛋白产生量的测定
[0266]
使用回收的细胞培养液,使用fibronectin elisa kit(takara制cat:mk115)测定第5天、第13天、第18天的纤维连接蛋白产生量。将结果示于表5。
[0267]
[表5]
[0268][0269]
实施例8:软骨细胞的小片多孔膜培养
[0270]
准备放入了经灭菌的聚酰亚胺多孔膜小片(1mm
×
1mm)120cm2的corning公司制125ml方型pet制存储瓶(带45mm盖子)。在放入了该小片多孔膜的方型灭菌瓶中,注入向培养基(kohjin bio co.,ltd.制无异源培养基;kbm adsc-4r)中加入葡萄糖液(fujifilm wako pure chemical corporation制;45w/v%d(+)-葡萄糖溶液)而将总葡萄糖浓度调整为3000mg/l的调整培养基30ml,使小片与培养基充分融合。
[0271]
使用gibco公司制胰蛋白酶-edta(0.05%),酚红剥离在iwaki i型胶原蛋白涂层培养皿中培养的第4代的promocell公司制人软骨细胞(y30 female439z037.3),进行离心/细胞回收后,悬浮在前述调整培养基(注入葡萄糖的kbm adsc-4r)中。以每1ml为1.0
×
106个细胞的悬浮细胞密度,相对于聚酰亚胺多孔膜小片的面积每1cm2注入1.0
×
104个的细胞(总计;1.2
×
106个细胞)的细胞悬浮液。注入后,将包含小片多孔膜的培养槽方型瓶移至co2培养箱内,开始进行静置培养。
[0272]
以每週2次的频率进行30ml的培养基更换,连续进行培养。在第8天、第15天、第20天、第35天利用基于同仁化学研究所制cell counting kit-8的呈色反应,测定了生长在多孔膜小片上的总细胞数。将增殖情况示于图9。确认了人软骨细胞良好的细胞生长情况。证实了通过小培养容器的静置培养能够稳定且长期、简便且容易地培养大量的细胞。
[0273]
另外,对于培养第19天的回收培养基内的外泌体产生量,用人源外泌体定量用cd9/cd63elisa试剂盒(cosmo bio co.,ltd.制;型号_exh0102el)以cd63的蛋白量的形式测定外泌体产生量,结果在储存3天时确认了117pg/ml的外泌体产生。与前述的连续培养系统同样地,在间歇培养系统中,也确认了高效且稳定的外泌体产生。
[0274]
实施例9:人皮肤成纤维细胞的小片多孔膜培养和细胞回收
[0275]
(1)小片多孔膜准备和细胞准备
[0276]
将灭菌的聚酰亚胺小片多孔膜(300cm2)以无菌操作移至sumitomo bakelite公司制50ml离心管(螺旋锥管)内,注入pbs 12ml将膜湿润。1小时后,吸除pbs,完成了膜准备。
[0277]
将人皮肤成纤维细胞(lonza公司制;lot.no.18tl215675)在corning公司制细胞培养falcon培养皿中进行2次传代,进行胰蛋白酶处理而将细胞(3.0
×
106个细胞)悬浮于
在培养基(lifeline公司制fibrolife(注册商标)成纤维细胞无血清培养基完整试剂盒)中加入了葡萄糖液并调整至2000mg/l的培养基3.0ml中。
[0278]
(2)细胞接种和细胞培养
[0279]
向先前在锥形管内准备的小片多孔膜中加入前述培养基10ml和上述悬浮细胞并缓慢摇动数次后,在co2培养箱内放置一整夜。第二天,将吸附了细胞的小片聚酰亚胺多孔膜移至corning公司制150ml灭菌瓶内,进而加入20ml的培养基开始进行培养。以每周2次的频率进行培养基更换(体积30ml),在第2天、第6天、第9天、第14天利用基于同仁化学研究所制cell counting kit-8的呈色反应,测到了生长在多孔膜小片上的总细胞数。测定各测定日的生长在瓶内小片聚酰亚胺多孔膜上的人皮肤成纤维细胞每1cm2的细胞密度和瓶内的总细胞数,确认了细胞的生长情况。将结果示于表6。
[0280]
[表6]
[0281][0282]
(3)自小片多孔膜上的细胞回收和传代
[0283]
在培养开始后第15天,去除瓶内的培养基,用pbs 20ml清洗瓶内的小片多孔膜后,吸除该pbs。接着,注入thermo fisher scientific公司制tryple express(商标)15ml,在co2培养箱内放置40分钟。回收细胞游离并发生白浊的上清液,进而用前述培养基25ml清洗小片多孔膜,回收游离细胞。离心分离后,用前述培养基3ml悬浮并实施细胞数测定,结果确认了3.6
×
106个活细胞。将回收的本细胞接种在培养孔板和小片聚酰亚胺多孔膜上,确认了细胞的生长。
[0284]
附图标记说明
[0285]
1a
ꢀꢀꢀ
细胞培养装置
[0286]
10
ꢀꢀꢀ
培养槽
[0287]
100
ꢀꢀ
培养槽主体
[0288]
101
ꢀꢀ
培养基排出口
[0289]
102
ꢀꢀ
侧部
[0290]
103
ꢀꢀ
底部
[0291]
104
ꢀꢀ
排出口连接器
[0292]
110
ꢀꢀ
培养槽盖体
[0293]
111
ꢀꢀ
第1盖体连接器
[0294]
112
ꢀꢀ
第1培养基供给管
[0295]
113
ꢀꢀ
培养基供给口
[0296]
114
ꢀꢀ
第1通气管
[0297]
115
ꢀꢀ
第1通气过滤器
[0298]
120
ꢀꢀ
培养后的培养基
[0299]
121
ꢀꢀ
培养基水平
[0300]
200a 小片聚合物多孔膜
[0301]
30
ꢀꢀꢀ
第2培养基供给管
[0302]
31
ꢀꢀꢀ
第3培养基供给管
[0303]
32
ꢀꢀꢀ
泵
[0304]
40
ꢀꢀꢀ
培养基供给槽
[0305]
400
ꢀꢀ
新鲜培养基
[0306]
41
ꢀꢀꢀ
培养基供给槽盖体
[0307]
410
ꢀꢀ
第2盖体连接器
[0308]
411
ꢀꢀ
第2通气管
[0309]
412
ꢀꢀ
第2通气过滤器
[0310]
50、51 培养基排出管
[0311]
52
ꢀꢀꢀ
引导件
[0312]
60
ꢀꢀꢀ
培养基回收槽
[0313]
61
ꢀꢀꢀ
培养基回收槽盖体
[0314]
610
ꢀꢀ
第3盖体连接器
[0315]
611
ꢀꢀ
第3通气管
[0316]
612
ꢀꢀ
第3通气过滤器
[0317]
70
ꢀꢀꢀ
培养槽设置台
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1