单倍体相合的干细胞移植中的抗病毒中央型记忆CD8
单倍体相合的干细胞移植中的抗病毒中央型记忆cd8
+
反抑细胞
1.相关申请本技术要求于2019年8月6日提交的美国临时专利申请号62/883,164的优先权利益,所述美国临时专利申请的内容通过引用以其整体引入本文。
2.技术领域和
背景技术:
本发明,在其一些实施方案中,涉及由记忆t细胞生成的反抑细胞,并且更具体地但非排他地,涉及其制造方法以及在用于达到稳定和长期的细胞或组织移植的疗法中的用途。
3.高剂量放化疗“调理”对于用同种异体造血细胞移植(allo-hct)获得血液恶性肿瘤的持久缓解是关键的模式,已转变为强调与后续免疫疗法结合的新近形成的供体衍生的免疫系统的免疫移植物抗恶性肿瘤效应。然而,保留能够保护患者在移植后早期过程中免于致死性感染的更强大的宿主免疫系统的调理减少,也与移植物排斥的风险增强相关。在单倍体相合的hct中,这可以通过使用非体外去除t细胞移植(t cell replete transplant)来克服,因为移植物中的同种异体反应性t细胞能够攻击宿主t细胞,并且为供体干细胞的移植物植入铺平了道路。然而,此类同种异体反应性t细胞也与危及生命的移植物抗宿主(gvh)反应性相关,需要移植后强效免疫抑制药物的使用。近年来,在移植之后使用高剂量环磷酰胺(cy)减少移植物抗宿主病(gvhd)的严重性方面已取得一些进展。然而,慢性gvhd仍是问题,并且需要免疫抑制药物的延长使用,这不利地影响移植物抗恶性肿瘤效应。此外,许多患者中的gvhd发生与胸腺功能不良相关,进一步限制了充分的抗肿瘤免疫。
4.为了克服这一障碍,可以使用
‘
大剂量
’ꢀ
t细胞耗尽的单倍体相合的hct,即使在不存在移植后免疫抑制疗法的情况下,这也没有gvhd风险。然而,由于存活过移植前调理方案的抗供体t细胞克隆的高水平,因此在非清髓性(nma)调理后实现移植物植入仍是重大挑战。用于解决这个挑战的一种方法是在移植之后不久使用高剂量cy (在pct公开号wo 2013/093920和wo 2013/093919中进行讨论)。
5.此外,已考虑了各种方法用于缺乏gvh反应性的耐受性诱导细胞(例如反抑细胞)的生成,及其作为用于移植物移植的辅助治疗的用途,一些方法在下文中进行概括。
6.pct公开号wo 2001/49243公开了非同种异体反应性抗第三方细胞毒性t淋巴细胞(ctl)的使用,其中所述非同种异体反应性抗第三方ctl通过引导供体的t淋巴细胞针对一种或多种第三方抗原而生成(在不存在外源性il-2的情况下),该剂量基本上耗尽能够发展为同种异体反应性ctl的t淋巴细胞(例如cd4
+ t细胞和/或cd56
+
天然杀死细胞)。
7.pct公开号wo 2007/023491公开了致耐受性细胞用于减少或预防受试者中的非同基因移植物的移植物排斥的用途。所公开的致耐受性t调节细胞(例如cd4
+
cd25
+
细胞)可以衍生自与受试者和移植物两者均非同基因的任何供体(“第三方”致耐受性细胞)。移植物(例如骨髓)可以衍生自与受试者为同种异体或异种的任何移植物供体。
8.pct公开号wo 2010/049935公开了具有中央型记忆t淋巴细胞(tcm)表型的非gvhd
诱导性抗第三方细胞的使用,该细胞是耐受性诱导细胞,并且能够在移植之后归巢到淋巴结。根据wo 2010/049935,该细胞通过以下生成:使非同基因的外周血单核细胞(pbmc)与一种或多种第三方抗原在剥夺细胞因子的培养物中接触,然后在允许包含tcm表型的细胞增殖的条件下,在il-15的存在下培养细胞。
9.pct公开号wo 2012/032526公开了具有tcm表型的非gvhd诱导性抗第三方细胞在疾病治疗中的用途,该细胞是耐受性诱导细胞,并且能够在移植之后归巢到淋巴结。根据wo 2012/032526,该细胞通过以下生成:在允许gvh反应性细胞消除的条件下(例如,培养1-5天),在il-21的存在或不存在下,使pbmc与一种或多种第三方抗原接触,然后在允许包含tcm表型的细胞增殖的条件下,在il-15的存在下培养细胞。
10.pct公开号wo 2013/035099公开了具有中央型记忆t淋巴细胞(tcm)表型的非gvhd诱导性抗第三方细胞的使用,该细胞是耐受性诱导细胞和/或被赋予抗疾病活性,并且能够在移植之后归巢到淋巴结。根据wo 2013/035099,该细胞通过以下生成:在il-21的存在下,使pbmc与一种或多种第三方抗原接触,以便允许抗原反应性细胞的富集,然后在无抗原的环境下,在il-21、il-15和il-7的存在下培养细胞,以便允许包含tcm表型的细胞增殖。
11.pct公开号wo 2018/002924公开了由记忆t细胞生成的反抑细胞、其制造方法以及在移植和疾病治疗中的用途。根据wo 2018/002924,反抑细胞是具有tcm表型的非gvhd诱导性抗第三方细胞,是耐受性诱导细胞和/或被赋予抗疾病活性,并且能够在移植之后归巢到淋巴结。
12.另外的背景技术包括pct公开号:wo 2017/009852、wo 2017/009853和wo2018/134824。
技术实现要素:
13.根据本发明的一些实施方案的一个方面,提供了生成包含中央型记忆t淋巴细胞(tcm)表型的非移植物抗宿主病(gvhd)诱导细胞的分离群体的方法,该细胞是耐受性诱导细胞和/或被赋予抗疾病活性,并且能够在移植之后归巢到淋巴结,该方法包括:(a)使来自供体受试者的外周血单核细胞(pbmc)的第一群体与能够结合cd14
+
表达细胞的抗体接触,并且选择能够成熟为抗原呈递细胞的cd14
+
表达细胞;(b)用病毒肽装载抗原呈递细胞;(c)用能够耗尽cd4
+
、cd56
+
和cd45ra
+
表达细胞的一种或多种试剂处理与pbmc的第一群体属于同一供体受试者的pbmc的第二群体,以便获得包含表达cd45ra-cd8
+
表型的记忆t细胞的细胞群体;(d)在il-21的存在下,使包含记忆t细胞的细胞群体与步骤(b)的用病毒肽装载的抗原呈递细胞接触,以便允许病毒反应性记忆t细胞的富集;和(e)在il-21、il-15和/或il-7的存在下,培养起因于步骤(d)的细胞,以便允许包含tcm表型的细胞增殖,从而生成包含tcm表型的非gvhd诱导细胞的分离群体。
14.根据本发明的一些实施方案的一个方面,提供了生成包含中央型记忆t淋巴细胞(tcm)表型的非移植物抗宿主病(gvhd)诱导细胞的分离群体的方法,该细胞是耐受性诱导细胞和/或被赋予抗疾病活性,并且能够在移植之后归巢到淋巴结,该方法包括:(a)提供包含t细胞的细胞群体,其中所述细胞群体中的t细胞包含至少40%的表达
cd45ra-cd8
+
表型并且耗尽cd4
+
、cd56
+
和cd45ra
+
表达细胞的记忆t细胞;和(b)在il-21的存在下,使包含记忆t细胞的细胞群体与衍生自4-10种类型的病毒的病毒肽接触,以便允许病毒反应性记忆t细胞的富集,其中所述病毒中的至少一种包含bk病毒;和(c)在il-21、il-15和/或il-7的存在下,培养起因于步骤(b)的细胞,以便允许包含tcm表型的细胞增殖,从而生成包含tcm表型的非gvhd诱导细胞的分离群体。
15.根据本发明的一些实施方案的一个方面,提供了生成包含中央型记忆t淋巴细胞(tcm)表型的非移植物抗宿主病(gvhd)诱导细胞的分离群体的方法,该细胞是耐受性诱导细胞和/或被赋予抗疾病活性,并且能够在移植之后归巢到淋巴结,该方法包括:(a)使来自供体受试者的外周血单核细胞(pbmc)的第一群体与能够选择cd14
+
表达细胞的抗体接触,并且选择能够成熟为树突状细胞的cd14
+
表达细胞;(b)用衍生自4-10种类型的病毒的病毒肽装载树突状细胞,其中所述病毒中的至少一种包含bk病毒;(c)用能够耗尽cd4
+
、cd56
+
和cd45ra
+
表达细胞的一种或多种试剂处理与pbmc的第一群体属于同一供体受试者的pbmc的第二群体,以便获得包含表达cd45ra-cd8
+
表型的记忆t细胞的细胞群体;(d)在il-21的存在下,使包含记忆t细胞的细胞群体与步骤(b)的用病毒肽装载的树突状细胞接触,以便允许病毒反应性记忆t细胞的富集;和(e)在il-21、il-15和/或il-7的存在下,培养起因于步骤(d)的细胞,以便允许包含tcm表型的细胞增殖,从而生成包含tcm表型的非gvhd诱导细胞的分离群体。
16.根据本发明的一些实施方案的一个方面,提供了根据本发明的一些实施方案的方法生成、包含具有中央型记忆t淋巴细胞(tcm)表型的细胞的非gvhd诱导细胞的分离群体,该细胞是耐受性诱导细胞和/或被赋予抗疾病活性,并且能够在移植之后归巢到淋巴结。
17.根据本发明的一些实施方案的一个方面,提供了药物组合物,其包含作为活性成分的本发明的一些实施方案的非gvhd诱导细胞的分离群体和药学上可接受的载体。
18.根据本发明的一些实施方案的一个方面,提供了治疗有此需要的受试者中的疾病的方法,该方法包括向受试者施用治疗有效量的本发明的一些实施方案的非gvhd诱导细胞的分离群体,从而治疗受试者中的疾病。
19.根据本发明的一些实施方案的一个方面,提供了本发明的一些实施方案的非gvhd诱导细胞的分离群体用于制造药物的用途,所述药物经鉴定用于治疗有此需要的受试者中的疾病。
20.根据本发明的一些实施方案的一个方面,提供了在有此需要的受试者中减少移植物排斥和/或移植物抗宿主病(gvhd)和/或诱导供体特异性耐受的方法,其中所述受试者需要非同基因细胞或组织移植,该方法包括向受试者施用治疗有效量的本发明的一些实施方案的非gvhd诱导细胞的分离群体,从而减少受试者中的移植物排斥和/或gvhd。
21.根据本发明的一些实施方案的一个方面,提供了本发明的一些实施方案的非gvhd诱导细胞的分离群体用于制造药物的用途,所述药物经鉴定用于在有此需要的受试者中减少移植物排斥和/或移植物抗宿主病(gvhd)和/或诱导供体特异性耐受,其中所述受试者需要非同基因细胞或组织移植。
22.根据本发明的一些实施方案的一个方面,提供了治疗需要非同基因细胞或组织移植的受试者的方法,该方法包括:(a)将细胞或组织移植物移植到受试者内;和(b)向受试者施用治疗有效量的本发明的一些实施方案的非gvhd诱导细胞的分离群体,从而治疗需要细胞或组织移植的受试者。
23.根据本发明的一些实施方案的一个方面,提供了本发明的一些实施方案的非gvhd诱导细胞的分离群体用于制造药物的用途,所述药物鉴定为用于非同基因细胞或组织移植到受试者内的辅助治疗,其中所述受试者需要非同基因细胞或组织移植。
24.根据本发明的一些实施方案的一个方面,提供了治疗需要未成熟造血细胞移植的受试者的方法,该方法包括:(a)在非清髓性移植前调理方案下调理受试者,其中所述非清髓性调理包含全身照射(tbi)和化学治疗剂,其中所述tbi和化学治疗剂在移植之前的第-7至-1天时(例如在移植之前的第-7至-2天时,例如在第-6至-1天时)施用;(b)将一定剂量的t细胞耗尽的未成熟造血细胞移植到受试者内,其中所述t细胞耗尽的未成熟造血细胞包含少于5 x 105个cd3
+ t细胞/千克受试者的理想体重,并且其中所述t细胞耗尽的未成熟造血细胞包含至少5 x 106个cd34
+
细胞/千克受试者的理想体重;(c)向受试者施用治疗有效量的环磷酰胺,其中所述环磷酰胺的治疗有效量包含25-200 mg环磷酰胺/千克受试者的理想体重,并且其中所述治疗有效量的环磷酰胺将在t细胞耗尽的未成熟造血细胞移植之后3和4天以两个剂量施用于受试者;和(d)向受试者施用治疗有效量的本发明的一些实施方案的非gvhd诱导细胞的分离群体,其中所述非gvhd诱导细胞的分离群体在t细胞耗尽的未成熟造血细胞移植之后的第6-9天时施用,从而治疗需要未成熟造血细胞移植的受试者。
25.根据本发明的一些实施方案,pbmc的第一群体和pbmc的第二群体来自同一批次。
26.根据本发明的一些实施方案,表达cd45ra-cd8
+
表型的记忆t细胞构成细胞群体中至少40%的t细胞。
27.根据本发明的一些实施方案,试剂是抗体。
28.根据本发明的一些实施方案,在il-21的存在下的接触进行12小时至6天。
29.根据本发明的一些实施方案,在il-21的存在下的接触进行3天。
30.根据本发明的一些实施方案,在il-21、il-15和/或il-7中的任一种的存在下的培养进行6至12天。
31.根据本发明的一些实施方案,在il-21、il-15和/或il-7中的任一种的存在下的培养进行9天。
32.根据本发明的一些实施方案,培养进一步包含将葡萄糖加入到至少50 mg/dl的浓度。
33.根据本发明的一些实施方案,病毒肽在抗原呈递细胞上呈递。
34.根据本发明的一些实施方案,抗原呈递细胞通过包括以下的方法获得:使来自供体受试者的pbmc与能够结合cd14
+
表达细胞的抗体接触,并且选择能够成熟为抗原呈递细胞的cd14
+
表达细胞。
35.根据本发明的一些实施方案,抗原呈递细胞与包含记忆t细胞的细胞群体属于同一供体受试者。
36.根据本发明的一些实施方案,选择cd14
+
表达细胞不受塑料粘附的影响。
37.根据本发明的一些实施方案,抗原呈递细胞包含树突状细胞。
38.根据本发明的一些实施方案,树突状细胞是成熟的树突状细胞。
39.根据本发明的一些实施方案,树突状细胞通过包括以下的方法获得:在包含树突状细胞成熟因子的培养物中培养cd14
+
表达细胞。
40.根据本发明的一些实施方案,病毒肽衍生自1-10种类型的病毒。
41.根据本发明的一些实施方案,病毒肽衍生自2-10种类型的病毒。
42.根据本发明的一些实施方案,病毒肽衍生自4-10种类型的病毒。
43.根据本发明的一些实施方案,病毒肽中的至少一种包含来自bk病毒的至少一种肽。根据本发明的一些实施方案,病毒肽包含eb病毒(ebv)肽、巨细胞病毒(cmv)肽、bk病毒肽和腺病毒(adv)肽。
44.根据本发明的一些实施方案,病毒肽包含ebv-lmp2、ebv-bzlf1、ebv-ebna1、ebv选择、cmv-pp65、cmv-ie-1、adv五邻体、adv六邻体、bkv lt、bkv (衣壳 vp1)、bkv (衣壳蛋白 vp2)、bkv (衣壳蛋白 vp2、同种型 (isoporm) vp3)、bkv (小 t 抗原)中的至少一种。
45.根据本发明的一些实施方案,病毒肽包含adv5六邻体、hcmv pp65、ebv选择和bkv lt中的至少一种。
46.根据本发明的一些实施方案,病毒肽包含adv5六邻体、hcmv pp65、ebv选择和bkv lt。
47.根据本发明的一些实施方案,病毒肽进一步包含至少一种类型的细菌肽、真菌肽或肿瘤肽。
48.根据一些实施方案,病毒肽和至少一种类型的细菌肽、真菌肽或肿瘤肽是一起利用的。
49.根据一些实施方案,病毒肽和至少一种类型的细菌肽、真菌肽或肿瘤肽是分开利用的。
50.根据本发明的一些实施方案,pbmc相对于受试者是非同基因的。
51.根据本发明的一些实施方案,pbmc相对于受试者是同种异体的。
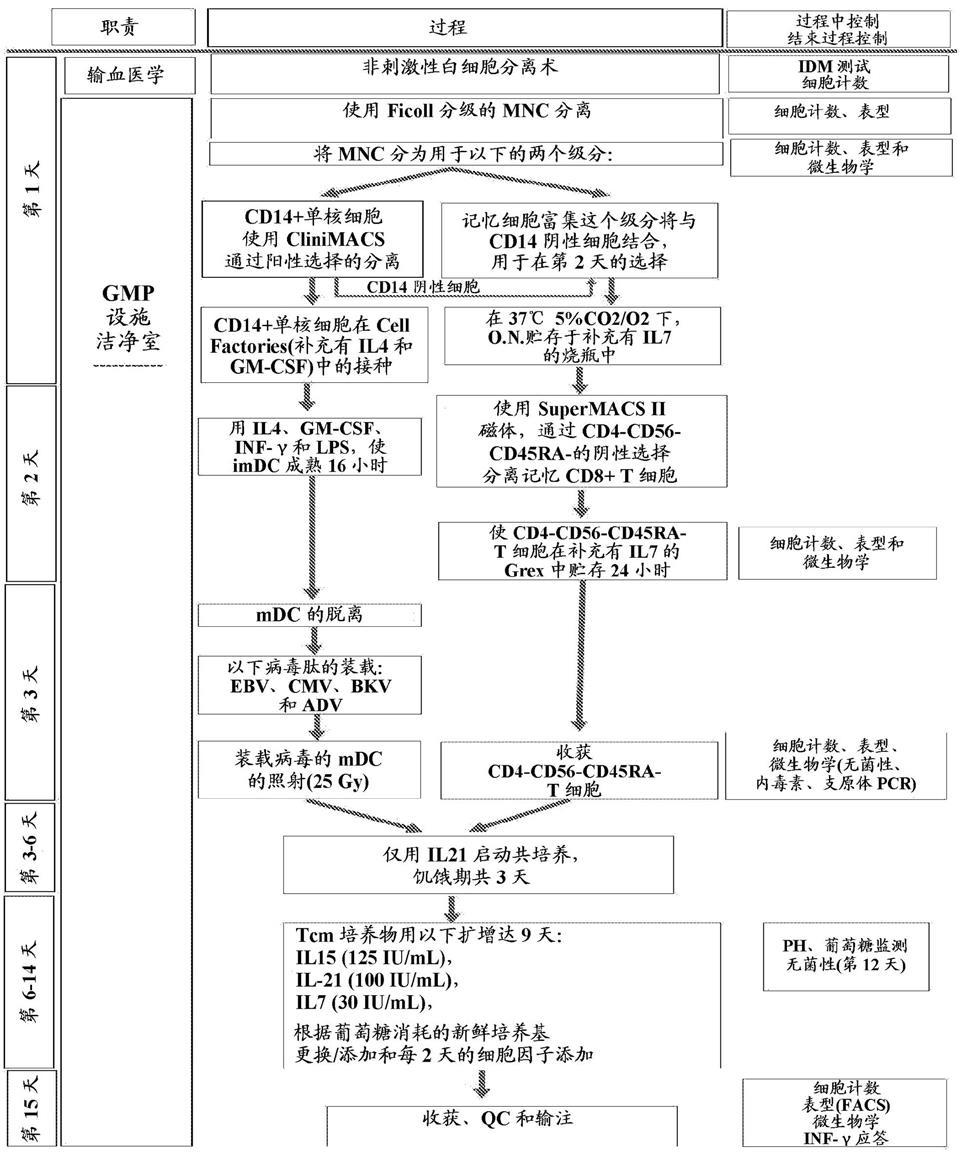
52.根据本发明的一些实施方案,包含记忆t细胞的细胞群体相对于受试者是非同基因的。
53.根据本发明的一些实施方案,包含记忆t细胞的细胞群体相对于受试者是同种异体的。
54.根据本发明的一些实施方案,具有tcm表型的细胞包含cd3
+
、cd8
+
、cd62l
+
、cd45ra-、cd45ro
+
特征。
55.根据本发明的一些实施方案,具有tcm表型的细胞构成至少30%的非gvhd诱导细胞的分离群体。
56.根据本发明的一些实施方案,非gvhd诱导细胞的分离群体配制用于作为新鲜细胞施用。
57.根据本发明的一些实施方案,非gvhd诱导细胞的分离群体配制用于作为冷冻保存
的细胞施用。
58.根据本发明的一些实施方案,方法进一步包括将细胞或组织移植物移植到受试者内。
59.根据本发明的一些实施方案,药物进一步包含细胞或组织移植物。
60.根据本发明的一些实施方案,方法进一步包括向受试者施用遗传修饰的t细胞。
61.根据本发明的一些实施方案,药物进一步包含遗传修饰的t细胞。
62.根据本发明的一些实施方案,遗传修饰的t细胞包含car-t细胞或tcr-转基因t细胞。
63.根据本发明的一些实施方案,细胞或组织移植包含未成熟造血细胞。
64.根据本发明的一些实施方案,疾病是恶性疾病。
65.根据本发明的一些实施方案,恶性疾病是实体瘤或肿瘤转移。
66.根据本发明的一些实施方案,恶性疾病是血液恶性肿瘤。
67.根据本发明的一些实施方案,恶性疾病选自白血病、淋巴瘤、骨髓瘤、黑色素瘤、肉瘤、神经母细胞瘤、结肠癌、结肠直肠癌、乳腺癌、卵巢癌、食道癌、滑膜细胞癌、肝癌、胰腺癌以及转移或复发。
68.根据本发明的一些实施方案,疾病是非恶性疾病。
69.根据本发明的一些实施方案,非恶性疾病选自器官功能障碍或衰竭、血液病、移植物相关疾病、传染病、遗传疾病或病症、镰状细胞病、自身免疫性疾病和代谢病症。
70.根据本发明的一些实施方案,非恶性疾病选自再生障碍性贫血、严重免疫缺陷和非恶性骨髓衰竭。
71.根据本发明的一些实施方案,非gvhd诱导细胞的分离群体用于在细胞或组织移植(例如非同基因细胞或组织移植)之后施用。
72.根据本发明的一些实施方案,非gvhd诱导细胞的分离群体用于在细胞或组织移植(例如非同基因细胞或组织移植)之后的第6-9天时施用。
73.根据本发明的一些实施方案,非gvhd诱导细胞的分离群体用于在细胞或组织移植(例如非同基因细胞或组织移植)之后的第7天时施用。
74.根据本发明的一些实施方案,非gvhd诱导细胞的分离群体用于以至少2.5 x 106个cd8
+
细胞/kg理想体重的剂量施用。
75.根据本发明的一些实施方案,非同基因细胞或组织移植包含未成熟造血细胞。
76.根据本发明的一些实施方案,未成熟造血细胞包含t细胞耗尽的未成熟造血细胞。
77.根据本发明的一些实施方案,未成熟造血细胞包含至少5 x 106个cd34
+
细胞/千克受试者的理想体重。
78.根据本发明的一些实施方案,使未成熟造血细胞耗尽cd3
+
和/或cd19
+
表达细胞。
79.根据本发明的一些实施方案,未成熟造血细胞包含少于4 x 105个cd3
+
表达细胞/kg受试者的理想体重。
80.根据本发明的一些实施方案,未成熟造血细胞包含少于3 x 105个cd3
+
表达细胞/kg受试者的理想体重。
81.根据本发明的一些实施方案,未成熟造血细胞包含少于2 x 105个cd3
+
表达细胞/kg受试者的理想体重。
82.根据本发明的一些实施方案,方法进一步包括在移植之前在非清髓性调理方案下调理受试者。
83.根据本发明的一些实施方案,方法进一步包括非清髓性移植前调理方案。
84.根据本发明的一些实施方案,非清髓性调理方案包含全身照射(tbi)、身体局部照射(tli)、化学治疗剂、抗体免疫疗法或共刺激阻断中的至少一种。
85.根据本发明的一些实施方案,tbi包含在1-5 gy范围内的单次或分次照射剂量。
86.根据本发明的一些实施方案,tbi在移植之前的第-1天时进行施用。
87.根据本发明的一些实施方案,在移植当天例如在第0天的早晨施用tbi,并且在同一天例如在晚上进行移植。
88.根据本发明的一些实施方案,化学治疗剂包含氟达拉滨、环磷酰胺、雷帕霉素、白消安、曲奥舒凡(trisulphan)、美法仑或噻替派中的至少一种。
89.根据本发明的一些实施方案,非清髓性调理方案包含t细胞减灭(t cell debulking)。
90.根据本发明的一些实施方案,非清髓性调理方案不包含t细胞减灭。
91.根据本发明的一些实施方案,t细胞减灭通过抗胸腺细胞球蛋白(atg)抗体、抗cd52抗体或抗cd3 (okt3)抗体中的至少一种来实现。
92.根据本发明的一些实施方案,方法进一步包括在移植后向受试者施用治疗有效量的环磷酰胺。
93.根据本发明的一些实施方案,进一步包括治疗有效量的环磷酰胺,其中所述环磷酰胺将在非同基因细胞或组织移植之后施用于受试者。
94.根据本发明的一些实施方案,治疗有效量的环磷酰胺包含25-200 mg环磷酰胺/千克受试者的理想体重。
95.根据本发明的一些实施方案,治疗有效量的环磷酰胺将在移植后3和4天以两个剂量施用于受试者。
96.根据本发明的一些实施方案,非清髓性移植前调理方案包含t细胞减灭。
97.根据本发明的一些实施方案,t细胞减灭通过抗胸腺细胞球蛋白(atg)来实现。
98.根据本发明的一些实施方案,非清髓性移植前调理方案不包含t细胞减灭。
99.根据本发明的一些实施方案,不施用皮质类固醇。
100.根据本发明的一些实施方案,受试者在移植之后不用gvhd预防进行长期治疗。
101.根据本发明的一些实施方案,受试者是人受试者。
102.除非另有定义,否则本文使用的所有技术和/或科学术语具有与本发明所属领域的普通技术人员通常理解相同的含义。尽管与本文描述的那些类似或等价的方法和材料,可以用于本发明的实施方案的实践或测试,但下文描述了示例性的方法和/或材料。在冲突的情况下,以专利说明书包括定义为准。另外,材料、方法和实施例仅是说明性的,并不预期必然是限制性的。
附图说明
103.参考附图,仅作为示例,在本文中描述了本发明的一些实施方案。现在详细地具体参考附图,要强调的是,所示出的细节是作为示例并且用于本发明的实施方案的说明性讨
论的目的。在这方面,结合附图进行的描述对于本领域技术人员而言可以如何实践本发明的实施方案是显而易见的。
104.在附图中:图1是概述了根据本发明的一些实施方案,抗病毒cd8
+
反抑细胞耗尽细胞的处理和测试的流程图。
105.图2是概述了根据本发明的一些实施方案,cd34
+
富集和cd3
+
cd19
+
耗尽细胞的处理和测试的流程图。
106.图3是具有根据本发明的一些实施方案使用的,新鲜的未成熟造血细胞移植的受体受试者的调理方案的示意性表示。
107.图4是具有根据本发明的一些实施方案使用的,冷冻保存的未成熟造血细胞移植的受体受试者的调理方案的示意性表示。
108.图5是在通过t细胞减灭(用atg)、氟达拉滨和3 gy tbi的非清髓性调理之后,将错配的大剂量t细胞耗尽的造血干细胞移植与移植后的高剂量cy组合的组合方案的示意图。
109.图6是说明在第7天时的反抑细胞输注使得能够在不存在受体的t细胞减灭的情况下克服移植物排斥的图。c3h受体小鼠在3.5 gy tbi之后,用大剂量t细胞耗尽的balb/nude (h2d) bm细胞进行移植。移植的小鼠还在移植后的第3-4天时接受移植后cy (100 mg/kg) (指定为nu/bn + ctx)、或在移植后的第7天时接受5 x 10
6 balb/c反抑tcm (h2d) (指定为nu/bn + tcm d-7)、或两者(指定为nu/bn + tcm d7 + ctx)。通过使用抗供体和抗宿主(h2d和h2k)抗体的facs,来分析外周血中的供体细胞百分比。每个点代表属于适当组的一只小鼠。
110.图7是不含atg的治疗方案的示意图,所述atg替换为在第7天时的反抑细胞施用。
111.图8a-c说明了如通过inf-γ和tnf-α的细胞内染色确定的tcm细胞的抗病毒活性。在布雷非德菌素a (ebioscience)的存在下,使反抑tcm细胞与分别的病毒肽混合物(ebv、cmv、adeno、bkv)一起在37℃ 5% co2下共培养6小时。将细胞固定、渗透化处理(invitrogen fix & perm set),并且对于cd45、cd3、cd8、ifnγ和tnfα (bd)进行免疫染色。阳性对照包括用pma/离子霉素的tcr不依赖性刺激。细胞关于cd45
+
/fsc淋巴细胞门和cd3
+
cd8
+
进行门控。
具体实施方式
112.本发明,在其一些实施方案中,涉及由记忆t细胞生成的反抑细胞,并且更具体地但非排他地,涉及其制造方法以及在用于达到稳定和长期的细胞或组织移植的疗法中的用途。
113.参考附图和所附说明书,可以更好地理解本发明的原理和操作。
114.在详细解释本发明的至少一个实施方案之前,应理解,本发明在其应用中并不一定限于下述描述中阐述的或由实施例例示的细节。本发明能够具有其它实施方案,或者能够以各种方式进行实践或执行。另外,应理解本文采用的短语和术语是用于描述的目的,并不应该被视为限制性的。
115.在将本发明付诸实践的同时,本发明人已发现用于生成大规模剂量的耐受性诱导细胞(例如反抑细胞)的改善方案,所述细胞还包含抗疾病活性(例如抗病毒活性),而不诱
导移植物抗宿主(gvh)反应。这些细胞通过以下生成:产生病毒呈递树突状细胞(借助于从pbmc中选择cd14+细胞,在成熟因子中培养并用病毒肽的特定组合装载),然后借助于用于病毒抗原激活的病毒肽的特定组合,从记忆cd8 t细胞中耗尽同种异体反应性克隆。本发明人已进一步发现,用这些促进移植物的反抑细胞(例如在hct后,如在hct后的第+7天时施用的)补充t细胞耗尽的大剂量同种异体造血细胞移植(allo-hct)可以耐受宿主的抗供体t细胞,在安全的非清髓性(nma)调理(例如包含tbi和化学治疗剂如氟达拉滨)之后,使在不存在gvhd的情况下的移植物植入成为可能,伴随包含环磷酰胺(例如在hct后的第+3和+4天时施用的)的最低限度的移植后免疫抑制疗法。
116.简言之,非动员的外周血单核细胞(pbmc)从细胞供体获得,并且使用ficoll进行分级以获得单核细胞(mnc)。将单核细胞分成两个级分,一个用于生成刺激细胞(即呈递病毒肽的抗原呈递细胞),而第二个用于生成抗病毒中央型记忆cd8
+
反抑细胞。相应地,通过使用结合cd14的单克隆抗体从mnc级分中选择cd14
+
表达细胞,从第一mnc级分生成刺激细胞,使cd14
+
表达细胞与包含il-4、gm-csf、ifn-γ和lps的树突状细胞成熟因子一起生长16小时。然后使成熟的树突状细胞(mdc)装载有包含ebv、cmv、bkv和腺病毒的病毒肽,并且进行照射(例如通过25 gy)。伴随地,通过使用与超顺磁性颗粒缀合的cd4
+
、cd56
+
和cd45ra
+
抗体对cd4-cd56-cd45ra-表达细胞的阴性选择,从第二mnc级分中富集记忆细胞。cd4-cd56-cd45ra-耗尽的细胞与装载病毒的树突状细胞(细胞/dc的比率为5:1)一起在t细胞生长培养基中共培养3天,所述t细胞生长培养基剥夺细胞因子,并且仅补充有il-21 (此类条件允许病毒反应性记忆cd8 t细胞的增殖和gvh反应性细胞的消除)。在3天后,使t细胞在il-21、il-15和il-7的存在下再培养9天(此类条件允许包含tcm表型的细胞增殖)。每2天更换细胞培养基,并且监测葡萄糖和ph水平,并且根据需要进行调整。所得到的细胞群体包含抗病毒中央型记忆cd8
+
反抑细胞,如通过免疫表型分型(例如通过cd3
+
cd8
+
cd62l
+
cd45ro
+
的表达)和功能性免疫研究(例如通过评价抗病毒活性,例如通过针对在培养开始时使用的原始病毒肽重新刺激tcm细胞,并且例如通过facs测量infγ
+
tnf
+
细胞的百分比)确定的。
117.抗病毒中央型记忆cd8
+
反抑细胞促进在非清髓性(nma)调理方案之后,同种异体cd34
+
富集的cd3
+
cd19
+
耗尽的造血细胞移植(即大剂量t细胞耗尽的同种异体造血干细胞(hsc)移植)的移植物植入。因此,例如,受体受试者可以在第-6至-3天时(或在第-7至-4天时)每天用氟达拉滨治疗,随后为在第-1天时(或在第-2天时)的低剂量tb (即分别在移植之前的第6至3天、第7至4天、第1天或第2天时),作为预处理方案i。在+3和+4天(即在移植后的第3至4天)时,患者接受环磷酰胺(cy),随后为在+7天(即在移植后的第+7天)时的反抑细胞输注。任选地,可以在移植之前的第-9至-7天时(或在第-10至-8天时)每天施用atg,以便诱导受体受试者中的t细胞减灭。
118.综上所述,抗病毒中央型记忆cd8
+
反抑细胞借助于其诱导针对供体细胞的免疫耐受的能力,提供了与供体造血祖细胞的移植物植入增强耦合的疾病治疗(例如免于病毒感染的保护或病毒感染的治疗)。此外,反抑细胞使大剂量t细胞耗尽的同种异体hsc移植成为可能,而无需在安全的非清髓性方案之后的延长的免疫抑制。此外,所提供的大规模方案使得能够生成以适用于人受试者治疗的剂量的抗病毒中央型记忆cd8
+
反抑细胞。
119.因此,根据本发明的一个方面,提供了生成包含中央型记忆t淋巴细胞(tcm)表型的非移植物抗宿主病(gvhd)诱导细胞的分离群体的方法,该细胞是耐受性诱导细胞和/或
被赋予抗疾病活性,并且能够在移植之后归巢到淋巴结,该方法包括:(a)使来自供体受试者的外周血单核细胞(pbmc)的第一群体与能够结合cd14
+
表达细胞的抗体接触,并且选择能够成熟为抗原呈递细胞的cd14
+
表达细胞;(b)用病毒肽装载抗原呈递细胞;(c)用能够耗尽cd4
+
、cd56
+
和cd45ra
+
表达细胞的一种或多种试剂处理与pbmc的第一群体属于同一供体受试者的pbmc的第二群体,以便获得包含表达cd45ra-cd8
+
表型的记忆t细胞的细胞群体;(d)在il-21的存在下,使包含记忆t细胞的细胞群体与步骤(b)的用病毒肽装载的抗原呈递细胞接触,以便允许病毒反应性记忆t细胞的富集;和(e)在il-21、il-15和/或il-7的存在下,培养起因于步骤(d)的细胞,以便允许包含tcm表型的细胞增殖,从而生成包含tcm表型的非gvhd诱导细胞的分离群体。
120.根据本发明的一个方面,提供了生成包含中央型记忆t淋巴细胞(tcm)表型的非移植物抗宿主病(gvhd)诱导细胞的分离群体的方法,该细胞是耐受性诱导细胞和/或被赋予抗疾病活性,并且能够在移植之后归巢到淋巴结,该方法包括:(a)提供包含t细胞的细胞群体,其中所述细胞群体中的t细胞包含至少40%的表达cd45ra-cd8
+
表型并且耗尽cd4
+
、cd56
+
和cd45ra
+
表达细胞的记忆t细胞;和(b)在il-21的存在下,使包含记忆t细胞的细胞群体与衍生自4-10种类型的病毒的病毒肽接触,以便允许病毒反应性记忆t细胞的富集,其中所述病毒中的至少一种包含bk病毒;和(c)在il-21、il-15和/或il-7的存在下,培养起因于步骤(b)的细胞,以便允许包含tcm表型的细胞增殖,从而生成包含tcm表型的非gvhd诱导细胞的分离群体。
121.术语“分离的”指已从其天然环境(例如,人体)中分离的细胞。
122.根据一个实施方案,细胞群体指异质细胞混合物。
123.如本文使用的,术语“非移植物抗宿主病”或“非gvhd”指具有基本上减少的或没有移植物抗宿主(gvh)诱导反应性。因此,本发明的一些实施方案的细胞被生成为并不显著地引起移植物抗宿主病(gvhd),如通过在移植之后30-120天内移植受试者的存活、重量和整体外观来证明的。就减少的gvhd评估受试者的方法是本领域的技术人员众所周知的。
124.根据一个实施方案,相对于未根据本文教导生成的细胞,本发明的一些实施方案的细胞具有针对宿主的反应性的至少10%、至少20%、至少30%、至少40%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或甚至100%减少。
125.如本文使用的,短语“中央型记忆t淋巴细胞(tcm)表型”指归巢到淋巴结的t细胞亚群。在人中,具有tcm表型的细胞通常包含cd3
+
/cd8
+
/cd62l
+
/cd45ro
+
/cd45ra-特征。应了解tcm细胞可以在单个细胞上表达所有的特征标记物,或者可以在单个细胞上仅表达特征标记物的部分。细胞表型的确定可以使用本领域技术人员已知的任何方法,例如通过荧光激活细胞分选(facs)或捕获elisa标记来进行。
126.根据一个实施方案,至少20%、至少25%、至少30%、至少35%、至少40%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%或甚至100%的非gvhd诱导细胞的分离群体具有tcm细胞特征。
127.根据一个具体实施方案,具有tcm表型的细胞构成非gvhd诱导细胞的分离群体的20%。
128.根据一个具体实施方案,具有tcm表型的细胞构成非gvhd诱导细胞的分离群体的30%。
129.根据一个具体实施方案,具有tcm表型的细胞构成非gvhd诱导细胞的分离群体的40%。
130.根据一个具体实施方案,具有tcm表型的细胞构成非gvhd诱导细胞的分离群体的50%。
131.根据一个具体实施方案,具有tcm表型的细胞构成非gvhd诱导细胞的分离群体的60%。
132.根据一个具体实施方案,具有tcm表型的细胞构成非gvhd诱导细胞的分离群体的70%。
133.根据一个具体实施方案,约10-20%、约10-30%、约10-40%、约10-50%、约20-30%、约20-40%、约30-50%、约40-60%、约50-70%、约60-80%、约70-90%、约80-100%、或约90-100%的非gvhd诱导细胞的分离群体具有tcm细胞特征。
134.根据一个具体实施方案,具有tcm表型的细胞构成非gvhd诱导细胞的分离群体的10-30%。
135.根据一个具体实施方案,具有tcm表型的细胞构成非gvhd诱导细胞的分离群体的10-50%。
136.根据一个具体实施方案,具有tcm表型的细胞构成非gvhd诱导细胞的分离群体的20-40%。
137.根据一个具体实施方案,具有tcm表型的细胞构成非gvhd诱导细胞的分离群体的30-50%。
138.根据一个具体实施方案,具有tcm表型的细胞构成非gvhd诱导细胞的分离群体的50-70%。
139.本发明的包含tcm表型的非gvhd诱导细胞在本文也被称为“tcm细胞”。
140.如所提到的,tcm细胞通常在移植之后归巢到淋巴结。根据一些实施方案,本发明的一些实施方案的分离的细胞群体可以在移植之后归巢到任一个淋巴结,如例如周围淋巴结和肠系膜淋巴结。这些细胞的归巢性质允许它们以快速和有效的方式发挥其反抑效应。
141.本发明的一些实施方案的包含tcm表型的非gvhd诱导细胞是耐受性诱导细胞。
142.如本文使用的,短语“耐受性诱导细胞”指与在所施用的耐受性诱导细胞的不存在下受体细胞的应答性相比,当受体的细胞(例如受体的t细胞)与供体细胞接触时,诱使受体细胞的应答性降低的细胞。耐受性诱导细胞包括反抑细胞(即在与宿主t细胞接触时导致其凋亡的t细胞),如先前在pct公开号wo 2001/049243和wo 2002/102971中描述的。
143.术语“反抑活性”涉及免疫细胞(例如供体衍生的t细胞),其在识别和结合反抑细胞后导致抗供体受体t细胞的失活。根据一个实施方案,失活导致抗供体受体t细胞的凋亡。
144.本发明的包含tcm表型的非gvhd诱导细胞在本文中也被称为“反抑细胞”。
145.另外或可替代地,本发明的一些实施方案的包含tcm表型的非gvhd诱导细胞的分离群体包含抗疾病活性。
146.术语“抗疾病活性”指tcm细胞针对患病细胞的功能。抗疾病活性可以是直接针对患病细胞的,例如杀死患病细胞的能力。这种活性可能是由于通过lfa1-i/cam1结合介导的tcr不依赖性杀死[arditti等人,blood (2005) 105 (8):3365-71. 电子版2004年7月6日]。另外或可替代地,抗疾病活性可能是间接的,例如通过激活其它类型的细胞(例如cd4
+ t细胞、b细胞、单核细胞、巨噬细胞、nk细胞),其导致患病细胞的死亡(例如通过杀死、凋亡,或者通过分泌其它因子如抗体、细胞因子等)。
[0147]
术语“抗病毒活性”指tcm细胞针对病毒感染的细胞的功能(例如,在细胞表面的mhc-肽复合物的背景下表达一种或多种病毒抗原)。通常,抗病毒活性导致病毒感染的细胞的杀死。
[0148]
术语“抗肿瘤活性”指tcm细胞针对肿瘤细胞的功能。通常,抗肿瘤活性导致肿瘤细胞的杀死。根据一个具体实施方案,抗肿瘤活性包含移植物抗白血病/淋巴瘤(gvl)活性。
[0149]
患病细胞可以包含例如病毒感染的细胞,细菌感染的细胞,癌细胞[如实体瘤的细胞或白血病/淋巴瘤细胞,在本文中也被称为tcm细胞的移植物抗白血病(gvl)活性],与自身免疫性疾病相关的细胞,与变应性应答相关的细胞,或者由于应激、辐射或年龄而改变的细胞。
[0150]
根据一些实施方案,取决于所需的应用(例如待治疗的疾病),本发明的一些实施方案的包含tcm表型的非gvhd诱导细胞可以是非遗传修饰的细胞或遗传修饰的细胞(例如已遗传改造为表达或不表达特定基因、标记物或肽,或者分泌或不分泌特定细胞因子的细胞)。此类确定完全在本领域普通技术人员的能力内。
[0151]
根据一个实施方案,tcm细胞表达嵌合抗原受体(car)或修饰的t细胞受体(tcr)。
[0152]
相应地,本发明的一些实施方案的tcm细胞可以被转导为表达tcr或car。
[0153]
如本文使用的,“用tcr转导”指两条链(即多肽链)的克隆,所述链例如t细胞受体(tcr)的α链、tcr的β链、tcr的γ链、tcr的δ链或其组合(例如αβ链或γδ链)。根据一个实施方案,tcr包含tcr的可变区(例如α和β链或γ和δ链)。用tcr转导细胞(例如t细胞) (例如以生成tcr-t细胞)的方法是本领域已知的,并且公开于例如nicholson等人adv hematol. 2012;2012:404081;wang和rivi
è
re cancer gene ther. 2015年3月;22 (2):85-94);以及lamers等人,cancer gene therapy (2002) 9,613
–
623中。
[0154]
如本文使用的,“用car转导”指编码嵌合抗原受体(car)的核酸序列的克隆,其中所述car包含抗原识别部分和t细胞激活部分。嵌合抗原受体(car)是人工构建的杂合蛋白或多肽,其含有与t细胞信号传导或t细胞激活结构域相连接的抗体的抗原结合结构域(例如单链可变片段(scfv))。用car转导细胞(例如t细胞) (例如以生成car-t)的方法是本领域已知的,并且公开于例如davila等人oncoimmunology. 2012年12月1日;1 (9):1577-1583;wang和rivi
è
re cancer gene ther. 2015年3月;22 (2):85-94);以及maus等人blood. 2014年4月24日;123 (17):2625-35中。
[0155]
根据一个实施方案,遗传修饰的tcm细胞表达转基因tcr (tcr-t)或car (car-t)。
[0156]
因此,本发明的一些实施方案的包含tcm表型的非gvhd诱导细胞的分离群体可以通过以下进行遗传修饰用于治疗(例如抗癌细胞治疗):借助于用t细胞受体(tcr)或嵌合抗原受体(car)转导,通过促进靶向疾病抗原(例如肿瘤抗原)的受体的呈递,重新引导细胞特异性(例如t细胞特异性)。例如,可以生成表达tcr或car的tcm细胞,以靶向恶性疾病例如滤
泡性淋巴瘤(cd20或gd2)、神经母细胞瘤(cd171)、非霍杰金淋巴瘤(cd20)、淋巴瘤(cd19)、胶质母细胞瘤(il13rα2)、慢性淋巴细胞性白血病或cll、以及急性淋巴细胞性白血病或all (均为cd19)。
[0157]
根据本发明的一些实施方案,提供了生成包含tcm表型的非gvhd诱导细胞的分离群体的方法。
[0158]
根据一个实施方案,方法包括使来自供体受试者的外周血单核细胞(pbmc)的第一群体与能够结合cd14
+
表达细胞的抗体接触,并且选择能够成熟为抗原呈递细胞的cd14
+
表达细胞。
[0159]
术语“供体受试者”指人类。
[0160]
根据一个实施方案,供体受试者相对于受试者(例如同种异体的)是非同基因的,如下文详细讨论的。
[0161]
术语“外周血单核细胞(pbmc)”指包含淋巴细胞(包括t细胞、b细胞、nk细胞等)和单核细胞的血液样品级分。
[0162]
根据一个实施方案,pbmc相对于受体受试者(例如同种异体的)是非同基因的,如下文详细讨论的。
[0163]
根据一个实施方案,用于生成包含tcm表型的非gvhd诱导细胞的pbmc是非动员的(即未接触抗原的) pbmc,即并非借助于使用药物来实现造血前体(例如干细胞)从骨髓移动到外周血循环内获得的细胞。
[0164]
根据一个实施方案,在造血细胞(hct)的计划移植日期(即第0天)之前5-15天(例如7-10天,例如7天,例如8天)收集pbmc,如下文详细讨论的。然而,应理解可以在计划移植日期之前的任何时间收集pbmc。此类pbmc可以按原样贮存,或可以如下文讨论的进行处理,然后贮存用于未来使用(例如冷冻保存)。
[0165]
根据一个实施方案,使用标准技术从供体受试者中收集pbmc。根据一个具体实施方案,使用白细胞去除术(即从供体受试者中基本上取出pbmc,将剩余的血液组分返回给供体受试者的过程)收集pbmc。
[0166]
根据一个实施方案,pbmc收集程序(例如白细胞去除术)得到例如0.01-1000 x 10
10
个单核细胞(mnc),例如0.1-100 x 10
10
,例如1 x 10
10
个mnc。
[0167]
根据一个实施方案,pbmc收集程序(例如白细胞去除术)得到最少500 x 106个单核细胞(mnc),例如500 x 10
10
至1000 x 10
10
个mnc,例如1 x 10
10
个mnc。
[0168]
根据一个实施方案,pbmc在单个收集程序中进行收集。
[0169]
根据一个实施方案,pbmc在二、三、四、五个或更多个收集程序中进行收集(例如为了获得所需数目的mnc)。
[0170]
根据一个实施方案,如果pbmc在两个或更多个收集程序中(例如从同一供体受试者中)进行收集,则pbmc可以合并在一起(例如用于进一步处理)或分开使用。
[0171]
根据一个实施方案,前述收集中的任何可以被称为批次。可替代地,任何一组收集(例如,经过几天例如1、2、3、4、5天,例如3天,在收集的背景下,来自同一供体受试者)可以被称为批次。
[0172]
根据一个实施方案,在进一步处理(例如,如下文讨论的mnc分离)之前,前述pbmc收集中的任一种可以在收集管中保持一天或更多天(例如1、2、3、4、5天,例如1-2天)。
hsa)中。根据一个实施方案,细胞培养基补充有细胞因子和生长因子。待使用的细胞因子和生长因子的确定在本领域技术人员的技术内。例如,细胞培养基补充有il-4 (例如200-2000 iu/ml,例如1000 iu/ml)和gm-csf (例如1000-4000 iu/ml,例如2000 iu/ml)。然后将细胞悬浮液接种(例如在细胞培养板中,例如cell factory板),并且在37 ℃、5% co2下温育12-36小时,例如16-24小时,例如24小时。
[0190]
根据一个实施方案,为了诱导cd14
+
表达细胞成熟为抗原呈递细胞(例如树突状细胞),cd14
+
富集的细胞制剂在成熟因子(例如树突状细胞成熟因子)的存在下进行培养。待使用的成熟因子的确定在本领域技术人员的技术内。因此,根据一个实施方案,接种的(例如在细胞培养板,例如cell factory板中) cd14
+
富集的细胞,在il-4 (例如200-2000 iu/ml,例如1000 iu/ml)、gm-csf (例如1000-4000 iu/ml,例如2000 iu/ml)、lps (例如10-100 ng/ml,例如40 ng/ml)和ifn-γ (例如50-500 iu/ml,例如200 iu/ml)的存在下,在37 ℃、5% co2下培养10-24小时,例如14-18小时,例如16小时。
[0191]
在培养期后,从细胞培养中获得抗原呈递细胞(例如成熟的树突状细胞,即mdc)。根据一个实施方案,去除非粘附细胞,并且使用本领域已知的任何方法(例如,通过添加冰冷的缓冲液,例如具有0.5%的25% has的acd-a和dpbs缓冲液,并且在冰或冷冻凝胶包上温育10-60分钟,例如30分钟),使抗原呈递细胞(即粘附细胞)脱离培养板。然后将收获的抗原呈递细胞离心,洗涤并重悬浮(例如在具有0.5%的25% has的acd-a和dpbs缓冲液中)。
[0192]
根据一个实施方案,抗原呈递细胞(例如mdc)装载有一种或多种抗原。
[0193]
如本文使用的,短语“装载”指一种或多种抗原(例如肽)附着到抗原呈递细胞(apc)的表面上的肽-mhc复合物中呈递的mhc肽(例如mhc i类或ii类)。
[0194]
如本文使用的,“一种或多种抗原”指能够诱导免疫应答的可溶性或不溶性(例如膜结合的)分子。
[0195]
例如,一种或多种抗原可以是整个细胞(例如活细胞或死细胞)、细胞级分(例如裂解的细胞)、细胞抗原(例如细胞表面抗原)、蛋白质提取物、纯化的蛋白质或合成肽。
[0196]
根据一个实施方案,一种或多种抗原包含病毒抗原。
[0197]
根据一个实施方案,病毒抗原衍生自至少1、2、3、4、5、6、7、8、9、10、15、20种或更多种不同类型的病毒。
[0198]
根据一个实施方案,病毒抗原衍生自1-50、1-40、1-30、1-25、1-20、1-15、1-10、1-9、1-8、1-7、1-6、1-5、1-4、1-3、1-2、2-50、2-40、2-30、2-20、2-10、2-8、2-6、2-4、3-50、3-40、3-30、3-20、3-10、3-9、3-7、3-5、3-4、4-50、4-40、4-30、4-20、4-10、4-8或4-6种类型的病毒。
[0199]
根据一个具体实施方案,病毒抗原衍生自1-20种类型的病毒。
[0200]
根据一个具体实施方案,病毒抗原衍生自1-10种类型的病毒。
[0201]
根据一个具体实施方案,病毒抗原衍生自1-4种类型的病毒。
[0202]
根据一个具体实施方案,病毒抗原衍生自2-10种类型的病毒。
[0203]
根据一个具体实施方案,病毒抗原衍生自2-4种类型的病毒。
[0204]
根据一个具体实施方案,病毒抗原衍生自4-20种类型的病毒。
[0205]
根据一个具体实施方案,病毒抗原衍生自4-10种类型的病毒。
[0206]
根据一个具体实施方案,病毒抗原衍生自4-8种类型的病毒。
[0207]
根据一个具体实施方案,病毒抗原衍生自4-6种类型的病毒。
[0208]
抗原可以衍生自(即源于)其的示例性病毒包括但不限于eb病毒(ebv),腺病毒(adv),巨细胞病毒(cmv),感冒病毒,流感病毒,甲型、乙型和丙型肝炎病毒,单纯疱疹,hiv,流感,日本脑炎,麻疹,脊髓灰质炎,狂犬病,呼吸道合胞,风疹,天花,水痘带状疱疹,轮状病毒,西尼罗病毒,多瘤病毒(例如bk病毒),寨卡病毒,细小病毒(例如细小病毒b19),水痘-带状疱疹病毒(vzv),单纯疱疹病毒(hsv),严重急性呼吸综合征(sars)和严重急性呼吸综合征冠状病毒2 (sars-cov-2)。
[0209]
病毒及其分别抗原的特定实例包括但不限于bk病毒抗原,包括但不限于bkv lt;bkv (衣壳vp1)、bkv (衣壳蛋白vp2)、bkv (衣壳蛋白vp2、同种型vp3)、bkv (小t抗原);腺病毒抗原包括但不限于adv五邻体或adv六邻体;cmv抗原包括但不限于包膜糖蛋白b、cmv ie-1和cmv pp65、ul28、ul32、ul36、ul40、ul48、ul55、ul84、ul94、ul99 ul103、ul151、ul153、us 29、us 32;ebv抗原包括但不限于ebv lmp2、ebv bzlf1、ebv ebna1、ebv p18和ebv p23;肝炎抗原包括但不限于乙型肝炎病毒的s、m和l蛋白,乙型肝炎病毒的前s抗原、hbcag delta、hbv hbe、丙型肝炎病毒rna、hcv ns3和hcv ns4;单纯疱疹病毒抗原包括但不限于立即早期蛋白和糖蛋白d;hiv抗原包括但不限于gag、pol和env基因的基因产物,例如hiv gp32、hiv gp41、hiv gp120、hiv gp160、hiv p17/24、hiv p24、hiv p55 gag、hiv p66 pol、hiv tat、hiv gp36、nef蛋白和逆转录酶;流感抗原包括但不限于血凝素和神经氨酸酶;日本脑炎病毒抗原包括但不限于蛋白e、m-e、m-e-ns1、ns1、ns1-ns2a和80% e;麻疹抗原包括但不限于麻疹病毒融合蛋白;狂犬病抗原包括但不限于狂犬病糖蛋白和狂犬病核蛋白;呼吸道合胞病毒抗原包括但不限于rsv融合蛋白和m2蛋白;轮状病毒抗原包括但不限于vp7sc;风疹抗原包括但不限于蛋白e1和e2;严重急性呼吸综合征(sars-cov)抗原包括但不限于s1、rbd、核衣壳和plpro;严重急性呼吸综合征冠状病毒2 (sars-cov-2)抗原包括但不限于s1、s2、s1+s2 ecd、rbd、n抗原、s抗原和核衣壳;并且水痘带状疱疹病毒抗原包括但不限于gpl和gpll。
[0210]
根据一个实施方案,一种或多种抗原包含病毒肽(或其片段)。
[0211]
根据一个实施方案,病毒肽包含1-50、1-40、1-30、1-25、1-20、1-15、1-10、1-9、1-8、1-7、1-6、1-5、1-4、1-3、1-2、2-50、2-40、2-30、2-20、2-10、2-8、2-6、2-4、3-50、3-40、3-30、3-20、3-10、3-9、3-7、3-5、3-4、4-50、4-40、4-30、4-20、4-10、4-8或4-6种病毒肽。
[0212]
根据一个具体实施方案,病毒肽包含4-50种病毒肽(例如在单个制剂或几个制剂中)。
[0213]
根据一个具体实施方案,病毒肽包含4-40种病毒肽(例如在单个制剂或几个制剂中)。
[0214]
根据一个具体实施方案,病毒肽包含4-30种病毒肽(例如在单个制剂或几个制剂中)。
[0215]
根据一个具体实施方案,病毒肽包含4-20种病毒肽(例如在单个制剂或几个制剂中)。
[0216]
根据一个具体实施方案,病毒肽包含4-10种病毒肽(例如在单个制剂或几个制剂中)。
[0217]
根据一个具体实施方案,病毒肽包含4-8种病毒肽(例如在单个制剂或几个制剂中)。
[0218]
根据一个具体实施方案,病毒肽包含4-6种病毒肽(例如在单个制剂或几个制剂中)。
[0219]
根据一个实施方案,病毒肽包含1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45或50种病毒肽(例如在单个制剂或几个制剂中)。
[0220]
根据一个具体实施方案,病毒肽包含4种病毒肽(例如在单个制剂或几个制剂中)。
[0221]
根据一个具体实施方案,病毒肽包含5种病毒肽(例如在单个制剂或几个制剂中)。
[0222]
根据一个具体实施方案,病毒肽包含6种病毒肽(例如在单个制剂或几个制剂中)。
[0223]
根据一个具体实施方案,病毒肽包含8种病毒肽(例如在单个制剂或几个制剂中)。
[0224]
根据一个具体实施方案,病毒肽包含10种病毒肽(例如在单个制剂或几个制剂中)。
[0225]
根据一个具体实施方案,病毒肽包含15种病毒肽(例如在单个制剂或几个制剂中)。
[0226]
根据一个具体实施方案,病毒肽包含20种病毒肽(例如在单个制剂或几个制剂中)。
[0227]
根据一个具体实施方案,病毒肽包含30种病毒肽(例如在单个制剂或几个制剂中)。
[0228]
根据一个具体实施方案,病毒肽包含40种病毒肽(例如在单个制剂或几个制剂中)。
[0229]
根据一个具体实施方案,病毒肽包含50种病毒肽(例如在单个制剂或几个制剂中)。
[0230]
根据一个具体实施方案,病毒肽包含来自单一生物(即来自一种病毒类型)的肽。
[0231]
根据一个具体实施方案,病毒肽包含来自两种或更多种生物的肽(即来自2、3、4、5或更多种病毒类型的混合物)。
[0232]
根据一个实施方案,病毒肽包含bk病毒肽。
[0233]
根据一个具体实施方案,病毒肽包含eb病毒(ebv)肽、巨细胞病毒(cmv)肽、bk病毒肽和腺病毒(adv)肽中的至少一种。
[0234]
根据一个具体实施方案,病毒肽包含eb病毒(ebv)肽、巨细胞病毒(cmv)肽、bk病毒肽和腺病毒(adv)肽。
[0235]
根据一个具体实施方案,病毒肽包含ebv-lmp2、ebv-bzlf1、ebv-ebna1、ebv-braf1、ebv-bmlf1、ebv-gp340/350 ebna2、ebv-ebna3a、ebv-ebna3b、ebv-ebna3c、cmv-pp65、cmv-ie-1、adv五邻体、adv六邻体、bkv lt、bkv (衣壳 vp1)、bkv (衣壳蛋白 vp2)、bkv (衣壳蛋白 vp2、同种型vp3)和bkv (小 t 抗原)中的至少一种。
[0236]
根据一个具体实施方案,病毒肽包含adv5六邻体、hcmv pp65、ebv选择(下文讨论的)和bkv lt中的至少一种。
[0237]
专用软件可以用于分析抗原序列,以鉴定免疫原性短肽,即在主要组织相容性复合体(mhc) i类或mhc ii类的背景下可呈递的肽。
[0238]
根据一个具体实施方案,一种或多种抗原包括pepmix的混合物,所述pepmix是跨越三种病毒的整个蛋白质序列的重叠肽文库(例如通过11个氨基酸重叠的15聚体):cmv、ebv和adeno (此类pepmix可以在商业上例如从jpt technologies,berlin,德国购买)。
[0239]
根据一个具体实施方案,病毒肽包含“ebv选择”,即来自miltenyi biotec的商业产品,其包含来自ebv的13种不同蛋白质的43种mhc 1类和2类限制性肽(例如macs gmp peptivator
®ꢀ
ebv select,例如目录号170-076-143)。另外或可替代地,病毒肽包含“集合ebv”,即来自jpt的包含pepmix的商业产品,所述pepmix包括来自14种不同ebv抗原的肽。另外或可替代地,病毒肽包含从jpt商购可得的pepmix
™ꢀ
bkv (衣壳蛋白vp1)、pepmix
™ꢀ
bkv (衣壳蛋白vp2)、pepmix
™ꢀ
bkv (衣壳蛋白vp2、同种型vp3)、pepmix
™ꢀ
bkv (大t抗原)、pepmix
™ꢀ
bkv (小t抗原)。
[0240]
根据另一个具体实施方案,一种或多种抗原包含跨越ebv-lmp2、ebv-bzlf1、ebv-ebna1、cmv-pp65、cmv-ie-1、adv五邻体和adv六邻体的七种pepmix的混合物,其浓度例如为100 ng/肽或700 ng/七种肽的混合物。
[0241]
根据一个实施方案,一种或多种抗原包含感染性生物(例如细菌、真菌生物)的一种或多种抗原,所述感染性生物通常影响免疫受损的受试者,如移植患者。
[0242]
根据一个实施方案,抗原是细菌抗原,例如但不限于炭疽;革兰氏阴性杆菌、衣原体、白喉、流感嗜血杆菌(haemophilus influenza)、幽门螺杆菌(helicobacter pylori)、疟疾、结核分枝杆菌(mycobacterium tuberculosis)、百日咳毒素、肺炎球菌、立克次氏体、葡萄球菌、链球菌和破伤风的抗原。
[0243]
作为细菌抗原的进一步特定实例,炭疽抗原包括但不限于炭疽保护性抗原;革兰氏阴性杆菌抗原包括但不限于脂多糖;流感嗜血杆菌抗原包括但不限于荚膜多糖;白喉抗原包括但不限于白喉毒素;结核分枝杆菌抗原包括但不限于霉菌酸、热休克蛋白65 (hsp65)、30 kda的主要分泌性蛋白和抗原85a;百日咳毒素抗原包括但不限于血凝素、百日咳杆菌粘附素、fim2、fim3和腺苷酸环化酶;肺炎球菌抗原包括但不限于肺炎球菌溶血素和肺炎球菌荚膜多糖;立克次氏体抗原包括但不限于rompa;链球菌抗原包括但不限于m蛋白;并且破伤风抗原包括但不限于破伤风毒素。
[0244]
根据一个实施方案,抗原是超级细菌抗原(例如多药抗性细菌)。超级细菌的实例包括但不限于:屎肠球菌(enterococcus faecium)、艰难梭菌(clostridium difficile)、鲍曼不动杆菌(acinetobacter baumannii)、铜绿假单胞菌(pseudomonas aeruginosa)和肠杆菌科(enterobacteriaceae) (包括大肠杆菌、肺炎克雷伯氏菌(klebsiella pneumoniae)、肠杆菌属(enterobacter)物种)。
[0245]
根据一个实施方案,抗原是真菌抗原。真菌的实例包括但不限于:念珠菌、球孢子菌(coccidiodes)、隐球菌、组织胞浆菌、利什曼原虫、疟原虫、原生动物、寄生虫、血吸虫、癣、弓形虫和克氏锥虫(trypanosoma cruzi )。
[0246]
作为真菌抗原的进一步特定实例,球孢子菌抗原包括但不限于小球(spherule)抗原;隐球菌抗原包括但不限于荚膜多糖;组织胞浆菌抗原包括但不限于热休克蛋白60 (hsp60);利什曼原虫抗原包括但不限于gp63和脂磷聚糖;恶性疟原虫(plasmodium falciparum)抗原包括但不限于裂殖子表面抗原、子孢子表面抗原、环子孢子抗原、配子母细胞/配子表面抗原,原生动物和其它寄生虫抗原包括血液阶段抗原pf 155/resa;血吸虫抗原包括但不限于谷胱甘肽-s-转移酶和副肌球蛋白;癣真菌抗原包括但不限于发癣菌素;弓形虫抗原包括但不限于sag-1和p30;并且克氏锥虫抗原包括但不限于75-77 kda抗原和56 kda抗原。
[0247]
根据一个实施方案,一种或多种抗原包含与恶性疾病相关的抗原(例如肿瘤抗原)。
[0248]
根据一个实施方案,抗原是由肿瘤细胞表达的抗原(或其部分,例如抗原表位)。根据一个实施方案,抗原(或其部分)衍生自在造血组织中表达的蛋白质(例如造血系统恶性肿瘤,例如白血病抗原)或在实体瘤(例如黑色素瘤、胰腺癌、肝癌、胃肠癌等)中表达的蛋白质。
[0249]
肿瘤抗原的实例包括但不限于:a33、bage、bcl-2、b细胞成熟抗原(bcma)、bcr-abl、β-连环蛋白、睾丸癌抗原(cta例如mage-1、mage-a2/a3和ny-eso-1)、ca l25、ca 19-9、ca 50、ca 27.29 (br 27.29)、ca 15-3、cd5、cd19、cd20、cd21、cd22、cd33、cd37、cd45、cd123、cea、c-met、cs-1、细胞周期蛋白b1、dage、ebna、egfr、ela2、ephrinb2、雌激素受体、fap、铁蛋白、叶酸盐结合蛋白、gage、g250/ca ix、gd-2、gm2、gp75、gp100 (pmel 17)、ha-1、ha-2、her-2/neu、hm1.24、hpv e6、hpv e7、htert、ki-67、lrp、间皮素、粘蛋白样癌相关抗原(mca)、muc1、p53、pr1、prame、prtn3、rhamm (cd168)、wt-1。进一步的肿瘤抗原在以下中提供:molldrem j. biology of blood and marrow transplantation (2006) 12:13-18;alatrash g.和molldrem j.,expert rev hematol. (2011) 4 (1): 37
–
50;renkvist等人,cancer lmmunol lmmunother (2001) 50:3-15;van der bruggen p,stroobant v,vigneron n,van den eynde b. peptide database: t cell-defined tumor antigens. cancer immun (2013),www(dot)cancerimmunity (dot)org/peptide/;rittenhouse、manderino和hass,laboratory medicine (1985) 16(9) 556-560;所有这些参考文献都通过引用引入本文。
[0250]
根据一个实施方案,一种或多种抗原包含抗原的混合物(例如,如所讨论的一组抗原的抗原混合物,例如病毒抗原;或来自不同组抗原的抗原混合物,例如病毒抗原和细菌抗原、病毒抗原和肿瘤抗原)。
[0251]
根据一个实施方案,一种或多种抗原包含病毒肽和肿瘤肽的混合物(例如在单个制剂或几个制剂中)。
[0252]
根据一个实施方案,一种或多种抗原包含病毒肽和细菌肽的混合物(例如在单个制剂或几个制剂中)。
[0253]
根据一个实施方案,一种或多种抗原包含病毒肽和真菌肽的混合物(例如在单个制剂或几个制剂中)。
[0254]
根据一个实施方案,用一种或多种抗原装载抗原呈递细胞(例如mdc)可以使用本领域中已知的任何方法进行。
[0255]
根据一个实施方案,为了在抗原呈递细胞(例如mdc)上装载(例如呈递)病毒肽,使病毒肽与抗原呈递细胞(例如mdc)一起在37℃、5% co2下共培养30分钟至3小时(例如1小时)。例如,通过在37℃、5% co2下温育30分钟至3小时(例如1小时),抗原呈递细胞(例如mdc)可以装载有peptivator (例如adv5六邻体、hcmv pp65、ebv选择和bkv lt)。
[0256]
在温育之后,将装载病毒肽的抗原呈递细胞(例如mdc)洗涤,并且用例如具有0.5%的25% has的acd-a和dpbs缓冲液进行离心,并且重悬浮于细胞生长培养基(例如t细胞生长培养基)中。
[0257]
根据一个实施方案,装载一种或多种抗原(例如病毒肽)的抗原呈递细胞(例如
mdc)经由x线源进行照射。因此,根据一个实施方案,用约1-5 gy、约5-10 gy、约10-20 gy、约10-30 gy、约10-40 gy、约10-50 gy、约20-30 gy、约20-40 gy、约20-50 gy照射装载的抗原呈递细胞(例如mdc)。根据一个具体实施方案,用约10-40 gy (例如25-30 gy,例如30 gy)照射dc。
[0258]
一旦照射完成,就将装载的抗原呈递细胞(例如装载病毒肽的mdc)洗涤、离心并重悬浮于细胞生长培养基(例如t细胞生长培养基)中。
[0259]
然后,装载抗原的抗原呈递细胞(例如mdc)准备用于从根据本发明的一些实施方案的包含记忆cd8 t细胞的细胞群体生成tcm细胞。
[0260]
根据一个具体实施方案,抗原呈递细胞包含树突状细胞(dc)。
[0261]
根据一个具体实施方案,抗原呈递细胞包含成熟的树突状细胞(mdc)。
[0262]
根据一个具体实施方案,至少50%、60%、70%、80%、90%、95%、99%或100%的抗原呈递细胞包含成熟的树突状细胞(mdc)。
[0263]
根据一个具体实施方案,抗原呈递细胞包含照射的树突状细胞。
[0264]
根据一个实施方案,抗原呈递细胞与细胞群体(如下文讨论的)属于同一供体受试者。
[0265]
应了解抗原呈递细胞可以在单个细胞上表达所有的抗原,或者可以在单个细胞上仅表达抗原的部分。此外,不同的抗原呈递细胞(例如在同一制剂中)可以表达不同的抗原。相应地,抗原呈递细胞(例如mdc)包含异质的细胞混合物。
[0266]
根据本发明的一些实施方案,一种或多种抗原(例如病毒肽)可以由遗传修饰的抗原呈递细胞或人工抗原呈递细胞呈递,所述抗原呈递细胞显示出可由记忆cd8 t细胞(例如用一种或多种抗原转染的细胞系)识别的mhc抗原(也称为人白细胞抗原(hla))。另外或可替代地,本发明的一些实施方案的一种或多种抗原(例如病毒肽)可以在人工媒介物(例如脂质体)上展示。
[0267]
因此,抗原呈递细胞(如上文讨论的)、细胞系、人工媒介物(例如脂质体)或人工抗原呈递细胞(例如用一种或多种抗原转染的白血病或成纤维细胞系),可以用于呈递与其融合或装载至其的短合成肽,或者呈递蛋白质提取物或纯化的蛋白质。此类短肽、蛋白质提取物或纯化的蛋白质可以是病毒、细菌、真菌或肿瘤抗原衍生的肽,或者代表任何其它抗原的肽。
[0268]
如上文提到的,本发明的一些实施方案的方法通过提供包含t细胞的细胞群体来实现,其中所述细胞群体中的t细胞包含至少40%的表达cd45ra-cd8
+
表型并且耗尽cd4
+
、cd56
+
和cd45ra
+
表达细胞的记忆t细胞。
[0269]
术语“包含t细胞的细胞群体”指包含t细胞、b细胞和髓样细胞的pbmc的异质混合物。包含t细胞的细胞群体通常包含具有众多特征、功能且能够结合各种抗原的t细胞(例如细胞毒性t细胞、记忆t细胞、效应t细胞等)。
[0270]
根据一个实施方案,包含t细胞的细胞群体不包含红细胞和粒细胞。
[0271]
如本文使用的,术语“记忆t细胞”指先前已遇到抗原并作出应答的t淋巴细胞亚群,也被称为经历抗原的t细胞。
[0272]
根据一个实施方案,记忆t细胞构成细胞群体中至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约95%、至少约99%或甚
至100%的t细胞。
[0273]
应了解在正常条件下(即如在健康受试者中确定的),记忆t细胞的水平构成包含t细胞的细胞群体中小于20%的细胞总数目。
[0274]
根据一个实施方案,记忆t细胞包含表达cd8标记物的t细胞(即cd8
+ t细胞)。
[0275]
根据另一个实施方案,记忆t细胞包含cd8
+
cd45ro
+
表型。
[0276]
根据另一个实施方案,记忆t细胞包含cd8
+
cd45ra-表型。
[0277]
根据另一个实施方案,记忆t细胞包含cd8
+
cd45ro
+
cd45ra-表型。
[0278]
根据一个实施方案,记忆t细胞缺乏cd45ra
+
细胞。
[0279]
根据一个实施方案,记忆t细胞缺乏cd4
+
和/或cd56
+
细胞。
[0280]
记忆cd8
+ t细胞的选择可以通过选择共表达cd8
+
和cd45ra-的细胞和/或共表达cd8
+
和cd45ro
+
的细胞来实现,并且可以使用本领域已知的任何方法,例如通过基于亲和力的纯化(例如,如通过使用macs珠、facs分选器和/或捕获elisa标记)来进行。
[0281]
记忆cd8
+ t细胞的选择可以进一步通过选择效应t细胞和中央型记忆t细胞来实现,后者表达例如cd62l、ccr7、cd27和/或cd28。
[0282]
为了获得其中t细胞群体包含高纯度的记忆t细胞(例如至少约30-50%的记忆t细胞,例如40%的记忆t细胞)的细胞群体、或为了增加记忆t细胞的数目,可以使pbmc耗尽幼稚细胞例如cd45ra
+
细胞、cd4
+
细胞(例如t辅助细胞)、cd56
+
细胞(例如nk细胞)或不包含记忆t细胞表型的任何其它细胞。
[0283]
幼稚t细胞(例如表达cd45ra
+
的细胞)、cd4
+
和/或cd56+细胞的耗尽可以使用本领域已知的任何方法,例如通过基于亲和力的纯化(例如,如通过使用macs珠、facs分选器和/或捕获elisa标记)来进行。
[0284]
根据一个实施方案,记忆t细胞从外周血单核细胞(pbmc)获得。
[0285]
根据一个实施方案,记忆t细胞通过包括以下的方法获得:用能够耗尽cd4
+
、cd56
+
和cd45ra
+
表达细胞的一种或多种试剂处理与pbmc的第一群体属于同一供体受试者的pbmc的第二群体,以便获得包括表达cd45ra-cd8
+
表型的至少40%记忆t细胞的细胞群体。
[0286]
根据一个实施方案,细胞群体进一步包含b细胞和髓样细胞。
[0287]
根据一个实施方案,在记忆t细胞富集之前,将从细胞的第一群体中收集的cd14-细胞与细胞的第二群体组合。
[0288]
根据一个实施方案,在记忆t细胞富集之前,将从细胞的第一群体中获得的cd14-细胞和/或从细胞的第二群体中获得的pbmc离心,并且以例如10-50 x 106个细胞/ml,例如30 x 106个细胞/ml的浓度重悬浮于细胞生长培养基,例如连同il-7 (30 iu/ml)一起的t细胞生长培养基(例如具有补充有1:100 glutamaxe和5%人ab血清的高级rpmi 1640的click培养基)中。根据一个实施方案,细胞生长培养基补充有il-7 (例如,以例如1-100 iu/ml,例如30 iu/ml的浓度)。然后将细胞悬浮液接种(例如在组织培养瓶中),并且在37 ℃、5% co2下温育12-36小时,例如16-24小时,例如24小时。
[0289]
根据一个实施方案,将pbmc的第二群体离心并且重悬浮于缓冲液(例如clinimacs
®
/0.5% hsa缓冲液)中至最小1:2的比率。
[0290]
根据一个实施方案,对pbmc的第二群体进行血小板洗涤(例如thrombowash),离心并且重悬浮于缓冲液(例如clinimacs
®
/0.5% hsa缓冲液)中。
[0291]
根据一个实施方案,使一个实施方案的血小板耗尽后的细胞制剂与ivig一起温育5-30分钟,例如10-15分钟。在初始温育后,将cd4
+
、cd56
+
和cd45ra
+
结合剂加入细胞制剂中,并且在轨道旋转器上温育例如10-60分钟,例如30分钟。
[0292]
根据一个实施方案,cd4
+
、cd56
+
和/或cd45ra
+
结合剂是抗体。
[0293]
根据一个具体实施方案,cd4
+
、cd56
+
和/或cd45ra
+
结合剂是单克隆抗体。
[0294]
根据一个具体实施方案,cd4
+
、cd56
+
和/或cd45ra
+
单克隆抗体与磁性颗粒缀合。
[0295]
根据一个具体实施方案,cd4
+
、cd56
+
和/或cd45ra
+
单克隆抗体与超顺磁性颗粒缀合。
[0296]
根据一个实施方案,在温育结束后,通过离心洗涤细胞,并且将细胞沉淀重悬浮于缓冲液(例如clinimacs
®
/0.5% hsa缓冲液)中,以去除过量试剂。
[0297]
根据一个实施方案,cd4
+
/cd56
+
/cd45ra
+
标记的细胞通过磁分离技术 (如下文详细讨论的)进行选择。
[0298]
根据一个具体实施方案,cd4
+
/cd56
+
/cd45ra
+
标记的细胞在clinimacs
®
柱上进行处理。
[0299]
根据一个实施方案,cd4
+
/cd56
+
/cd45ra
+
磁性标记的细胞(即cd4
+
/cd56
+
/cd45ra
+
表达细胞)由分离柱保留(即阴性选择),并且收集cd4-/cd56-/cd45ra-细胞。根据一个实施方案,将收集的细胞洗涤并且重悬浮于t细胞生长培养基中。根据一个实施方案,取出来自每个级分的样品用于细胞计数、生存力和/或免疫表型分型。
[0300]
根据一个实施方案,收集的cd4-/cd56-/cd45ra-细胞级分在补充有细胞因子和生长因子的t细胞生长培养基中调整为0.01-10 x 106个细胞/ml,例如2 x 106个细胞/ml。待使用的细胞因子和生长因子的确定在本领域技术人员的技术内。例如,t细胞生长培养基补充有il-7 (例如以例如1-100 iu/ml,例如30 iu/ml的浓度)。然后将细胞悬浮液接种(例如在g-rex
®
100中),并且在37 ℃、5% co2下温育12-36小时,例如16-24小时,例如24小时。
[0301]
为了借助于抗原(例如病毒抗原)激活从记忆t细胞池中耗尽同种异体反应性克隆,使记忆t细胞与抗原肽例如病毒肽接触。
[0302]
通常,本发明的包含tcm表型的非gvhd诱导细胞通过以下生成:在补充有il-21的培养物中(例如在无其它细胞因子的培养物中,即不添加任何另外的细胞因子),使包含记忆t细胞的细胞群体与装载有抗原肽例如病毒肽(例如上文所述的)的抗原呈递细胞接触。该步骤通常进行约12-24小时、约12-36小时、约12-72小时、12-96小时、12-120小时、约24-36小时、约24-48小时、约24-72小时、约36-48小时、约36-72小时、约48-72小时、约48-96小时、约48-120小时、0.5-1天、0.5-2天、0.5-3天、0.5-5天、1-2天、1-3天、1-5天、1-7天、1-10天、2-3天、2-4天、2-5天、2-6天、2-8天、3-4天、3-5天、3-7天、4-5天、4-8天、5-7天、6-8天或8-10天,并且允许抗原(例如病毒抗原)反应性细胞的富集。
[0303]
根据一个具体实施方案,在补充有il-21的培养物(无其它细胞因子的培养物)中,使耗尽cd4+、cd56+和cd45ra+细胞并且包含记忆cd8
+ t细胞的pbmc群体(例如包含t细胞的细胞群体,其中所述细胞群体中的t细胞包含至少40%的记忆t细胞)与一种或多种抗原(例如上文所述的)接触进行12小时-6天(例如3天)。
[0304]
在补充有il-21的培养物中,使包含记忆cd8
+ t细胞的细胞群体与一种或多种抗原(例如上文所述的)接触通常在以下的存在下进行:0.001-3000 iu/ml、0.01-3000 iu/
ml、0.1-3000 iu/ml、1-3000 iu/ml、10-3000 iu/ml、100-3000 iu/ml、1000-3000 iu/ml、0.001-1000 iu/ml、0.01-1000 iu/ml、0.1-1000 iu/ml、1-1000 iu/ml、10-1000 iu/ml、100-1000 iu/ml、250-1000 iu/ml、500-1000 iu/ml、750-1000 iu/ml、10-500 iu/ml、50-500 iu/ml、100-500 iu/ml、250-500 iu/ml、100-250 iu/ml、0.1-100 iu/ml、1-100 iu/ml、10-100 iu/ml、30-100 iu/ml、50-100 iu/ml、1-50 iu/ml、10-50 iu/ml、20-50 iu/ml、30-50 iu/ml、1-30 iu/ml、10-30 iu/ml、20-30 iu/ml、10-20 iu/ml、0.1-10 iu/ml、或 1-10 iu/ml il-21。根据一个具体实施方案,il-21的浓度为50-500 iu/ml (例如100 iu/ml)。
[0305]
根据一个具体实施方案,使包含记忆cd8
+ t细胞的细胞群体与一种或多种抗原接触在无细胞因子的培养物(例如仅补充有il-21)中实现,此类培养条件使得仅经历通过一种或多种抗原的刺激和激活的那些细胞(即抗原反应性细胞,例如病毒反应性记忆t细胞)能够存活和富集,因为这些细胞分泌使得其能够存活(所有剩余的细胞在这些培养条件下死亡)的细胞因子(例如il-2)。
[0306]
根据一个实施方案,包含记忆cd8
+ t细胞(即cd4-cd56-cd45ra-细胞)的细胞群体/装载抗原(例如病毒)肽的抗原呈递细胞(例如mdc)的比率通常为约2:1至约10:1,例如约2:1、约3:1、约4:1、约5:1、约6:1、约8:1或约10:1。根据一个具体实施方案,包含记忆cd8
+ t细胞(即cd4-cd56-cd45ra-细胞)的细胞群体/装载抗原(例如病毒)肽的抗原呈递细胞(例如mdc)的比率为约2:1至8:1,例如约5:1。
[0307]
根据一个具体实施方案,包含记忆cd8
+ t细胞(即cd4-cd56-cd45ra-细胞)的细胞群体,以0.01-10 x 106个细胞/ml例如1 x 106个细胞/ml的浓度,连同装载病毒肽的抗原呈递细胞(例如mdc)一起,以约2:1至约8:1例如约5:1 (记忆cd8
+ t细胞:抗原呈递细胞(例如mdc))的比率,在连同il-21 (例如以50-500 iu/ml,例如100 iu/ml的浓度)一起的t细胞生长培养基中,在37 ℃、5% co2下接种(例如在g-rex
®
100中) 1-5天(例如3天)。
[0308]
接下来,在il-21、il-15和/或il-7的存在下,培养所得的包含记忆cd8
+ t细胞的细胞群体(即,在用il-21培养后),以便允许包含tcm表型的细胞增殖。该步骤通常进行约12-24小时、约12-36小时、约12-72小时、约12-96小时、约12-120小时、约12-240小时、24-36小时、24-48小时、约24-72小时、24-96小时、24-120小时、24-240小时、约48-72小时、约48-120小时、约48-240小时、约96-240小时、约120-144小时、约120-240小时、约144-240小时、0.5-1天、0.5-2天、0.5-3天、0.5-5天、0.5-10天、1-2天、1-3天、1-4天、1-6天、1-8天、1-9天、1-10天、2-3天、2-4天、2-5天、2-6天、2-8天、2-9天、2-10天、4-5天、4-6天、4-8天、4-9天、4-10天、5-6天、5-7天、5-8天、5-9天、5-10天、5-15天、6-7天、6-8天、6-9天、6-10天、6-12天、7-8天、7-9天、7-11天、7-13天、7-15天、8-9天、8-10天、9-10天、9-12天、9-15天、10-12天、10-15天、12-15天、14-16天、14-18天、16-18天或18-20天。根据一个具体实施方案,在il-21、il-15和il-7的存在下,将所得的包含记忆cd8
+ t细胞的细胞群体(即,在用il-21培养后)培养约6-12天(例如9天)。
[0309]
该步骤通常在il-21的存在下进行,其浓度为约0.001-3000 iu/ml、0.01-3000 iu/ml、0.1-3000 iu/ml、1-3000 iu/ml、10-3000 iu/ml、100-3000 iu/ml、1000-3000 iu/ml、0.001-1000 iu/ml、0.01-1000 iu/ml、0.1-1000 iu/ml、1-1000 iu/ml、10-1000 iu/ml、100-1000 iu/ml、250-1000 iu/ml、500-1000 iu/ml、750-1000 iu/ml、10-500 iu/ml、
50-500 iu/ml、100-500 iu/ml、250-500 iu/ml、100-250 iu/ml、0.1-100 iu/ml、1-100 iu/ml、10-100 iu/ml、30-100 iu/ml、50-100 iu/ml、1-50 iu/ml、10-50 iu/ml、20-50 iu/ml、30-50 iu/ml、1-30 iu/ml、10-30 iu/ml、20-30 iu/ml、10-20 iu/ml、0.1-10 iu/ml、或 1-10 iu/ml il-21。根据一个具体实施方案,il-21的浓度为50-500 iu/ml (例如100 iu/ml)。
[0310]
该步骤在il-15的存在下进一步进行,其浓度为约0.001-3000 iu/ml、0.01-3000 iu/ml、0.1-3000 iu/ml、1-3000 iu/ml、10-3000 iu/ml、100-3000 iu/ml、125-3000 iu/ml、1000-3000 iu/ml、0.001-1000 iu/ml、0.01-1000 iu/ml、0.1-1000 iu/ml、1-1000 iu/ml、10-1000 iu/ml、100-1000 iu/ml、125-1000 iu/ml、250-1000 iu/ml、500-1000 iu/ml、750-1000 iu/ml、10-500 iu/ml、50-500 iu/ml、100-500 iu/ml、125-500 iu/ml、250-500 iu/ml、250-500 iu/ml、125-250 iu/ml、100-250 iu/ml、0.1-100 iu/ml、1-100 iu/ml、10-100 iu/ml、30-100 iu/ml、50-100 iu/ml、1-50 iu/ml、10-50 iu/ml、20-50 iu/ml、30-50 iu/ml、1-30 iu/ml、10-30 iu/ml、20-30 iu/ml、10-20 iu/ml、0.1-10 iu/ml、或 1-10 iu/ml il-15。根据一个具体实施方案,il-15的浓度为50-500 iu/ml (例如125 iu/ml)。
[0311]
该步骤在il-7的存在下进一步进行,其浓度为约0.001-3000 iu/ml、0.01-3000 iu/ml、0.1-3000 iu/ml、1-3000 iu/ml、10-3000 iu/ml、30-3000 iu/ml、100-3000 iu/ml、1000-3000 iu/ml、0.001-1000 iu/ml、0.01-1000 iu/ml、0.1-1000 iu/ml、1-1000 iu/ml、10-1000 iu/ml、30-1000 iu/ml、100-1000 iu/ml、250-1000 iu/ml、500-1000 iu/ml、750-1000 iu/ml、10-500 iu/ml、30-500 iu/ml、50-500 iu/ml、100-500 iu/ml、250-500 iu/ml、100-250 iu/ml、0.1-100 iu/ml、1-100 iu/ml、10-100 iu/ml、30-100 iu/ml、50-100 iu/ml、1-50 iu/ml、10-50 iu/ml、20-50 iu/ml、30-50 iu/ml、1-30 iu/ml、10-30 iu/ml、20-30 iu/ml、10-20 iu/ml、0.1-10 iu/ml、或 1-10 iu/ml il-7。根据一个具体实施方案,il-7的浓度为1-100 iu/ml (30 iu/ml)。
[0312]
根据一个具体实施方案,包含所得的包含记忆cd8
+ t细胞的细胞群体(即,在用il-21培养后)的细胞培养物补充有以50%培养体积的il-7 (例如,以例如1-100 iu/ml,例如30 iu/ml的浓度)、il-15 (例如,以例如50-500 iu/ml,例如125 iu/ml的浓度)和il-21 (例如,以例如50-500 iu/ml,例如100 iu/ml的浓度),并且培养约6-12天(例如9天),同时每约48-96小时,例如48小时,例如72小时补充il-7、il-15、il-21。
[0313]
根据一个实施方案,用于生成tcm细胞的培养时间的总长度为约9、10、11、12、13、14、15、17、19或21天(例如12天)。
[0314]
根据一个实施方案,包含所得的包含记忆cd8
+ t细胞的细胞群体(即,在用il-21培养后)的细胞培养物就葡萄糖水平进行监测。
[0315]
根据一个实施方案,葡萄糖为包含10-500 mg/dl,例如50-170 mg/dl的水平。
[0316]
根据一个实施方案,当葡萄糖水平在170 mg/dl和130 mg/dl之间时,将细胞因子il-7、il-15、il-21加入培养物中(如上文详述的)。
[0317]
根据一个实施方案,当葡萄糖水平在129 mg/dl至100 mg/dl之间时,将新鲜的t细胞生长培养基例如25%体积,例如100 ml (例如400 ml的25%的g-rex
®
100体积)加上细胞因子il-7、il-15、il-21加入培养物中。
[0318]
根据一个实施方案,当葡萄糖水平在99 mg/dl至50 mg/dl之间时,将新鲜的t细胞
生长培养基例如50%体积,例如200 ml (例如400 ml的50%的g-rex
®
100体积)加上细胞因子il-7、il-15、il-21加入培养物中。
[0319]
根据一个实施方案,培养进一步包括将葡萄糖加入到至少约20 mg/dl、至少约30 mg/dl、至少约40 mg/dl、至少约50 mg/dl、至少约60 mg/dl、至少约70 mg/dl、至少约80 mg/dl、至少约90 mg/dl、至少约100 mg/dl的浓度。
[0320]
根据一个具体实施方案,培养进一步包括将葡萄糖加入到至少约50 mg/dl的浓度。
[0321]
根据一个实施方案,包含所得的包含记忆cd8
+ t细胞的细胞群体(即,在用il-21培养后)的细胞培养物就ph水平进行监测。根据一个实施方案,ph处于生理范围(例如ph 7.2-7.6)。在ph水平不处于生理范围的情况下,可以使用本领域已知的任何方法调整ph水平。
[0322]
根据本发明的一个实施方案,提供了生成包含中央型记忆t淋巴细胞(tcm)表型的非移植物抗宿主病(gvhd)诱导细胞的分离群体的方法,该细胞是耐受性诱导细胞和/或被赋予抗疾病活性,并且能够在移植之后归巢到淋巴结,该方法包括:(a)使来自供体受试者的外周血单核细胞(pbmc)的第一群体与能够选择cd14
+
表达细胞的抗体接触,并且选择能够成熟为树突状细胞的cd14
+
表达细胞;(b)用衍生自4-10种类型的病毒的病毒肽装载树突状细胞,其中所述病毒中的至少一种包含bk病毒;(c)用能够耗尽cd4
+
、cd56
+
和cd45ra
+
表达细胞的一种或多种试剂处理与pbmc的第一群体属于同一供体受试者的pbmc的第二群体,以便获得包含表达cd45ra-cd8
+
表型的记忆t细胞的细胞群体;(d)在il-21的存在下,使包含记忆t细胞的细胞群体与步骤(b)的用病毒肽装载的树突状细胞接触,以便允许病毒反应性记忆t细胞的富集;和(e)在il-21、il-15和/或il-7的存在下,培养起因于步骤(d)的细胞,以便允许包含tcm表型的细胞增殖,从而生成包含tcm表型的非gvhd诱导细胞的分离群体。
[0323]
根据一个实施方案,在il-21、il-15和/或il-7的存在下,培养所得的包含记忆cd8
+ t细胞的细胞群体 (即,在用il-21培养后),通常在无抗原的环境下(即,不添加一种或多种抗原,例如病毒肽)实现。然而,应理解在用il-21培养后(即在包括例如il-21、il-15和il-7的添加的tcm增殖步骤中),残留的一种或多种抗原(例如病毒肽)可以存在于细胞培养中,并且因此,无抗原环境涉及不添加呈递一种或多种抗原(例如病毒肽)的补充性抗原呈递细胞的细胞培养。
[0324]
根据一个实施方案,为了获得对一种或多种抗原特异性的记忆cd8
+ t细胞,在由其获得记忆cd8
+ t细胞之前(例如在提供包含至少40%记忆cd8
+ t细胞的t细胞群体之前),将抗原(例如肿瘤抗原、病毒抗原)施用于供体受试者。可以采用使细胞供体针对抗原进行免疫的任何方法,以便引发免疫原性应答(例如记忆cd8
+ t细胞的生成)。
[0325]
抗原可以按原样施用,或作为包含佐剂(例如完全弗氏佐剂(cfa)或不完全弗氏佐剂(ifa))的组合物的部分施用。根据一个实施方案,将抗原施用于供体受试者一次。根据一个实施方案,供体受试者接受抗原的至少一次另外(例如加强)施用(例如2、3、4次或更多次施用)。此类另外施用可以在抗原的第一次施用之后的1、3、5、7、10、12、14、21、30天或更长
时间实现。
[0326]
为了进一步富集针对特定抗原的记忆cd8
+ t细胞,并且从记忆t细胞池中耗尽同种异体反应性克隆,包含记忆cd8
+ t细胞的细胞群体可以与相同的一种或多种抗原(例如与施用于细胞供体相同的抗原)进一步接触,如上文所述。
[0327]
应了解在生成包含tcm表型的非gvhd诱导细胞的分离群体的过程期间,可以在任何阶段获得细胞样品和培养基样品。这些可以用于评估细胞数目、细胞生存力、无菌性、免疫表型分型、葡萄糖和ph水平等。本领域已知的任何方法都可以用于实施此类程序。
[0328]
根据一个实施方案,提供了根据本发明的一些实施方案的方法生成、包含具有中央型记忆t淋巴细胞(tcm)表型的细胞的非gvhd诱导细胞的分离群体,该细胞是耐受性诱导细胞和/或被赋予抗疾病活性,并且能够在移植之后归巢到淋巴结。
[0329]
在包含tcm表型的非gvhd诱导的生成之后,细胞可以作为新鲜细胞使用(例如在约1、2、3、4、5、6、7、8、9或10天内,例如在约3天内)。
[0330]
可替代地,细胞可以冷冻保存直到需要时(例如1周、2周、1个月、2个月、4个月、6个月、1年或更长时间)。
[0331]
根据一个实施方案,本发明的包含tcm表型的非gvhd诱导细胞并非天然存在的,并且不是自然界的产物。这些细胞通常通过离体操作(即,在特定细胞因子的存在下,暴露于一种或多种抗原)产生。
[0332]
上文描述的方案通常用于非同基因应用,并且因此所使用的包含记忆t细胞或pbmc的细胞群体通常相对于受体受试者是同种异体的(例如来自同种异体供体)。同样地,在其中异种应用可能是有益的情况下,所使用的记忆t细胞或pbmc可以具有异种来源,如下文讨论的。然而,在其中同基因应用可能是有益的情况下,所使用的包含记忆t细胞或pbmc的细胞群体相对于受体受试者可以是自体的(例如来自受试者)。尤其是考虑到所提供的公开内容,此类确定完全在本领域技术人员的能力内。
[0333]
因此,如所提到的,包含记忆cd8
+ t细胞或pbmc的细胞群体相对于受试者可以是同基因的或非同基因的。
[0334]
如本文使用的,术语“同基因的”细胞指与受试者或受试者的基本上所有淋巴细胞基本上在遗传上同一的细胞。同基因细胞的实例包括衍生自受试者(在本领域中也被称为“自体的”),受试者的克隆,或受试者的同卵双胞胎的细胞。
[0335]
如本文使用的,术语“非同基因的”细胞指与受试者或受试者的基本上所有淋巴细胞并非基本上在遗传上同一的细胞,例如同种异体细胞或异种细胞。
[0336]
如本文使用的,术语“同种异体的”指衍生自供体受试者的细胞,所述供体受试者与受体受试者属于同一物种,但与受体受试者是基本上非克隆的。通常,同一物种的远亲杂交的非合子双胞胎哺乳动物彼此是同种异体的。应了解同种异体细胞相对于受体受试者可以是hla相合、部分hla相合或hla不相合的(即展示一个或多个不同的hla决定簇)。
[0337]
根据一个实施方案,供体是人类。
[0338]
如本文使用的,术语“异种的”指相对于受试者的基本比例的淋巴细胞的种类,基本上表达不同种类的抗原的细胞。通常,不同物种的远亲杂交的哺乳动物彼此是异种的。
[0339]
本发明设想了异种细胞衍生自各种物种。因此,根据一个实施方案,细胞可以衍生自任何哺乳动物。关于细胞的合适物种起源包含主要的驯养动物或家畜动物和灵长类动
物。此类动物包括但不限于猪科动物(例如猪)、牛科动物(例如牛)、马科动物(例如马)、绵羊科动物(例如山羊、绵羊)、猫科动物(例如家猫(felis domestica))、犬科动物(例如canis domestica)、啮齿类动物(例如小鼠、大鼠、兔、豚鼠、沙鼠、仓鼠)和灵长类动物(例如黑猩猩、恒河猴、猕猴、狨猴)。异种起源(例如猪科动物起源)的细胞优选得自已知没有人畜共患病,例如猪内源性逆转录病毒的来源。类似地,人衍生的细胞或组织优选从基本上无病原体的来源获得。
[0340]
因此,包含记忆cd8
+ t细胞或pbmc的细胞群体的来源相对于细胞的预期用途(参见下文的进一步细节)进行确定,并且尤其是按照本文提供的详细公开内容,完全在本领域技术人员的能力内。
[0341]
在其中需要消除移植物排斥、克服移植物抗宿主病(gvhd)和/或诱导供体特异性耐受的情形下,例如在同种异体或异种细胞或组织的移植中,反抑细胞的使用是尤其有益的。反抑细胞的使用对于“现成的”同种异体的遗传修饰的t细胞,例如car-t细胞或tcr转基因t细胞(tcr-t)的延长也可能是有益的。
[0342]
相应地,本发明的一些实施方案的反抑细胞可以用作辅助疗法,以促进遗传修饰的细胞的移植物植入,所述细胞被转导为表达包含t细胞受体信号传导模块(即,负责激活受体已置于其中的t细胞的至少一种正常效应子功能的受体的细胞内部分)的细胞表面受体,例如转基因t细胞受体(tg-tcr)或嵌合抗原受体(car),如本文上文详细讨论的。
[0343]
根据一个实施方案,本发明的一些实施方案的反抑细胞可以与任何car-t或tcr-t细胞(例如从反抑细胞供体的细胞生成的car-t或tcr-t细胞),例如靶向各种肿瘤抗原的肿瘤特异性car-t或tcr-t细胞结合使用,用于治疗造血系统癌症或实体癌。这些癌症及其可以靶向的抗原的实例包括但不限于滤泡性淋巴瘤(cd20或gd2)、神经母细胞瘤(cd171)、非霍杰金淋巴瘤(cd20)、淋巴瘤(cd19)、胶质母细胞瘤(il13rα2)、慢性淋巴细胞性白血病或cll、多发性骨髓瘤(bcma、cd138、cs1)、以及急性淋巴细胞性白血病或all (均为cd19)。
[0344]
应了解反抑细胞和car-t/tcr-t细胞可以伴随地或在彼此之后(例如在同一天时或在例如彼此的约1、2、3、4、5、6、7天内)使用。
[0345]
如上文提到的,本发明的反抑细胞进一步被赋予抗疾病活性(例如抗病毒活性或抗肿瘤活性,例如gvl),并且因此在其中受试者例如移植受试者在移植前或移植后(例如在建立免疫重建之前)患有疾病或状况(例如恶性、病毒、细菌、真菌、自身免疫性或过敏性疾病或状况)的情形下是有益的。
[0346]
根据一个实施方案,本发明的反抑细胞对于预防病毒感染是有益的。
[0347]
根据一个实施方案,本发明的反抑细胞对于杀死癌细胞,包括残留的癌细胞(例如白血病细胞)是有益的。
[0348]
根据一个实施方案,本发明的反抑细胞对于预防疾病复发(例如白血病复发)是有益的。
[0349]
因此,根据本发明的另一个方面,提供了治疗有此需要的受试者中的疾病的方法,该方法包括向受试者施用治疗有效量的本发明的一些实施方案的非gvhd诱导细胞的分离群体(即tcm细胞),从而治疗受试者中的疾病。
[0350]
根据本发明的另一个方面,提供了本发明的一些实施方案的包含tcm表型的非gvhd诱导细胞用于制造药物的用途,所述药物经鉴定用于治疗有此需要的受试者中的疾
病。
[0351]
如本文使用的,术语“治疗”包括取消状况,基本上抑制、减慢或逆转状况的发展,基本上改善状况的临床或美学症状,或者基本上预防状况的临床或美学症状的出现。
[0352]
如本文使用的,术语“受试者”或“有此需要的受试者”指哺乳动物,优选人类,处于任何年龄的男性或女性,其需要细胞或组织移植或者患有可以用非gvhd诱导tcm细胞进行治疗的疾病。通常,由于顺应经由细胞或组织移植治疗的病症或者病理或不希望有的状况、状态或综合征,或者身体、形态或生理学上的异常,受试者需要细胞或组织移植(在本文中也被称为受体)。下文进一步提供了此类病症的实例。
[0353]
因此,本发明的方法可以应用于治疗任何疾病,例如但不限于恶性疾病、与移植物移植相关的疾病(例如移植物排斥、移植物抗宿主病)、传染病(例如病毒病、真菌病或细菌病)、炎性疾病、自身免疫性疾病和/或过敏性疾病或状况。
[0354]
根据一个实施方案,受试者患有恶性疾病。
[0355]
可以通过本发明的一些实施方案的方法治疗的恶性疾病(也称为癌症)可以是任何实体瘤或非实体瘤和/或肿瘤转移和/或疾病复发。
[0356]
癌症的实例包括但不限于癌、淋巴瘤、母细胞瘤、肉瘤和白血病。此类癌症的更具体实例包括鳞状细胞癌、软组织肉瘤、卡波西氏肉瘤、黑色素瘤、肺癌(包括小细胞肺癌、非小细胞肺癌、肺腺癌和肺鳞癌)、腹膜癌、肝细胞癌、胃的癌或胃癌(包括胃肠癌)、胰腺癌、胶质母细胞瘤、宫颈癌、卵巢癌、肝癌、膀胱癌、肝细胞瘤、乳腺癌、结肠癌、结肠直肠癌、直肠癌、子宫内膜癌或子宫癌、类癌、唾液腺癌、肾癌或肾的癌、肝癌、前列腺癌、外阴癌、甲状腺癌、肝癌、间皮瘤、多发性骨髓瘤、移植后淋巴增生性病症(ptld)、以及各种类型的头颈癌(例如脑瘤)。顺应本发明的治疗的癌性状况包括转移癌。
[0357]
根据一个具体实施方案,恶性疾病是白血病、淋巴瘤、骨髓瘤、黑色素瘤、肉瘤、神经母细胞瘤、结肠癌、结肠直肠癌、乳腺癌、卵巢癌、食道癌、滑膜细胞癌、肝癌和胰腺癌。
[0358]
根据一个实施方案,恶性疾病是血液恶性肿瘤。示例性的血液恶性肿瘤包括但不限于白血病[例如急性淋巴性、急性成淋巴细胞性、急性成淋巴细胞性前b细胞、急性成淋巴细胞性t细胞白血病、急性
ꢀ‑ꢀ
巨核母细胞性、单核细胞性、急性粒细胞性、急性髓样、急性髓样伴嗜酸性粒细胞增多、b细胞、嗜碱性、慢性髓样、慢性、b细胞、嗜酸性、friend、粒细胞或髓性、毛细胞、淋巴细胞性、巨核母细胞性、单核细胞性、单核细胞-巨核细胞性、成髓细胞性、髓样、骨髓单核细胞性、浆细胞性、前b细胞、早幼粒细胞性、亚急性、t细胞性、淋巴样赘生物、髓样恶性肿瘤的易感性、急性非淋巴细胞性白血病、t细胞急性淋巴细胞性白血病(t-all)和b细胞慢性淋巴细胞性白血病(b-cll)]和淋巴瘤[例如霍杰金氏病、非霍杰金氏淋巴瘤、伯基特、皮肤t细胞、组织细胞、成淋巴细胞、t细胞、胸腺、b细胞,包括低级别/滤泡性;小淋巴细胞(sl) nhl;中级别/滤泡性nhl;中级别弥漫性nhl;高级别免疫母细胞性nhl;高级别成淋巴细胞性nhl;高级别小无裂细胞nhl;巨大肿块nhl (bulky disease nhl);套细胞淋巴瘤;aids相关淋巴瘤;以及华氏巨球蛋白血症]。
[0359]
根据一个具体实施方案,血液恶性肿瘤是滤泡性淋巴瘤(fl)、套细胞淋巴瘤(mcl)、慢性淋巴细胞性白血病(cll)、多发性骨髓瘤(mm)、霍杰金氏淋巴瘤(hl)、非霍杰金氏淋巴瘤(nhl)、慢性髓样白血病(cml)、骨髓增生性综合征(mpd)、急性髓样白血病(aml)或急性淋巴样白血病(all)。
[0360]
根据一个实施方案,受试者患有非恶性疾病。
[0361]
根据一个实施方案,非恶性疾病是器官功能障碍或衰竭、血液病、移植物相关疾病、传染病、炎性疾病、自身免疫性疾病、过敏性疾病、遗传性疾病或病症、代谢病症、创伤和伤害。
[0362]
根据一个实施方案,本发明的受试者可能患有可通过细胞或组织移植治疗的心血管疾病、类风湿病、腺病、胃肠疾病、皮肤疾病、肝病、神经系统疾病、肌肉疾病、肾病、结缔组织病、全身性疾病和/或与生殖有关的疾病中的任一种。
[0363]
示例性的非恶性疾病包括但不限于严重联合免疫缺陷综合征(scid)、镰状细胞病(例如镰状细胞性贫血)、先天性嗜中性粒细胞减少症、血小板减少症、再生障碍性贫血(例如重度再生障碍性贫血)、骨髓增生异常综合征、7号单体、骨硬化症、戈谢氏病、赫勒氏病、异染性脑白质营养不良、肾上腺脑白质营养不良、地中海贫血、先天性或遗传决定的造血异常、腺苷脱氨酶(ada)、狼疮、自身免疫性肝炎、乳糜泻、i型糖尿病、格雷夫斯氏病、格巴二氏综合征、重症肌无力、类风湿性关节炎、硬皮病和牛皮癣。
[0364]
根据一个实施方案,非恶性疾病可以通过经由添加反抑细胞辅助的造血祖细胞移植进行治疗。
[0365]
根据一个实施方案,非恶性疾病可以通过经由造血祖细胞和反抑细胞(例如诱导供体嵌合状态)移植辅助的细胞或组织移植物(如下文讨论的)移植进行治疗。
[0366]
传染病传染病的实例包括但不限于慢性传染病、亚急性传染病、急性传染病、病毒病、细菌病、原生动物病、寄生虫病、真菌病、支原体病和朊病毒病。
[0367]
引起可根据本发明的教导治疗的传染病的病毒病原体的具体类型包括但不限于逆转录病毒、圆环病毒、细小病毒、乳多空病毒、腺病毒、疱疹病毒、虹彩病毒、痘病毒、嗜肝dna病毒、微小核糖核酸病毒、杯状病毒、披膜病毒、黄病毒、呼肠孤病毒、正粘病毒、副粘病毒、弹状病毒、布尼亚病毒、冠状病毒、沙粒病毒和丝状病毒。
[0368]
可以根据本发明的教导治疗的病毒感染的具体实例包括但不限于由以下引起的病毒感染:人免疫缺陷病毒(hiv)诱导的获得性免疫缺陷综合征(aids),流感,鼻病毒感染,病毒性脑膜炎,eb病毒(ebv)感染,甲型、乙型或丙型肝炎病毒感染,麻疹,乳头状瘤病毒感染/疣,巨细胞病毒(cmv)感染,单纯疱疹病毒感染,黄热病,埃博拉病毒感染,狂犬病,腺病毒(adv),感冒病毒,流感病毒,日本脑炎,脊髓灰质炎,呼吸道合胞,风疹,天花,水痘带状疱疹,轮状病毒,西尼罗病毒和寨卡病毒。
[0369]
可以根据本发明的教导治疗的细菌感染的具体实例包括但不限于由以下引起的细菌感染:炭疽;革兰氏阴性杆菌、衣原体、白喉、流感嗜血杆菌、幽门螺杆菌、疟疾、结核分枝杆菌、百日咳毒素、肺炎球菌、立克次氏体、葡萄球菌、链球菌和破伤风。
[0370]
可以根据本发明的教导治疗的超级细菌感染(例如多药抗性细菌)的具体实例包括但不限于由以下引起的超级细菌感染:屎肠球菌、艰难梭菌、鲍曼不动杆菌、铜绿假单胞菌和肠杆菌科(包括大肠杆菌、肺炎克雷伯氏菌、肠杆菌属物种)。
[0371]
可以根据本发明的教导治疗的真菌感染的具体实例包括但不限于由以下引起的真菌感染:念珠菌、球孢子菌、隐球菌、组织胞浆菌、利什曼原虫、疟原虫、原生动物、寄生虫、血吸虫、癣、弓形虫和克氏锥虫。
[0372]
移植物排斥疾病根据其它实施方案,疾病与移植物的移植相关。与移植物的移植相关的疾病的实例包括但不限于移植物排斥、慢性移植物排斥、亚急性移植物排斥、超急性移植物排斥、急性移植物排斥、同种异体移植物排斥、异种移植物排斥和移植物抗宿主病(gvhd)。
[0373]
非恶性血液病非恶性血液病的实例包括但不限于贫血、骨髓病症、深静脉血栓形成/肺栓塞、戴布二氏贫血、血色素沉着症、血友病、免疫性血液病症、铁代谢病症、镰状细胞病(例如镰状细胞性贫血)、地中海贫血、血小板减少症和血管性血友病。
[0374]
根据一个具体实施方案,非恶性疾病是镰状细胞病或自身免疫性疾病(例如可通过hct加上反抑细胞治疗,如下文讨论的)。
[0375]
自身免疫性疾病的非限制性实例包括但不限于:急性播散性脑脊髓炎(adem)、艾迪生病、无丙种球蛋白血症、斑秃、肌萎缩侧索硬化、强直性脊柱炎、抗磷脂综合征、抗合成酶综合征、特应性变态反应、特应性皮炎、自身免疫性再生障碍性贫血、自身免疫性心肌病、自身免疫性肠病、自身免疫性溶血性贫血、自身免疫性肝炎、自身免疫性内耳病、自身免疫性淋巴细胞增生综合征、自身免疫性周围神经病、自身免疫性胰腺炎、自身免疫性多内分泌综合征、自身免疫性孕酮性皮炎、自身免疫性血小板减少性紫癜、自身免疫性葡萄膜炎(例如非感染性葡萄膜炎)、白塞氏病、乳糜泻、慢性肾小球肾炎、冷凝集素病、克罗恩氏病、皮肌炎、皮肌炎、糖尿病1型(1型糖尿病(t1dm))、嗜酸细胞性筋膜炎、古德帕斯彻氏综合征、格雷夫斯氏病、格巴二氏综合征(gbs)、桥本氏脑病、桥本氏甲状腺炎、特发性血小板减少性紫癜、免疫性血小板减少性紫癜(itp)、红斑狼疮(sle)、米勒-费希尔综合征、混合性结缔组织病、多发性硬化(ms)、重症肌无力、发作性睡病、寻常型天疱疮、恶性贫血、多发性肌炎、原发性胆汁性肝硬变、牛皮癣、牛皮癣关节炎、复发性多软骨炎、类风湿性关节炎(ra)、风湿热、系统性硬皮病、干燥综合征、颞动脉炎、横贯性脊髓炎、溃疡性结肠炎(uc)、未分化结缔组织病、血管炎和韦格纳氏肉芽肿。
[0376]
根据一个具体实施方案,自身免疫性疾病是红斑狼疮(sle)、多发性硬化(ms)和糖尿病1型(1型糖尿病(t1dm))。
[0377]
根据一个具体实施方案,非恶性疾病是再生障碍性贫血、严重免疫缺陷和非恶性骨髓衰竭。
[0378]
如上文提到的,为了增强包含tcm表型的非gvhd诱导细胞的抗疾病活性,选择与待治疗疾病相关的一种或多种抗原(例如病毒抗原)并且生成抗原特异性tcm细胞用于治疗是有益的。另外或可替代地,如上文讨论的,包含tcm表型的非gvhd诱导细胞可以进行遗传修饰用于治疗。
[0379]
如上文讨论的,本发明的包含tcm表型的非gvhd诱导细胞被赋予反抑活性。相应地,本发明的tcm细胞可以用作细胞或组织移植的辅助疗法。由于本发明的包含tcm表型的非gvhd诱导细胞也被赋予抗疾病活性,因此本发明的方法可以另外有利地应用于治疗受试者中的疾病,同时伴随地促进细胞或组织移植的移植物植入。
[0380]
根据一个实施方案,方法进一步包括将细胞或组织移植物移植到受试者内。
[0381]
根据一个实施方案,药物进一步包含细胞或组织移植物。
[0382]
根据一个实施方案,提供了治疗需要非同基因细胞或组织移植的受试者的方法,
该方法包括:(a)将细胞或组织移植物移植到受试者内;并且(b)向受试者施用治疗有效量的本发明的一些实施方案的非gvhd诱导细胞的分离群体,从而治疗需要细胞或组织移植的受试者。
[0383]
根据一个实施方案,提供了本发明的一些实施方案的非gvhd诱导细胞的分离群体用于制造药物的用途,所述药物鉴定为用于非同基因细胞或组织移植到受试者内的辅助治疗,其中所述受试者需要非同基因细胞或组织移植。
[0384]
如本文使用的,短语“细胞或组织移植”指身体的细胞(例如单个细胞或一组细胞)或组织(例如固体组织/器官或软组织,其可以全部或部分移植)。可以根据本文教导进行移植的示例性组织或器官包括但不限于肝、胰腺、脾、肾、心脏、肺、皮肤、肠和淋巴样/造血组织(例如淋巴结、派尔斑、胸腺或骨髓)。可以根据本文教导进行移植的示例性细胞包括但不限于未成熟造血细胞,包括干细胞、心脏细胞、肝细胞、胰腺细胞、脾细胞、肺细胞、脑细胞、肾细胞、肠/肠道细胞、卵巢细胞、皮肤细胞(例如,这些细胞中的任一种的分离群体)。此外,本发明还考虑了整个器官例如肾、心脏、肝或皮肤的移植。
[0385]
取决于应用和可用的来源,本发明的细胞或组织可以从出生前生物、出生后生物、成年生物或尸体供体获得。此外,取决于所需的应用,细胞或组织可以是幼稚的或遗传修饰的。此类确定完全在本领域普通技术人员的能力内。
[0386]
可以采用本领域已知的任何方法来获得细胞或组织(例如用于移植)。
[0387]
根据一个具体实施方案,细胞或组织移植包含未成熟造血细胞。
[0388]
如本文使用的,短语“未成熟造血细胞”指包含前体造血细胞(例如造血干细胞)的造血组织或细胞制剂。此类组织/细胞制剂包括或衍生自生物样品,例如,骨髓、动员的外周血(例如cd34
+
细胞的动员以增强其浓度)、脐带血(例如脐带)、胎肝、卵黄囊和/或胎盘。另外,纯化的cd34
+
细胞或其它造血干细胞例如cd131
+
细胞可以根据本文教导使用,伴随或不伴随离体扩增。
[0389]
根据一个实施方案,未成熟造血细胞包含t细胞耗尽的未成熟造血细胞。
[0390]
如本文使用的,短语“t细胞耗尽的未成熟造血细胞”指耗尽t淋巴细胞的前体造血细胞群体。t细胞耗尽的未成熟造血细胞可以包括例如cd34
+
、cd33
+
和/或cd56
+
细胞。t细胞耗尽的未成熟造血细胞可以耗尽cd3
+
细胞、cd2
+
细胞、cd8
+
细胞、cd4
+
细胞、α/β t细胞和/或γ/δ t细胞。
[0391]
根据一个实施方案,未成熟造血细胞包含富含cd34
+
未成熟造血细胞的t细胞耗尽的动员的血细胞。
[0392]
根据一个实施方案,t细胞耗尽的未成熟造血细胞包含至少约0.1 x 106个cd34
+
细胞、0.5 x 106个cd34
+
细胞、1 x 106个cd34
+
细胞、2 x 106个cd34
+
细胞、3 x 106个cd34
+
细胞、4 x 106个cd34
+
细胞、5 x 106个cd34
+
细胞、6 x 106个cd34
+
细胞、7 x 106个cd34
+
细胞、8 x 106个cd34
+
细胞、9 x 106个cd34
+
细胞、10 x 106个cd34
+
细胞、15 x 106个cd34
+
细胞或20 x 106个cd34
+
细胞/kg受试者的理想体重。
[0393]
根据一个具体实施方案,t细胞耗尽的未成熟造血细胞包含至少约2.5-20 x 106个cd34
+
细胞(例如5-10 x 106个cd34
+
细胞)/kg受试者的理想体重。
[0394]
根据一个具体实施方案,t细胞耗尽的未成熟造血细胞包含至少约5 x 106个cd34
+
细胞/kg受试者的理想体重。
[0395]
根据一个具体实施方案,t细胞耗尽的未成熟造血细胞包含至少约6 x 106个cd34
+
细胞/kg受试者的理想体重。
[0396]
根据一个具体实施方案,t细胞耗尽的未成熟造血细胞包含至少约8 x 106个cd34
+
细胞/kg受试者的理想体重。
[0397]
根据一个具体实施方案,t细胞耗尽的未成熟造血细胞包含至少约10 x 106个cd34
+
细胞/kg受试者的理想体重。
[0398]
根据一个实施方案,使未成熟造血细胞耗尽cd3
+
和/或cd19
+
细胞。
[0399]
根据一个实施方案,t细胞耗尽的未成熟造血细胞包含少于约50 x 105个cd3
+
细胞、40 x 105个cd3
+
细胞、30 x 105个cd3
+
细胞、20 x 105个cd3
+
细胞、15 x 105个cd3
+
细胞、10 x 105个cd3
+
细胞、9 x 105个cd3
+
细胞、8 x 105个cd3
+
细胞、7 x 105个cd3
+
细胞、6 x 105个cd3
+
细胞、5 x 105个cd3
+
细胞、4 x 105个cd3
+
细胞、3 x 105个cd3
+
细胞、2 x 105个cd3
+
细胞、1 x 105个cd3
+
细胞、0.5 x 105个cd3
+
细胞或0.1 x 105个cd3
+
细胞/千克受试者的理想体重。
[0400]
根据一个具体实施方案,t细胞耗尽的未成熟造血细胞包含少于1-5 x 105个cd3
+
细胞(例如2-5 x 105个cd3
+
细胞)/千克受试者的理想体重。
[0401]
根据一个具体实施方案,t细胞耗尽的未成熟造血细胞包含少于5 x 105个cd3
+
细胞/千克受试者的理想体重。
[0402]
根据一个具体实施方案,t细胞耗尽的未成熟造血细胞包含少于4 x 105个cd3
+
细胞/千克受试者的理想体重。
[0403]
根据一个具体实施方案,t细胞耗尽的未成熟造血细胞包含少于3 x 105个cd3
+
细胞/千克受试者的理想体重。
[0404]
根据一个具体实施方案,t细胞耗尽的未成熟造血细胞包含少于2 x 105个cd3
+
细胞/千克受试者的理想体重。
[0405]
根据一个实施方案,使未成熟造血细胞耗尽cd8+细胞。
[0406]
根据一个实施方案,t细胞耗尽的未成熟造血细胞包含少于1 x 10
4 –ꢀ
5 x 105个cd8
+
细胞(例如0.1-4 x 105个cd8
+
细胞,例如1-3 x 105个cd8
+
细胞)/千克受试者的理想体重。
[0407]
根据一个实施方案,t细胞耗尽的未成熟造血细胞包含少于约50 x 105个cd8
+
细胞、25 x 105个cd8
+
细胞、15 x 105个cd8
+
细胞、10 x 105个cd8
+
细胞、9 x 105个cd8
+
细胞、8 x 105个cd8
+
细胞、7 x 105个cd8
+
细胞、6 x 105个cd8
+
细胞、5 x 105个cd8
+
细胞、4 x 105个cd8
+
细胞、3 x 105个cd8
+
细胞、2 x 105个cd8
+
细胞、1 x 105个cd8
+
细胞、9 x 104个cd8
+
细胞、8 x 104个cd8
+
细胞、7 x 104个cd8
+
细胞、6 x 104个cd8
+
细胞、5 x 104个cd8
+
细胞、4 x 104个cd8
+
细胞、3 x 104个cd8
+
细胞、2 x 104个cd8
+
细胞或1 x 104个cd8
+
细胞/千克受试者的理想体重。
[0408]
根据一个具体实施方案,t细胞耗尽的未成熟造血细胞包含少于5 x 105个cd8
+
细胞/千克受试者的理想体重。
[0409]
根据一个具体实施方案,t细胞耗尽的未成熟造血细胞包含少于4 x 105个cd8
+
细胞/千克受试者的理想体重。
[0410]
根据一个具体实施方案,t细胞耗尽的未成熟造血细胞包含少于3 x 105个cd8
+
细
胞/千克受试者的理想体重。
[0411]
根据一个实施方案,t细胞耗尽的未成熟造血细胞包含少于约1 x 106个cd8
+ tcrα/β-细胞、0.5 x 106个cd8
+ tcrα/β-细胞、1 x 105个cd8
+ tcrα/β-细胞、0.5 x 105个cd8
+ tcrα/β-细胞、1 x 104个cd8
+ tcrα/β-细胞、0.5 x 104个cd8
+ tcrα/β-细胞、1 x 103个cd8
+ tcrα/β-细胞或0.5 x 103个cd8
+ tcrα/β-细胞/千克受试者的理想体重。
[0412]
根据一个具体实施方案,t细胞耗尽的未成熟造血细胞包含少于1 x 105ꢀ‑ꢀ
1 x 106个cd8
+ tcrα/β-细胞/千克受试者的理想体重。
[0413]
根据一个具体实施方案,t细胞耗尽的未成熟造血细胞包含少于1 x 106个cd8
+ tcrα/β-细胞/千克受试者的理想体重。
[0414]
根据一个具体实施方案,t细胞耗尽的未成熟造血细胞包含少于5 x 105个cd8
+ tcrα/β-细胞/千克受试者的理想体重。
[0415]
根据一个具体实施方案,t细胞耗尽的未成熟造血细胞包含少于1 x 105个cd8
+ tcrα/β-细胞/千克受试者的理想体重。
[0416]
根据一个实施方案,使未成熟造血细胞耗尽b细胞。
[0417]
根据一个实施方案,使未成熟造血细胞耗尽b细胞(cd19
+
和/或cd20
+ b细胞)。
[0418]
根据一个实施方案,未成熟造血细胞包含少于约50 x 105个cd19
+
和/或cd20
+
细胞、40 x 105个cd19
+
和/或cd20
+
细胞、30 x 105个cd19
+
和/或cd20
+
细胞、20 x 105个cd19
+
和/或cd20
+
细胞、10 x 105个cd19
+
和/或cd20
+
细胞、9 x 105个cd19
+
和/或cd20
+
细胞、8 x 105个cd19
+
和/或cd20
+
细胞、7 x 105个cd19
+
和/或cd20
+
细胞、6 x 105个cd19
+
和/或cd20
+
细胞、5 x 105个cd19
+
和/或cd20
+
细胞、4 x 105个cd19
+
和/或cd20
+
细胞、3 x 105个cd19
+
和/或cd20
+
细胞、2 x 105个cd19
+
和/或cd20
+
细胞或1 x 105个cd19
+
和/或cd20
+
细胞/千克受试者的理想体重。
[0419]
根据一个具体实施方案,未成熟造血细胞包含少于1-5 x 105个cd19
+
和/或cd20
+
细胞(例如3-5 x 105个cd19
+
和/或cd20
+
细胞)/千克受试者的理想体重。
[0420]
根据一个具体实施方案,未成熟造血细胞包含少于4 x 105个cd19
+
和/或cd20
+
细胞/千克受试者的理想体重。
[0421]
根据一个具体实施方案,未成熟造血细胞包含少于3 x 105个cd19
+
和/或cd20
+
细胞/千克受试者的理想体重。
[0422]
根据一个具体实施方案,未成熟造血细胞包含少于2 x 105个cd19
+
和/或cd20
+
细胞/千克受试者的理想体重。
[0423]
根据一个具体实施方案,t细胞耗尽的未成熟造血细胞包含两个或更多个细胞批次,例如包含cd34+选择的细胞的第一批次和包含cd3
+
/cd19
+
耗尽的细胞的第二批次(即,从同一供体获得)。应了解这些细胞可以伴随地或在彼此之后(例如在同一天时或在例如彼此的约1、2、3、4、5、6、7天内,如下文讨论的)使用。
[0424]
t细胞例如cd3
+
、cd2
+
、tcrα/β
+
、cd4
+
和/或cd8
+
细胞,或者b细胞例如cd19
+
和/或cd20
+
细胞的耗尽可以使用本领域已知的任何方法进行,所述方法例如通过用特异性抗体根除(例如杀死)或通过基于亲和力的纯化,例如通过使用磁细胞分离技术、facs分选器和/或捕获elisa标记进行。
[0425]
此类方法在本文以及the handbook of experimental immunology,第1至4卷,
(d.n. weir,编辑)和flow cytometry and cell sorting (a. radbruch,编辑,springer verlag,1992)中进行描述。例如,细胞可以通过例如流式细胞术或facs进行分选。因此,可以使用荧光激活细胞分选(facs),并且可以具有不同程度的颜色通道、低角度和钝光散射检测通道和阻抗通道。本领域已知的任何配体依赖性分离技术可以与阳性和阴性分离技术两者结合使用,所述分离技术依赖细胞的物理性质而不是抗体亲和力,包括但不限于洗脱和密度梯度离心。
[0426]
用于细胞分选的其它方法包括例如使用亲和技术的淘选和分离,包括使用固体支持物如板、珠和柱的那些技术。因此,生物样品可以通过用附着至固体基质例如板的抗体的“淘选”进行分离。
[0427]
可替代地,细胞可以通过磁分离技术进行分选/分离,并且这些方法中的一些利用磁珠。不同的磁珠可从许多来源获得,所述来源包括例如dynal (挪威)、advanced magnetics (cambridge,ma,u.s.a.)、immuncon (philadelphia,u.s.a.)、immunotec (marseille,法国)、invitrogen、stem cell technologies (u.s.a)和cellpro (u.s.a)。另外,抗体可以是生物素化的或与地高辛配基缀合,并且与抗生物素蛋白或抗地高辛配基包被的亲和柱结合使用。
[0428]
根据一个实施方案,不同的耗尽/分离方法可以组合,例如,磁细胞分选可以与facs组合,以增加分离质量或允许通过多重参数的分选。
[0429]
根据一个具体实施方案,t细胞耗尽的未成熟造血细胞通过包括以下的方法获得:从供体受试者中收集动员的pbmc (例如从其中收集非动员的pbmc用于生成包含tcm表型的非gvhd诱导细胞的同一供体受试者)。
[0430]
根据一个实施方案,动员通过g-csf来实现。
[0431]
根据一个实施方案,动员通过g-csf和plerixafor来实现。
[0432]
根据一个具体实施方案,动员的pbmc的收集在单次收集中获得。
[0433]
根据一个具体实施方案,动员的pbmc的收集在二、三、四、五次或更多次每日收集,例如三次每日收集(例如在相继的几天时或在相隔的几天内)中获得。
[0434]
根据一个具体实施方案,将含有至少约0.1-5 x 106个cd34
+
细胞,例如2 x 106个cd34
+
细胞,例如1 x 106个cd34
+
细胞/kg理想体重的未修饰的动员pbmc的备用级分(例如从第一次收集获得的)留出且冷冻保存。
[0435]
根据一个具体实施方案,将动员的pbmc的收集(例如来自第一天和第二天的收集的剩余部分)合并,进行cd34
+
选择(如下文讨论的)且冷冻保存。
[0436]
根据一个具体实施方案,使第三天的收集耗尽cd3
+
/cd19
+
细胞(如下文讨论的)且冷冻保存。
[0437]
根据一个实施方案,cd34
+
表达细胞的富集通过使pbmc与cd34结合剂一起温育来实现。
[0438]
根据一个具体实施方案,cd34结合剂是抗体。
[0439]
根据一个具体实施方案,cd34抗体是单克隆抗体。
[0440]
根据一个具体实施方案,cd34单克隆抗体与磁性颗粒缀合。
[0441]
根据一个具体实施方案,cd34单克隆抗体与超顺磁性颗粒缀合。
[0442]
根据一个实施方案,cd34
+
标记的细胞通过磁分离技术(如上文详细讨论的)进行
选择。
[0443]
根据一个具体实施方案,cd34磁性标记的细胞(即cd34
+
表达细胞)由分离柱保留(即阳性选择),并且去除cd34-细胞。然后将cd34
+
细胞从柱中释放并收集。根据一个实施方案,取出来自每个级分的样品用于细胞计数、生存力和/或免疫表型分型。
[0444]
根据一个实施方案,使用例如cobe 2991,使动员的pbmc耗尽血小板。
[0445]
根据一个实施方案,使一个实施方案的血小板耗尽后的pbmc制剂与ivig一起温育5-30分钟,例如10-15分钟。在初始温育后,将cd3
+
和cd19
+
结合剂加入细胞制剂中,并且在轨道旋转器上温育例如10-60分钟,例如30分钟。
[0446]
根据一个具体实施方案,cd3和/或cd19结合剂是抗体。
[0447]
根据一个具体实施方案,cd3和/或cd19抗体是单克隆抗体。
[0448]
根据一个具体实施方案,cd3和/或cd19单克隆抗体与磁性颗粒缀合。
[0449]
根据一个具体实施方案,cd3和/或cd19单克隆抗体与超顺磁性颗粒缀合。
[0450]
根据一个实施方案,在温育结束后,通过离心洗涤细胞,并且将细胞沉淀重悬浮于缓冲液(例如cobe 2991)中,以去除过量试剂。
[0451]
根据一个实施方案,cd3
+
/cd19
+
标记的细胞通过磁分离技术 (如下文详细讨论的)进行选择。
[0452]
根据一个具体实施方案,cd3
+
/cd19
+
标记的细胞在clinimacs
®
柱上进行处理。
[0453]
根据一个具体实施方案,cd3
+
/cd19
+
磁性标记的细胞(即cd3
+
/cd19
+
表达细胞)由分离柱保留(即阴性选择),并且收集cd4-/cd56-/cd45ra-细胞。根据一个实施方案,将收集的细胞(cd3-/cd19-细胞)洗涤且收集。根据一个实施方案,取出来自每个级分的样品用于细胞计数、生存力和/或免疫表型分型。
[0454]
根据一个具体实施方案,在其中多于约1 x 10
5 cd3至5 x 10
5 cd3,例如1 x 10
5 cd3至3 x 10
5 cd3,例如2.5 x 10
5 cd3,例如2 x 10
5 cd3/kg理想体重存在于收集的细胞级分中的情形下,进行第二个cd3
+
耗尽步骤(如上文讨论的)。
[0455]
可替代地,只利用t细胞耗尽级分的部分的输注,以便避免多于5 x 10
5 cd3,例如3 x 10
5 cd3,例如2 x 10
5 cd3细胞/kg理想体重的输注。
[0456]
根据一个实施方案,t细胞耗尽的未成熟造血细胞(即,用于细胞移植)和用于生成包含tcm表型的非gvhd诱导细胞(即,用于生成反抑细胞)的pbmc从同一供体受试者中获得。
[0457]
取决于应用,方法可以使用与受体受试者(例如同种异体的)同基因或非同基因的细胞或组织来实现,如上文讨论的。
[0458]
根据本发明的一个实施方案,受体受试者和供体受试者两者均为人。
[0459]
根据本发明的一个实施方案,受试者(即,受体受试者)患有可以通过细胞或组织移植物的移植进行治疗的疾病。
[0460]
根据本发明的一个实施方案,受试者(即,受体受试者)患有可以通过器官或组织的移植进行治疗的疾病。
[0461]
根据本发明的一个实施方案,受试者(即,受体受试者)患有可以通过未成熟造血细胞移植(例如,t细胞耗尽的未成熟造血细胞)进行治疗的疾病。
[0462]
根据本发明的一个实施方案,受试者(即,受体受试者)患有可以通过未成熟造血细胞和实体器官或组织(例如肾、肺、肝、胰腺、心脏等)的共移植进行治疗的疾病。
[0463]
根据本发明的一个实施方案,受试者(即,受体受试者)患有可以通过未成熟造血细胞以及从实体器官或组织中获得的分离细胞(例如,如上文讨论的肾、肺细胞、肝细胞、胰腺细胞、心脏细胞等)的共移植进行治疗的疾病。
[0464]
根据本发明的一个实施方案,受试者(即,受体受试者)患有可以通过几个器官(例如心脏和肺组织)的共移植进行治疗的疾病。
[0465]
根据一个实施方案,用于共移植的细胞、器官或组织得自同一供体。
[0466]
将细胞或组织移植到受试者内可能以众多方式来实现,取决于各种参数例如细胞或组织类型;受体疾病的类型、阶段或严重性(例如恶性疾病的类型和阶段);受试者特异性的物理或生理参数;和/或所需的治疗结果。
[0467]
取决于应用,移植本发明的细胞或组织移植物可以通过将细胞或组织移植物移植到各种解剖位置中的任何一个内来实现。细胞或组织移植物可以移植到同位解剖位置(用于移植的正常解剖位置),或移植到异位解剖位置(用于移植的异常解剖位置)。取决于应用,细胞或组织移植物可以有利地植入肾囊下,或者肾、睾丸脂肪、皮下组织、网膜、门静脉、肝、脾、心腔、心脏、胸腔、肺、皮肤、胰腺和/或腹内空间内。
[0468]
本发明的一些实施方案的未成熟造血细胞(例如t细胞耗尽的未成熟造血细胞)可以使用本领域已知的用于细胞移植的任何方法移植到受试者内,所述方法例如但不限于细胞输注(例如i.v.)或经由腹膜内途径。
[0469]
在根据本文教导将细胞或组织移植物移植到受试者内之后,可取的是,根据标准医学实践,根据各种标准的领域技术中的任何一种来监测细胞、组织或器官的生长功能性和免疫相容性。例如,可以通过标准的血液和骨髓测试(例如通过facs分析)在受试者中监测未成熟造血细胞的细胞数目。可以经由计算机断层扫描或超声成像来监测细胞或组织的结构发展。
[0470]
取决于移植背景,为了促进细胞或组织移植的移植物植入,方法可以进一步有利地包括在移植之前,在亚致死、致死或超致死条件下调理受试者。
[0471]
如本文使用的,当涉及本发明的受试者的调理时,术语“亚致死”、“致死”和“超致死”指骨髓毒性和/或淋巴细胞毒性处理,当分别应用于受试者的代表性群体时,所述处理通常:对群体的基本上所有成员非致死;对群体中的一些但并非所有成员致死;或在正常无菌条件下对群体的基本上所有成员致死。
[0472]
根据本发明的一些实施方案,亚致死性、致死性或超致死性调理包括全身照射(tbi)、全淋巴照射(tli,即所有淋巴结、胸腺和脾的暴露)、身体局部照射(例如,肺、肾、脑等的特异性暴露)、清髓性调理和/或非清髓性调理,例如使用包括但不限于共刺激阻断、化学治疗剂和/或抗体免疫疗法的不同组合。根据本发明的一些实施方案,调理包括任何上述调理方案的组合(例如化学治疗剂和tbi、共刺激阻断和化学治疗剂、抗体免疫疗法和化学治疗剂等)。
[0473]
根据一个实施方案,调理通过在超致死条件下,例如在清髓性条件下(即,其中骨髓细胞被破坏的强化调理方案)调理受试者来实现。
[0474]
可替代地,调理可以通过在致死或亚致死条件下调理受试者,例如分别通过在骨髓减少性(myeloreductive)条件或非清髓性条件下调理受试者(即,其为侵略性较少的调理方案的降低强度调理)来实现。
[0475]
根据一个具体实施方案,调理包含非清髓性调理(例如,降低强度的调理方案)。
[0476]
根据一个实施方案,在细胞或组织移植物的移植之前,降低强度的调理进行最多2周(例如1-10或1-7天)。
[0477]
根据一个具体实施方案,非清髓性调理包含化学治疗剂和tbi/tli。
[0478]
根据一个实施方案,tbi包含在0.5-1 gy、0.5-1.5 gy、0.5-2 gy、0.5-2.5 gy、0.5-5 gy、0.5-7.5 gy、0.5-10 gy、0.5-15 gy、1-1.5 gy、1-2 gy、1-2.5 gy、1-3 gy、1-3.5 gy、1-4 gy、1-4.5 gy、1-5 gy、1-7.5 gy、1-10 gy、2-3 gy、2-4 gy、2-5 gy、2-6 gy、2-7 gy、2-8 gy、2-9 gy、2-10 gy、3-4 gy、3-5 gy、3-6 gy、3-7 gy、3-8 gy、3-9 gy、3-10 gy、4-5 gy、4-6 gy、4-7 gy、4-8 gy、4-9 gy、4-10 gy、5-6 gy、5-7 gy、5-8 gy、5-9 gy、5-10 gy、6-7 gy、6-8 gy、6-9 gy、6-10 gy、7-8 gy、7-9 gy、7-10 gy、8-9 gy、8-10 gy、10-12 gy或10-15 gy范围内的单次或分次照射剂量。
[0479]
根据一个具体实施方案,tbi包含在1-7.5 gy范围内的单次或分次照射剂量。
[0480]
根据一个具体实施方案,tbi包含在1-5 gy范围内的单次或分次照射剂量。
[0481]
根据一个具体实施方案,tbi包含3 gy的单次或分次照射剂量。
[0482]
根据一个实施方案,tbi治疗在移植之前1-10天(例如1-3天)施用于受试者。根据一个实施方案,受试者在移植之前1、2、3或4天用tbi调理一次。
[0483]
根据一个实施方案,tbi在移植之前的第-2天时进行施用。
[0484]
根据一个实施方案,tbi在移植之前的第-1天时进行施用。
[0485]
根据一个实施方案,在移植当天例如在第0天的早晨施用tbi,并且在同一天例如在晚上进行移植。
[0486]
根据一个具体实施方案,tbi包含在第-1天(即移植前一天)时的单次或分次照射剂量。
[0487]
根据一个具体实施方案,tli包含在0.5-1 gy、0.5-1.5 gy、0.5-2.5 gy、0.5-5 gy、0.5-7.5 gy、0.5-10 gy、0.5-15 gy、1-1.5 gy、1-2 gy、1-2.5 gy、1-3 gy、1-3.5 gy、1-4 gy、1-4.5 gy、1-1.5 gy、1-7.5 gy、1-10 gy、2-3 gy、2-4 gy、2-5 gy、2-6 gy、2-7 gy、2-8 gy、2-9 gy、2-10 gy、3-4 gy、3-5 gy、3-6 gy、3-7 gy、3-8 gy、3-9 gy、3-10 gy、4-5 gy、4-6 gy、4-7 gy、4-8 gy、4-9 gy、4-10 gy、5-6 gy、5-7 gy、5-8 gy、5-9 gy、5-10 gy、6-7 gy、6-8 gy、6-9 gy、6-10 gy、7-8 gy、7-9 gy、7-10 gy、8-9 gy、8-10 gy、10-12 gy、10-15 gy、10-20 gy、10-30 gy、10-40 gy、10-50 gy、0.5-20 gy、0.5-30 gy、0.5-40 gy或0.5-50 gy范围内的照射剂量。
[0488]
根据一个具体实施方案,tli包含在1-7.5 gy范围内的单次或分次照射剂量。
[0489]
根据一个具体实施方案,tli包含在1-5 gy范围内的单次或分次照射剂量。
[0490]
根据一个具体实施方案,tli包含3 gy的单次或分次照射剂量。
[0491]
根据一个实施方案,tli治疗在移植之前1-10天(例如1-3天)施用于受试者。根据一个实施方案,受试者在移植之前1、2、3或4天用tli调理一次。
[0492]
根据一个实施方案,tli在移植之前的第-2天时进行施用。
[0493]
根据一个实施方案,tli在移植之前的第-1天时进行施用。
[0494]
根据一个实施方案,在移植当天例如在第0天的早晨施用tli,并且在同一天例如在晚上进行移植。
[0495]
根据一个具体实施方案,tli包含在第-1天(即移植前一天)时的单次或分次照射剂量。
[0496]
根据一个实施方案,调理包含化学治疗剂。示例性的化学治疗剂包括但不限于白消安、白舒非、环磷酰胺、氟达拉滨、美法仑、马利兰、雷帕霉素、曲奥舒凡和噻替派。化学治疗剂可以在移植之前以单一剂量或几个剂量,例如2、3、4、5、6、7、8、9、10个或更多个剂量(例如日剂量)施用于受试者。
[0497]
根据一个具体实施方案,受试者在移植之前(例如在第-7至-4天时,例如在-6至-3天时)连续3、4、5或6天(例如连续4天)施用化学治疗剂(例如以30 mg/m2/天的剂量的氟达拉滨)。
[0498]
氟达拉滨例如在商品名例如fludara下,从例如sanofi genzyme、bayer和teva商购可得。
[0499]
根据一个实施方案,移植前调理包含体内t细胞减灭。
[0500]
根据一些实施方案,体内t细胞减灭通过抗体来实现。
[0501]
根据本发明的一些实施方案,抗体包含抗cd8抗体、抗cd4抗体或两者。
[0502]
根据本发明的一些实施方案,抗体包含抗胸腺细胞球蛋白(atg)抗体、抗cd52抗体或抗cd3 (okt3)抗体。
[0503]
根据一个实施方案,抗体在移植之前以单一剂量或几个剂量,例如2、3、4、5、6、7、8、9、10个或更多个剂量(例如日剂量)施用于受试者。
[0504]
根据一个具体实施方案,受试者在移植之前(例如在移植之前的第-10至-8天时,例如在移植之前的第-9至-7天时)连续2、3、4或5天(例如连续3天)施用抗体治疗剂(例如,如以约2 mg/kg理想体重的剂量的atg)。
[0505]
根据一个具体实施方案,受试者在移植之前用atg的三次施用进行治疗(例如在移植之前的第-9、-8和-7天时,例如以约2 mg/kg理想体重的剂量)。
[0506]
根据一个具体实施方案,受试者在移植之前用atg的两次施用进行治疗(例如在移植之前的第-9和-8、或-8和-7天时,例如以约2 mg/kg理想体重的剂量)。
[0507]
根据一个具体实施方案,受试者在移植之前用atg的一次施用进行治疗(例如在移植之前的第-9、-8或-7天时,例如以约2 mg/kg理想体重的剂量)。
[0508]
根据一个具体实施方案,移植前调理不包含体内t细胞减灭。
[0509]
根据一个具体实施方案,受试者在移植之前并未用atg进行治疗。
[0510]
应了解当不使用atg或使用较低剂量的atg例如单个剂量或两个剂量(例如各自以约2 mg/kg理想体重的剂量)时,可以使用较高的辐射剂量作为非清髓性细胞调理方案的部分(例如以3-5 gy,例如3 gy、4 gy或5 gy的单次或分次照射剂量的tbi)。
[0511]
抗胸腺细胞球蛋白(atg)抗体例如在商品名例如thymoglobulin和atgam下,从例如genzyme和pfizer商购可得。
[0512]
根据一个实施方案,当受试者患有b细胞恶性肿瘤时,移植前的调理方案包含利妥昔单抗(例如在移植之前的第-12、-11、-10、-9、-8或-7天时,例如在第-10天时,例如以约375 mg/m2的剂量)。
[0513]
利妥昔单抗例如在商品名例如mabthera、rixathon、truxima、rituxan下,从例如genentech和roche商购可得。
[0514]
根据一个实施方案,方法包括治疗有效量的环磷酰胺的移植后施用。
[0515]
根据一个实施方案,除如本文所述的在移植之后的施用之外,本发明还进一步考虑了在移植之前(例如在移植之前的第6、5、4或3天,即d-6至-3时)的环磷酰胺施用。
[0516]
例如,在细胞或组织移植的情况下,环磷酰胺的治疗有效量包含约1-25 mg、1-50 mg、1-75 mg、1-100 mg、1-250 mg、1-500 mg、1-750 mg、1-1000 mg、5-50 mg、5-75 mg、5-100 mg、5-250 mg、5-500 mg、5-750 mg、5-1000 mg、10-50 mg、10-75 mg、10-100 mg、10-250 mg、10-500 mg、10-750 mg、10-1000 mg、25-50 mg、25-75 mg、25-100 mg、25-125 mg、25-200 mg、25-300 mg、25-400 mg、25-500 mg、25-750 mg、25-1000 mg、50-75 mg、50-100 mg、50-125 mg、50-150 mg、50-175 mg、50-200 mg、50-250 mg、50-500 mg、50-1000 mg、75-100 mg、75-125 mg、75-150 mg、75-250 mg、75-500 mg、75-1000 mg、100-125 mg、100-150 mg、100-200 mg、100-300 mg、100-400 mg、100-500 mg、100-1000 mg、125-150 mg、125-250 mg、125-500 mg、125-1000 mg、150-200 mg、150-300 mg、150-500 mg、150-1000 mg、200-300 mg、200-400 mg、200-500 mg、200-750 mg、200-1000 mg、250-500 mg、250-750 mg、250-1000 mg/千克受试者的理想体重。
[0517]
根据一个具体实施方案,环磷酰胺的治疗有效量为约25-200 mg/千克受试者的理想体重。
[0518]
根据一个实施方案,环磷酰胺以单一剂量施用。
[0519]
根据一个实施方案,环磷酰胺以多重剂量,例如以2、3、4、5个或更多个剂量施用。
[0520]
根据一个具体实施方案,环磷酰胺以两个剂量施用。
[0521]
每次环磷酰胺施用的剂量可以包含约5 mg、7.5 mg、10 mg、20 mg、30 mg、40 mg、50 mg、60 mg、70 mg、80 mg、90 mg、100 mg、110 mg、120 mg、130 mg、140 mg、150 mg、160 mg、170 mg、180 mg、190 mg、200 mg、210 mg、220 mg、230 mg、240 mg、250 mg、260 mg、270 mg、280 mg、290 mg、300 mg、350 mg、400 mg、450 mg或500 mg/千克受试者的理想体重。
[0522]
根据一个具体实施方案,环磷酰胺的每个剂量为50 mg/千克受试者的理想体重。
[0523]
如所提到的,环磷酰胺在移植后进行施用。因此,例如,环磷酰胺可以在移植后1、2、3、4、5天(即d+1、+2、+3、+4、+5)施用于受试者。
[0524]
根据一个具体实施方案,环磷酰胺在移植后3和4天以两个剂量施用于受试者。
[0525]
环磷酰胺在endoxan、cytoxan、neosar、procytox和revimmune的商品名下,从例如zydus (german remedies)、roxane laboratories inc-boehringer ingelheim、bristol-myers squibb co
ꢀ‑ꢀ
mead johnson and co和pfizer
ꢀ‑ꢀ
pharmacia & upjohn商购可得。
[0526]
根据一个实施方案,受试者用另外的支持性药物例如化学疗法辅助剂进行治疗。
[0527]
根据一个实施方案,临在环磷酰胺的第一剂量之前(例如在环磷酰胺的第一剂量之前的2小时、1小时、30分钟、15分钟),用美司钠的一个剂量(例如10 mg/kg借道静脉输液法(intravenous piggy back,ivpb))来治疗受试者。根据一个实施方案,每4小时重复一次美司钠的施用,总共10个剂量。
[0528]
美司钠在uromitexan和mesnex的商品名下,从例如baxter商购可得。
[0529]
根据一个实施方案,受试者在每个剂量的环磷酰胺(cy)之前用昂丹司琼(或另一种止吐剂)进行治疗。
[0530]
根据一个实施方案,受试者并未用免疫抑制剂(例如除了cy和本文讨论的反抑细
胞之外)进行治疗。
[0531]
根据一个实施方案,受试者用免疫抑制剂进行治疗。
[0532]
免疫抑制剂的实例包括但不限于他克莫司(也被称为fk-506或藤霉素,商品名:prograf、advagraf、protopic)、霉酚酸酯、霉酚酸钠、泼尼松、氨甲蝶呤、环磷酰胺、环孢菌素、环孢素a、氯喹、羟氯喹、柳氮磺胺吡啶(柳氮磺吡啶)、金盐、d-青霉胺、来氟米特、硫唑嘌呤、阿那白滞素、英夫利昔单抗(remicade)、依那西普、tnfα阻滞剂、靶向炎性细胞因子的生物制剂和非甾体抗炎药(nsaid)。nsaid的实例包括但不限于乙酰水杨酸、胆碱水杨酸镁、二氟尼柳、水杨酸镁、双水杨酯、水杨酸钠、双氯芬酸、依托度酸、非诺洛芬、氟比洛芬、消炎痛、酮洛芬、酮咯酸、甲氯芬酸、萘普生、萘丁美酮、保泰松、吡罗昔康、舒林酸、托美丁、对乙酰氨基酚、布洛芬、cox-2抑制剂、曲马多、雷帕霉素(西罗莫司)和雷帕霉素类似物(如cci-779、rad001、ap23573)。这些药剂可以个别地或组合地进行施用。
[0533]
根据一个实施方案,不施用皮质类固醇作为对反抑细胞的预处理。
[0534]
根据本发明的另一个方面,提供了治疗需要未成熟造血细胞移植的受试者的方法,该方法包括:(a)在非清髓性移植前调理方案下调理受试者,其中所述非清髓性调理包含全身照射(tbi)和化学治疗剂,其中所述tbi和化学治疗剂在移植之前的第-7至-1天时(例如在移植之前的第-7至-2天时或在第-6至-1天时)施用;(b)将一定剂量的t细胞耗尽的未成熟造血细胞移植到受试者内,其中所述t细胞耗尽的未成熟造血细胞包含少于5 x 105个cd3
+ t细胞/千克受试者的理想体重,并且其中所述t细胞耗尽的未成熟造血细胞包含至少5 x 106个cd34
+
细胞/千克受试者的理想体重;(c)向受试者施用治疗有效量的环磷酰胺,其中所述环磷酰胺的治疗有效量包含25-200 mg环磷酰胺/千克受试者的理想体重,并且其中所述治疗有效量的环磷酰胺将在t细胞耗尽的未成熟造血细胞移植之后3和4天以两个剂量施用于受试者;和(d)向受试者施用治疗有效量的本发明的一些实施方案的非gvhd诱导细胞的分离群体,其中所述非gvhd诱导细胞的分离群体在t细胞耗尽的未成熟造血细胞移植之后的第7天时施用,从而治疗需要未成熟造血细胞移植的受试者。
[0535]
根据一个具体实施方案,在t细胞耗尽的未成熟造血细胞的移植当天,例如在第0天的早晨施用tbi,并且在同一天例如在晚上进行移植。
[0536]
根据一个具体实施方案,受试者如下进行治疗:在第-6天至第-3天时(在移植之前),以4个连续剂量(例如30 mg/m2/天),将氟达拉滨施用于受试者,在移植之前的第-1天时,以单次或分次的照射剂量(例如3-5 gy,例如3 gy),将tbi施用于受试者,在第0天时(即移植当天),受试者用包含cd34
+
选择的细胞和/或cd3/cd19耗尽的细胞的大剂量t细胞耗尽的未成熟造血细胞(例如,在供体动员后收集,耗尽cd3/cd19表达细胞和/或选择cd34的表达,冷冻保存并在移植当天解冻的细胞,如本文所述的)进行输注(例如iv),在第+3和+4天时,受试者用各自以例如50 mg/kg理想体重/天的剂量的环磷酰胺(cy)进行施用(例如iv),并且在第+7天时,受试者用本发明的一些实施方案的抗病毒反抑细胞,以例如2.5-10 x 106个cd8
+
细胞/kg理想体重进行输注。
[0537]
根据一个具体实施方案,受试者在-9至-7天时(在移植之前)用以3个连续剂量(例
如2 mg/kg理想体重)的atg (thymoglobulin)进行施用。
[0538]
根据一个具体实施方案,受试者如下进行治疗:在第-7天至第-4天时(在移植之前),以4个连续剂量(例如30 mg/m2/天),将氟达拉滨施用于受试者,在移植之前的第-2天时,以单次或分次的照射剂量(例如3-5 gy,例如3 gy),将tbi施用于受试者,在第-1天时,受试者用包含cd34
+
选择的细胞的大剂量t细胞耗尽的未成熟造血细胞(例如,在供体动员后收集,并且选择cd34的表达,并且作为新鲜细胞使用的细胞,如本文所述的)的第一剂量进行输注(例如iv),在第0天时,受试者用包含cd3/cd19耗尽的细胞的大剂量t细胞耗尽的未成熟造血细胞(例如,在供体动员后收集,耗尽cd3/cd19表达细胞,并且作为新鲜细胞使用的细胞,如本文所述的)的第二剂量进行输注(例如iv),在第+3和+4天时,受试者用各自以例如50 mg/kg理想体重/天的剂量的环磷酰胺(cy)进行施用(例如iv),并且在第+7天时,受试者用本发明的一些实施方案的抗病毒反抑细胞,以例如2.5-10 x 106个cd8
+
细胞/kg理想体重进行输注。
[0539]
根据一个具体实施方案,受试者在-10至-8天时(在移植之前)用以3个连续剂量(例如2 mg/kg理想体重)的atg (thymoglobulin)进行施用。
[0540]
根据一个具体实施方案,临在环磷酰胺的第一剂量之前,用美司钠的一个剂量(例如10 mg/kg借道静脉输液法(ivpb))来治疗受试者。根据一个实施方案,这每4小时重复一次,总共10个剂量。
[0541]
根据一个具体实施方案,受试者在每个剂量的环磷酰胺(cy)之前用昂丹司琼(或另一种止吐剂)进行治疗。
[0542]
根据一个具体实施方案,用于反抑细胞的预处理不包括皮质类固醇。
[0543]
根据一个具体实施方案,当受试者患有b细胞恶性肿瘤时,移植前的调理方案包含利妥昔单抗(例如在移植之前的第-10天时,例如以约375 mg/m2的剂量)。
[0544]
移植前和移植后免疫抑制药物和/或免疫抑制照射的施用次数和治疗有效量,可以考虑到移植的类型和受试者对方案的应答根据需要进行调整。尤其是鉴于本文提供的详细公开内容,施用次数和治疗有效量的确定完全在本领域技术人员的能力内。
[0545]
无论移植类型如何,为了避免移植物排斥和移植物抗宿主病(ghvd)和/或诱导供体特异性耐受,本发明的方法利用了新型tcm细胞(如上文详细描述的)。
[0546]
根据一个实施方案,本发明的一些实施方案的包含tcm表型的非gvhd诱导细胞(即反抑细胞)本身用于减少移植物排斥和或减少(例如从同一供体移植的)移植细胞、组织或器官的gvhd。
[0547]
根据一个实施方案,包含tcm表型的非gvhd诱导细胞(即反抑细胞)用于与细胞或组织移植物的移植同时、在其之前或之后施用。
[0548]
根据一个实施方案,包含tcm表型的非gvhd诱导细胞(即反抑细胞)用于与未成熟造血细胞(例如t细胞耗尽的未成熟造血细胞)的移植同时、在其之前或之后施用。
[0549]
根据一个具体实施方案,包含tcm表型的非gvhd诱导细胞(即反抑细胞)用于在非同基因细胞或组织移植之后施用。
[0550]
根据一个具体实施方案,包含tcm表型的非gvhd诱导细胞(即反抑细胞)用于在未成熟造血细胞(例如t细胞耗尽的未成熟造血细胞)之后施用。
[0551]
根据一个实施方案,包含tcm表型的非gvhd诱导细胞(即反抑细胞)用于在非同基
因细胞或组织移植(例如t细胞耗尽的未成熟造血细胞)之后的第3、4、5、6、7、8、9、10、12、14、21天时施用。
[0552]
根据一个实施方案,包含tcm表型的非gvhd诱导细胞(即反抑细胞)用于在未成熟造血细胞(例如t细胞耗尽的未成熟造血细胞)之后的第3、4、5、6、7、8、9、10、12、14、21天时施用。
[0553]
根据一个具体实施方案,包含tcm表型的非gvhd诱导细胞(即反抑细胞)用于在非同基因细胞或组织移植(例如未成熟造血细胞,例如t细胞耗尽的未成熟造血细胞)之后的第6-9天时施用。
[0554]
根据一个具体实施方案,包含tcm表型的非gvhd诱导细胞(即反抑细胞)用于在非同基因细胞或组织移植之后的第9天时施用。
[0555]
根据一个具体实施方案,包含tcm表型的非gvhd诱导细胞(即反抑细胞)用于在非同基因细胞或组织移植之后的第8天时施用。
[0556]
根据一个具体实施方案,包含tcm表型的非gvhd诱导细胞(即反抑细胞)用于在非同基因细胞或组织移植之后的第7天时施用。
[0557]
根据一个具体实施方案,包含tcm表型的非gvhd诱导细胞(即反抑细胞)用于在非同基因细胞或组织移植之后的第6天时施用。
[0558]
根据一个具体实施方案,包含tcm表型的非gvhd诱导细胞(即反抑细胞)用于在未成熟造血细胞(例如t细胞耗尽的未成熟造血细胞)之后的第9天时施用。
[0559]
根据一个具体实施方案,包含tcm表型的非gvhd诱导细胞(即反抑细胞)用于在未成熟造血细胞(例如t细胞耗尽的未成熟造血细胞)之后的第8天时施用。
[0560]
根据一个具体实施方案,包含tcm表型的非gvhd诱导细胞(即反抑细胞)用于在未成熟造血细胞(例如t细胞耗尽的未成熟造血细胞)之后的第7天时施用。
[0561]
根据一个具体实施方案,包含tcm表型的非gvhd诱导细胞(即反抑细胞)用于在未成熟造血细胞(例如t细胞耗尽的未成熟造血细胞)之后的第6天时施用。
[0562]
根据一个具体实施方案,当反抑细胞用作从实体器官或组织中获得的细胞或组织(例如,如上文讨论的肾、肺细胞、肝细胞、胰腺细胞、心脏细胞等)移植的辅助治疗时,反抑细胞可以在细胞或组织移植物的移植同时、在其之前或之后施用。
[0563]
根据一个具体实施方案,当进行未成熟造血细胞(例如t细胞耗尽的未成熟造血细胞)以及从实体器官或组织中获得的细胞或组织(例如,如上文讨论的肾、肺细胞、肝细胞、胰腺细胞、心脏细胞等)的共移植时,反抑细胞、未成熟造血细胞和细胞或组织可以按任何次序进行施用(例如肾、未成熟造血细胞和反抑细胞;未成熟造血细胞、肾和反抑细胞等)。
[0564]
根据一个具体实施方案,当进行未成熟造血细胞(例如t细胞耗尽的未成熟造血细胞)以及从实体器官或组织中获得的细胞或组织(例如,如上文讨论的肾、肺细胞、肝细胞、胰腺细胞、心脏细胞等)的共移植时,施用反抑细胞和未成熟造血细胞,并且仅在嵌合状态建立之后移植细胞或组织移植物(例如未成熟造血细胞、反抑细胞和肾)。
[0565]
根据一个具体实施方案,未成熟造血细胞可以以单一施用进行施用,所述单一施用例如包含cd3
+
/cd19
+
耗尽的cd34+细胞(例如当使用在移植当天解冻的冷冻保存的细胞时)。
[0566]
根据一个具体实施方案,未成熟造血细胞可以以两次或更多次施用进行施用,所
述两次或更多次施用例如包含cd34
+
选择的细胞的第一次施用、以及包含cd3
+
/cd19
+
耗尽的细胞的第二次施用(例如当使用新鲜细胞,即在约1、2、3、4、5、6、7、8、9或10天内,例如在约1天内收集且使用的细胞时)。应了解,这些可以伴随地或在彼此之后(例如在同一天时或在彼此的1、2、3、4、5天内)施用。
[0567]
本发明的一些实施方案的包含tcm表型的非gvhd诱导细胞可以经由本领域已知的用于细胞移植的任何方法进行施用,所述方法例如但不限于细胞输注(例如静脉内)或经由腹膜内途径。
[0568]
根据一个实施方案,包含tcm表型的非gvhd诱导细胞作为新鲜细胞使用。
[0569]
根据一个实施方案,包含tcm表型的非gvhd诱导细胞进行冷冻保存。
[0570]
本发明的一些实施方案的包含tcm表型的非gvhd诱导细胞可以本身,或者在其中它与合适的载体或赋形剂混合的药物组合物中施用于生物。
[0571]
同样地,本发明的一些实施方案的细胞或组织移植,例如未成熟造血细胞(例如t细胞耗尽的未成熟造血细胞)可以本身,或者在其中它与合适的载体或赋形剂混合的药物组合物中施用于生物。
[0572]
如本文使用的,“药物组合物”指本文所述的一种或多种活性成分与其它化学组分,例如生理学上合适的载体和赋形剂的制剂。药物组合物的目的是促进化合物对生物的施用。
[0573]
在本文中,“活性成分”指负责生物效应的tcm细胞。
[0574]
在下文,可以互换使用的短语“生理学上可接受的载体”和“药学上可接受的载体”指这样的载体或稀释剂,其不引起对生物的明显刺激,并且不取消所施用化合物的生物活性和特性。佐剂包括在这些短语下。
[0575]
在本文中,“赋形剂”指加入药物组合物中,以进一步促进活性成分的施用的惰性物质。赋形剂的实例包括但不限于碳酸钙、磷酸钙、各种类型的糖和淀粉、纤维素衍生物、明胶、植物油和聚乙二醇。
[0576]
关于药物配制和施用的技术可以在“remington’s pharmaceutical sciences,
”ꢀ
mack publishing co.,easton,pa,最新版本中找到,所述参考文献通过引用引入本文。
[0577]
合适的施用途径可以例如包括经口,直肠,经粘膜,尤其是经鼻、肠或肠胃外递送,包括肌内、皮下和髓内注射,以及鞘内、直接心室内、心内例如在右心室腔或左心室腔内、在普通冠状动脉内、静脉内、腹膜内、鼻内或眼内注射。
[0578]
用于对中枢神经系统(cns)的药物递送的常规方法包括:神经外科策略(例如,脑内注射或脑室内输注);在利用bbb的内源性转运途径之一的尝试中,试剂的分子操作(例如,产生嵌合融合蛋白,其包含与本身不能跨越bbb的试剂组合的对于内皮细胞表面分子具有亲和力的转运肽);设计为增加试剂的脂溶性的药理学策略(例如,水溶性试剂与脂质或胆固醇载体的缀合);以及通过高渗破坏(起因于甘露糖醇溶液输注到颈动脉内或使用生物活性剂如血管紧张素肽)来暂时破坏bbb的完整性。然而,这些策略各自具有局限性,例如与侵入性手术操作相关的固有风险、由内源性转运系统固有的局限性施加的尺寸限制、与包含在cns外部可以是活性的载体基序的嵌合分子的全身施用相关的潜在地不希望有的生物副作用、以及在其中bbb被破坏的脑区域内可能的脑损伤风险,这致使其成为亚最佳的递送方法。
[0579]
可替代地,可以例如经由将药物组合物直接注射到患者的组织区域内,以局部而不是全身方式施用药物组合物。
[0580]
本发明的一些实施方案的药物组合物可以通过本领域众所周知的工艺来制造,例如,借助于常规混合、溶解、制粒、糖衣丸制备、水飞(levigating)、乳化、包囊、包埋或冻干工艺。
[0581]
因此,用于根据本发明的一些实施方案使用的药物组合物可以以常规方式,使用包含赋形剂和助剂的一种或多种生理学上可接受的载体进行配制,所述载体促进活性成分加工成可以在药学上使用的制剂。适当的制剂取决于选择的施用途径。
[0582]
对于注射,药物组合物的活性成分可以在水溶液中进行配制,优选在生理学相容的缓冲液中,例如汉克氏溶液、林格氏溶液或生理盐缓冲液。对于经粘膜施用,在制剂中使用对于待渗透的屏障适当的渗透剂。此类渗透剂是本领域一般已知的。
[0583]
对于经口施用,可以通过将活性化合物与本领域众所周知的药学上可接受的载体组合,来容易地配制药物组合物。此类载体使得药物组合物能够被配制为片剂、丸剂、糖衣丸、胶囊、液体、凝胶、糖浆剂、浆料、悬浮液等等,用于被患者经口摄取。用于经口使用的药物制剂可以通过以下进行制备:使用固体赋形剂,任选地研磨所得到的混合物,并且在需要时加入合适的助剂后,加工颗粒的混合物,以获得片剂或糖衣丸芯。合适的赋形剂特别是填料,例如糖,包括乳糖、蔗糖、甘露糖醇或山梨糖醇;纤维素制剂,例如玉蜀黍淀粉、小麦淀粉、大米淀粉、马铃薯淀粉、明胶、黄蓍树胶、甲基纤维素、羟丙基甲基纤维素、羧甲基纤维素钠;和/或生理学上可接受的聚合物,例如聚乙烯吡咯烷酮(pvp)。需要时,可以加入崩解剂,例如交联的聚乙烯吡咯烷酮、琼脂或海藻酸或其盐例如海藻酸钠。
[0584]
糖衣丸芯提供有合适的包衣。为此,可以使用浓缩的糖溶液,其可以任选地含有阿拉伯树胶、滑石、聚乙烯吡咯烷酮、卡波姆凝胶、聚乙二醇、二氧化钛、漆溶液和合适的有机溶剂或溶剂混合物。可以将染料或色素加入片剂或糖衣丸包衣中,用于鉴定或表征活性化合物剂量的不同组合。
[0585]
可以经口使用的药物组合物包括由明胶制成的推入配合胶囊,以及由明胶和增塑剂如甘油或山梨糖醇制成的密封软胶囊。推入配合胶囊可以含有与填料如乳糖、粘合剂如淀粉、润滑剂如滑石或硬脂酸镁以及任选的稳定剂混合的活性成分。在软胶囊中,活性成分可以溶解或悬浮于合适的液体中,所述液体例如脂肪油、液体石蜡或液体聚乙二醇。另外,可以添加稳定剂。用于经口施用的所有制剂应该为适合于选择的施用途径的剂量。
[0586]
对于颊部施用,组合物可以采取以常规方式配制的片剂或锭剂的形式。
[0587]
对于通过鼻吸入的施用,用于根据本发明的一些实施方案使用的活性成分,以来自加压包装或喷雾器的气溶胶喷雾呈现的形式方便地递送,其中使用合适的推进剂,例如二氯二氟甲烷、三氯氟甲烷、二氯四氟乙烷或二氧化碳。在加压气溶胶的情况下,剂量单位可以通过提供阀门以递送计量的量来确定。可以配制用于分配器中的例如明胶的胶囊和药液筒,其含有化合物和合适的粉末基质例如乳糖或淀粉的粉末混合物。
[0588]
本文所述的药物组合物可以配制用于肠胃外施用,例如通过推注或连续输注。用于注射的制剂可以以单位剂型存在于例如安瓿或多剂量容器中,具有任选添加的防腐剂。组合物可以是在油性或水性媒介物中的悬浮液、溶液或乳剂,并且可以含有配制试剂例如助悬剂、稳定剂和/或分散剂。
[0589]
用于肠胃外施用的药物组合物包括以水溶性形式的活性制剂的水溶液。另外,可以将活性成分的悬浮液制备为适当地基于油或水的注射悬浮液。合适的亲脂性溶剂或媒介物包括脂肪油例如芝麻油,或者合成脂肪酸酯例如油酸乙酯、甘油三酯或脂质体。水性注射悬浮液可以含有增加悬浮液的粘度的物质,例如羧甲基纤维素钠、山梨糖醇或葡聚糖。任选地,悬浮液还可以含有合适的稳定剂或增加活性成分的溶解度的试剂,以允许制备高度浓缩的溶液。
[0590]
可替代地,活性成分可以是粉末形式,用于在使用前由合适的媒介物例如无菌、无热原的水基溶液复溶。
[0591]
本发明的一些实施方案的药物组合物也可以使用例如常规的栓剂基质,例如可可脂或其它甘油酯配制成直肠组合物,例如栓剂或保留灌肠剂。
[0592]
根据一个实施方案,包含tcm表型的非gvhd诱导细胞配制用于作为新鲜细胞施用。
[0593]
根据一个实施方案,包含tcm表型的非gvhd诱导细胞配制用于作为冷冻保存的细胞施用。
[0594]
适用于本发明的一些实施方案的背景下的药物组合物包括这样的组合物,其中活性成分以有效达到预期目的的量包含。更具体而言,治疗有效量意指活性成分(非gvhd诱导的tcm细胞)的量,其对于耐受性(即反抑效应)、抗疾病效应、抗肿瘤效应和/或免疫重建有效,而不诱导gvhd。由于本发明的tcm细胞在移植之后归巢到淋巴结,因此可能需要较少的细胞量(与先前使用的细胞剂量相比,参见例如wo 2001/049243),以实现细胞的有益效应(例如耐受性、抗疾病效应、抗肿瘤效应和/或免疫重建)。应了解,与本发明的tcm细胞结合,可能需要较低水平的免疫抑制药物(上文讨论的)。同样地,与本发明的tcm细胞结合,可能需要较低水平的非清髓性药物(上文讨论的) (例如从移植前调理方案中排除atg)。
[0595]
尤其是按照本文提供的详细公开内容,治疗有效量的确定完全在本领域技术人员的能力内。
[0596]
对于本发明的方法中使用的任何制剂,治疗有效量或剂量可以最初从体外和细胞培养测定进行估计。例如,可以在动物模型中制定剂量,以达到所需的浓度或滴度。此类信息可以用于更准确地确定在人中的有用剂量。
[0597]
例如,在细胞移植(例如大剂量t细胞耗尽的未成熟造血细胞移植,如下文讨论的)的情况下,输注给受试者的tcm细胞数目应该多于1 x 106个细胞/kg克理想体重。输注给受试者的tcm细胞数目通常应该在以下范围内:0.01 x 106至20 x 106个细胞/kg理想体重、0.01 x 106至0.5 x 106个细胞/kg理想体重、0.01 x 106至1 x 106个细胞/kg理想体重、0.01 x 106至5 x 106个细胞/kg理想体重、0.1 x 106至0.5 x 106个细胞/kg理想体重、0.1 x 106至1 x 106个细胞/kg理想体重、0.1 x 106至5 x 106个细胞/kg理想体重、0.5 x 106至1 x 106个细胞/kg理想体重、0.5 x 106至1 x 106个细胞/kg理想体重、0.5 x 106至5 x 106个细胞/kg理想体重、1 x 106至5 x 106个细胞/kg理想体重、1 x 106至20 x 106个细胞/kg理想体重、5 x 106至20 x 106个细胞/kg理想体重、10 x 106至15 x 106个细胞/kg理想体重、10 x 106至20 x 106个细胞/kg理想体重或15 x 106至20 x 106个细胞/kg理想体重。
[0598]
根据一个具体实施方案,输注给受试者的tcm细胞的剂量为约2.5 x 106个cd8
+
细胞/kg理想体重。
[0599]
根据一个具体实施方案,输注给受试者的tcm细胞的剂量为约5 x 106个cd8
+
细胞/
kg理想体重。
[0600]
根据一个具体实施方案,输注给受试者的tcm细胞的剂量为约10 x 106个cd8
+
细胞/kg理想体重。
[0601]
如本文使用的,术语“理想体重”指临床上用于调整药物给药、帮助估计肾功能和药代动力学(例如在肥胖患者中)的测量。
[0602]
用于估计理想体重(kg)的公式如下:男性:ibw = 50 kg +对于超过5英寸的每英寸2.3 kg女性:ibw = 45.5 kg +对于超过5英寸的每英寸2.3 kg理想体重在peterson等人[am j clin nutr 2016;103:1197
–
203]中详细讨论,所述参考文献通过引用引入本文。
[0603]
本文所述的活性成分的毒性和治疗功效可以通过体外标准药学程序、以细胞培养物或实验动物来确定。从这些体外和细胞培养测定以及动物研究中获得的数据可以用于制定用于在人中使用的剂量范围。剂量可以根据采用的剂型和利用的施用途径而变。确切的制剂、施用途径和剂量可以由各个医生考虑到患者的状况加以选择。(参见例如,fingl等人,1975,于"the pharmacological basis of therapeutics",第1章,第1页)。
[0604]
剂量的量和间隔可以个别地进行调整,以提供足以诱导或抑制生物效应的充足的活性成分水平(最小有效浓度,mec)。mec对于每种制剂不同,但可以从体外数据进行估计。达到mec所需的剂量取决于个体特性和施用途径。检测测定可以用于确定血浆浓度。
[0605]
取决于待治疗状况的严重性和响应性,给药可以是单次施用或多次施用,其中治疗过程持续数天至数周,或者直至实现治愈或达到疾病状态的减轻。
[0606]
取决于待治疗状况的严重性和响应性,给药可以是单次施用或多次施用,其中治疗过程持续数天至数周,或者直至实现治愈或达到疾病状态的减轻。
[0607]
当然,待施用的组合物的量取决于待治疗的受试者、病痛的严重性、施用模式、开处方医生的判断等。
[0608]
需要时,本发明的一些实施方案的组合物可以存在于包装或分配器装置,例如fda批准的试剂盒中,其可以包含含有活性成分的一个或多个单位剂型。包装可以例如包含金属箔或塑料箔,例如泡罩包装。包装或分配器装置可能伴随有施用说明书。包装或分配器也可以被伴随容器的通告容纳,所述通告为由管理药品的制造、使用或销售的政府机构规定的形式,所述通告反映了机构批准的组合物的形式或者人或兽医学施用。例如,此类通告可以是由美国食物药品监督管理局(u.s. food and drug administration)批准用于处方药的标签,或者批准的产品插页。如上文进一步详述的,还可以制备包含在相容的药物载体中配制的本发明的制剂的组合物,置于适当的容器中,并且标记用于治疗指示的状况。
[0609]
根据一个实施方案,本发明的一些实施方案的包含tcm表型的非gvhd诱导细胞可以被制造成用于治疗的“现成”产品(例如,作为如上文讨论的用于治疗的反抑细胞)。
[0610]
根据一个实施方案,受试者在移植后不用gvhd预防(例如用皮质类固醇和/或免疫抑制剂)进行长期治疗(例如延长时间段,例如多于8、9、10、12、14、21、25、30、45、60或90天,例如10-21天,例如10或14天)。
[0611]
根据一个实施方案,在造血干细胞移植后复发的情况下,受试者可以通过供体淋巴细胞输注(dli)进行进一步治疗。例如,受试者可以如通过dazzi等人[dazzi,szydlo等
biology"第i-iii卷ausubel,r. m.编辑(1994);ausubel等人,"current protocols in molecular biology",john wiley and sons,baltimore,maryland(1989);perbal,"a practical guide to molecular cloning",john wiley & sons,new york(1988);watson等人,"recombinant dna",scientific american books,new york;birren等人(编辑)"genome analysis: a laboratory manual series",第1-4卷,cold spring harbor laboratory press,new york(1998);如美国专利号4,666,828;4,683,202;4,801,531;5,192,659和5,272,057中所示的方法学;"cell biology: a laboratory handbook",第i-iii卷cellis,j. e.编辑(1994);"current protocols in immunology"第i-iii卷coligan j. e.编辑(1994);stites等人(编辑),"basic and clinical immunology"(第8版),appleton & lange,norwalk,ct(1994);mishell和shiigi(编辑),"selected methods in cellular immunology",w. h. freeman and co.,new york(1980);可用的免疫测定在专利和科学文献中得到广泛描述,参见例如美国专利号3,791,932;3,839,153;3,850,752;3,850,578;3,853,987;3,867,517;3,879,262;3,901,654;3,935,074;3,984,533;3,996,345;4,034,074;4,098,876;4,879,219;5,011,771和5,281,521;"oligonucleotide synthesis" gait,m. j.编辑(1984);“nucleic acid hybridization" hames,b. d.和higgins s. j.编辑(1985);"transcription and translation" hames,b. d.和higgins s. j.编辑(1984);"animal cell culture" freshney,r. i.编辑(1986);"immobilized cells and enzymes" irl press,(1986);"a practical guide to molecular cloning" perbal,b.,(1984),以及"methods in enzymology"第1-317卷,academic press;"pcr protocols: a guide to methods and applications",academic press,san diego,ca (1990);marshak等人,"strategies for protein purification and characterization
ꢀ‑ꢀ
a laboratory course manual" cshl press(1996);所有这些都通过引用引入,如同它在本文中充分阐述一样。本文件自始至终提供了其它一般参考文献。其中的程序被认为是本领域众所周知的,并且为了读者的方便而提供。其中包含的所有信息都通过引用引入本文。
[0624]
实施例1临床方案患者纳入标准
●ꢀ
年龄12-70岁
●ꢀ
诊断为滤泡性淋巴瘤(fl)、套细胞淋巴瘤(mcl)、慢性淋巴细胞性白血病(cll)、多发性骨髓瘤(mm)、霍杰金氏淋巴瘤(hl)、非霍杰金氏淋巴瘤(nhl)、慢性髓样白血病(cml)、骨髓增生性综合征(mpd)、急性髓样白血病(aml)或急性淋巴样白血病(all)的患者。
[0625]
●ꢀ
患有再生障碍性贫血和严重免疫缺陷或非恶性骨髓衰竭状态的患者。
[0626]
●ꢀ
血液恶性肿瘤患者必须具有尽管最初的化学疗法,仍持续或进展的疾病,并且必须已达到稳定疾病或者对其最近的化学疗法的部分应答或完全应答。
[0627]
●ꢀ
细胞供体的可获得性
●ꢀ
karnofsky体力状态≥ 70%
●ꢀ
如通过以下证实的充分的主要器官系统功能:
‑ꢀ
至少40%的左心室射血分数
‑ꢀ
证实对于血红蛋白浓度至少50%预测值的调整扩散能力的肺功能测试(pft)
‑ꢀ
血清肌酐≤ 1.5 mg/dl
‑ꢀ
sgpt ≤ 200 iu/ml
‑ꢀ
胆红素《 1.5 mg/dl (除非吉尔伯特氏综合征)。
[0628]
‑ꢀ
具有生育潜力的女性中的阴性妊娠测试。
[0629]
患者排除标准
●ꢀ
hiv血清阳性。
[0630]
●ꢀ
不受控制的感染或严重的医学或精神状况,其将限制对方案治疗的耐受性。
[0631]
●ꢀ
活动性cns恶性肿瘤。
[0632]
治疗计划存在来自供体的两次收集,即用于制备反抑细胞的一次“未接触抗原的”单核细胞(mnc)、以及用于制备大剂量t细胞耗尽的干细胞移植的动员的外周血祖细胞(pbpc)的第二次收集。两次收集均遵循标准护理程序(soc),并且供体签署soc捐赠同意书。
[0633]
用于产生抗病毒中央型记忆cd8
+
反抑t细胞的未接触抗原的(即非动员的)外周血单核细胞收集可以在任何时间进行,但一般在计划移植日期(即第0天,即d0)前约7天完成。反抑细胞或在其制造结束后新鲜使用,并且将在d+7时输注,或在其制造结束后冷冻保存。
[0634]
如果临床上需要的话,用于大剂量移植的使用g-csf和plerixafor的动员pbpc的收集,可以在用于产生抗病毒中央型记忆cd8
+
反抑细胞的pbmc收集前7天或更长时间完成。可替代地,可以使用新鲜的cd34
+
干细胞,其中在连续三天(第-2天、第-1天和第0天)时执行动员干细胞的收集,同时在第-8天时开始用于反抑细胞的pbmc收集。获得》 10 x 106个cd34
+
细胞/kg理想体重的最佳pbmc细胞剂量目标;需要最低限度5 x 106个cd34
+
细胞/kg理想体重,其包括含有大约1 x 106个cd34
+
细胞/kg理想体重的pbpc的未分级等分试样,以作为在反抑细胞产生不足或移植后移植物失败的情况下的备份冷冻保存,或可用于移植物失败的治疗。如果供体并不耐受该程序,或不能收集足够的细胞剂量,则可以使用替代供体(如果可用的话)。
[0635]
动员的pbpc一般在3天内收集。将前2天的收集合并,并且使用clinimacs装置(miltenyi)选择cd34
+
细胞,该细胞可以新鲜使用(连同第三次收集的细胞一起),或可以冷冻保存。使第三天的收集耗尽cd3
+
/cd19
+
细胞,该细胞可以新鲜使用(连同先前2天收集的细胞一起),或可以冷冻保存。在整个t细胞耗尽的干细胞移植中,最大的t细胞剂量是2 x 105个cd3+细胞/kg理想受体体重。在对剩余的pbpc产物执行cd34
+
细胞选择程序前,从第一天的收集中取出未操纵的pbpc的备用级分。
[0636]
当使用新鲜的cd34
+
选择和cd3
+
/cd19
+
耗尽的干细胞时,这些干细胞通常分别在第-1和0天时进行施用。可替代地,当使用冷冻保存的cd34
+
选择和cd3
+
/cd19
+
耗尽的干细胞时,它们通常在第0天时进行解冻并输注。
[0637]
抗病毒中央型记忆cd8
+
反抑t细胞(反抑细胞)的产生下文的实施例2中提供了用于产生反抑细胞的详细方案。本节段提供了本发明的一些实施方案的简要描述。
[0638]
该方案包含三个步骤:
步骤1:刺激物的制备(第-8到-5天):从pbmc中的单核细胞制备供体dc第-8天:通过白细胞去除术收集大约1 x 10
10
个单核细胞,并且保存过夜。
[0639]
第-7天:通过ficol分离处理细胞,并且其后将单核细胞的一半用于通过cd14磁珠(miltenyi磁珠分选系统)的单核细胞分离。其后,用粒细胞巨噬细胞集落刺激因子(gm-csf)和白细胞介素4 (il-4),使cd14
+
单核细胞分化为未成熟dc。
[0640]
平行地,将cd14
‑ (即cd14阴性)细胞与ficol分离后获得的初始单核细胞的一半组合,并且在il-7的存在下,在37 ℃ 5% o2/co2中贮存过夜。这些细胞在第二天时用于cd8
+
记忆t细胞的富集。
[0641]
第-6天:通过添加包含脂多糖(lps)、干扰素γ (ifnγ)、gm-csf和il-4的细胞因子混合物(cocktail)用于16小时的温育,使dc成熟。
[0642]
第-5天:收获成熟的dc (mdc),用病毒肽混合物装载并进行照射。
[0643]
第2步:制备应答者并且与装载病毒的mdc共培养(第-6天至第-5天):a) 记忆t细胞(cd4-cd56-cd45-)纯化(来自供体pbmc
ꢀ‑ꢀ
应答者)第-6天:使供体cd14-细胞与同il-7一起温育过夜的单核细胞的一半组合,通过磁珠耗尽cd4
+
、cd56
+
和cd45ra
+
细胞,并且在il-7的存在下,在37 ℃ 5% o2/co2中再贮存一晚。
[0644]
b) 应答者(供体)刺激物(装载病毒肽的供体dc)共培养物的建立。
[0645]
第-5天:纯化的记忆应答者t细胞(cd4-cd56-cd45ra-)在il-21的存在下与装载病毒肽的mdc一起温育3天。
[0646]
步骤3:抗病毒反抑tcm的分化和扩增(第-5至+7天):a) 抗病毒中央型记忆cd8
+
反抑t细胞(tcm)的扩增第-5至-2天:仅用il-21启动tcm表型。
[0647]
第-2至+7天:取决于在培养中观察到的扩增,通过根据葡萄糖水平消耗拆分,并且加入补充有下述细胞因子的培养基,对tcm培养物进行扩增:il-7、il-15和il-21。
[0648]
第+7天:细胞的收获和输注。
[0649]
图1中显示了来自预期的pbmc供体的tcm产生和dc制备的大致时间线。细胞在造血干细胞移植后的第+7天时进行收获并输注。
[0650]
抗病毒中央型记忆cd8
+
反抑细胞的等分试样就放行标准和功能性免疫研究进行评价(如下文讨论的)。
[0651]
治疗计划
ꢀ‑ꢀ
调理方案包括新鲜的cd34
+
细胞如图3中所示,从d-10到d-2 (即在移植前的第10至2天)的调理方案包括抗胸腺细胞球蛋白(atg) (从第-10天到第-8天的3个剂量)、氟达拉滨(flu) (从第-7天到第-4天的4个剂量)和3 gy全身照射(tbi) (在第-2天时一次)。在第-1天和第0天时输注t细胞耗尽的干细胞移植物。在移植后的d+3和+4 (即在移植后的第3和4天)时,患者接受环磷酰胺(cy),随后为在移植后的d+7时(即在移植后的第7天时)的反抑细胞输注。b细胞恶性肿瘤患者可以在第-11天时接受利妥昔单抗375 mg/m2。
[0652]
日子和治疗:-11入院/静脉内(iv)水合/rituxan 375 mg/m
2 (用于b细胞恶性肿瘤)-10 atg (thymoglobulin) 2 mg/kg-9 atg (thymoglobulin) 2 mg/kg-8 atg (thymoglobulin) 2 mg/kg-7氟达拉滨30 mg/m
2-6氟达拉滨30 mg/m
2-5氟达拉滨30 mg/m
2-4氟达拉滨30 mg/m
2-3休息(不治疗)-2单次的tbi 3 gy-1大剂量t细胞耗尽的pbpc (含有cd34
+
选择的细胞)的输注0 cd3-/cd19-耗尽的细胞的输注+3环磷酰胺(cy) 50 mg/kg/天iv+4环磷酰胺(cy) 50 mg/kg/天iv+7以如所示的剂量的抗病毒反抑细胞输注。
[0653]
值得注意的是,临在环磷酰胺的第一剂量之前,患者接受美司钠10 mg/kg借道静脉输液法(ivpb)的一个剂量。这每4小时重复一次,总共10个剂量。患者还在环磷酰胺(cy)的每个剂量之前接受昂丹司琼(或其它止吐药)。
[0654]
用于反抑细胞的术前用药不包括皮质类固醇。
[0655]
使用冷冻保存的cd34
+
细胞如图4中所示,从d-9到d-1 (即在移植前的第9至1天),患者接受作为预处理方案的抗胸腺细胞球蛋白(atg)、氟达拉滨(fu)和低剂量的全身照射(tbi)。在移植后的d+3和+4 (即在移植后的第3至4天)时,患者接受环磷酰胺(cy),随后为在移植后的第7天(在移植后的d+7)时的反抑细胞输注。b细胞恶性肿瘤患者可以在第-10天时接受利妥昔单抗375 mg/m2。
[0656]
日子和治疗:-10入院/静脉内(iv)水合/rituxan 375 mg/m
2 (用于b细胞恶性肿瘤)-9 atg (thymoglobulin) 2 mg/kg理想体重-8 atg (thymoglobulin) 2 mg/kg理想体重-7 atg (thymoglobulin) 2 mg/kg理想体重-6氟达拉滨30 mg/m
2-5氟达拉滨30 mg/m
2-4氟达拉滨30 mg/m
2-3氟达拉滨30 mg/m
2-2休息(不治疗)-1单次的tbi 3 gy0大剂量t细胞耗尽的pbpc (含有cd34
+
选择的细胞和cd3
+
/cd19
+
耗尽的细胞)的输注+3环磷酰胺(cy) 50 mg/kg理想体重/天iv
+4环磷酰胺(cy) 50 mg/kg理想体重/天iv+7以如所示的剂量的抗病毒反抑细胞输注。
[0657]
值得注意的是,临在环磷酰胺的第一剂量之前,患者接受美司钠10 mg/kg借道静脉输液法(ivpb)的一个剂量。这每4小时重复一次,总共10个剂量。患者还在环磷酰胺(cy)的每个剂量之前接受昂丹司琼(或其它止吐药)。
[0658]
用于反抑细胞的术前用药不包括皮质类固醇。
[0659]
抗病毒反抑细胞剂量水平
ꢀ‑ꢀ
cd8+细胞剂量递增剂量水平1:2.5 x 106个cd8
+
细胞/kg理想体重剂量水平2:5 x 106个cd8
+
细胞/kg理想体重剂量水平3:10 x 106个cd8
+
细胞/kg理想体重不施用另外的移植后免疫抑制疗法作为gvhd预防。
[0660]
在制造的细胞产物低于计划的剂量水平的情况下的考虑剂量水平1包含2.5 x 106个细胞/kg理想体重。值得注意的是,较低的剂量通常不被视为可接受的。
[0661]
对于剂量水平2,靶剂量是5 x 106个细胞/kg理想体重,然而,2.6至5 x 106个细胞/kg理想体重的剂量被视为足够的,且被视为剂量水平2。
[0662]
对于剂量水平3,靶剂量是10 x 106个细胞/kg理想体重,然而,5.1至10 x 106个细胞/kg理想体重的剂量被视为足够的,且被视为剂量水平3。
[0663]
在研究期间的评估努力遵守事件的时间表和所有方案要求。不影响患者权利和安全的事件时间表和其它方案要求的变化不被视为偏差。此类变化可能包括在时间表之外完成的实验室评价和偶尔错过的所需研究样品。用于相关研究的错过样品并不构成方案的偏差。
[0664]
在移植之前(基线)的评估:用于移植的标准工作以及疾病评价在研究进入之前作为诊断或常规移植前评估的部分完成。下述测试是移植前的标准护理测试,而不是方案特异性的。结果用于确定移植合格性,并且在治疗开始之前不重复。如果治疗在同意后延迟多于30天,则pi或指定人员应该确定哪些(如果有的话)测试需要如临床上指示的进行重复。
[0665]
‑ꢀ
cbc、分类和血小板
‑ꢀ
胆红素、血清肌酐和肌酐清除率、alt、白蛋白、电解质、ldh、碱性磷酸酶
‑ꢀ
传染病小组(肝炎血清学(b、c)、hiv、htlv、i/ii、cmv、tpha筛查)、弓形虫血清学、类圆线虫血清学(如果指示的话)、结核病、irga (如果指示的话)
‑ꢀ
pt和ptt
‑ꢀ
abo和rh分型
‑ꢀ
如果临床上指示的话,则伴随细胞遗传学和分子研究的骨髓抽吸
‑ꢀ
嵌合状态分析基线
‑ꢀ
具有生育潜力的女性中的妊娠测试
‑ꢀ
用dlco的肺功能测试
‑ꢀ
评价左心室ef和肺动脉压的超声心动图
‑ꢀ
胸部x线和ecg
‑ꢀ
用于供体特异性抗hla抗体(dsa)的血清用于本研究中治疗的患者的积极治疗期从预处理方案的开始(第-9天)到移植后的第+42天。这之后,患者具有如临床上指示的直至d+100的随访。其后,根据干细胞移植受体的标准随访,收集疾病复发、感染、急性和慢性gvhd以及存活数据。在一年后,患者从研究中移除。急性gvhd和慢性gvhd根据nih共识标准进行评分。
[0666]
标准后评估标准后评估按照同种异体移植后的soc。骨髓抽吸和外周血
ꢀ–ꢀ
以评估治疗应答、移植物植入、嵌合状态和免疫重建
ꢀ‑ꢀ
每月执行一次,共3个月,并且如临床上指示的。
[0667]
相关研究免疫重建通过流式细胞术免疫表型小组和通过四聚体分析的抗病毒应答进行评价。免疫耐受性测试在移植后大约3个月执行。用于相关研究的错过样品并不构成方案的偏差。
[0668]
急性gvhd的发展通过nih共识标准进行评价且评分。疾病复发或进展通过患者的恶性肿瘤的形态学复发进行评价。收集关于细菌、病毒、真菌和寄生虫感染的数据。慢性gvhd的发展按照nih共识标准[jagasia mh等人national institutes of health consensus development project on criteria for clinical trials in chronic graft-versus-host disease: i. the 2014 diagnosis and staging working group report. biol blood marrow transplant. (2015) 21:389-401 e381]进行描述。
[0669]
表1a:评价表
支持性护理
●ꢀ
无移植后生长因子
●ꢀ
不施用移植后免疫抑制疗法作为gvhd预防。
[0670]
●ꢀ
其它方面的支持性护理如临床上指示的进行施用(例如,在其中移植物植入缓慢的情况下通过g-csf支持,或者通过例如甲泼尼龙、他克莫司或其它免疫抑制用药的gvhd治疗)。在研究期间施用于患者的伴随用药记录在患者的主要医疗记录中。
[0671]
关于抗病毒反抑细胞产生不足的意外情况如果反抑细胞符合放行标准,但细胞剂量低于靶细胞剂量水平:如果剂量》 2.5 x 106个cd8
+
细胞/kg理想体重(剂量水平1),则输注细胞。在这种情况下,通过意向治疗原则,患者按其分配的剂量水平进行评估。
[0672]
如果反抑细胞的剂量少于2.5 x 106个cd8
+
细胞/kg理想体重,或者如果反抑细胞
sample size for prior calibration in bayesian phase i-ii dose-finding.clinical trials. (2014) 11:657-666]。
[0682]
共同的主要结果。为了剂量发现的目的,(1)毒性定义为在反抑细胞输注的42天内的3或4级gvhd,或者因任何原因的死亡;并且(2)功效定义为在反抑细胞输注后的第42天,患者活着并且植入移植物。入选试验,但出于任何原因,在allosct后的第7天时并未接受反抑细胞的患者在样本中进行替换。
[0683]
剂量可接受性。对于两个efftox剂量可接受性原则,关于毒性概率的上限为.20,功效的最小概率为.80,且使用后验概率决定截断.10或两个可接受性标准。如果发现最低剂量水平在高毒性或低功效方面是无法接受的,则终止试验,并且不选择反抑细胞剂量水平。
[0684]
最大样本大小和队列大小。最多24个患者以大小3的至多8个队列进行治疗,其中第一个队列以剂量d=2进行治疗,并且关于后续所有队列的剂量适应地进行选择,以使基于最近的累积数据计算的功效-毒性权衡达到最大。必要时,在各队列之间暂停招募,以确保对于所有先前治疗的患者评估42天的功效和毒性结果两者,以便应用结果适应性原则。
[0685]
先验:关于模型参数的先验根据表1b上给出的引发的平均边缘结果概率,使用efftox程序版本4.0.12进行计算,伴随校准的超方差以获得先验有效样本大小1。
[0686]
表1b:关于每个反抑细胞剂量水平的毒性和功效的引发的先验平均概率 2.5x106个反抑细胞/kg理想体重5x106个反抑细胞/kg理想体重10x106个反抑细胞/kg理想体重 d=1d=2d=3pr(毒性).10.20.30pr(功效).70.80.90
功效-毒性权衡曲线:用于计算权衡曲线的三个等价权衡概率对是(.30,0)、(.55,.30)和(1,.80)。
[0687]
3. 设计操作特性在六种假设的剂量-结果情况下,设计的操作特性(oc)在下文进行概括。计算oc的模拟使用efftox版本4.0.12进行,具有2000次重复/情况,使用模拟种子10502。
[0688]
表2a:设计的操作特性
4. 实施efftox设计使用md anderson cancer center (mdacc) department of biostatistics clinical trial conduct网站www(dot)biostatistics(dot) mdanderson (dot)org/clinicaltrialconduct/进行实施。在试验进行过程中,必要时,应该咨询研究的生物统计学家peter thall或生物统计学部(biostatistics department)指定的统计分析
员。
[0689]
5. 次要结果和数据分析次要结果包括感染、无进展存活(pfs)时间、总体存活(os)时间、巨细胞病毒和免疫重建,其中对于每个患者具有1年的随访期。使用kaplan和meier的方法[kaplan,el和meier,p: nonparametric estimator from incomplete observations. j. american statistical association (1958) 53:457-481],估计时间-事件结果的未调整的分布,并且其与预后协变量和反抑细胞剂量水平的关系通过贝叶斯分段指数存活回归[ibrahim jg,chen m-h,sinha d. bayesian survival analysis. springer,ny (2001)]进行评估。
[0690]
数据和方案管理方案顺应通过临床试验研究者和/或其指定人员,在最初的28天过程中且如临床上指示的,患者每周就毒性和移植物植入进行监测。如果存在意见分歧,则研究主席是毒性的最终仲裁者。
[0691]
从研究中去除的标准患者因下述任一种而退出研究:1)患者参与同意书的撤回。
[0692]
2)用于输注的反抑细胞产物不足。
[0693]
3)疾病的进展。
[0694]
4)需要第二次移植的移植物失败的发展。
[0695]
5)治疗后一年。
[0696]
6)被研究主席认为无法接受的所观察到的毒性增加或意外模式。
[0697]
7)当患者的健康和最佳利益受到损害时,研究者的判断。
[0698]
8)被研究主席视为有损于研究终点评估的不顺应。
[0699]
9)死亡报告要求不良事件定义不良事件是在起始研究药物时间后发生的任何不希望有的体征、症状或医学状况的出现或恶化,即使该事件被视为与研究药物无关。仅当起始研究药物前存在的医学状况/疾病在起始研究药物后恶化时,它们才被视为不良事件。仅当异常的实验室值或测试结果诱导临床症状或体征、被视为临床上显著的、或需要治疗时,它们才构成不良事件。
[0700]
不良事件的评价研究者或医生指定人员负责验证且提供所有不良事件的源文件,并且对于入选试验的所有受试者的每个事件分配属性。
[0701]
不良事件和方案特异性数据被录入redcap内。redcap用作该方案的电子病例报告形式。
[0702]
不良事件(ae)的严重性收集与抗反抑细胞输注有关的所有级别的ae。
[0703]
一般分级:1级:轻度:存在不适,而不干扰日常活动,不需要除预防外的治疗。
[0704]
2级:中度:存在不适,具有日常活动的一定干扰,需要治疗。
[0705]
3级:重度:妨碍正常日常活动的不适,不响应一线治疗。
[0706]
4级:危及生命:代表立即死亡风险的不适表2b:推荐的不良事件记录指南因果关系评价这项研究的治疗计划的调查组分是反抑细胞的输注。
[0707]
与反抑细胞的输注有关的不良事件。可能发生输注反应。预计没有其它毒性。
[0708]
因此,当评价因果关系时,已知由反抑细胞输注引起的事件及其直接后果被评价为明确有关的。
[0709]
当不能排除反抑细胞输注和移植调理之间的不良事件关系时,该事件被评分为很可能或可能有关的。
[0710]
已知与用作化学疗法的药物以及用作支持性治疗的药物有关的事件被评分为与抗反抑细胞输注无关。
[0711]
主要研究者是确定因果关系评价的最终仲裁者。
[0712]
被视为严重的不良事件为了这项研究的目的,被视为与原始疾病相关的异常实验室发现以及实验室参数的孤立变化,例如电解质镁和代谢失衡,尿酸变化,gpt、got、ldh和碱性磷酸酶的升高,并不视为不良事件,并且不被收集到数据库中。
[0713]
严重不良事件报告(sae)如果在研究者或发起人看来,不良事件或疑似不良反应导致下述结果中的任一种,则它被视为“严重的”。
[0714]
●ꢀ
死亡
●ꢀ
危及生命的药物不良经历
ꢀ‑ꢀ
在最初的报告者看来,当它发生时,使患者置于因不良经历的立即死亡风险中的任何不良经历。它不包括如果它以更严重的形式发生,则可能已导致死亡的不良经历。
[0715]
●ꢀ
住院患者的住院治疗或现有住院治疗的延长
●ꢀ
进行正常生活功能的持续或显著丧失能力或进行正常生活功能的能力的基本破坏。
[0716]
●ꢀ
先天性异常/出生缺陷。
[0717]
●
当基于适当的医学判断,可能并不导致死亡、危及生命或需要住院治疗的重要医学事件可能危害患者或受试者,并且可能需要医学或手术干预以预防本定义中所列出的结果之一时,则它们可以被视为严重药物不良经历。
[0718]
此类医学事件的实例包括需要在急诊室或家中的强化治疗的过敏性支气管痉挛,并未导致住院患者的住院治疗的血液恶液质或抽搐,或者药物依赖或药物滥用的发展(21 cfr 312.32)。
[0719]
●ꢀ
如上文定义的重要医学事件也可以被视为严重不良事件。如果由主要研究者或ind办公室的ind发起人认为适当的,则任何重要医学事件都可以是sae并且应该作为sae报告。
[0720]
●ꢀ
在方案进行过程中发生且符合sae定义的所有事件都必须按照“the university of texas m. d. anderson cancer center institutional review board policy for investigators on reporting unanticipated adverse events for drugs and devices”中概述的期限和程序报告给irb。除非方案中另有说明,否则预料或出乎意料的所有sae都必须报告给ind办公室,无论其属性如何(在得知事件后的5个工作日内)。
[0721]
●ꢀ
出乎意料的并且与研究药物有关的所有危及生命或致命的事件,必须在得知事件后24小时内(下一个工作日)具有向ind办公室的安全项目经理提交的书面报告。
[0722]
●ꢀ
除非另有说明,否则电子sae申请(esae)用于向ind办公室和mdacc irb的安全报告。
[0723]
●ꢀ
严重不良事件从第一次方案特异性干预的时间捕捉直到抗反抑细胞的输注后30天,除非参与者撤回同意书。必须跟踪严重不良事件,直到临床恢复完成,并且实验室测试已恢复到基线,事件的进展已稳定,或者已存在可接受的事件解决方案。
[0724]
●ꢀ
另外,在30天时间段后发生的与研究治疗有关的任何严重不良事件必须报告给ind办公室。
[0725]
背景药物信息环磷酰胺稳定性和贮存要求:
●ꢀ
在混合之前:室温
●ꢀ
在混合之后:在室温下稳定24小时,并且当冷藏时稳定6天。
[0726]
通常的剂量范围:作为单个剂量至多2000 mg/m2,每3周重复一次。较小的剂量可以更频繁地给予。至多1.5 gm/m2/d x 4的剂量可以与骨髓或外周血祖细胞移植结合使用。
[0727]
已知的副作用和毒性。骨髓抑制(白细胞减少大于血细胞减少)、出血性膀胱炎、恶心、呕吐、脱发、以及罕见的闭经和无精子症。
[0728]
专门预防措施。每天用2-3升液体的足够水合,伴有大量的尿输出,可以预防膀胱炎。由于显著的肾排泄,在肾功能不全的患者中必须进行剂量减少。
[0729]
作用机制:环磷酰胺被视为经典的双功能烷化剂,其中占优势的烷化反应在鸟嘌呤的7号氮处发生。环磷酰胺必须由肝微粒体酶激活,以便损伤dna分子。尽管在细胞周期自始至终有活性,但该药剂在s期过程中是最有活性的。
[0730]
人体药理学:环磷酰胺可以经口或静脉内给予,尽管经口吸收是不完全的(30-60%的剂量可在粪便中回收)。在距经口剂量一小时内达到最大血浆水平。血浆t-1/2是4-6.5小时。大约60%的静脉内剂量在24小时内在尿中回收,在肾功能不全的患者中需要剂量调整。该药物由肝微粒体酶激活并随后失活。
[0731]
氟达拉滨(fu)同义词(商品名等):福达华治疗分类:氟化核苷类似物每个小瓶含有50 mg冻干药物,待用2 ml无菌水重构为25 mg/ml的溶液,用于iv施用。
[0732]
药物数据:溶液用静脉内粉末:50 mg溶液制备:将每个小瓶与2 ml无菌无热原水混合为澄清溶液,其为25 mg/ml,仅用于iv施用。重构的溶液应该在8小时内使用。
[0733]
•ꢀ
使用正确的程序用于化学疗法的处理和处置作用机制:在磷酸化为氟-ara-atp后,该药物似乎掺入dna内,并且抑制dna聚合酶α、核糖核苷酸还原酶和dna引发酶,因此抑制dna合成。
[0734]
人体安全和药理学:激活的化合物的半衰期为大约10小时,但药理学并未完全理解。排泄在肾功能受损的患者中受损。
[0735]
抗胸腺细胞球蛋白(atg) (thymoglobulin)治疗分类:免疫抑制剂作用机制:atg是兔抗胸腺细胞球蛋白。它是选择性免疫抑制剂的超免疫血清的纯化的、无菌的、主要单体igg级分。它被认为通过改变淋巴细胞的数目和功能来起作用。
[0736]
药物数据:atg在0.9% nacl中进行稀释。atg作为4小时输注静脉内给予中央静脉内。它是无色至轻微乳白色的蛋白质溶液。atg不应该在右旋糖或低盐液体中稀释,因为这可能引起沉淀。与酸性溶液一起输注可能引起物理不稳定性。尽管不知道进一步的不相容性或药物相互作用,但建议单独施用atg。
[0737]
稳定性和贮存要求:商购可得的。输注用溶液含有1 mg atg/2 ml。它应该贮存在2℃至8℃的冰箱中(不要冷冻)。稀释的atg稳定24小时。
[0738]
已知的副作用:atg可能引起任何细胞系的细胞减少、寒战、发热或水肿。也可能发展血清病样综合征。已报道了包括皮疹、瘙痒、荨麻疹、风团和潮红反应、支气管痉挛出血和过敏性休克的不良反应。在施用期间应备有复苏设备。在过敏性反应后,不应该重新开始输注。
[0739]
美司钠同义词(商品名等):mesnex治疗分类:出血性膀胱炎抑制剂,抗肿瘤剂
药物数据:100 mg/ml注射用溶液,400 mg经口片剂通常的剂量范围:
•ꢀ
环磷酰胺不良反应,高剂量;预防
ꢀ‑ꢀ
出血性膀胱炎;预防:在0、3、6、9小时的40% iv (w/w)的环磷酰胺剂量和iv输液。
[0740]
•ꢀ
环磷酰胺不良反应,低剂量;预防
ꢀ‑ꢀ
出血性膀胱炎;预防:每3-4小时经口20 mg/kg理想体重。
[0741]
•ꢀ
出血性膀胱炎;预防
ꢀ–ꢀ
异环磷酰胺不良反应;预防:iv推注方案,在0、4、8小时内iv推注20%的异环磷酰胺剂量(w/w)。
[0742]
•ꢀ
出血性膀胱炎;预防
ꢀ–ꢀ
异环磷酰胺不良反应;预防:经口片剂方案,在输注时iv推注20%的异环磷酰胺剂量(w/w),在2、6小时40%的异环磷酰胺剂量的片剂。
[0743]
•ꢀ
出血性膀胱炎;预防
ꢀ–ꢀ
异环磷酰胺不良反应;预防:连续iv方案(非 fda 批准方案),推注剂量(20%总异环磷酰胺剂量),然后40%的异环磷酰胺civ。
[0744]
已知的副作用和毒性:常见的不利效应:疲劳、头痛、恶心、呕吐和腹泻(伴随较高剂量(80 mg/kg理想体重)发生)。可以发生低血压。
[0745]
专门预防措施:iv美司钠应该在异环磷酰胺或环磷酰胺完成后继续12-24小时。
[0746]
禁忌症:对美司钠/其它硫醇化合物的超敏反应。
[0747]
药物相互作用:华法林。
[0748]
实施例2抗病毒中央型记忆cd8
+
反抑细胞的产生细胞制剂的制造和特性信息细胞类型和衍生化该方案需要收集两种分开的干细胞制剂。一种类型的干细胞制剂来自动员的单倍体相合的供体,其一部分就cd34
+
细胞进行选择,并且另一部分使用miltenyi clinimacs
®
装置耗尽cd3
+
/cd19
+
细胞且冷冻保存。第二种类型的制剂是同种异体的非动员的外周血单核(pbmc)细胞,用于产生抗病毒中央型记忆cd8
+
反抑t细胞。pbmc用于生成树突状细胞和记忆应答者t细胞(cd4-cd56-cd45ra-),其然后进行共培养以刺激抗病毒中央型记忆cd8
+
反抑细胞(tcm)的产生。然后将tcm细胞扩增,收获且输注。该制剂用于tcm细胞的制造和输注中,以在来自cd34
+
富集细胞的t细胞耗尽的大剂量单倍体相合的供体的输注后实现移植物植入,而无gvhd。
[0749]
制造实验室本发明的一些实施方案的细胞制剂在mdacc的干细胞移植和细胞治疗部(stem cell transplantation and cellular therapy) (scct)的细胞治疗实验室(cell therapy laboratory) (ctl)中进行处理。该设施含有用于最低限度操作的细胞制备的细胞处理实验室(cell processing laboratory),以及用于超过最低限度操作的细胞制备的分类套间(classified suites) (iso7级)两者。本发明的一些实施方案的细胞制剂主要在iso7级套间中进行制造。ctl还包括流式细胞术和质量控制实验室(flow cytometry and quality control laboratories),用于支持临床试验、研究和开发。
[0750]
相关认证(fact、cap、clia)sctct ctl在fda登记(fei #0001670014),并且得到了细胞治疗认证基金会
(foundationofaccreditationofcellulartherapy)(fact)、美国病理学家学会(collegeofamericanpathologists)(cap)的认可,并且持有由美国医疗保险和医疗补助服务中心(centersformedicareandmedicaidservices)(cms)颁发的临床实验室改进修正法案(clia)认证证书(clinicallaboratoryimprovementamendments(clia)certificateforaccreditation)。
[0751]
原材料pbmc:该方案需要两种分开的细胞类型制剂。一种制剂包含同种异体的非动员的外周血单核细胞,用于产生抗病毒中央型记忆cd8
+
反抑t细胞(tcm),而另一种来自动员的单倍体相合的外周血制剂。这两种制剂均经由白细胞去除术进行收集。
[0752]
用于产生tcm细胞的非动员的(未接触抗原的)外周血单核细胞在计划移植日期(第0天)前约7天收集。靶白细胞去除术的单核细胞产量为1x10
10
。tcm细胞在cd34
+
富集制剂输注后的d+7时进行输注。
[0753]
动员的外周血细胞经过3天进行收集。第1天和第2天收集是cd34
+
选择且冷冻保存的。使第三天的收集耗尽cd3
+
/cd19
+
细胞且冷冻保存。在富集程序之前,可以将多重收集合并。从第1天的收集中获取含有2x106个cd34
+
细胞/kg理想体重的未修饰pbmc的备用级分,并且冷冻保存。
[0754]
方法描述mdacc供体首先就适合性进行评价,包括合格性筛查和身体检查。然后征得供体的同意并安排收集。靶细胞数目是方案特异性的,并且可能需要多次收集。在收集程序完成后,细胞由ctl工作人员在塑料冷却器中从收集设施运送到ctl实验室,以保护细胞免于温度波动和物理损伤。然后在ctl对制剂进行记录。
[0755]
传染病测试和交叉污染的预防供体合格性所有供体都根据下文进行筛查且测试。供体必须在7天内就治疗性细胞(pbmc)进行测试。
[0756]
寨卡病毒供体筛查:如果供体具有下述风险因素中的任一种,则他们被视为不合格的。
[0757]
1.在过去6个月内寨卡感染的医学诊断。
[0758]
2.在过去6个月内居住在寨卡传播活跃的地区,或到该地区旅行。
[0759]
3.在过去6个月内与已知具有上文项目1或2中列出的风险因素中任一的男性发生性关系。
[0760]
医疗史mdacc供体和患者的医疗史由主治医生或其指定人员在scct诊所进行确定。
[0761]
测试列表所有测试都由clia认证的实验室,使用fda批准的测试(如果可用的话)执行。传染病测试包括抗hiv-1/hiv-2(dhiv/1/2)、丙型肝炎病毒抗体(dhcvab)、抗htlvi/htlvii(dhtlvi/ii)、乙型肝炎抗原(dhbsag)、乙型肝炎核心抗体(dhbcab)、西尼罗病毒-nat测试(通过核酸测试的wnv)、梅毒血清学测试(供体tp-ha或rpr)、抗cmv(供体cmv抗体)、美州锥虫病、hiv、通过核酸测试(nat)的hcv抗原测试。值得注意的是:nathiv/hcv检
106个细胞/ml。取出用于无菌性测试的样品。将级分ii在g-rex
®
100中接种,并且在37℃、5% co2下温育24小时(+/
‑ꢀ
2小时)。
[0776]
限制:除非由实验室主任或指定人员批准更高的数目,否则用一个试剂盒和配管组处理的最大tnc为200 x 10
6 tnc/ml。clinimacs
®
仪器的最大装载体积为300 ml。
[0777]
第3天:成熟dc收获和病毒肽装载和共培养成熟dc (mdc)收获在16小时温育后,去除上清液,并且用温磁珠缓冲液轻轻地洗涤cell factories。取出洗涤缓冲液和任何非粘附细胞并加入mdc上清液中。取出来自mdc上清液和洗涤缓冲液的样品用于细胞计数、tb生存力和免疫表型分型。
[0778]
通过加入冰冷的磁珠缓冲液,并且在冷冻的凝胶包上静置30分钟,使粘附的mdc从cell factories脱离并收获。在30分钟后,收获mdc,并且用冰冷的磁珠缓冲液将 cell factories洗涤一次。cell factories用显微镜进行检查,以确定是否所有mdc都被取出。如果观察到并非所有mdc都被取出,则重复洗涤过程。随后将收获的(粘附的) mdc悬浮液离心、洗涤并重悬浮于磁珠缓冲液中。取出来自粘附的mdc的样品用于细胞计数、tb。在确定mdc体积和tnc后,将细胞浓度调整到1 x 107个细胞/ml用于肽装载。取出用于免疫表型分型的过程中样品。一旦确定了每个级分的体积和tnc,就弃去mdc上清液级分,并且进一步处理一个实施方案的mdc细胞制剂。
[0779]
病毒肽的装载在收获mdc后,将计算的peptivator (adv5六邻体、hcmv pp65、ebv选择和bkv lt)加入细胞中,并且在37℃、5% co2下温育1小时。在温育之后,用磁珠缓冲液洗涤且离心装载病毒肽的mdc。然后用t细胞生长培养基重悬浮装载病毒肽的mdc,并且经由x线源用30-25 gy进行照射。
[0780]
一旦照射完成,就将装载病毒肽的mdc洗涤、离心并重悬浮于t细胞生长培养基中。取出样品用于细胞计数、tb生存力、免疫表型分型和无菌性。
[0781]
共培养物制备和饥饿阶段在级分ii (cd4-cd56-cd45ra-)的24小时温育之后,从培养箱中取出细胞,离心并重悬浮于t细胞生长培养基中。取出用于细胞计数、tb生存力、免疫表型分型和无菌性的样品。然后将来自级分ii (cd4-cd56-cd45ra-)的细胞洗涤,并且以1 x 106个细胞/ml (100 ml/g-rex
®
100)的浓度连同装载病毒肽的mdc一起,以5:1的比率(级分ii细胞:树突状细胞(dc))接种到g-rex
®
100中的连同il-21 (100 iu/ml)一起的t细胞生长培养基中。使共培养的细胞在37℃、5% co2中温育3天,用于饥饿期。
[0782]
第6天:抗病毒反抑细胞(tcm)的分化和扩增在72小时的饥饿阶段之后,小心地取出来自g-rex
®
100的上清液的样品,而不破坏细胞层,以确定培养物的ph和葡萄糖水平。ph应该处于生理范围(ph 7.2-7.6),并且葡萄糖应该为至少50 mg/dl。将补充有il-7 (30 iu/ml)、il-15 (125 iu/ml)和il-21 (100 iu/ml)的新鲜t细胞生长培养基以50%的培养体积加入每个g-rex
®
100中。然后使细胞在37℃与5% co2下再温育48小时。这个过程每72小时重复一次,直到培养结束。
[0783]
细胞在培养中最多12天。取决于ph和葡萄糖水平,每48小时加入含有细胞因子的
新鲜培养基或仅细胞因子。如果葡萄糖水平在以下之间:
●ꢀ
170 mg/dl至130 mg/dl的葡萄糖水平:仅将细胞因子il-7、il-15、il-21加入培养物中。
[0784]
●ꢀ
129 mg/dl至100 mg/dl的葡萄糖水平:将100 ml (g-rex
®
100体积的25%)的新鲜t细胞生长培养基 + 细胞因子il-7、il-15、il-21加入培养物中。
[0785]
●ꢀ
99 mg/dl至50 mg/dl的葡萄糖水平:将200 ml (g-rex
®
100体积的50%)新鲜t细胞生长培养基 + 细胞因子il-7、il-15、il-21加入培养物中。
[0786]
值得注意的是:g-rex
®
100的最大体积水平是400 ml。如果达到g-rex
®
100的最大体积,则补充培养物的体积。
[0787]
第12天:在第12天时,获得无菌性样品用于质量控制放行测试。
[0788]
第13天:培养细胞计数评价在第13天时,取出细胞计数、tb生存力和免疫表型分型样品,用于tnc确定。
[0789]
第14天:在第14天时,如上文所述,取决于ph和葡萄糖水平,加入含有细胞因子的新鲜培养基或仅细胞因子。一旦加入培养基和/或细胞因子,细胞培养物就在收获之前在37℃、5% co2下温育24小时(+/
‑ꢀ
2小时)。
[0790]
培养的总时间:12天(第3天至第15天)第15天:抗病毒的cd8中央型记忆细胞(tcm)的最后配制和输注在第15天时,tcm细胞就肉眼可见的污染进行检查,收获且用细胞悬浮培养基(plamalyte-a/0.5%的25% hsa)进行洗涤。取出样品用于非放行测试:细胞计数、tb生存力、无菌性,以及用于放行测试:在细胞洗涤之前的内毒素和支原体。
[0791]
在将一个实施方案的细胞制剂洗涤且重悬浮后,取出用于细胞计数、生存力和免疫表型分型的放行测试样品。在细胞计数和tnc确定之后,将一个实施方案的细胞制剂重悬浮于大约50-100 ml的细胞悬浮培养基中,至根据临床方案中开出的剂量的tcm细胞剂量。获得用于放行测试的样品用于革兰氏染色和作为非放行测试的无菌性。在细胞制剂放行之前,最终的tcm细胞制剂符合放行标准。
[0792]
最终的tcm细胞由ctl工作人员在塑料冷却器中从ctl运送到患者楼层,以保护细胞制剂免于温度波动和物理损伤。ctl工作人员将细胞制剂递送并发放给输注人员。
[0793]
cd34
+
富集细胞的生成程序概述如图2中所示,动员的造血祖细胞(也称为hpc-a)在三天内进行收集。将含有1 x 106个cd34
+
细胞/kg理想体重的未修饰pbmc的备用级分留出且冷冻保存。将剩余的第一天和第二天的收集合并,进行cd34
+
选择且冷冻保存。使第三天的收集耗尽cd3
+
/cd19
+
细胞且冷冻保存。从所有级分中收集的整个t细胞耗尽的干细胞移植的最大t细胞剂量是2 x 105个cd3
+
细胞/kg理想体重。
[0794]
两个程序均在ctl核心实验室(ctl core laboratory)使用miltenyi clinimacs
®
装置来执行。ctl对于该装置的使用具有充分确定的sop,并且已将其用于多重临床试验的细胞制剂制造。取决于细胞数目和时间表,单个hpc-a制剂可以进行拆分或合并。一个实施
方案的细胞制剂在分别程序的完成后进行冷冻保存。
[0795]
cd34
+
富集过程设置在动员的hpc-a的第一天收集时,根据充分确定的实验室sop,在处理前制备含有0.5%人血清白蛋白(hsa)的clinimacs
® pbs/edta缓冲液袋(1000 ml)。确定hpc-a制剂的重量。取出来自hpc-a的第1天和第2天的样品用于下述测试:细胞计数、生存力、无菌性、免疫表型分型。每个缓冲液和细胞制备袋用患者的姓名、mdacc编号和制备日期进行标记。在对剩余的pbpc细胞制剂执行cd34
+
选择程序之前,从第一天的收集中取出2 x 106个cd34
+
细胞/kg理想体重的备用级分。第一天收集的剩余细胞保存过夜,并且与第二天的收集合并用于cd34
+
富集过程。
[0796]
cd34
+
分离使一个实施方案的合并的hpc-a细胞制剂与cd34试剂(与超顺磁性颗粒缀合的cd34抗体)一起温育。洗涤细胞以去除过量的试剂。取出细胞计数和免疫表型分型样品。然后使用clinimacs
®
配管组和cd34
+
选择程序,在clinimacs
®
上处理cd34标记的细胞。在这种情况下,磁性标记的细胞(cd34
+
)由柱保留,并且去除cd34阴性细胞。cd34
+
细胞然后从柱中释放并收集。取出来自每个级分的样品用于细胞计数、生存力和免疫表型分型。
[0797]
cd34
+
富集的细胞制剂可以冷冻保存用于输注(如下文讨论的),或可以作为新鲜细胞使用(如上文讨论的)。
[0798]
限制:除非由实验室主任或指定人员批准更高的数目,否则用一个试剂盒和配管组处理的最大tnc为6 x 10
10
。关于clinimacs
®
仪器的最大装载体积为300 ml。
[0799]
cd3
+
/cd19
+
耗尽过程设置根据充分确定的实验室sop,在处理前制备含有0.5%人血清白蛋白(hsa)的clinimacs
® pbs/edta缓冲液袋(1000 ml)。确定hpc-a细胞制剂的重量。取出来自hpc-a的样品用于下述测试:细胞计数、生存力、无菌性和免疫表型分型。每个缓冲液和细胞制备袋用患者的姓名、医疗记录编号(mrn)和制备日期进行标记。
[0800]
血小板耗尽一个实施方案的hpc-a细胞制剂在cd3
+
/cd19
+
耗尽之前使用cobe 2991进行血小板耗尽。一旦细胞从cobe 2991中取出,就取出用于细胞计数的样品。然后使细胞制剂与cd3试剂和cd19试剂一起温育。
[0801]
cd3
+
/cd19
+
耗尽使一个实施方案的血小板耗尽后的hpc-a细胞制剂与ivig一起温育10-15分钟。在初始温育后,将cd3
+
和cd19
+
试剂(与超顺磁性颗粒缀合的cd3和cd19抗体)加入细胞制剂中,并且在轨道旋转器上温育30分钟。在温育结束后,使用cobe 2991洗涤细胞,以去除过量的试剂。取出细胞计数和免疫表型分型样品。然后使用耗尽配管组和耗尽程序,在clinimacs
®
上处理cd3
+
/cd19
+
标记的细胞。在这种情况下,磁性标记的细胞(cd3
+
/cd19
+
)由柱保留,并且使cd3和cd19阴性细胞通过柱,并且作为cd3
+
/cd19
+
耗尽的级分进行收集。取出来自每个级分的样品用于细胞计数、生存力和免疫表型分型。
[0802]
一个实施方案的cd3
+
/cd19
+
耗尽的细胞制剂进行冷冻保存用于输注(如下文讨论的),或可以作为新鲜细胞使用(如上文讨论的)。
[0803]
限制:除非由实验室主任或指定人员批准更高的数目,否则用一个试剂盒和配管组处理的最大tnc为8 x 10
10
。
[0804]
第二次cd3
+
耗尽(并非必需步骤,待根据需要使用)如果存在多于2 x 10
5 cd3/kg理想体重,则可以对cd3
+
/cd19
+
耗尽的制剂进行cd3耗尽的第二循环,以进一步减少细胞制剂中的cd3群体。从每个级分中获得用于细胞计数和免疫表型分型、生存力和无菌性的样品。
[0805]
可替代地,仅利用t细胞耗尽的级分的部分的输注,以便避免输注多于2 x 105个cd3细胞/kg理想体重。
[0806]
cd34
+
富集和cd3
+
/cd19
+
耗尽的细胞制剂的最终配制和冷冻保存:在细胞选择或耗尽和取样后,一个实施方案的细胞制剂根据在ctl验证的程序进行浓缩且冷冻保存。在细胞制剂的冷冻保存之前,获得最终的细胞计数、生存力、免疫表型分型、革兰氏染色和无菌性样品。在细胞计数和tnc确定之后,根据sop在冷冻培养基(50% plasma-lyte a、7.5% dmso和35% hsa 25%)中冷冻保存一个实施方案的细胞制剂。含有cd34
+
富集的细胞或cd3
+
/cd19
+
耗尽的细胞的袋在可控速率的冷冻机中冷冻,并且以气相贮存于液氮冷冻机中。
[0807]
值得注意的是:最终的细胞制剂是冷冻保存前的制剂,因为细胞的解冻无需进一步操作在床边发生。
[0808]
细胞制剂放行和输注在输注当天,cd34
+
富集的细胞或cd3
+
/cd19
+
耗尽的细胞制剂由ctl工作人员送至患者楼层,并且分发给输注人员。最终的细胞制剂在细胞制剂放行之前符合批次放行标准。然后根据方案特异性剂量,将这些细胞输注到患者内。值得注意的是,当使用冷冻保存的时,细胞按照标准操作程序在楼层上解冻并发放给输注人员。另外,当使用冷冻保存的时,最终的细胞制剂由ctl工作人员在批准的聚苯乙烯泡沫塑料ln2运输容器中从ctl运送到楼层,所述容器具有充有大约2英寸的液氮的无缝金属插件。
[0809]
所有的细胞制剂测试都是方案特异性的,并且根据sop执行。
[0810]
试剂表3:试剂、制造商、状态(许可、分析证书(coa)或主文件(mf))列表
表3,续试剂是方案特异性的,并且根据制造商的建议进行贮存。所有的试剂在细胞制剂制造的启动之前都是合格的。试剂的库存控制包括收货文件、试剂文件审查、由库存经理的跟踪;以及适当时通过qa的审查和放行。关于所有fda批准的试剂的文件可通过mdacc pharmacy获得。关于未批准的试剂的分析证书和交叉参考信必须从供应商获得。msds作为实验室安全政策(laboratory safety policy)的部分进行管理。
[0811]
资格认证程序在临床制剂生产的启动之前,试剂必须是合格的。这通常在制造中涉及的程序验证期间完成。试剂和供应商可能先前已作为先前临床方案的部分是合格的。
[0812]
从最终的细胞制剂中去除试剂从最终的细胞制剂中去除试剂。这使用各种细胞洗涤、浓缩和重悬浮程序来完成。
[0813]
细胞制剂的测试微生物检测无菌性测试:bd bactec:mdacc实验室医学部(mdacc department of laboratory medicine)使用这种自动化微生物检测系统来测试过程中和最终的细胞制剂样品。所有的测试都保留14天或直到细胞制剂变成阳性。测试结果在细胞制剂放行前获得。
[0814]
待测试的样品:
测试的数目和时机是对细胞执行的操作的量、培养时间和测试要求的因素。待测试的样品必须对于测试的类型是最佳的。在制造启动之前,对样品条件进行验证,以确保培养基或其它缓冲液的任何部分都不干扰无菌性测定。需要0.5 ml/测试的最小样品体积。
[0815]
无菌性取样点:抗病毒中央型记忆cd8
+
反抑t细胞1. 第1天:hpc-a
ꢀ–ꢀ
ficoll前2. 第1天:hpc-a
ꢀ‑ꢀ
ficoll后-级分i3. 第1天:cd14
+
分离
ꢀ‑ꢀ
阴性级分(过夜)4. 第1天:cd14
+
分离
ꢀ–ꢀ
具有细胞因子的阳性级分(过夜)5. 第2天:cd4
+
cd56
+
cd45ra
+
耗尽
ꢀ‑ꢀ
阴性级分(级分ii) (过夜)6. 第3天:装载病毒的dc
ꢀ‑ꢀ
照射后7. 第3天:级分ii
ꢀ‑ꢀ
过夜收获8. 第3天:共培养
ꢀ–ꢀ
级分ii和装载病毒的dc9. 第12天:共培养
ꢀ‑ꢀ
第12天10. 第13天:共培养
ꢀ‑ꢀ
第13天11. 第15天:共培养
ꢀ‑ꢀ
收获后12. 第15天:最终的tcm细胞cd34
+
大剂量1. hpc-a
ꢀ‑ꢀ
收获2. cd34
+
富集细胞
ꢀ–ꢀ
最终的细胞制剂(预冷冻)或新鲜使用3. cd3
+
cd19
+
耗尽的细胞
–ꢀ
最终的细胞制剂(预冷冻)或新鲜使用支原体测试一个实施方案中的冷冻保存的tcm细胞制剂就支原体的存在进行测试。tcm细胞制剂(冷冻保存的)通过基于凝胶终点聚合酶(pcr)的测定进行检测。pcr测定由批准的许可参考实验室执行。除基于pcr的测定之外,最终的tcm细胞还使用批准的生物化学支原体快速检测测试(mycoalert,lonza walkersville,inc.)进行检测。样品在细胞洗涤前的收获时获取,并且含有细胞和培养基两者。样品体积为最少0.5 ml。在执行基于支原体pcr的测定时,mycoalert结果用作临时测试放行标准。支原体pcr结果并不用作放行标准,而是连同临床应答一起进行分析,以帮助鉴定与积极临床结果相关的标准。支原体结果必须是阴性的。
[0816]
制剂输注后收到的阳性无菌性结果在细胞制剂已输注后,关于培养的细胞制剂的14天无菌性或支原体结果返回为阳性的情况下,通知实验室主任、技术主任、医务主任、实验室质量保证部门、主要研究者、主治医生和研究用新药(ind)办公室
ꢀ‑ꢀ
或机构发起人/临床研究vp。质量保证部门进行调查以鉴定任何纠正和/或预防行为。关于阳性无菌性测试的调查和建议的纠正包括:微生物的鉴定和抗微生物剂敏感性测试;用于收集且处理细胞制剂的目前程序的评估,以确定在其下可能引入污染的步骤;帮助预防未来的无菌性失效的程序变化的开发;以及适当测试的实施,以确保此类程序变化产生无菌细胞制剂。主治医生负责患者的通知、监测和治疗。主要研究者负责将偏差和不良事件告知适当的监管机构(fda、irb)。另外,报告无菌性失败和原因调查的结果以及任何纠正行为(在及时提交给ind的信息修正中,例如在最初收到阳性
培养物测试结果后的30个日历日内)。
[0817]
革兰氏染色在其中需要快速微生物测试的情况下,由mdacc实验室医学部执行革兰氏染色。需要最少0.5 ml的样品。对tcm细胞、cd34
+
富集的细胞制剂和cd3
+
cd19
+
耗尽的细胞制剂进行检测,并且结果是用于新鲜输注的放行标准的部分。细胞制剂必须未见生物。
[0818]
标识所有ctl细胞制剂都进行标记且贮存,以便确保准确标识且防止混淆。所有的细胞制剂都分配独特的标识符号。在细胞制剂的标记和检索过程中的关键步骤需要监督人员的验证。
[0819]
cd34
+
富集和cd3
+
/cd19
+
耗尽的细胞制剂:流式细胞术也用于鉴定回输到患者内的不同细胞群体。除cd34
+
和cd3
+
/cd19
+
确定之外,还评估了下述亚群标记物:cd3、cd4、cd8、cd16/ cd56、cd19 cd14、cd45ro和cd37。
[0820]
tcm细胞制剂:流式细胞术也用于鉴定回输到患者内的不同细胞群体。除cd45、cd3、cd8、cd62l和cd45ro确定之外,还评估了下述亚群标记物:cd4、cd56、cd16、cd95和cd45ra。
[0821]
纯度流式细胞术在多个点处使用,以确定细胞表型。关于cd45
+
细胞的cd3
+
cd8
+
cd62l
+
cd45ro
+
7aad-的tcm细胞制剂流式细胞术标记物必须≥ 30%。
[0822]
cd34
+
富集的制剂和cd3
+
cd19
+
耗尽的制剂两者的总和必须具有大于6 x106个cd34
+
细胞/kg理想体重的最低限度可接受的细胞剂量。所有其它免疫表型分型数据并不用作放行标准,而是连同临床应答一起进行分析,以帮助鉴定可能与积极临床结果相关的适当效力测定。
[0823]
效力通过流式细胞术的免疫表型分型用于测量几种潜在的效力标记物,包括上文纯度节段中提到的标记物。其它免疫表型分型数据无一用作放行标准,而是连同临床应答一起进行分析,以帮助鉴定与积极临床结果相关的标准。
[0824]
在该i期自始至终开发效力测定,并且在iii期试验启动之前建立该效力测定。
[0825]
内毒素内毒素水平在ctl质量控制实验室使用鲎阿米巴样细胞溶解物(limulus amebocyte lysate) (lal)测定进行确定。该方法在临床使用之前对于待测试的所有细胞/培养基组合进行验证。对最终的tcm细胞制剂进行测试,并且结果是放行标准的部分。需要最少0.5 ml的样品。内毒素水平必须小于5 eu/kg受体的理想体重。
[0826]
目视检查所有细胞制剂在输注前之都进行目视检查。细胞制剂必须具有无污染的证据。
[0827]
生存力生存力可以由ctl通过使用台盼蓝(tb)测定或使用流式细胞术(7aad)进行确定。最终的tcm细胞、cd34
+
富集的细胞制剂和cd3
+
cd19
+
耗尽的制剂必须具有≥ 70%的7aad生存力。在此过程中,台盼蓝生存力可以用作过程中测试。
[0828]
细胞剂量
ctl细胞剂量使用通过流式细胞术的细胞计数和免疫表型分型进行确定。
[0829]
最终tcm细胞制剂的剂量由受试者在其下入选临床试验的cd8
+
剂量水平进行确定。过量的细胞可以用于细胞功能的相关研究、表型研究和冷冻保存。数据并不用作放行标准,而是连同临床应答一起进行分析,以帮助鉴定与积极临床结果相关的标准。如果tcm细胞制剂cd8
+
的剂量少于2.5 x 106个cd8
+
细胞/kg理想体重的计划剂量水平一(1) (剂量水平1),或者如果cd8
+
细胞并不符合放行标准,则不输注这些细胞。相反,输注备用pbpc加上t细胞耗尽的pbpc,以重建“标准pbpc移植”,并且患者按方案接受标准护理的预处理方案。如果tcm细胞符合放行标准,但cd8
+
细胞剂量少于5 x 106个cd8
+
细胞/kg理想体重的剂量水平2的靶细胞剂量水平,则2.6至5 x 106个cd8
+
细胞/kg理想体重被视为足够的,并且被视为剂量水平2。对于具有10 x 106个cd8
+
细胞/kg理想体重的靶剂量的剂量水平3,则5.1至10 x 106个cd8
+
细胞/kg理想体重被视为足够的,并且被视为剂量水平3。
[0830]
cd34
+
富集的制剂和cd3
+
cd19
+
耗尽的制剂两者的总和必须具有6 x 106个cd34
+
细胞/kg理想体重的最低限度的可接受细胞剂量,并且不超过由放行标准定义为2 x 105个cd3
+
细胞/kg理想体重的t细胞剂量限制。监测最终的cd34
+
富集的细胞制剂剂量,并且连同临床应答一起进行分析,以帮助鉴定与积极临床结果相关的标准。
[0831]
保留等分试样所有的qc管都保留一周;然而,对于大多数样品,这些样品的效用在48小时后快速降低。所有冷冻的细胞制剂在冷冻保存时也具有同时贮存的参考小瓶。
[0832]
细胞制剂放行标准测试和另外的测试表4:tcm制剂批次放行测试和规格表5:cd34
+
富集制剂批次放行测试和规格测试:规格:无菌性在14天时无生长革兰氏染色未见生物
生存力(最终制剂)≥70%cd3
+
细胞总剂量《2x105个cd3
+
细胞/kg理想体重cd34
+
细胞总剂量≥5x106个cd34
+
细胞/kg理想体重表6:另外的过程中测试(非放行)测试:规格无菌性14天时无生长免疫表型仅供参考tnc仅供参考支原体(pcr)阴性实施例3在不存在atg的情况下的治疗方案材料和实验条件宿主非反应性供体抗第三方细胞的制备抗第三方tcm细胞如先前所述[ophir e.等人,blood. 2013,121:1220]进行制备。简言之,供体小鼠的脾细胞在细胞因子剥夺下,针对照射的第三方脾细胞培养60小时。随后,使用磁性颗粒(bd pharmingen)对cd8细胞进行阳性选择,并且在无ag的环境中进行培养。每隔一天添加rhil-15 (20 ng/ml;r&d systems)。为了在培养结束时(第16天)获得纯化的群体,tcm就cd62l表达进行阳性选择(磁激活细胞分选[macs
® cell separation,miltenyi biotec,bergisch gladbach,德国]),并且回收细胞用于facs分析。
[0833]
造血干细胞的制备从balb/c裸鼠(10-12周龄)中收获长骨。通过研磨骨以达到单细胞悬浮液来提取骨髓。对骨髓进行计数并使其达到正确的浓度,然后iv注射到小鼠的尾静脉中。
[0834]
嵌合状态分析嵌合状态通过流式细胞术进行确定。通过眶后出血收集外周血,细胞在ficoll-paque plus (amersham pharmacia biotech,ab)上进行分级,并且通过针对供体和宿主表面标记物的直接免疫荧光,对每只小鼠的分离的单核细胞进行染色。
[0835]
如通过细胞内染色确定的tcm细胞的抗病毒活性在布雷非德菌素a (ebioscience)的存在下,使反抑tcm细胞与分别的病毒肽混合物(ebv、cmv、adeno、bkv)一起在37℃、5% co2下共培养6小时。将细胞固定、渗透化处理(invitrogen fix & perm set),并且对于cd45、cd3、cd8、ifn-γ和tnf-α (bd)进行免疫染色。阳性对照包括用pma/离子霉素的tcr不依赖性刺激。细胞关于cd45
+
/fsc淋巴细胞门和cd3
+
cd8
+
进行门控。
[0836]
结果本发明人先前已证实了,在通过用atg的t细胞减灭、3 gy tbi和氟达拉滨(图5)的非清髓性调理之后,将t细胞耗尽的大剂量单倍体-hct与移植后的cy组合,可以使得在不存在gvhd的情况下的持久移植物植入成为可能(数据未显示)。
[0837]
考虑到用抗t细胞抗体例如atg的t细胞减灭与包括病毒感染的风险增加的显著毒性有关,检查了通过使用在第7天时输注的中央型记忆反抑细胞替换t细胞减灭的可能性。
[0838]
如图6中所示,在不存在t细胞减灭的情况下,在亚致死性tbi (3.5 gy)之后将t细
胞耗尽的大剂量单倍体-hct与移植后cy组合,导致了移植排斥和没有嵌合状态的证据。相比之下,在第7天时中央型记忆cd8
+
反抑细胞的输注使得明显的供体型嵌合状态成为可能。
[0839]
这些结果提供了关于在第7天时使用反抑细胞施用作为用试剂如atg的t细胞减灭的替代的概念证明。此类方案包括亚致死性tbi (例如3 gy)、氟达拉滨、大剂量t细胞耗尽的造血干细胞和移植后cy,如图7中所示。
[0840]
此外,如通过inf-γ和tnf-α染色所示的,反抑细胞产物独特地显示出针对病毒肽即ebv、cmv、adeno、bkv的混合物的抗病毒活性(图8a-c)。
[0841]
尽管本发明已与其具体实施方案结合进行描述,但很明显,许多替代、修改和变化对于本领域技术人员将是显而易见的。相应地,预期涵盖落入所附权利要求的精神和广泛范围内的所有此类替代、修改和变化。
[0842]
本说明书中提到的所有出版物、专利和专利申请都在本文中整体引入说明书内,其程度与每个个别出版物、专利或专利申请具体地且个别地指示通过引用引入本文相同。另外,在本技术中的任何参考文献的引用或鉴定,不应解释为承认此类参考文献可用作本发明的现有技术。就使用节段标题而言,它们不应被解释为必然的限制。另外,本技术的任何优先权文件在此通过引用以其整体引入本文。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1