抗肿瘤天然药物melodienones及其类似物的制备方法
:
1.本发明属于合成药物化学领域,具体涉及抗肿瘤天然药物melodienones及其类似物的制备方法。
背景技术:
:
2.γ
‑
氧代
‑
α,β
‑
烯烃酯是γ位被氧取代的α,β
‑
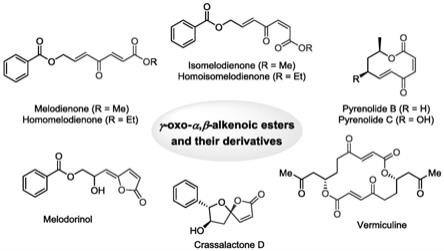
不饱和酯,其衍生物不仅作为生物活性次生代谢产物广泛存在于自然界中(图1);也由于其显著的生物活性(抗菌、抗疟、抗病毒、抗癌等),常被用于治疗各种疾病,如目前已在临床上广泛使用的抗炎药物罗非昔布和抗病毒药物奥司他韦。这类分子是良好的迈克尔加成受体,可与体内蛋白中的氨基或巯基等亲核基团发生加成,通过抑制控制细胞分裂的酶活性发挥其生物效应。后续进一步的研究中证实,其作用机制是由这类结构的表面张力和不饱和体系的亲电性质共同作用的结果,因此这类结构具有良好的成药前景。
3.20世纪九十年代以来,众多含γ
‑
氧代
‑
α,β
‑
烯烃酯基团的庚烯类天然产物陆续被发现,此类分子c7骨架中的每个碳原子都是功能化的(图2)。尽管这些化合物表面上结构简单,但研究表明,这些分子显示出一系列的生物活性功能。选取的庚烯类活性天然产物melodienone(1)、homomelodienone(2)、isomelodienone(3)和homoisomelodienone(4)是由jung等人从番荔枝科(annonaceae)的美乐多(melodorum fruticosum lour.)中分离得到。体外细胞毒活性评价实验表明这些化合物对肺癌(a
‑
549)、人非小细胞肺癌(nci
‑
h187)、人乳腺癌(mcf
‑
7)和结肠癌细胞系(ht
‑
29)具有中等到显著的细胞毒活性,尤其是化合物isomelodienone(3)对人乳腺癌细胞(mcf
‑
7)的ed
50
值低至0.171μg/ml,明显优于阳性对照阿霉素(ic
50
=3.45μm)。
4.目前为止,这些具有生物学意义的化合物的合成报道仅有两例,且先前的研究多采用步骤繁琐、相对苛刻的条件或复杂的原料制备。例如1994年,barcoa等通过11步线性反应完成了melodienone(1)和其同系物7
‑
hydroxy
‑6‑
hydromelodienone的首次全合成。其中涉及缩酮化、swern氧化、[3+2]
‑
环加成、羟基保护、氢气
‑
雷尼镍还原等多种反应,但最终产率并不理想。在1998年,boukouvalas等报道了另一种合成melodienone(1)和isomelodienone(3)的新方法,该方法依赖于呋喃环对其他活性官能团的掩蔽,最终通过甲氧基呋喃在适当条件下的氧化开环来构建γ
‑
氧代
‑
α,β
‑
烯烃酯基团。该法较barcoa的方法来讲,缩短了反应步骤,但起始原料所需的2
‑
甲氧基呋喃价格并不便宜且多次使用高危试剂dibal
‑
h和正丁基锂,条件相对苛刻。
技术实现要素:
:
[0005]
本发明的目的是提供一种具有显著的抑制肿瘤生长的庚烯类活性天然产物melodienone(1)、homomelodienone(2)、isomelodienone(3)和homoisomelodienone(4)的合成制备方法。本发明的合成制备方法只需4个线性步骤就成功简明的完成了这些天然产物的合成。
[0006]
改进的炔丙醇异构法反应条件温和高效,且无需使用呋喃衍生物作为原料构建γ
‑
氧代
‑
α,β
‑
烯烃酯,大大提高了操作安全性以及经济性。因此我们考虑能否将改进的炔丙醇异构法应用到这些活性天然产物的合成中。如果能够成功,将可快速、安全、经济的完成具有类似结构的活性天然产物的全合成,为此类结构合成提供安全高效的新思路。基于前面的研究基础与假设,本发明拟对目标分子进行逆合成分析,具体如3)的逆合成分析式。活性天然产物1、2、3和4可由炔丙醇衍生物5(6)通过确立的氧化还原异构方法处理所得。炔丙醇衍生物5(6)经化合物(7)和丙炔酸甲酯(丙炔酸乙酯)在二异丙基氨基锂(lda)的作用下生成。化合物(7)可由苯甲酸酯衍生物(8)再经过二氧化锰氧化得到。而苯甲酸酯衍生物(8)则可由市售可得的苯甲酰氯(9)和顺式
‑
1,2
‑
二羟甲基乙烯(10)经过酰化反应生成。
[0007]
1)丙炔酸酯对不饱和醛基的加成:
[0008][0009]
2)炔丙醇的异构:
[0010][0011]
3)逆合成分析式
[0012][0013]
因此,本发明的第一个目的是提供melodienone或isomelodienone的制备方法,包括以下步骤:
[0014]
苯甲酰氯(9)和顺式
‑
1,2
‑
二羟甲基乙烯(10)在强碱条件下得到苯甲酸单酯产物
(8),苯甲酸单酯产物(8)经氧化得到不饱和醛(7),不饱和醛(7)用丙炔酸甲酯锂处理,生成前体炔丙醇衍生物(5),炔丙醇衍生物(5)通过碱介导的氧化还原异构化反应得到melodienone(1)和isomelodienone(3),具体合成路线如式1所示:
[0015][0016]
所述的强碱优选为氢化钠。
[0017]
优选,所述的苯甲酸单酯产物(8)经氧化得到不饱和醛(7)是苯甲酸单酯产物(8)经mno2氧化得到不饱和醛(7)。
[0018]
本发明的第二个目的是提供homomelodienone和homoisomelodienone的制备方法,包括以下步骤:
[0019]
苯甲酰氯(9)和顺式
‑
1,2
‑
二羟甲基乙烯(10)在强碱条件得到苯甲酸单酯产物(8),苯甲酸单酯产物(8)经氧化得到不饱和醛(7),不饱和醛(7)用丙炔酸乙酯锂处理获得炔丙醇衍生物(6),炔丙醇衍生物(6)经氧化还原异构化得到产物homomelodienone(2)和homoisomelodienone(4),具体合成路线如式2所示:
[0020][0021]
所述的强碱优选为氢化钠。
[0022]
优选,所述的苯甲酸单酯产物(8)经氧化得到不饱和醛(7)是苯甲酸单酯产物(8)
经mno2氧化得到不饱和醛(7)。
[0023]
根据合成的天然产物melodienones与先前文献报道的分离得到的天然产物的核磁光谱数据对比,验证了合成的天然产物melodienones结构的正确性。
[0024]
综上,本发明从市售价格低廉的原料出发,共经四个线性步骤安全高效的完成了一系列天然产物melodienones的全合成,充分展示了改进的炔丙醇异构法在天然产物全合成中的应用前景
[0025]
本发明的有益效果如下:本发明首次实现了melodienone(1)、homomelodienone(2)、isomelodienone(3)和homoisomelodienone(4)的全合成,并它们的结构类似物以进行后续的构效关系、成药性开发和生产,提供了一种高效可靠、经济的制备方法。
附图说明
[0026]
图1是代表性天然产物;
[0027]
图2是melodienones天然产物的结构。
[0028]
具体实施方法
[0029]
以下实施例是对本发明的进一步说明,不是对本发明的限制。
[0030]
实施例1:melodienone(1)和isomelodienone(3)的全合成。
[0031]
基于前期的逆合成分析,对目标分子melodienone(1)、homomelodienone(2)、isomelodienone(3)和homoisomelodienone(4)进行全合成,具体路线如式3所示。本文从商业易得原料苯甲酰氯(9)和顺式
‑
1,2
‑
二羟甲基乙烯(10)出发,在氢化钠条件下以74%的产率得到酯化产物(8)。苯甲酸单酯产物(8)用mno2进一步氧化以98%的产率得到了不饱和醛(7),化合物(7)用在低温下原位形成的丙炔酸甲酯锂处理,以优异的产率生成前体炔丙醇(5)。最令人满意的是,炔丙醇(5)通过碱介导的氧化还原异构化反应成功地进行了转化,得到了所期望的目标分子melodienone(1)和isomelodienone(3),产率为51%,z/e比为1:1.1。
[0032][0033]
合成过程中具体包括如下的实验步骤
[0034]
a)化合物8的合成
[0035][0036]
冰水浴中,向溶有顺式
‑
1,2
‑
二羟甲基乙烯10(1.0g,11.4mmol)的thf(17ml)溶液中加入nah(0.47g,11.7mmol,60%煤油混合物),并于8分钟内加完。待混合物搅拌30分钟后,向其缓慢滴加溶解在四氢呋喃(thf,13ml)中的苯甲酰氯9(1.31ml,11.4mmol)。0℃下继续反应约3小时。tlc跟踪监测,当产物8不再生成时,用水(5ml)淬灭反应。混合溶液先用乙酸乙酯(3
×
30ml)萃取,合并有机相,再用饱和食盐水(20ml)洗涤及无水硫酸钠干燥,减压蒸馏得到粗产物。粗产物经快速柱层析(正己烷/乙酸乙酯=3/1)分离纯化后得到透明油状化合物8(1.6g,8.32mmol),产率为33%。
[0037]
b)化合物7的合成
[0038][0039]
将称取好的化合物8(1.0g,5.2mmol)溶解在二氯甲烷(dcm,50ml)溶液中,加入二氧化锰(mno2,2.26g,26mmol),室温下搅拌8小时。tlc监测,待反应完成后,将溶液过滤去除残渣,过滤后的液体减压浓缩,粗产物经快速柱层析(正己烷/乙酸乙酯=10/1)分离纯化后得到透明油状化合物7(0.97g,5.1mmol),产率为98%。
[0040]
c)化合物5的合成
[0041][0042]
在
‑
78℃,氮气氛围下向新制的二异丙基氨基锂的thf(10ml,2.5mmol,0.25mmol/ml)溶液中,逐滴添加丙炔酸甲酯11(206μl,2.31mmol)。反应10分钟后,通过注射器添加溶解在thf(2ml)中的化合物7(0.4g,2.10mmol)的溶液,低温搅拌30分钟。tlc点板监测,待反应完成后,将饱和氯化铵水溶液(10ml)缓慢加入反应瓶中,然后加入乙酸乙酯(3
×
20ml)萃取,合并有机相,经饱和食盐水(30ml)洗涤,无水硫酸钠干燥,减压浓缩去除溶剂,粗品经硅胶柱层析进一步纯化,用正己烷/乙酸乙酯=2:1洗脱得到黄色油状化合物5(426mg,1.55mmol,74%)。
[0043]
d)melodienone(1)和isomelodienone(3)的合成。
[0044][0045]
室温下,将称取的炔丙醇衍生物5(164mg,0.6mmol)溶解在乙腈(5ml)溶液中,添加
三乙胺(83μl,0.6mmol,),反应液在室温下搅拌3小时。tlc监测,待反应完成后,加入1n盐酸将反应液ph调至中性,乙酸乙酯(3
×
20ml)萃取,饱和食盐水(30ml)洗涤,无水硫酸钠干燥,真空减压浓缩后,残余物通过硅胶柱色谱法(乙酸乙酯/己烷=20:1到5:1)进一步纯化,得到淡黄色油状产物1和3(84mg,0.31mmol,51%收率),二者之比为1.1:1。
[0046]
实施例2:homomelodienone(2)和homoisomelodienone(4)的全合成。
[0047]
如式4所示,与melodienone(1)和isomelodienone(3)的合成类似,当关键前体(7)在低温下用丙炔酸乙酯锂处理后,它也如预期的一样顺利地以优异的产率生成了所需的炔丙醇衍生物(6),产率为79%。经过上述确立的碱介导的反应条件处理后,乙烯基炔丙醇(6)最终的氧化还原异构化也成功地进行,以42%的产率得到了目标天然产物homomelodienone(2)和homoisomelodienone(4),z/e比为1:1.2。自此,本文共从市售价格低廉的原料出发,共经四个线性步骤安全高效的完成了一系列天然产物melodienones的全合成,充分展示了改进的炔丙醇异构法在天然产物全合成中的应用前景。
[0048][0049]
合成过程中具体包括如下的实验步骤:
[0050]
a)化合物6的合成
[0051][0052]
氮气保护下向新制的二异丙基氨基锂的thf(10ml,2.5mmol,0.25mmol/ml)溶液中,逐滴添加丙炔酸乙酯12(227μl,2.31mmol)。
‑
78℃下反应10分钟后,通过注射器添加溶解在thf(2ml)中的化合物7(0.4g,2.10mmol)的溶液,继续搅拌30分钟。tlc监测,待反应完成后,饱和氯化铵淬灭,加入乙酸乙酯(3
×
20ml)萃取,合并有机相,经饱和食盐水(30ml)洗涤,无水硫酸钠干燥,减压浓缩后,粗品经硅胶柱层析进一步纯化,用正己烷/乙酸乙酯=2:1洗脱得到黄色油状化合物6(479mg,1.66mmol,79%)。
[0053]
b)homomelodienone(2)和homoisomelodienone(4)的合成。
[0054][0055]
将炔丙醇衍生物6(173mg,0.6mmol)溶解在乙腈(5ml)溶液中,然后加入三乙胺(83
μl,0.6mmol,),室温下搅拌3小时,反应过程中用tlc监测。待原料消失后,加入1n盐酸将反应液ph调至中性,加入乙酸乙酯(3
×
20ml)萃取,合并有机层后用饱和食盐水(30ml)洗涤,无水硫酸钠干燥,真空减压浓缩后,粗品经硅胶柱色谱进一步纯化(乙酸乙酯/正己烷=20:1到5:1),顺利得到了淡黄色的油状产物2和4(73mg,0.25mmol,42%),二者之比为1.2:1。
[0056]
化合物melodienone(1)、homomelodienone(2)、isomelodienone(3)和homoisomelodienone(4)的核磁数据如表1
‑
7所示。
[0057]
表1、the comparison of 1
h nmr data of melodienone(1)
[0058][0059][0060]
a
the 1
h nmr data were recorded on a bruker avance 400spectrometer in cdcl3.
[0061]
b
the 1
h nmr data were recorded on a bruker avance 500spectrometer in cdcl
3 and referenced against residual chcl
3 in cdcl
3 as 7.26ppm.
[0062]
c
δδ/ppm refers the relative difference of each signal between the synthetic and natural samples.
[0063]
表2、the comparison of 13
c nmr data of melodienone(1)
[0064][0065][0066]
a
the 13
c nmr data were recorded on a bruker avance 100spectrometer in cdcl3.
[0067]
b
the 13
c nmr data were recorded on a bruker avance 500spectrometer in cdcl
3 and referenced against residual chcl
3 in cdcl
3 as 77.2ppm.
[0068]
c
δδ/ppm refers the relative difference of each signal between the synthetic and natural samples.
[0069]
表3、the comparison of 1
h nmr data of isomelodienone(3)
[0070][0071]
a
the 1
h nmr data were recorded on a bruker avance 200spectrometer in cdcl3.
[0072]
b
the 1
h nmr data were recorded on a bruker avance 500spectrometer in cdcl
3 and referenced against residual chcl
3 in cdcl
3 as 7.26ppm.
[0073]
c
δδ/ppm refers the relative difference of each signal between the synthetic and natural samples.
[0074]
表4、the comparison of 13
c nmr data of isomelodienone(3)
[0075][0076]
a
the 13
c nmr data were recorded on a bruker avance 125spectrometer in aceton
‑
d6.
[0077]
b
the 13
c nmr data were recorded on a bruker avance 125spectrometer in cdcl
3 and referenced against residual chcl
3 in cdcl
3 as 77.2ppm.
[0078]
c
δδ/ppm refers the relative difference of each signal between the synthetic and natural samples.
[0079]
表5、the comparison of 1
h nmr data of homomelodienone(2)
[0080]
[0081][0082]
a
the 1
h nmr data were recorded on a bruker avance 500spectrometer in cdcl3.
[0083]
b
the 1
h nmr data were recorded on a bruker avance 500spectrometer in cdcl
3 and referenced against residual chcl
3 in cdcl
3 as 7.26ppm.
[0084]
c
δδ/ppm refers the relative difference of each signal between the synthetic and natural samples.
[0085]
表6、the comparison of 1
h nmr data of homoisomelodienone(4)
[0086]
[0087][0088]
a
the 1
h nmr data were recorded on a bruker avance 500spectrometer in cdcl3.
[0089]
b
the 1
h nmr data were recorded on a bruker avance 500spectrometer in cdcl
3 and referenced against residual chcl
3 in cdcl
3 as 7.26ppm.
[0090]
c
δδ/ppm refers the relative difference of each signal between the synthetic and natural samples
[0091]
表7、the comparison of 13
c nmr data of homoisomelodienone(4)
[0092]
[0093][0094]
a
the 13
c nmr data were recorded on a bruker avance 125spectrometer in cdcl3.
[0095]
b
the 13
c nmr data were recorded on a bruker avance 125spectrometer in cdcl
3 and referenced against residual chcl
3 in cdcl
3 as 77.2ppm.
[0096]
c
δδ/ppm refers the relative difference of each signal between the synthetic and natural samples.
[0097]
对合成的melodienone(1)、homomelodienone(2)、isomelodienone(3)和homoisomelodienone(4)的核磁光谱进行分析,发现其测试值也与理论值相符合。从而证实了本实验仅用4个线性步骤就成功简明的完成了这些天然产物的合成。
[0098]
具体的实验数据如下:
[0099]
1、(e)
‑4‑
hydroxybut
‑2‑
en
‑1‑
yl benzoate(8)
[0100][0101]
colorless oil(1.6g,8.32mmol;74%yield);8:1h nmr(500mhz,cdcl3):δ
h 8.03(m,2h),7.53(m,1h),7.41(m,2h),5.95(m,2h),4.81(dd,j=5.6,1.2hz,2h),4.17(s,2h),2.39(brs,1h);
13
c nmr(125mhz,cdcl3):δ
c 166.5,133.7,133.1,130.1,129.7,128.4,125.0,64.8,62.6;hresims m/z 193.0857[m+h]
+
(calcd for c
11
h
13
o3,193.0865).
[0102]
2、(e)
‑4‑
oxobut
‑2‑
en
‑1‑
yl benzoate(7)
[0103][0104]
colorless oil(970 mg,5.10 mmol,98%);7:1h nmr(500 mhz,cdcl3):δ
h 9.62(d,j=7.8hz,1h),8.07(m,2h),7.59(m,1h),7.47(t,j=7.8hz,2h),6.94(dt,j=15.8,4.2hz,1h),6.40(m,1h),5.11(dd,j=4.2,1.9hz,2h);
13
c nmr(125mhz,cdcl3):δ
c 192.9,165.8,149.7,133.6,132.2,129.8,129.3,128.6,62.9;hresims m/z 213.0518[m+na]
+
(calcd for c
11
h
10
o3na,213.0528).
[0105]
3、(e)
‑4‑
hydroxy
‑7‑
methoxy
‑7‑
oxohept
‑2‑
en
‑5‑
yn
‑1‑
yl benzoate(5)
[0106][0107]
yellow oil(426mg,1.55mmol,74%);6:1h nmr(500mhz,cdcl3):δ
h 8.06(m,2h),7.57(m,1h),7.45(m,2h),6.16(m,1h),5.97(m,1h),5.07(d,j=5.4hz,1h),4.87(m,2h),3.78(s,3h);
13
c nmr(125mhz,cdcl3):δ
c 166.4,153.7,133.3,130.2,129.9,129.8,128.6,128.1,85.5,77.6,63.9,61.9,53.1;hresims m/z 275.0915[m+h]
+
(calcd for c
15
h
15
o5,275.0919).
[0108]
4、melodienone(1)and isomelodienone(3)
[0109][0110]
light yellow oils(84mg,0.31mmol,51%total yield,e/z=1.1:1);
[0111]
melodienone(1):1h nmr(500mhz,cdcl3):δ
h 8.09(d,j=7.4hz,2h),7.61(t,j=7.4hz,1h),7.49(t,j=7.8hz,2h),7.39(d,j=15.7hz,1h),7.09(dt,j=15.9,4.4hz,1h),6.78(d,j=15.7hz,1h),6.62(dt,j=16.0,2.0hz,1h),5.08
‑
5.09(dd,j=4.4,2.0hz,2h),3.82(s,3h);
13
c nmr(125mhz,cdcl3):δ
c 188.0,166.0,166.0,142.6,138.0,133.6,131.6,129.9,129.5,128.8,128.7,63.2,52.5;hresims m/z 275.0915[m+h]
+
(calcd for c
15
h
15
o5,275.0919);
[0112]
isomelodienone(3):1h nmr(500mhz,cdcl3):δ
h 8.08(dd,j=8.4,1.4hz,2h),7.60(tt,j=8.1,1.3hz,1h),7.47(tt,j=8.1,1.3hz,2h),6.88(dt,j=16.2,4.4hz,1h),6.62(d,j=12.1hz,1h),6.51(dt,j=16.2,1.9hz,1h),6.20(d,j=12.1hz,1h),5.04(dd,j=4.5,1.9hz,2h),3.73(s,3h);
13
c nmr(125mhz,cdcl3):δ
c 193.1,166.0,165.5,142.3,140.4,133.6,130.1,129.9,129.5,128.7,126.3,63.1,52.2;hresims m/z 297.0734[m+na]
+
(calcd for c
15
h
14
o5na,297.0739).
[0113]
5、(e)
‑7‑
ethoxy
‑4‑
hydroxy
‑7‑
oxohept
‑2‑
en
‑5‑
yn
‑1‑
yl benzoate(6)
[0114][0115]
yellow oil(479mg,1.66mmol,79%);6:1h nmr(500mhz,cdcl3):δ
h 8.06(m,2h),7.56(m,1h),7.45(t,j=7.8hz,2h),6.15(m,1h),5.97(m,1h),5.07(m,1h),4.87(dt,j=5.5,1.4hz,2h),4.24(q,j=7.1hz,2h),1.31(t,j=7.1hz,3h);
13
c nmr(125mhz,cdcl3):δ
c 166.3,153.3,133.3,130.2,129.9,129.8,128.6,128.1,85.0,77.9,63.9,62.5,62.0,14.1;hresims m/z289.1069[m+h]
+
(calcd for c
16
h
17
o5,289.1076).
[0116]
6、homomelodienone(2)and homoisomelodienone(4)
[0117][0118]
light yellow oils(73mg,0.25mmol,42%total yield,e/z=1.2:1);
[0119]
homomelodienone(2):1h nmr(500 mhz,cdcl3):δ
h 8.09(d,2h,j=7.8hz),7.60(t,j=7.8hz,1h),7.48(t,j=7.8hz,2h),7.36(d,j=15.8hz,1h),7.09(dt,j=15.9,4.4hz,1h),6.76(d,j=15.8hz,1h),6.62(dt,j=15.9,1.9hz,1h),5.07(dd,j=4.4,2.0hz,2h),4.27(q,j=7.1hz,2h),1.32(t,j=7.1hz,3h);
13
c nmr(125mhz,cdcl3):δ
c 188.1,165.9,165.6,142.5,137.8,133.6,132.1,129.9,129.5,128.7,128.7,63.2,61.6,14.3;hresims m/z 289.1071[m+h]
+
(calcd for c
16
h
17
o5,289.1076);
[0120]
homoisomelodienone(4):1h nmr(500mhz,cdcl3):δ
h 8.07(dd,j=7.8,1.3hz,2h),7.60(tt,j=7.8,1.3hz,1h),7.47(t,j=7.8hz,2h),6.88(dt,j=16.2,4.4hz,1h),6.60(d,j=12.1hz,1h),6.51(dt,j=16.2,1.9hz,1h),6.18(d,j=12.1hz,1h),5.04(dd,j=4.4,1.9hz,2h),4.18(q,j=7.2hz,2h),1.26(t,j=7.2hz,3h);
13
c nmr(125mhz,cdcl3):δ
c 193.3,166.0,165.0,142.1,140.1,133.6,130.2,129.9,128.7,128.6,126.7,63.1,61.4,14.1;hresims m/z311.0891[m+na]
+
(calcd for c
16
h
16
o5na,311.0895).
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1