体外高效扩增NK和转染NKG2D活化NK细胞的方法与流程
体外高效扩增nk和转染nkg2d活化nk细胞的方法
技术领域
1.本发明属于生物医药领域,细胞治疗技术范畴,具体是体外高效扩增nk和转染nkg2d 活化nk细胞的方法。
背景技术:
2.采用新细胞因子组合方案在体外成功高效扩增高纯度nk细胞技术的基础上,继续优化 nk细胞临床产业化培养方案和选择nkg2d这一活化受体靶点分子,对nk细胞进行了 nkg2d修饰,期望获得具有更好靶向性、更高杀伤活性及持久性的靶向肿瘤细胞分子的nk 细胞,具有重要的临床价值和科学意义。
3.肿瘤在机体内的发生发展过程中,nk细胞均可以起到“控制”作用,基于nk细胞的肿瘤免疫治疗具有良好的临床应用前景。虽然nk细胞在临床应用上的安全性和疗效得到肯定,但由于它仅占外周血淋巴细胞的10%
‑
20%,因而如何获得高纯度、高质量的nk细胞成为治疗的关键。所以有必要建立一种nk细胞体外扩增技术,用于研究nk细胞的功能,并为肿瘤的细胞免疫治疗奠定基础。从产业化制备nk细胞的角度出发,建立nk细胞的高效扩增技术以及分析与功能相关的免疫表型等,为其下一步的临床应用奠定基础。
4.健康的供体可通过白细胞单采术及免疫磁珠分选来获得纯度很高的nk细胞,但使用这两种方法取的nk细胞过程中会造成细胞的活化及损失,故很难得到大量纯度很高的nk细胞,另外临床补充血源途径中脐血来源,由于脐血数量的限制而不能采用单采术来获得足量的nk细胞。传统的nk细胞扩增技术由于扩增效率不高且纯度不够未能得到广泛应用。在扩增的过程中添加辅助细胞提高nk细胞扩增效率等,并以此细胞来刺激nk细胞的增殖,但最后发现其结果并不十分理想。故通过何种办法能有效地在体外获得数量足够且纯度较高的nk细胞,这仍然是nk细胞临床治疗需要解决的问题。
5.研究发现,综合使用各种细胞因子或许在体外、体内有助于nk的增殖及效应功能。γ链细胞因子在nk细胞增殖及功能发挥上发挥了重要作用,该家族成员包括il
‑
2、il
‑
4、 il
‑
7、il
‑
9、il
‑
15和il
‑
21等。在nk细胞分化过程中,不同的细胞因子都具有不同的作用。
6.在前期利用不同细胞因子组合方法建立体外高效扩增高纯度nk细胞技术,拟进一步优化nk细胞培养方案,并为了提高nk细胞杀伤肿瘤细胞的特异性,继续对nk细胞进行基因修饰活化。
7.基因修饰可以作为一种技术手段改变细胞的功能,已经被广泛应用于多种细胞如t细胞、 dc、单核细胞和nk细胞等。尤其是对细胞进t行基因修饰,已经取得了长足进展。nk细胞在这方面的研究明显落后于t细胞,但随着理论研究的深入和技术手段的发展,已逐步走上正轨。
8.nk细胞表面存在识别靶细胞表面分子的活化受体和抑制性受体,nk细胞对靶细胞效应功能取决于活化信号与抑制性信号的综合,即何者占优势。活化受体识别经典、非经典的mhci类分子或mhc i类相关分子,在nk活化的启动方面起关键作用,其中尤为引人注目的是 nkg2d,nkg2d不仅表达于所有的nk细胞,而且在nkt细胞和活化的巨噬细胞均有表达。
9.nkg2d识别的配基具有高度多态性的mhc
‑
i类链相关分子mica、micb及ulbp 1,2,3。在正常情况下,mica和micb表达仅限于胃肠上皮,但这些分子在许多上皮及非上皮来源的肿瘤细胞、病毒感染细胞和受到“应激性刺激”的细胞均有表达或上调。ulbps虽然表达相对广泛,但正常处于低表达状态,在许多肿瘤组织呈现高表达。研究表明,nkg2d的单独活化即足以刺激nk细胞的活化,并能克服抑制性受体的强势信号,因此,在nk细胞活化过程中起着举足轻重的作用。
10.体外高效扩增nk和转染nkg2d活化nk细胞技术拟解决的关键问题有:(1)进一步优化产业化高效扩增高纯度nk细胞技术,主要采用细胞因子组合添加方法体外大规模培养 nk细胞,使用这些细胞因子时,考虑到一方面这些因子是nk功能有力激活剂,;另外一方面考虑高效扩增nk细胞的效应功能,适用于产业化生产nk细胞。(2)转染nkg2d涉及外源基因在哺乳动物细胞的表达的技术问题,其表达水平受基因拷贝、转录、翻译及翻译后修饰降解等多因素的影响。因此我们拟在进行nkg2d基因的表达研究中采用pegfp
‑
n1与 nkg2d基因片段的orf正确连接,目的基因在较强的cmv中早期启动子的作用下转录,以期获得较高的转录效率。
技术实现要素:
11.本发明提供一种利用基因工程技术构建pegfp
‑
n1/nkg2d真核荧光表达载体,将构建好的pegfp
‑
n1/nkg2d质粒转染nk细胞,应用mtt方法检测nkg2d转染前后nk细胞的增殖情况和对肿瘤细胞系的杀伤效应,rt
‑
pcr方法检测相关杀伤分子il
‑
2、tnf
‑
a、 perforin、tweak的mrna表达水平,为nk细胞用于肿瘤和肿瘤过继免疫治疗提供了新的思路的体外高效扩增nk和转染nkg2d活化nk细胞的方法。
12.本发明所采用的技术方案为:体外高效扩增nk和转染nkg2d活化nk细胞的方法,其特征在于:包括具体方法为:
13.s1:nk细胞体外高效扩增技术优化及nk免疫生物学特性检测;流式细胞仪检测cd3
‑ꢀ
cd16+cd56+nk细胞亚群含量以及nk细胞上cd62l、激活性受体nkg2d、自然细胞毒受体nkp30、nkp44、nkp46、颗粒酶b、穿孔素的表达情况;
14.s2:应用rt
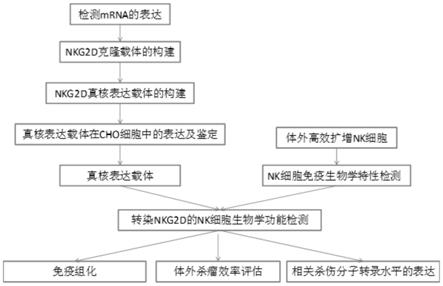
‑
pcr方法检测肿瘤细胞及肿瘤组织中nkg2d配体mica,ulbp 1,2,3的 mrna表达;
15.s3:nkg2d克隆载体的构建;从nk细胞中经rt
‑
pcr技术获得nkg2d cdna,与 pgem
‑
t easy连接及转化大肠杆菌后,构建nkg2d克隆载体,进行dna序列测定;
16.s4:nkg2d真核表达载体的构建;应用限制性内切酶将nkg2d基因从克隆载体上切下来,连接到荧光真核表达载体pegfp
‑
n1上,构建pegfp
‑
n1/nkg2d真核表达载体;
17.s5:真核表达载体在cho细胞中的表达及鉴定;将筛选出的pegfp
‑
n1/nkg2d质粒通过脂质体转染到cho细胞中,经g418筛选,克隆,rt
‑
pcr鉴定nkg2d mrna的表达,荧光显微镜、western blot和免疫组化方法鉴定nkg2d蛋白的表达;
18.s6:真核表达载体转染nk细胞及对nk细胞生物学功能影响。
19.所述nk细胞体外高效扩增方案标准操作流程:
20.s1:包被:t 175培养瓶中8ml dpbs加入组合细胞因子,置于37℃培养箱中,包被2 小时;
21.s2:第一天:细胞制备;
22.a:抽取抗凝外周血50ml,800g,15min室温离心;
23.b:自体血浆制备:取上清血浆,置于水浴锅中56℃,30min;然后
‑
20℃静置10min;最后4℃,1100g,离心15min,4℃保存备用;
24.c:取上述离心后下部细胞成分,加d
‑
pbs至50ml,混匀,加到2个装有20ml医疗级淋巴细胞分离液的50ml离心管中,800g,15min室温离心;
25.d:取细胞层,加入培养基至50ml,600g 10min,弃上清液;
26.e:分离出的pbmc加入40ml组合细胞因子,制成细胞悬液,加入到弃掉包被液的培养瓶中,加入2ml血浆,置于饱和湿度、37℃、5.0%co2培养箱中培养;
27.f:nk培养液配置方法:活化培养基为500ml增殖培养基中加入组合细胞因子,增殖培养基为每1000mlnk
‑
ex培养基加入组合细胞因子,先使用完活化培养基,再使用增殖培养基;
28.s3:第四天:加入40mlnk活化培养基重悬,种入原培养瓶,加入4ml血浆,加入本试剂盒组合细胞因子;
29.s4:第六天:补加70mlnk活化培养基,加入4ml血浆,加入组合细胞因子;
30.s5:第八天:将培养瓶中细胞完全吹打下来,加入剩下血浆,转移到1个培养袋,建议补至400ml;
31.s6:第十天:视细胞生长状态,每个培养袋补加nk培养液400ml;
32.s7:第十一天:视细胞生长状态,每个培养袋补加nk培养液700ml;送检第三方做细菌、真菌、支原体、内毒素检测同时做好自检;
33.s8:第十五天:收集nk细胞悬液1500ml,1500rpm
×
8min离心后弃去上清液,250ml 离心管集2管每管生理盐水200ml洗涤(1500rpm
×
8min)1次,再用50ml离心管生理盐水 100ml洗涤(1200rpm
×
8min)1次,按照200ml生理盐水+8ml 20%血清白蛋白重悬细胞,封装好后送病房,同时留样封存以备日后检测。
34.所述nk免疫生物学特性检测包括nk细胞检测前处理、nk细胞表面受体的检测、颗粒酶b和穿孔素的检测。
35.所述nk细胞检测前处理先收集培养nk细胞,在流试管中加入3%乙酸溶液0.38ml(即取冰乙酸3ml,加蒸馏水至100ml混合),然后所需检测的细胞0.02ml,立即吹入稀释液中,并将吸管壁的血洗入稀释液内,轻轻摇匀;用小滴管自上述摇匀的稀释液中吸取少量液体加入血细胞计数池内,静置1~2分钟,在显微镜下用低倍镜计数4个大方格的白细胞总数;进行细胞计数后,将细胞浓度调整为5
×
106/ml。
36.所述nk细胞表面受体的检测标记抗体的方法为:各取50ul培养的细胞加入每只流式检测管中,每组共9管,在避光条件下按照以下的顺序标记抗体,加入每种抗体10ul,标记抗体后,将每个流式检测管充分振荡后混匀,置于4℃避光环境中30分钟,使抗体与细胞发生充分的反应;将充分孵育后的标本加入pbs缓冲液2ml,振荡混匀后,1000rpm 20℃离心10分钟,弃上清,再加入pbs缓冲液2ml,1000rpm 20℃离心10分钟,弃上清,用 300μl的pbs缓冲液重悬细胞,加入100μl 3%中性甲醛固定液后进行流式细胞仪检测。
37.所述颗粒酶b和穿孔素的检测取50ul培养的细胞加入1支流式检测管中,在避光条件下分别标记cd56抗体,加入每种抗体10ul;标记抗体后,将各流式检测管充分振荡混匀,
置于4℃避光环境中30分钟,使抗体与细胞发生充分的反应;加入pbs于试管中混匀,4℃ 1000rpm 20℃离心10分钟,弃上清,重悬细胞;加入100ul破膜剂1,室温下避光反应 15min;加入破膜剂2,室温下反应5min,用pbs洗涤1次,1000rpm 20℃离心10分钟,去上清;每一管加入加入10ul穿孔素抗体及颗粒酶b抗体,置于4℃避光环境中30分钟, 1000rpm 20℃离心10分钟,去上清;荧光显微镜下确认抗体标记;将孵育后的标本加入pbs 缓冲液2ml,振荡混匀后,1000rpm 20℃离心10分钟,弃上清,再加入pbs缓冲液2ml, 1000rpm 20℃离心10分钟,弃上清,用300μl的pbs缓冲液重悬细胞,加入100μl 3%中性甲醛固定液后进行流式细胞仪检测。
38.所述真核表达载体转染nk细胞及对nk细胞生物学功能影响包括:
39.s1:将pegfp
‑
n1/nkg2d质粒通过脂质体转染到nk细胞中,免疫组化方法检测nkg2d 蛋白在nkg2d转染前后的变化;
40.s2:mtt方法检测nk细胞转染前后的增殖情况及对肿瘤细胞的杀伤情况;
41.s3:rt
‑
pcr技术检测杀伤相关分子,即抗病毒分子ifn
‑
γ、细胞增殖分子il
‑
2、溶膜分子perforin和诱导细胞凋亡分子家族tnf超家族(tnf
‑
a、fas/fasl、trail、tweak)的转录水平,并同时设置β
‑
actin为rt
‑
pcr系统的内参照。
42.本发明的有益效果:
43.一、采用多种细胞因子进行合适组合后,能有效地诱导、刺激特定的nk细胞扩殖,并促进扩增的nk细胞分化成熟。与其它文献中报道的扩增nk细胞法相比,本发明扩增方法避免了加入辅助细胞等,更简单、经济、有效且在扩增倍数、表型纯度,杀伤活性和安全性上都较高的nk细胞,从而为nk细胞的肿瘤早期干预奠定基础。
44.二、选用外周血来源pbmc体外扩增培养nk细胞,培养体系操作步骤容易、流程简化,节省成本,性价比高。
45.三、nk可以用于同种异体移植治疗,增强移植物抗肿瘤反应,并且不会存在移植物抗宿主反应。
46.四、细胞成分纯度高,成分均一,回输后不会出现严重的毒副反应,安全性高。
47.五、利用基因工程方法,通过对nkg2d全长基因的克隆、表达载体的构建及鉴定,获得了nkg2d的重组表达载体,通过nkg2d活化修饰nk细胞,能有效地避免肿瘤细胞及其微环境所产生的包括抑制性细胞等所致的免疫抑制作用,因而不仅提高了nk细胞的杀瘤效应,而且可提高nk细胞的生存时间,可长期在体内存活,具备彻底清除肿瘤细胞的能力。
48.六、由于不依赖于不同个体的hla,同一个nkg2d的结构能应用于半抗原靶向分子中,且不需要抗原递呈的机制而识别肿瘤抗原,能克服肿瘤细胞通过下调mhc以及降低抗原递呈等而介导的免疫逃逸。
附图说明
49.图1为本发明体外高效扩增nk和转染nkg2d活化nk细胞的方法的技术路线图。
具体实施方式
50.体外高效扩增nk和转染nkg2d活化nk细胞的方法,其特征在于:包括具体方法为:
51.s1:nk细胞体外高效扩增技术优化及nk免疫生物学特性检测;流式细胞仪检测
cd3
‑ꢀ
cd16+cd56+nk细胞亚群含量以及nk细胞上cd62l、激活性受体nkg2d、自然细胞毒受体nkp30、nkp44、nkp46、颗粒酶b、穿孔素的表达情况;
52.s2:应用rt
‑
pcr方法检测肿瘤细胞及肿瘤组织中nkg2d配体mica,ulbp 1,2,3的 mrna表达;
53.s3:nkg2d克隆载体的构建;从nk细胞中经rt
‑
pcr技术获得nkg2d cdna,与 pgem
‑
t easy连接及转化大肠杆菌后,构建nkg2d克隆载体,进行dna序列测定;
54.s4:nkg2d真核表达载体的构建;应用限制性内切酶将nkg2d基因从克隆载体上切下来,连接到荧光真核表达载体pegfp
‑
n1上,构建pegfp
‑
n1/nkg2d真核表达载体;
55.s5:真核表达载体在cho细胞中的表达及鉴定;将筛选出的pegfp
‑
n1/nkg2d质粒通过脂质体转染到cho细胞中,经g418筛选,克隆,rt
‑
pcr鉴定nkg2d mrna的表达,荧光显微镜、western blot和免疫组化方法鉴定nkg2d蛋白的表达;
56.s6:真核表达载体转染nk细胞及对nk细胞生物学功能影响。
57.所述nk细胞体外高效扩增方案标准操作流程:
58.s1:包被:t 175培养瓶中8ml dpbs加入组合细胞因子,置于37℃培养箱中,至少包被2小时;
59.s2:第一天:细胞制备;
60.a:抽取抗凝外周血50ml,800g,15min室温离心;
61.b:自体血浆制备:取上清血浆,置于水浴锅中56℃,30min;然后
‑
20℃静置10min;最后4℃,1100g,离心15min,4℃保存备用;
62.c:取上述离心后下部细胞成分,加d
‑
pbs至50ml,混匀,加到2个装有20ml医疗级淋巴细胞分离液的50ml离心管中,800g,15min室温离心;
63.d:取细胞层,加入培养基至50ml,600g 10min,弃上清液;
64.e:分离出的pbmc加入40ml组合细胞因子,制成细胞悬液,加入到弃掉包被液的培养瓶中,加入2ml血浆,置于饱和湿度、37℃、5.0%co2培养箱中培养;
65.f:nk培养液配置方法:活化培养基为500ml增殖培养基中加入组合细胞因子,增殖培养基为每1000mlnk
‑
ex培养基加入组合细胞因子,先使用完活化培养基,再使用增殖培养基;
66.s3:第四天:加入40mlnk活化培养基重悬,种入原培养瓶,加入4ml血浆,加入本试剂盒组合细胞因子;
67.s4:第六天:补加70mlnk活化培养基,加入4ml血浆,加入组合细胞因子;
68.s5:第八天:将培养瓶中细胞完全吹打下来,加入剩下血浆,转移到1个培养袋,建议补至400ml;
69.s6:第十天:视细胞生长状态,建议每个培养袋补加nk培养液400ml;
70.s7:第十一天:视细胞生长状态,建议每个培养袋补加nk培养液700ml;送检第三方做细菌、真菌、支原体、内毒素检测同时做好自检;
71.s8:第十五天:收集nk细胞悬液1500ml,1500rpm
×
8min离心后弃去上清液,250ml 离心管集2管每管生理盐水200ml洗涤(1500rpm
×
8min)1次,再用50ml离心管生理盐水 100ml洗涤(1200rpm
×
8min)1次,按照200ml生理盐水+8ml 20%血清白蛋白重悬细胞,封装好后送病房,同时留样封存以备日后检测。
72.所述nk免疫生物学特性检测包括nk细胞检测前处理、nk细胞表面受体的检测、颗粒酶b和穿孔素的检测。
73.所述nk细胞检测前处理先收集培养nk细胞,在流试管中加入3%乙酸溶液0.38ml(即取冰乙酸3ml,加蒸馏水至100ml混合),然后所需检测的细胞0.02ml,立即吹入稀释液中,并将吸管壁的血洗入稀释液内,轻轻摇匀;用小滴管自上述摇匀的稀释液中吸取少量液体加入血细胞计数池内,静置1~2分钟,在显微镜下用低倍镜计数4个大方格的白细胞总数;进行细胞计数后,将细胞浓度调整为5
×
106/ml。
74.所述nk细胞表面受体的检测标记抗体的方法为:各取50ul培养的细胞加入每只流式检测管中,每组共9管,在避光条件下按照以下的顺序标记抗体,加入每种抗体10ul,标记抗体后,将每个流式检测管充分振荡后混匀,置于4℃避光环境中30分钟,使抗体与细胞发生充分的反应;将充分孵育后的标本加入pbs缓冲液2ml,振荡混匀后,1000rpm 20℃离心10分钟,弃上清,再加入pbs缓冲液2ml,1000rpm 20℃离心10分钟,弃上清,用 300μl的pbs缓冲液重悬细胞,加入100μl 3%中性甲醛固定液后进行流式细胞仪检测。
75.所述颗粒酶b和穿孔素的检测取50ul培养的细胞加入1支流式检测管中,在避光条件下分别标记cd56抗体,加入每种抗体10ul;标记抗体后,将各流式检测管充分振荡混匀,置于4℃避光环境中30分钟,使抗体与细胞发生充分的反应;加入pbs于试管中混匀,4℃ 1000rpm 20℃离心10分钟,弃上清,重悬细胞;加入100ul破膜剂1,室温下避光反应 15min;加入破膜剂2,室温下反应5min,用pbs洗涤1次,1000rpm 20℃离心10分钟,去上清;每一管加入加入10ul穿孔素抗体及颗粒酶b抗体,置于4℃避光环境中30分钟, 1000rpm 20℃离心10分钟,去上清;荧光显微镜下确认抗体标记;将孵育后的标本加入pbs 缓冲液2ml,振荡混匀后,1000rpm 20℃离心10分钟,弃上清,再加入pbs缓冲液2ml, 1000rpm 20℃离心10分钟,弃上清,用300μl的pbs缓冲液重悬细胞,加入100μl 3%中性甲醛固定液后进行流式细胞仪检测。
76.所述真核表达载体转染nk细胞及对nk细胞生物学功能影响包括:
77.s1:将pegfp
‑
n1/nkg2d质粒通过脂质体转染到nk细胞中,免疫组化方法检测nkg2d 蛋白在nkg2d转染前后的变化;
78.s2:mtt方法检测nk细胞转染前后的增殖情况及对肿瘤细胞的杀伤情况;
79.s3:rt
‑
pcr技术检测杀伤相关分子,即抗病毒分子ifn
‑
γ、细胞增殖分子il
‑
2、溶膜分子perforin和诱导细胞凋亡分子家族tnf超家族(tnf
‑
a、fas/fasl、trail、tweak)的转录水平,并同时设置β
‑
actin为rt
‑
pcr系统的内参照。
80.一、采用多种细胞因子进行合适组合后,能有效地诱导、刺激特定的nk细胞扩殖,并促进扩增的nk细胞分化成熟。与其它文献中报道的扩增nk细胞法相比,本发明扩增方法避免了加入辅助细胞等,更简单、经济、有效且在扩增倍数、表型纯度,杀伤活性和安全性上都较高的nk细胞,从而为nk细胞的肿瘤早期干预奠定基础。
81.二、选用外周血来源pbmc体外扩增培养nk细胞,培养体系操作步骤容易、流程简化,节省成本,性价比高。
82.三、nk可以用于同种异体移植治疗,增强移植物抗肿瘤反应,并且不会存在移植物抗宿主反应。
83.四、细胞成分纯度高,成分均一,回输后不会出现严重的毒副反应,安全性高。
84.五、利用基因工程方法,通过对nkg2d全长基因的克隆、表达载体的构建及鉴定,获得了nkg2d的重组表达载体,通过nkg2d活化修饰nk细胞,能有效地避免肿瘤细胞及其微环境所产生的包括抑制性细胞等所致的免疫抑制作用,因而不仅提高了nk细胞的杀瘤效应,而且可提高nk细胞的生存时间,可长期在体内存活,具备彻底清除肿瘤细胞的能力。
85.六、由于不依赖于不同个体的hla,同一个nkg2d的结构能应用于半抗原靶向分子中,且不需要抗原递呈的机制而识别肿瘤抗原,能克服肿瘤细胞通过下调mhc以及降低抗原递呈等而介导的免疫逃逸。
86.以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术员应当理解:其依然可以对前述实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明实施例技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1