新的重组杆状病毒基因组插入位点及其应用
1.本发明属于病毒载体技术领域,更具体地,涉及一种重组杆状病毒表达系统中重组杆状病毒(bev)基因组中能够允许外源基因稳定表达的新的插入位点及其应用。
背景技术:
2.昆虫细胞表达系统(即重组杆状病毒表达系统)具有重组蛋白表达量高、蛋白翻译后修饰较为全面、适合大规模生产、生产成本较低等优势,已被广泛用于多种重组蛋白的表达、药物研发、药物和疫苗等的商业化生产。其中,重组杆状病毒(bev)作为外源基因表达载体主要有以下优势:杆状病毒基因组相对较小易于操作,可容纳的外源基因片段较大、安全性高等。目前,重组杆状病毒(bev)应用最广泛的是基于苜蓿银纹夜蛾核形多角体病毒(acmnpv)基因组改造而来,acmnpv基因组为双链环状dna,全长133,966bp,序列和图谱参考(maghodia等,genome announc,2014,2(6):e01202-14.),应用较为广泛昆虫细胞系是来自草地贪夜蛾(spodoptera frugiperda)的sf9细胞。
3.现有的重组杆状病毒表达系统中,其中被广泛采用的是bac-to-bac系统,该系统最早的开发者luckow等选用杆状病毒的复制非必须基因多角体基因(polyhedron,polh)位点作为tn7转座子的重组位点,外源基因选择插入这个基因座通常能够获得很高的表达水平。其原理是:首先将外源基因构建到穿梭质粒中,接着将重组穿梭质粒转化含有重组杆粒的大肠杆菌,通过tn7转座子介导的细菌水平重组将重组穿梭质粒携带的外源基因整合到重组杆粒中。然后从上述大肠杆菌中抽提获得的重组杆粒dna转染昆虫细胞后拯救出携带有外源基因的重组杆状病毒bev。该系统中这种既能在大肠杆菌中进行复制增殖又能在昆虫细胞中进行复制并包装出重组杆状病毒的大分子环状dna被称为杆粒(bacmid),其携带有细菌复制原点、抗生素抗性基因、重组杆状病毒基因组和tn7重组克隆位点,便于重组杆状病毒的构建,acmnpv bacmid(bmon14272)的结构参考(luckow等,j virol,1993.67(8):4566-79.)。
4.有研究报道昆虫杆状病毒表达系统中的bev在传代过程中,会产生并积累丢失部分基因的缺陷干扰病毒,导致外源基因表达下降(pijlman等,j gen virol,2003,84:2669-78)。外源基因在bev基因组中的不稳定因素,包括外源基因自身的不稳定性、插入dna片段的负载、插入的位点以及不同细胞环境对缺陷病毒的选择性等(willemsen等,virus evol,2019,5(2):vez045)。例如:制备重组腺相关病毒载体(raav)的不依赖sf9包装细胞系的新型一杆状病毒(one bac)系统中的bev/cap2-(itr-gfp)-rep稳定性在p4代后出现显著降低(wu等,mol ther methods clin dev,2018;10:38-47)。acmnpv双链环状dna基因组全长约134kbp,含有约150多个开放阅读框(orf)和多种非编码的基因调节序列元件,目前仍有多种orf的功能未知。在杆状病毒基因组中已经发现了多种允许异源基因高表达的复制非必须基因的基因座。noad等发现了ctx、egt、39k、orf51、pg37、iap2、odv-e56非必须基因座(noad等,2009,bmc molecular biology,10:87)。近期,有研究发现bac to bac系统中tn7转座子由原来的polh位点置换到新的插入位点odv-e56基因座时,所获得的bev能够高表达
外源基因,尤其值得的注意的是该bev连续传代的稳定性有显著增强(pijlman等,j gen virol,2003,84:2669-78),这非常有利于扩大感染sf9细胞生产规模。然而,目前发现的这种能够插入较大外源基因后长期稳定传代的bev基因组中的有效插入位点仍然很匮乏。
技术实现要素:
5.针对现有技术的以上缺陷或改进需求,本发明一方面提供了新的可稳定携载外源基因的重组杆状病毒基因组插入位点,通过在杆状病毒acmnpv的基因组中筛选和鉴定出合适的非编码区插入位点s1位点和s2位点,可以实现插入外源基因的bev具有较高的连续传代稳定性,从而为杆状病毒表达系统中的bev基因组中的有效插入位点提供新的选择。另一方面,提供了一种稳定性较高的携带荧光蛋白报告基因的bev,可方便的测定bev的感染滴度。
6.为实现上述目的,本发明采用以下技术方案:
7.重组杆状病毒:在重组杆状病毒acmnpv基因组非编码区s1位点或s2位点插入外源dna,s1位点是开放阅读框ac-orf-19与ac-arif-1之间的223bp非编码区,其核苷酸序列如seq id no.1所示,s2位点是开放阅读框ac-pif-4与ac-38k之间的153bp非编码区,其核苷酸序列如seq id no.2所示。
8.一种稳定性较高的携带荧光蛋白报告基因的重组杆状病毒:在s1或s2位点插入荧光蛋白报告基因表达框。具体地,在本发明的具体实施例中插入红色荧光蛋白(mcherry)报告基因,报告基因表达框为etl-mcherry-sv40pa:杆状病毒早晚期etl启动子调控mcherry报告基因以及sv40pa元件,由于etl属于早晚期启动子,可以在bev感染sf9细胞后,较早的时间启动mcherry的表达,缩短检测时间。
9.稳定性较高的携带荧光蛋白报告基因的重组杆状病毒在可视化检测重组杆状病毒感染滴度中的应用,包括以下步骤:
10.(1)构建含有表达荧光蛋白报告基因的表达框,该表达框两侧为s1或s2插入位点上下游同源臂;
11.(2)利用red重组将荧光蛋白报告基因的表达框重组进上述插入位点,并获得重组病毒;
12.(3)将获得的bev病毒,按照一定的比例梯度稀释后感染96孔板中培养的sf9细胞;
13.(4)感染48h后,可通过荧光显微镜观察荧光报告基因的表达,测定raav的感染活性。与现有技术相比,本发明具有以下优点及有益效果:
14.1、本发明筛选获得的2个插入位点所在的非编码区序列,有一个共同的特点,均位于2个尾对尾的orf终止密码子之间的序列。由于一般orf终止密码子之后的序列,相比orf起码密码子之前的序列,对于orf的表达影响相当较小。这也可能是我们所选择的2个插入位点序列获得成功的原因之一。
15.2、相对于有些外源基因插入在非必须基因座,虽然不影响复制,但影响odv的生成,导致不能利用bev口服感染昆虫虫体,而在本发明提供的两个插入位点插入外源基因并不破坏原有基因组的构成,对bev天然属性影响小,
16.3、在本发明提供的s1或s2位点插入红色荧光蛋白基因表达框后获得的重组杆状病毒连续传代多次(至少9代)后,荧光蛋白基因的表达仍然能够维持较高的水平,该重组杆
状病毒可应用于快速可视化检测bev的感染滴度。
附图说明
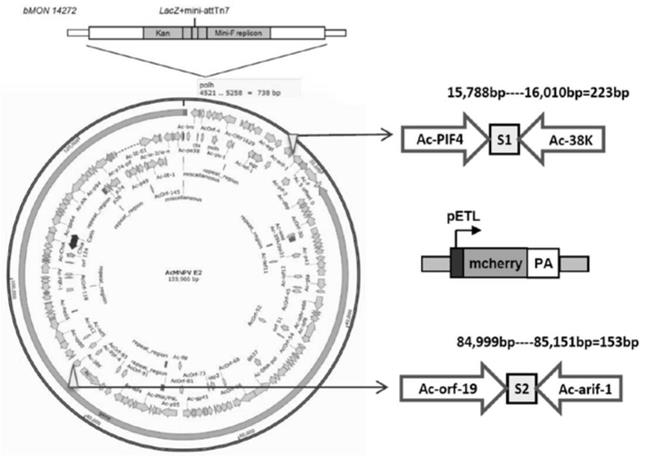
17.图1是本发明杆状病毒acmnpv基因组插入位点s1和s2以及插入红色荧光蛋白mcherry报告基因表达框的示意图。左侧为acmnpv重组杆粒基因组示意图,其中杆状病毒acmnpv基因组为双链环状dna,全长133,966bp。
18.图2是在杆状病毒基因组插入位点s1和s2插入红色荧光蛋白(mcherry)报告基因表达框,获得的重组杆状病毒bev-s1-mcherry和bev-s2-mcherry感染sf9细胞后表达红色荧光的结果。
19.图3是实施例1和实施例2中获得的bev-s1-mcherry和bev-s2-mcherry连续传代稳定性测试结果。
20.图4是实施例1中获得的bev-s1-mcherry梯度稀释感染sf9细胞进行感染滴度测试的结果。
21.图5是实施例2中获得的bev-s2-mcherry梯度稀释感染sf9细胞进行感染滴度测试的结果。
具体实施方式
22.我们通过对杆状病毒acmnpv基因组序列进行分析,选择了多个位点进行测试,最终优选出2个非编码区插入位点s1(对应于orf ac-orf-19与orf ac-arif-1之间的223bp非编码区序列,其核苷酸序列如seq id no.1所示)和s2(对应于orf ac-pif-4与orf ac-38k之间的153bp非编码区序列,其核苷酸序列如seq id no.2所示)。
23.实施例1.构建s1插入位点表达报告基因mcherry的bev
24.为了便于重组克隆操作,我们利用red重组技术,使用转化有pkd46质粒并含有acmnpv杆粒的大肠杆菌dh10bac菌株,通过同源臂基因重组的方法来改造杆粒基因组。pkd46质粒是温度敏感型低拷贝质粒,在20~25℃条件下,加入阿拉伯糖可以诱导exo、beta和gam这3种蛋白(即red重组酶)的表达,能够将携带有同源臂的外源基因与细菌中的杆粒基因组进行高效的特异性重组(参考doublet等,2008,j microbiol methods.,75(2):359-61)。为了便于重组子的筛选,引入两侧带有frt序列的氯霉素(chloromycetin,chlo)抗性基因(用引物从pkd3质粒上扩增片段p1-frt-chlo-p2,序列如seq id no.3所示),便于随后通过flp重组酶的作用去除该抗性基因。
25.本实施例中选用杆状病毒早晚期etl启动子调控红色荧光蛋白(mcherry)报告基因,加上sv40pa元件的表达框mcherry报告基因的表达框为etl-mcherry-sv40pa,优选seq id no.4所示的序列。由于etl属于早期至晚期启动子,可以在bev感染sf9细胞后,较早的时间启动mcherry的表达,缩短检测时间。具体方法如下:
26.我们利用pbluescriptii ks(+)质粒骨架进行构建,在pblue质粒的sal1和spe1酶切位点之间引入人工合成的上游同源臂s1-up(如seq id no.5所示的序列)和下游同源臂s1-down(如seq id no.6所示的序列),然后将氯霉素抗性基因片段p1-frt-chlo-p2和mcherry报告基因的表达框etl-mcherry-sv40pa插入到上下同源臂的中间。通过多片段重组克隆的方法,构建质粒pblue-s1-up-p1-frt-chlo-p2-mcherry-s1-down。然后用sal1和
mcherry的p1-p9病毒代感染sf9细胞后,红色荧光蛋白(mcherry)的表达都维持了较高的水平,bev稳定性得到了较大程度的提高(图3)。综上,实验结果表明bev-s1-mcherry和bev-s2-mcherry在p1-p9代稳定性较好,在bev基因组的s1和s2位点允许插入一定长度的外源基因片段而不影响bev的复制且具有较好的传代稳定性。
34.实施例4.利用表达报告基因mcherry测试bev的感染滴度
35.我们将上述实施例中获得的bev-s1-mcherry(p1)和bev-s2-mcherry(p1)按10μl的起始感染体积进行10倍梯度稀释,然后分别感染96孔板中培养的sf9细胞(约70%汇合度),感染2天后,利用荧光显微镜观察并拍照记录红色荧光蛋白(mcherry)的表达。我们可以观察到没有感染的sf9细胞对照孔中不表达红色荧光蛋白,而随着bev-s1-mcherry(p1)和bev-s2-mcherry(p1)梯度稀释感染滴度的降低,96孔板中被感染的表达mcherry的sf9细胞数目呈一定的梯度比例减少,红色荧光亮度也有所降低;直至出现某一个稀释度的96孔板中只有少量几个表达mcherry的sf9细胞,而下一个稀释度的96孔板中没有表达mcherry的sf9细胞(图4和图5)。我们可以通过统计某一个高稀释度的96孔板中只有少量几个表达mcherry的sf9细胞数目,以及该96孔所对应的bev稀释倍数和起始感染bev的体积,综合计算出待测bev的滴度,以病毒的荧光灶单位(ffu/ml)来表示。经过计算本实施例中所获得的bev-s1-mcherry(p1)和bev-s2-mcherry(p1)的滴度分别约为2.4e+9ffu/ml和8.5e+8ffu/ml。由此可见,在重组杆状病毒基因组s1和s2位点插入荧光蛋白报告基因表达框获得的bev,可应用于快速方便地测定bev的感染滴度。
36.本领域的技术人员容易理解,以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1