一株对橡胶树红根病菌具有拮抗作用的贝莱斯芽孢杆菌SF305及其应用
一株对橡胶树红根病菌具有拮抗作用的贝莱斯芽孢杆菌sf305及其应用
技术领域
1.本发明属于微生物技术应用领域,尤其是涉及一株贝莱斯芽孢杆菌sf305 及其应用。
背景技术:
2.天然橡胶因其具有良好的弹性、绝缘性、强伸性,较好的防水性、气密性和耐磨性,易于与其它材料粘合等优点,广泛用于军工、航天、医疗、汽车制造等领域,是重要的工业原料和战略物资,其制品多达7万多种(刘锐金,莫业勇,杨琳,等.我国天然橡胶产业战略地位的再认识与发展建议,中国热带农业.2022(01):13-18)。美国将天然橡胶作为关键农业原料,欧盟将其列入关键原材料清单,我国在建国后也积极发展橡胶产业(europeancommission.study on the eu’s list of critical raw materials-final report(2020). brussels:european commission,2020);而世界天然橡胶总产量98%以上均来自巴西橡胶树(hevea brasiliensis)(陈圣文,毛新翠.世界天然橡胶产业发展分析报告.中国热带农业.2020(01):29-34+59)。
3.我国橡胶树生产上危害面积最广、影响最大的根部传染性病害是红根病,其病原菌为ganoderma pseudoferreum(丁婧钰,橡胶树与相思树病原灵芝种类鉴定及生物学特性研究.海南大学,2018;张贺,蒲金基,张欣,等.橡胶树红根病病原菌生物学培养特性.热带作物学报,2008,29(5):632-635)。该病害危害巴西橡胶树根部或根颈部,胶树感病后叶片变小,缺乏光泽、色转黄并卷缩,树冠逐渐稀疏,树干干缩或树干基部出现条沟,最终死亡,严重缩短胶林的生产寿命和产胶量(蔡志英,李国华.橡胶树常见病害诊断及其防治.中国农业科学技术出版社,北京,2017)。橡胶树红根病病原菌寄主范围广,能侵染柑桔、荔枝、茶树等十多种作物,同时根病病原菌在土壤里的潜伏期很长(何康,黄宗道.热带北缘橡胶树栽培.广东科技出版社,广州, 1987),直径3cm病根的病原菌在土中能存活2年,碰到合适的寄主后年平均蔓延量高达1.83米(张运强,张辉强.橡胶树红根病的蔓延速度及预测预报. 热带作物学报,1998,19(1):7-12)。目前红根病在我国各植胶区普遍发生,病区几乎分布于每个植胶农场,发病严重的林段发病率达到40%,而未进行预防处理的幼树区能高达60%,若没有及时处理死亡率为100%,给橡胶产业带来巨大损失(涂敏,蔡海滨,彭延麟,等.橡胶树红根病患病与健康植株根际土壤微生物结构及多样性分析.热带作物学报,2021,42(12):3639-3645)。
4.多年来,生产上橡胶树红根病的防治主要以机械挖除和化学防治为主。 19世纪70年代以来,田间主要使用的化学药剂为75%的十三吗啉乳油及15%的三唑酮可湿性粉剂的施用为主(林盛武,吴吉祥,郭泽忠等.十三吗啉防治橡胶红根病.农药,1992,31(3):57-58;谭象生,范会雄.橡胶树红根病在橡胶园的演变及防治对策.植物保护.1991,(06):46-48)。2012年,通过对丙环唑乳油的田间试验发现其防治效果与十三吗啉相当,并且价格适中。室内毒力测定三唑类农药己唑醇wp对橡胶树红根病菌抑菌作用最强(李四有,邱学俊. 丙环
唑防治橡胶树红根病田间试验.热带生物学报.2012.3(4):325-328)。但化学防治存在农药残留、环境污染、病原体抗性、防效下降等问题依然存在,因此化学防治上还具有较大的局限性。
5.近年来,生物防治逐渐成为植物病理学研究领域的热点之一,一方面其对于环境的影响比较温和,另一方面其对病原菌有一定的特异性,也不易使病原菌产生抗性。生防真菌木霉菌对红根病菌有抑菌作用(秦云霞,涂敏,阳美芳,等.8株木霉菌对橡胶树红根病的拮抗作用.热带农业科学,2015, 35(03):41-45+53);研究发现枯草芽孢杆菌czk1对红根病菌也有较好的抑制作用(梁艳琼,李锐,吴伟怀,等.枯草芽孢杆菌czk1挥发物混合活性组分对橡胶灵芝菌的抑菌机理,中国农业科技导报,2022,24(2):152-159;谢立,贺春萍,梁艳琼,等.枯草芽孢杆菌czk1与化学杀菌剂协同防治橡胶树根病.热带作物学报,2020,(08):1625-1633)。红根病菌自身含多糖多酚,生长速度较慢,对其基因的功能研究相对困难。因此,对于研究者来说,大力响应国家“预防为主、综合防治”的植物保护方针,从自然环境中筛选出对病害具有拮抗作用的生物资源,是一种值得探索的防治方法,也是一项具有重大意义的工作。
技术实现要素:
6.本发明的目的是为了提供一株对橡胶树红根病菌具有显著抑制作用的贝莱斯芽孢杆菌及其应用。
7.本发明的贝莱斯芽孢杆菌对植物病原真菌如橡胶树胶孢炭疽病菌、尖孢炭疽病菌、水稻稻瘟病菌、黄瓜枯萎病菌、辣椒疫霉病菌和灰霉菌等表现出广谱的抑菌活性;对水稻白叶枯病菌和水稻条斑病菌等细菌病害也有较好抑菌活性,同时可以促进植物生长。本发明结果表明该菌株具有防病、促生应用前景,为橡胶树红根病的防治提供了良好的生防资源,也为橡胶炭疽病、水稻白叶枯病、条斑病等多种病害的防治提供参考。
8.本发明的技术方案是这样实现的:
9.本发明的第一方面是提供一株贝莱斯芽孢杆菌,于2018年11月8日分离自海南省海口市海甸港湾花园果园地土壤,命名为贝莱斯芽孢杆菌(bacillusvelezensis)sf305,所述贝莱斯芽孢杆菌已于2022年02月18日在中国典型培养物保藏中心(cctcc)保藏,保藏编号为cctcc no:m 2022129。
10.本发明的第二个方面是提供上述贝莱斯芽孢杆菌的发酵液。
11.以上所述的发酵液的制备方法,包括以下步骤:
12.以上所述的贝莱斯芽孢杆菌,取其单菌落接种至nb培养基中,28℃、 180rpm摇床中培养12h后,即得。
13.本发明的第三方面是提供上述的贝莱斯芽孢杆菌或者所述的发酵液在拮抗橡胶树红根病菌上的应用。
14.本发明的第四个方面是提供上述的贝莱斯芽孢杆菌或者所述的发酵液在制备防治橡胶树红根病菌(ganoderma pseudoferreum)所致病害的药剂中的应用。
15.本发明的第五个方面是提供上述贝莱斯芽孢杆菌或者所述的发酵液对多种植物病原真菌具有拮抗作用,具体包括橡胶树胶孢炭疽病菌(colletotrichumgloeosporioides)、橡胶树尖孢炭疽病菌(colletotrichum acutatum)、稻瘟病菌
(magnaporthe oryzae)、黄瓜枯萎病菌(fusarium oxysporumf.sp cucumerinum)、辣椒疫霉病菌(phytophthora capsici)和灰霉菌(botrytiscinerea)。
16.本发明的第六个方面是提供以上所述贝莱斯芽孢杆菌或者所述的发酵液拮抗拮抗水稻白叶枯病菌(xanthomonas oryzae pv.oryzae,xoo)和水稻条斑病菌(xanthomonas oryzae pv.oryzicola,xoc)上的应用。
17.在本发明的一个具体实施方式中,所述水稻白叶枯病菌包括pxo99a,所述水稻条斑病菌包括rs105。
18.本发明第七个方面是提供以上所述的贝莱斯芽孢杆菌或者所述的发酵液在制备防治由橡胶树胶孢炭疽病菌、橡胶树尖孢炭疽病菌、稻瘟病菌、黄瓜枯萎病菌、辣椒疫霉病菌、灰霉菌、水稻白叶枯病菌和/或水稻条斑病菌所致病害的制剂上的应用。
19.本发明的第八个方面是提供以上所述的贝莱斯芽孢杆菌或者所述的发酵液在促进植物生长上的应用。
20.本发明的第九个方面是提供一种生防菌剂,包括上述的贝莱斯芽孢杆菌或者所述的发酵液。
21.本发明的有益效果:
22.与现有技术相比,本发明提供的贝莱斯芽孢杆菌sf305及其发酵液,对橡胶树红根病菌具有显著的拮抗作用,对目前生产上重要的植物病原真菌和细菌也具有拮抗活性。本发明结果表明该菌株具有广谱的抑菌和促生能力,在防治橡胶树根病以及多种作物重要的真菌和细菌病害上具有较好的应用潜力,其生防潜力有待于进一步开发,将为研发多功能的生防菌剂打下基础。
附图说明
23.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
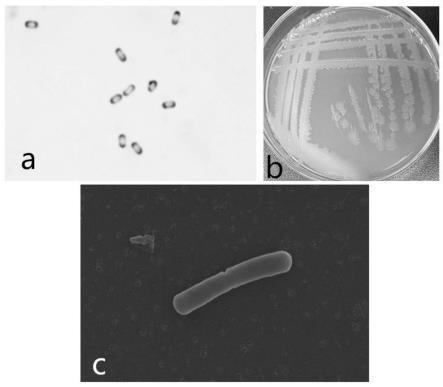
24.图1.贝莱斯芽孢杆菌sf305的显微镜(1000x)观察照片、电镜照片及菌落形态;其中,a为显微镜(1000x)观察照片,b为菌落形态平皿照片,c为扫描电镜观察照片。
25.图2. 16s rrna基因的凝胶电泳结果。其中1代表dl2000 marker;2代表16srrna基因的产物。
26.图3.贝莱斯芽孢杆菌sf305 16s rrna基因序列比对结果,以virgibacilluspantothenticus ncdo 1765(x60627)为外枝构建的neighbor-joining系统发育树。
27.图4.贝莱斯芽孢杆菌sf305对橡胶树红根病菌的拮抗效果图。
28.图5.贝莱斯芽孢杆菌sf305对橡胶树胶孢炭疽病菌的拮抗效果图。
29.图6.贝莱斯芽孢杆菌sf305对橡胶树尖孢炭疽病菌的拮抗效果图。
30.图7.贝莱斯芽孢杆菌sf305对稻瘟病菌的拮抗效果图。
31.图8.贝莱斯芽孢杆菌sf305对黄瓜枯萎病菌的拮抗效果图。
32.图9.贝莱斯芽孢杆菌sf305对辣椒疫霉病菌的拮抗效果图。
33.图10.贝莱斯芽孢杆菌sf305对灰霉菌的拮抗效果图。
34.图11.贝莱斯芽孢杆菌sf305对水稻白叶枯病菌pxo99a的拮抗效果图。
35.图12.贝莱斯芽孢杆菌sf305对水稻条斑病菌rs105的拮抗效果图。
具体实施方式
36.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
37.以下实施例中所用的菌种培养基如下:
38.na固体培养基(g/l):牛肉浸膏3g,多聚蛋白胨5g,蔗糖10g,酵母粉1g,琼脂粉15g,加水溶解并定容至1000ml,调节ph 7.0-7.2,高压灭菌(121℃,20min)。
39.nb液体培养基(g/l):牛肉浸膏3g,多聚蛋白胨5g,蔗糖10g,酵母粉1g,加水溶解并定容至1000ml,调节ph 7.0-7.2,高压灭菌(121℃,20 min)。
40.pda固体培养基(g/l):马铃薯200g,葡萄糖20g,琼脂15g,加入水溶解,最后定容至1000ml,ph 7.0-7.2,高压灭菌(121℃,20min)。
41.实施例1贝莱斯芽孢杆菌sf305的获得
42.1、土壤来源
43.2018年11月8日采集的海南省海口市海甸港湾花园果园地土壤。
44.2、菌株的筛选
45.(1)土样采集
46.采集果树植株根围表层约10cm的土样,每点采集200g土样。每块地采集3个土样,记录好采样的时间、地点和种类。采集完成的土样置于常温保存,以用于细菌的分离。
47.(2)细菌的分离
48.平板稀释法:称取10g土样于锥形瓶中,加入90ml无菌水,然后在200 rpm,28℃摇床中振荡,20min后取出,在室温静置10min,制成土壤菌悬液原液。将该原液进行梯度稀释,分别得到100、10-1
、10-2
、10-3
、10-4
、10-5
,共6个梯度的稀释液。各取200μl菌悬液稀释液,均匀涂布于含有水稻条斑病菌rs105(od600=2.0)的na平板上,每个梯度做3个重复。将平板置于 28℃培养箱中,培养48h,观察。
49.(3)细菌纯化
50.观察并挑出具有明显抑菌圈的单菌落,在na平板上进行划线纯化,在 28℃培养箱倒置培养,12h后挑取单菌落,依次编号。
51.(4)细菌的保存
52.将菌株单菌落接种在nb液体培养基中,在28℃、180rpm摇床中培养 12h后,吸取1ml发酵液与1ml 50%的无菌甘油,轻轻振荡混匀,置于-80℃长期保存。
53.最终获得贝莱斯芽孢杆菌(bacillus velezensis)sf305,已于2022年02 月18日在中国典型培养物保藏中心(cctcc)保藏,保藏编号为cctcc no: m 2022129,地址在中国武汉的武汉大学。
54.获得的贝莱斯芽孢杆菌sf305的显微镜(1000x)观察照片、电镜照片及菌落形态如图1所示。
55.实施例2贝莱斯芽孢杆菌sf305的16s rrna
56.利用omega公司becterial dna kit试剂盒提取菌株sf305的基因组 dna,利用细菌16s rdna基因引物:27f 5'-agagtttgatcctggctcag-3’和1492r 5
’‑
tacggctaccttgttacgactt-3’,以提取的基因组dna为模板,进行pcr扩增,以获得目的片段。pcr反应体系为:
57.表1 ex-taq聚合酶链式反应体系
[0058][0059]
pcr反应基本条件为:95℃预变性5min,94℃变性1min,56℃退火1min, 72℃延伸2min(1kb/min),72℃预延伸6min,4℃保存,共30个循环。反应结束后,pcr产物均通过1%琼脂糖凝胶电泳检验,将pcr原液送铂尚生物技术(上海)有限公司进行测序。测序结果如图2所示。运用dna star进行分析测序结果,并在ncbi网站上进行blast比对,确定近缘株细菌的种属。如表2所示。贝莱斯芽孢杆菌sf305的16srrna基因的序列如seq idno.1所示。
[0060]
表2贝莱斯芽孢杆菌sf305 16s rrna基因测序blast结果
[0061][0062]
[0063]
贝莱斯芽孢杆菌sf305 16s rrna基因序列比对结果以virgibacilluspantothenticus ncdo 1765(x60627)为外枝构建的neighbor-joining系统发育树如图3所示,结果显示:sf305的16srrna基因与bacillus velezensis具有 99.36%的相似度。
[0064]
实施例3贝莱斯芽孢杆菌sf305的生理生化鉴定
[0065]
本发明的贝莱斯芽孢杆菌sf305的生理生化特征为:能够分泌3-羟基丁酮产生乙酰甲基甲醇和明胶酶;不能水解邻硝基苯-半乳糖苷、精氨酸、赖氨酸、鸟氨酸、柠檬酸钠和硫代硫酸钠等;不能够氧化葡萄糖、甘露醇、肌醇、山梨醇和鼠李糖等;能够利用甘油、l-阿拉伯糖、核糖、d-木糖、半乳糖、葡萄糖和果糖等20种碳源产酸,见表3和表4。
[0066]
表3菌株sf305生理生化特性
–
酶活、碳源氧化
[0067][0068][0069]
+:阳性反应;-:阴性反应;w:弱阳性反应
[0070]
表4菌株sf305生理生化特性
–
利用碳源产酸
[0071][0072][0073]
+:阳性反应;-:阴性反应;w:弱阳性反应
[0074]
实施例4贝莱斯芽孢杆菌sf305的拮抗谱测定
[0075]
将贝莱斯芽孢杆菌sf305单菌落接种至nb培养基中,28℃、180rpm摇床中培养12h后,得到贝莱斯芽孢杆菌sf305的发酵液。之后,调整发酵液浓度为od600=2.0,备用。
[0076]
1)贝莱斯芽孢杆菌sf305对橡胶树红根病菌的拮抗活性测定
[0077]
取橡胶树红根病菌(ganoderma pseudoferreum)菌饼于pda培养基上,待菌丝长满整个平板后,用5mm孔径打孔器在平板上打取菌块,取其中一个菌饼,菌丝面朝上,接种到新的pda平板中央,在菌饼左右等距离(20mm) 的上、下、左、右放入预先处理的滤纸片。其中上、下位置的滤纸片为灭菌烘干后加入30ul的nb培养基,左、右位置的滤纸片为灭菌烘干加入30ul的贝莱斯芽孢杆菌sf305的发酵液,设置3个重复。同时,以不接贝莱斯芽孢杆菌sf305发酵液,只接橡胶树红根病菌菌饼的平板为对照。置于28℃的培养箱中,培养7d后观察并记录抑菌结果。
[0078]
贝莱斯芽孢杆菌sf305对橡胶树红根病菌的拮抗效果图如图4所示,抑菌效果如表5所示。
[0079]
结果显示,贝莱斯芽孢杆菌sf305对橡胶树红根病菌的平均抑菌率为 73.76%,表明sf305对橡胶树红根病菌具有显著的拮抗作用。
[0080]
表5贝莱斯芽孢杆菌sf305对橡胶树红根病菌的抑菌效果
[0081][0082]
2)贝莱斯芽孢杆菌sf305对6种植物病原真菌的拮抗活性测定
[0083]
采用滤纸片对峙培养法,将橡胶树胶孢炭疽病菌、橡胶树尖孢炭疽病菌、稻瘟病菌、黄瓜枯萎病菌、辣椒疫霉病菌、灰霉病菌分别在pda培养基上培养,待菌丝长满整个平板后,用5mm孔径打孔器在平板上打取菌块,取其中一个菌饼,菌丝面朝上,接种到新的pda平板中央,在菌饼上、下、左、右等距离(20mm)放入预先处理的滤纸片。其中上、下位置的滤纸片为灭菌烘干后加入30ul的nb培养基,左、右位置的滤纸片为加入30ul的贝莱斯芽孢杆菌sf305的发酵液,每个病原菌3个重复。同时,以不接贝莱斯芽孢杆菌 sf305发酵液,只接橡胶树胶孢炭疽病菌、橡胶树尖孢炭疽病菌、稻瘟病菌、黄瓜枯萎病菌、辣椒疫霉病菌、灰霉病菌6种病原真菌菌饼的平板为对照。 25℃培养5d后,观察并记录抑菌现象。其结果如表6和图5-10所示。
[0084]
表6贝莱斯芽孢杆菌sf305对6种植物病原真菌的抑菌效果
[0085][0086]
贝莱斯芽孢杆菌sf305对橡胶树胶孢炭疽病菌的拮抗效果如图5所示,对橡胶树尖
孢炭疽病菌的拮抗效果如图6所示,对稻瘟病菌的拮抗效果如图7 所示,对黄瓜枯萎病菌的拮抗效果如图8所示,对辣椒疫霉病菌的拮抗效果如图9所示,对灰霉病的拮抗效果如图10所示。
[0087]
结果显示,贝莱斯芽孢杆菌sf305对橡胶树胶孢炭疽病菌的抑菌率为58.70%,对橡胶树尖孢炭疽病菌的抑菌率分为65.36%,对稻瘟病菌的抑菌率为62.04%,对黄瓜枯萎病菌的抑菌率为60.55%,对辣椒疫霉病菌的抑菌率为 61.85%,对灰霉菌的抑菌率为57.41%。这表明,sf305对这6种病原真菌都具有较好的拮抗作用。
[0088]
3)贝莱斯芽孢杆菌sf305对水稻黄单胞菌的拮抗活性测定
[0089]
将水稻白叶枯病菌(xanthomos oryzae pv.oryzae,xoo)pxo99a和水稻条斑病菌(xanthomonas oryzae pv.oryzicola,xoc)rs105分别单菌落nb培养基中, 28℃、180rpm摇床中培养12h后,分别得到水稻白叶枯病菌pxo99a和水稻条斑病菌rs105的发酵液。之后统一调整发酵液浓度为od
600
=2.0。
[0090]
分别吸取pxo99a和rs105的发酵液200μl与约25ml的na固体培养基充分混匀后,倒板,然后在na平板中心放上直径为6mm的牛津杯,每个牛津杯内接10μl的sf305发酵液,每个病原菌做3个重复。同时,以不接贝莱斯芽孢杆菌sf305发酵液,只接pxo99a和rs105发酵液的平板为对照。置于28℃的培养箱中,培养48h后观察抑菌圈的有无,并记录抑菌圈大小,整理拍照。
[0091]
贝莱斯芽孢杆菌sf305对水稻白叶枯病菌pxo99a的拮抗效果图如图11 所示,对水稻条斑病菌rs105的拮抗效果图如图12所示,抑菌效果如表7所示。
[0092]
结果显示,贝莱斯芽孢杆菌sf305对水稻白叶枯病菌pxo99a的抑菌率为68.82%,对水稻条斑病菌rs105的抑菌率为68.51%。这表明,sf305对水稻黄单胞菌具有较好的拮抗作用。
[0093]
表7贝莱斯芽孢杆菌sf305对水稻黄单胞菌的抑菌效果
[0094][0095]
由此,利用本发明提供的贝莱斯芽孢杆菌sf305,对橡胶树红根病菌具有显著的拮抗作用,对多种生产上重要的植物病原真菌和细菌也具有拮抗作用,为橡胶树红根病的生物防治提供了新资源,也为其他重要病害防治研发新型的微生物菌剂打下了基础。
[0096]
实施例5贝莱斯芽孢杆菌sf305促生作用测定
[0097]
贝莱斯芽孢杆菌sf305分别单菌落nb培养基中,28℃、180rpm摇床中培养12h后,调整发酵液浓度od600=1.0,然后稀释5倍。
[0098]
选择同时播种、长势相似的小青菜“长征二号”菜苗,菜苗采用稀释后的贝莱斯芽孢杆菌sf305发酵液浸根5min后移栽,对照组不做任何处理,直接移栽。统一进行田间栽培管理。栽培25d后,分别采摘小青菜的地上部分 (用剪刀去除小青菜的地下部分),立即每4棵一组称重,计算其地上部分的鲜重及鲜重增加率。
[0099]
表8促生增重效果
[0100][0101]
由表8可以看出,移栽前采用贝莱斯芽孢杆菌sf305菌株发酵液浸根处理,可以显著增加小青菜的鲜重。说明贝莱斯芽孢杆菌sf305具有显著的促生作用。
[0102]
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1