一种提高普那霉素产量的发酵方法与流程
1.本发明涉及微生物发酵领域,具体涉及一种提高普那霉素产量的发酵方法。
背景技术:
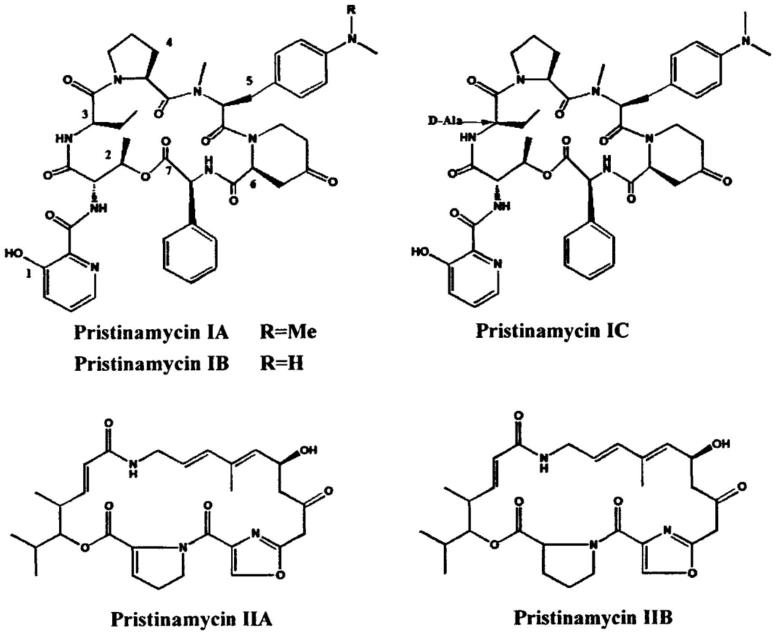
2.普那霉素(pristinamycins)属链阳性菌素类抗生素,于1955年从始旋链霉菌(streptomyces pristinaespiralis)中分离得到,由约30%普那霉素i和70%普那霉素ii组成。其中普那霉素i是由普那霉素ia、普那霉素ib、普那霉素ic组成的环六肽内酯,普那霉素ii是由普那霉素iia和普那霉素iib组成的多不饱和内酯。普那霉素ia和普那霉素iia是普那霉素的主要组分。
3.普那霉素对革兰阳性菌具有较强的杀菌活性,主要用于治疗由革兰阳性菌包括耐药菌引起的感染。然而天然的普那霉素水溶性差,不易制成肠外制剂,因此临床应用受到限制。天然的普那霉素ia和iia经过化学修饰得到水溶性衍生物rp59500(商品名synercid)则可以解决这一问题,它是第一个上市的链阳性菌素注射剂。
4.普那霉素的具体结构式如下:
[0005][0006]
虽然普那霉素具有广泛的应用,且其制剂成品已经上市,但普那霉素较低的发酵产量和较高的生产成本,仍然是限制其应用的和发展的主要因素。
技术实现要素:
[0007]
本发明为解决现有技术中普那霉素产量低、生产成本高的问题,提供了一种提高
普那霉素产量的发酵方法,所述方法包括:
[0008]
在发酵培养过程中,向发酵培养基中补加正丙醇。
[0009]
优选的,所述补加的时间为发酵培养开始后的10-60h,优选10-50h,更优选20-50h,最优选30-40h。
[0010]
优选的,所述补加正丙醇采用连续补加的方式,补加速率为发酵培养基初始体积的0.04-0.1%/天,优选0.06-0.08%/天。
[0011]
优选的,所述发酵培养基包含:2-10g/100ml碳源,2-5g/100ml氮源,0.2-1.0g/100ml无机盐。
[0012]
优选的,所述发酵培养基的碳源选自葡萄糖、蔗糖、乳糖、麦芽糖、麦芽糊精、可溶性淀粉、山梨醇、甘油之一或者上述物质的组合,优选可溶性淀粉、葡萄糖和蔗糖的组合。
[0013]
优选的,所述发酵培养基的氮源选自黄豆饼粉、酵母粉、玉米蛋白粉、棉籽饼粉、花生饼粉、大豆粉、玉米浆干粉、酵母抽提物、蛋白胨之一或者上述物质的组合,优选黄豆饼粉和酵母粉的组合。
[0014]
优选的,所述发酵培养基包含:可溶性淀粉3.0
±
0.6,葡萄糖2.0
±
0.4,蔗糖0.5
±
0.1,黄豆饼粉2.0
±
0.4,酵母粉0.5
±
0.1,硫酸铵0.2
±
0.04,硫酸锰0.1
±
0.02,硫酸亚铁0.01
±
0.002,磷酸二氢钾0.05
±
0.01,碳酸钙0.3
±
0.06,单位为g/100ml,ph=7.0
±
0.2。
[0015]
优选的,所述发酵培养的时间为80-160h,优选100-160h。
[0016]
优选的,所述发酵培养的条件为:温度27
±
1.0℃,通气量0.5-1.0vvm,罐压0.045-0.065mpa,溶氧30-100%。
[0017]
本发明通过流加葡萄糖溶液的方式,将葡萄糖含量控制在0.2-1.0%(葡萄糖在实时发酵培养基中的含量,单位为g/ml)。葡萄糖溶液的浓度为50%(g/ml),121.0-123.0℃灭菌30min后使用,发酵过程中当培养基中葡萄糖的含量低于1.0%时开始流加。
[0018]
本发明发酵培养使用的菌株是任意可产普那霉素的始旋链霉菌,例如可购自中国普通微生物菌种保藏管理中心的始旋链霉菌streptomyces pristinaespiralis,atcc 25486(其在中国普通微生物菌种保藏管理中心的保藏编号为cgmcc 4.1352)。
[0019]
从生物合成的角度分析,普那霉素合成的起始单位是氨基酸,包括苯丙氨酸、苏氨酸、甲硫氨酸、赖氨酸、脯氨酸和缬氨酸等。但本发明人发现,补加氨基酸并未明显提高普那霉素的产量,因此推测阻碍普那霉素合成的主要限制因素并非起始氨基酸,而是其碳链的延伸单位。普那霉素的内酯环的形成是以乙酸为起始单位的,发明人推测其碳链的延伸单位可能是短链脂肪酸/短链脂肪酸钠,根据这一原理,分别尝试补加甲酸钠、乙酸钠、丙酸钠、丁二酸钠等,但对提高普那霉素产量无明显影响。
[0020]
通常,正丙醇对于微生物的生长代谢是具有毒害作用的,但本发明人意外发现,加入正丙醇(尤其是一定条件下)能够大幅提高普那霉素的产量。但对于加入与正丙醇相似的乙醇,却降低了普那霉素的产量。
[0021]
与现有技术相比,本发明的有益效果主要体现在:
[0022]
本发明通过在发酵培养过程中,向发酵培养基中补加正丙醇,能够大幅提高普那霉素的产量,发酵培养基组分简单,成本低廉,在工艺控制上简便易行,降低了普那霉素的生产成本,有利于工业化生产。
具体实施方式
[0023]
以下实施例对本发明作进一步说明。然而,本发明可能具体体现为许多不同的形式,例如不同培养基或者相似的菌株均有均能达到相似的效果,而且它不应该被局限于此处所描述的实施例中,提供这些实施例的目的是为了使所披露内容更完整。在下列实例中,除非另有指明,所有温度为摄氏温度;除非另有指明,各种起始原料和试剂均来自市售,均不经进一步纯化直接使用;除非另有指明,各种溶剂均为工业级溶剂,不经进一步处理直接使用。
[0024]
本实施例中所测的普那霉素含量指的是普那霉素ia和普那霉素iia两种主要成分的含量之和,检测条件如下:
[0025]
色谱柱:agilent zorbax c
18
柱(4.6mm x250mm x 5μm);
[0026]
流动相a:磷酸缓冲液(0.03mol/l磷酸二氢钾溶液,用磷酸调ph至2.3);
[0027]
流动相b:乙腈;
[0028]
流速:1.0ml/min;
[0029]
线性梯度:在0-22min:b相由35%到35%,在22-40min:b相由35%到80%,在40-50min:b相由80%到35%,在50-60min:b相由35%到35%;
[0030]
柱温:30℃;
[0031]
检测波长:210nm;
[0032]
进样量:10μl。
[0033]
对比例:发酵培养过程中补加组分的筛选
[0034]
(1)选取出发菌株:实验中所使用的菌株为始旋链霉菌(streptomyces pristinaespiralis,atcc 25486)。
[0035]
(2)菌株斜面培养:将始旋链霉菌(streptomyces pristinaespiralis,atcc 25486)甘油管解冻后接种于斜面培养基,于27
±
1.0℃条件下培养165h,得到斜面菌种。
[0036]
斜面培养基成分及其用量为:可溶性淀粉2.0,黄豆饼粉1.0,蛋白胨0.5,磷酸氢二钾0.1,硫酸镁0.1,琼脂2.0,单位为g/100ml,ph=7.0。
[0037]
(3)菌株摇瓶培养:在无菌条件下挖取2-5cm2步骤(2)制备的斜面菌种,使用匀浆仪打散后接种于摇瓶培养基中,摇瓶置于27
±
1.0℃条件下培养28h,得到成熟的摇瓶种子液。
[0038]
摇瓶培养基的成分及用量为:可溶性淀粉2.0,葡萄糖1.5,黄豆饼粉1.0,蛋白胨0.5,磷酸氢二钾0.2,氯化钠0.2,碳酸钙0.3,单位为g/100ml,ph=7.0。
[0039]
(4)种子罐培养:15l种子罐装10l种子培养基,121.0-123.0℃灭菌30min后冷却至27
±
1.0℃。将步骤(3)得到的摇瓶种子液以体积比0.05%接种量接种至种子罐培养基中,控制培养温度27
±
1.0℃,通气量控制在0.5-1.0vvm,罐压0.045-0.065mpa,起始搅拌转速为150rpm,培养过程中控制搅拌转速在150-550rpm,使溶氧控制在30%以上,培养35h得到种子罐种子液。
[0040]
种子罐培养基的成分及用量为:可溶性淀粉2.0,葡萄糖1.5,黄豆饼粉1.0,蛋白胨0.5,磷酸氢二钾0.2,氯化钠0.2,碳酸钙0.3,消泡剂0.05,单位为g/100ml,ph=7.0。
[0041]
(5)发酵培养:50l发酵罐装30l发酵培养基,121.0-123.0℃灭菌30min后冷却至27
±
1.0℃,将步骤(4)得到的种子罐种子液以体积比5%接种量接种至发酵培养基中,控制发
酵温度在27
±
1.0℃,通气量控制在0.5-1.0vvm,罐压0.045-0.065mpa,起始搅拌转速为150rpm,培养过程中控制搅拌转速在150-550rpm,使溶氧控制在30-100%,葡萄糖含量控制在0.2-1.0%。发酵培养30h后,分别向培养基中连续补加水、不同种类的短链脂肪酸钠、乙醇、正丙醇和不同种类的氨基酸,补加的速率均为发酵培养基初始体积的0.06%/天。其中,补加等量的水的实验为对照实验。发酵培养100h后检测培养基中普那霉素的含量,实验结果如表1、表2所示:
[0042]
表1:补加不同短链脂肪酸钠和乙醇、正丙醇对普那霉素产量的影响
[0043]
补加物质甲酸钠乙酸钠丙酸钠丁二酸钠乙醇正丙醇普那霉素产量(mg/l)1194.151246.321295.891209.651045.901869.97
[0044]
表2:补加不同氨基酸对普那霉素产量的影响
[0045]
氨基酸名称苯丙氨酸苏氨酸甲硫氨酸赖氨酸脯氨酸缬氨酸普那霉素产量(mg/l)1185.821194.671209.411272.181298.741186.38
[0046]
其中,补加等量的水的对照实验,发酵培养100h后,普那霉素的产量为1217.32mg/l。
[0047]
发酵培养基成分及用量为:可溶性淀粉3.0,葡萄糖2.0,蔗糖0.5,黄豆饼粉2.0,酵母粉0.5,硫酸铵0.2,硫酸锰0.1,硫酸亚铁0.01,磷酸二氢钾0.05,碳酸钙0.3,单位为g/100ml,ph=7.0。
[0048]
实验结果证明,在相同的实验条件下,发酵培养过程中补加苯丙氨酸等不同种类的氨基酸对普那霉素的产量几乎没有增益作用,甲酸钠等短链脂肪酸钠、乙醇也不能提高普那霉素的产量。然而,正丙醇的补加却大大提高了普那霉素的产量。
[0049]
实施例1:发酵培养30h后以体积比0.06%/天的速率补加正丙醇
[0050]
(1)选取出发菌株:实验中所使用的菌株为始旋链霉菌(streptomyces pristinaespiralis,atcc 25486)。
[0051]
(2)菌株斜面培养:将始旋链霉菌(streptomyces pristinaespiralis,atcc 25486)甘油管解冻后接种于斜面培养基,于27
±
1.0℃条件下培养165h,得到斜面菌种。
[0052]
斜面培养基成分及其用量为:可溶性淀粉2.0,黄豆饼粉1.0,蛋白胨0.5,磷酸氢二钾0.1,硫酸镁0.1,琼脂2.0,单位为g/100ml,ph=7.0。
[0053]
(3)菌株摇瓶培养:在无菌条件下挖取2-5cm2步骤(2)制备的斜面菌种,使用匀浆仪打散后接种于摇瓶培养基中,摇瓶置于27
±
1.0℃条件下培养28h,得到成熟的摇瓶种子液。
[0054]
摇瓶培养基的成分及用量为:可溶性淀粉2.0,葡萄糖1.5,黄豆饼粉1.0,蛋白胨0.5,磷酸氢二钾0.2,氯化钠0.2,碳酸钙0.3,单位为g/100ml,ph=7.0。
[0055]
(4)种子罐培养:15l种子罐装10l种子培养基,121.0-123.0℃灭菌30min后冷却至27
±
1.0℃。将步骤(3)得到的摇瓶种子液以体积比0.05%接种量接种至种子罐培养基中,控制培养温度27
±
1.0℃,通气量控制在0.5-1.0vvm,罐压0.045-0.065mpa,起始搅拌转速为150rpm,培养过程中控制搅拌转速在150-550rpm,使溶氧控制在30%以上,培养35h得到种子罐种子液。
[0056]
种子罐培养基的成分及用量为:可溶性淀粉2.0,葡萄糖1.5,黄豆饼粉1.0,蛋白胨0.5,磷酸氢二钾0.2,氯化钠0.2,碳酸钙0.3,消泡剂0.05,单位为g/100ml,ph=7.0。
[0057]
(5)发酵培养:50l发酵罐装30l发酵培养基,121.0-123.0℃灭菌30min后冷却至27
±
1.0℃,将步骤(4)得到的种子罐种子液以体积比5%接种量接种至发酵培养基中,控制发酵温度在27
±
1.0℃,通气量控制在0.5-1.0vvm,罐压0.045-0.065mpa,起始搅拌转速为150rpm,培养过程中控制搅拌转速在150-550rpm,使溶氧控制在30-100%,葡萄糖含量控制在0.2-1.0%。发酵培养30h后,向培养基中连续补加正丙醇,补加的速率为发酵培养基初始体积的0.06%/天。发酵培养80h、100h、120h、140h、160h后取样检测培养基中普那霉素的含量,普那霉素的产量情况如表3所示:
[0058]
表3:不同培养周期普那霉素的产量
[0059]
周期(h)80100120140160普那霉素产量(mg/l)1633.171846.321832.661870.261910.09
[0060]
发酵培养基成分及用量为:可溶性淀粉3.0,葡萄糖2.0,蔗糖0.5,黄豆饼粉2.0,酵母粉0.5,硫酸铵0.2,硫酸锰0.1,硫酸亚铁0.01,磷酸二氢钾0.05,碳酸钙0.3,单位为g/100ml,ph=7.0。
[0061]
实施例2:发酵培养40h后以发酵培养基初始体积0.08%/天的速率补加正丙醇
[0062]
(1)选取出发菌株:实验中所使用的菌株为始旋链霉菌(streptomyces pristinaespiralis,atcc 25486)。
[0063]
(2)菌株斜面培养:将始旋链霉菌(streptomyces pristinaespiralis,atcc 25486)甘油管解冻后接种于斜面培养基,于27
±
1.0℃条件下培养165h,得到斜面菌种。
[0064]
斜面培养基成分及其用量为:可溶性淀粉2.0,黄豆饼粉1.0,蛋白胨0.5,磷酸氢二钾0.1,硫酸镁0.1,琼脂2.0,单位为g/100ml,ph=7.0。
[0065]
(3)菌株摇瓶培养:在无菌条件下挖取2-5cm2步骤(2)制备的斜面菌种,使用匀浆仪打散后接种于摇瓶培养基中,摇瓶置于27
±
1.0℃条件下培养28h,得到成熟的摇瓶种子液。
[0066]
摇瓶培养基的成分及用量为:可溶性淀粉2.0,葡萄糖1.5,黄豆饼粉1.0,蛋白胨0.5,磷酸氢二钾0.2,氯化钠0.2,碳酸钙0.3,单位为g/100ml,ph=7.0。
[0067]
(4)种子罐培养:15l种子罐装10l种子培养基,121.0-123.0℃灭菌30min后冷却至27
±
1.0℃。将步骤(3)得到的摇瓶种子液以体积比0.05%接种量接种至种子罐培养基中,控制培养温度27
±
1.0℃,通气量控制在0.5-1.0vvm,罐压0.045-0.065mpa,起始搅拌转速为150rpm,培养过程中控制搅拌转速在150-550rpm,使溶氧控制在30%以上,培养35h得到种子罐种子液。
[0068]
种子罐培养基的成分及用量为:可溶性淀粉2.0,葡萄糖1.5,黄豆饼粉1.0,蛋白胨0.5,磷酸氢二钾0.2,氯化钠0.2,碳酸钙0.3,消泡剂0.05,单位为g/100ml,ph=7.0。
[0069]
(5)发酵培养:50l发酵罐装30l发酵培养基,121.0-123.0℃灭菌30min后冷却至27
±
1.0℃,将步骤(4)得到的种子罐种子液以体积比5%接种量接种至发酵培养基中,控制发酵温度在27
±
1.0℃,通气量控制在0.5-1.0vvm,罐压0.045-0.065mpa,起始搅拌转速为150rpm,培养过程中控制搅拌转速在150-550rpm,使溶氧控制在30-100%,葡萄糖含量控制在0.2-1.0%。发酵培养40h后,向培养基中连续补加正丙醇,补加的速率为发酵培养基初始体积的0.08%/天。发酵培养100h后检测培养基中普那霉素的含量,测得其含量为1661.35mg/l。
25486)甘油管解冻后接种于斜面培养基,于27
±
1.0℃条件下培养165h,得到斜面菌种。
[0086]
斜面培养基成分及其用量为:可溶性淀粉2.0,黄豆饼粉1.0,蛋白胨0.5,磷酸氢二钾0.1,硫酸镁0.1,琼脂2.0,单位为g/100ml,ph=7.0。
[0087]
(3)菌株摇瓶培养:在无菌条件下挖取2-5cm2步骤(2)制备的斜面菌种,使用匀浆仪打散后接种于摇瓶培养基中,摇瓶置于27
±
1.0℃条件下培养28h,得到成熟的摇瓶种子液。
[0088]
摇瓶培养基的成分及用量为:可溶性淀粉2.0,葡萄糖1.5,黄豆饼粉1.0,蛋白胨0.5,磷酸氢二钾0.2,氯化钠0.2,碳酸钙0.3,单位为g/100ml,ph=7.0。
[0089]
(4)种子罐培养:15l种子罐装10l种子培养基,121.0-123.0℃灭菌30min后冷却至27
±
1.0℃。将步骤(3)得到的摇瓶种子液以体积比0.05%接种量接种至种子罐培养基中,控制培养温度27
±
1.0℃,通气量控制在0.5-1.0vvm,罐压0.045-0.065mpa,起始搅拌转速为150rpm,培养过程中控制搅拌转速在150-550rpm,使溶氧控制在30%以上,培养35h得到种子罐种子液。
[0090]
种子罐培养基的成分及用量为:可溶性淀粉2.0,葡萄糖1.5,黄豆饼粉1.0,蛋白胨0.5,磷酸氢二钾0.2,氯化钠0.2,碳酸钙0.3,消泡剂0.05,单位为g/100ml,ph=7.0。
[0091]
(5)发酵培养:50l发酵罐装30l发酵培养基,121.0-123.0℃灭菌30min后冷却至27
±
1.0℃,将步骤(4)得到的种子罐种子液以体积比5%接种量接种至发酵培养基中,控制发酵温度在27
±
1.0℃,通气量控制在0.5-1.0vvm,罐压0.045-0.065mpa,起始搅拌转速为150rpm,培养过程中控制搅拌转速在150-550rpm,使溶氧控制在30-100%,葡萄糖含量控制在0.2-1.0%。发酵培养过程中,分别在培养周期的0h、10h、20h、30h、40h、50h、60h、70h和80h开始连续补加正丙醇,补加的速率为发酵培养基初始体积的0.06%/天。发酵培养100h后检测培养基中普那霉素的含量,其含量如表5所示:
[0092]
表5:正丙醇添加时间对普那霉素产量的影响
[0093][0094]
发酵培养基成分及用量为:可溶性淀粉3.0,葡萄糖2.0,蔗糖0.5,黄豆饼粉2.0,酵母粉0.5,硫酸铵0.2,硫酸锰0.1,硫酸亚铁0.01,磷酸二氢钾0.05,碳酸钙0.3,单位为g/100ml,ph=7.0。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1