检测高浓度γ-谷氨酰转肽酶的荧光探针及其制备方法与流程
本发明涉及一种用于γ-谷氨酰转肽酶检测的新型荧光探针及其制备方法,具体涉及一种用于检测高浓度γ-谷氨酰转肽酶的荧光探针及其制备方法,属于分析化学技术领域。
背景技术:
γ-谷氨酰转肽酶(GGT)是存在于细胞表面的一种酶,在很多的生理过程中起着重要的作用。据报道,在成年女性和成年男性中,GGT的正常浓度分别为5-55U/L和15-85U/L。在一些肝胆疾病中,GGT浓度水平可升高到正常浓度的10倍以上。GGT也在多种人类肿瘤细胞中过度表达,如卵巢癌、宫颈癌和肝癌等。因此,GGT浓度的检测在评价肝胆疾病方面具有重要的临床诊断价值,且是肿瘤临床诊断的重要指标。发展能对异常浓度的GGT进行检测的方法具有重要的理论价值和实际意义。
荧光技术不仅可以检测被检物,还可以实现对被检物的成像,目前已有许多种类的荧光成像剂,既包括多肽、药剂等小分子,又有聚合物、重组蛋白、工程抗体、纳米粒子等大分子,荧光成像技术为探讨生物分子的生理功能和作用机制提供一种便捷有效的方法。荧光探针是荧光技术的基础,它将识别基团和荧光团耦合,使其能够识别或者靶向被检物,并且将识别信息传递给荧光团,从而将识别过程转变为容易观察和测量的荧光信号。
荧光成像分析法具有灵敏度高、选择性好、操作简单等优点,并且在生物样本检测中不会对样品带来损伤,已广泛用于各种生物体内检测。
在生物样品中检测γ-谷氨酰转肽酶(GGT),文献报道了多种方法,例如比色法、高效液相色谱和荧光检测技术。作为一种无侵害检测方法,荧光技术因其具有易使用,高灵敏度,有助于深层组织成像(使用双光子技术)等优点,被广泛应用于各个方面。但到目前为止,已报道的用于γ-谷氨酰转肽酶(GGT)的检测或成像的荧光探针并不多。
White等报道了基于香豆素的γ-GGT荧光探针[Anal.Biochem.,1996,233:71-75],和文献中的比色法相比,该荧光检测法使用的底物浓度更低,灵敏度更高。Kobayashi课题组设计合成了一种基于罗丹明的γ-GGT荧光探针[Sci.Transl.Med.,2011,3:110-119],该探针分子本身处于闭环状态,无荧光产生,在γ-GGT的催化作用下,γ-谷氨酰基断裂,导致螺环结构开环,生成具有强烈荧光的物质。Wu等开发了一例以萘酰亚胺为荧光团的比率型荧光探针[Chem.Commun.,2014,50:3417-3420],用于检测和识别γ-GGT。Fan等[Angew.Chem.Int.Ed.,2015,54:7349-7353]开发了两种新型的荧光原位靶向探针,特异性靶向癌细胞中的γ-GGT。在γ-GGT催化作用下,含硫取代的BODIPY转化为氨基取代的BODIPY,致使荧光发生很大的变化,通过利用酶促引发的光物理特性。另外,CN201510284155.7公开了一种基于甲酚紫的γ-GGT荧光探针,CN 2015 10199040.8还公开了一种新型BODIPY荧光染料与谷胱甘肽GSH的结合物,检测癌细胞中的γ-GGT。
硼原子与氟离子之间的络合作用是一种己被证明有效的实现氟化物检测的手段。三芳基硼由于硼中心原子上的庞大取代基所产生的空间位阻作用,对氟离子表现出更高的选择性,因此三芳基硼类荧光衍生物被应用于F离子荧光探针的设计中,但是这种F离子荧光探针一般只能应用在有机溶剂中。当在水溶液中,由于水分子与氟离子形成氢键的能力比硼和氟络合能力强,所以在水溶液中,硼和氟不会络合,而是氟离子与水形成氢键。同时,由于在三芳基硼分子上引入其他离子识别基团的难度较大,因此限制了其在其他检测方向发展。
三芳基硼化合物中心硼原子以SP2杂化的方式直接和芳香基团的碳原子相连,由于硼原子的缺电子性,杂化后具有空的P轨道。当与中心原子硼相连接的三个芳香环本身具有强的给电子能力或与强的给电子基团共轭时,能形成典型的分子内电荷转移化合物(ICT),该类化合物通常具有强的发光、发光性质对微环境变化敏感、双光子性质等。这些性质都是非常适合用于生物成像的。但是,在三芳基硼应用于GGT检测的生物荧光探针设计上,未见文献报道。
另外,目前报道的能用于GGT检测的几乎所有荧光探针都只能用于在人体的正常GGT浓度范围内进行检测。因此开发新的能够实时快速检测异常浓度GGT的荧光探针具有重要的意义。
技术实现要素:
针对现有技术的不足,一方面,本发明的目的是提供一种基于三芳基硼类的GGT荧光探针,特别提供一种能够实时快速检测高浓度GGT的荧光探针。本发明的荧光探针在GGT高于人体正常浓度后开始产生明显的荧光变化,随着GGT的浓度增高,荧光探针溶液产生大的荧光增强和明显的颜色变化。
为实现本发明的上述目的,本发明提供一种用于检测高浓度γ-谷氨酰转肽酶的荧光探针,其化学结构通式如下(I)所示:
在本发明中,R1、R2、R3可以相同或不同,分别为被谷胱甘肽(GSH)、谷胱甘肽单取代烷基酯、半胱氨酸(Cys)、半胱氨酰甘氨酸(Cys-Gly)基团取代的-N-杂环基或卤素原子,且R1、R2、R3不能全部同时为卤素原子。
进一步,R1、R2、R3可以相同或不同,为卤素原子或被谷胱甘肽(GSH)、谷胱甘肽单取代烷基酯、半胱氨酸(Cys)、半胱氨酰甘氨酸(Cys-Gly)中任意一种基团取代的-N-杂环基,且R1、R2、R3不能全部同时为卤素原子。
本发明的荧光探针以谷胱甘肽(GSH)、谷胱甘肽单取代烷基酯、半胱氨酸(Cys)、半胱氨酰甘氨酸(Cys-Gly)为荧光识别基团,以三芳基硼类作为荧光生色基团,-N-杂环基上的氮原子可以与三芳基苯硼的苯环相连,形成与硼原子共轭体系,氮原子可以作为电子给体与硼原子作为受体,从而形成分子内电荷转移(ICT)化合物,确保三芳基硼类探针的优良发光性质。此探针在GGT存在的条件下,周围的荧光识别基团(GSH、GSH单取代烷基酯、Cys、Cys-Gly)可以被GGT选择性水解,当GGT浓度超过人体正常浓度以后,荧光探针的强度逐渐增强,发光光谱逐渐蓝移,其颜色由弱的黄色变为强的青色,从而达到检测高浓度GGT的目的。
在本发明中,由于三芳基硼敏感的光化学性质,使得三芳基硼类的GGT荧光探针在与GGT反应前后具有明显的荧光增强和颜色变化,有助于裸眼观测。
本发明的荧光探针还能进一步用于细胞成像,由于探针本身含有强亲水性的羧基(来自GSH、GSH单酯、Cys、Cys-Gly基团)导致其无法通过细胞膜的疏水区域,从而呈现弱的细胞膜通透性,一旦被GGT水解后,羧基的离去会导致探针的细胞膜通透性变强,从而实现选择性对GGT细胞的成像。
优选的,所述的-N-杂环基为多氮杂环烷衍生物基团;进一步优选所述的多氮杂环烷为哌嗪、三氮杂环壬烷、四氮杂环十二烷中的任意一种。
多氮杂环一方面可以通过其中一个N原子作为给电子基团与硼形成分子内电荷转移(ICT),另一方面其他多个N原子可用于引入多个识别基团,有利于更高浓度γ-谷氨酰转肽酶的检测。
优选的,所述的卤素原子可以是Cl、Br,优选Br;所述的谷胱甘肽单取代烷基酯为谷胱甘肽单甲酯(GSH-Me)、谷胱甘肽单乙酯(GSH-Et)、谷胱甘肽单丙酯(GSH-Pr)、谷胱甘肽单丁酯(GSH-Bu)中的任意一种。
在本发明的实施方式中,所述的被谷胱甘肽(GSH)、谷胱甘肽单取代烷基酯、半胱氨酸(Cys)、半胱氨酰甘氨酸(Cys-Gly)中任意一种基团取代的-N-杂环基,可以选自如下结构中的任意一种:
其中,-N-杂环上的其他氮原子能形成如上结构中的酰胺键。该酰胺键可以在GGT水解荧光探针中的谷胱甘肽(GSH)、谷胱甘肽单乙酯(GSH-Et)、半胱氨酸(Cys)、半胱氨酰甘氨酸(Cys-Gly)基团后,进一步被GGT水解。从而使本发明的荧光探针进一步实现对更高浓度GGT的检测,检测范围为50-1000U/L。
另外,由于GGT对探针结构中的-N-杂环上的酰胺键水解呈现专一性,所以本发明的荧光探针对GGT的响应具有一定的选择性,其他一些常见的酶,如ATP水解酶、胰蛋白酶、酯酶等不能引起探针的荧光变化,同时对Hcy、Cys、GSH、ATP、ADP、AMP、Na2S、Na2SO3、、H2O2、NaNO2、VC等小分子也没有响应。
在本发明的较佳实施方式中,TAB-3-GSH在GGT存在的条件下,周围的三个谷胱甘肽基团可以被GGT选择性水解,当GGT浓度高于50U/L时,TAB-3-GSH开始产生荧光响应,随着GGT浓度的升高,荧光强度逐渐增强,光谱逐渐蓝移;当GGT浓度达到1000U/L时,在490nm处荧光强度增强大约50倍。
在本发明中,本发明的荧光探针能进一步用于细胞成像,由于探针本身含有多个强亲水性的羧基导致其无法通过细胞膜的疏水区域,从而呈现弱的细胞膜通透性,一旦被GGT水解后,羧基的离去会导致探针的细胞膜通透性变强。因此,该探针能选择性成像GGT高表达的细胞,如卵巢癌细胞。
在本发明的较佳实施方式中,当TAB-3-GSH探针与NIH/3T3和HUVEC两种正常细胞一起培养后,细胞内没有荧光信号出现,表明探针无法成像正常细胞。当与卵巢癌细胞SKOV-3一起培养时,细胞内出现明显的荧光,表明该探针能成像高表达GGT的卵巢癌细胞。
同时,本发明还提供该荧光探针的用途,主要是在环境和细胞内GGT的检测用途。优选地,检测评价时的检测条件为:激发波长为405nm,在450-700nm之间进行荧光发射光谱的检测。
另一方面,本发明还提供所述荧光探针的制备方法,包括以下步骤:
步骤一,惰性气体保护下,以5-卤代-2-碘间二甲苯为原料,加入烷基锂试剂、三氟化硼乙醚络合物,得到卤代三芳基苯硼烷;
步骤二,偶联反应:惰性气体保护,在偶联试剂作用下,卤代三芳基苯硼烷与部分氨基被保护的多氮杂环烷反应得到碳氮偶联产物;
步骤三,脱保护反应:脱去上述碳氮偶联产物中氨基的保护基团,得到去保护的碳氮偶联产物;
步骤四,酰化反应:碱性条件下,将去保护的碳氮偶联产物与卤代酰氯反应,得到酰胺产物;
步骤五,取代反应:在碱的作用下,酰胺产物与谷胱甘肽(GSH)、谷胱甘肽单取代烷基酯、半胱氨酸(Cys)、半胱氨酰甘氨酸(Cys-Gly)中的一种或几种反应,制备得到所述荧光探针。
在本发明的具体实施例中,所述的步骤一中,反应温度为低温,优选为-78℃;所述的惰性气体可以选自氮气或氩气;所述的烷基锂试剂可以选自正丁基锂或叔丁基锂;所述的5-卤代-2-碘间二甲苯可以选自5-溴-2-碘间二甲苯或5-氯-2-碘间二甲苯;反应结束后优选用水洗,用石油醚作展开剂过硅胶柱提纯。
所述的步骤二中,反应温度优选90℃;所述的惰性气体可以选自氮气或氩气;所述的偶联试剂为叔丁醇钠(NaOtBu)、三叔丁基磷(BINAP)和醋酸钯(Pd(AcO)2)的甲苯溶液;所述的部分氨基被保护的多氮杂环烷的氨基保护基团可以选自苄氧羰基(Cbz)或叔丁氧羰基(Boc)保护基;所述多氮杂环烷可以选自哌嗪、三氮杂环壬烷、四氮杂环十二烷中的任意一种;反应结束后优选用水洗,硫酸镁干燥,再用硅胶柱提纯。
所述的步骤三为通过加入酸,脱去氨基的保护基团,反应优选在冰浴条件下进行;其中所述的酸可以选自HCl、TFA或HBr;反应结束后用碱性离子交换树脂进行提纯。
所述的步骤四中,反应优选在冰浴条件下进行;所述碱可以是三乙胺,所述的卤代酰氯可以选自氯代乙酰氯或溴代乙酰氯;反应后优选用水洗,硫酸镁干燥,再用硅胶柱提纯。
所述的步骤五中,反应优选在常温条件下进行;所述的碱为碳酸钾;所述的谷胱甘肽单取代烷基酯为谷胱甘肽单甲酯(GSH-Me)、谷胱甘肽单乙酯(GSH-Et)、谷胱甘肽单丙酯(GSH-Pr)、谷胱甘肽单丁酯(GSH-Bu)中的任意一种;反应后优选透析的方法进行提纯。
另一方面,本发明还提供将荧光探针应用于体外GGT的检测应用。优选地,评价时的具体测定方法为:将待测样品加入到的荧光探针的PBS溶液中,测定溶液的荧光强度和荧光颜色作为是否含有GGT及GGT浓度的评价指标。
将本发明所述荧光探针的PBS溶液注入细胞的培养基中进行培养,然后用PBS(磷酸盐缓冲溶液)冲洗培养细胞,再进行荧光成像;根据荧光成像结果判断是否含有GGT。
技术效果
(1)本发明所述的检测GGT的荧光探针可经化学合成获得,合成工艺简单易行,原料廉价易得,制备成本低,易于推广。
(2)本发明所述的检测GGT的荧光探针具有高特异性,在进行相应GGT检测过程中基本不受其他组分的干扰,可用于环境和活细胞内GGT的实时测定,具有广阔的应用前景。
(3)本发明所述的检测GGT的荧光探针只有当GGT浓度高于人体正常浓度(成年女性:5-55U/L;成年男性:15-85U/L)时才产生明显的荧光响应,能有助于检测肝胆疾病和肿瘤的发生。
(4)本发明所述的检测GGT的荧光探针,在进行相应GGT检测时能出现明显的荧光增强和颜色变化,有助于裸眼观测。
(5)本发明所述的检测GGT的荧光探针,在与GGT反应后细胞膜通透性大大增强,能实现选择性成像高浓度GGT细胞(如卵巢癌细胞)的目的。
以下将结合具体实施例和附图对本发明的构思、过程、具体结构及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
附图说明
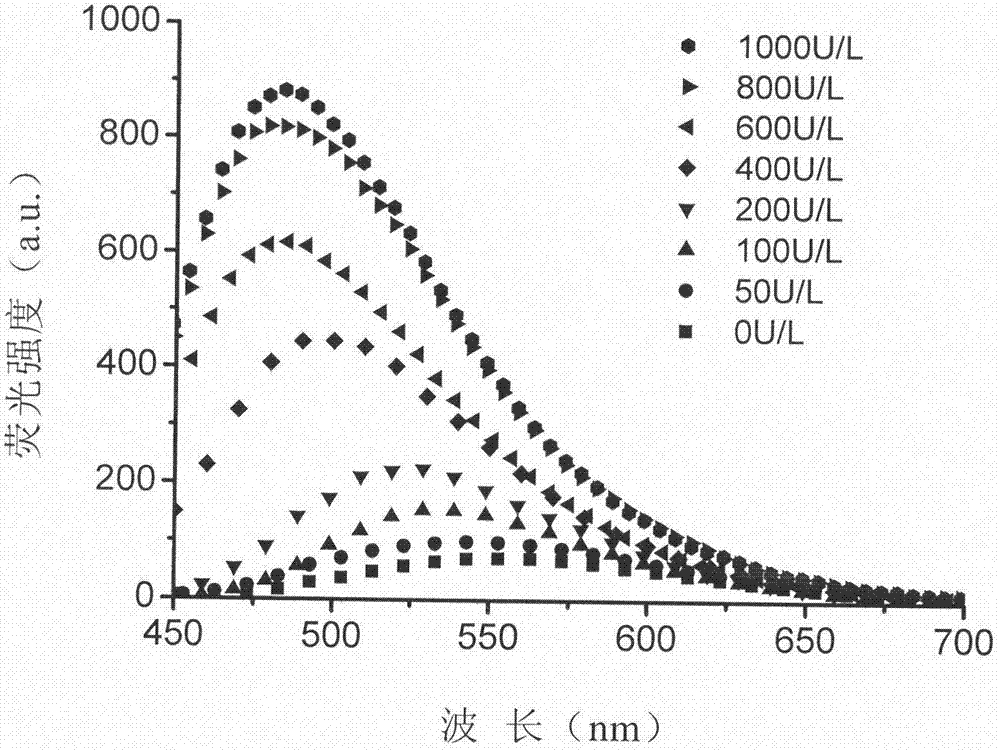
图1是本发明的一较佳实施例的TAB-3-GSH荧光探针在不同浓度GGT条件下的荧光光谱。
图2是本发明的一较佳实施例的TAB-3-Cys-Gly荧光探针在不同浓度GGT条件下的荧光光谱。
图3是本发明的一较佳实施例的TAB-3-GSH荧光探针在加入GGT前后的荧光颜色变化。
图4是本发明的一较佳实施例的TAB-3-GSH荧光探针在活细胞中的成像应用。
具体实施方式
为了进一步说明本发明的指导思想,给出下列具体实施例,但本发明并不受这些具体实施例的限制,任何了解该领域的技术人员对本发明的些许改动将可以达到类似的结果,这些改动也包含在本发明之中。
实施例1
TAB-3-GSH的合成
(1)化合物2的制备:在氮气的保护下,将10g(32mmol)化合物2溶解于60mL干燥的乙醚中,冷却至-78℃,向其滴加入20mL浓度为1.6M的正丁基锂正己烷溶液。将反应升温至室温并搅拌20min。然后,再次冷却至-78℃,加入1.25mL(10mmol)三氟化硼乙醚。反应继续在室温反应,搅拌过夜。旋干溶剂,进一步用硅胶柱色谱纯化得白色固体4.0g,产率71%。
(2)化合物3的制备:将595mg(3.2mmol)N-甲酸叔丁酯哌嗪,560mg(1mmol)化合物2,864mg(9mmol)叔丁基醇钠,27mg(0.12mmol)醋酸钯放入三口瓶中,在双排管上抽排三次,在氮气的保护下,加入50mL甲苯,再加入25mg三叔丁基磷,常温搅拌15min。然后升温至90℃并反应24h。然后将反应冷却至20℃,水洗,用乙酸乙酯萃取,用无水硫酸镁干燥并浓缩。初产物通过硅胶柱进一步纯化得化合物3为334mg,产率为38%。
(3)化合物4的制备:将88mg(0.1mmol)化合物3溶于5mL二氯甲烷;甲醇=5∶2的混合溶剂中,并加入2mL浓盐酸。该反应在室温搅拌48h(直到没有起始原料),反应结束后将溶剂旋干,产生粘稠的固体,将固体用10mL甲醇溶解并倒入强碱性的阴离子交换柱上(Ion exchanger III;Merck)。用100ml甲醇冲洗。将溶液旋干得到57mg(99%)化合物4为黄色固体。
(4)化合物5的制备:在氮气的保护下,在装有57g(0.99mmol)化合物4的圆底烧瓶中加入干燥的二氯甲烷,并加入0.5ml三乙胺,在冰盐浴的条件下逐滴滴入氯代乙酰氯67.2mg(0.6mmol),搅拌过夜。反应结束后初产物通过硅胶柱进一步纯化得化合物5为71.2mg,产率为89%。
(5)TAB-3-GSH的制备:将8mg(0.01mmol)化合物5、9.2mg(0.03mmol)GSH、4.1mg(0.03mmol)碳酸钾溶解于5mL乙腈∶水=4∶1的混合溶剂中,搅拌过夜。将溶液旋干,溶解于1ml水中,用分子量为3000的透析袋进行透析三天。浓缩得TAB-3-GSH为13.9mg,产率为86%。
实施例2
TAB-3-Cys-Gly的合成
(1)化合物2的制备:在氮气的保护下,将10g(32mmol)化合物2溶解于60mL干燥的乙醚中,冷却至-78℃,向其滴加入20mL浓度为1.6M的正丁基锂正己烷溶液。将反应升温至室温并搅拌20min。然后,再次冷却至-78℃,加入1.25mL(10mmol)三氟化硼乙醚。反应继续在室温反应,搅拌过夜。旋干溶剂,进一步用硅胶柱色谱纯化得白色固体4.0g,产率71%。
(2)化合物3的制备:将595mg(3.2mmol)N-甲酸叔丁酯哌嗪,560mg(1mmol)化合物2,864mg(9mmol)叔丁基醇钠,27mg(0.12mmol)醋酸钯放入三口瓶中,在双排管上抽排三次,在氮气的保护下,加入50mL甲苯,再加入25mg三叔丁基磷,常温搅拌15min。然后升温至90℃并反应24h。然后将反应冷却至20℃,水洗,用乙酸乙酯萃取,用无水硫酸镁干燥并浓缩。初产物通过硅胶柱进一步纯化得化合物3为334mg,产率为38%。
(3)化合物4的制备:将88mg(0.1mmol)化合物3溶于5mL二氯甲烷;甲醇=5∶2的混合溶剂中,并加入2mL浓盐酸。该反应在室温搅拌48h(直到没有起始原料),反应结束后将溶剂旋干,产生粘稠的固体,将固体用10mL甲醇溶解并倒入强碱性的阴离子交换柱上(Ion exchanger III;Merck)。用100ml甲醇冲洗。将溶液旋干得到57mg(99%)化合物4为黄色固体。
(4)化合物5的制备:在氮气的保护下,在装有57g(0.99mmol)化合物4的圆底烧瓶中加入干燥的二氯甲烷,并加入0.5ml三乙胺,在冰盐浴的条件下逐滴滴入氯代乙酰氯67.2mg(0.6mmol),搅拌过夜。反应结束后初产物通过硅胶柱进一步纯化得化合物5为71.2mg,产率为89%。
(5)TAB-3-Cys-Gly的制备:将8mg(0.01mmol)化合物5、5.3mg(0.03mmol)Cys-Gly、4.1mg(0.03mmol)碳酸钾溶解于5mL乙腈∶水=4∶1的混合溶剂中,搅拌过夜。将溶液旋干,溶解于1ml水中,用分子量为500的透析袋进行透析三天。浓缩得TAB-3-Cys-Gly为11.1mg,产率为89%。
实施例3
TAB-3-Cys的合成
(1)化合物2的制备:在氮气的保护下,将10g(32mmol)化合物2溶解于60mL干燥的乙醚中,冷却至-78℃,向其滴加入20mL浓度为1.6M的正丁基锂正己烷溶液。将反应升温至室温并搅拌20min。然后,再次冷却至-78℃,加入1.25mL(10mmol)三氟化硼乙醚。反应继续在室温反应,搅拌过夜。旋干溶剂,进一步用硅胶柱色谱纯化得白色固体4.0g,产率71%。
(2)化合物3的制备:将595mg(3.2mmol)N-甲酸叔丁酯哌嗪,560mg(1mmol)化合物2,864mg(9mmol)叔丁基醇钠,27mg(0.12mmol)醋酸钯放入三口瓶中,在双排管上抽排三次,在氮气的保护下,加入50mL甲苯,再加入25mg三叔丁基磷,常温搅拌15min。然后升温至90℃并反应24h。然后将反应冷却至20℃,水洗,用乙酸乙酯萃取,用无水硫酸镁干燥并浓缩。初产物通过硅胶柱进一步纯化得化合物3为334mg,产率为38%。
(3)化合物4的制备:将88mg(0.1mmol)化合物3溶于5mL二氯甲烷;甲醇=5∶2的混合溶剂中,并加入2mL浓盐酸。该反应在室温搅拌48h(直到没有起始原料),反应结束后将溶剂旋干,产生粘稠的固体,将固体用10mL甲醇溶解并倒入强碱性的阴离子交换柱上(Ion exchanger III;Merck)。用100ml甲醇冲洗。将溶液旋干得到57mg(99%)化合物4为黄色固体。
(4)化合物5的制备:在氮气的保护下,在装有57g(0.99mmol)化合物4的圆底烧瓶中加入干燥的二氯甲烷,并加入0.5ml三乙胺,在冰盐浴的条件下逐滴滴入氯代乙酰氯67.2mg(0.6mmol),搅拌过夜。反应结束后初产物通过硅胶柱进一步纯化得化合物5为71.2mg,产率为89%。
(5)TAB-3-Cys的制备:将8mg(0.01mmol)化合物5、3.6mg(0.03mmol)Cys、4.1mg(0.03mmol)碳酸钾溶解于5mL乙腈∶水=4∶1的混合溶剂中,搅拌过夜。将溶液旋干,溶解于1ml水中,用分子量为500的透析袋进行透析三天。浓缩得TAB-3-Cys为9.5mg,产率为89.6%。
实施例4
本发明TAB-3-GSH荧光探针在不同GGT浓度下的荧光检测。
本发明采用GGT溶解在PBS缓冲液(pH=7.4)中供应GGT。预先准备8份2mL的0.5μM的TAB-3-GSH探针缓冲溶液;分别加入GGT使得探针缓冲溶液中GGT依次为0U/L、50U/L、100U/L、200U/L、400U/L、600U/L、800U/L、1000U/L。然后进行荧光检测(Ex=405nm);计算各体系中荧光强度;通过分析480nm处的荧光强度与GGT浓度的关系,评估该探针对GGT的响应性能(见图1)。图1表明,当GGT浓度高于50U/L时,TAB-3-GSH开始产生荧光响应,随着GGT浓度的升高,荧光强度逐渐增强,光谱逐渐蓝移,当GGT浓度达到1000U/L时,在490nm处荧光强度增强大约50倍。
实施例5
本发明TAB-3-Cys-Gly荧光探针在不同GGT浓度下的荧光检测。
本发明采用GGT溶解在PBS缓冲液(pH=7.4)中供应GGT。预先准备8份2mL的0.5μM的TAB-3-Cys-Gly探针缓冲溶液;分别加入GGT使得探针缓冲溶液中GGT依次为0U/L、50U/L、100U/L、200U/L、400U/L、600U/L、800U/L、1000U/L。然后进行荧光检测(Ex=405nm);计算各体系中荧光强度;通过分析480nm处的荧光强度与GGT浓度的关系,评估该探针对GGT的响应性能(见图2)。图2表明,当GGT浓度高于50U/L时,TAB-3-Cys-Gly开始产生荧光响应,随着GGT浓度的升高,荧光强度逐渐增强,光谱逐渐蓝移,当GGT浓度达到1000U/L时,在490nm处荧光强度增强大约10倍。
实施例6
预先准备10份2mL的0.5μM的TAB-3-GSH探针PBS缓冲溶液(pH=7.4),然后分别向该体系中依次加入Apyrase、Trypsin、Esterase、Hcy、Cys、GSH、ATP、ADP、AMP、Na2S、Na2SO3、H2O2、NaNO2、VC等小分子的PBS溶液。然后进行荧光检测(λEx=405nm);计算各体系中荧光强度;评估该不同物质对荧光探针溶液的干扰性(见图3)。从图3中看出,只有当探针溶液中加入GGT时,能够使溶液产生显著的荧光;而当探针溶液中加入Apyrase、Trypsin、Esterase、Hcy、Cys、GSH、ATP、ADP、AMP、Na2S、Na2SO3、、H2O2、NaNO2、VC等小分子时,溶液荧光基本没有变化;这表示该探针只对GGT有响应,而基本不受其他小分子的干扰。
实施例7:
TAB-3-GSH荧光探针在活细胞中的成像应用
将小鼠成纤维细胞NIH/3T3、静脉内皮细胞HUVEC-1、卵巢癌细胞SKOV-3分别利用培养基(培养基中DMEM培养液和胎牛血清的体积比为9∶1)培养在共聚焦培养皿上。放置于条件为37℃、5%(体积分数)CO2和20%(体积分数)O2的培养箱中培养24-48h。移除培养基,用PBS洗三次,然后加入不含血清的DMEM培养液,分别于各培养皿中加入TAB-3-GSH荧光探针的溶液,继续在培养箱中培养2h,PBS(磷酸盐缓冲溶液)冲洗培养细胞6次。利用共聚焦显微镜进行荧光成像(图4)。成像条件为:激发波长405nm,收集范围为:500-550nm(绿色通道);570-620(红色通道)。由图4可知,当探针与NIH/3T3和HUVEC两种正常细胞一起培养后,细胞内没有荧光信号出现,表明探针无法成像正常细胞,当与卵巢癌细胞SKOV-3一起培养时,细胞内出现明显的荧光,表明该探针能成像高表达GGT的卵巢癌细胞。
以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!