通过结合成碱金属碳酸盐来封存二氧化碳的制作方法
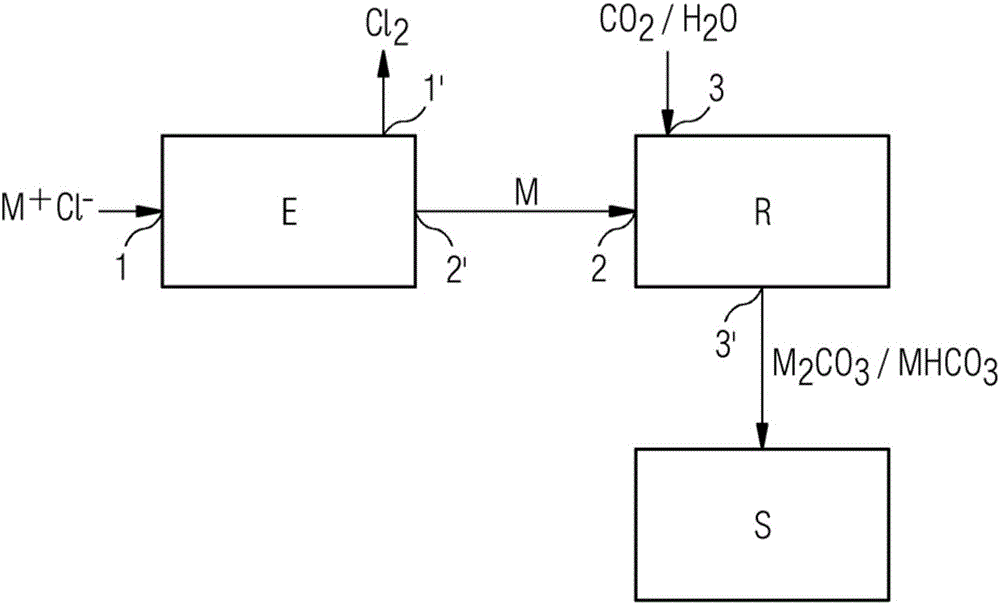
本发明涉及一种用于制备氯气和储存二氧化碳的方法,其中将化学式为M+Cl-的化合物以电解的方式转化成M和Cl2,其中M+=Na、K或其混合物,M与二氧化碳以及可能还有H2O反应生成M2CO3和/或可能反应生成MHCO3,并且储存M2CO3和/或可能MHCO3,以及本发明涉及一种用于实现这种方法的装置。
背景技术:
世界能源需求的约80%现今通过燃烧化石燃料覆盖。2011年,在世界范围内经由所述燃烧过程向大气层中释放了约34032.7百万吨二氧化碳(CO2)。这种释放是处置甚至大量的CO2的最简单方式(褐煤发电厂超过50000吨/天)。
此外,CO2可以通过各种方法进行分离或作为原料利用。
例如,借助单乙醇胺(MEA)清洗来自烟气的二氧化碳。接着将MEA-CO2络合物在升高的温度下裂解。纯的CO2可以例如储存或最终存放于气体洞穴或地上储罐中。化学工业也利用CO2,例如用聚碳酸酯取代聚合物中的一部分单体单元。在这样制备的塑料泡沫中所观察到的性能部分好于没有碳酸盐添加剂的情形。从DE102008031437-A1、WO2010000681-A2、WO2010000681-A3、EP2294643-A2、US20110113844-A1、CN102077395-A中还得知这样的方法,其中碱金属通过与CO2反应提供了适合电厂的热能和同时为化学工业提供了很有价值的中间产品。然而,这样的方法不一定能够捕捉到所制备的全部二氧化碳并且在部分情况下对现有设备的改造过于昂贵。
从WO2012/038330和WO2013/156476中已知该方法的进一步改进。
关于温室气体CO2对气候的负面影响的讨论已经引起了对重复利用CO2的考虑。从热力学角度看,CO2处于非常低的位置并且因而可能难以再次还折合可利用的产品。因此,考虑了将CO2通过引入地下气体洞穴中进行最终存放(碳捕捉和储存)。因为存在逸出令人窒息的气体的风险并且可能转变成 显著的健康风险,所以普通大众不能接受这种最终存放CO2的形式。
因此,需要一种用于安全且有效地储存二氧化碳的方法。
发明概述
根据本发明,发现了还可以如下封存二氧化碳,即利用Na和/或K的碱金属盐并且同时生成氯气,其中这里除了安全储存CO2以外还可以获得有用产品。有利地还可以简单地且廉价地获得NaCl和或KCl作为原材料。
根据第一方面,本发明涉及一种用于制备氯气和储存二氧化碳的方法,其中
a)将化学式为M+Cl-的化合物以电解的方式转化成M和Cl2,其中M+=Na、K或其混合物;
b)M与二氧化碳和可能还有H2O反应生成M2CO3和/或可能反应生成MHCO3;
并且
c)储存M2CO3和/或可能还有MHCO3。
根据另一方面,本发明涉及一种用于制备氯气和储存二氧化碳的设备,其包括:
电解装置E,其设计用于将化学式为M+Cl-的化合物以电解的方式转化成M和Cl2,其中M+=Na、K或其混合物;
用于M+Cl-的第一进料装置1,其设计用于给电解装置E供应M+Cl-;
用于Cl2的第一排出装置1',其设计用于从电解装置E中取出Cl2;
用于M的第二排出装置2',其设计用于从电解装置E中取出M;
用于使二氧化碳与M反应的第一反应器R,其设计用于使M与二氧化碳和可能还有H2O反应生成M2CO3和/或可能反应生成MHCO3;
用于M的第二进料装置2,其与用于M的第二排出装置2'连接并且设计用于给第一反应器R供应M;
用于二氧化碳和可能还有H2O的第三进料装置3,其设计用于给第一反应器R供应二氧化碳和可能还有H2O;
用于M2CO3和/或可能还有MHCO3的第三排出装置3',其设计用于从第一反应器R中取出M2CO3和/或可能还有MHCO3;
用于储存M2CO3和/或可能还有MHCO3的储存装置S,其设计用于储存来 自第三排出装置3'的M2CO3和/或可能还有MHCO3。
本发明的其他方面可由从属权利要求和详述中获得。
附图说明
附图旨在说明本发明的实施方式和赋予本发明的进一步理解。结合附图说明,附图用来阐述本发明的构思和原理。从附图中获悉其他实施方式和许多所提及的优点。附图中的要素不一定相互按比例示出。在附图中,相同的、功能相同和作用相同的要素、特征和组成部分均设有同样的附图标记,除非另外说明。
图1是本发明的第一示例性实施方式的示意图;
图2是本发明的第二示例性实施方式的示意图;
图3是本发明的第三示例性实施方式的示意图。
发明详述
根据具体实施方式,本发明涉及用于制备氯气和储存二氧化碳的方法,其中
a)将化学式为M+Cl-的化合物以电解的方式转化成M和Cl2,其中M+=Na、K或其混合物;
b)M与二氧化碳和可能还有H2O反应生成M2CO3和/或可能反应生成MHCO3;并且
c)储存M2CO3和/或可能还有MHCO3。
该实施方式的整个反应的原理可在下列反应式中示出:
2MCl+2CO2→M2CO3+CO+Cl2,其中M=Na和K或其混合物。
因此,在步骤b)的反应中也可以生成一氧化碳,其可随后转化成进一步的化学产品。
当封存的不是碳酸盐而是碳酸氢盐时,按照所用金属氯化物计的CO2储存密度加倍。
2MCl+3CO2+H2O→2MHCO3+CO+Cl2,其中M=Na和K或其混合物。
在步骤c)的反应中,例如当使用具有氧气、水和二氧化碳组分的空气时,例如可以进行以下反应:
2M+CO2→M2O+CO
2M+2CO2→M2CO3+CO
2M+1/2O2→M2O;M2O+CO2→M2CO3
2M+2H2O→MOH+H2MOH+CO2→MHCO3
根据这些反应式得到的CO可以在步骤b)后从该方法中取出,即,从用于使二氧化碳与M反应的反应器中取出,并且用作有用物质。例如,其可以在Fischer-Tropsch-方法中与水反应生成醇或其它长链烃。
nCO+(2n+1)H2→CnH2n+2+nH2O(烷烃)
nCO+(2n)H2→CnH2n+nH2O(烯烃)
nCO+(2n)H2→CnH2n+1OH+(n-1)H2O(醇)
这些反应过程放热,因此无需使用额外的能量用于该过程。由此在步骤b)的反应中可生成一氧化碳,其可转化成进一步的化学产品。这些产品本身是有用物质,它们可以原样出售或者作为反应物用于化学工业。
此外,也可任选地在步骤b)中进行M与氮气的反应,因为在反应气氛中存在氮气。在此,可以由氮气生成各种产品,其随后可进一步反应生成氨水、胺(与CO或烷烃、烯烃等反应)、氮化合物等。由此还可以获得氨水作为有用物质。
另外,在根据本发明的方法中生成了氯气,其可从步骤a)中取出并且可能还有储存和/或输出。根据具体实施方式,氯气也可就地用于其它化学反应,例如用于氯化以上制备的烷烃、烯烃、醇等,或者通过与氢反应生成HCl。Cl2在化学工业中用于制备溶剂、中间体或盐酸。
2013年氯气的年产率为约71百万吨。这相当于在根据本发明的方法中可封存88百万吨的CO2量。另外,还可以加上44百万吨CO2,这些CO2作为CO(28百万吨)离开整个工艺。基于氯市场,根据本发明的工艺流程由此具有132百万吨/年的未排放到大气中的CO2总量。在CO2补贴价格为30€/t(CO2)的情况下,这相当于补贴储蓄39.6亿€。在较低的预期CO2排放补贴价格约7至10€/t CO2的情况下,补贴储蓄单独地也有约10亿€。从28百万吨CO能够制备约14百万吨的粗汽油(Rohbenzin),这在650€/t的市值下进一步地相当于91亿€的总量。23个最大的德国褐煤和硬煤发电厂排放约200百万吨CO2。这意味着,当建立起该工艺流程并且根据本发明的工艺流程制备原料氯气时,德国发电厂的CO2废物的2/3可作为固态物质最终存放 于地下。
根据优选实施方式,化学式为M+Cl-的化合物源自化学工业的废弃产物和/或从所述废弃产物中获得。例如,这些(废弃)产物源自盐的分解。
步骤a)中的电解根据本发明不是特别限定的并且例如可以包括化学式为M+Cl-的化合物的熔盐电解或化学式为M+Cl-的化合物的水溶液的电解。
在使用包含化学式M+Cl-的化合物的混合物的熔盐电解时获得的优点在于,实现了更高的效率并且另外产生氢气作为副产物,当存在足够的氢气时,该副产物可能是不希望的。
另一方面,当步骤a)的电解通过电解化学式为M+Cl-的化合物的水溶液产生氢气来实现时,该氢气例如用作有用产品或者根据具体实施方式与步骤b)的反应中产生的一氧化碳反应生成进一步的化学产品,正如在上式中示例性地示出的。当然也可能的是,用于与在步骤b)中生成的一氧化碳发生反应的氢气源自其它来源。一氧化碳与氢气的反应例如也可在第一反应器中进行,不过也可在另一反应器中进行。
根据具体实施方式,步骤b)中M与二氧化碳和可能还有H2O的反应可通过使M在包含二氧化碳和可能还有H2O的气氛中燃烧来实现。然而,只要包含二氧化碳,步骤b)中的气氛不是特别限定的,并且例如也可为空气或来自燃烧工艺的废气,例如像在煤电厂中那样的常规热燃烧工艺中或者在石油和/或天然气的燃烧工艺中的废气。优选地,所述反应在这样的气氛中发生,所述气氛相较于正常环境空气而言具有富集的二氧化碳,例如来自用于产生电能的含碳物质的燃烧的废气。在步骤b)的燃烧中更有效且更迅速的反应过程是有利的。针对该目的,必要时可以例如通过添加水或通过电气的或其它的点火源如电弧、激光等起动所述燃烧。
在具体实施方式中可从步骤b)的反应中得到额外的热能,所述热能必要时可以转变成电能和/或用于预加热M。该电能也可以用于步骤a)的电解。根据优选实施方式,用于将M+Cl-电解反应成M和Cl2的能量基本上由来自可再生能源的过剩能量提供,确切地说,基于电解的能量需求量,例如多于50%,优选地多于70%,进一步优选地多于80%,特别优选地多于90%由来自可再生能源的过剩能量提供。对此,当通过可再生能源和/或常规能源提供了比消费者所购买的电流更多的电流时,就可以使用来自可再生能源的过剩能量。尤其地,所述能量是指通过诸如太阳能设备、风能设备、水力设备、 地热设备或生物能设备(生物质)等的可再生能源过剩地提供的能量并且所述能量在生产商的生产时刻不能在当地、区域地和/或跨区域地由消费者购买。在此,该能量也可以来自其他来源,例如来自常规电源和/或来自以上在步骤b)的反应中产生的能量。根据特别优选的实施方式,用于电解化学式为M+Cl-的化合物的能量100%来自可再生能源,其中为了运行电解单元,不直接与化学式为M+Cl-的化合物的电解相关联的能量,例如用于照明目的或用于驱动泵等的能量也可源自其它能源,但是也可源自可再生能源。
另外,本发明包括一种设备,本发明的方法可使用该设备实现。
因此,根据具体实施方式,本发明涉及一种用于制备氯气和储存二氧化碳的设备,其包括:电解装置E,其设计用于将化学式为M+Cl-的化合物以电解的方式转化成M和Cl2,其中M+=Na、K或其混合物;
用于M+Cl-的第一进料装置1,其设计用于给电解装置E供应M+Cl-;
用于Cl2的第一排出装置1',其设计用于从电解装置E中取出Cl2;
用于M的第二排出装置2',其设计用于从电解装置E中取出M;
用于使二氧化碳与M反应的第一反应器R,其设计用于使M与二氧化碳和可能还有H2O反应生成M2CO3和/或可能反应生成MHCO3;
用于M的第二进料装置2,其与用于M的第二排出装置2'连接并且设计用于给第一反应器R供应M;
用于二氧化碳和可能还有H2O的第三进料装置3,其设计用于给第一反应器R供应二氧化碳和可能还有H2O;
用于M2CO3和/或可能还有MHCO3的第三排出装置3',其设计用于从第一反应器R中取出M2CO3和/或可能还有MHCO3;
用于储存M2CO3和/或可能还有MHCO3的储存装置S,其设计用于储存来自第三排出装置3'的M2CO3和/或可能还有MHCO3。
根据具体实施方式,根据本发明的设备可进一步包括用于产生可再生能量的装置,其设计用于为电解装置(E)供应电能。用于产生可再生能量的装置/设备在此不是特别限定的并且可以包括风能设备、水力设备、地热设备、太阳能设备、潮汐发电站、生物热设备或生物质设备等。
第一反应器R在具体实施方式中可以具有用于使M与二氧化碳和可能还有H2O燃烧的燃烧器。为了起动燃烧也可存在用于产生点火功能或等离子体的点火源如电弧,用于产生点火功能或等离子体的其它已知的点火设备例 如为磁点火器、电子点火器和激光点火器。
根据具体实施方式,第一反应器R可包括用于产生的气态产物如CO、NH3等的其它排出装置。
根据具体实施方式,电解装置E可以是熔盐电解装置,或者根据其它具体实施方式,电解装置E可设计用于电解M+Cl-的水溶液,其中该设备则也可进一步包括用于氢气的第四排出装置4',其设计用于从电解装置E取出氢气。
另外,根据本发明的设备可包括用于氢气的第四进料装置4,其根据具体实施方式与用于氢气的第四排出装置4'连接并且设计用于为第一反应器R供应氢气。当然也可存在用于氢气的第四进料装置4,其不与用于氢气的第四排出装置4'连接,或者这样的用于氢气的第四进料装置4也可以这样的实施方式存在,其中用于氢气的第四排出装置4'不一定存在,例如当电解装置E被配置成实施熔盐电解时。
另外,根据本发明的设备也可包括一个或多个用于储存氯气和/或其它产物如一氧化碳或氢气和/或还有衍生产物如COC12(CO+Cl2)、HCl(Cl2+H2)等的储库,和/或还包括用于使一氧化碳与氢气反应的反应器和任选地用于储存一氧化碳和氢气的这种反应的产物如烷烃、烯烃和/或醇的储库。在此有利的是,这些产物可在同时封存二氧化碳的情况下产生。在这样的其它反应中可能产生的二氧化碳可以在本发明的方法中回收利用或也可排放到大气中,当对于步骤b)的反应而言能够获得二氧化碳较高浓度的、例如来自含碳化合物的燃烧的废气时,或者当电解单元E和第一反应器R在空间上远离地彼此设置时。
根据本发明可能的是,电解单元E和第一反应器R处于空间上远离的地点,例如当电解单元E处于用于产生可再生能量的设备附近并且第一反应器R处于另一地点时,在所述另一地点处已事先进行了二氧化碳与金属M的燃烧或类似反应并且将金属M从电解装置E例如用船、火车或卡车输送至第一反应器R要比靠近电解单元E建立新的第一反应器R(这可能关系到巨额成本)便宜。也可能的是,第一反应器R和储存装置S位于空间上远离的地点,例如当在第一反应器R的附近没有足以储存所生成的产物如M2CO3和/或可能还有MHCO3的空间时,或者当这些产物在其它位置处也可作为反应物找到购买方并且由购买方原位储存是优选的时。
然而,根据具体实施方式,电解单元E、第一反应器R和/或储存装置S以及任选地用于其它产物的其它储库不是彼此距离太远,以尽可能避免通过将例如M、M2CO3和/或MHCO3或其它生成的物质运输至其它储库而产生二氧化碳。电解单元E也优选地处于用于产生可再生能量的设备附近,所述用于产生可再生能量的设备常常产生不能在当地或区域中出售的过剩能量。然而,因为这也可季节性地波动,所以不同的电解装置E也可以在不同时间为第一反应器R提供M。
根据本发明,不同的进料装置,即第一进料装置1、第二进料装置2、第三进料装置3和可能还有第四进料装置4,以及不同的排出装置,即第一排出装置1'、第二排出装置2'、第三排出装置3'和可能还有第四排出装置4'不是特别限定的并且可以包括(填充)漏斗、管、输送带等,但是也可包括能够适宜地设置的输送工具如卡车、船、火车集装箱等,例如在供应M的情况下。
此外要注意的是,中间产物碱金属M、在M与水燃烧时可产生的碱液MOH、碱金属碳酸氢盐或碱金属碳酸盐本身已经具有价值并且目前可以其它途径获得。碳酸钠例如目前从天然资源中获得,而其它产物如氢氧化钠通过其它化学过程获得。因为根据本发明的方法提供了显著更大量的碳酸钠或碳酸氢钠和/或氢氧化钠,所以由此例如可以必要时替代或至少避免这些物质从天然资源中的开采或者通过其它方法的制备。
这些与过程有关的优点尤其在以下情形中出现,即,水性的碱金属氯化物电解(其中碱金属为K或Na)由熔盐电解取代并且这些物质按照工艺流程以纯的或者改性的形式反应。在具体实施方式中,在能量方面尤其通过生产过剩的不能存入电网的电能来供应整个工序。
原则上,根据本发明的方法可以在那些现在例如在氯化钠水溶液的情况下利用NaCl和或KCl的电解来获得原料氯气的地点处应用。迄今通常不应用这里产生的氢气,其中所述氢气如上所示地可用来制备更高价值的产品如烷烃、烯烃或醇。如果存在过多的氢气,则应用熔盐电解是有利的,从而根据氢气的存在和对氢气的需求,也可交替地进行M+Cl-水溶液的电解或熔盐电解,以按照制备更高价值的产物的需求和/或需要,例如采用Fischer-Tropsch工艺来提供氢气。
因此,整个方法可以例如以可能存在的准备步骤如下进行:
0)氯化钠和氯化钾在自然界中通常相关联地存在并且通过静电工艺相对费事地分离。然而所述分离仅具有有限的有效性,因此产生了大量的出于经济原因而不再进一步加工的氯化钠/钾矿堆。
静电工艺
例如将如盐NaCl或KCl的一种物质在另一材料上摩擦,则二者可以彼此带电。该原理被用来分离固体混合物。粗盐为此例如被研磨成毫米粒径。在下一步骤中,该盐可以用表面活性剂进行处理,以使其选择性地彼此带正电或负电。随后使盐晶体滴过“自由落体分离器”。该自由落体分离器由两个电极构成,这两个电极之间存在高压电场。带有不同电荷的盐向阳极或向阴极偏转。在自由落体分离器下方分开地收集经分选的矿物质。
该矿堆这时可以用作氯源,其中KCl和NaCl的混合物也可就此用作步骤a)的氯源。对于该目的不太优选的是直接分解。如果CO2-补贴的价值上升,则直接分解也可以是经济的。优选地,在此涉及的混合物是含不同比例的氯化钾和氯化钠的无价值的混合物。根据NaCl-KCl的相图,混合物中的这些盐的熔点明显下降,这使得电解在能量上更加有利,尤其是在熔盐电解的情况下。典型的效率在此例如大于50%。对于该方法而言碱金属是否以纯的形式或者作为各组分的合金被分离是不重要的。其它盐添加剂(例如CaCl2)同样可以用于降低熔点。
1)正如已经熟知的那样,在第二步骤中由卤化物通过例如熔盐电解制备碱金属。
根据现有技术,电解钠例如可以在所谓的唐士电解池(Downs-Zelle)中在通过干燥的氯化钠的熔盐电解来制备钠的过程中实现。为了在较低温度下实现有效电解,在此为了降低熔点可以例如使用由60%的氯化钙和40%的氯化钠形成的共晶盐混合物,该共晶盐混合物在580℃熔融。甚至氯化钡也可用作添加剂。在施加了适合的电压后,例如约7伏,发生例如以下过程:
阴极:
2Na++2e-→2Na0
阳极:
2Cl-→Cl2+2e-
整个反应:
2Na++2Cl-→2Na+Cl2
例如,为了制备1公斤钠,在根据现有技术的方法的电解过程中消耗了约10kWh电流。
类似的反应出现在KCl和/或NaCl和KCl的混合物的情况下。
2)随后,步骤b)的反应例如根据以下反应式进行:
2M+CO2→M2O+CO
2M+2CO2→M2CO3+CO
2M+1/2O2→M2O;M2O+CO2→M2CO3
2M+2H2O→MOH+H2MOH+CO2→MHCO3
因此,当在包含例如CO2、N2、O2、H2O的气氛中燃烧碱金属时,在包括第一反应器R的设备或电厂中可以得到可应用的热量(例如也用于预加热M的热量)和有用的合成基础材料如CO、H2。
为了提高储存密度,金属碳酸盐可以与水和其它的CO2反应生成金属碳酸氢盐:
M2CO3+H2O+CO2→2MHCO3
金属碳酸盐或金属碳酸氢盐可以随后加以利用或者在所期望的过剩生产的情况下被封存。
以上实施方式、设计方式和扩展方案只要有利就可以任意地彼此结合。本发明的其它可能的设计方式、扩展方案和实施方案还包括之前或随后关于实施例进行描述的本发明特征的未明确提及的组合。尤其地,本领域技术人员也可添加单个方面作为对本发明的相应基本形式的改善或补充。
实施例
图1至图3中示出了一种设备的示例性设计方式。
实施例1
图1中示出了根据本发明的设备的第一实施方式。
将化合物M+Cl-通过用于M+Cl-的第一进料装置1供应至电解装置E。 电解装置E例如设计成熔盐电解。随后,在该电解装置E中将该化合物电解成Cl2和M,其中通过用于Cl2的第一排出装置1'从电解装置E中取出Cl2并且随后可将其储存、输出或进一步应用。另外,通过用于M的第二排出装置2'从电解装置E中取出M。该第二排出装置2'与用于M的第二进料装置2连接,通过该第二进料装置2将M引入用于转化二氧化碳的第一反应器R中。进一步地,将二氧化碳和可能还有H2O通过用于二氧化碳和可能还有H2O的第三进料装置3供应至第一反应器R。在那里,M与CO2和可能还有H2O以及可能还有其它未示出的气体如N2或O2反应生成M2CO3和/或可能还有MHCO3以及可能还有其它未示出的产物如MOH、NH3等。将所生成的M2CO3和/或可能还有MHCO3通过用于M2CO3和/或可能还有MHCO3的第三排出装置3'从第一反应器R中取出并且引入到用于储存M2CO3和/或可能还有MHCO3的储存装置S中。任选地,按照相应需求可从储存装置S取出M2CO3和/或可能还有MHCO3。也可将第一反应器R中生成的气态产物通过未示出的排出装置从第一反应器R中取出。
实施例2
实施例2的设备在图2中示出并且相当于实施例1的设备,其中作为电解装置E,熔盐电解被其中电解M+Cl-的水溶液的电解方式取代。由此在电解装置E中产生了氢气,该氢气通过用于氢气的第四排出装置4'从电解装置E中取出。所述用于氢气的第四排出装置4'与用于氢气的第四进料装置4连接,通过所述用于氢气的第四进料装置4给第一反应器R供应氢气,其中氢气在这里可以与CO制备烷烃、烯烃、醇等。这些也可以通过未示出的用于气态产物的排出装置或者另一排出装置取出。
实施例3
图3中示出的实施例3的设备相当于实施例1的设备,其中通过用于氢气的第四进料装置4给第一反应器R供应氢气。氢气可以再次与CO反应生成烷烃、烯烃、醇等,它们也可以通过未示出的用于气态产物的排出装置或者另一排出装置取出。
根据本发明,描述了如下的整体构思:
a.将天然地作为氯化物出现的物质如氯化钠或氯化钾用作物质源。
b.优选地,借助过剩电能获得作为通过电解得到的物质型季节性储能器的碱金属钠和钾并且获得氯气用于制备氯。
c.这些金属与CO2燃烧生成碳酸钠或碳酸钾,同时形成CO。
d.将碳酸钠或碳酸钾或碳酸氢钠或碳酸氢钾封存,由此从大气中提取出CO2。根据现有的过剩能量和氯气需求判断可封存的量。
e.为化学工业提供用于制备溶剂、中间体或盐酸的基本化学品氯气。
氯的制备与物质型季节性储能器碱金属的结合提供了将CO2封存为金属碳酸盐或金属碳酸氢盐的过程的可能性。
该过程另外还实现了“碳捕捉和储存”与取决于时间和地点的可再生能量的过剩生产相结合。过剩能量以碱金属形式储存。这些储存器与CO2相关联的卸载为反向发电提供了处于高温度水平的热能并且为化学合成提供了额外的有价值的中间产物。
在利益链条的最后产生了固态、易于填埋、无毒的金属碳酸盐和/或金属碳酸氢盐。
最大可能容量可限于世界范围内的氯需求,但是最终处置24个最大的德国褐煤和燃煤电厂的CO2排放的2/3就会足够。
通过节省CO2补贴和获得有用产品如粗汽油或醇,得到了额外的财务效益。
- 还没有人留言评论。精彩留言会获得点赞!