用于分离微囊泡的方法与流程
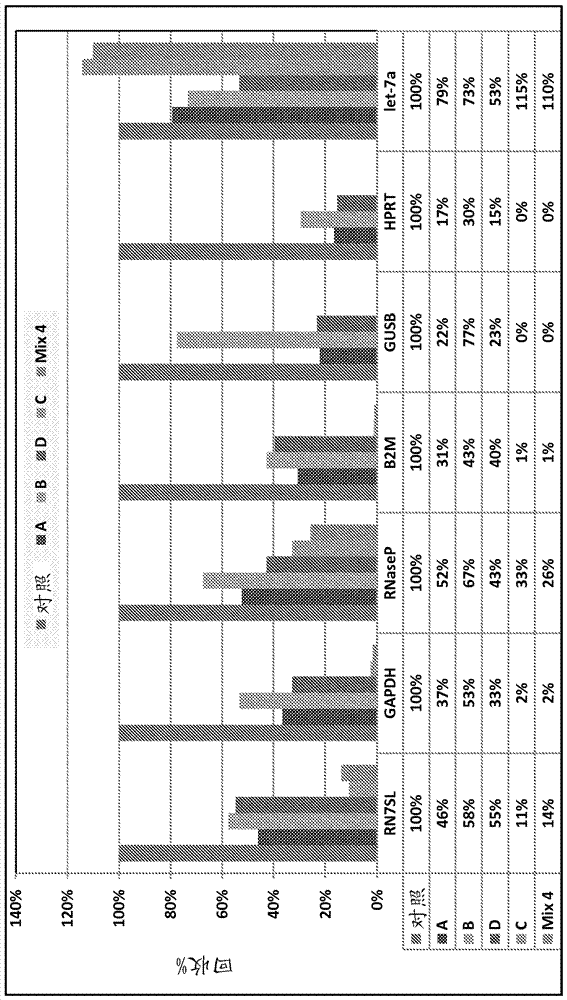
本申请要求于2013年1月3日提交的美国临时申请号61/748,575的优先权和利益,所述美国临时申请的内容在此整体引入作为参考。发明领域本发明提供了用于从生物样品中分离微囊泡且用于从微囊泡中提取核酸的新型方法和试剂盒。背景由细胞脱落且直径<0.8µm的膜囊泡统称为微囊泡。来自多种细胞来源的微囊泡已关于蛋白质和脂质含量进行广泛研究。近来,已发现微囊泡还含有DNA和RNA,包括基因组DNA、cDNA、线粒体DNA、微小RNA(miRNA)和信使RNA(mRNA)。由于由细胞脱落的微囊泡中含有的遗传和蛋白质组学信息,目前研究旨在利用微囊泡以获得这些细胞状态的进一步了解,例如疾病状态或疾病倾向。相应地,存在从生物样品中分离微囊泡的方法,和提取高质量核酸用于医学状况和疾病的精确诊断的方法的需要。发明概述本发明提供了通过将微囊泡捕获至表面且随后裂解微囊泡以释放其中含有的核酸,用于分离微囊泡的方法和试剂盒。在一些实施方案中,该方法和试剂盒从微囊泡级分中分离且提取RNA。这些方法和试剂盒在本文中被称为基于EXO50或EXO50的方法和/或试剂盒。在一些实施方案中,该方法和试剂盒从微囊泡级分中分离且提取DNA。RNA随后可以加工用于进一步分析。这些方法和试剂盒在本文中被称为基于EXO52或EXO52的方法和/或试剂盒,并且可以包括EXO52方法和/或试剂盒的衍生物,在本文中被称为EXO52.2。DNA随后可以加工用于进一步分析。本发明还提供了通过将微囊泡捕获至表面且随后从捕获表面洗脱微囊泡,用于分离微囊泡的方法和试剂盒。这些方法和试剂盒在本文中被称为EXO51。微囊泡随后可以加工用于进一步分析。用于从生物样品中分离微囊泡级分且从微囊泡级分中提取核酸的先前操作依赖使用超速离心,例如以小于10,000xg旋转1-3小时,随后去除上清液,洗涤团块,裂解团块且在柱上纯化核酸例如RNA。这些先前方法证实几个缺点例如缓慢、繁琐、遭受分批之间的变异性,并且不适合于可扩展性。用于分离和提取的方法和试剂盒克服这些缺点,并且提供了用于分离和提取的基于旋转的柱,其是快速、稳健的且易于扩展至大体积。该方法和试剂盒使用下述一般操作从生物样品中分离且提取RNA,其在本文中被称为“EXO50”。首先,微囊泡级分与膜滤器结合,并且洗涤滤器。随后,使用试剂执行膜上裂解和RNA释放。氯仿提取随后使用PLG管执行,随后为乙醇条件化。RNA随后与二氧化硅柱结合,洗涤且随后洗脱。RNA随后加工用于进一步分析。在EXO50方法和试剂盒中使用的膜具有大孔,并且总体是带正电的。在一些实施方案中,超过一个膜用于EXO50方法和试剂盒中,例如使用两个或更多个膜。在一些实施方案中,使用三个膜。在一些实施方案中,使用超过三个膜。在一些实施方案中,每层膜是不同类型的膜。在一些实施方案中,每层膜是相同类型的膜。在一些实施方案中,膜层是至少两种不同类型的膜的组合。在一些实施方案中,每层膜由不同材料组成。在一些实施方案中,每层膜由相同材料组成。在一些实施方案中,每层膜是带电的。在一些实施方案中,至少一层是不带电的。在一些实施方案中,每层膜具有相同电荷。在一些实施方案中,每层膜具有相同电荷。在一些实施方案中,每层膜具有不同电荷。在一些实施方案中,膜或至少一层膜是带正电的膜。在一些实施方案中,捕获表面或至少一层是再生纤维素、强碱性阴离子交换剂(“RC/SBAE”)膜,其是带正电的膜并且是具有季胺的阴离子交换剂。例如,RC/SBAE膜由季铵,R-CH2-N+(CH3)3官能化。在一些实施方案中,膜具有至少3um的孔径。在EXO50方法和试剂盒中使用的膜数目与一次可以分析的总样品体积关联。在方法和试剂盒中使用的层数和每层的容量例如结合容量、流通率或其他量度影响可以使用的样品大小的总体积。当一层或每层具有更高的结合容量时,更多层可以用于方法和/或试剂盒中,并且当一层或每层具有更低的结合容量时,更少层可以用于方法和/或试剂盒中。此外,样品的粘度和组成也影响可以使用的样品大小的总体积。例如,在其中样品是血浆的一些实施方案中,约1ml样品加工用于EXO50方法和试剂盒中使用的每层膜。在一些实施方案中,用于膜上裂解的试剂是QIAzol。在一些实施方案中,QIAzol以约700ul的体积使用。该方法和试剂盒使用下述一般操作从生物样品中分离且提取DNA,其在本文中被称为“EXO52”。首先,微囊泡级分与膜滤器结合,并且洗涤滤器。随后,使用试剂执行膜上裂解和核酸例如RNA释放。随后执行乙醇沉淀,随后为裂解和蛋白酶降解。DNA随后与二氧化硅柱结合,洗涤且随后洗脱。DNA随后加工用于进一步分析。在EXO52方法和试剂盒中使用的膜具有大孔,并且总体是带正电的。在一些实施方案中,超过一个膜用于EXO52方法和试剂盒中,例如使用两个或更多个膜。在一些实施方案中,使用三个膜。在一些实施方案中,使用超过三个膜。在一些实施方案中,每层膜是不同类型的膜。在一些实施方案中,每层膜是相同类型的膜。在一些实施方案中,膜层是至少两种不同类型的膜的组合。在一些实施方案中,每层膜由不同材料组成。在一些实施方案中,每层膜由相同材料组成。在一些实施方案中,每层膜是带电的。在一些实施方案中,至少一层是不带电的。在一些实施方案中,每层膜具有相同电荷。在一些实施方案中,每层膜具有相同电荷。在一些实施方案中,每层膜具有不同电荷。在一些实施方案中,膜或至少一层膜是带正电的膜。在一些实施方案中,捕获表面或至少一层是再生纤维素、强碱性阴离子交换剂(“RC/SBAE”)膜,其是带正电的膜并且是具有季胺的阴离子交换剂。例如,RC/SBAE膜由季铵,R-CH2-N+(CH3)3官能化。在一些实施方案中,膜具有至少3um的孔径。在EXO52方法和试剂盒中使用的膜数目与一次可以分析的总样品体积关联。在方法和试剂盒中使用的层数和每层的容量例如结合容量、流通率或其他量度影响可以使用的样品大小的总体积。当一层或每层具有更高的结合容量时,更多层可以用于方法和/或试剂盒中,并且当一层或每层具有更低的结合容量时,更少层可以用于方法和/或试剂盒中。此外,样品的粘度和组成也影响可以使用的样品大小的总体积。例如,在其中样品是血浆的一些实施方案中,约1ml样品加工用于EXO52方法和试剂盒中使用的每层膜。在一些实施方案中,用于膜上裂解的试剂是QIAzol。在一些实施方案中,QIAzol以约700ul的体积使用。在EXO51方法和试剂盒中使用的膜具有大孔,并且总体是带正电的。在一些实施方案中,超过一个膜用于EXO51方法和试剂盒中,例如使用两个或更多个膜。在一些实施方案中,使用三个膜。在一些实施方案中,使用超过三个膜。在一些实施方案中,每层膜是不同类型的膜。在一些实施方案中,每层膜是相同类型的膜。在一些实施方案中,膜层是至少两种不同类型的膜的组合。在一些实施方案中,每层膜由不同材料组成。在一些实施方案中,每层膜由相同材料组成。在一些实施方案中,每层膜是带电的。在一些实施方案中,至少一层是不带电的。在一些实施方案中,每层膜具有相同电荷。在一些实施方案中,每层膜具有相同电荷。在一些实施方案中,每层膜具有不同电荷。在一些实施方案中,膜或至少一层膜是带正电的膜。在一些实施方案中,捕获表面或至少一层是再生纤维素、强碱性阴离子交换剂(“RC/SBAE”)膜,其是带正电的膜并且是具有季胺的阴离子交换剂。例如,RC/SBAE膜由季铵,R-CH2-N+(CH3)3官能化。在一些实施方案中,膜具有至少3um的孔径。在EXO51方法和试剂盒中使用的膜数目与一次可以分析的总样品体积关联。在方法和试剂盒中使用的层数和每层的容量例如结合容量、流通率或其他量度影响可以使用的样品大小的总体积。当一层或每层具有更高的结合容量时,更多层可以用于方法和/或试剂盒中,并且当一层或每层具有更低的结合容量时,更少层可以用于方法和/或试剂盒中。此外,样品的粘度和组成也影响可以使用的样品大小的总体积。例如,在其中样品是血浆的一些实施方案中,约1ml样品加工用于EXO51方法和试剂盒中使用的每层膜。在一些实施方案中,用于膜上裂解的试剂是QIAzol。在一些实施方案中,QIAzol以约700ul的体积使用。使用离子交换技术执行这些方法和/或试剂盒中任一种中的微囊泡级分纯化。在一些实施方案中,离子交换技术是选自在本文提供的工作实施例中所示那些的技术。在一个方面,用于从生物样品中提取核酸的方法包括(a)提供生物样品;(b)在足以使微囊泡级分保留在捕获表面之上或其中的条件下,使生物样品与捕获表面接触;(c)在微囊泡处于捕获表面之上或其中时,裂解微囊泡级分;和(d)从微囊泡级分中提取核酸。可替代地,用于从生物样品中提取核酸的进一步方法包括在步骤(b)后从捕获表面洗脱微囊泡级分,收集洗脱的微囊泡级分,且从洗脱的微囊泡级分中提取核酸。任选地,洗脱的微囊泡级分可以通过旋转浓缩器进行浓缩,以获得浓缩的微囊泡级分,并且随后从浓缩的微囊泡级分中提取核酸。在一个实施方案中,捕获表面是带正电的。在另一个实施方案中,捕获表面是带负电的。在另外一个实施方案中,捕获表面是中性的。在一些实施方案中,捕获表面包括超过一层。在一些实施方案中,超过一个膜用于EXO51方法和试剂盒中,例如使用两个或更多个膜。在一些实施方案中,使用三个膜。在一些实施方案中,使用超过三个膜。在一些实施方案中,每层膜是不同类型的膜。在一些实施方案中,每层膜是相同类型的膜。在一些实施方案中,膜层是至少两种不同类型的膜的组合。在一些实施方案中,每层膜由不同材料组成。在一些实施方案中,每层膜由相同材料组成。在一些实施方案中,每层膜是带电的。在一些实施方案中,至少一层是不带电的。在一些实施方案中,每层膜具有相同电荷。在一些实施方案中,每层膜具有相同电荷。在一些实施方案中,每层膜具有不同电荷。在一个实施方案中,捕获表面是珠。例如,珠是磁性的。可替代地,珠是非磁性的。在另外一个实施方案中,珠由亲和配体官能化。优选地,捕获表面是膜。在一个方面,膜包含再生纤维素。例如,膜具有在3-5um范围内的孔径。在另一个方面,膜包含聚乙烯砜(PES)。例如,膜具有在20nm-0.8um范围内的孔径。在另一个方面,膜是带正电的。在一些方面,膜是官能化的。例如,膜由季铵R-CH2-N+(CH3)3官能化。在一个实施方案中,捕获表面包含三个膜,其中所述三个膜彼此直接邻近。优选地,生物样品是血浆、血清、尿、脑脊髓液或细胞培养物上清液。在一些方面,本文描述的方法和/或试剂盒进一步包括使生物样品与装载缓冲液接触。装载缓冲液在pH4-8的范围内。在一个方面,装载缓冲液具有中性pH。本文描述的方法和/或试剂盒提供了从微囊泡中提取核酸。优选地,提取的核酸是RNA。提取的RNA可以包含信使RNA、核糖体RNA、转移RNA、小RNA例如微小RNA、非编码RNA和任何其他短RNA和/或RNA片段、或其任何组合。在一些实施方案中,该方法和/或试剂盒用于从生物样品中去除核酸种类。例如,EXO50和/或试剂盒用于从生物样品中去除RNA种类,作为非限制性例子包括从生物样品中去除囊泡结合的RNA,以从流通物中分离一种或多种交互RNA(reciprocalRNA)。现在将详细描述本发明的多个方面和实施方案。应当理解可以作出细节的修饰,而不背离本发明的范围。进一步地,除非上下文另有要求,否则单数术语应包括复数,并且复数术语应包括单数。鉴定的所有专利、专利申请和出版物明确引入本文作为参考,用于描述和公开例如此类出版物中所述的方法的目的,所述方法可以与本发明结合使用。这些出版物在本申请的提交日期之前仅为了其公开内容提供。在这点上决不应解释为本发明人无权由于先前发明或任何其他原因而先于这些公开内容的承认。关于日期的所有陈述或关于这些文件内容的表示均基于申请人可获得的信息,并且不构成关于这些文件的日期或内容的正确性的任何承认。附图简述图1是描述使用以真空形式的0.65um带正电的QPES滤器(Millipore),可以如何分离血浆微囊泡RNA的一系列图表。图1A描述了比较通过超速离心和0.65um带正电的Q聚乙烯砜(PES)真空过滤(滤器和滤液),从4mL正常对照血浆中提取的微囊泡总RNA的质量、浓度和大小分布的生物分析仪曲线。相对荧光单位(FU)针对时间进行标绘。25s峰代表内部标准。最突出的峰代表小RNA。在~41s和~47s处的峰分别代表18S和28S。图1B描述了使用定量RT-PCR由相同样品分析的mRNA和成熟miRNA水平。相对量值呈现为平均值±SD。图2是描述使用以真空形式的0.65um带正电的QPES滤器(Millipore),可以如何在2mL血浆和12mL血浆中检测BRAFV600E突变的一系列图表。使用定量RT-PCR由2mL和12mL血浆评价BRAFV600E拷贝数,所述血浆通过超速离心和0.65um带正电的QPES真空过滤(滤器、滤液和洗涤)提取。图3是描述使用以旋转柱形式的3-5um带正电的Q再生纤维素滤器(Sartorius),可以如何分离血浆微囊泡RNA的一系列图表。图3A描述了比较通过超速离心和3-5um带正电的Q再生纤维素旋转柱过滤(滤器、滤液和洗涤),从4mL正常对照血浆中提取的微囊泡总RNA的质量、浓度和大小分布的生物分析仪曲线。相对荧光单位(FU)针对时间进行标绘。25s峰代表内部标准。最突出的峰代表小RNA。在~41s和~47s处的峰分别代表18S和28S。图3B描述了使用定量RT-PCR由相同样品分析的mRNA和成熟miRNA水平。相对量值呈现为平均值±SD。图4是描述使用以自制旋转柱形式的0.8um带负电的SPES滤器(Pall),可以如何分离血浆微囊泡RNA的一系列图表。图4A是比较通过超速离心和0.8um带负电的SPES旋转柱过滤,从4mL正常对照血浆中提取的微囊泡总RNA的质量、浓度和大小分布的生物分析仪曲线。相对荧光单位(FU)针对时间进行标绘。25s峰代表内部标准。最突出的峰代表小RNA。在~41s和~47s处的峰分别代表18S和28S。图4B描述了使用定量RT-PCR由相同样品分析的mRNA和成熟miRNA水平。相对量值呈现为平均值±SD。图5是描述使用以自制旋转柱形式的0.8um带正电的QPES滤器(Pall),可以如何分离血浆微囊泡RNA的一系列图表。图5A是比较通过超速离心和0.8um带正电的QPES旋转柱过滤,从4mL正常对照血浆中提取的微囊泡总RNA的质量、浓度和大小分布的生物分析仪曲线。相对荧光单位(FU)针对时间进行标绘。25s峰代表内部标准。最突出的峰代表小RNA。在~41s处的峰代表18S。图5B描述了使用定量RT-PCR由相同样品分析的mRNA和成熟miRNA水平。相对量值呈现为平均值±SD。图6是描述使用以0.8um带正电的QPES注射器式滤器(Pall),可以如何分离血浆微囊泡RNA的图表。血浆微囊泡RNA可以用0.8um带负电的SPES注射器式滤器(Pall)进行分离。使用定量RT-PCR由4mL血浆分析mRNA和成熟miRNA水平,所述血浆通过超速离心、0.8um带正电的QPES注射器过滤(滤器和滤液)和0.8um带负电的SPES注射器过滤(滤器和滤液)提取。相对量值呈现为平均值±SD。图7是描述使用荷电的尼龙注射器式滤器,可以如何分离血浆微囊泡RNA的一系列图表。图7A是比较通过超速离心和带负电的尼龙注射器过滤(滤器和滤液),从4mL正常对照血浆中提取的微囊泡总RNA的质量、浓度和大小分布的生物分析仪曲线。相对荧光单位(FU)针对时间进行标绘。25s峰代表内部标准。最突出的峰代表小RNA。在~41s和~47s处的峰分别代表18S和28S。图7B描述了使用定量RT-PCR对相同样品分析的mRNA和成熟miRNA水平。循环阈值(Ct)呈现为平均值±SD。图8是描述使用以真空形式的0.65um带正电的QPES滤器(Millipore),可以如何分离尿微囊泡RNA的一系列图表。图8A是比较通过超速离心和0.65um带正电的QPES真空过滤(滤器和滤液),从10mL正常对照尿中提取的微囊泡总RNA的质量、浓度和大小分布的生物分析仪曲线。相对荧光单位(FU)针对大小(nt)进行标绘。25s峰代表内部标准。最突出的峰代表小RNA。在~1900nt和3900nt处的峰分别代表18S和28S。图8B描述了使用定量RT-PCR由相同样品分析的mRNA和成熟miRNA水平。相对量值呈现为平均值±SD。图9是描述qRT-PCR如何在血浆样品中得到抑制的图表,所述血浆样品使用以旋转柱形式的带负电的S再生纤维素滤器(ThermoScientific)提取。使用定量RT-PCR对4mL血浆样品分析GAPDH水平,所述血浆样品使用超速离心、3-5um带正电的Q再生纤维素旋转柱过滤和3-5um带负电的S再生纤维素旋转柱过滤提取。所有RNA样品均在cDNA合成前1:10和1:100稀释。循环阈值(Ct)呈现为平均值±SD。图10是描述微囊泡如何在酸性pH下稳定的一系列图表。图10A是比较通过离心从1.9mL正常对照血浆中提取的微囊泡总RNA的质量、浓度和大小分布的生物分析仪曲线。相对荧光单位(FU)针对大小(nt)进行标绘。25nt峰代表内部标准。最突出的峰代表小RNA。在~1900nt和~4000nt处的峰分别代表18S和28S。图10B描述了使用定量RT-PCR对相同样品分析的mRNA和成熟miRNA水平。循环阈值(Ct)呈现为平均值±SD。图11是描述微囊泡如何在碱性pH下不稳定的一系列图表。图11A是比较通过离心从1.9mL正常对照血浆中提取的微囊泡总RNA的质量、浓度和大小分布的生物分析仪曲线。相对荧光单位(FU)针对大小(nt)进行标绘。25nt峰代表内部标准。最突出的峰代表小RNA。它应在~150nt处显示。然而,由于技术误差,峰在~0nt处显示。另外,由于技术误差,在~1500nt和~3700nt处的峰分别代表18S和28S。相反,18S和28S峰应分别在~1900nt和~4700nt处显示。图11B描述了使用定量RT-PCR对相同样品分析的mRNA和成熟miRNA水平。循环阈值(Ct)呈现为平均值±SD。图12是描述在荷电滤器上的微囊泡捕获和/或微囊泡稳定性如何受缓冲液pH和/或缓冲液浓度和/或缓冲液类型(比较其为相同浓度,但官能团浓度不同的缓冲液)影响的一系列图表。图12A是比较通过超速离心和带正电的Q再生纤维素离心过滤(滤器和滤液),从4.8mL正常对照血浆中提取的微囊泡总RNA的质量、浓度和大小分布的生物分析仪曲线。过滤样品用下述缓冲液设置进行分离:·100mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH6.8(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH7(平衡和洗涤缓冲液)·100mMTris、150mMNaCl,pH8(2X装载缓冲液)和50mMTris、150mMNaCl,pH8(平衡和洗涤缓冲液)·100mM二乙醇胺、150mMNaCl,pH9(2X装载缓冲液)和50mM二乙醇胺、150mMNaCl,pH9(平衡和洗涤缓冲液)在图12A中,图例仅通过平衡和洗涤缓冲液鉴定样品。相对荧光单位(FU)针对时间进行标绘。25s峰代表内部标准。最突出的峰代表小RNA。在~41s和~47s处的峰分别代表18S和28S。图12B描述了使用定量RT-PCR由相同样品分析的mRNA和成熟miRNA水平。循环阈值(Ct)呈现为平均值±SD。图13是描述在荷电滤器上的微囊泡捕获和/或微囊泡稳定性如何受缓冲液pH和/或缓冲液浓度和/或缓冲液类型(比较其为相同浓度,但官能团浓度不同的缓冲液)影响的一系列图表。图13A是比较通过超速离心和带正电的Q再生纤维素离心过滤,从3.8mL正常对照血浆中提取的微囊泡总RNA的质量、浓度和大小分布的生物分析仪曲线。过滤样品用下述缓冲液设置进行分离:·100mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH6(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH6.5(平衡和洗涤缓冲液)·100mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH6.8(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH7(平衡和洗涤缓冲液)·100mM三乙醇胺(TEA)、150mMNaCl,pH6.5(2X装载缓冲液)和50mM三乙醇胺、150mMNaCl,pH7.0(平衡和洗涤缓冲液)·100mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH7.4(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH7.5(平衡和洗涤缓冲液)·100mMTris、150mMNaCl,pH7.4(2X装载缓冲液)和50mMTris、150mMNaCl,pH7.5(平衡和洗涤缓冲液)·100mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH8(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH8(平衡和洗涤缓冲液)·100mMTris、150mMNaCl,pH8(2X装载缓冲液)和50mMTris、150mMNaCl,pH8(平衡和洗涤缓冲液)·100mMTris、150mMNaCl,pH8.5(2X装载缓冲液)和50mMTris、150mMNaCl,pH8.5(平衡和洗涤缓冲液)在图13A中,图例仅通过平衡和洗涤缓冲液鉴定样品。相对荧光单位(FU)针对时间进行标绘。25s峰代表内部标准。最突出的峰代表小RNA。图14B描述了使用定量RT-PCR由相同样品分析的mRNA和成熟miRNA水平。循环阈值(Ct)呈现为平均值±SD。图14是描述在荷电滤器上的微囊泡捕获和/或微囊泡稳定性如何受缓冲液pH和缓冲液浓度(比较其为相同官能团浓度,但不是总体浓度的缓冲液)影响的一系列图表。图14A是比较通过超速离心和带正电的Q再生纤维素离心过滤,从3.8mL正常对照血浆中提取的微囊泡总RNA的质量、浓度和大小分布的生物分析仪曲线。过滤样品用下述缓冲液设置进行分离:·117mMBisTris、150mMNaCl,pH1.9(2X装载缓冲液)和58.5mMBisTris、150mMNaCl,pH6(平衡和洗涤缓冲液)·117mMBisTris、150mMNaCl,pH6.1(2X装载缓冲液)和58.5mMBisTris、150mMNaCl,pH6.5(平衡和洗涤缓冲液)·100mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH6(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH6.5(平衡和洗涤缓冲液)·100mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH6.8(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH7(平衡和洗涤缓冲液)·100mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH7.4(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH7.5(平衡和洗涤缓冲液)·200mMTris、150mMNaCl,pH7.5(2X装载缓冲液)和100mMTris、150mMNaCl,pH7.5(平衡和洗涤缓冲液)在图14A中,图例仅通过平衡和洗涤缓冲液鉴定样品。相对荧光单位(FU)针对时间进行标绘。25s峰代表内部标准。最突出的峰代表小RNA。在~41s和~47s处的峰分别代表18S和28S。图14B描述了使用定量RT-PCR由相同样品分析的mRNA和成熟miRNA水平。循环阈值(Ct)呈现为平均值±SD。图15是描述在荷电滤器上的微囊泡捕获和微囊泡稳定性如何受缓冲液的浓度影响的一系列图表。图15A是比较通过超速离心和带正电的Q再生纤维素离心过滤,从3.8mL正常对照血浆中提取的微囊泡总RNA的质量、浓度和大小分布的生物分析仪曲线。过滤样品用下述缓冲液设置进行分离:·100mM双[三(羟甲基)甲基氨基]丙烷、0.15mMNaCl,pH6(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、0.15mMNaCl,pH6.5(平衡和洗涤缓冲液)·500mM双[三(羟甲基)甲基氨基]丙烷、900mMNaCl,pH6.4(2X装载缓冲液)和250mM双[三(羟甲基)甲基氨基]丙烷、450mMNaCl,pH6.5(平衡和洗涤缓冲液)在图15A中,图例仅通过平衡和洗涤缓冲液鉴定样品。相对荧光单位(FU)针对时间进行标绘。25s峰代表内部标准。最突出的峰代表小RNA。在~41s和~47s处的峰分别代表18S和28S。图15B描述了使用定量RT-PCR由相同样品分析的mRNA和成熟miRNA水平。循环阈值(Ct)呈现为平均值±SD。图16是描述微囊泡是如何稳定,并且总体RNA得率如何不受低至高盐浓度影响的一系列图表。图16A是比较通过离心从1.9mL正常对照血浆中提取的微囊泡总RNA的质量、浓度和大小分布的生物分析仪曲线。将微囊泡团块重悬浮于具有下述NaCl浓度的50mM双[三(羟甲基)甲基氨基]丙烷,pH6.5缓冲液中,并且在裂解前温育20分钟:0.15MNaCl、0.3MNaCl、0.6MNaCl、1.2MNaCl和2.4MNaCl。相对荧光单位(FU)针对大小(nt)进行标绘。25nt峰代表内部标准。最突出的峰代表小RNA。在~1900nt和~3900nt处的峰分别代表18S和28S。图16B描述了使用定量RT-PCR对相同样品分析的mRNA和成熟miRNA水平。循环阈值(Ct)呈现为平均值±SD。图17是描述在荷电滤器上的微囊泡捕获和微囊泡稳定性如何不受装载缓冲液的盐浓度影响的一系列图表。图17A是比较通过超速离心和带正电的Q再生纤维素离心过滤(滤器和滤液),从3.8mL正常对照血浆中提取的微囊泡总RNA的质量、浓度和大小分布的生物分析仪曲线。过滤样品用下述缓冲液设置进行分离:·100mM双[三(羟甲基)甲基氨基]丙烷、0.15MNaCl,pH6.0(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、0.15MNaCl,pH6.5(平衡缓冲液)·100mM双[三(羟甲基)甲基氨基]丙烷、1.05MNaCl,pH6.0(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、0.6MNaCl,pH6.5(平衡缓冲液)·100mM双[三(羟甲基)甲基氨基]丙烷、2.25MNaCl,pH6.0(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、1.2MNaCl,pH6.5(平衡缓冲液)·100mM双[三(羟甲基)甲基氨基]丙烷、4.65MNaCl,pH6.0(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、2.4MNaCl,pH6.5(平衡缓冲液)过滤样品在洗脱前不洗涤。在图17A中,图例仅通过平衡缓冲液鉴定样品。相对荧光单位(FU)针对时间进行标绘。25s峰代表内部标准。最突出的峰代表小RNA。图17B描述了使用定量RT-PCR由相同样品分析的mRNA和成熟miRNA水平。循环阈值(Ct)呈现为平均值±SD。图18是描述在荷电滤器上的微囊泡捕获和微囊泡稳定性如何不受装载或洗涤缓冲液的盐浓度影响的一系列图表。图18A是比较通过超速离心和带正电的Q再生纤维素离心过滤,从3.8mL正常对照血浆中提取的微囊泡总RNA的质量、浓度和大小分布的生物分析仪曲线。过滤样品用下述缓冲液设置进行分离:·100mM双[三(羟甲基)甲基氨基]丙烷、0.15mMNaCl,pH6(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、0.15mMNaCl,pH6.5(平衡和洗涤缓冲液)·100mM双[三(羟甲基)甲基氨基]丙烷、1.05MNaCl,pH6(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、0.6MNaCl,pH6.5(平衡和洗涤缓冲液)·100mM双[三(羟甲基)甲基氨基]丙烷、2.25MNaCl,pH6(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、1.2MNaCl,pH6.5(平衡和洗涤缓冲液)·100mM双[三(羟甲基)甲基氨基]丙烷、4.65MNaCl,pH6(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、2.4MNaCl,pH6.5(平衡和洗涤缓冲液)。在图18A中,图例仅通过平衡和洗涤缓冲液中的NaCl浓度鉴定样品。相对荧光单位(FU)针对时间进行标绘。25s峰代表内部标准。最突出的峰代表小RNA。在~42s和~50s处的峰分别代表18S和28S。图18B描述了使用定量RT-PCR由相同样品分析的mRNA和成熟miRNA水平。循环阈值(Ct)呈现为平均值±SD。图19是描述RNA裂解缓冲液如何影响来自用荷电滤器分离的微囊泡的RNA得率的图表。使用定量RT-PCR由4mL血浆分析mRNA和成熟miRNA水平,所述血浆通过超速离心和带正电的QPES真空过滤提取。过滤样品用Qiazol或Promega裂解缓冲液分离。相对量值呈现为平均值±SD。图20是描述当在荷电滤器上分离微囊泡时,第二体积的Qiazol如何不显著改善RNA得率的一系列图表。图20A是比较通过超速离心和带正电的QPES真空过滤,从2mL正常对照血浆中提取的微囊泡总RNA的质量、浓度和大小分布的生物分析仪曲线。用两体积的Qiazol裂解缓冲液分离滤器样品。相对荧光单位(FU)针对时间进行标绘。25s峰代表内部标准。最突出的峰代表小RNA。在~41s和~47s处的峰分别代表18S和28S。对于第二Qiazol洗脱样品存在技术困难。内部标准改在~18s处,并且小RNA峰在25s处。图20B描述了使用定量RT-PCR由相同样品分析的mRNA和成熟miRNA水平。循环阈值(Ct)呈现为平均值±SD。图21是描述当在荷电滤器上分离微囊泡时,第二体积的Qiazol如何不显著改善RNA得率的一系列图表。图21A是比较通过超速离心和带正电的Q再生纤维素离心过滤,从4mL正常对照血浆中提取的微囊泡总RNA的质量、浓度和大小分布的生物分析仪曲线。用两体积的Qiazol裂解缓冲液分离过滤样品。相对荧光单位(FU)针对大小(nt)进行标绘。25nt峰代表内部标准。最突出的峰代表小RNA。在~1900nt和~3900nt处的峰分别代表18S和28S。图21B描述了使用定量RT-PCR由相同样品分析的mRNA和成熟miRNA水平。循环阈值(Ct)呈现为平均值±SD。图22是描述使用20nmPES中性注射器式滤器,可以如何分离微囊泡RNA的一系列图表。图22A是比较通过超速离心和20nm中性PES注射器过滤,从4mL正常对照血浆中提取的微囊泡总RNA的质量、浓度和大小分布的生物分析仪曲线。相对荧光单位(FU)针对大小(nt)进行标绘。25nt峰代表内部标准。最突出的峰代表小RNA。在~1900nt和~3900nt处的峰分别代表18S和28S。图22B描述了使用定量RT-PCR由相同样品分析的mRNA水平。循环阈值(Ct)呈现为平均值±SD。图23是描述使用20nmPES中性注射器式滤器,可以如何分离微囊泡RNA的一系列图表。图23A是比较通过超速离心和20nm中性PES注射器过滤,从4mL正常对照血浆中提取的微囊泡总RNA的质量、浓度和大小分布的生物分析仪曲线。相对荧光单位(FU)针对时间进行标绘。25s峰代表内部标准。最突出的峰代表小RNA。在~41s和~47s处的峰分别代表18S和28S。图23B描述了使用定量RT-PCR由相同样品分析的mRNA水平。循环阈值(Ct)呈现为平均值±SD。图24是描述使用20nmPES中性注射器式滤器(Tisch),可以如何分离微囊泡miRNA的一系列图表。图24A是比较通过超速离心和20nm中性PES注射器过滤,从2mL正常对照血浆中提取的微囊泡总RNA的质量、浓度和大小分布的生物分析仪曲线。相对荧光单位(FU)针对大小(nt)进行标绘。25nt峰代表内部标准。最突出的峰代表小RNA。在~1900nt和~3900nt处的峰分别代表18S和28S。图24B描述了使用定量RT-PCR由相同样品分析的成熟miRNA水平。循环阈值(Ct)呈现为平均值±SD。图25是描述微囊泡捕获如何是RNA依赖性的一系列图表。一些RNA与其他相比较在滤器上更有效捕获(GAPDH相对于miR-451)。这可以取决于RNA是否受蛋白质和/或微囊泡保护且取决于微囊泡大小。图25A是比较通过中性PES注射器过滤(滤器和滤液),从2mL正常对照血浆中提取的微囊泡总RNA的质量、浓度和大小分布的生物分析仪曲线。相对荧光单位(FU)针对大小(nt)进行标绘。25nt峰代表内部标准。最突出的峰代表小RNA。在~1900nt和~3900nt处的峰分别代表18S和28S。图25B描述了使用定量RT-PCR由相同样品分析的mRNA和成熟miRNA水平。循环阈值(Ct)呈现为平均值±SD。图26是描述使用30nm和50nmPES中性注射器式滤器,可以如何分离微囊泡RNA的一系列图表。图26A是比较通过超速离心和30nm(5um或0.05um玻璃纤维(GF)预滤器)和50nm(5umGF预滤器)中性PES注射器过滤(滤器和滤液),从2mL正常对照血浆中提取的微囊泡总RNA的质量、浓度和大小分布的生物分析仪曲线。相对荧光单位(FU)针对时间进行标绘。25s峰代表内部标准。最突出的峰代表小RNA。在~41s和~47s处的峰分别代表18S和28S。图26B描述了使用定量RT-PCR由相同样品分析的mRNA和成熟miRNA水平。循环阈值(Ct)呈现为平均值±SD。图27是描述使用以旋转柱形式的0.2umPES中性滤器(Pall),可以如何分离微囊泡RNA的一系列图表。图27A是比较通过超速离心和中性0.2umPES离心过滤(滤器和滤液),从4mL正常对照血浆中提取的微囊泡总RNA的质量、浓度和大小分布的生物分析仪曲线。相对荧光单位(FU)针对大小(nt)进行标绘。25nt峰代表内部标准。最突出的峰代表小RNA。在~1900nt和~4200nt处的峰分别代表18S和28S。图27B描述了使用定量RT-PCR由相同样品分析的mRNA和成熟miRNA水平。循环阈值(Ct)呈现为平均值±SD。图28是描述使用0.8umPES中性注射器式滤器,可以如何分离微囊泡RNA的一系列图表。图28A是比较通过超速离心和中性0.8umPES注射器过滤(滤器和滤液),从4mL正常对照血浆中提取的微囊泡总RNA的质量、浓度和大小分布的生物分析仪曲线。相对荧光单位(FU)针对时间进行标绘。25s峰代表内部标准。最突出的峰代表小RNA。在~41s和~47s处的峰分别代表18S和28S。图28B描述了使用定量RT-PCR由相同样品分析的mRNA和成熟miRNA水平。循环阈值(Ct)呈现为平均值±SD。图29是描述使用以旋转柱形式的0.8umPES中性滤器(Pall),可以如何分离微囊泡RNA的一系列图表。图29A是比较通过超速离心和中性0.8umPES离心过滤(滤器和滤液),从4mL正常对照血浆中提取的微囊泡总RNA的质量、浓度和大小分布的生物分析仪曲线。0.8um滤液样品仅从总样品体积的一半中分离。相对荧光单位(FU)针对大小(nt)进行标绘。25nt峰代表内部标准。最突出的峰代表小RNA。在~1900nt和~4200nt处的峰分别代表18S和28S。图29B描述了使用定量RT-PCR由相同样品分析的mRNA和成熟miRNA水平。循环阈值(Ct)呈现为平均值±SD。“0.8um滤器”和“超速离心”样品Ct值已进行调整,以补偿仅部分分离。图30是描述当在中性PES滤器上分离微囊泡时,微囊泡RNA得率如何受裂解缓冲液类型影响的图表。图30是比较通过中性PES注射器过滤,从6mL正常对照血浆中提取的微囊泡总RNA的质量、浓度和大小分布的生物分析仪曲线。过滤样品用Qiazol(Qiagen)、RLT(Qiagen)或miCURY(Exiqon)进行裂解。相对荧光单位(FU)针对时间进行标绘。25s峰代表内部标准。最突出的峰代表小RNA。在~41s和~47s处的峰分别代表18S和28S。图31是描述在20nmPES中性注射器式滤器上的微囊泡RNA分离中,用Qiazol的额外洗脱如何不显著改善RNA得率的一系列图表。图31A是比较通过中性PES注射器过滤,从6mL正常对照血浆中提取的微囊泡总RNA的质量、浓度和大小分布的生物分析仪曲线。用两体积的Qiazol裂解过滤样品。相对荧光单位(FU)针对大小(nt)进行标绘。25nt峰代表内部标准。最突出的峰代表小RNA。在~1900nt和~4200nt处的峰分别代表18S和28S。图31B描述了使用定量RT-PCR由相同样品分析的mRNA水平。循环阈值(Ct)呈现为平均值±SD。图32是描述当在中性滤器上分离微囊泡时,微囊泡稳定性和/或微囊泡RNA得率如何受洗涤步骤影响的一系列图表。图32A是比较通过中性PES注射器过滤,从6mL正常对照血浆中提取的微囊泡总RNA的质量、浓度和大小分布的生物分析仪曲线。过滤样品用0mL、20mL或50mL10mM磷酸钠、2mM磷酸钾、2.7mMKCl、137mMNaCl,pH7.4缓冲液进行洗涤。相对荧光单位(FU)针对大小(nt)进行标绘。25nt峰代表内部标准。最突出的峰代表小RNA。在~1900nt和~4200nt处的峰分别代表18S和28S。图32B描述了使用定量RT-PCR由相同样品分析的mRNA和成熟miRNA水平。循环阈值(Ct)呈现为平均值±SD。图33是描述RNA如何粘在以注射器形式的20nmPES滤器上,且不能容易洗脱出的一系列图表。较大的RNA(例如GAPDH)比较小的RNA(let-7a)更难以洗脱出。图33A是比较10ng对照总RNA的质量、浓度和大小分布的生物分析仪曲线,所述对照总RNA通过重悬浮于Qiazol中和后续RNA分离,或通过20nm中性PES注射器过滤随后在Qiazol中洗脱和后续RNA分离进行分离。相对荧光单位(FU)针对大小(nt)进行标绘。25nt峰代表内部标准。最突出的峰代表小RNA。在~1900nt和~3900nt处的峰分别代表18S和28S。图33B描述了使用定量RT-PCR由相同样品分析的mRNA和成熟miRNA水平。循环阈值(Ct)呈现为平均值±SD。图34是关于使用珠的微囊泡分离和RNA提取的一般流程图的图示。图35是描述使用不同类型的磁珠的微囊泡分离的图表。图36是描述使用不同类型的磁珠的微囊泡回收的图表。图37是关于使用磁珠的微囊泡分离和RNA提取的流程图的图示。图38是描述用RT-qPCR(阈值=0.1)对所选mRNA靶测试的,使用TEA处理对比咪唑处理的环氧珠的微囊泡分离的图表。图39是描述从微囊泡中回收的所选mRNA靶的图表,所述微囊泡用TEA处理对比咪唑处理的环氧珠分离。图40是描述用RT-qPCR(阈值=0.1)对所选微小RNA靶测试的,使用TEA处理对比咪唑处理的环氧珠的微囊泡分离的图表。图41是描述从微囊泡中回收的所选微小RNA靶的图表,所述微囊泡用TEA处理对比咪唑处理的环氧珠分离。图42是描述用RT-qPCR,阈值=0.1,X:阳离子,R:阴离子对所选mRNA靶测试的,用非磁珠的微囊泡分离的图表。图43是描述从微囊泡中回收的所选mRNA靶的图表,所述微囊泡用非磁性阳离子/阴离子交换树脂分离。图44是描述用RT-qPCR,阈值=0.1,X:阳离子,R:阴离子对微小RNA靶测试的,用非磁珠的微囊泡分离的图表。图45是描述关于微小mRNA阳离子/阴离子交换树脂的回收分析的图表。图46是描述用RT-qPCR,阈值=0.1)对所选mRNA测试的,使用对照珠的微囊泡分离的图表。图47是描述从用对照珠分离的微囊泡中回收的所选mRNA靶的图表。图48是描述用RT-qPCR,阈值=0.1对微小RNA测试的,使用对照珠的微囊泡分离的图表。图49是描述从用对照珠分离的微囊泡中回收的微小RNA靶的图表。图50是描述对微囊泡分离和RNA提取的珠滴定的图示。图51A-51G是描述对于RN7SL(图51A)、GAPDH(图51B)、RNaseP(图51C)、B2M(图51D)、GUSB(图51E)、HPRT1(图51F)和Let-7a(图51G),使用RT-qPCR的微囊泡捕获评估的一系列图表。图52是描述在个别和混合珠(对于所有靶,以2:1的珠/微囊泡(B/E)比)之间的Ct比较的图表。图53是描述在个别相对于以B/E比2:1的混合珠之间的回收比较的图表。图54是描述使用磁珠(MB)的微囊泡分离和RNA提取的图示。图55A-55G是描述对于RN7SL(图55A)、GAPDH(图55B)、RNaseP(图55C)、B2M(图55D)、GUSB(图55E)、HPRT1(图55F)和Let-7a(图55G),使用血浆滴定以固定的珠与微囊泡比(B/E)的微囊泡回收评估的一系列图表。图56是描述从0.4mL、1mL到4mL的血浆滴定,关于以B/E比5:1的多种靶的回收比较的图表。图57是描述在微囊泡分离时的MB结合的时间过程研究的图表。图58是描述关于环氧珠-微囊泡结合的时间过程研究的图表(1分钟、5分钟、15分钟、30分钟和60分钟)。图59是描述珠-微囊泡结合的时间过程研究的图表(B/E=5:1,0.4mL血浆)。图60是描述珠-微囊泡结合的时间过程研究的图表(B/E=5:1,0.4mL血浆)。图61是描述关于微囊泡-环氧MB结合的灵敏检查研究的图表。图62是描述在收集的级分中(仅环氧珠)所选RNA靶的平均Ct的图表。图63是描述所选RNA靶(仅环氧珠)的回收%的图表。图64是显示EXO50柱的一系列示意图。在左侧上的小图显示滤器支架的外部。中图显示横截面,其显示内管在滤器支架内的放置。右上图显示保持在滤器支架底部处、在内管(膜上方)和外熔块(柱底部)之间的合适位置的膜滤器。右下图显示允许流体流通的外熔块的配置。图65是显示具有收集管的EXO50柱的完全装配的一系列照片。在左侧和中间照片中所示的收集管是50mL锥形管。右侧照片显示EXO50滤器支架的顶视图。图66是描述在使用相同缓冲条件时,不同官能化膜的图表。y轴显示从微囊泡中提取的选择mRNA靶的Ct值,所述微囊泡使用x轴中列出的不同官能化膜分离。官能化膜是:Q、S、D、IDA、醛和DE81。图67是描述EXO50柱的结合容量的图表。将体积渐增(0.5ml、1.0ml、2.0ml、4.0ml、8.0ml和16ml)的血浆加入EXO50柱。提取的RNA就选择mRNA靶的Ct值进行评价。图表证实体积0.5ml-4.0ml导致表达信号中的线性增加。图68是描述EXO50柱的结合容量的图表,如通过相对于生物样品(血浆)的体积渐增的拷贝数检测证实的。图69是描述具有3层膜的柱的装载容量的图表。关于每个体积的第一组条值代表由血浆样品检测的表达,而关于每个体积的第二组条值代表在第一个微囊泡级分捕获后,由流通物检测的表达。使用2△CT计算与正常样品装载步骤有关的来自流通物的拷贝数百分比。图70是证实通过来自在膜上捕获的微囊泡的特异性mRNA靶的RNA检测测量的,捕获来自4ml血浆的所有微囊泡所需的膜层数的图表。图71是显示在装载的EXO50柱的膜之上和之中捕获的外来体的扫描电子显微镜检查照片。图72是显示关于生物样品的大范围类型的装载缓冲液与EXO50操作相容的图表。y轴代表关于测试的mRNA靶的Ct值。显示了重复实验。图73是显示EXO50操作耐受低pH缓冲条件的图表。y轴代表关于测试的mRNA靶的Ct值。显示了重复实验。图74是显示EXO50操作还耐受缓冲系统中不同浓度的去污剂例如SDS、Tween20和TritonX-100的图表。y轴代表关于测试的mRNA靶的Ct值。图75是显示一系列生物分析仪曲线图的图表,证实由EXO50分离的总RNA可以通过在提取期间使用在二氧化硅柱结合缓冲液中的不同乙醇浓度分离成大和小级分。图76是显示通过EXO50纯化的RNA是PCR可扩增的RNA(即适合于扩增和PCR加工)的图表。测试的mRNA靶的表达通过基于扩增的qPCR进行检测。图77是显示乙醇滴定可以进行优化以分离mRNA和miRNA的图表。图78是显示EXO50纯化来自商购可得的癌症外来体(以3000、1500和150ng干重)的100%mRNA的图表。提取的总RNA(直接裂解)与EXO50分离(EXO50)和来自流通物的提取(EXO50流通物)相比较。图79是显示不含任何另外的过程步骤的EXO50操作分离极少DNA的图表。与turboDNA酶或RNA酶的温育与EXO50相比较。阴性对照由RT-(无逆转录酶)表示。显示了重复分离。图80是证实EXO50对于许多样品的平行加工是稳健的图表。执行8个EXO50重复,其中对于分离中的每个单个步骤添加3分钟吸取延迟。关于分离重复之间的个别测定的标准差为<0.5Ct。图81是显示关于两个输入体积(0.2ml和2ml)的EXO50分析的一系列图表,所述EXO50分析在不同洲的不同实验室用不同操作者和PCR化学试剂执行。(A)MUC;(B)MSP;(C)CMH;(D)MEM;(E)IND;(F)LAX;(G)SAN;(H)AUS。实验一式三份执行。图82是显示EXO50分析在不同实验室通过首次使用者用相同的血浆和PCR化学试剂执行的一系列图表。图83是证实EXO50可以修改为小型旋转柱形式的图表。关于靶mRNA的Ct值在EXO50小型旋转柱和超速离心之间相比较。图84是证实对于两个不同的输入样品体积,与超速离心相比较,在微型再生纤维素柱中的不同官能化膜的图表。图85是显示微囊泡超速离心(左)和EXO50(右)分离方法的两个扫描电子显微镜检查照片。图86是两个生物分析仪曲线图,显示通过EXO50和超速离心从血浆中提取的RNA的概况具有相似的RNA大小分布。(A)癌症患者#1;(B)癌症患者#2。图87是显示通过自装配柱、EXO50和超速离心,来自血浆的RNA提取之间的比较的一个图表。执行重复实验。图88是显示通过超速离心、直接裂解和EXO50,来自200ul血浆的RNA提取之间的比较的一个图表。还分析了来自EXO50流通物的RNA提取。图89是显示通过EXO50试剂盒和miRNeasy来自200ul血浆以及通过EXO50试剂盒和超速离心来自4ml血浆的RNA提取之间的比较的一个图表。图90是显示与超速离心相比较,EXO50分离来自黑素瘤BRAFV600E的含有突变的RNA的一个图表。图91是显示在从EXO50柱洗脱后的RNA分离获得与EXO50过程一样多的RNA的一个图表。图92是证实使用两个分开的方案用于分离微囊泡级分、释放微囊泡核酸且提取RNA和DNA的EXO52方案的示意图。图93是证实使用单一方案用于分离微囊泡级分、释放微囊泡核酸且提取RNA和DNA的EXO52.2方案的示意图。图94是显示在单一提取中对于分离微囊泡RNA和DNA,在相分离中的氯仿浓度的效应的图表,如通过野生型BRAFRNA和DNA检测证实的。图95是显示在单一提取中对于分离微囊泡RNA和DNA,在相分离中的氯仿浓度的效应的图表,如通过GAPDHRNA和DNA检测证实的。图96是显示相分离中的pH调整影响DNA提取和检测的图表。图97是显示脑脊髓液(CSF)的样品体积的滴定对微囊泡RNA提取和检测的作用的图表。图98是显示来自超速离心和EXO60分离方法的微囊泡RNA靶的检测比较的图表。图99是显示对于不同患者CSF样品,来自超速离心和EXO60分离方法的微囊泡RNA靶检测比较的图表。患者样品通过患者ID指定。利用不同的样品体积。(*)指示死后样品。图100是显示CSF样品体积(0.25ml、0.5ml、1.0ml和2.0ml)对不同微囊泡RNA分离和提取方法的作用的图表。UC(超速离心)、uCSC(尿过滤方法)和EXO60。图101是一系列生物分析仪曲线,其描述与尿循环干细胞(uCSC)方法相比较,使用EXO70方案从两个不同的尿样品提取的RNA概况。图102是显示与urineCSC方法相比较,在通过EXO70分离和提取后的RNA检测之间的关联的图表。图103是显示在通过EXO70或uCSC方法分离和提取后,不同RNA靶的检测的两个图表。从分离的微囊泡级分(EXO70或uCSC)和分离后的流通物或上清液级分(EXO70流动或uCSC流动)提取且分析RNA。(A)mRNA靶;(B)miRNA靶。图104是描述关于跨越4个样品类型的4种mRNA的CT(y轴)的图表。所有点均为关于2个微囊泡分离各自的一式两份实验的平均值。“SJCRH”是来自儿科患者的血浆,“DAOY”是成髓细胞瘤细胞系,并且“DAOYMED”是来自这些细胞的培养基的微囊泡。商购可得的血浆未获得结果。图105是描述EXO50分离来自100µL细胞培养上清液的所有mRNA的能力的图表。发明详述本发明提供了通过将微囊泡捕获至表面且随后裂解微囊泡以释放其中含有的核酸特别是RNA,用于分离微囊泡的方法。微囊泡由真核细胞脱落或质膜出芽脱离(buddedoff)至细胞的外部。这些膜囊泡在大小中是异质的,具有直径范围为约10nm-约5000nm的大小。直径<0.8µm由细胞脱落的所有膜囊泡在本文中统称为“微囊泡”。这些微囊泡包括微囊泡、微囊泡样颗粒、前列腺小体、树状细胞胞外体(dexosome)、肿瘤细胞胞外体(texosome)、外粒体、致癌组(oncosome)、细胞凋亡小体、逆转录病毒样颗粒、和人内源性逆转录病毒(HERV)颗粒。由细胞内多泡体的胞吐作用释放的小微囊泡(直径大约10-1000nm,且更通常为30-200nm)在本领域中被称为“微囊泡”。分离微囊泡的目前方法包括超速离心、例如使用100kD滤器的超滤、聚合物沉淀技术和/或基于大小的过滤。然而,存在可替代方法的需要,所述方法对于分离微囊泡且任选提取其中含有的核酸(优选微囊泡RNA)用于多种应用包括诊断用途是有效和高效的。在一些实施方案中,本发明提供了通过将微囊泡捕获至表面且随后裂解微囊泡以释放其中含有的核酸特别是RNA,用于分离微囊泡的方法。在一些实施方案中,本发明提供了通过将微囊泡捕获至表面且随后从捕获表面洗脱完整微囊泡,用于分离微囊泡的方法。微囊泡是由所有细胞分泌且存在于所有人生物流体中的高质量核酸的丰富来源。微囊泡中的RNA提供了原发性肿瘤、转移灶和周围微环境的转录组的实时快照。因此,通过测定精确评价微囊泡的RNA概况提供了疾病的伴侣诊断和实时监控。这种开发已由于目前分离外来体的标准而停滞,所述标准是缓慢、繁琐、可变的且不适合于诊断环境。被称为EXO50血浆外来体RNA提取方法和/或试剂盒的本文提供的分离和提取方法和/或试剂盒使用基于旋转柱的纯化过程,使用结合微囊泡的亲和膜。公开内容的方法和试剂盒允许平行运行大量临床样品的能力,使用在单一柱上的0.2直到4mL的体积。分离的RNA是高度纯的,由囊泡膜保护直至裂解时,并且完整囊泡可以从EXO50膜中洗脱。EXO50操作能够耗尽来自血浆输入的所有mRNA,并且当与超速离心或直接裂解相比较时,在mRNA/miRNA得率中相等或更佳。相比之下,EXO50方法和/或试剂盒富集微囊泡结合的miRNA级分,并且它们可容易扩展至大量输入材料。这种放大能力允许对有意思的低丰度转录物的研究。与上市的其他商购可得的产品相比较,公开内容的方法和试剂盒提供了通过本文提供的例子证实的独特能力。EXO50方法和试剂盒使用下述一般操作,从生物样品中分离且提取核酸例如RNA。首先,使微囊泡级分与膜滤器结合,并且洗涤滤器。随后,试剂用于执行核酸例如RNA的膜上裂解和释放。随后使用PLG管执行氯仿提取,随后为乙醇条件化。核酸例如RNA随后与二氧化硅柱结合,洗涤且随后洗脱。使用捕获表面方法从生物样品中分离微囊泡RNA的一般流程的图示显示于下文:使用膜方法从血浆样品中分离微囊泡RNA的一般流程的图示显示于下文:使用珠方法从血浆样品中分离微囊泡RNA的一般流程的图示显示于下文:使用捕获表面方法从尿样品中分离微囊泡RNA的一般流程的图示显示于下文:如通过本文提供的工作实施例证实的,捕获表面例如珠或滤器(在本文中也称为膜)的形式不影响本文提供的方法有效捕获来自生物样品的微囊泡的能力。此外,捕获表面的表面电荷不影响本文提供的方法有效捕获微囊泡的能力。另外,工作实施例证实结合和洗涤缓冲液的离子强度在本文提供的方法中具有有限的重要性。广泛范围的表面能够根据本文提供的方法捕获微囊泡,但并非所有表面均捕获微囊泡(一些表面不捕获任何事物)。本公开内容还描述了使用一次性使用的塑料零件和离心设备,用于从生物或临床样品中分离且浓缩微囊泡的装置。另外,该装置包括包含捕获表面(即,膜滤器)的柱,将捕获表面固定在外熔块和内管之间的支架以及收集管。外熔块包含大型网状结构,以允许液体的经过,并且优选在柱的一个端部处。内管使捕获表面保持在合适位置处,且优选是稍微圆锥状的。收集管可以是商购可得的,即50mlFalcon管。柱优选适合于旋转,即大小与标准离心和微量离心机相容。在其中捕获表面是膜的实施方案中,用于从生物样品中分离微囊泡级分的装置含有至少一个膜。在一些实施方案中,装置含有一、二、三、四、五或六个膜。优选地,该装置包含三个膜。在其中装置包含超过一个膜的实施方案中,膜全部在柱的一个端部处彼此直接邻近。在其中装置包含超过一个膜的实施方案中,膜全部彼此相同,即具有相同电荷和/或具有相同官能团。如由本文提供的工作实施例1-32证实的,一种或多种缓冲液组分的选择、缓冲液的pH和裂解缓冲液的选择影响本文提供的方法有效捕获微囊泡且释放其中含有的核酸特别是RNA的能力。在一些实施方案中,裂解缓冲液是基于苯酚的裂解缓冲液。例如,裂解缓冲液是QIAzol®裂解试剂(Qiagen)。本文提供的工作实施例1-32还证实通过小于微囊泡的孔径过滤的捕获不是由本文提供的方法的主要捕获机制。然而,滤器孔径仍是非常重要的,例如因为mRNA粘在20nm滤器上,并且不能回收,而微小RNA可以容易洗脱出,并且例如因为滤器孔径是可用捕获表面积中的重要参数。本文提供的工作实施例1-32还证实使用珠(磁性或非磁性)的微囊泡分离的可行性,所述珠将是临床效用中的更合适形式。结果显示带正电、带负电和中性的珠均显示良好的微囊泡捕获效率。该观察提示它们可以作用于在微囊泡表面上的不同配体,因此一个微囊泡可以经由不同(多重)力用不同(官能化)颗粒捕获。本文提供的方法使用多种捕获表面中的任一种。在一些实施方案中,捕获表面是膜,在本文中也称为滤器或膜滤器。在一些实施方案中,捕获表面是商购可得的膜。在一些实施方案中,捕获表面是荷电的商购可得的膜。在一些实施方案中,捕获表面是中性的。在一些实施方案中,捕获表面选自来自PALLCorporation的Mustang®离子交换膜;来自SartoriusAG的Vivapure®Q膜;SartobindQ或Vivapure®QMaxiH;来自SartoriusAG的Sartobind®D,来自SartoriusAG的Sartobind(S),来自SartoriusAG的Sartobind®Q,来自SartoriusAG的Sartobind®IDA,来自SartoriusAG的Sartobind®Aldehyde,来自Sigma的Whatman®DE81,来自EMDMillipore的FastTrap病毒纯化柱;ThermoScientific*Pierce强阳离子和阴离子交换旋转柱。在其中捕获表面是荷电的实施方案中,捕获表面可以是选自下述的荷电滤器:0.65um带正电的QPES真空过滤、3-5um带正电的QRC旋转柱过滤、0.8um带正电的QPES自制旋转柱过滤、0.8um带正电的QPES注射器过滤、0.8um带负电的SPES自制旋转柱过滤、0.8um带负电的SPES注射器过滤、和50nm带负电的尼龙注射器过滤。优选地,荷电滤器不容纳在注射器过滤仪器中,因为Qiazol/RNA在这些实施方案中更难以离开滤器。优选地,荷电容器容纳在柱的一个端部处。在其中捕获表面是膜的实施方案中,膜可以由多种合适的材料制成。在一些实施方案中,膜是聚乙烯砜(PES)(例如来自Millipore或PALLCorp.)。在一些实施方案中,膜是再生纤维素(RC)(例如来自Sartorius或Pierce)。在一些实施方案中,捕获表面是带正电的膜。在一些实施方案中,捕获表面是Q膜,其是带正电的膜并且是具有季胺的阴离子交换剂。例如,Q膜由季铵,R-CH2-N+(CH3)3官能化。在一些实施方案中,捕获表面是带负电的膜。在一些实施方案中,捕获表面是S膜,其是带负电的膜并且是具有磺酸基团的阳离子交换剂。例如,S膜由磺酸,R-CH2-SO3-官能化。在一些实施方案中,捕获表面是D膜,其是具有二乙胺基团,R-CH2-NH+(C2H5)2的弱碱性阴离子交换剂。在一些实施方案中,捕获表面是金属螯合物膜。例如,膜是由亚氨基二乙酸(minodiaceticacid)–N(CH2COOH-)2官能化的IDA膜。在一些实施方案中,捕获表面是由醛基,-CHO官能化的微孔膜。在其他实施方案中,膜是弱碱性阴离子交换剂,具有二乙氨基乙基(DEAE)纤维素。并非所有荷电膜均适用于本文提供的方法,例如使用再生纤维素、强碱性阳离子交换剂(“RC/SACE”)膜旋转柱分离的RNA显示RT-qPCR抑制,并且因此不适合于PCR相关下游测定。在其中捕获表面是荷电的实施方案中,微囊泡可以用带正电的滤器分离。在其中捕获表面是荷电的实施方案中,捕获表面优选不是带负电的再生纤维素S滤器,因为该实施方案引起PCR抑制。相比之下,带负电的PES滤器不显示出这种现象。在其中捕获表面是荷电的实施方案中,在微囊泡捕获期间的pH是pH≤7。在一些实施方案中,pH大于4且小于或等于8。在其中捕获表面是带正电的Q滤器的实施方案中,缓冲系统包括包含250mM双[三(羟甲基)甲基氨基]丙烷,pH6.5-7.0的洗涤缓冲液。在其中捕获表面是带正电的Q滤器的实施方案中,裂解缓冲液是Qiazol。在其中捕获表面是带正电的Q滤器的实施方案中,裂解缓冲液以一体积存在。在其中捕获表面是带正电的Q滤器的实施方案中,裂解缓冲液以超过一体积存在。在其中捕获表面是中性的实施方案中,捕获表面是选自下述的滤器:20nm中性PES注射器过滤(Tisch和Exomir)、30nm中性PES注射器过滤(Sterlitech)、50nm中性PES注射器过滤(Sterlitech)、0.2um中性PES自制旋转柱过滤(Pall)、0.8um中性PES自制旋转柱过滤(Pall)、和0.8um中性PES注射器过滤(Pall)。在其中捕获表面是中性的实施方案中,优选地,中性捕获表面不容纳在注射器式滤器中。在其中捕获表面是中性的实施方案中,裂解缓冲液是Qiazol。在其中捕获表面是中性的实施方案中,裂解缓冲液以一体积存在。在其中捕获表面是中性的实施方案中,裂解缓冲液以超过一体积存在。在其中捕获表面是中性的实施方案中,该方法包括洗涤步骤。取决于膜材料,膜的孔径范围为3µm-20nm。例如,在其中捕获表面是商购可得的PES膜的实施方案中,膜具有20nm(Exomir)、0.65µm(Millipore)或0.8µm(Pall)的孔径。在其中捕获表面是商购可得的RC膜的实施方案中,膜具有在3-5µm(Sartorius,Pierce)范围内的孔径。捕获表面的表面电荷可以是正、负或中性的。在一些实施方案中,捕获表面是一种或多种带正电的珠。在一些实施方案中,捕获表面是一种或多种带负电的珠。在一些实施方案中,捕获表面是一种或多种中性珠。在一些实施方案中,捕获表面是中性滤器,例如不由荷电基团表面修饰的PES膜。在一些实施方案中,本文提供的方法包括多种缓冲液,包括装载和洗涤缓冲液。在一些实施方案中,装载和洗涤缓冲液可以具有高或低离子强度。在一些实施方案中,盐浓度例如NaCl浓度可以是0-2.4M。缓冲液可以包括多种组分。在一些实施方案中,缓冲液包括下述组分中的一种或多种:Tris、BisTris、双[三(羟甲基)甲基氨基]丙烷、咪唑、柠檬酸盐、甲基丙二酸、乙酸、乙醇胺、二乙醇胺、三乙醇胺(TEA)和磷酸钠。在本文提供的方法中,装载和洗涤缓冲液的pH是重要的。当血浆样品在装载前设为pH≤5.5时,滤器趋于堵塞(血浆将完全不离心通过柱),并且在更高pH下,由于微囊泡的不稳定性,微囊泡RNA回收更低。在中性pH下,来自微囊泡的RNA回收是最佳的。在一些实施方案中,使用的缓冲液以1X浓度、2X浓度、3X浓度或4X浓度。例如,装载或结合缓冲液以2X浓度,而洗涤缓冲液以1X浓度。在一些实施方案中,该方法包括例如在使生物样品与捕获表面接触后的一个或多个洗涤步骤。在一些实施方案中,去污剂加入洗涤缓冲液中,以促进去除非特异性结合(即,污染物、细胞碎片和循环蛋白质复合物或核酸),以获得更纯的微囊泡级分。适用的去污剂包括但不限于十二烷基硫酸钠(SDS)、Tween-20、Tween-80、TritonX-100、NonidetP-40(NP-40)、Brij-35、Brij-58、辛基葡糖苷、辛基硫代葡糖苷、CHAPS或CHAPSO。在一些实施方案中,捕获表面例如膜容纳在装置内;所述装置用于离心例如旋转柱,或用于真空系统例如真空滤器支架,或用于由压力过滤例如注射器式滤器。在优选实施方案中,捕获表面容纳在旋转柱或真空系统中。在提取核酸前从生物样品中分离微囊泡出于下述原因是有利的:1)从微囊泡中提取核酸提供了通过从流体样品内分离除了其他微囊泡外的疾病或肿瘤特异性微囊泡,选择性分析疾病或肿瘤特异性核酸的机会;2)与通过直接从流体样品中提取核酸而不首先分离微囊泡获得的得率/完整性相比较,含核酸的微囊泡提供了显著更高的核酸种类得率,伴随更高的完整性;3)可扩展性,例如为了检测以低水平表达的核酸,灵敏度可以通过使用本文描述的方法和/或试剂盒从更大体积的样品中浓缩微囊泡得到增加;4)更纯或更高质量/完整性的提取核酸,因为在生物样品内天然发现的蛋白质、脂质、细胞碎片、细胞及其他潜在污染物和PCR抑制剂在核酸提取步骤前被排除;和5)可以利用核酸提取方法中的更多选择,因为分离的微囊泡级分可以具有比起始样品体积更小的体积,使得能够使用小体积柱滤器从这些级分或团块中提取核酸。从生物样品中分离微囊泡的几种方法已在本领域中得到描述。例如,差异离心方法在通过Raposo等人的论文(Raposo等人,1996)、通过Skog等人的论文(Skog等人,2008)和通过Nilsson等人的论文(Nilsson等人,2009)中得到描述。离子交换和/或凝胶渗透层析方法在美国专利号6,899,863和6,812,023中得到描述。蔗糖密度梯度或细胞器电泳方法在美国专利号7,198,923中得到描述。磁激活细胞分选(MACS)方法在通过Taylor和GercelTaylor的论文(Taylor和Gercel-Taylor,2008)中得到描述。纳米膜超滤浓缩方法在通过Cheruvanky等人的论文(Cheruvanky等人,2007)中得到描述。Percoll梯度分离方法在通过Miranda等人的出版物(Miranda等人,2010)中得到描述。进一步地,微囊泡可以通过微流体装置从对象的体液中得到鉴定且分离(Chen等人,2010)。在研究和开发以及核酸生物标记的商业应用中,希望以一致、可靠和实用方式从生物样品中提取高质量核酸。本发明的目的因此是提供用于从生物样品例如体液中快速和容易分离含核酸颗粒,且从分离的颗粒中提取高质量核酸的方法。本发明的方法可以适合于适应且掺入紧凑装置或器械内用于实验室或临床背景中或者野外。在本文提供的工作实施例中,来自正常健康对照的人血浆得自具有由ExosomeDiagnosticInc开发的血液集合SOP的BioreclamationLLC。简言之,将血液收集到K2EDTA管内,并且使用完全倒置充分混合。随后,将管以1300xg离心10分钟,以分离血细胞和血浆。随后取出血浆且通过0.8µm滤器过滤,以去除细胞碎片和血小板。所有血浆样品随后等分到1ml冷冻小瓶内且贮存于-80℃下直至使用时。在RNA分离前,膜通过经过平衡缓冲液进行条件化。解冻的血浆样品用装载缓冲液稀释。稀释的血浆样品缓慢经过吸附微囊泡的膜。膜随后用洗涤缓冲液洗涤,以去除任何弱结合的血浆组分。随后,使裂解试剂经过膜,以裂解微囊泡。使用miRNeasy试剂盒(Qiagen)分离RNA。使用RNA6000PicoChip,用2100Bioanalyzer(Agilent)就质量和浓度评价RNA。使用来自AppliedBiosystems的所选人基因表达测定法(TaqmanAssay),通过RT-qPCR测量所提取RNA的相对数量。虽然本文提供的实例使用血浆样品,但技术人员应当理解这些方法可应用于多种生物样品。其他合适的生物样品包括尿、脑脊髓液、血液包括血液成分例如血浆和血清、痰、胸膜液、乳头抽吸物、淋巴液、呼吸道、肠道和泌尿生殖道流体、泪液、唾液、母乳、来自淋巴系统的流体、精液、器官系统内流体(intraorgansystemfluid)、腹水、肿瘤囊液、羊水、细胞培养上清液及其组合。公开内容的方法和试剂盒适合与衍生自人对象的样品一起使用。公开内容的方法和试剂盒适合与衍生自非人对象的样品一起使用,所述非人对象例如啮齿类动物、非人灵长类动物、伴侣动物(例如猫、犬、马)和/或农场动物(例如鸡)。在一些实施方案中,执行在微囊泡分离、纯化或富集前的预加工步骤,以去除大量不需要的颗粒、细胞和/或细胞碎片和生物样品中存在的其他污染物。预加工步骤可以通过一个或多个离心步骤(例如差异离心)或者一个或多个过滤步骤(例如超滤)或其组合来实现。当执行超过一个离心预加工步骤时,生物样品可以首先以低速且随后以高速离心。需要时,可以进行进一步的合适的离心预加工步骤。对于一个或多个离心预加工步骤可替代地或另外地,生物样品可以是过滤的。例如,生物样品可以首先以20,000g离心1小时,以去除大量不需要的颗粒;样品可以例如通过0.8µm滤器进行过滤。在一些实施方案中,在使生物样品与捕获表面接触之前或之后执行一个或多个离心步骤,以分离微囊泡且浓缩从生物级分中分离的微囊泡。例如,样品在4℃下以20,000g离心1小时。为了去除大量不需要的颗粒、细胞和/或细胞碎片,样品可以以约100-500g、优选约250-300g的低速离心。可替代地或另外地,样品可以以更高速度离心。合适的离心速度是最高达约200,000g;例如约2,000g至小于约200,000g。超过约15,000g和小于约200,000g或超过约15,000g和小于约100,000g或超过约15,000g和小于约50,000g的速度是优选的。约18,000g至约40,000g或约30,000g;和约18,000g至约25,000g的速度是更优选的。特别优选的是约20,000g的离心速度。一般地,用于离心的合适时间是约5分钟至约2小时,例如约10分钟至约1.5小时,或更优选约15分钟至约1小时。约0.5小时的时间可以是优选的。有时优选对生物样品实施以约20,000g约0.5小时的离心。然而,上述速度和时间可以适当地以任何组合使用(例如约18,000g至约25,000g、或约30,000g至约40,000g共约10分钟至约1.5小时、或约15分钟至约1小时、或约0.5小时等等)。一个或多个离心步骤可以在低于环境温度下,例如在0-10℃、优选约1-5℃,例如约3℃或约4℃下进行。在一些实施方案中,在使生物样品与捕获表面接触前或后执行一个或多个过滤步骤。可以采用具有在约0.1至约1.0µm范围内,优选约0.8µm或0.22µm的大小的滤器。过滤还可以由使用具有递降多孔性的滤器的序贯过滤来执行。在一些实施方案中,执行一个或多个离心步骤,以便降低在层析阶段期间、在使生物样品与捕获表面接触之前或之后待处理的样品体积。浓度可以通过以高速例如10,000-100,000g的样品离心,以引起微囊泡沉降。这可以由一系列差异离心组成。所获得的团块中的微囊泡可以用更小的体积和在合适缓冲液中重构,用于过程的后续步骤。浓缩步骤还可以通过超滤执行。事实上,该超滤浓缩生物样品且执行微囊泡级分的另外纯化。在另一个实施方案中,过滤是超滤,优选切向超滤。切向超滤由两个区室(滤液和渗余物)之间的溶液浓缩和分馏组成,所述两个区室由具有确定的截断阈值的膜分离。通过在渗余物区室中应用流动且在该区室和滤液区室之间应用跨膜压来进行分离。不同系统可以用于执行超滤,例如螺旋膜(Millipore,Amicon)、平坦膜或空心纤维(Amicon,Millipore,Sartorius,Pall,GF,Sepracor)。在本发明的范围内,具有低于1000kDa,优选100kDa-1000kDa,或甚至更优选100kDa-600kDa的截断阈值的膜的使用是有利的。在一些实施方案中,在使生物样品与捕获表面接触之前或之后,执行一个或多个尺寸排阻层析步骤或凝胶渗透层析步骤。为了执行凝胶渗透层析步骤,优选使用选自二氧化硅、丙烯酰胺、琼脂糖、右旋糖酐、乙二醇-甲基丙烯酸酯共聚物或其混合物例如琼脂糖-右旋糖酐混合物的载体。例如,此类载体包括但不限于:SUPERDEX®200HR(Pharmacia)、TSKG6000(TosoHaas)或SEPHACRYL®S(Pharmacia)。在一些实施方案中,在使生物样品与捕获表面接触之前或之后执行一个或多个亲和层析步骤。一些微囊泡还可以通过某些表面分子进行表征。因为微囊泡由细胞质膜出芽形成,所以这些微囊泡通常共有在它们来源的细胞上发现的相同表面分子中的许多。如本文使用的,“表面分子”共同指在微囊泡的表面上或者膜之中或之上发现的抗原、蛋白质、脂质、碳水化合物和标记。这些表面分子可以包括例如受体、肿瘤相关抗原、膜蛋白质修饰(例如糖基化结构)。例如,由肿瘤细胞出芽的微囊泡通常在其细胞表面上展示肿瘤相关抗原。像这样,亲和层析或亲和排阻层析还可以与本文提供的方法组合利用,以从特异性供体细胞类型中分离、鉴定和或富集微囊泡的特异性群体(Al-Nedawi等人,2008;Taylor和Gercel-Taylor,2008)。例如,肿瘤(恶性或非恶性)微囊泡携带肿瘤细胞表面抗原,并且可以经由这些特异性肿瘤相关表面抗原检测、分离和/或富集。在一个例子中,表面抗原是上皮细胞粘附分子(EpCAM),其对来自肺(long)、结肠直肠、乳腺、前列腺、头与颈和肝起源,而不是造血细胞起源的癌的微囊泡特异性(Balzar等人,1999;Went等人,2004)。另外,肿瘤特异性微囊泡还可以通过某些表面标记例如CD80和CD86的缺乏进行表征。在这些情况下,具有这些标记的微囊泡可以从例如通过亲和排阻层析的肿瘤特异性标记的进一步分析中排除。亲和层析可以例如通过使用不同载体、树脂、珠、抗体、适体、适体类似物、分子印记聚合物或本领域已知的其他分子来完成,所述其他分子特异性靶向微囊泡上的所需表面分子。任选地,对照颗粒可以在微囊泡分离或核酸提取前加入样品中,以充当内部对照来评估微囊泡纯化和/或核酸提取的效率或质量。本文描述的方法和/或试剂盒提供了对照颗粒连同微囊泡级分的有效分离。这些对照颗粒包括Q-β细菌噬菌体、病毒颗粒或含有对照核酸(例如至少一种对照靶基因)的任何其他颗粒,所述对照核酸可以是天然存在的或通过重组DNA技术改造的。在一些实施方案中,对照颗粒的数量在加入样品前是已知的。对照靶基因可以使用实时PCR分析进行定量。对照靶基因的定量可以用于测定微囊泡纯化或核酸提取过程的效率或质量。优选地,对照颗粒是Q-β细菌噬菌体,在本文中被称为“Q-β颗粒”。在本文描述的方法和/或试剂盒中使用的Q-β颗粒可以是天然存在的病毒颗粒或者可以是重组或经改造的病毒,其中病毒颗粒的至少一种组分(例如基因组或外壳蛋白质的一部分)通过本领域已知的重组DNA或分子生物学技术来合成。Q-β是光滑病毒科的成员,特征在于线性、单链RNA基因组,其由编码四种病毒蛋白质的3种基因组成:外壳蛋白质、成熟蛋白质、裂解蛋白质和RNA复制酶。由于其与平均微囊泡的相似大小,使用如本文描述的用于分离微囊泡的相同纯化方法,Q-β可以容易地从生物样品中纯化。另外,由于其在基于扩增的核酸测定中作为对照的用途,Q-β病毒单链基因结构的低复杂性是有利的。Q-β颗粒含有待检测或测量的对照靶基因或对照靶序列,用于定量样品中的Q-β颗粒的量。例如,对照靶基因是Q-β外壳蛋白质基因。在Q-β颗粒加入生物样品中之后,使用本文描述的提取方法和/或试剂盒,提取来自Q-β颗粒的核酸连同来自生物样品的核酸。Q-β对照靶基因的检测可以通过RT-PCR分析,例如与目的生物标记(即BRAF)同时进行测定。在对照靶基因的10倍稀释物中的至少2、3或4个已知浓度的标准曲线可以用于测定拷贝数。可以比较检测到的拷贝数和添加的Q-β颗粒数量,以确定分离和/或提取过程的质量。在优选实施方案中,Q-β颗粒在核酸提取之前加入尿样品中。例如,Q-β颗粒在超滤之前和/或在预过滤步骤之后加入尿样品中。在一些实施方案中,将Q-β颗粒的50、100、150、200、250、300、350、400、450、500、1,000或5,000个拷贝加入体液样品中。在优选实施方案中,将Q-β颗粒的100个拷贝加入体液样品中。Q-β颗粒的拷贝数可以基于Q-β细菌噬菌体感染靶细胞的能力进行计算。因此,Q-β颗粒的拷贝数与Q-β细菌噬菌体的菌落形成单位关联。核酸提取本发明涉及捕获表面用于微囊泡的改善分离、纯化或富集的用途。本文公开的方法提供了高度富集的微囊泡级分用于从所述微囊泡中提取高质量的核酸。通过本文所述的方法和/或试剂盒获得的核酸提取可以用于其中高质量的核酸提取是需要或优选的多种应用中,例如用于疾病或医学状况的诊断、预后或监控中。近期研究揭示在微囊泡内的核酸具有作为生物标记的作用。例如,WO2009/100029尤其描述了从GBM患者血清中的微囊泡中提取的核酸用于医学诊断、预后和治疗评估的用途。WO2009/100029还描述了从人尿中的微囊泡提取的核酸用于相同目的的用途。认为从微囊泡中提取的核酸的使用潜在地规避活组织检查的需要,突出显示微囊泡生物学的巨大诊断潜力(Skog等人,2008)。分离的微囊泡的质量或纯度可以直接影响所提取的微囊泡核酸的质量,其随后直接影响生物标记测定用于疾病诊断、预后和/或监控的效率和灵敏度。考虑到在临床领域中的准确和灵敏诊断测试的重要性,需要用于从生物样品中分离高度富集的微囊泡级分的方法。为了解决该需要,本发明提供了用于从生物样品中分离微囊泡用于从生物样品中提取高质量核酸的方法。如本文所示,高度富集的微囊泡级分通过本文描述的方法和/或试剂盒从生物样品中分离,并且其中高质量核酸随后从高度富集的微囊泡级分中提取。这些高质量的提取核酸可用于测量或评价生物标记的存在或不存在,用于帮助疾病或其他医学状况的诊断、预后和/或监控。如本文使用的,术语“生物样品”指含有生物材料例如DNA、RNA和蛋白质的样品。在一些实施方案中,生物样品可以适当地包含来自对象的体液。体液可以是从对象机体的任何地方优选外周位置分离的流体,包括但不限于例如血液、血浆、血清、尿、痰、脊髓液、脑脊髓液、胸膜液、乳头抽吸物、淋巴液、呼吸道、肠道和泌尿生殖道流体、泪液、唾液、母乳、来自淋巴系统的流体、精液、器官系统内流体、腹水、肿瘤囊液、羊水和细胞培养上清液及其组合。在一些实施方案中,用作生物样品的优选体液是尿。在其他实施方案中,优选体液是血清。在另外其他实施方案中,优选体液是血浆。在其他实施方案中,优选体液是脑脊髓液。适当地,可以使用约0.1m1-约30m1流体的样品体积。流体体积可以取决于少数因素,例如使用的流体类型。例如,血清样品的体积可以是约0.1m1-约4m1,优选约0.2ml-4ml。血浆样品的体积可以是约0.1ml-约4ml,优选0.5ml-4ml。尿样品的体积可以是约10m1-约30m1,优选约20ml。生物样品还可以包括粪便或盲肠样品,或由其分离的上清液。术语“对象”意欲包括显示或预期具有含核酸颗粒的所有动物。在特定实施方案中,对象是哺乳动物、人或非人灵长类动物、犬、猫、马、牛、其他农场动物或啮齿类动物(例如小鼠、大鼠、豚鼠等)。人对象可以是没有可观察到的异常例如疾病的正常人类。人对象可以是具有可观察到的异常例如疾病的人类。可观察到的异常可以由人类自己或医学专业人员观察到。术语“对象”、“患者”和“个体”在本文中可互换使用。如本文使用的,术语“核酸”指DNA和RNA。核酸可以是单链或双链的。在一些情况下,核酸是DNA。在一些情况下,核酸是RNA。RNA包括但不限于信使RNA、转移RNA、核糖体RNA、非编码RNA、微小RNA和HERV元件。如本文使用的,在提及核酸提取中的术语“高质量”意指其中能够检测到18S和28SrRNA的提取,优选以大约1:1-大约1:2;且更优选大约1:2的比。理想地,通过本文描述的方法和/或试剂盒获得的高质量核酸提取还具有对于低蛋白质生物样品(例如尿)大于或等于5的RNA完整性数目,或对于高蛋白质生物样品(例如血清)大于或等于3的RNA完整性数目,以及来自20m低蛋白质生物样品或1ml高蛋白质生物样品大于或等于50pg/ml的核酸得率。高质量RNA提取是希望的,因为RNA降解可以不利地影响所提取RNA的下游评价,例如在基因表达和mRNA分析中,以及在非编码RNA例如小RNA和微小RNA的分析中。本文描述的新方法和/或试剂盒允许从分离自生物样品的微囊泡中提取高质量核酸,从而使得可以执行在微囊泡内的核酸的准确分析。在从生物样品中分离微囊泡后,核酸可以从分离或富集的微囊泡级分中提取。为了实现这点,在一些实施方案中,微囊泡可以首先进行裂解。微囊泡的裂解和核酸的提取可以用本领域已知的多种方法来实现。在一个实施方案中,裂解和提取步骤可以使用商购可得的QiagenRNeasyPlus试剂盒来实现。在另一个实施方案中,裂解和提取步骤可以使用商购可得的QiagenmiRNeasy试剂盒来实现。在另外一个实施方案中,根据本领域已知的标准操作和技术,核酸提取可以使用苯酚:氯仿来实现。此类方法还可以利用核酸结合柱,以捕获微囊泡内含有的核酸。一旦结合,核酸随后就可以使用适合破坏核酸和结合柱之间的相互作用的缓冲液或溶液进行洗脱,从而成功洗脱核酸。在一些实施方案中,核酸提取方法还包括去除或减轻不利因素的步骤,所述不利因素阻止来自生物样品的高质量核酸提取。此类不利因素是异质的,因为不同生物样品可以含有不利因素的多个种类。在一些生物样品中,诸如过量DNA的因素可以影响来自此类样品的核酸提取的质量。在其他样品中,诸如过量内源RNA酶的因素可以影响来自此类样品的核酸提取的质量。许多试剂和方法可以用于去除这些不利因素。这些方法和试剂在本文中统称为“提取增强操作”。在一些情况下,提取增强操作可以涉及将核酸提取增强试剂加入生物样品中。为了去除不利因素例如内源RNA酶,如本文定义的此类提取增强试剂可以包括但不限于RNA酶抑制剂,例如Superase-In(由AmbionInc.商购可得)或RNaseINplus(由PromegaCorp.商购可得),或以相似方式起作用的其他试剂;蛋白酶(其可以充当RNA抑制剂);DNA酶;还原剂;诱饵底物例如合成RNA和/或载体RNA;可以结合RNA酶的可溶性受体;小干扰RNA(siRNA);RNA结合分子例如抗RNA抗体、碱性蛋白质或伴侣蛋白质;RNA酶变性物质,例如高同渗容摩溶液、去污剂或其组合。例如,提取增强操作可以包括在提取核酸之前,将RNA酶抑制剂加入生物样品和/或分离的微囊泡级分中;优选地,RNA酶抑制剂对于体积等于或超过1μl的样品具有大于0.027AU(IX)的浓度;可替代地,对于等于或超过1μl的样品,大于或等于0.135AU(5X)的浓度;可替代地,对于等于或超过Iμl的样品,大于或等于0.27AU(10X)的浓度;可替代地,对于等于或超过1μl的样品,大于或等于0.675AU(25X)的浓度;或可替代地,对于等于或超过1μl的样品,大于或等于1.35AU(50X)的浓度;其中IX浓度指其中0.027AU或更多的RNA酶抑制剂用于处理从1μl或更多体液中分离的微囊泡的酶促条件,5X浓度指其中0.135AU或更多的RNA酶抑制剂用于处理从1μl或更多体液中分离的微囊泡的酶促条件,10X蛋白酶浓度指其中0.27AU或更多的RNA酶抑制剂用于处理从1μl或更多体液中分离的颗粒的酶促条件,25X浓度指其中0.675AU或更多的RNA酶抑制剂用于处理从1μl或更多体液中分离的微囊泡的酶促条件,并且50X蛋白酶浓度指其中1.35AU或更多的RNA酶抑制剂用于处理从1μl或更多体液中分离的颗粒的酶促条件。优选地,RNA酶抑制剂是蛋白酶,在所述情况下,1AU是释放对应于1μmol酪氨酸/分钟的folin阳性氨基酸和肽的蛋白酶活性。这些增强试剂可以以多种方式发挥其功能,例如通过抑制RNA酶活性(例如RNA酶抑制剂),通过蛋白质的遍在降解(例如蛋白酶),或通过结合且保护RNA的伴侣蛋白质(例如RNA结合蛋白)。在所有情况下,此类提取增强试剂均去除或至少减轻在生物样品中或与分离的颗粒结合的不利因素的一些或全部,所述不利因素以其它方式阻止或干扰来自分离颗粒的核酸的高质量提取。在一些实施方案中,所提取的18S和28SrRNA的定量可以用于测定核酸提取的质量。核酸生物标记的检测在一些实施方案中,所提取的核酸包含RNA。在这种情况下,RNA优选在进一步扩增前逆转录成互补DNA(cDNA)。此类逆转录可以单独或与扩增步骤组合执行。组合逆转录和扩增步骤的方法的一个例子是逆转录聚合酶链反应(RT-PCR),其可以进一步修饰为定量的,例如如美国专利号5,639,606中所述的定量RT-PCR,所述专利为了该教导通过并入本文作为参考。该方法的另一个例子包括两个分开步骤:将RNA转换成cDNA的第一个逆转录步骤,和使用定量PCR定量cDNA量的第二个步骤。如下文实施例中证实的,使用本文公开的方法从含核酸颗粒中提取的RNA包括许多转录物种类,包括但不限于核糖体18S和28SrRNA,微小RNA,转移RNA,与疾病或医学状况相关的转录物,和对于医学状况的诊断、预后和监控重要的生物标记。例如,RT-PCR分析测定关于每个反应的Ct(循环阈值)值。在RT-PCR中,阳性反应通过荧光信号的累积进行检测。Ct值定义为荧光信号跨越阈值(即,超过本底水平)所需的循环数目。Ct水平与样品中的靶核酸或对照核酸量成反比(即Ct水平越低,样品中的对照核酸量越大)。在另一个实施方案中,对照核酸的拷贝数可以使用多种领域公认技术中的任一种,包括但不限于RT-PCR进行测量。对照核酸的拷贝数可以使用本领域已知的方法进行测定,例如通过生成且利用校正或标准曲线。在一些实施方案中,一种或多种生物标记可以是遗传异常之一或集合,所述遗传异常在本文中用于指在含核酸颗粒内的核酸量以及核酸变体。具体地,遗传异常包括但不限于基因(例如癌基因)或一组基因的过表达、基因(例如肿瘤抑制基因例如p53或RB)或一组基因的表达不足、基因或一组基因的剪接变体的选择性产生、拷贝数变体(CNV)(例如DNA双微体(DNAdoubleminutes)(Hahn,1993)、核酸修饰(例如甲基化、乙酰化和磷酸化)、单核苷酸多态性(SNP)、染色体重排(例如倒位、缺失和重复)、以及基因或一组基因的突变(插入、缺失、重复、错义、无义、同义或任何其他核苷酸变化,在许多情况下,所述突变最终影响基因产物的活性和功能,导致选择性转录剪接变体和/或基因表达水平的变化),或前述任何的组合。分离的颗粒中存在的核酸的分析是定量的和/或定性的。对于定量分析,用本领域已知的方法(下文描述)测量分离的颗粒内的特异性目的核酸的相对或绝对量(表达水平)。对于定性分析,用本领域已知的方法鉴定分离的微囊泡内的特异性目的核酸的种类,无论是野生型还是变体。本发明还包括从生物样品中分离微囊泡用于高质量核酸提取的新方法的多种用途,用于(i)帮助对象的诊断,(ii)监控对象中的疾病或其他医学状况的进展或复发,或(iii)帮助评估经历或考虑对于疾病或其他医学状况的治疗的对象的治疗功效;其中测定得自方法的核酸提取中的一种或多种生物标记的存在或不存在,并且一种或多种生物标记分别与疾病或其他医学状况的诊断、进展或复发、或治疗功效相关。用于从生物样品中分离微囊泡的试剂盒本发明的一个方面进一步涉及用于本文公开的方法中的试剂盒。试剂盒包括足以使来自生物样品的微囊泡与也存在于生物样品中的不需要的颗粒、碎片和小分子分离的捕获表面仪器。本发明还任选包括在分离和任选的后续核酸提取过程中使用前述试剂的说明书。实施例虽然本文提供的实施例使用用于离心和/或过滤目的的多种膜和装置,但应当理解这些方法可以与任何捕获表面和/或容纳装置一起使用,所述装置允许微囊泡的有效捕获,以及其中含有的核酸特别是RNA的释放。实施例1:血浆微囊泡RNA可以使用以真空形式的0.65um带正电的QPES滤器进行分离正常对照血浆得自BioreclamationLLC。将血液收集到K2EDTA管内,并且使用完全倒置充分混合。将管以1300xg离心10分钟,以分离血细胞和血浆。随后,将血浆通过0.8µm混合纤维素酯滤器(Millipore,Billerica,Ma.,USA)过滤,以去除细胞碎片和血小板,且分成1ml等分试样。将等分试样在-80℃下冷冻直至需要时。使用超速离心或FastTrap腺病毒纯化和浓缩试剂盒(Millipore,Billerica,Ma.,USA)0.65um带正电的Q聚乙烯砜真空过滤,进行4mL血浆微囊泡RNA的分离。在超速离心方法中,将来自四个对象的一个1mL血浆等分试样转移至含有8µLRNasinPlus(40U/µl,Promega,Madison,Wi.,USA)RNA酶抑制剂的5mL异质同晶聚合物(polyallomer)管(Beckman-Coulter,Miami,Fl.,USA),并且在室温下温育5分钟。在温育后,将血浆在1mLPBS(10mM磷酸钠、2mM磷酸钾、2.7mMKCl、137mMNaCl,pH7.4)中稀释。微囊泡通过在8℃下以120,000g超速离心80分钟形成团块。将微囊泡团块在42µLPBS和8µLRNasinPlus中洗涤,并且在室温下温育20分钟。将微囊泡团块在700ulQiazol试剂(Qiagen,Valencia,Ca.,USA)中裂解。在0.65um带正电的Q聚乙烯砜真空过滤方法中,取来自超速离心方法中使用的相同四个对象的一个1mL血浆等分试样,用5mLPBS稀释,并且与1mL10X结合缓冲液(Millipore)混合。在应用血浆样品前,滤器通过经由真空经过25mL平衡缓冲液(Millipore)进行条件化。随后,使血浆样品经由真空经过滤器。将滤液保存用于进一步分析。将滤器经由真空用20mL洗涤缓冲液(Millipore)洗涤。随后,用Qiazol裂解微囊泡。将2.25mLQiazol应用于膜,并且通过经由真空抽取大约5滴Qiazol经过滤器进行分配。随后将滤器在室温下温育5分钟,并且经由真空洗脱。将滤液样品转移至含有8µLRNasinPlus(40U/µl,Promega,Madison,Wi.,USA)RNA酶抑制剂的两个5mL异质同晶聚合物管(Beckman-Coulter,Miami,Fl.,USA),并且在室温下温育5分钟。微囊泡通过在8℃下以120,000g离心80分钟形成团块。将微囊泡团块在42µLPBS和8µLRNasinPlus中洗涤,并且在室温下温育20分钟。将微囊泡团块在700ulQiazol试剂(Qiagen,Valencia,Ca.,USA)中裂解。对于超速离心和过滤(滤器和滤液)样品,根据制造商的建议,使用miRNeasy试剂盒(Qiagen)分离微囊泡RNA。使用RNA6000PicoChip(图1A),用2100Bioanalyzer(Agilent,PaloAlto,Ca.,USA)评价RNA质量和浓度。根据制造商的方案,分别使用SuperScriptVILOcDNA合成试剂盒(Invitrogen,Carlsbad,Ca.,USA)和TaqmanMicroRNA逆转录试剂盒(AppliedBiosystems,FosterCity,Ca.,USA),将微囊泡RNA总体积的三分之二和九分之二转换成cDNA。为了比较通过过滤(滤器和滤液)和超速离心分离的微囊泡RNA,使用对于GAPDH、RN7SL、RNaseP、miR-16、miR-150和let-7a特异性的引物和探针,对mRNA和非编码RNA(包括微小RNA)执行RT-PCR。对于GAPDH和RNaseP,扩增反应在20ul体积中执行,所述20ul体积含有2XTaqman基因表达预混物(AppliedBiosystems,FosterCity,Ca.,USA)、20XTaqman基因表达测定(AppliedBiosystems,FosterCity,Ca.,USA)、以及用SuperScriptVILOcDNA合成试剂盒逆转录的cDNA的1:15级分。对于RN7SL,扩增反应在20ul体积中执行,所述20ul体积含有2XTaqman基因表达预混物、900nMRN7SL正向CAAAACTCCCGTGCTGATCA(SEQIDNO1)、900nMRN7SL反向GGCTGGAGTGCAGTGGCTAT(SEQIDNO2)、250nMRN7SL探针TGGGATCGCGCCTGT(SEQIDNO3)、以及用SuperScriptVILOcDNA合成试剂盒逆转录的cDNA的1:15级分。对于miR-16、miR-150和let-7a,扩增反应在20ul体积中执行,所述20ul体积含有2XTaqman通用PCR预混物、20XTaqmanMicroRNA测定(AppliedBiosystems,FosterCity,Ca.,USA)、以及用TaqmanMicroRNA逆转录试剂盒逆转录的cDNA的1:20级分。扩增条件由下述组成:50℃,2分钟的1个循环;95℃,10分钟的1个循环;95℃,10分钟和60℃,1分钟的40个循环。参见图1B。实施例2:使用MilliporeFastTrap病毒纯化柱,在来自黑素瘤患者的血浆样品中检测BRAF_V600E突变依照由IRB批准和如实施例1中所述的方案,黑素瘤血浆得自LudwigMaximiliansUniversity。使用超速离心或FastTrap腺病毒纯化和浓缩试剂盒(Millipore,Billerica,Ma.,USA)0.65um带正电的Q聚乙烯砜真空过滤,进行2mL和12mL血浆微囊泡RNA的分离。在超速离心方法中,将2mL和3X4mL血浆转移至含有8µLRNasinPlus(40U/µl,Promega,Madison,Wi.,USA)RNA酶抑制剂的5mL异质同晶聚合物管(Beckman-Coulter,Miami,Fl.,USA),并且在室温下温育5分钟。在温育后,将2mL和每个4mL血浆分别在3mL和1mLPBS中稀释。如实施例1中所述,将微囊泡形成团块且裂解。在0.65um带正电的Q聚乙烯砜真空过滤方法中,将2mL和12mL血浆分别用2.5mL和15mLPBS稀释,并且分别与500ul和3mL10X结合缓冲液(Millipore)混合。在应用血浆样品前,滤器通过经由真空经过25mL平衡缓冲液(Millipore)进行条件化。随后,使血浆样品经由真空经过滤器。将滤液保存用于进一步分析。将滤器经由真空用20mL洗涤缓冲液(Millipore)洗涤。将洗涤保存用于进一步分析。如实施例1中所述裂解滤器。将2mL和12mL血浆滤液样品分别转移至一和六个5mL异质同晶聚合物管(Beckman-Coulter,Miami,Fl.,USA)。将洗涤样品各自转移至四个5mL异质同晶聚合物管。使异质同晶聚合物管与8µLRNasinPlus(40U/µl,Promega,Madison,Wi.,USA)RNA酶抑制剂一起在室温下温育5分钟。如实施例1中所述,将微囊泡形成团块且裂解。对于超速离心和过滤(滤器、滤液和洗涤)样品,分离微囊泡RNA,并且评价质量和浓度,如实施例1中所述。对于超速离心和过滤(滤器、滤液和洗涤)样品,分离微囊泡RNA,并且评价质量和浓度,如实施例1中所述。参见图12A。根据制造商的方案,使用SuperScriptVILOcDNA合成试剂盒(Invitrogen,Carlsbad,Ca.,USA),将微囊泡RNA总体积的七分之六转换为cDNA。为了比较通过过滤(滤器、滤液和洗涤)和超速离心分离的微囊泡RNA检测BRAF突变的能力,对野生型和突变型BRAFmRNA执行RT-PCR。BRAF突变测定使用ARMS(扩增折射和突变系统(AmplificatoryrefractiveandMutationSystem))等位基因特异性PCR。该测定由AstraZeneca(Cheshire,UK)修改。突变测定含有对于扩增BRAFT1799A(检测V600E、V600K或V600D,取决于在1798或1800位置处存在的另外突变)特异性的引物。扩增反应在20ul体积中执行,所述20ul体积含有2XTaqman通用PCR预混物、900nMBRAFWT正向AAAAATAGGTGATTTTGGTCTAGCTACAGT(SEQIDNO4)、900nMBRAFMTARMS正向AAAAATAGGTGATTTTGGTCTAGCTACATA(SEQIDNO5)、900nMBRAFJSE15反向TGGATCCAGACAACTGTTCAA(SEQIDNO6)、250nMBRAFAZE15探针GATGGAGTGGGTCCCATCAG(SEQIDNO7)和cDNA的1:20级分。扩增条件由下述组成:50℃,2分钟的1个循环;95℃,10分钟的1个循环;95℃,10分钟和60℃1分钟的50个循环。参见图2。实施例3:再生纤维素旋转柱如实施例1中所述,正常对照血浆得自BioreclamationLLC。使用超速离心或3um带正电的Q再生纤维素离心过滤进行4mL血浆微囊泡RNA的分离。如实施例1中所述,将超速离心样品制备、形成团块且裂解。在3um带正电的Q再生纤维素离心过滤方法中,将来自超速离心方法中使用的相同四个对象的1mL血浆等分试样合并,且用444ul10X装载缓冲液(Sartorius)稀释。在应用血浆样品前,滤器通过在500xg下经过5mL1X洗涤缓冲液(Sartorius)5分钟进行条件化。随后,使血浆样品在500xg下经过滤器5分钟。将滤液保存用于进一步分析。将滤器在500xg下用18mL洗涤缓冲液(Sartorius)洗涤两次共5分钟。将第一次洗涤保存用于进一步分析。随后,用Qiazol裂解微囊泡。将1mLQiazol应用于膜,并且在100xg下分配1秒。随后将滤器在室温下温育10分钟,并且在500xg下洗脱5分钟。将滤液和洗涤样品分别转移至一和四个5mL异质同晶聚合物管(Beckman-Coulter,Miami,Fl.,USA)。使异质同晶聚合物管与8µLRNasinPlus(40U/µl,Promega,Madison,Wi.,USA)RNA酶抑制剂一起在室温下温育5分钟。用500ulPBS稀释洗涤异质同晶聚合物管。如实施例1中所述,将微囊泡形成团块且裂解。对于超速离心和过滤(滤器、滤液和洗涤)样品,分离微囊泡RNA,并且评价质量和浓度,如实施例1中所述。参见图3A。如实施例1中所述合成cDNA。为了比较通过过滤(滤器、滤液和洗涤)和超速离心分离的微囊泡RNA,使用对于GAPDH、RN7SL、RNaseP、miR-16、miR-150和let-7a特异性的引物和探针,对mRNA和非编码(包括微小RNA)执行RT-PCR,如实施例1中所述。参见图3B。实施例4:在旋转柱(自制柱)中的PallMustangS膜如实施例1中所述,正常对照血浆得自BioreclamationLLC。使用超速离心或使用自制旋转柱装置的MustangS(Pall,PortWashington,Ny.,USA)0.8um带负电的S聚乙烯砜离心过滤,进行4mL血浆微囊泡RNA的分离。如实施例1中所述,将超速离心样品制备、形成团块且裂解。在0.8um带负电的S聚乙烯砜离心过滤方法中,通过将三个切割滤器层置于旋转柱外壳中且用VitonO形圈密封,制备旋转柱。取来自超速离心方法中使用的相同四个对象的一个1mL血浆等分试样,且用2X装载缓冲液(100mM磷酸钠,pH6.8)稀释。在应用血浆样品前,滤器通过在500xg下经过18mL平衡缓冲液(50mM磷酸钠、150mMNaCl,pH6.8)5分钟进行条件化。随后,使血浆样品在200xg下经过滤器2分钟。将滤器在200xg下用18mL洗涤缓冲液(50mM磷酸钠、150mMNaCl,pH6.8)洗涤2分钟。随后,用Qiazol裂解微囊泡。将1mLQiazol应用于膜,并且在100xg下分配1分钟。随后将滤器在室温下温育10分钟,并且在100xg下洗脱2分钟,随后为2,000xg洗脱2分钟。对于超速离心和过滤样品,分离微囊泡RNA,并且评价质量和浓度,如实施例1中所述。参见图4A。如实施例1中所述合成cDNA。为了比较通过过滤和超速离心分离的微囊泡RNA,使用对于GAPDH、RN7SL、RNaseP、miR-16、miR-150和let-7a特异性的引物和探针,对mRNA和非编码(包括微小RNA)执行RT-PCR,如实施例1中所述。参见图4B。实施例5:在旋转柱中的PallMustang膜如实施例1中所述,正常对照血浆得自BioreclamationLLC。使用超速离心或使用自制旋转柱装置的0.8umMustangQ(Pall)带正电的Q聚乙烯砜离心过滤,进行4mL血浆微囊泡RNA的分离。如实施例1中所述,将超速离心样品制备、形成团块且裂解。在0.8um带正电的Q聚乙烯砜离心过滤方法中,如实施例4中所述制备旋转柱。取来自超速离心方法中使用的相同四个对象的一个1mL血浆等分试样,且用5mLPBS稀释,且与1mL10X装载缓冲液(1MTris、1MNaCl、0.1MMaCl2,pH8)混合。在应用血浆样品前,滤器通过在500xg下经过18mL平衡缓冲液(0.1MTris、0.1MNaCl、0.01MMaCl2,pH8)5分钟进行条件化。随后,使血浆样品在200xg下经过滤器2分钟。将滤器在200xg下用18mL洗涤缓冲液(0.1MTris、0.2MNaCl、0.01MMgCl2,pH8)洗涤2分钟。随后,用Qiazol裂解微囊泡。将1mLQiazol应用于膜,并且在100xg下分配1秒。随后将滤器在室温下温育10分钟,并且在100xg下洗脱2分钟,随后为2,000xg洗脱2分钟。对于超速离心和过滤样品,分离微囊泡RNA,并且评价质量和浓度,如实施例1中所述。参见图5A。如实施例1中所述合成cDNA。为了比较通过过滤和超速离心分离的微囊泡RNA,使用对于GAPDH、RN7SL、RNaseP、miR-16、miR-150和let-7a特异性的引物和探针,对mRNA和非编码(包括微小RNA)执行RT-PCR,如实施例1中所述。参见图5B。实施例6:在注射器式滤器中的PallMustang膜Q或S如实施例1中所述,正常对照血浆得自BioreclamationLLC。使用超速离心或MustangQ(Pall)0.8um带正电的Q聚乙烯砜注射器过滤或MustangS(Pall)0.8um带负电的S聚乙烯砜注射器过滤,进行4mL血浆微囊泡RNA的分离。如实施例1所述,将超速离心样品制备、形成团块且裂解。在0.8um带正电的Q聚乙烯砜注射器过滤方法和0.8um带负电的S聚乙烯砜注射器过滤方法中,将来自超速离心方法中使用的相同四个对象的两个1mL血浆等分试样合并,且用5mLPBS稀释,且与1mL10X装载缓冲液(Q:200mMTris、100mMNaCl,pH7.4;S:200mM磷酸盐、100mMNaCl,pH7.4)混合。在应用血浆样品前,滤器通过经由注射器经过20mL适当的平衡缓冲液(Q:20mMTris、100mMNaCl,pH7.4;S:20mM磷酸盐、100mMNaCl,pH7.4)进行条件化。随后,使血浆样品经由注射器经过滤器。将滤液保存用于进一步分析。将滤器经由注射器用20mL适当的洗涤缓冲液(Q:20mMTris、100mMNaCl,pH7.4;S:20mM磷酸盐、100mMNaCl,pH7.4)洗涤。随后,从滤器中去除残留流体,并且用Qiazol裂解微囊泡。将700ulQiazol应用于膜,并且经由注射器分配。随后将滤器在室温下温育5分钟,并且经由注射器洗脱。如实施例1中所述,将超速离心样品制备、形成团块且裂解。对于超速离心和过滤(滤器和滤液)样品,分离微囊泡RNA,并且评价质量和浓度,如实施例1中所述。如实施例1中所述合成cDNA。为了比较通过过滤(滤器和滤液)和超速离心分离的微囊泡RNA,使用对于GAPDH、RN7SL、RNaseP、miR-16、miR-150和let-7a特异性的引物和探针,对mRNA和非编码(包括微小RNA)执行RT-PCR,如实施例1中所述。参见图6。实施例7:带负电的尼龙(注射器式滤器)如实施例1中所述,正常对照血浆得自BioreclamationLLC。使用超速离心或50nm带负电的尼龙注射器过滤(Sterlitech,Kent,Wa.,USA),进行4mL血浆微囊泡RNA的分离。如实施例1中所述,将超速离心样品制备、形成团块且裂解。在50nm带负电的尼龙注射器过滤方法中,取来自超速离心方法中使用的相同四个对象的一个1mL血浆等分试样。使血浆样品经由注射器经过滤器。将滤液保存用于进一步分析。将滤器经由注射器用20mLPBS洗涤。随后,经由注射器从滤器中去除残留流体。对于裂解,将700ulQiazol应用于膜,并且经由注射器分配。随后将滤器在室温下温育20秒,并且经由注射器洗脱。将滤液转移至含有8µLRNasinPlus(40U/µl,Promega,Madison,Wi.,USA)RNA酶抑制剂的5mL异质同晶聚合物管(Beckman-Coulter,Miami,Fl.,USA),并且在室温下温育5分钟。在温育后,将滤液用1mLPBS稀释。如实施例1中所述,将微囊泡形成团块且裂解。对于超速离心和过滤(滤器和滤液)样品,分离微囊泡RNA,并且评价质量和浓度,如实施例1中所述。参见图7A。如实施例1中所述合成cDNA。为了比较通过过滤(滤器和滤液)和超速离心分离的微囊泡RNA,使用对于GAPDH、RN7SL、RNaseP、miR-16、miR-150和let-7a特异性的引物和探针,对mRNA和非编码(包括微小RNA)执行RT-PCR,如实施例1中所述。参见图7B。实施例8:从尿样品中分离微囊泡RNA正常对照尿内部获得,并且通过0.8µm混合纤维素酯滤器(Millipore)过滤,以去除细胞碎片。将过滤的尿贮存于4℃下直至需要时。使用100K离心滤器单元浓缩(Millipore)或FastTrap腺病毒纯化和浓缩试剂盒(Millipore,Billerica,Ma.,USA)0.65um带正电的Q聚乙烯砜真空过滤,进行10mL尿微囊泡RNA的分离。在100K离心滤器单元浓缩中,将10mL尿转移至100K离心滤器单元过滤且以4,500xg离心5分钟。随后在700ulQiazol中裂解浓缩的微囊泡样品。在0.65um带正电的Q聚乙烯砜真空过滤方法中,来自100K离心滤器单元浓缩中使用的相同对象的10mL尿用8mLPBS稀释,且与2mL10X结合缓冲液(Millipore)混合。如实施例1中所述,将滤器平衡、装载有血浆样品、洗涤且裂解。将滤液样品转移至含有8µLRNasinPlus(40U/µl,Promega,Madison,Wi.,USA)RNA酶抑制剂的四个5mL异质同晶聚合物管(Beckman-Coulter,Miami,Fl.,USA),并且在室温下温育5分钟。如实施例1中所述,将微囊泡形成团块且裂解。对于超速离心和过滤(滤器和滤液)样品,分离微囊泡RNA,并且评价质量和浓度,如实施例1中所述。参见图8A。如实施例1中所述合成cDNA。为了比较通过过滤(滤器和滤液)和100K离心滤器单元浓缩分离的尿微囊泡RNA,使用对于GAPDH、RN7SL、RNaseP、miR-16、miR-150和let-7a特异性的引物和探针,对mRNA和非编码(包括微小RNA)执行RT-PCR,如实施例1中所述。参见图8B。实施例9:表面电荷(S抑制)如实施例1中所述,正常对照血浆得自BioreclamationLLC。使用超速离心或经修饰的3um带正电的Q再生纤维素离心过滤或经修饰的3um带负电的S再生纤维素离心过滤,进行4mL血浆微囊泡RNA的分离。如实施例1中所述,将超速离心样品制备、形成团块且裂解。在3um带正电的Q再生纤维素离心过滤方法和3um带负电的S再生纤维素离心过滤方法中,通过去除24个滤器层中的21个,将旋转柱各自修饰。取来自超速离心方法中使用的相同四个对象的一个1mL血浆等分试样。对于超速离心和过滤样品,分离微囊泡RNA,并且评价质量和浓度,如实施例1中所述。在cDNA合成前,将RNA稀释1:10和1:100。根据制造商的方案,使用SuperScriptVILOcDNA合成试剂盒(Invitrogen,Carlsbad,Ca.,USA),将微囊泡RNA总体积的五分之三、1:10RNA稀释物和1:100RNA稀释物转换为cDNA。为了测定在RNA水平上是否存在任何RT-PCR抑制,比较通过过滤和超速离心分离的微囊泡RNA的稀释物。对GAPDH执行RT-PCR。扩增反应在20ul体积中执行,所述20ul体积含有2XTaqman基因表达预混物(AppliedBiosystems,FosterCity,Ca.,USA)、20XTaqman基因表达测定(AppliedBiosystems,FosterCity,Ca.,USA)、以及用SuperScriptVILOcDNA合成试剂盒逆转录的cDNA的1:15级分。扩增条件如实施例1中所述。参见图9。如果在RNA水平上不存在任何RT-PCR抑制,则每个1:10稀释物导致3.3Ct增加,如超速离心和3um带正电的Q再生纤维素离心过滤中所示。然而,对于3um带负电的S再生纤维素离心过滤,平均Ct值随着稀释度而减少,指示在RNA水平上的RT-PCR抑制。观察到当血浆样品在装载前处于小于或等于5.5的pH设置时,滤器趋于堵塞,并且血浆将不旋转通过柱。实施例10:微囊泡在酸性pH下是稳定的如实施例1中所述,正常对照血浆得自BioreclamationLLC。使用离心进行1.9mL血浆微囊泡RNA的分离。将团块一式两份地重悬浮于下述缓冲液中:·50mM甲基丙二酸、150mMNaCl,pH2.5·50mM甲基丙二酸、150mMNaCl,pH3.5·50mM乙酸、150mMNaCl,pH4.5·10mM磷酸钠、2mM磷酸钾、2.7mMKCl、137mMNaCl,pH7.4具体地,合并来自一个对象的16个1mL血浆等分试样。将1.9mL合并血浆转移至八个2.0mLEppendorf管,并且在8℃下以21,130xg共30分钟形成团块。将微囊泡团块重悬浮于150ul适当缓冲液中,并且在室温下温育20分钟。微囊泡团块随后在700ulQiazol试剂(Qiagen,Valencia,Ca.,USA)中裂解。分离微囊泡RNA,并且评价质量和浓度,如实施例1中所述。参见图10A。如实施例1中所述合成cDNA。为了测定血浆微囊泡在酸性pH下的稳定性,使用对于GAPDH、RN7SL、RNaseP、miR-16、miR-150和let-7a特异性的引物和探针,对mRNA和非编码RNA(包括微小RNA)执行RT-PCR,如实施例1中所述。参见图10B。实施例11:微囊泡在碱性pH下是不稳定的。如实施例1中所述,正常对照血浆得自BioreclamationLLC。为了测定血浆微囊泡在碱性pH下的稳定性,将微囊泡团块重悬浮于下述缓冲液中:·50mM双[三(羟甲基)甲基氨基]丙烷,150mMNaCl,pH7·50mMTris、150mMNaCl,pH8·50mM二乙醇胺、150mMNaCl,pH9·50mM乙醇胺、150mMNaCl,pH10如实施例10中所述执行血浆微囊泡RNA分离和分析。参见图11A和11B。实施例12:在荷电膜上的微囊泡捕获和/或微囊泡稳定性受缓冲液pH和/或缓冲液浓度和/或缓冲液类型影响。如实施例1中所述,正常对照血浆得自BioreclamationLLC。使用超速离心或3um带正电的Q再生纤维素离心过滤,进行4.8mL血浆微囊泡RNA的分离。在超速离心方法中,合并来自五个对象的1mL血浆等分试样。将4.8mL合并血浆转移至含有8µLRNasinPlus(40U/µl,Promega,Madison,Wi.,USA)RNA酶抑制剂的5mL异质同晶聚合物管(Beckman-Coulter,Miami,Fl.,USA),并且在室温下温育5分钟。如实施例1中所述,将微囊泡形成团块且裂解。在3um带正电的Q再生纤维素离心过滤方法中,平衡、装载和洗涤缓冲液用不同缓冲液类型和pH进行测试。使用下述缓冲液设置:·100mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH6.8(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH7(平衡和洗涤缓冲液),·100mMTris、150mMNaCl,pH8(2X装载缓冲液)和50mMTris、150mMNaCl,pH8(平衡和洗涤缓冲液),或·100mM二乙醇胺、150mMNaCl,pH9(2X装载缓冲液)和50mM二乙醇胺、150mMNaCl,pH9(平衡和洗涤缓冲液)。首先,将来自超速离心方法中使用的相同五个对象的三个1mL血浆等分试样合并。将4.8mL合并血浆等分到对于每个缓冲液设置分开的50mL锥形管内,并且与4.8mL适当的2X装载缓冲液混合。每个稀释的血浆样品的pH就准确度进行评价。在应用血浆样品前,滤器通过在500xg下经过5mL适当的平衡缓冲液5分钟进行条件化。随后,使血浆样品在500xg下经过滤器5分钟。将滤液保存用于进一步分析。将滤器在500xg下用18mL适当的洗涤缓冲液洗涤两次共5分钟。随后,用Qiazol裂解微囊泡。将1mLQiazol应用于膜,并且通过以100xg离心1秒进行分配。随后将滤器在室温下温育10分钟,并且在500xg下洗脱5分钟。如实施例1中所述,将滤液样品各自制备、形成团块且裂解。对于超速离心和过滤(滤器和滤液)样品,分离微囊泡RNA,并且评价质量和浓度,如实施例1中所述。参见图12A。如实施例1中所述合成cDNA。为了测定用于微囊泡RNA过滤的优选pH,且为了比较通过过滤(滤器和滤液)和超速离心分离的微囊泡RNA,使用对于GAPDH、RN7SL、RNaseP、miR-16、miR-150和let-7a特异性的引物和探针,对mRNA和非编码(包括微小RNA)执行RT-PCR,如实施例1中所述。如图12B中所示,pH和/或缓冲液类型对关于GAPDH、RN7SL、RNaseP、let-7a和miR-150的过滤样品具有显著作用。100mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH6.8(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH7(平衡和洗涤缓冲液)缓冲液设置对于滤器样品是优选的。pH和/或缓冲液类型对关于miR-16的过滤样品不具有显著作用。另外,关于GAPDH、RN7SL和RNaseP的RNA水平对于滤器和超速离心机样品是相似的。与优选的滤器样品相比较,在超速离心机样品中,平均Ct值对于let-7a低0.9Ct,并且对于miR-150高0.7Ct。与优选的滤器样品相比较,在超速离心机样品中,平均Ct值对于miR-16低2.3Ct。这最可能是由于微囊泡中的微小RNA包装中的差异。一些微小RNA在血浆中的核糖核蛋白复合物中发现,并且不一定通过带正电的过滤捕获。实施例13:在荷电滤器上的微囊泡捕获和/或微囊泡稳定性受缓冲液pH和/或缓冲液浓度和/或缓冲液类型影响。如实施例1中所述,正常对照血浆得自BioreclamationLLC。使用超速离心或3um带正电的Q再生纤维素离心过滤,进行3.8mL血浆微囊泡RNA的分离。在超速离心方法中,合并来自四个对象的1mL血浆等分试样。将3.8mL合并血浆转移至含有8µLRNasinPlus(40U/µl,Promega,Madison,Wi.,USA)RNA酶抑制剂的5mL异质同晶聚合物管(Beckman-Coulter,Miami,Fl.,USA),并且在室温下温育5分钟。在温育后,将血浆在1.2mLPBS中稀释。如实施例1中所述,将微囊泡形成团块且裂解。在3um带正电的Q再生纤维素离心过滤方法中,平衡、装载和洗涤缓冲液用不同缓冲液类型和pH进行测试。使用下述缓冲液设置:·100mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH6(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH6.5(平衡和洗涤缓冲液)·100mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH6.8(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH7(平衡和洗涤缓冲液)·100mM三乙醇胺、150mMNaCl,pH6.5(2X装载缓冲液)和50mM三乙醇胺、150mMNaCl,pH7.0(平衡和洗涤缓冲液)·100mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH7.4(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH7.5(平衡和洗涤缓冲液)·100mMTris、150mMNaCl,pH7.4(2X装载缓冲液)和50mMTris、150mMNaCl,pH7.5(平衡和洗涤缓冲液)·100mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH8(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH8(平衡和洗涤缓冲液)·100mMTris、150mMNaCl,pH8(2X装载缓冲液)和50mMTris、150mMNaCl,pH8(平衡和洗涤缓冲液)·100mMTris、150mMNaCl,pH8.5(2X装载缓冲液)和50mMTris、150mMNaCl,pH8.5(平衡和洗涤缓冲液)首先,将来自超速离心方法中使用的相同四个对象的八个1mL血浆等分试样合并。将3.8mL合并血浆等分到对于每个缓冲液设置分开的50mL锥形管内,并且与3.8mL适当的2X装载缓冲液混合。每个稀释的血浆样品的pH就准确度进行评价。在应用血浆样品前,滤器通过在500xg下经过5mL适当的平衡缓冲液5分钟进行条件化。随后,使血浆样品在500xg下经过滤器5分钟。将滤器在500xg下用18mL适当的洗涤缓冲液洗涤两次共5分钟。随后,用Qiazol裂解微囊泡。将1mLQiazol应用于膜,并且通过以100xg离心1秒进行分配。随后将滤器在室温下温育10分钟,并且在500xg下洗脱5分钟。对于超速离心和过滤样品,分离微囊泡RNA,并且评价质量和浓度,如实施例1中所述。参见图13A。如实施例1中所述合成cDNA。为了测定用于微囊泡RNA过滤的优选pH和缓冲液类型,且为了比较通过过滤和超速离心分离的微囊泡RNA,使用对于GAPDH、RN7SL、RNaseP、miR-16、miR-150和let-7a特异性的引物和探针,对mRNA和非编码(包括微小RNA)执行RT-PCR,如实施例1中所述。参见图13B。下述缓冲液设置是优选的:100mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH6(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH6.5(平衡和洗涤缓冲液);以及100mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH6.8(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH7(平衡和洗涤缓冲液)。实施例14:在荷电滤器上的微囊泡捕获和/或微囊泡稳定性受缓冲液pH和缓冲液浓度影响。如实施例1中所述,正常对照血浆得自BioreclamationLLC。使用超速离心或3um带正电的Q再生纤维素离心过滤,进行3.8mL血浆微囊泡RNA的分离。如实施例13中所述,将超速离心样品制备、形成团块且裂解。在3um带正电的Q再生纤维素离心过滤方法中,平衡、装载和洗涤缓冲液用不同缓冲液类型和pH进行测试。使用下述缓冲液设置:·117mMBisTris、150mMNaCl,pH1.9(2X装载缓冲液)和58.5mMBisTris、150mMNaCl,pH6(平衡和洗涤缓冲液)·117mMBisTris、150mMNaCl,pH6.1(2X装载缓冲液)和58.5mMBisTris、150mMNaCl,pH6.5(平衡和洗涤缓冲液)·100mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH6(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH6.5(平衡和洗涤缓冲液)·100mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH6.8(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH7(平衡和洗涤缓冲液)·100mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH7.4(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH7.5(平衡和洗涤缓冲液)·200mMTris、150mMNaCl,pH7.5(2X装载缓冲液)和100mMTris、150mMNaCl,pH7.5(平衡和洗涤缓冲液)首先,将来自超速离心方法中使用的相同四个对象的六个1mL血浆等分试样合并。将3.8mL合并血浆等分到对于每个缓冲液设置分开的50mL锥形管内,并且与3.8mL适当的2X装载缓冲液混合。每个稀释的血浆样品的pH就准确度进行评价。如实施例13中所述,将滤器平衡、装载有血浆样品、洗涤且裂解。对于超速离心和过滤样品,分离微囊泡RNA,并且评价质量和浓度,如实施例1中所述。参见图14A。如实施例1中所述合成cDNA。为了测定用于微囊泡RNA过滤的优选pH和缓冲液类型,且为了比较通过过滤和超速离心分离的微囊泡RNA,使用对于GAPDH、RN7SL、RNaseP、miR-16、miR-150和let-7a特异性的引物和探针,对mRNA和非编码(包括微小RNA)执行RT-PCR,如实施例1中所述。参见图14B。下述缓冲液设置是优选的:100mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH6(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH6.5(平衡和洗涤缓冲液);以及100mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH6.8(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、150mMNaCl,pH7(平衡和洗涤缓冲液)。实施例15:在荷电滤器上的微囊泡捕获和微囊泡稳定性受缓冲液的浓度影响。如实施例1中所述,正常对照血浆得自BioreclamationLLC。使用超速离心或3um带正电的Q再生纤维素离心过滤,进行3.8mL血浆微囊泡RNA的分离。如实施例13中所述,将超速离心样品制备、形成团块且裂解。在3um带正电的Q再生纤维素离心过滤方法中,平衡、装载和洗涤缓冲液用不同缓冲液浓度进行测试。使用下述缓冲液设置:·100mM双[三(羟甲基)甲基氨基]丙烷、0.15mMNaCl,pH6(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、0.15mMNaCl,pH6.5(平衡和洗涤缓冲液)·500mM双[三(羟甲基)甲基氨基]丙烷、900mMNaCl,pH6.4(2X装载缓冲液)和250mM双[三(羟甲基)甲基氨基]丙烷、450mMNaCl,pH6.5(平衡和洗涤缓冲液)首先,将来自超速离心方法中使用的相同四个对象的两个1mL血浆等分试样合并。将3.8mL合并血浆等分到对于每个缓冲液设置分开的50mL锥形管内,并且与3.8mL适当的2X装载缓冲液混合。每个稀释的血浆样品的pH就准确度进行评价。如实施例13中所述,将滤器平衡、装载有血浆样品、洗涤且裂解。对于超速离心和过滤样品,分离微囊泡RNA,并且评价质量和浓度,如实施例1中所述。参见图15A。如实施例1中所述合成cDNA。为了测定用于微囊泡RNA过滤的优选缓冲液浓度,且为了比较通过过滤和超速离心分离的微囊泡RNA,使用对于GAPDH、RN7SL、RNaseP、miR-16、miR-150和let-7a特异性的引物和探针,对mRNA和非编码(包括微小RNA)执行RT-PCR,如实施例1中所述。参见图15B。实施例16:微囊泡是稳定的,并且总体RNA得率不受低至高盐浓度影响。如实施例1中所述,正常对照血浆得自BioreclamationLLC。为了测定血浆微囊泡在NaCl中的稳定性,将微囊泡团块一式两份地重悬浮于具有下述NaCl浓度的50mM双[三(羟甲基)甲基氨基]丙烷,pH6.5缓冲液中:•0.15MNaCl•0.3MNaCl•0.6MNaCl•1.2MNaCl•2.4MNaCl。具体地,将来自一个对象的20个1mL血浆等分试样合并,并且将1.9mL合并血浆转移至十个2.0mLEppendorf管。如实施例10中所述,将血浆微囊泡形成团块、重悬浮且裂解。分离微囊泡RNA,并且评价质量和浓度,如实施例1中所述。参见图16A。如实施例1中所述合成cDNA。为了测定血浆微囊泡在不同盐浓度下的稳定性,使用对于GAPDH、HPRT1、RN7SL、RNaseP、miR-16和let-7a特异性的引物和探针,对mRNA和非编码(包括微小RNA)执行RT-PCR。对于GAPDH、RNaseP和HPRT1,扩增反应在20ul体积中执行,所述20ul体积含有2XTaqman基因表达预混物(AppliedBiosystems,FosterCity,Ca.,USA)、20XTaqman基因表达测定(AppliedBiosystems,FosterCity,Ca.,USA)、以及用SuperScriptVILOcDNA合成试剂盒逆转录的cDNA的1:20级分。对于RN7SL,扩增反应在20ul体积中执行,所述20ul体积含有2XTaqman基因表达预混物、900nMRN7SL正向CAAAACTCCCGTGCTGATCA(SEQIDNO1)、900nMRN7SL反向GGCTGGAGTGCAGTGGCTAT(SEQIDNO2)、250nMRN7SL探针TGGGATCGCGCCTGT(SEQIDNO3)、以及用SuperScriptVILOcDNA合成试剂盒逆转录的cDNA的1:20级分。对于miR-16和let-7a,扩增反应在20ul体积中执行,所述20ul体积含有2XTaqman通用PCR预混物、20XTaqmanMicroRNA测定(AppliedBiosystems,FosterCity,Ca.,USA)、以及用TaqmanMicroRNA逆转录试剂盒逆转录的cDNA的1:20级分。扩增条件如实施例1中所述执行。参见图16B。实施例17:在荷电滤器上的微囊泡捕获和微囊泡稳定性不受装载缓冲液的盐浓度影响。如实施例1中所述,正常对照血浆得自BioreclamationLLC。使用超速离心或3um带正电的Q再生纤维素离心过滤,进行3.8mL血浆微囊泡RNA的分离。如实施例13中所述,将超速离心样品制备、形成团块且裂解。在3um带正电的Q再生纤维素离心过滤方法中,平衡和装载缓冲液用不同盐浓度进行测试。使用下述缓冲液设置:·100mM双[三(羟甲基)甲基氨基]丙烷、0.15MNaCl,pH6.0(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、0.15MNaCl,pH6.5(平衡缓冲液)·100mM双[三(羟甲基)甲基氨基]丙烷、1.05MNaCl,pH6.0(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、0.6MNaCl,pH6.5(平衡缓冲液)·100mM双[三(羟甲基)甲基氨基]丙烷、2.25MNaCl,pH6.0(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、1.2MNaCl,pH6.5(平衡缓冲液)·100mM双[三(羟甲基)甲基氨基]丙烷、4.65MNaCl,pH6.0(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、2.4MNaCl,pH6.5(平衡缓冲液)首先,将来自超速离心方法中使用的相同四个对象的四个1mL血浆等分试样合并。将3.8mL合并血浆等分到对于每个缓冲液设置分开的50mL锥形管内,并且与3.8mL适当的2X装载缓冲液混合。在应用血浆样品前,滤器通过在100xg下经过5mL适当的平衡缓冲液5分钟进行条件化。随后,使血浆样品在100xg下经过滤器5分钟。将滤液保存用于进一步分析。无需洗涤,用Qiazol裂解微囊泡。将1mLQiazol应用于膜,并且通过以100xg离心1秒进行分配。随后将滤器在室温下温育10分钟,并且在200xg下洗脱2分钟,随后为5000xg洗脱2分钟。将3.8mL血浆滤液样品各自转移至含有8µLRNasinPlus(40U/µl,Promega,Madison,Wi.,USA)RNA酶抑制剂的两个5mL异质同晶聚合物管(Beckman-Coulter,Miami,Fl.,USA),并且在室温下温育5分钟。在温育后,将每个滤液等分试样在1.2mLPBS中稀释。如实施例1中所述,将微囊泡形成团块且裂解。对于超速离心和过滤样品,分离微囊泡RNA,并且评价质量和浓度,如实施例1中所述。参见图17A。如实施例1中所述合成cDNA。为了测定过滤方法中用于装载血浆样品的优选盐浓度,且为了比较通过过滤(滤器和滤液)和超速离心分离的微囊泡RNA,使用对于GAPDH、HPRT1、RN7SL、BRAF、miR-16和let-7a特异性的引物和探针,对mRNA和非编码(包括微小RNA)执行RT-PCR。对于GAPDH和HPRT1,扩增反应在20ul体积中执行,所述20ul体积含有2XTaqman基因表达预混物(AppliedBiosystems,FosterCity,Ca.,USA)、20XTaqman基因表达测定(AppliedBiosystems,FosterCity,Ca.,USA)、以及用SuperScriptVILOcDNA合成试剂盒逆转录的cDNA的1:20级分。对于RN7SL,扩增反应在20ul体积中执行,所述20ul体积含有2XTaqman基因表达预混物、900nMRN7SL正向CAAAACTCCCGTGCTGATCA(SEQIDNO1)、900nMRN7SL反向GGCTGGAGTGCAGTGGCTAT(SEQIDNO2)、250nMRN7SL探针TGGGATCGCGCCTGT(SEQIDNO3)、以及用SuperScriptVILOcDNA合成试剂盒逆转录的cDNA的1:20级分。对于BRAF,扩增反应在20ul体积中执行,所述20ul体积含有2XTaqman基因表达预混物、900nMBRAFWT正向AAAAATAGGTGATTTTGGTCTAGCTACAGT(SEQIDNO4)、900nMBRAFJSE15反向TGGATCCAGACAACTGTTCAA(SEQIDNO6)、250nMBRAFAZE15探针GATGGAGTGGGTCCCATCAG(SEQIDNO7)、以及用SuperScriptVILOcDNA合成试剂盒逆转录的cDNA的1:20级分。对于miR-16和let-7a,扩增反应在20ul体积中执行,所述20ul体积含有2XTaqman通用PCR预混物、20XTaqmanMicroRNA测定(AppliedBiosystems,FosterCity,Ca.,USA)、以及用TaqmanMicroRNA逆转录试剂盒逆转录的cDNA的1:20级分。扩增条件如实施例1中所述执行。参见图17B。实施例18:在荷电滤器上的微囊泡捕获和微囊泡稳定性不受装载或洗涤缓冲液的盐浓度影响。如实施例1中所述,正常对照血浆得自BioreclamationLLC。使用超速离心或3um带正电的Q再生纤维素离心过滤,进行3.8mL血浆微囊泡RNA的分离。如实施例13中所述,将超速离心样品制备、形成团块且裂解。在3um带正电的Q再生纤维素离心过滤方法中,平衡和装载缓冲液用不同盐浓度进行测试。使用下述缓冲液设置:·100mM双[三(羟甲基)甲基氨基]丙烷、0.15mMNaCl,pH6(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、0.15mMNaCl,pH6.5(平衡和洗涤缓冲液)·100mM双[三(羟甲基)甲基氨基]丙烷、1.05MNaCl,pH6(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、0.6MNaCl,pH6.5(平衡和洗涤缓冲液)·100mM双[三(羟甲基)甲基氨基]丙烷、2.25MNaCl,pH6(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、1.2MNaCl,pH6.5(平衡和洗涤缓冲液)·100mM双[三(羟甲基)甲基氨基]丙烷、4.65MNaCl,pH6(2X装载缓冲液)和50mM双[三(羟甲基)甲基氨基]丙烷、2.4MNaCl,pH6.5(平衡和洗涤缓冲液)首先,将来自超速离心方法中使用的相同四个对象的四个1mL血浆等分试样合并。将3.8mL合并血浆等分到对于每个缓冲液设置分开的50mL锥形管内,并且与3.8mL适当的2X装载缓冲液混合。在应用血浆样品前,滤器通过在100xg下经过5mL适当的平衡缓冲液5分钟进行条件化。随后,使血浆样品在100xg下经过滤器5分钟。将滤液保存用于进一步分析。将滤器在100xg下用18mL适当的洗涤缓冲液洗涤5分钟。随后,用Qiazol裂解微囊泡。将1mLQiazol应用于膜,并且通过以100xg离心1秒进行分配。随后将滤器在室温下温育10分钟,并且在200xg下洗脱2分钟,随后为5000xg洗脱2分钟。对于超速离心和过滤样品,分离微囊泡RNA,并且评价质量和浓度,如实施例1中所述。参见图18A。如实施例1中所述合成cDNA。为了测定过滤方法中用于洗涤血浆样品的优选盐浓度,且为了比较通过过滤和超速离心分离的微囊泡RNA,使用对于GAPDH、RN7SL、HPRT1、BRAF、miR-16和let-7a特异性的引物和探针,对mRNA和非编码(包括微小RNA)执行RT-PCR,如实施例17中所述。参见图18B。实施例19:RNA裂解缓冲液影响来自用荷电滤器分离的微囊泡的RNA得率如实施例1中所述,正常对照血浆得自BioreclamationLLC。使用超速离心或FastTrap腺病毒纯化和浓缩试剂盒(Millipore,Billerica,Ma.,USA)0.65um带正电的Q聚乙烯砜真空过滤,进行4mL血浆微囊泡RNA的分离。在0.65um带正电的Q聚乙烯砜真空过滤方法中,用Qiazol(Qiagen)或Promega裂解试剂(Promega)裂解微囊泡RNA。如实施例1中所述,将超速离心样品制备、形成团块且裂解。制备用于由Qiazol(Qiagen)裂解的0.65um带正电的Q聚乙烯砜真空过滤的4mL血浆,并且将滤器平衡、装载有血浆样品、洗涤且裂解,如实施例1中所述。对于超速离心和由Qiazol裂解的0.65um带正电的Q聚乙烯砜真空过滤样品,分离微囊泡RNA,如实施例1中所述。在用Promega裂解试剂(Promega)裂解的0.65um带正电的Q聚乙烯砜真空过滤方法中,将来自超速离心方法中使用的相同四个对象的一个1mL血浆等分试样合并,并且与4mL2X装载缓冲液(20mMTris,pH7)混合。在应用血浆样品前,滤器通过经由真空经过25mL平衡缓冲液(Millipore)进行条件化。随后,使血浆样品经由真空经过滤器。将滤器经由真空用20mL洗涤缓冲液(10mMTris,pH7)洗涤。随后,用Promega裂解试剂裂解微囊泡。将2.25mLPromega裂解试剂应用于膜,并且通过经由真空抽取大约5滴Promega裂解试剂经过滤器进行分配。随后将滤器在室温下温育5分钟,并且经由真空洗脱。为了分离微囊泡RNA,将0.27体积100%异丙醇加入裂解产物中,通过吸管混合,转移至旋转柱,并且以13,000xg离心30秒直至所有裂解产物均应用。柱随后用500ulRNA洗涤溶液(Promega)以13,000xg洗涤两次共30秒。将最后300ulRNA洗涤溶液以13,000xg应用于柱2分钟。为了使膜干燥,将柱以13,000xg离心2分钟。将RNA用20ulH2O洗脱到1.5mLEppendorf管内,并且在室温下温育1分钟,并且以10,000xg离心1分钟。对于所有微囊泡RNA样品,评价质量和浓度,如实施例1中所述。如实施例1中所述合成cDNA。为了测定用于微囊泡RNA过滤的优选裂解缓冲液,且为了比较通过过滤和超速离心分离的微囊泡RNA,使用对于GAPDH、RN7SL、RNaseP、miR-16、miR-150和let-7a特异性的引物和探针,对mRNA和非编码(包括微小RNA)执行RT-PCR,如实施例1中所述。参见图19。实施例20:当在荷电滤器上分离微囊泡时,第二体积的Qiazol不显著改善RNA得率。如实施例1中所述,正常对照血浆得自BioreclamationLLC。使用超速离心或FastTrap腺病毒纯化和浓缩试剂盒(Millipore,Billerica,Ma.,USA)0.65um带正电的Q聚乙烯砜真空过滤,进行4mL血浆微囊泡RNA的分离。如实施例1中所述,将超速离心样品制备、形成团块且裂解。制备用于0.65um带正电的Q聚乙烯砜真空过滤的4mL血浆,并且将滤器平衡、装载有血浆样品且洗涤,如实施例1中所述。用Qiazol裂解滤器微囊泡。将2.25mLQiazol应用于膜,并且通过经由真空抽取大约5滴Qiazol经过滤器进行分配。随后将滤器在室温下温育5分钟,并且经由真空洗脱。用另外2.25mLQiazol重复裂解。分别分离两种裂解产物用于微囊泡RNA。对于超速离心和过滤样品,分离微囊泡RNA,并且评价质量和浓度,如实施例1中所述。参见图20A。如实施例1中所述合成cDNA。为了测定用于微囊泡RNA过滤的优选和所需裂解缓冲液体积数目,且为了比较通过过滤和超速离心分离的微囊泡RNA,使用对于GAPDH、RN7SL、RNaseP、miR-16、miR-150和let-7a特异性的引物和探针,对mRNA和非编码(包括微小RNA)执行RT-PCR,如实施例1中所述。参见图20B。实施例21:当在荷电滤器上分离微囊泡时,第二体积的Qiazol不显著改善RNA得率。如实施例1中所述,正常对照血浆得自BioreclamationLLC。使用超速离心或3um带正电的Q再生纤维素离心过滤,进行4mL血浆微囊泡RNA的分离。如实施例1中所述,将超速离心样品制备、形成团块且裂解。制备用于3um带正电的Q再生纤维素离心过滤的4mL血浆,并且将滤器平衡、装载有血浆样品且洗涤,如实施例1中所述。用Qiazol裂解滤器微囊泡。将1mLQiazol应用于膜,并且以100xg分配1秒。随后将滤器在室温下温育10分钟,并且以500xg洗脱5分钟。用另外1mLQiazol重复裂解。分别分离两种裂解产物用于微囊泡RNA。对于超速离心和过滤样品,分离微囊泡RNA,并且评价质量和浓度,如实施例1中所述。参见图21A。如实施例1中所述合成cDNA。为了测定用于微囊泡RNA过滤的优选和所需裂解缓冲液体积数目,且为了比较通过过滤和超速离心分离的微囊泡RNA,使用对于GAPDH、RN7SL、RNaseP、miR-16、miR-150和let-7a特异性的引物和探针,对mRNA和非编码(包括微小RNA)执行RT-PCR,如实施例1中所述。参见图21B。实施例22:使用20nmPES中性注射器式滤器,可以分离微囊泡RNA如实施例1中所述,正常对照血浆得自内部。使用超速离心或ExoMir试剂盒(BiooScientific,Austin,Tx.,USA)20nm中性聚乙烯砜注射器过滤,进行4mL血浆微囊泡RNA的分离。在超速离心方法中,将来自相同对象的4mL血浆等分试样转移至含有8µLRNasinPlus(40U/µl,Promega,Madison,Wi.,USA)RNA酶抑制剂的5mL异质同晶聚合物管(Beckman-Coulter,Miami,Fl.,USA),并且在室温下温育5分钟。在温育后,将血浆用1mLPBS稀释。如实施例1中所述,将微囊泡形成团块且裂解。在20nm中性聚乙烯砜注射器过滤方法中,将来自超速离心方法中使用的相同对象的4mL用200ul蛋白酶K(>600mAU/ml,Qiagen)在室温下处理15分钟。在温育后,使血浆经由注射器经过一叠滤器(0.8um中性混合纤维素酯滤器(Millipore)+20nm中性聚乙烯砜滤器(BiooScientific)。该叠滤器经由注射器用20mLPBS进行洗涤。随后,弃去0.8um中性混合纤维素酯滤器,并且仅经由注射器从20nm中性聚乙烯砜滤器中去除残留流体。对于裂解,经由注射器将700ulQiazol应用于滤器且分配。随后将滤器在室温下温育20秒且通过注射器洗脱。对于超速离心和过滤样品,分离微囊泡RNA,并且评价质量和浓度,如实施例1中所述。参见图22A。根据制造商的方案,使用SuperScriptVILOcDNA合成试剂盒(Invitrogen,Carlsbad,Ca.,USA),将微囊泡RNA总体积的七分之六转换为cDNA。为了比较通过过滤和超速离心分离的微囊泡RNA,使用对于GAPDH、RN7SL、18S、BRAF、HERVK和PO特异性的引物和探针,对mRNA和非编码执行RT-PCR。对于GAPDH、18S和PO,扩增反应在20ul体积中执行,所述20ul体积含有2XTaqman基因表达预混物(AppliedBiosystems,FosterCity,Ca.,USA)、20XTaqman基因表达测定(AppliedBiosystems,FosterCity,Ca.,USA)、以及cDNA的1:20级分。对于RN7SL,扩增反应在20ul体积中执行,所述20ul体积含有2XTaqman基因表达预混物、900nMRN7SL正向CAAAACTCCCGTGCTGATCA(SEQIDNO1)、900nMRN7SL反向GGCTGGAGTGCAGTGGCTAT(SEQIDNO2)、250nMRN7SL探针TGGGATCGCGCCTGT(SEQIDNO3)、以及cDNA的1:20级分。对于BRAF,扩增反应在20ul体积中执行,所述20ul体积含有2XTaqman基因表达预混物、900nMBRAFWT正向AAAAATAGGTGATTTTGGTCTAGCTACAGT(SEQIDNO4)、900nMBRAFJSE15反向TGGATCCAGACAACTGTTCAA(SEQIDNO6)、250nMBRAFAZE15探针GATGGAGTGGGTCCCATCAG(SEQIDNO7)、以及cDNA的1:20级分。对于HERVK,扩增反应在20ul体积中执行,所述20ul体积含有2XTaqman基因表达预混物、900nMHERVK正向ACCCAACAGCTCCGAAGAGA(SEQIDNO8)、900nMHERVK反向CCCCACATTTCCCCCTTT(SEQIDNO9)、HERVK探针CGACCATCGAGAACAG(SEQIDNO10)、以及cDNA的1:20级分。扩增条件如实施例1中所述。参见图22B。实施例23:使用20nmPES中性注射器式滤器,可以分离微囊泡RNA如实施例1中所述,正常对照血浆得自BioreclamationLLC。使用超速离心或20nm中性聚乙烯砜注射器过滤(Tisch,NorthBend,Oh.,USA),进行4mL血浆微囊泡RNA的分离。如实施例1中所述,将超速离心样品制备、形成团块且裂解。在20nm中性聚乙烯砜注射器过滤方法中,将来自超速离心方法中使用的相同四个对象的一个1mL血浆等分试样合并,并且经由注射器经过滤器。滤器经由注射器用20mLPBS进行洗涤。随后,经由注射器去除残留流体。对于裂解,经由注射器将700ulQiazol应用于滤器且分配。随后将滤器在室温下温育20秒且通过注射器洗脱。对于超速离心和过滤样品,分离微囊泡RNA,并且评价质量和浓度,如实施例1中所述。参见图23A。如实施例22中所述合成cDNA。为了比较通过过滤和超速离心分离的微囊泡RNA,使用对于GAPDH、RN7SL和RNaseP特异性的引物和探针,对mRNA和非编码执行RT-PCR。对于GAPDH和RNaseP,扩增反应在20ul体积中执行,所述20ul体积含有2XTaqman基因表达预混物(AppliedBiosystems,FosterCity,Ca.,USA)、20XTaqman基因表达测定(AppliedBiosystems,FosterCity,Ca.,USA)、以及cDNA的1:10级分。对于RN7SL,扩增反应在20ul体积中执行,所述20ul体积含有2XTaqman基因表达预混物、900nMRN7SL正向(SEQIDNO1)、900nMRN7SL反向(SEQIDNO2)、250nMRN7SL探针(SEQIDNO3)、以及cDNA的1:10级分。扩增条件如实施例1中所述。参见图23B。实施例24:使用20nmPES中性注射器式滤器(Tisch)的微囊泡miRNA分离使用20nmPES中性注射器式滤器(Tisch),可以分离微囊泡miRNA。参见图24。实施例25:RNA对微囊泡捕获的作用微囊泡捕获是RNA依赖性的。一些RNA与其他相比较在滤器上更有效捕获(GAPDH相对于miR-451)。这可以取决于RNA是否受蛋白质和/或微囊泡保护且取决于微囊泡大小。参见图25。实施例26:使用中性滤器的微囊泡RNA分离使用30nm和50nmPES中性注射器式滤器,可以分离微囊泡RNA。参见图26。使用以旋转柱形式的0.2umPES中性滤器(Pall),可以分离微囊泡RNA。参见图27。使用0.8umPES中性注射器式滤器,可以分离微囊泡RNA。参见图28。使用以旋转柱形式的0.8umPES中性滤器(Pall),可以分离微囊泡RNA。参见图29。当在中性PES滤器上分离微囊泡时,微囊泡RNA得率受裂解缓冲液类型影响。参见图30。在20nmPES中性注射器式滤器上的微囊泡RNA分离中,用Qiazol的另外洗脱不显著改善RNA得率。参见图31。当在中性滤器上分离微囊泡时,微囊泡稳定性和/或微囊泡RNA得率受洗涤步骤影响。参见图32。RNA粘在以注射器形式的20nmPES滤器上,且不能容易洗脱出。较大的RNA(例如GAPDH)比较小的RNA(let-7a)更难以洗脱出。参见图33。实施例27:使用珠的微囊泡RNA分离本文提供的研究证实使用荷电或中性(磁性)珠用于分离微囊泡RNA的可行性。这些研究证实在电荷或官能团、结合和洗涤缓冲液、珠装载/浓度和/或温育时间的多种不同条件下,由珠的亲和捕获。关于用珠的微囊泡分离和RNA提取的一般流程图显示于图34中。不同类型的磁珠的筛选:在本文描述的研究中评估下述四个类型的磁珠:使用这些类型的珠各自获得的微囊泡分离和回收显示于图35和36中。结果显示胺(JAM)官能化和羧基(CMX)官能化的珠在大多数靶中类似地捕获微囊泡,如用RT-qPCR评估的。使用季胺珠的微囊泡RNA分离:环氧珠用咪唑进行处理,以生成咪唑鎓阳离子,或用TEA进行处理,以产生带正电的季胺,其中预期是这些带正电的胺可以比1°或2°胺更高效地捕获微囊泡。在该研究中使用的方法的概述呈现于图37中。评估下述类型的胺磁珠:使用RT-qPCR评估微囊泡捕获。简言之,执行下述步骤:通过Qiazole方法的捕获微囊泡的裂解和总RNA的提取;用QiagenmiRNeasy试剂盒/MinElute柱(20uL)的总RNA纯化;在Bioanalyzer(1uL)上检查的RNA概况;使用VILORT试剂盒(12uL)和MicroRT试剂盒(4uL)的RT反应;对下述靶使用2uLcDNA的实时PCR:VILO产品(GAPDH(新测定试剂盒)、RN7SL、RNaseP、B2M、GUSB、HPRT1)和MicroRT产品(miR16、miR150、Let-7a)。使用所选mRNA靶测试的微囊泡分离结果显示于图38中,并且来自分离的微囊泡的所选mRNA靶的回收显示于图39中。使用所选微小RNA靶测试的微囊泡分离结果显示于图40中,并且来自分离的微囊泡的所选微小RNA靶的回收显示于图41中。重现性研究:在本文描述的研究中评估使用TEA处理的珠的微囊泡分离的重现性。简言之,用TEA珠、0.4mL血浆库BH11、qiazole裂解和总RNA提取(miRNeasy试剂盒),执行一式三份的微囊泡分离。结果概括显示于下表中:数据概括:用TEA珠的一式三份的微囊泡分离初步结果显示TEA珠看起来在微囊泡分离中比咪唑珠好1至2倍。RT-qPCR结果显示在上清液和珠提取之间的微囊泡RNA分布中的基因依赖性模式:·GAPDH和RN7SL:接近于1:1分布·RNaseP:2.1-2.8X在珠中>在上清液中·B2M:6.6-7.3X在珠中>在上清液中·miR16:3.3-6.5X在珠中>在上清液中·Let-7a:4.6-7.1X在珠中>在上清液中·GUSB:2-3X在上清液中>在珠中·HPRT1:3X在上清液中>在珠中·miR150:3-4X在上清液中>在珠中不预期受理论束缚,数据提示可以存在荷有不同表面(膜)特征,例如电荷、极性等的多类微囊泡。除其膜性质之外,每类微囊泡同样可以携带不同的RNA表达模式。使用其他珠的微囊泡分离的证实:本文描述的研究设计为证实使用其他季胺或磺酸盐官能化的非磁性离子交换珠的微囊泡分离。评估下述珠:商业制造的(Hamilton);季胺(阳离子)树脂:PRP-X400和磺酸盐(阴离子交换)树脂:RCX30。每个珠类型的特征概括于下表中:测试的阳离子交换树脂测试的阴离子交换树脂使用所选mRNA靶的对于非磁性珠的微囊泡分离结果显示于图42中,其中X是阳离子的并且R是阴离子的。这些所选mRNA靶的回收显示于图43中。使用所选微小RNA靶的对于非磁性珠的微囊泡分离结果显示于图44中,其中X是阳离子的并且R是阴离子的。这些所选微小RNA靶的回收显示于图45中。总之,结果显示微囊泡无法由阳离子交换树脂进行检测,如由对所选mRNA和微小RNA靶的RT-qPCR分析的。阴离子交换树脂类似于TEA处理的磁珠捕获在所测试的RNA靶上的微囊泡。观察到在上清液和珠提取之间的微囊泡RNA分布中的基因依赖性模式:·GAPDH、GUSB、RN7SL、HPRT:接近于1:1分布·RNaseP:2.5X在珠中>在上清液中·B2M:10-15X在珠中>在上清液中·miR16:~2X在珠中>在上清液中·Let-7a:~3.5X在珠中>在上清液中·miR150:3-4X在上清液中>在珠中微囊泡与所选对照珠的结合的评估:在本文描述的研究中,评估与多种对照珠的结合的本底水平。在这些研究中,使用未经处理的环氧珠和未官能化的聚苯乙烯珠。特别地,测试下述珠:测试的对照珠:使用所选mRNA靶的对于对照珠的微囊泡分离结果显示于图46中,并且这些所选mRNA靶的回收显示于图47中。使用所选微小RNA靶的对于对照珠的微囊泡分离结果显示于图48中,并且这些所选微小RNA靶的回收显示于图49中。总之,用两种阴离子交换剂(HamiltonTEA树脂和内部TEA修饰的珠)两者均观察到相似的微囊泡分离模式。磺酸盐交换剂(阳离子交换树脂)显示极弱的微囊泡回收,如经由RT-qPCR评估的。不预期受理论束缚,这可以是由于弱微囊泡捕获和/或RT-qPCR抑制剂从阳离子树脂中浸出。然而,使用羧基珠(阳离子的)的初步研究未显示与磺酸盐树脂一样的此类效应;因此,它可能不是阳离子交换剂的一般问题。结果显示在上清液和珠提取之间的微囊泡RNA分布中的基因依赖性模式。再次,不预期受理论束缚,数据提示可以存在荷有不同表面(膜)特征,例如电荷、极性、蛋白质(抗原)、碳水化合物等的多类微囊泡。所观察到的差异RNA表达可能与其微囊泡起源间接相关。实施例28:捕获效率和RNA得率的珠滴定效应在本文描述的研究中,使用固定的血浆体积(0.4mL)和渐增量的珠(以将珠与微囊泡比(在本文中也称为B:E比)从0.05:1扩展到20:1)评估四类珠。下表呈现用于这些研究中的微囊泡RNA分离的磁珠的特征:该研究中的珠滴定对于珠A和B给出从0.05:1、0.25:1、1:1、2.5:1到5:1的B/E(=珠SA与微囊泡的切割SA的比);对于珠C给出从0.1:1、0.5:1、2:1、5:1到10:1的B/E;并且对于珠D给出从0.2:1、1:1、4:1、10:1到20:1的B/E。标准对照是对于0.4mL血浆的超速离心。在该研究中使用的方法的概述显示于图50中。微囊泡捕获的评估经由RT-qPCR执行。实时PCR对下述7种靶执行,并且使用超速离心结果作为100%计算回收:VILO产品(GAPDH、RN7SL、RNaseP、B2M、GUSB和HPRT1)和MicroRT产品(Let-7a)。关于每种靶根据B:E比的回收百分比显示于图51A-51G中。在个别和混合珠之间的Ct比较显示于图52中,其中关于所有靶的珠/微囊泡比均为2:1。来自混合珠的Ct值类似于珠C(PM),即显著高于个别珠,除了let-7a靶之外。不预期受理论束缚,这最可能是珠C的抑制效应。在个别和混合珠之间的回收比较显示于图53中,其中关于所有靶的珠/微囊泡比均为2:1。来自混合珠的回收%类似于珠C,即对于所有靶均显著低于个别珠,除了let-7a之外。不预期受理论束缚,对于混合珠的弱回收最可能是来自珠C的抑制效应。关于每种靶的回收%概括显示于下表中:总之,关于所选RNA靶的珠滴定研究显示如先前研究(用珠A和B测试的)中所选择的珠/微囊泡的2.5:1比,实现关于大多数基因(除了RNAseP、GAPDH之外)的饱和水平。结果显示微囊泡通过具有不同表面特征(荷电、中性、疏水的等)的珠捕获。不预期受理论束缚,这与先前假设一致:可以存在荷有不同表面(膜)特征,例如电荷、极性等的多类微囊泡。除其膜性质之外,每类微囊泡同样可以携带不同的RNA表达模式。珠C(PM)看起来对测试的所有靶均是抑制性的,除了let-7a之外。抑制可以处于RT水平(关于let-7a的microRT试剂盒)或微囊泡捕获。A、B、C和D珠的混合表现类似于珠C,提示抑制由珠C遗传。这还降低抑制对微囊泡捕获起作用的可能性。抑制来源可以通过从4种珠的混合中简单地消除C加以证实。实施例29:使用固定的珠与微囊泡比的血浆体积滴定在本文描述的研究中,使用四类珠评估血浆滴定,以评估以固定的珠:微囊泡比的微囊泡回收。使用的珠的特征显示于下表中:在1XPBS中具有0.4、1、4mL血浆的超速离心用作对照。珠等分试样如下表中所示进行制备:*注:关于珠A-1mL和珠B-1mL的管从磁性分离器中跌落,这导致两个样品中的一些珠丧失。在这些研究中使用的方法的概述显示于图54中。关于每种靶的平均Ct值显示于图55A-55G中。关于以5:1的珠:微囊泡比的多种靶的回收比较和从0.4mL、1mL到4mL的血浆滴定显示于图56中。回收%结果的概括显示于下表中:总之,以固定的珠/微囊泡比(5:1)的血浆滴定显示在0.4、1和4mL血浆体积范围内的中等重现性。实施例30:在血浆中的珠-微囊泡结合的时间过程研究在本文描述的研究中,环氧磁珠(EPM-30)就来自0.4mL血浆的与微囊泡(以5:1的珠:微囊泡比)的结合进行评估。下表呈现了用于这些研究中的微囊泡分离的磁珠:在这些研究中使用的方法的概述显示于图57中。与0.4mL血浆(B/E=5:1)混合的EPM-30珠的五个等分试样在4℃下(在转子上)温育,并且在1分钟、5分钟、15分钟、30分钟和60分钟时停止。将珠分离且用1XBB洗涤,随后为Qiazol裂解和使用miRNeasy试剂盒的总RNA分离。对所选mRNA靶和let-7a微小RNA执行RT-qPCR。标准对照是使用0.4mL血浆的超速离心。关于在1分钟、5分钟、15分钟、30分钟和60分钟时的环氧珠-微囊泡结合的时间过程研究中,关于多种靶的平均Ct值显示于图58中,并且在相同时间点关于每种靶的回收%值显示于图59中。根据珠-微囊泡结合时间的回收%显示于图60中。结果显示对于除了EGFR之外的所有靶,30分钟(关于HPRT和let-7a15分钟)温育给出最高的微囊泡RNA检测。信号在60分钟时开始下降。EGFR用极弱信号检测到(在5分钟时~4.4%回收)。每个单一类型的珠(环氧)看起来类似表现(在回收%方面)(如先前观察到的)。未来研究将设计为评估捕获至一个珠类型的微囊泡是否与其他类型珠结合的那些微囊泡相同,但通过不同亲和力/相互作用结合。实施例31:与环氧珠的微囊泡结合的另外研究本文描述的研究设计为评估(如果未完全捕获)上清液中的剩余微囊泡是否可以进一步通过另外的新鲜珠捕获,并且评估与Eppendorf管的微囊泡吸附的本底水平。这些研究的概述显示于图61中。简言之,这些研究使用下述步骤执行:·执行一个血浆(0.4mL,在1mL1XBB中预混合)与两个环氧珠等分试样(B/E比=5)的序贯结合。监控上清液中存在的结合珠的微囊泡(与两个等分试样)以及游离的未结合的微囊泡。·通过将预混合的血浆(0.4mL)加入空Eppendorf管执行模拟珠结合。监控上清液中存在的结合管的微囊泡以及游离的未结合的微囊泡。·经由RT-qPCR测量上清液中与珠/管结合或游离的微囊泡的量,并且表示为所选RNA靶的量(注:qPCR作为单一靶测定执行)。关于收集级分(仅环氧珠)中的多种RNA靶的平均Ct值显示于图62中,并且关于这些RNA靶的回收百分比显示于图63中。对于EGFR或BRAF标准测定高线性(R2>0.99)曲线,指示对于任一靶可靠的RT-qPCR测定。来自序贯珠结合研究的结果显示微囊泡主要(90~124%)捕获至第一个珠等分试样,并且<10%捕获至第二个珠等分试样。然而,在上清液中仍存在7~59%微囊泡,提示这些微囊泡或是失活的或不处于珠结合的最佳条件下。模拟珠结合结果显示微囊泡视为专一地在上清液中,其中仅0.05~0.51%吸附至管。虽然EGFR微囊泡的捕获仍存在问题,但将执行关于筛选和测试多种珠的未来研究。本文提供的研究已证实使用珠(磁性或非磁性)的微囊泡分离的可行性,所述珠将是临床效用中的更合适形式。结果显示带正电、带负电和中性的珠均显示良好的微囊泡捕获效率。该观察提示它们可以作用于在微囊泡表面上的不同配体,因此一个微囊泡可以经由不同(多重)力用不同(官能化)颗粒捕获。实施例32:EXO50微囊泡分离和RNA提取该实施例描述了用于微囊泡分离、后续RNA提取和RNA制剂的靶表达分析的EXO50旋转柱和方案。在该实施例中所述的方法用于下述实验,任选伴随如具体工作实施例中所述的一些变化。EXO50旋转柱,在本文中称为EXO50,包含膜滤器(优选地,Q官能化的)。柱还可以包括柱支架,其使膜滤器保持在外熔块和内管之间(图64)。将柱置于收集管中(图65)。在将生物样品加入膜滤器之后,将柱旋转,并且弃去流通物。将洗涤缓冲液加入膜中,并且将柱旋转,并且弃去流通物。需要时,可以重复洗涤步骤。随后将裂解缓冲液即Qiazol加入膜中,用于微囊泡的裂解和微囊泡RNA的后续释放。将柱再次旋转以收集微囊泡RNA。可以通过氯仿提取和乙醇条件化,和/或使用二氧化硅柱且从二氧化硅柱中洗脱分离的RNA来执行RNA提取。通过定量PCR的RNA靶的后续检测用于测量微囊泡分离和/或RNA提取的质量。一旦从微囊泡级分中提取RNA,就例如通过使用用于mRNA的SuperscriptII®VILOcDNA合成试剂盒(LifeTechnologies)或用于短RNA的miScriptIIRT试剂盒(Qiagen),将RNA逆转录成cDNA。使用特异性RNA靶引物和任选的探针执行定量PCR或Taqman分析,以测定Ct值。表达分析一式两份或一式三份执行。选择多种RNA靶用于表达分析。检测到大(即核糖体RNA和信使RNA)和小RNA(即miRNA)。检测到的核糖体RNA的例子包括18S和28S。靶信使RNA包括看家基因,例如HPRT1、GAPDH。其他信使RNA包括癌症特异性基因,例如野生型(wt)BRAF、突变的BRAFV600E。靶miRNA的例子包括let7a、miR16。在一些实验中,评价来自对照颗粒例如Qβ的靶基因(即Qβ外壳蛋白质)。实施例33:不同膜滤器的分析适合于分离微囊泡的膜滤器优选是荷电的。下表呈现了适合分离微囊泡的多类膜滤器:样品编号膜分离方法官能团(1)+(7)再生纤维素,>3µm孔径(“RC/WBAE”)弱碱性阴离子交换剂二乙胺R-CH2-NH+(C2H5)2(2)+(8)再生纤维素,>3µm孔径(“RC/SACE”)强酸性阳离子交换剂磺酸R-CH2-SO3-(3)+(9)再生纤维素,>3µm孔径(“RC/SBAE”)强碱性阴离子交换剂季铵R-CH2-N+(CH3)3(4)+(10)金属螯合物膜,3-5µm,孔径(“MCM”)金属螯合物膜亚氨基二乙酸–N(CH2COOH-)2(5)+(11)再生纤维素偶联膜,0.45μm孔径(“RCCM”)微孔膜醛-CHO(6)+(12)DEAE纤维素纸(“DEAE”)弱碱性阴离子交换剂DEAE纤维素纸评价上表中列出的膜各自用于分离微囊泡的能力。具体地,RNA靶信号(Ct值)的评价测定为定量微囊泡分离的质量的方法。使用下述膜分离微囊泡:再生纤维素膜例如由再生纤维素强化的强化型稳定纤维素膜、金属螯合物膜、再生纤维素偶联膜和DEAE纤维素纸。关于测试的每种膜的分离方法显示于上表中。将生物样品加入含有不同膜的柱中,类似于实施例32中所述的柱。弃去流通物,并且使用裂解缓冲液例如在膜上裂解微囊泡。随后使用二氧化硅柱提取微囊泡RNA。通过qPCR分析测定mRNA靶基因GAPDH、HPRT和野生型(wt)BRAF以及miRNA靶基因hsa-let-7a和hsa-miR16的检测(图66)。每种膜滤器关于每种特异性靶基因获得的Ct值的比较证实膜各自成功地从生物样品中分离微囊泡的能力。关于每种膜的所有缓冲条件是相同的。如图66中所示,所有膜均能够分离足以用于RNA提取和至少一种RNA靶检测的微囊泡。然而,膜RC/SBAE;RC/WBAE;和RCCM表现优于测试的其他膜。与所有其他膜相比较,RC/SBAE官能化的膜表现最好。具体地,对于测定的mRNA和miRNA靶各自,与来自微囊泡级分的任何其他膜相比较,更低的Ct值得自通过RC/SBAE膜分离的微囊泡的RNA制剂。在下述实施例中所述的EXO50柱的捕获表面包含RC/SBAE膜。这些结果证实带正电(阴离子)的离子交换膜在生理学pH下纯化囊泡。然而,带负电的离子交换在生理学pH下无效纯化囊泡。图71显示了如通过扫描电子显微镜检查检测的,与EXO50膜结合的微囊泡。箭头指示捕获的微囊泡。实施例34:EXO50膜输入容量接下来,通过滴定加入膜中的输入血浆体积的量,评价RC/SBAE膜的输入容量。将体积渐增的样品输入加入RC/SBAE膜中;例如0.5ml、1.0ml、2.0ml、4.0ml、8.0ml和16ml血浆。如实施例32中所述,分离微囊泡级分且提取微囊泡RNA。执行QPCR分析,以检测mRNA基因wtBRAF和HPRT1以及miRNAslet7a、miR16和18S。如图67中所示,关于mRNA和miRNA基因两者的qPCR信号由0.5ml-4.0ml的样品线性增加(即Ct值中的线性减少)。然而,大于4.0ml(即8.0ml和16ml)的样品未能证实检测到的信号中的另外增加。这些结果指示大于4ml的样品体积未显示出任何增加。在图68中,来自通过EXO50分离的微囊泡级分提取的RNA的拷贝数与来自流通物的拷贝数相比较。该实验鉴定使膜饱和的样品输入的最大体积,从而使得微囊泡存在于流通物中,并且将检测到来自流通物的RNA信号。例如,当与由4.0ml的样品检测到的信号相比较时,大于4.0ml的输入体积未证实线性增加的信号。与这些结果一致,由流通物检测到的信号对于大于4.0ml的体积增加。多种靶基因的相对表达水平在第一个EXO50柱中的生物样品的初始装载和分离之间与第二个EXO50柱中的流通物进行比较。将生物样品加入EXO50中,其中微囊泡分离、RNA提取和靶基因分析如实施例32中所述执行。来自第一个EXO50柱的流通物随后装载到第二个EXO50柱,用于微囊泡分离、RNA提取和靶基因分析,使用与用于第一个EXO50柱的初始生物样品相同的方法。测试不同体积的初始生物样品(0.5ml–16ml血浆)。靶基因包括mRNA靶:wtBRAF、GAPDH和HPRT1;以及miRNA:let7a、miR16;和核糖体RNA18S。每种靶基因的表达水平针对由第一个装载步骤检测到的相应靶基因的表达水平标准化。如图69中所示,来自0.5ml-4.0ml样品的流通物具有任何靶基因的极少表达,指示EXO50已有效捕获来自生物样品的所有微囊泡。相比之下,来自8.0ml和16ml样品的流通物显示对于一些靶基因检测到的表达中的至少10%增加,和对于其他靶基因检测到的最高达200%增加。这些结果显示来自更大样品输入体积的流通物仍含有从第二个EXO50柱中分离的微囊泡,从而证实8ml和16ml的样品体积无法完全被耗尽微囊泡。此外,这些结果证实无需两个分离和裂解步骤以分离来自0.5ml-4ml生物样品的所有微囊泡。实施例35:测定耗尽样品的膜层数对于来自4.0ml血浆样品的微囊泡RNA的完全耗尽,评价膜层数。将一至六层RC/SBAE彼此邻近放置于EXO50柱中。如实施例32中所述,从样品和流通物中提取且分析微囊泡RNA。评价的靶基因是wtBRAF和GAPDH。图70中所示的结果显示一和两层不足以捕获来自样品的所有微囊泡,如通过由流通物(滤液)数据点检测到的信号证实的。然而,具有4层或更多层的柱未显示来自输入数据点的信号中的任何增加,而流通物(滤液)完全耗尽任何信号。因此,这些结果显示3层是确保足够的微囊泡捕获最佳的,而将层数增至4或更大未获得关于微囊泡捕获的任何附加利益。实施例36:用于微囊泡分离的EXO50缓冲条件使用如实施例32中所述的EXO50柱和方法,就最佳微囊泡分离评价多种缓冲条件。评价加入每种样品用于装载到柱上的不同装载缓冲液。所测试的缓冲液包括:·160mMTris、142mMCl-,pH7.0·192mM咪唑;159mMCl-,pH6.5-6.8·300mMBisTris、211mMCl-,pH6.3-6.4·40mM柠檬酸盐、124mMNa+,pH6.7-6.9·50mM磷酸盐、265mMNa+、185mMCl-,pH7.0-7.2·80mM双[三(羟甲基)甲基氨基]丙烷、14mMCl-,pH6.7.如图72中所示,所有缓冲液均导致成功的微囊泡分离,从而使得检测到RNA靶BRAF、GAPDH和HPRT。还评价不同pH条件。缓冲液以2XPBSpH2.0,pH4.75,pH10.25和pH13.0制备用于装载样品。洗涤缓冲液是1X。在装载到EXO50柱内之后,将1000个Qβ拷贝掺料到样品内。具有渐增pH的缓冲液证实最佳缓冲条件在pH2-10.25之间,而极碱性缓冲液导致更不有效的微囊泡分离(图73)。用于分离的最佳范围在pH4-8之间。测试具有不同量的去污剂的缓冲剂,以显示该过程对于具有不同强度的去污剂的缓冲液是耐受的。图74证实在结合和洗涤缓冲液两者中最高达0.001%的SDS、最高达0.01%的TritonX-100和最高达0.1%Tween的去污剂导致成功的微囊泡分离和后续微囊泡RNA提取分析。实施例37:EXO50RNA制备图76中所示的结果证实通过EXO50纯化的RNA是PCR可扩增的RNA,即适合于扩增和PCR加工,并且EXO50从大体积的血浆分离与超速离心相同量和质量的RNA。4ml血浆样品或通过EXO50或通过超速离心进行加工。RNA靶(wtBRAF、GAPDH、Qβ、let7a、miR16)分离和检测的比较显示EXO50纯化与通过超速离心获得的相似质量的RNA。就一些靶基因而言,EXO50显示具有改善的RNA质量,如通过增加的Ct信号指示的。此外,EXO50纯化来自微囊泡的高百分比的mRNA。例如,EXO50纯化来自商购可得的癌症外来体或癌细胞培养上清液的100%mRNA。通过EXO50或通过直接裂解(使用QiagenmiRNeasyRNA分离试剂盒)加工来自结肠癌细胞系的商购可得的癌症外来体的渐增输入(150、1500和3000ng)。图78中所示的结果证实来自EXO50加工的流通物未显示mRNA的检测(对于RPL0无Ct信号,和对于GAPDH极高的Ct信号),因此指示从样品的微囊泡级分中成功提取100%的mRNA。EXO50RNA制剂还含有极少污染DNA。来自未逆转录(-RT)的RNA制剂的某些靶检测的本底水平显示存在污染DNA的一定本底水平(图79)。EXO50RNA制剂用RNA酶A进行消化,其显示对于靶基因的Ct信号丧失,以显示制剂主要含有RNA和极少的污染DNA。RNA酶消化的RNA制剂的QPCR分析显示极低的BRAF本底水平,类似于当样品未逆转录时检测到的那种。DNA酶的添加显示去除本底DNA信号,如通过未逆转录的DNA酶消化的样品中的信号丧失所示。实施例38:EXO50操作性实验EXO50对于许多样品的平行加工是稳健的。使用EXO50平行加工八个4ml血浆样品,其中每个样品对于分离中的每个单个步骤已添加3分钟吸取延迟。因此,一个样品如正常进行加工(0分钟),第二个样品伴随每个步骤之间的3分钟进行加工(3分钟),第三个样品伴随每个步骤之间的6分钟进行加工(6分钟)等,其中第八个样品伴随每个步骤之间的21分钟进行加工。对于靶GAPDH、wtBRAF、hsa-miR-142-3p和hsa-miR-92a,即使对于每个步骤之间的21分钟,在检测到的Ct值中也不存在显著差异(图80)。关于分离重复之间的个别测定的标准差小于0.5Ct。该实验证实EXO50过程允许加工一长排重复,而无分离效率中的变化-每个步骤允许长达21分钟吸取时间。在现场实验中比较通过在不同研究场所的不同使用者、使用不同qPCR分析试剂的EXO50过程操作性,以便评价EXO50过程的容易使用性和结果的重现性。在该实验中使用的样品包含来自900次单次抽血的血浆库。样品在干冰上运送至8个不同实验室,一些在不同洲。每个实验室用2ml或0.2ml血浆一式三份执行EXO50过程。执行关于2种mRNA(即wtBRAF、GAPDH)和2种miRNA(即miR-16和let-7a)的RT-qPCR分析,并且结果在图81中比较。在所有实验室中,EXO50操作均是有重现性的,并且PCR输出对于从0.2mL到2mL的血浆输入线性放大。使用相同PCR引物的首次使用者显示非常相似的输出PCR信号(图81)。这些结果证实EXO50关于重现性的稳健性,不依赖于使用者和研究场所。实施例39:EXO50小型旋转柱形式EXO50形式还修改为小型旋转柱形式,以评价其重现性和可扩展性。EXO50小型形式包括微型RC/SBAE膜。还测试微型RC/WBAE和RC/SACE膜用于比较。测试2ml和0.2ml血浆样品。使用标准缓冲液:结合缓冲液(2X)100mM磷酸盐缓冲液、370mMNaCl;洗涤缓冲液(1X)50mM磷酸盐缓冲液、185mMNaCl。来自小型形式的结果也与超速离心相比较。靶mRNA和miRNA的检测显示与微型RC/SACE和微型RC/WBAE膜相比较,微型RC/SBAE膜具有最佳的Ct信号(图84)。EXO50小型形式(RC/SBAE膜)和超速离心之间的比较显示于图83中。实施例40:EXO50与其他方法的比较标准超速离心过程包括使生物样品即血浆预过滤通过0.8μm滤器。随后将滤液装载到超速离心机内,且以>100,000xg旋转1-3小时。去除上清液,并且裂解含有微囊泡的团块。随后使用制造商的方案,在二氧化硅柱即商购可得的RNA分离柱(Qiagen)上纯化微囊泡RNA。来自通过超速离心或通过EXO50提取的RNA的生物分析仪概况的比较就RNA大小分布而言是相似的(图86)。EXO50显示分离小和大RNA两者。微囊泡RNA的分离通过乙醇分级分馏来实现。rRNA(即大RNA)峰在2Kb和4Kb处清晰可见。大多数分离的小RNA在50-200碱基对之间。在超速离心、EXO50和自装配的膜捕获系统之间的比较显示于图87中。自装配的膜捕获系统还包括Q官能化的膜。对于每个柱显示了两次分开的技术重复提取。空心圆圈(miR-16和miR-92a)已知作为游离的循环蛋白质结合的miRNA存在。本文所示的结果证实EXO50和自装配的Q膜导致对于微囊泡RNA靶增加的Ct信号。相似的比较实验也使用0.2ml血浆执行,比较超速离心、直接裂解和EXO50。如图88中所示,对于几乎所有基因,EXO50也表现优于直接裂解。EXO50流通物证实一些miRNA信号仍在流通物中检测到。然而,将样品体积增至4ml血浆显示与超速离心相比较,EXO50具有增加的检测到的Ct信号(图89)。实施例41:癌症突变的EXO50检测重要的是,EXO50显示成功检测来自黑素瘤患者的2ml血浆样品的癌症突变。样品通过超速离心(UC)或EXO50进行加工。拷贝数通过野生型BRAF(wtBRAF)的qPCR分析进行测定,并且与突变的BRAF(BRAFV600E)的拷贝数相比较。如图90中所示,超速离心和EXO50均能够检测wtBRAF拷贝。然而,仅EXO50能够检测突变的BRAFV600E的存在。这些结果证实EXO50能够检测来自微囊泡RNA的癌症突变,而超速离心不能分辨癌症突变的存在。实施例42:EXO51洗脱步骤该实施例显示在RNA裂解和提取前从滤膜中分离微囊泡的任选洗脱步骤,在本文中也称为EXO51。具体地,微囊泡通过洗涤/洗脱步骤从EXO50柱中分离,以从膜中分离完整的分离的微囊泡。将10ml洗涤/洗脱缓冲液两次加入柱中。在一些情况下,与第二次相比较,第一次使用不同的NaCl浓度,而在一些情况下,使用相同的NaCl浓度。例如,185mM、1000mM和2000mMNaCl缓冲液用于第一次洗涤。对于第二次洗涤,使用185mM、1000mM和2000mMNaCl缓冲液。柱以5,000xg旋转1分钟。与EXO50相比较,使用多种洗脱方案,关于多种基因(即GAPDH、BRAF、Kras等)的Ct值比较证实EXO51的RNA分离可与EXO50的那种相比较(图91)。来自EXO51的洗脱微囊泡的扫描电子显微镜检查显示大小50-200nm的微囊泡(图85)。相比之下,通过超速离心分离的微囊泡揭示在分离的微囊泡中更多的纤维状蛋白质结构样材料,其可以潜在影响RNA裂解和提取、RNA纯度和从RNA制剂中检测/扩增RNA序列的能力。EXO51分离含有的颗粒类似于使用UC操作获得的纯化材料,但不类似于来源材料。来自EXO51方法的流通物仍含有不同于纯化的囊泡材料的大量颗粒。对于EXO51方案可以利用另外的浓缩步骤。使用具有不同大小截断值的多种旋转浓缩器(例如VivaSpin20柱),例如使用10,000MW、50,000MW和100,000MW截断浓缩器。将洗脱物旋转5分钟。如果渗余物体积太高(>200µL),则渗余物以5分钟增量旋转至所需体积,即小于200µL。伴随轻轻重悬浮,转移来自浓缩器的上部室(滤器侧)的浓缩洗脱物。通过使用1x洗涤缓冲液,将浓缩洗脱物填充最高达200µL总体积。随后,样品准备用于裂解和RNA提取。浓缩旋转速度和时间对于浓缩微囊泡洗脱物范围为800xg和4500xg,而不显著改变得自RNA表达分析的RNA得率或后续Ct值。实施例43:DNA的EXO52分离EXO50柱还可以用于从血浆中分离所有DNA。除RNA之外,利用EXO50柱用于DNA分离的两种方法在图92(EXO52)和图93(EXO52.2)中描述。具体地,两个过程EXO52和EXO52.2之间的差异在于RNA和DNA提取在EXO52.2中的一个管中合并,用于易于使用、方案的层流和增加的重现性。图94显示EXO50RNA+DNA(EXO52.2)中1.5Ct的增加。图95显示在相分离期间增加氯仿的量将DNA回加到水相,从而使得DNA用正常EXO50操作共分离。在相分离期间的pH水平的进一步优化也将DNA加入制剂中,如图96中所示。因此,如EXO52和EXO52.2中所示,EXO50方法可以用于从血浆样品中分离所有DNA。在相分离后从QIAzol裂解的下层疏水相中回收DNA。与EXO52方法(例如EXO52或EXO52.2)组合的EXO50方法,对于相同样品体积以相似水平分离RNA和DNA,并且RNA和DNA可以彼此分离。与商购可得的分离试剂盒例如Qiagen相比较,公开内容的这些方法捕获相同或更多mRNA和多得多的miRNA。实施例44:来自CSF的EXO60微囊泡分离和RNA提取该实施例证实在本文中称为EXO60的过程中,使用含EXO50RC/SBAE膜的柱,可以从脑脊髓液(CSF)中分离且提取微囊泡RNA。使用来自患者的渐增体积的CSF样品(0.5ml、1ml、2ml和4ml)执行滴定实验。CSF样品在冷冻前通过0.8um滤器预过滤。如实施例32中所述,使CSF通过柱进行加工。来自qPCR分析的结果显示于图97中,并且显示关于靶基因(mRNA和miRNA两者)的Ct信号随着样品体积线性增加。该实验证实EXO60从CSF样品中成功分离微囊泡。执行另外的实验,比较来自不同患者样品和来源的EXO60和超速离心。还评价来自EXO60分离的流通物和来自超速离心的上清液,以确定微囊泡提取的质量。评价的基因是mRNA靶GAPDH和HIF1A,并且miRNA靶向hsa-miR-16和hsa-miR-124-3p。如图99中所示,成功分离微囊泡RNA,类似于得自超速离心的结果。如图100中所示,EXO60比基于大小过滤或超速离心的方法更好地从CSF中分离RNA。对于EXO60,使用70%EtOH提取RNA,而uCSC提取使用30%异丙醇,并且UC提取使用60%EtOH。EXO60证实在至少0.2-2mLCSF输入范围内的线性PCR输出。在EXO60的流通物中,仅发现一些miR-16miRNA,并且未发现GAPDH和HIF1AmRNA。与uCSC提取形成对比,miR-16仅在柱级分中发现,并且GAPDH和HIF1A以及一些miR-16在流通物级分中发现。UC提取显示大多数mRNA和miRNA保留在上清液中。在团块级分中未发现HIF1a且仅发现一些GAPDH。实施例45:来自尿的EXO70微囊泡分离和RNA提取本文呈现的研究设计为比较基于EXO50的微囊泡RNA分离,在本文中被称为EXO70,与基于过滤的分离(uCSC)。每种分离方法使用20ml尿样品运行。对于EXO70分离,根据实施例32提取且分离RNA,但对于仅mRNA捕获使用30%EtOH。对于uCSC分离,根据实施例32提取且分离RNA。如图101中所示,当乙醇条件化调整至仅分离大RNA时,通过EXO70和过滤分离的RNA展示相似的RNA大小分布。该研究还证实两种方法均获得相同强度的PCR信号。如图102、103A和103B中所示,来自EXO70的流通物装载至新鲜的uCSC柱获得对于mRNA信号高得多的Ct值(约8Ct值),指示在流通物中仅剩下小于1%信号。因此,EXO70以>99%效率捕获mRNA和miRNA,因为在流通物中剩下小于1%的mRNA和miRNA。来自装载到EXO70柱上的uCSC的流通物对于4个患者中的2个中的mRNA获得很少至无信号,并且如果存在可检测的信号,则它比柱上数据点高约15Ct值。在EXO70和uCSC两者的尿流通物中均剩下小于1%的mRNA信号。实施例46:细胞上清液样品中的EXO50微囊泡分离本文呈现的研究设计为测试EXO50方法和试剂盒对细胞上清液样品的使用。样品如上文实施例32中所示进行加工。如图104和105中所示,EXO50从人细胞培养上清液中分离囊泡RNA。如图105中所示,使用不同浓度的2x结合缓冲液(BB)与Gli36细胞系上清液。其他实施方案虽然本发明已与其详述结合进行描述,但前述说明书预期举例说明而不是限制由所附权利要求的范围限定的本发明的范围。其他方面、优点和修饰在下述的范围内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1