阿比特龙衍生物的药代动力学评估方法与流程
本发明涉及一种阿比特龙衍生物的药代动力学评估方法,属于药理学研究技术领域。
背景技术:
前列腺癌是男性最常见的恶性肿瘤之一,全球范围内,前列腺癌发病率居于男性所有恶性肿瘤中的第二,在癌症相关的死亡率中排第五。亚洲国家前列腺癌的发病率逐渐上升,相比于西方国家,亚洲国家前列腺癌患者中,晚期和转移性前列腺癌患者所占比例较大。截止2012年我国肿瘤登记地区前列腺癌发病率为9.92/10万,列男性恶性肿瘤发病率的第6位,已经成为严重威胁我国人民健康和生命的一大杀手。内分泌治疗是目前晚期前列腺癌的主要治疗方法,大多数患者起初都对去势(手术或药物)或联合雄激素阻断治疗有效,但经过14~30个月的中位时间后,大部分患者病变将逐渐发展为去势抵抗性前列腺癌(Castration Resistant Prostate Cancer,CRPC),其中位生存期小于20个月。因此,开发能有效对抗CRPC的药物是关系国计民生的重大问题。
醋酸阿比特龙(商品名:ZYTIGA)是CYP17的一种抑制剂(17α-羟化酶/C17,20-裂解酶),于2011年4月28号被美国FDA批准上市。ZYTIGA与泼尼松联用适用于曾接受既往含多烯紫杉醇化疗转移的去势难治性前列腺癌(CRPC)患者的治疗[1-2]。
技术实现要素:
针对现有技术中的缺陷,本发明的目的是提供一种阿比特龙衍生物的药代动力学评估方法。
本发明是通过以下技术方案实现的:
本发明提供一种阿比特龙衍生物的药代动力学评估方法,其包括如下步骤:
将雄性小鼠进行去势手术后,接种LNCaP/AR细胞;
将所述雄性小鼠等效分为醋酸阿比特龙-170mg/kg组、醋酸阿比特龙联合泼尼松组、受试药阿比特龙衍生物-300mg/kg组、阿比特龙衍生物-200mg/kg组、阿比特龙衍生物联 合泼尼松组、溶剂对照组和泼尼松-2mg/kg共七组;
采用经口灌胃给药,对所有组别的雄性小鼠按照组别每天给药一次,连续给药28天,定期测定体重及肿瘤体积,末次给药后24小时,收集血清测定前列腺特异性抗原(PSA)浓度,并取肿瘤、精囊腺和前列腺进行称重,并计算得到相对肿瘤体积、相对肿瘤增殖率、肿瘤体积改变百分比、瘤重抑制率及体重变化百分比。
作为优选方案,所述雄性小鼠为6~7周龄的雄性CB17SCID小鼠。
作为优选方案,接种LNCaP/AR细胞的雄性小鼠的肿瘤体积为100~250mm3。
与现有技术相比,本发明具有如下的有益效果:
受试药阿比特龙衍生物-200mg/kg联合泼尼松后,对去势抵抗性前列腺癌荷瘤小鼠肿瘤增长有较为明显的抑制作用,未呈现明显毒副作用,与同等剂量下的阳性药醋酸阿比特龙-170mg/kg联合泼尼松对肿瘤的抑制作用相当,但还未达到《细胞毒类抗肿瘤药物非临床研究技术指导原则》的有效标准。
附图说明
通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:
图1为溶剂对照组平均相对肿瘤体积生长趋势;
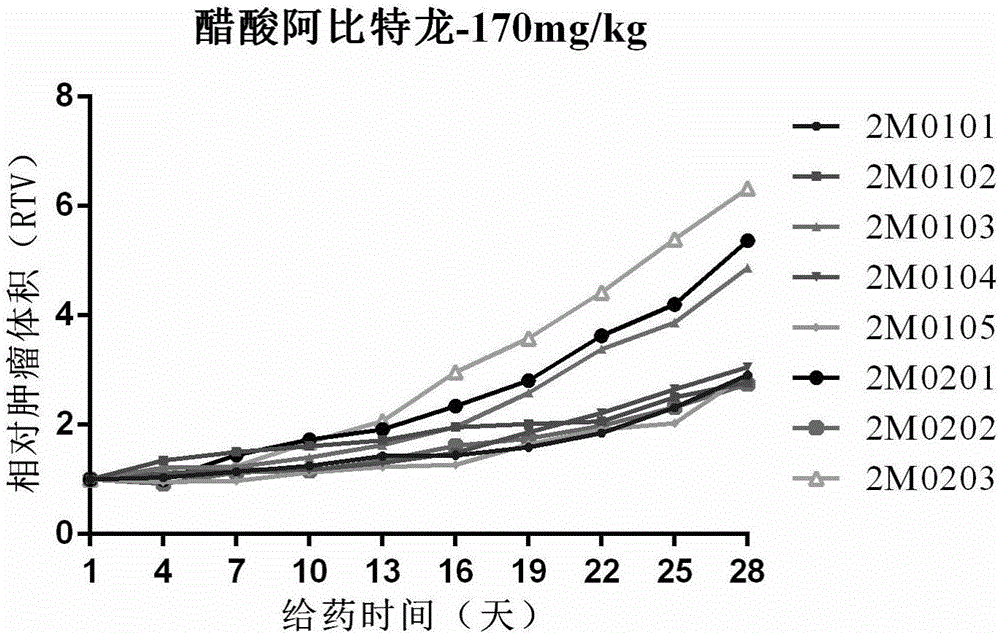
图2为醋酸阿比特龙-170mg/kg组平均相对肿瘤体积生长趋势;
图3为醋酸阿比特龙联合泼尼松组平均相对肿瘤体积生长趋势;
图4为阿比特龙衍生物-300mg/kg组平均相对肿瘤体积生长趋势;
图5为阿比特龙衍生物-200mg/kg组平均相对肿瘤体积生长趋势;
图6为阿比特龙衍生物联合泼尼松组平均相对肿瘤体积生长趋势;
图7为泼尼松-2mg/kg组平均相对肿瘤体积生长趋势。
具体实施方式
下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进。这些都属于本发明的保护范围。
实施例1
1.1试验名称及编号
试验名称:AHS-114的药效评估试验
试验编号:KP19-2015
1.2试验目的
使用AR过表达的人前列腺癌细胞系LNCaP/AR皮下移植的CB17SCID荷瘤小鼠模型,观察阿比特龙衍生物AHS-114对去势抗性前列腺癌的治疗作用。
1.3本试验遵循的法规
《药品注册管理办法》(国家食品药品监督管理局局令第28号,2007年10月01日)[3];
《细胞毒类抗肿瘤药物非临床研究技术指导原则》(国家食品药品监督管理局药品审评中心,2006年11月)[4];
《药物非临床研究质量管理规范》(国家食品药品监督管理局局令第2号,2003年09月01日)[5];
本试验的实施除方案特殊说明外,均遵循本机构标准操作规程(Standard Operating Procedure:SOP)。
2试验材料
2.1供试品
名称或代号:阿比特龙衍生物AHS-114;
来源:上海麦步医药科技有限公司;
性状:白色至类白色粉末;
规格及浓度:99.71%;
批号:Mb039-26-3;
保存条件:常温,密闭干燥避光保存;
注意事项:本品极易吸潮,注意防潮;
有效期:2017.07;
保存地点:四川康城生物科技有限公司供试品存放室;
配制方法:含0.5%甲基纤维素以及0.1%吐温-80的0.9%生理盐水配制[1];
配制后标识:注明试验编号、试验物质名称及浓度、配制体积、保存条件、有效期、责任人及配制日期等;
配制后暂存条件:2~8℃密闭保存;
配制后有效期:1周;
返还及剩余供试品的处理:给药后剩余供试品统一收集到废液桶中。留样供试品参照《供试品的保存》SOP储存于供试品存放室。
2.2对照品
名称或代号:醋酸阿比特龙;
来源:上海麦步医药科技有限公司;
性状:白色至类白色粉末;
规格及浓度:99.87%;
批号:20141101;
保存条件:常温,密闭干燥避光保存;
有效期:2017.07;
保存地点:四川康城生物科技有限公司供试品存放室;
配制方法:含0.5%甲基纤维素以及0.1%吐温-80的0.9%生理盐水配制;
配制后标识:注明试验编号、试验物质名称及浓度、配制体积、保存条件、有效期、责任人及配制日期等;
配制后暂存条件:2~8℃密闭保存;
配制后有效期:1周;
返还及剩余对照品的处理:给药后剩余对照品统一收集到废液桶中。
名称或代号:醋酸泼尼松;
来源:上海麦步医药科技有限公司;
性状:白色至类白色粉末;
规格及浓度:99.5%;
批号:100012-201407;
保存条件:常温,密闭干燥避光保存;
有效期:2017.07;
保存地点:四川康城生物科技有限公司供试品存放室;
配制方法:含0.5%甲基纤维素以及0.1%吐温-80的0.9%生理盐水配制;
配制后标识:注明试验编号、试验物质名称及浓度、配制体积、保存条件、有效期、责任人及配制日期等;
配制后暂存条件:2~8℃密闭保存;
配制后有效期:1周;
返还及剩余对照品的处理:给药后剩余对照品统一收集到废液桶中。
2.3溶剂对照品
名称或代号:含0.5%甲基纤维素及0.1%吐温-80的0.9%生理盐水;
来源:甲基纤维素和吐温-80来自于Sigma,0.9%生理盐水来自于四川科伦药业股份有限公司;
性状:无色澄明液体;
规格及浓度:0.5%甲基纤维素、0.1%吐温-80、0.9%生理盐水;
保存条件:室温密闭保存;
保存地点:四川康城生物科技有限公司供试品存放室;
配制方法:称取所需质量的甲基纤维素,充分溶解于适量体积0.9%生理盐水中,超声处理15min,冰浴10min,然后加入所需质量的吐温-80,使用生理盐水定容,充分混匀;
配制后标识:以白色标签标识,并注明试验编号、试验物质名称及浓度、配制体积、保存条件、有效期、责任人及配制日期等;
返还及剩余溶剂对照品的处理:给药后返还的溶剂对照品倒入下水道。
2.4其他主要试剂
改良型RPMI-1640培养基(HyClone公司产品,规格:500mL,批号:NZG1385)。
胎牛血清(Feotal Bovine Serum,Biological Industries公司产品,规格:500mL,批号:1452736)。
胰蛋白酶(0.25%Tripsin-EDTA(1×),GIBCO公司产品,规格:100mL,批号:1620318)。
基质胶(Matrigel Matrix,CORNING公司产品,规格:10mL,批号:4090004)
Human Kallikrein 3/PSA Quantikine ELISA(R&D Systems公司产品,规格:96孔,批号:330695)
2.5主要仪器、器械
单人生物安全柜(苏州安泰公司产品,型号:BSC-1300IIA2)
二氧化碳培养箱(THERMO公司产品,型号:THERMO 311)
倒置显微镜(Olympus公司产品,型号:CKX41)
电子数显卡尺(成都成量工具集团有限公司,型号:0-220)
1000μL、200μL、20μL微量加样器(EPPENDRF公司产品)
分析天平(METTLER公司产品,型号:ME104)
2.6细胞株
细胞株名称:LNCaP/AR人前列腺癌细胞系;
来源:四川大学生物治疗国家重点试验室。
3试验系统
3.1试验动物
种属:CB17SCID小鼠;
等级:SPF级;
购入动物数量和性别:80只(雄性);
使用动物数量和性别:53只(雄性);
年龄:5~6周龄;
体重:去势手术时体重均值20~24g,体重个体值在均数±20%范围内;
来源:北京华阜康生物科技股份有限公司,生产许可证号:SCXK(京)2014-0004。
3.2饲养管理
3.2.1环境适应
试验前环境适应6-7天,选择健康CB17SCID小鼠作为受试动物。适应期主要检查结果:
与订购时要求的质量指标一致;
动物一般状态正常;
动物体重达到试验要求的体重范围;
不合格的异常动物未纳入本试验。
3.2.2饲养地点
华西海圻医药科技有限公司SPF区(第3栋)(实验动物使用许可证号:SYXK(川)2009-123)。
3.2.3饲养条件
饲养密度:≤5只/笼;
笼具空间位移频度:1次/周。
3.2.4饲养环境条件
饲养环境条件标准:中华人民共和国国标GB14925-2010;
饲养环境控制系统:Honeywell公司EBI400自动控制全新风中央空调系统;
温度:20~26℃(日温差<4℃);
湿度:相对湿度40~70%;
光照:人工照明,12小时明暗交替(07点30分开灯,19点30分关灯,如因试验需要,黑暗期间可以照明);
换气次数:≥15次/小时,100%全新风。非工作时间可降低换气次数,未低于10次/小时。
3.2.5饲料
种类:大小鼠维持饲料;
制造单位:上海斯莱克实验动物有限责任公司提供。饲料生产企业审查合格证:沪饲审(2008)04002;
给料方法:自由摄取(试验有特殊要求时除外);
营养成分检测:(由饲料供应商每批提供检测报告)常规营养成分指标:粗蛋白、粗脂肪、粗纤维、粗灰分、水分、钙和磷;氨基酸指标:苏氨酸、胱氨酸+蛋氨酸、缬氨酸、异亮氨酸、亮氨酸、酪氨酸+苯丙氨酸、组氨酸、赖氨酸、精氨酸、色氨酸,参照中华人民共和国国家标准GB14924.3-2010;
饲料污染物含量的确认:由饲料供应商每批提供检测报告,化学污染物指标:砷、铅、镉、汞、六六六、滴滴涕、黄曲霉毒素B1、菌落总数、大肠菌群、霉菌和酵母菌数、致病菌(沙门氏菌),参照中华人民共和国国家标准GB14924.2-2001。
3.2.6饮水
种类:实验动物饮用水(反渗透水);
供水方法:饮水瓶盛装,自由摄取;
菌落总数检测:参照中华人民共和国国家标准GB5749-2006,取样自检(1次/周);
水质常规指标的检测:参照中华人民共和国国家标准GB5749-2006,取样送具有相关资质的单位检测,每年至少2次。
4试验方法
4.1CRPC模型建立
将6~7周龄CB17SCID小鼠进行去势手术,同时进行LNCaP/AR细胞培养。去势手术3天后(小鼠状态基本恢复),将小鼠剃毛,在右前肢背侧皮下接种约1.0*107个/只的LNCaP/AR细胞(细胞悬液与Matrigel按1:1的比例混匀,总体积约100μL/只),接种后每周观察小鼠状态及成瘤情况两至三次。肿瘤体积达到100-250mm3,将小鼠按照肿瘤体积范围等效分组。
4.2动物分组与标识
4.2.1动物标识
环境适应期及分组后:采用尾号和笼卡作为动物的识别标记;
笼卡的标记方法:
环境适应期间:统一使用白色笼卡,并注明试验编号、动物种系、动物流水号、入室时间、备注信息等;
分组后:用不同颜色笼卡进行组别区分,在笼卡上注明试验编号、动物种系、动物编号、处理因素、预期试验起止时间、备注信息等。
4.2.2动物分组
试验组别设计:溶剂对照组,阿醋酸比特龙-170mg/kg,醋酸阿比特龙联合泼尼松,AHS-114-300mg/kg,AHS-114-200mg/kg,AHS-114联合泼尼松,泼尼松-2mg/kg;
动物数量:泼尼松组为5只,其他各组每组8只;
性别:雄性;
分组方法:根据CB17SCID小鼠肿瘤大小等效分组,其中泼尼松组为待其他各组分组完毕后用剩余动物进行的补充分组。
4.3剂量设计及依据
根据人用量折算并参考阿比特龙衍生物AHS-114CB17SCID小鼠亚急性毒性试验(KP18-2015)结果,及与委托方协商,具体剂量设计见表1。
表1给药设计表
备注:联合用药组需先将两种药物在同一份溶剂中进行均匀混合后再给予该组小鼠。
4.4给药
给药途径:经口灌胃;
给药途径选择理由:与临床拟用药途径一致;
给药体积:10mL/kg;
给药频率:每日一次,连续给药28天;
给药:首次给药当天定义为试验第1天。
4.5检测指标
4.5.1一般状态观察
观察时间和频率:每天至少观察1次;
动物出现明显毒性症状时,增加观察频率;
观察指标或内容:包括但不限于小鼠外观体征、一般行为活动、精神状态、腺体分泌、呼吸状态、粪便性状、生殖器、死亡等情况及其它毒性表现。
4.5.2肿瘤测量与评价
4.5.2.1相对肿瘤体积和相对肿瘤增值率
肿瘤测量频率:开始给药前至少测定一次,给药期每隔2天测量一次测定肿瘤的长(a)和宽(b),根据“肿瘤体积(TumorVolume,TV),TV=l/2×a×b2”计算出肿瘤体积。分别计算出相对肿瘤体积(Relative TumorVolume,RTV,RTV=Vt/V0)和相对肿瘤增殖率T/C(%)=TRTV/CRTV×100,其中V0为首次给药当天(即第一天)测量所得肿瘤体积,V t为每一次测量时的肿瘤体积,TRTV为治疗组RTV,CRTV为阴性对照组RTV。
疗效评价标准:T/C(%)≥40为无效;T/C(%)<40,并经方差分析与阴性对照组相比P<0.05为有效。
4.5.2.2肿瘤体积改变百分比
根据肿瘤体积,计算末次给药当天(第28天)肿瘤体积改变百分比(Vchange%,Vchange%=(Vt-V0)/V0×100),其中V0为首次给药当天(即第一天)测量所得肿瘤体积,Vt为每一次测量时的肿瘤体积。
4.5.2.3瘤重及瘤重抑制率
末次给药后24小时,将待解剖CB17SCID小鼠实施安乐死,取瘤,尽快除去脏器周围结缔组织,并用吸水纸吸去脏器表面的血液及体液,以千分之一或以上精度电子天平进行称量。
瘤重抑制率(%)=(溶剂对照组平均瘤重-给药组平均瘤重)/阴性对照组平均瘤重×100%。
疗效评价标准:瘤重抑制率<40%为无效,≥40%,并经统计学处理P<0.05为有效。
4.5.3血清PSA检测
解剖前采集小鼠全血,室温放置0.5h至1h,于4℃,3000rpm离心15分钟后分离血清,于-80℃保存备用,待全部动物采样结束后按照Human Kallikrein 3/PSA(R&D Systems)Quantikine ELISA试剂盒说明,进行各小鼠血清PSA测定。
4.5.4前列腺及精囊腺重量
摘取肿瘤的同时摘取各小鼠的前列腺及精囊腺,用分析天平测定其重量。
4.5.5体重
测定时间:于去势手术前测定1次体重,并于手术后根据小鼠状态进行体重监测;首次给药前测定1次,开始给药后每1-2天测定一次。根据体重计算各小鼠的体重改变百分比(Wchange%=(Wt-W0)/W0*100,其中W0为首次给药当天(即第一天)测量所得体重,Wt为每一次测量时的体重)。
5统计分析与结果判定
所获数据采用EXCEL和SPSS进行数据分析。
先采用LEVENE检验进行方差齐性检验,当方差齐时(P≥0.05),采用重复测量方差分析(Repeated measures ANOVA)对相对肿瘤体积及体重改变百分比的组别差异进行统计学检验,组别差异有统计学意义时(P<0.05),采用单因素方差分析(ANOVA)中的Dunnett’s t检验(Dunnett法)对各时间点的组间差异进行比较;重复测量方差分析显示组间差异无统计学意义时(P≥0.05),则统计分析结束。当方差不齐时(P<0.05),采用Kruskal-Wallis H秩和检验(K-W法)进行统计分析。当Kruskal-Wallis H秩和检验显示差异有统计学意义时(P<0.05),则采用Mann-Whitney U检验(M-W法)对各时间点组间差异进行比较;当Kruskal-Wallis H秩和检验显示差异无统计学意义时(P≥0.05),统计分析结束。
其他指标均数的组别差异,当方差齐时(P≥0.05),采用单因素方差分析(ONE-WAYANOVA)对组别差异进行统计学检验,组别差异有统计学意义时(P<0.05),采用Dunnett’s t检验(Dunnett法)对组间差异进行比较;单因素方差分析显示组间差异无统计学意义时(P≥0.05),则统计分析结束。当方差不齐时(P<0.05),采用Kruskal-Wallis H秩和检验(K-W法)进行统计分析。当Kruskal-Wallis H秩和检验显示差异有统计学意义时(P<0.05),则采用Mann-Whitney U检验(M-W法)对组间差异进行比较;当Kruskal-Wallis H秩和检验显示差异无统计学意义时(P≥0.05),统计分析结束。
6试验结果
6.1一般状态观察
各组肿瘤直观情况如图1所示。进入给药期后,各组小鼠体重普遍呈下降趋势,各组小鼠均有个别小鼠体呈现瘦弱状态。从肿瘤直观状态来看,醋酸阿比特龙联合泼尼松组、AHS-114联合泼尼松组小鼠肿瘤相对其他组较小,到给药后期,各组均有1-2只小鼠肿瘤处皮肤出现坏死龟裂甚至溃烂,如图1中黑色箭头所示。各组小鼠精神状态尚佳。
6.2肿瘤测量与评价
6.2.1.1相对肿瘤体积
如表2及图2所示,溶剂对照组平均相对肿瘤体积呈现出稳步增长趋势,在给药期最后一天(第28天)为3.92±0.5,泼尼松-2mg/kg组肿瘤生长情况与溶剂对照组相仿,在给药最后一天为4.14±0.71。醋酸阿比特龙-170mg/kg组、AHS-114-300mg/kg及AHS-114-200mg/kg组在给药最后一天平均相对肿瘤体积分别为3.87±0.5、3.93±0.37及3.20±0.55,也与溶剂对照组相当。两个联合用药组醋酸阿比特龙联合泼尼松、AHS-114联合泼尼松组效果相对较好,给药最后一天平均相对肿瘤体积分别为1.62±0.29、2.16±0.30。
与溶剂对照组相比,醋酸阿比特龙联合泼尼松组给药第4天相对肿瘤体积显著性降低(P<0.05),给药第7天至试验结束相对肿瘤体积均极显著性降低(P<0.01);AHS-114联合泼尼松组给药第10天,第19天至试验结束相对肿瘤体积均显著性降低(P<0.05);其他各组与溶剂对照组相比均无显著性差异(P≥0.05)。
与醋酸泼尼松单用组相比,醋酸阿比特龙联合泼尼松组自给药第4天至试验结束,相对肿瘤体积均极显著性降低(P<0.01);AHS-114-300mg/kg组给药第10天和第16天相对肿瘤体积显著性降低(P<0.05);AHS-114-200mg/kg组给药第10天、第13天及第16天相对肿瘤体积显著性降低(P<0.05);AHS-114联合泼尼松组于给药第7天、第19 天和第28天相对肿瘤体积显著性降低(P<0.05),给药第10天至16天、第22天和第25天相对肿瘤体积极显著性降低(P<0.01)。
两个联合用药组相比,相对肿瘤体积均无显著性差异(P≥0.05)。
各组相对肿瘤体积原始数据及图表如附录所示。
表2各组平均相对肿瘤体积(Mean±SEM)
备注:*P<0.05,**P<0.01vs.溶剂对照组;▲P<0.05,▲▲P<0.01vs.泼尼松组;#P<0.05,##P<0.01醋酸阿比特龙联合泼尼松组vs.AHS-114联合泼尼松组。
6.2.1.2相对肿瘤增值率
各组相对肿瘤增值率(T/C(%))如表3和图3所示,统计学检验结果与相对肿瘤体积相同,在此不作赘述。由图3可见,两个联合用药组T/C(%)随着给药时间的增长呈持续下降趋势,在给药最后一天,醋酸阿比特龙联合泼尼松组T/C(%)为41.39±7.46,AHS-114联合泼尼松组T/C(%)为55.03±7.60,均能显著性抑制肿瘤生长,但是未能达到《细胞毒类抗肿瘤药物非临床研究技术指导原则》的药物有效标准中的有效标准(T/C(%)≤40)。
表3各组相对肿瘤增值率(%)(Mean±SEM)
备注:*P<0.05,**P<0.01vs.溶剂对照组;▲P<0.05,▲▲P<0.01vs.泼尼松组;#P<0.05,##P<0.01醋酸阿比特龙联合泼尼松组vs.AHS-114联合泼尼松组。
6.2.2肿瘤体积改变百分比
图4为给药最后一天(第28天)各组肿瘤体积改变百分比(Vchange%=(V t-V0)/V0×100),由图可见溶剂对照组各小鼠肿瘤体积均较初始体积大,该组共8只小鼠,肿瘤体积均较初始肿瘤体积增大1倍以上(>100%)。醋酸阿比特龙-170mg/kg组、AHS-114-300mg/kg、AHS-114-200mg/kg及泼尼松-2mg/kg组肿瘤体积改变百分比分布情况与溶剂对照组相仿;两个联合用药组肿瘤体积改变百分比整体偏小,醋酸阿比特龙联合泼尼松组8只中有5只肿瘤体积较初始肿瘤体积增大在1倍以内(<100%),其中有3只肿瘤体积较初始肿瘤体积缩小(<0%);AHS-114联合泼尼松组8只中有5只肿瘤体积较初始肿瘤体积增大在1倍以内(<100%)。说明两个联合用药组对肿瘤生长的抑制作用较为明显。
6.2.3瘤重及瘤重抑制率
如表4及图5所示,溶剂对照组平均评价瘤重为0.431±0.066g,泼尼松-2mg/kg组瘤重为0.656±0.230g。醋酸阿比特龙-170mg/kg组、AHS-114-300mg/kg及AHS-114-200mg/kg组瘤重与溶剂对照组相当。两个联合用药组醋酸阿比特龙联合泼尼松、AHS-114联合泼尼松组效果相对较好,平均瘤重分别为0.234±0.077g、0.204±0.038g,瘤重抑制率分别为45.67%、52.56%。
与溶剂对照组相比,醋酸阿比特龙联合泼尼松组瘤重显著性降低(P<0.05),AHS-114联合泼尼松组瘤重极显著性降低(P<0.01)。其他各组与溶剂对照组相比均无显著性差异(P≥0.05)。
与泼尼松-2mg/kg组相比,两个联合用药组瘤重均显著性降低(P<0.05)。
两个联合用药组间相比,瘤重无显著性差异(P≥0.05)。
图6为各组离体肿瘤组织数码照片。
表4瘤重和瘤重抑制率(Mean±SEM)
备注:*P<0.05,**P<0.01vs.溶剂对照组;▲P<0.05,▲▲P<0.01vs.泼尼松组;#P<0.05,##P<0.01醋酸阿比特龙联合泼尼松组vs.AHS-114联合泼尼松组。
6.3血清PSA检测
各组血清PSA浓度如表5及图7所示,溶剂对照组血清PSA浓度为64.67±10.27ng/mL,醋酸阿比特龙联合泼尼松组血清PSA浓度为40.16±16.25ng/mL,AHS-114联合泼尼松组血清PSA浓度为22.23±6.80ng/mL。
与溶剂对照组相比,醋酸阿比特龙联合泼尼松能一定程度降低血清PSA含量,但无统计学差异(P≥0.05);AHS-114联合泼尼松能极显著性降低血清PSA含量(P<0.01);其他各组与溶剂对照组相比均无显著性差异(P≥0.05)。
与泼尼松-2mg/kg组相比,AHS-114联合泼尼松能显著性降低血清PSA含量(P<0.05)。
两个联合用药组间相比,血清PSA含量无显著性差异(P≥0.05)。
6.4前列腺及精囊腺重量
各组前列腺及精囊腺重量如表6所示,各组间均无显著性差异(P≥0.05)。
表6前列腺及精囊腺重量(Mean±SEM)
备注:*P<0.05,**P<0.01vs.溶剂对照组;▲P<0.05,▲▲P<0.01vs.泼尼松组;#P<0.05,##P<0.01醋酸阿比特龙联合泼尼松组vs.AHS-114联合泼尼松组。
6.5体重
各组体重变化百分比如所示,各组体重随时间的延长均呈现持续下降趋势,组间差异无统计学意义(P≥0.05)。
结论
溶剂对照组(n=8)与泼尼松单用组(n=5)平均相对肿瘤体积呈现出稳步增长趋势,与溶剂对照组相比,醋酸阿比特龙联合泼尼松组(n=8)给药第4天相对肿瘤体积显著性降低,给药第7天至试验结束相对肿瘤体积均极显著性降低;AHS-114联合泼尼松组(n=8)给药第10天,第19天至试验结束相对肿瘤体积均显著性降低;其他各给药组肿瘤生长情况与溶剂对照组相仿。在给药最后一天,泼尼松单用组T/C(%)为105.64±18.14,瘤重抑制率为-18.78%,与溶剂对照组相比无肿瘤抑制作用;醋酸阿比特龙联合泼尼松组T/C(%)为41.39±7.46,AHS-114联合泼尼松组T/C(%)为55.03±7.60,均能显著性抑制肿瘤生长,但是还未能达到《细胞毒类抗肿瘤药物非临床研究技术指导原则》的药物有效标准中的有效标准(T/C(%)≤40),两组瘤重抑制率分别为45.67%、52.56%,对瘤重抑制作用明显;另外,AHS-114联合泼尼松还能极显著性地降低荷瘤小鼠血清PSA浓度,也进一步说明受试药AHS-114联合泼尼松后能对去势抵抗性前列腺癌荷瘤小鼠肿瘤增长有较为明显的抑制作用。两个联合用药组间相比,各指标均无显著性差异。
各组均有个别小鼠肿瘤处皮肤出现龟裂和坏死,同时各组体重普遍呈下降趋势,各 组对体重的改善情况均不明显。
综上所述,受试药AHS-114-200mg/kg联合泼尼松后,对去势抵抗性前列腺癌荷瘤小鼠肿瘤增长有较为明显的抑制作用,未呈现明显毒副作用,与同等剂量下的阳性药醋酸阿比特龙联合泼尼松对肿瘤的抑制作用相当,但还未达到《细胞毒类抗肿瘤药物非临床研究技术指导原则》的有效标准。
以上对本发明的具体实施例进行了描述。需要理解的是,本发明并不局限于上述特定实施方式,本领域技术人员可以在权利要求的范围内做出各种变形或修改,这并不影响本发明的实质内容。
- 还没有人留言评论。精彩留言会获得点赞!