一种甘蔗叶片中赤霉素含量的HPLC检测方法与流程
本发明涉及甘蔗梢腐病检测
技术领域:
,特别是一种甘蔗叶片中赤霉素含量的HPLC检测方法。
背景技术:
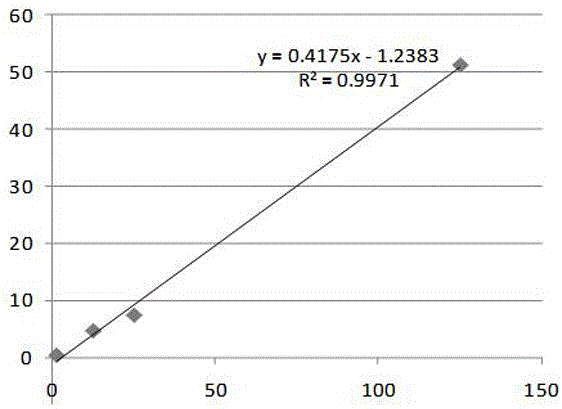
:甘蔗(Saccharumofficinarum)是我国最重要糖料作物,蔗糖占我国食糖总产92%。由于梢腐病逐渐表现出无区域性和无规律性等特点,导致该病对甘蔗产业的危害日趋严重。在巴西、印度、伊朗、马来西亚以及我国等蔗区各类梢腐病症状层出不穷,尤其在高温高湿季节容易暴发此病。据2012-2014年广西甘蔗品种区域试验以及2013-2014年国家甘蔗品种区域试验调查,参试品种发病率达到100%。此病害可导致甘蔗株高显著降低,产量减少5%~20%,糖分降低达3%。甘蔗在受到梢腐病病原侵染时,会产生一系列的防御反应来保护自己,与此同时,病原真菌也会通过改变自身毒性或产生变异,由此影响甘蔗正常生理生化进程,从而感染甘蔗并导致发病。赤霉素作为一种重要的植物内源激素,其参与甘蔗生理代谢过程一个突出特点是促使蔗茎的伸长和蔗株增高。而甘蔗是以蔗茎作为收获产品的作物,因此在生产中增加蔗株高度对于提高甘蔗产量是相当重要的。但至今尚无建立高效、精确的甘蔗梢腐病叶片赤霉素含量检测方法,鉴于我国甘蔗梢腐病发生逐渐加重的趋势,因此建立一套快速有效的甘蔗梢腐病叶片赤霉素含量检测方法对研究其介导甘蔗梢腐病病原菌胁迫应答的生化机制具有非常重要的意义。技术实现要素:针对我国甘蔗梢腐病叶片赤霉素含量检测方法的空白,本发明的目的在于提供一种简便、快速、准确的甘蔗叶片中赤霉素含量的HPLC检测方法。为实现上述目的,本发明采用的技术方法如下:一种甘蔗叶片中赤霉素含量的HPLC检测方法,包括以下步骤:S1.待测的甘蔗叶片加入液氮磨碎,加入预冷至2~5℃的体积分数为70~90%甲醇水溶液,2~5℃浸提10~20h,离心,取上清液,残渣再加入预冷至2~5℃的体积分数为70~90%甲醇水溶液浸提1~3h,离心后取出上清液,重复残渣浸提和离心操作0~3次,合并上清液,30~40℃下减压蒸发至不含甲醇,加入石油醚萃取脱色2~5次,弃去上层有机相,下层水相在30~40℃下减压蒸干,加入HPLC检测所用流动相溶解,定容,过滤,作为样品溶液备用;S2.采用HPLC检测样品溶液中赤霉素的含量。进一步的,所述步骤S2中,HPLC色谱条件为:流动相由甲醇、超纯水和乙酸按体积比200:300:3混合制成,柱温为32~38℃,流速0.8~1.2ml/min,紫外检测波长306nm。更进一步的,HPLC色谱条件为:柱温为35℃,流速1ml/min,进样量10μL。进一步的,所述步骤S1中,所述待测的甘蔗叶片在冰盒下剪下。进一步的,所述步骤S1中,待测的甘蔗叶片和残渣浸提采用的是体积分数为80%的甲醇水溶液。进一步的,所述步骤S1中,待测的甘蔗叶片和残渣浸提的温度为4℃。进一步的,所述步骤S1中,待测甘蔗叶片采用甲醇水溶液进行浸提,液固比为0.2~0.5g/mL。进一步的,所述步骤S5中,加入流动相溶解后,采用0.45μm微孔滤膜进行过滤。进一步的,所述步骤S1中,待测的甘蔗叶片和残渣浸提采用的甲醇水溶液为甲醇-超纯水溶液。本发明还进一步提供了以上所述的检测方法在判断甘蔗品种对梢腐病感性和抗性差异方面的应用。本发明的有益效果是:1)样品前处理方法采用甲醇-超纯水提取剂结合超声波萃取法提取赤霉素;并通过石油醚脱色对样品进行提纯;与其他方法相比,除杂效果好,提取时间短,待测样品纯净度高。2)通过本发明HPLC色谱条件测量样品溶液中赤霉素的含量,赤霉素能与其他有效成分较好地进行分离,且样品保留时间稳定,具有更好的峰形,在具备高效液相色谱仪的实验室均能通过此法开展赤霉素含量检测工作。3)本发明能检测甘蔗处理前后叶片赤霉素含量变化,检测结果表明:接种处理与正常生长的甘蔗叶片赤霉素含量存在显著差异,且差异性趋势增大;正常生长的甘蔗叶片中赤霉素含量会逐渐上升,接种处理的甘蔗叶片中赤霉素含量逐渐下降;该检测结果为研究其介导甘蔗梢腐病病原菌胁迫应答的生化机制提供科学依据。同时,该方法的推广使用,对于筛选抗病品种和指导甘蔗抗病育种具有重要意义和现实作用。附图说明图1为赤霉素的标准工作曲线。图2a为标准溶液检测得到的色谱图。图2b为样品溶液检测得到的色谱图。图3为不同生长阶段甘蔗接种样品和甘蔗对照样品中赤霉素含量的趋势分析图。具体实施方式下面结合具体实施例,对本发明作进一步详细的阐述,但本发明的实施方式并不局限于实施例表示的范围。这些实施例仅用于说明本发明,而非用于限制本发明的范围。此外,在阅读本发明的内容后,本领域的技术人员可以对本发明作各种修改,这些等价变化同样落于本发明所附权利要求书所限定的范围。实施例1甘蔗叶片中赤霉素含量的HPLC检测方法。S1.选取感染甘蔗梢腐病病原的甘蔗叶片作为待测样品,取待测样品2g加入液氮磨碎,加入10mL预冷至4℃的体积分数80%甲醇水溶液,保鲜膜密封后于4℃浸提16h;然后于4℃条件下以8000r/min离心10min得上清液,残渣用5mL预冷至4℃的体积分数其80%甲醇水溶液浸提2h,离心10min后取出上清液,合并两次上清液于40℃减压蒸发至不含甲醇(约剩0.3mL水溶液),加入15mL石油醚萃取脱色3次,弃去上层有机相,下层水相40℃下减压蒸干,加入0.5mLHPLC检测所用流动相溶解,定容至2mL,经0.45μm微孔滤膜过滤于带有内衬管的样品瓶内,作为样品溶液。S2.采用HPLC检测样品溶液中水杨酸的含量。S2-1.色谱条件:ARigolL3000高效液相色谱仪;色谱柱:KromasilC18反相色谱柱(250mm×4.6mm,5μm);流动相:200mL甲醇和300mL超纯水混合,加入3mL乙酸;柱温:35℃;走样时间为20min;流速:0.8mL/min;检测波长:306nm;进样体积:10μL。S2-2.称取赤霉素标准品1.25mg,加入10mL水溶解,配置成125μg/mL的标准溶液母液;然后用标准溶液母液再一次稀释成浓度分别为25μg/mL、12.5μg/mL、1.25μg/mL的标准溶液,采用S2-1的色谱条件检测标准溶液母液和标准溶液,其对应峰面积分别为51.256、7.311、4.571、0.272;然后以峰面积为纵坐标、以赤霉素浓度为横坐标做标准曲线,标准曲线如图1所述,由图1可见,在所检测范围内(1.25μg/mL~125μg/mL),回归方程式为y=0.4175x-1.2383,液相色谱峰面积与赤霉素浓度具有良好的线性关系(R2=0.9971)。S2-3.专属性考察:分别取125μg/mL的标准溶液母液和样品溶液注入液相色谱仪中,按照S2-1的色谱条件进行检测,赤霉素的保留时间为7.77min,标准溶液母液检测结果见图2a,样品溶液检测结果见图2b。S2-4.加标回收实验:分别向同一样品溶液中添加1mL的浓度为10μg/mL、20μg/mL、30μg/mL、50μg/mL的赤霉素标准溶液,按照5.1的液相色谱条件检测,计算回收率,结果见表1。表1赤霉素回收率测定结果S2-5.方法精密度试验:取浓度为1.25μg/mL的标准溶液,按照S2-1的色谱条件检测,连续进样5针观察保留时间与峰面积,结果见表2。表2方法精密度实验结果编号保留时间(min)峰面积(μvsec)17.7681.35827.7521.34537.6431.32447.7181.29657.7351.320标准偏差0.0490.024相对标准偏差0.6291.801S2-6.S1获得的样品溶液分析。采用S2-1的色谱条件检测,重复测定三次,得样品的中赤霉素的含量为2.456μg/g。由本实施例可以看出,本方法的灵敏度、检出限和精密度能够满足甘蔗叶片中水杨酸含量的测定;尤其适用于感染梢腐病的甘蔗叶片中水杨酸含量的测定,通过上述样品的前处理方法和色谱条件,能排除梢腐病病原菌对检测结果的干扰。实施例2判断甘蔗品种感染梢腐病后的感性和抗性差异研究。(1)接种体的制备:将甘蔗梢腐病病原菌接种于PDA培养基上活化3天,挑取PDA培养基边缘菌丝接种在灭菌的马铃薯葡萄糖水培养基中振荡培养3天,离心、用灭菌的脱脂棉过滤、收集所获得的菌体,用无菌水与菌体配制成浓度为1×106CFU/ml甘蔗梢腐病病原菌孢子悬浮液。(2)接种材料的处理:选取甘蔗品种YT94-128、甘蔗品种GT37为接种材料,温室条件下每个品种种植30桶,每桶4个芽,下种前用0.3%多菌灵浸种20min,出苗后正常管理,长出5~6片完全叶时进行接种。(3)注射接种:取长势相同的甘蔗品种YT94-128、甘蔗品种GT37的幼苗各30株,使用1ml医用注射器分别将100μl甘蔗梢腐病病原菌孢子悬浮液到甘蔗+1叶位,作为甘蔗接种样品;再另外取长势相同的甘蔗品种YT94-128、甘蔗品种GT37的幼苗各30株,以注射无菌水为对照,作为甘蔗对照样品;甘蔗接种结束后保持室内温度28-30℃,湿度80%。(4)样品选取:选择相同株龄+1叶位上相同位置有近似病症的甘蔗叶片,在冰盒上将其剪成1cm×1cm的叶片进行备样。(5)检测方法与结果S1.取各生长阶段(2、4、8、16d)的甘蔗接种样品YT94-128、GT37和甘蔗对照样品YT94-128、GT37叶片2g分别加入液氮磨碎,加入10mL4℃预冷的体积分数80%甲醇水溶液,保鲜膜密封后于4℃浸提16h;然后于4℃条件下以8000r/min离心10min得上清液,残渣用5mL预冷至4℃的体积分数其80%甲醇水溶液浸提2h,离心10min后取出上清液,合并两次上清液于40℃减压蒸发至不含甲醇(约剩0.3mL水溶液),加入15mL石油醚萃取脱色3次,弃去上层有机相,下层水相40℃下减压蒸干,加入0.5mLHPLC检测所用流动相溶解,定容至2mL,经0.45μm微孔滤膜过滤于带有内衬管的样品瓶内,作为研究样品溶液备用;S2.采用HPLC检测样品溶液中赤霉素的含量。S2-1.色谱条件:ARigolL3000高效液相色谱仪;色谱柱:KromasilC18反相色谱柱(250mm×4.6mm,5μm);流动相:200mL甲醇和300mL超纯水混合,加入3mL乙酸;柱温:35℃;走样时间为20min;流速:0.8mL/min;检测波长:306nm;进样体积:10μL。S2-2取不同生长阶段(2、4、8、16d)的甘蔗接种样品YT94-128、GT37和甘蔗对照样品制成的研究样品溶液,进行赤霉素含量的测定,每个样品重复测定3次,结果见表3。表3不同生长阶段甘蔗接种样品中赤霉素的含量S2-3实验结果分析。赤霉素(GA)作为一种重要的植物内源激素,其参与甘蔗生理代谢过程一个突出特点是促使蔗茎的伸长和蔗株增高。经鉴定,YT94-128对梢腐病表现出抗性,GT37对梢腐病表现出感性。由上述表3获得的数据制得赤霉素含量的趋势变化图,如图3所示,其中,A为对照样品GT37的赤霉素含量变化趋势,B为对照样品YT94-128的赤霉素含量变化趋势,C为接种样品GT37的赤霉素含量变化趋势,D为接种样品YT94-128的赤霉素含量变化趋势,结合图3所示,对照样品中的赤霉素含量随甘蔗生长而逐渐上升,感病品种GT37的赤霉素含量变化趋势高于抗病品种YT94-128;病原菌接种处理的甘蔗叶片中赤霉素含量随甘蔗生长而不断降低,感病品种GT37的赤霉素含量降低的趋势要高于YT94-128;其中,接种后2至4天,蒸馏水接种和病原菌接种处理之间的赤霉素含量差异并不显著,但接种后一周左右时间,接种处理与对照之间的差异达到极显著。本试验说明,空白处理下,感病品种GT37叶片合成赤霉素的速率要高于抗病品种YT94-128;在接种病原菌后,感病品种GT37梢腐病病情指数不断加重,其叶片合成赤霉素的能力受到显著影响,同时蔗株在受到生物(病原菌)和非生物(针刺)胁迫后发生赤霉素次生合成反应,但前者大于后者,从而导致GT37叶片中赤霉素含量呈显著降低趋势。抗病品种YT94-128在接种病原菌后,尽管其病情指数并不严重,但蔗株叶片合成赤霉素的能力也受到影响,有可能是YT94-128叶片本身合成赤霉素速率并不是很突出,到了接种后12至16天表现出与GT37叶片赤霉素含量的相似性变化。结论:由试验可看出,同一甘蔗品种,在感染梢腐病第7至10天后,正常生长的甘蔗叶片与感染梢腐病的甘蔗叶片之间赤霉素含量差异越小,该甘蔗品种对梢腐病表现出抗性的可能性越大,反之,该甘蔗品种对梢腐病表现出感性的可能性越大。这一试验结果为研究赤霉素抗逆性生理生化机制、筛选抗病品种和指导甘蔗抗病育种提供了重要的技术参考。本文中所描述的具体实施例仅仅是对本发明精神作举例说明。本发明所属
技术领域:
的技术人员可以对所描述的具体实施例做各种各样的修改或补充或采用类似的方式替代,但并不会偏离本发明的精神或者超越所附权利要求书所定义的范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1