一种抗体蛋白含量的微量检测方法与流程
本发明属于生物制药
技术领域:
,涉及抗体蛋白含量检测技术,特别涉及一种抗体蛋白含量的微量检测方法。
背景技术:
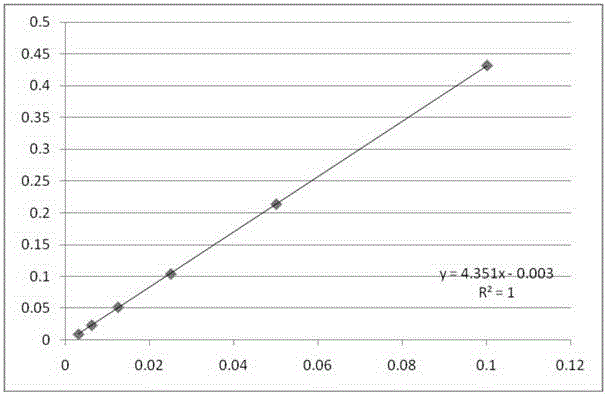
:目前,测定蛋白质含量的常用方法有:凯氏定氮法、双缩脲法、Lowry法、Bradford法、紫外吸收法等。这些方法各有优劣,对于不同种类的样品可以选择不同的测定方法。凯氏定氮法常用于有机化合物的测定,反应时间长,操作复杂,用样量大。双缩脲法、Lowry法和Bradford法均为蛋白质溶液的显色测定方法且均需标准品。双缩脲法常用于快速但不需要十分精确的测定,如用于蛋白质纯化的前几个步骤的测定。Lowry法一直被选为蛋白质的标准测定方法,此法基于在碱性溶液中,蛋白质的易氧化成分(如巯基、酚基)将Cu2+还原为Cu+,Folin-酚试剂定量地与Cu+反应,形成蓝色化合物,此蓝色化合物在650nm有最大吸收峰。最近,新开发的BCA法也是在Lowry法基础上的改进,只是BCA与Cu+的反应比Folin-酚试剂与Cu+的反应更强。此方法配制试剂比较复杂,操作繁琐,而且需要相对应的标准品,一般新型抗体没有相对应的标准品,故不适用于抗体蛋白含量的检测。Bradford法又叫考马斯亮蓝法,是染料考马斯亮蓝G-250在酸性溶液中与蛋白质的碱性氨基酸(精氨酸等)及芳香族氨基酸残基相结合,溶液由棕黑色变为蓝色,最大吸收波长变为595nm,在595nm波长下测定的吸光度与蛋白浓度呈线性关系。此法灵敏度高,重复性也好,但由于各种蛋白质中精氨酸和芳香族氨基酸的含量不同,Bradford法用于不同蛋白质测定时有较大的偏差,故通常使用该方法时,需对应的标准品,但通常对于新型抗体是没有法定标准品。常规抗体蛋白含量的检测方法主要为紫外吸收法。该方法要求有针对该蛋白的消光系数。由于蛋白质中存在着含有共轭双键的酪氨酸、色氨酸、胱氨酸等,它们具有吸收紫外光的性质,其吸收高峰在280nm波长处,且在此波长下的吸光度与其浓度成正比关系,故可作为蛋白质定量测定的依据。通常的操作为:用配制蛋白质溶液的溶剂(水或缓冲液)作空白对照调零,根据经验把蛋白溶液稀释至合适的浓度,使其280nm处吸光值在0.5~1.0之间,将待测蛋白质溶液倒入石英比色皿中,三次平行测定,根据Lambert-Beer定律计算蛋白溶液的含量:A=εcl式中,A-吸光度,OD;ε-摩尔吸收系数,旧称摩尔消光系数;c-浓度,mol/L;l-比色皿光程厚度,cm。此方法比色皿最小测量体积为4uL,根据经验稀释蛋白溶液,不同的稀释倍数计算得到的浓度不同,精确度不高,且折叠蛋白质的摩尔消光系数会受到其二级、三级结构的影响,从而发生变化,并不能简单的进行推定。通常确定其消光系数都是通过测定氨基酸组成或是按模型计算而求得。两方法一种所需蛋白量达到毫克级,一种理论推算可能会导致较大误差,均不如本法测得准确。技术实现要素:本发明提供一种抗体蛋白含量的微量检测方法,更加微量、精确的测定抗体蛋白含量的方法,以解决现有A280紫外吸收法测定蛋白浓度的缺点和不足。本发明的方法所需样品量极少,操作简单迅速,重复性好,且对不同种类的抗体蛋白溶液均能进行有效测定。本发明建立在现有A280紫外吸收法的基础上,用盐酸胍溶液将抗体蛋白完全变性去折叠,从而可以根据待测抗体蛋白中色氨酸、酪氨酸残基和二硫键等的数量计算其理论摩尔消光系数。本发明采用微量比色皿进行实验,选用抗体样品梯度稀释制作线性曲线,测量体积仅为4μL,可以线性拟合不同稀释倍数与吸光度之间的关系,计算蛋白含量结果准确度更高。本发明的技术方案如下:一种抗体蛋白含量的微量检测方法,包括以下步骤:(1)以变性液为稀释液将供试样品进行梯度稀释,室温放置一段时间,以使抗体蛋白完全变性,测定不同稀释倍数溶液的吸光度;以稀释系数为横坐标,测得的吸光度值为纵坐标绘制变性线性曲线,得到变性线性方程Y=AX+B;(2)根据该供试样品的氨基酸序列,利用ExPASyProtParamtool在线计算供试样品非变性条件下的消光系数,即正常状态下蛋白为1mg/mL,光程为1cm的吸光度值;(3)将所述的吸光度值代入变性线性方程Y=AX+B,计算该完全变性蛋白为1mg/mL时的稀释系数(即d的倒数);根据下述公式计算该供试样品的抗体蛋白浓度:C=1.0×d×1/L式中,c-抗体蛋白浓度,mg/mL;d-蛋白溶液稀释倍数;L-为光程(微量比色皿光程)。优选为,还包括步骤(4)以非变性液为稀释液将另一供试样品进行同梯度稀释,然后重复步骤(1)的其他步骤,得到非变性线性曲线;然后将步骤(3)该完全变性蛋白为1mg/mL时的稀释系数代入非变性线性曲线,得到该供试样品抗体蛋白未变性即常态时消光系数ζ,该消光系数试用于下列公式,直接用于该供试样品抗体蛋白未变性时的浓度测定:A=ζ*C*L式中,c-抗体蛋白浓度,mg/mL;A-吸光度,OD;ζ为消光系数;L为光程,cm。优选为,步骤(1)中所述的变性液为6.3mM十二水合磷酸氢二钠,13.7mM二水合磷酸二氢钠,6M盐酸胍,pH=6.5的混合液;步骤(4)中所述的非变性液为6.3mM十二水合磷酸氢二钠,13.7mM二水合磷酸二氢钠,pH=6.5±0.1的混合液。优选为,步骤(1)和(4)中所述的供试样品为纯化后得到的抗体蛋白溶液,且不含有吸收紫外线的物质。优选为,步骤(1)和(4)中梯度稀释系数根据所述的供试样品的吸光度值而定,使稀释后溶液测定的吸光度值在仪器测量范围内。优选为,稀释后溶液测定的吸光度值在0.056至0.42之间。优选为,步骤(1)和(4)中所述的吸光度值的测定仪器为紫外分光光度计,如AgilentCary60等。优选为,所述的紫外分光光度计的参数设置为波长280nm,读数次数三次,运行时进行曲线校正,拟合类型线性,最小R2为0.99,测定比色皿为微量比色皿,光程l为0.1cm。优选为,在测定所述的供试样品的吸光度之前,用所述的变性液进行调零,调零吸光度在0.37以下。优选为,按照稀释倍数从高到低依次测定,每测完一个稀释倍数溶液,用超纯水清洗微量比色皿后,再测下一个稀释倍数溶液。本发明还公开了上述抗体蛋白含量的微量检测方法在抗体蛋白检测试剂盒的应用。与现有技术相比,本发明的有益效果如下:与现有A280方法相比,本发明无需通过其他方法测定消光系数,且使用了微量比色皿,从而极大的节省了测试所需样品量,对纯化后的少量抗体样品可以快速测定,满足实验室和企业研发需要;同时为了解决现有方法准确度不高的问题,本发明对蛋白溶液稀释系数和吸光度进行线性拟合,避免了对蛋白溶液稀释倍数不同,而导致计算出的供试品蛋白含量不同的问题;且本发明的方法重复性好,方法学验证精密度RSD均小于5%;和可根据不同的抗体蛋白的结构特点改变摩尔消光系数,适用于各种抗体蛋白含量的测定,应用范围广。本发明的方法线性拟合不同稀释倍数与抗体蛋白溶液吸光度之间的关系,解决了原有A280紫外吸收法精确度不高的问题,对不同抗体样品的蛋白含量均能进行有效测定。附图说明图1为本实施例1变性液梯度稀释后的抗体1测得的以稀释倍数的倒数为X轴-以吸光度为Y轴的变性线性曲线图;图2为本实施例1非变性液梯度稀释后的抗体1测得的以稀释倍数的倒数为X轴-以吸光度为Y轴的非变性线性曲线图;图3为本实施例2变性液梯度稀释后的抗体2测得的以稀释倍数的倒数为X轴-以吸光度为Y轴的变性线性曲线图;图4为本实施例2非变性液梯度稀释后的抗体2测得的以稀释倍数的倒数为X轴-以吸光度为Y轴的非变性线性曲线图。具体实施方式下面结合具体实施例,进一步阐述本发明。应该理解,这些实施例仅用于说明本发明,而不用于限定本发明的保护范围。在实际应用中本领域技术人员根据本发明做出的改进和调整,仍属于本发明的保护范围。当本发明未做特别的说明,以下实施例中所用的技术手段为本领域技术人员所熟知的常规技术手段,且所用的原料、试剂也均为市售可购买得到的商品。实施例1测定抗体1的抗体蛋白含量(1)变性线性曲线的制作:以变性液为稀释液将抗体1梯度稀释10倍、20倍、40倍、80倍、160倍、320倍,室温放置1小时后,测定不同稀释倍数溶液的吸光度值;以稀释系数(稀释倍数的倒数)为横坐标,测定的吸光值为纵坐标绘制变性线性曲线,如图1所示。所述的变性液为6.3mM十二水合磷酸氢二钠,13.7mM二水合磷酸二氢钠,6M盐酸胍,pH=6.5的混合液;所述的抗体1为上海泰因生物技术有限公司发酵、纯化所得;稀释所得溶液测定吸光度值在0.056到0.42之间。(2)根据抗体1的蛋白质结构即氨基酸序列,利用ExPASyProtParamtool在线计算其理论消光系数。(3)将步骤(2)得到的吸光系数,即1mg/mL完全变性蛋白的吸光度值1.304代入所得标曲:y=4.1728x-0.007,得到蛋白含量为1mg/mL时的稀释倍数为3.18,代入C=1.0×d×1/L计算抗体蛋白浓度:C=1.0*3.18*1/0.1=31.8mg/mL。(4)绘制非变性线性曲线,通过计算抗体1未变性时的消光系数,用以矫正步骤(1)的变性线性曲线,并可直接用于该供试样品抗体蛋白未变性时的浓度测定:以非变性液为稀释液将抗体1梯度稀释10倍、20倍、40倍、80倍、160倍、320倍,测定不同稀释系数溶液的吸光度值;以稀释系数(即稀释倍数的倒数)为横坐标,测定吸光值为纵坐标绘制非变性线性曲线,如图2所示。所述的非变性液为6.3mM十二水合磷酸氢二钠,13.7mM二水合磷酸二氢钠,pH6.5±0.1的混合液;所述的抗体1为上海泰因生物技术有限公司发酵、纯化所得;稀释所得溶液测定吸光度值处于0.056至0.42之间。将步骤(3)所得蛋白含量为1mg/mL时的稀释系数代入非变性标准线性曲线,计算得该抗体1未变性时的消光系数为:ε′=1.37。实施例2测定抗体2的抗体蛋白含量(1)变性线性曲线的制作:以变性液为稀释液将抗体2梯度稀释3.33倍、6.66倍、8.88倍、13.32倍、17.76倍,室温放置1小时后,测定不同稀释倍数溶液的吸光度值;以稀释系数(即稀释倍数的倒数)为横坐标,测定吸光度值为纵坐标绘制变性线性曲线,如图3所示。所述的变性液为6.3mM十二水合磷酸氢二钠,13.7mM二水合磷酸二氢钠,6M盐酸胍,pH=6.5的混合液;所述的抗体2为上海泰因生物技术有限公司发酵、纯化所得;稀释所得溶液测定吸光度值0.056至0.42之间。(2)根据抗体2的蛋白质结构,利用ExPASyProtParamtool在线计算其消光系数:(3)将步骤(2)所得的吸光系数,即1mg/mL完全变性蛋白的吸光度值1.567代入所得标曲:y=1.6003x-0.0228,得到蛋白含量为1mg/mL时的稀释倍数为1.01,代入C=1.0×d×1/L计算抗体蛋白浓度:C=1.0*1.01*1/0.1=10.1mg/mL。(4)绘制非变性线性曲线,通过计算抗体2未变性时的消光系数,用以矫正步骤(1)的变性线性曲线,并可直接用于该供试样品抗体蛋白未变性时的浓度测定:以非变性液为稀释液将抗体2梯度稀释3.33倍、6.66倍、8.88倍、13.32倍、17.76倍,测定不同稀释倍数溶液的吸光度值。以稀释系数(即稀释倍数的倒数)为横坐标,测定吸光度值为纵坐标绘制标准曲线,如图4所示。所述的非变性液为6.3mM十二水合磷酸氢二钠,13.7mM二水合磷酸二氢钠,pH6.5±0.1的混合液;所述的抗体2为上海泰因生物技术有限公司发酵、纯化所得;稀释3.33倍所得溶液测定吸光度值小于1。将步骤(3)所得蛋白含量为1mg/mL时的稀释系数(即稀释倍数的倒数)代入非变性线性曲线,计算得该抗体2未变性时的消光系数为:ε′=1.57。实施例3方法精密度的验证3.1仪器重复性:同一日期同一分析人员对供试样品制作一组标曲溶液,对这组标曲溶液重复进样测定6次,得到6次的标准曲线,分别计算供试样品蛋白浓度。结果见表1,6次计算所得该供试样品蛋白浓度RSD为1.30%。表1仪器重复性实验结果进样序号浓度(mg/mL)128.36227.95328.29428.92528.32628.85平均值28.45标准偏差0.37相对标准偏差%1.30%3.2样品重复性:同一日期同一分析人员对同一供试样品制作两组溶液,对这两组溶液分别重复进样3次,共得到6次线性曲线,分别计算供试样品蛋白浓度。结果见表2,6次计算所得该供试样品蛋白浓度RSD为3.99%。表2样品重复性实验结果3.3中间精密度:不同分析人员在不同日期对同一供试样品制作溶液,进样测定,共得到3次线性曲线,分别计算供试样品蛋白浓度。结果见表3,3次所得该供试样品蛋白浓度RSD为3.89%。表3中间精密度实验结果本方法的使用量微克级就够了,并且本方法不需要用标准品,使用微量比色皿,操作简单迅速,代替了常规方法是两种实验相结合才能得出结果的繁琐步骤,本发明的方法线性拟合不同稀释倍数与抗体蛋白溶液吸光度之间的关系,解决了原有A280紫外吸收法精确度不高的问题,对不同抗体样品的蛋白含量均能进行有效测定。本发明还公开了一种试剂盒,包括变性液和非变性液,所述试剂盒用于抗体蛋白含量的微量检测。以上公开的本发明优选实施例只是用于帮助阐述本发明。优选实施例并没有详尽叙述所有的细节,也不限制该发明仅为所述的具体实施方式。显然,根据本说明书的内容,可作很多的修改和变化。本说明书选取并具体描述这些实施例,是为了更好地解释本发明的原理和实际应用,从而使所属
技术领域:
技术人员能很好地理解和利用本发明。本发明仅受权利要求书及其全部范围和等效物的限制。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1