靶DNA引发的层层自组装石墨烯基光电生物传感器及其检测方法和应用与流程
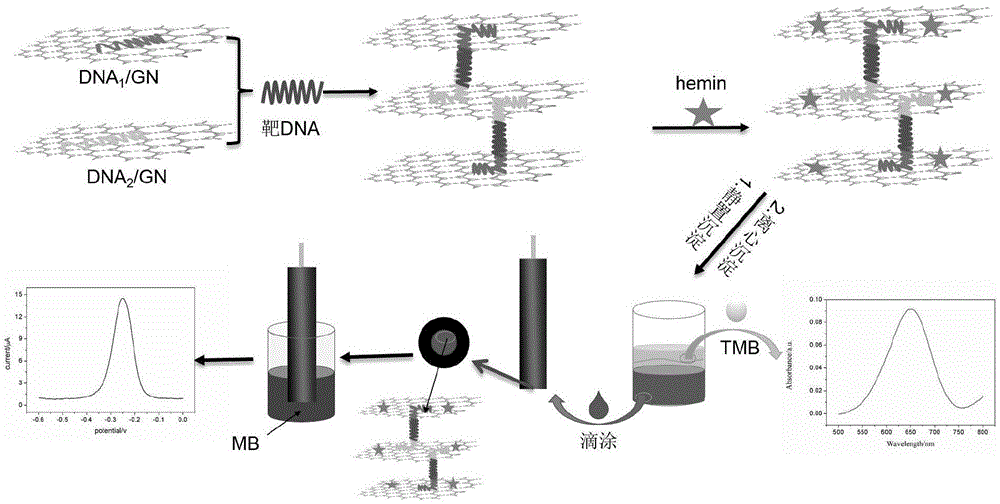
本发明属于生物传感技术领域,具体涉及一种靶DNA引发的层层自组装石墨烯基光电生物传感器及其检测方法和应用。
背景技术:
石墨烯是由碳原子以sp2杂化组成的六边形蜂巢晶格状的单原子薄膜,厚度仅为0.35nm,是目前发现的最薄的二维材料。同时,石墨烯具有一系列优异的物理化学性质,如良好的电子传导性和超高的电子流动性(载流子迁移率达1.5×104cm2·V-1·S-1)、优异的热导性(热导率可达5×103W·m-1·K-1)、较高的机械强度等。基于其所具有的独特性能,石墨烯已被应用于化学修饰电极、化学电源、催化剂、药物载体以及气体传感器等方面的研究。
近年来,基于石墨烯制备DNA生物传感器成为生物传感器技术领域研究的热点。然而,由于石墨烯在干燥状态或正常溶剂中均会发生不可逆的团聚,降低了其功效,使其在实际应用中受到一定限制。为了进一步探索基于石墨烯材料的应用价值,近年来科学家在通过金属纳米粒子修饰石墨烯合成石墨烯-金属纳米粒子复合物方面开展了研究工作。中国专利(CN 103063715A)公开了一种基于石墨烯/三维纳米金复合材料电化学DNA生物传感器,该生物传感器根据待测基因片段设计特异性识别探针,捕获探针通过金-硫键自组装于石墨烯/三维纳米金复合物修饰的玻碳电极表面,在目标DNA存在的情况下,捕获探针及末端标记有生物素的信号探针分别与目标DNA结合形成“三明治”结构,从而实现了骨肉瘤相关基因的高灵敏度、高特异性检测。中国专利(CN 103033544A)公开了一种基于石墨烯/贵金属复合材料的电化学DNA传感器,所述传感器制备方法为:采用Hummer法由石墨粉制备氧化石墨烯分散水溶液;采用化学还原法制备石墨烯/纳米贵金属粒子复合材料;将石墨烯/纳米贵金属粒子复合材料黏附到玻碳电极上,通过修饰单链DNA,实现修饰电极和目的基因的连接,即制备得到电化学DNA传感器。
虽然上述制备方法通过引入金属纳米材料降低了石墨烯的团聚现象,但是上述基于石墨烯制备得到的DNA生物传感器均需首先合成石墨烯-金属纳米粒子复合物,制备过程繁琐、耗时,且往往需要高毒的化学还原剂(如联氨、氢醌等),制备成本偏高,成功率较低;同时制备得到的DNA生物传感器均为单一电化学生物传感器,检测数据单一,利用率低。
技术实现要素:
为克服现有技术的不足,本发明提供了一种靶DNA引发的层层自组装石墨烯基光电生物传感器及其检测方法和应用,本发明利用DNA分子间以及DNA分子与石墨烯间的相互作用,由靶DNA引发形成层层自组装石墨烯复合结构,同时引入氯高铁血红素(hemin),利用hemin对亚甲基蓝(MB)-H2O2和3,3',5,5'-四甲基联苯胺(TMB)-过氧化氢(H2O2)反应体系的催化作用,同时实现了靶DNA的电化学和紫外-可见吸收检测。
为实现上述技术目的,本发明采用的技术方案如下:
一种基于靶DNA引发的层层自组装DNA/石墨烯复合物,所述层层自组装DNA/石墨烯复合物制备过程如下:
(1)将还原氧化石墨烯(GN)超声分散均匀后,分别取两份还原氧化石墨烯分散液,向其中分别加入DNA1、DNA2,室温下反应,制得DNA1/GN、DNA2/GN复合物;其中,所述DNA1为5'端富含AG序列且与靶DNA形成互补度为1/3~1/2的核酸片段,所述DNA2为3'端富含AG序列且与靶DNA形成互补度为1/3~1/2的核酸片段;
(2)将步骤(1)得到的DNA1/GN、DNA2/GN复合物混合后,向体系中加入靶DNA(tDNA),室温下进行层层自组装反应,制得(DNA1/GN-tDNA-DNA2/GN)n结构的层层自组装DNA/石墨烯复合物;
优选的,所述步骤(1)中,当所述靶DNA为乙型肝炎病毒(HBV)DNA序列(5'-GAG ACC ACC GTG AAC GCC CAC CAA-3')时,所述DNA1的碱基序列为:5'-(AG)15TTG GTG GGC GTT-3',所述DNA2的碱基序列为:5'-CAC GGT GGT CTC(AG)15-3';
当所述靶DNA为TP53DNA序列(碱基序列为:5'-GAT GGG CCT CCG GTT CAT GCC GCC CA-3')时,所述DNA1的碱基序列为:5'-(AG)15TGG GCG GCA TGA A-3',所述DNA2的碱基序列为:5'-CCG GAG GCC CAT C(AG)15-3';
当所述靶DNA序列为5'-ATA TTG CTG GCG TCT ATG GGC GAT GTC CTC-3'时,所述DNA1的碱基序列为5'-(AG)15GAG GAC ATC GCC CAT-3',所述DNA2的碱基序列为:5'-AGA CGC CAG CAA TAT(AG)15-3';
优选的,所述步骤(1)中还原氧化石墨烯的制备方法为:将氧化石墨烯溶液超声分散后,向其中依次加入氨水和水合肼,将混合物摇匀,利用水合肼的还原作用制备还原氧化石墨烯(GN);其中所述氨水、水合肼和氧化石墨烯溶液的体积比为1~3:0.15:100,进一步优选为1:0.15:100;所述氧化石墨烯溶液的浓度为0.4~0.6g/L,进一步优选为0.5g/L;
所述还原氧化石墨烯分散液的浓度为0.1mg/mL,所述DNA1与所述石墨烯分散液的质量体积比为5OD:1mL;所述DNA2与所述石墨烯分散液的质量体积比为5OD:1mL;
本发明还公开了由上述层层自组装DNA/石墨烯复合物构建的靶DNA引发的层层自组装石墨烯基光电生物传感器。
一种靶DNA引发的层层自组装石墨烯基光电生物传感器检测DNA的方法,包括:
a)在上述制备层层DNA/石墨烯复合物的步骤(2)加入靶DNA后再向其中加入氯高铁血红素(hemin),从而实现hemin在石墨烯表面的吸附,室温下反应至步骤(2)层层自组装反应完毕;
b)将步骤a)得到的产物离心,使反应过程中形成的复合物沉淀,与未连接成功的石墨烯分离,用于后期检测;
c)将步骤b)所得的复合物沉淀滴涂在处理过的金电极表面,室温下干燥,使复合物固定在金电极表面;
d)将步骤c)制备得到的表面固定有复合物的金电极沉浸在含有亚甲基蓝(MB)的tris-HCl溶液中,进行电化学检测,测定MB的电化学响应信号;
e)取步骤b)中的上清液,加入到含有3,3',5,5'-四甲基联苯胺(TMB)、TMB缓冲液和H2O2的混合溶液中,进行紫外-可见吸收检测。
优选的,所述步骤a)中,hemin与石墨烯的质量比为1:8~12,进一步优选为1:10;
优选的,所述步骤c)中,金电极的处理方法具体为:先后用0.5μm和0.03μm的Al2O3粉末将金电极打磨成镜面;用二次水清洗后,依次置于乙醇和二次水中超声2~3min;然后用0.5M的浓硫酸对电极进行活化,直到得到稳定的循环伏安扫描图,扫描电压为0.20~1.65V,扫速为0.1V·s-1;最后用二次水冲洗,氮气吹干;
优选的,所述步骤d)中,MB溶液的浓度为0.3~0.6mM,tris-HCl的pH为7.2~7.5;进一步优选的,所述MB溶液的浓度为0.5mM,所述tris-HCl的pH为7.4;
优选的,所述电化学检测方法为方波伏安法,所述方波伏安法采用三电极工作体系(铂丝电极/金电极/甘汞电极),参数设置为:电位区间为-0.6V~0V;振幅:25mV;频率:10Hz;
优选的,所述步骤e)中,TMB的浓度为0.01M,溶剂为二甲基亚砜;TMB与H2O2的体积比为1:2~3,优选为1:2;
所述紫外-可见吸收检测中波长范围为500~800nm。
本发明还公开了上述方法用于检测DNA分子的应用。根据本发明的发明构思可以检测各种DNA分子,所述DNA分子包括乙型肝炎病毒、TP53。
本申请发明原理:发明人在前期研究中发现,单链DNA可通过范德华力、π-π堆积和氢键等作用力与石墨烯及其衍生物结合,基于此,本发明利用DNA分子间的相互作用引发石墨烯层层自组装,形成具有良好化学催化活性以及化学稳定性的DNA/石墨烯复合物;当靶DNA溶度较高时,则形成较多的层层DNA/石墨烯复合物,反之,则形成较少的层层DNA/石墨烯复合物,即靶DNA浓度与形成的层层DNA/石墨烯复合物的量呈正比例关系。
随后,本发明引入hemin,利用hemin对MB-H2O2和TMB-H2O2反应体系的催化作用,同时实现对靶DNA的电化学检测和紫外-可见吸收检测;具体的,本发明利用hemin对MB氧化还原反应的催化作用,当形成的层层DNA/石墨烯复合物越多,则沉淀中hemin的浓度越多,从而其对MB的催化作用越明显,相应的MB电化学信号越大,即靶DNA浓度与电化学信号呈正比例关系;同时本发明利用hemin对TMB氧化还原反应的催化作用,当形成的层层DNA/石墨烯复合物越多,则上清液中的石墨烯浓度越小,即hemin的浓度越少,从而其对TMB的催化作用越弱,相应的TMB紫外-可见吸收信号越弱,即靶DNA浓度与紫外-可见吸收信号呈反比例关系。通过上述技术方案,本发明实现了对靶DNA的电化学检测和紫外-可见吸收检测。因此本发明同现有技术相比,具有如下优点:
本发明利用DNA分子间的相互作用引发石墨烯自组装,形成层层DNA/石墨烯复合物,在不引入纳米金属等其他材料的情况下有效克服了石墨烯的团聚现象,制备得到的层层DNA/石墨烯复合物表现出出极好的化学催化活性以及化学稳定性,有利于后续对靶DNA进行电化学及光化学检测;该生物传感器具有制备简便、廉价、稳定性好、灵敏度高、线性范围宽、选择性好等优点。
本发明利用光电检测方法还使其具备了操作简便、成本低廉,快速高效,易微型化等优点,因此,基于靶DNA引发的层层自组装石墨烯基光电生物传感器为DNA分子的检测提供了一种灵敏高效的新方法。
附图说明
图1为本发明的原理图;
图2为电化学方波伏安法检测乙型肝炎病毒DNA片段的线性关系图;
图3为紫外-可见吸收法检测乙型肝炎病毒DNA片段的线性关系图。
具体实施方式
结合实施例对本发明作进一步的说明,应该说明的是,下述说明仅是为了解释本发明,并不对其内容进行限定。
实施例1
(1)取20mL分散均匀的氧化石墨烯溶液(0.5mg/mL),向其中依次加入200μL氨水和30μL水合肼(50%),将混合物搅拌5min。在60℃水浴条件下反应3.5h,将所得产物用二次水洗涤五次,在60℃真空干燥箱中充分干燥,制得还原氧化石墨烯(GN);
(2)称取上述制得的石墨烯0.2mg溶于2mL水中,超声分散均匀后,分别取两份1mL分散液,向其中分别加入53μL浓度为10-4M的DNA1(碱基序列为:5'-(AG)15TTG GTG GGC GTT-3')、53μL浓度为10-4M的DNA2(碱基序列为:5'-CAC GGT GGT CTC(AG)15-3'),室温条件下反应24h,以实现DNA与石墨烯之间的吸附反应,最终制得DNA1/GN、DNA2/GN复合物;
(3)分别取上述所得到的两种复合物各100μL,混合后向体系中加入10μL不同浓度的乙型肝炎病毒(HBV)DNA片段(碱基序列为:5'-GAG ACC ACC GTG AAC GCC CAC CAA-3')。室温反应12h,制得不同浓度(DNA1/GN-tDNA-DNA2/GN)n复合物;
(4)在步骤(3)过程中分别向各个反应体系加入0.614μL浓度为5×10-3M的氯高铁血红素(hemin),实现hemin在石墨烯表面的吸附,室温下反应至步骤(3)反应完毕;
(5)将步骤(4)所得到的产物在10000r/min下离心5min,使反应过程形成的层层复合物沉淀与未连接成功的石墨烯分离,用于后期检测;
(6)将金电极先后用0.5μm和0.03μm的Al2O3粉末打磨成镜面。用二次水清洗后,依次置于乙醇和二次水中超声2~3min。处理完成后,用0.5M的浓硫酸对电极进行活化,直到得到稳定的循环伏安扫描图,扫描电压为0.20~1.65V,扫速为0.1V·s-1。最后用二次水冲洗,氮气吹干;
(7)取10μL步骤(5)所得的复合物沉淀滴涂在处理后的金电极表面,室温下干燥,使复合物固定在金电极表面;
(8)将上述金电极沉浸在10mL含有MB(0.5mM)的tris-HCl溶液中,利用三电极工作体系(铂丝电极/金电极/甘汞电极)进行电化学检测,测定其方波伏安响应信号(参数设置分别为,电位区间:-0.6V~0V;振幅:25mV;频率:10Hz);
(9)取50μL步骤(5)中的上清液,加入到含有20μL 3,3',5,5'-四甲基联苯胺(TMB)、1.89mL TMB缓冲液(0.1mol/L柠檬酸-0.2mol/L磷酸氢二钠缓冲液,pH 5.0~5.4)和40μL过氧化氢(H2O2)的混合溶液中,进行紫外-可见吸光检测(波长范围500~800nm)。
实施例2
(1)取20mL分散均匀的氧化石墨烯溶液(0.5mg/mL),向其中依次加入200μL氨水和30μL水合肼(50%),将混合物搅拌5min。在60℃水浴条件下反应3.5h,将所得产物用二次水洗涤五次,在60℃真空干燥箱中充分干燥,制得还原氧化石墨烯(GN);
(2)称取上述制得的石墨烯0.2mg溶于2mL水中,超声分散均匀后,分别取两份1mL分散液,向其中分别加入53μL浓度为10-4M的DNA1(碱基序列为:5'-(AG)15TGG GCG GCA TGA A-3')、53μL浓度为10-4M的DNA2(碱基序列为:5'-CCG GAG GCC CAT C(AG)15-3'),室温条件下反应24h,以实现DNA与石墨烯之间的吸附反应,最终制得DNA1/GN、DNA2/GN复合物;
(3)分别取上述所得到的两种复合物各100μL,混合后向体系中加入10μL不同浓度的TP53靶DNA(碱基序列为:5'-GAT GGG CCT CCG GTT CAT GCC GCC CA-3')。室温反应12h,制得不同浓度(DNA1/GN-tDNA-DNA2/GN)n复合物;
(4)在步骤(3)过程中分别向各个反应体系加入0.614μL浓度为5×10-3M的氯高铁血红素(hemin),实现hemin在石墨烯表面的吸附,室温下反应至步骤(3)反应完毕;
(5)将步骤(4)所得到的产物在10000r/min下离心5min,使反应过程形成的层层复合物沉淀与未连接成功的石墨烯分离,用于后期检测;
(6)将金电极先后用0.5μm和0.03μm的Al2O3粉末打磨成镜面。用二次水清洗后,依次置于乙醇和二次水中超声2~3min。处理完成后,用0.5M的浓硫酸对电极进行活化,直到得到稳定的循环伏安扫描图,扫描电压为0.20~1.65V,扫速为0.1V·s-1。最后用二次水冲洗,氮气吹干;
(7)取10μL步骤(5)所得的复合物沉淀滴涂在处理后的金电极表面,室温下干燥,使复合物固定在金电极表面;
(8)将上述金电极沉浸在10mL含有MB(0.5mM)的tris-HCl溶液中,利用三电极工作体系(铂丝电极/金电极/甘汞电极)进行电化学检测,测定其方波伏安响应信号(参数设置分别为,电位区间:-0.6V~0V;振幅:25mV;频率:10Hz);
(9)取50μL步骤(5)中的上清液,加入到含有20μL 3,3',5,5'-四甲基联苯胺(TMB)、1.89mL TMB缓冲液(0.1mol/L柠檬酸-0.2mol/L磷酸氢二钠缓冲液,pH5.0~5.4)和40μL过氧化氢(H2O2)的混合溶液中,进行紫外-可见吸光检测(波长范围500~800nm)。
实施例3
(1)取20mL分散均匀的氧化石墨烯溶液(0.5mg/mL),向其中依次加入200μL氨水和30μL水合肼(50%),将混合物搅拌5min。在60℃水浴条件下反应3.5h,将所得产物用二次水洗涤五次,在60℃真空干燥箱中充分干燥,制得还原氧化石墨烯(GN);
(2)称取上述制得的石墨烯0.2mg溶于2mL水中,超声分散均匀后,分别取两份1mL分散液,向其中分别加入53μL浓度为10-4M的DNA1(碱基序列为:5'-(AG)15GAG GAC ATC GCC CAT-3')、53μL浓度为10-4M的DNA2(碱基序列为:5'-AGA CGC CAG CAA TAT(AG)15-3'),室温条件下反应24h,以实现DNA与石墨烯之间的吸附反应,最终制得DNA1/GN、DNA2/GN复合物;
(3)分别取上述所得到的两种复合物各100μL,混合后向体系中加入10μL不同浓度的特定靶DNA(碱基序列为:5'-ATA TTG CTG GCG TCT ATG GGC GAT GTC CTC-3')。室温反应12h,制得不同浓度(DNA1/GN-tDNA-DNA2/GN)n复合物;
(4)在步骤(3)过程中分别向各个反应体系加入0.614μL浓度为5×10-3M的氯高铁血红素(hemin),实现hemin在石墨烯表面的吸附,室温下反应至步骤(3)反应完毕;
(5)将步骤(4)所得到的产物在10000r/min下离心5min,使反应过程形成的层层复合物沉淀与未连接成功的石墨烯分离,用于后期检测;
(6)将金电极先后用0.5μm和0.03μm的Al2O3粉末打磨成镜面。用二次水清洗后,依次置于乙醇和二次水中超声2~3min。处理完成后,用0.5M的浓硫酸对电极进行活化,直到得到稳定的循环伏安扫描图,扫描电压为0.20~1.65V,扫速为0.1V·s-1。最后用二次水冲洗,氮气吹干;
(7)取10μL步骤(5)所得的复合物沉淀滴涂在处理后的金电极表面,室温下干燥,使复合物固定在金电极表面;
(8)将上述金电极沉浸在10mL含有MB(0.5mM)的tris-HCl溶液中,利用三电极工作体系(铂丝电极/金电极/甘汞电极)进行电化学检测,测定其方波伏安响应信号(参数设置分别为,电位区间:-0.6V~0V;振幅:25mV;频率:10Hz);
(9)取50μL步骤(5)中的上清液,加入到含有20μL 3,3',5,5'-四甲基联苯胺(TMB)、1.89mL TMB缓冲液(0.1mol/L柠檬酸-0.2mol/L磷酸氢二钠缓冲液,pH5.0~5.4)和40μL过氧化氢(H2O2)的混合溶液中,进行紫外-可见吸光检测(波长范围500~800nm)。
对乙型肝炎病毒DNA片段检测结果表明,不同浓度的靶DNA在电化学和紫外-可见吸收检测过程中均表现出较好的响应信号。其中,在方波伏安检测过程中,峰电流与10-13~10-5M范围内靶DNA浓度的对数呈线性相关(图2),检测限(LOD)为5.29×10-14M;在紫外-可见吸收检测过程中,吸光度与10-13~10-6M范围内靶DNA浓度的对数呈线性相关(图3),检测限(LOD)为3.67×10-5M。因此可确定本发明可有效地对靶DNA进行浓度分析。
上述实例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,所属领域技术人员应该明白,在本发明的技术方案的基础上,本领域技术人员不需要付出创造性劳动即可做出的各种修改或变形仍在本发明的保护范围。
SEQUENCE LISTING
<110> 青岛大学 江西中烟工业有限责任公司 清华大学
<120> 靶DNA引发的层层自组装石墨烯基光电生物传感器及其检测方法和应用
<130>
<160> 9
<170> PatentIn version 3.3
<210> 1
<211> 24
<212> DNA
<213> 人工序列
<400> 1
gagaccaccg tgaacgccca ccaa 24
<210> 2
<211> 42
<212> DNA
<213> 人工序列
<400> 2
agagagagag agagagagag agagagagag ttggtgggcg tt 42
<210> 3
<211> 42
<212> DNA
<213> 人工序列
<400> 3
cacggtggtc tcagagagag agagagagag agagagagag ag 42
<210> 4
<211> 26
<212> DNA
<213> 人工序列
<400> 4
gatgggcctc cggttcatgc cgccca 26
<210> 5
<211> 43
<212> DNA
<213> 人工序列
<400> 5
agagagagag agagagagag agagagagag tgggcggcat gaa 43
<210> 6
<211> 43
<212> DNA
<213> 人工序列
<400> 6
ccggaggccc atcagagaga gagagagaga gagagagaga gag 43
<210> 7
<211> 30
<212> DNA
<213> 人工序列
<400> 7
atattgctgg cgtctatggg cgatgtcctc 30
<210> 8
<211> 45
<212> DNA
<213> 人工序列
<400> 8
agagagagag agagagagag agagagagag gaggacatcg cccat 45
<210> 9
<211> 45
<212> DNA
<213> 人工序列
<400> 9
agacgccagc aatatagaga gagagagaga gagagagaga gagag 45
- 还没有人留言评论。精彩留言会获得点赞!