病毒检测方法与流程
本发明属于生物技术领域,尤其涉及一种病毒检测方法。
背景技术:
手足口病(Hand,food and mouth disease,HFMD)是由多种人肠道病毒引起的一种儿童常见传染病,易感人群多为学龄前儿童,以3岁以下年龄组发病率最高,是我国法定报告管理的丙类传染病。该病多数患者症状轻微,以发热,手、足、口、臀等多部位出现疱疹或皮疹为主要症状,少数病例可致无菌性脑膜炎、脑干、脑炎、脑脊髓炎、心肌炎、急性迟缓性麻痹、肺水肿和心脏衰竭等重症表现,多由EV71感染引起,个别重症患儿病情进展快,可导致死亡,致死原因主要为脑干、脑炎及神经源性肺水肿。该病毒的变异性较强,大量研究和临床实践证明,早期有效地发现、诊断及治疗是防治手足口传染疾病与降低死亡率的关键。现有EV71检测方法难以满足简单、快速、高灵敏、特异性、结果显而易见,且不需要复杂仪器的要求。
病毒检测的金标准是聚合酶链反应(PCR),其原理是基于检测病毒的核酸,该方法选择性好、灵敏度高。但是PCR技术技巧性极强,需要专门人员操作和特定且昂贵的PCR仪器完成检测,不具有简单、快速、易于便携的特点,特别并不适合基层的病毒检测,同时该方法目前主要局限于病毒核酸的检测,对于病毒蛋白和完整的病毒粒子的检测显得无能为力。因此发展适用于现场的简单、快速、高灵敏、抗干扰能力强、无需任何仪器的病毒检测方法是亟待解决的难题。
技术实现要素:
本发明的目的在于克服现有技术的上述不足,提供一种基于免疫磁分离技术的可视化的病毒检测方法,旨在解决现有病毒检测复杂、易受干扰、耗时费用高、适用场合有限等问题。
为实现上述发明目的,本发明采用的技术方案如下:
本发明提供一种病毒检测方法,该方法包括如下步骤:
利用不同浓度的双氧水还原同一浓度的氯金酸制备纳米金,获取纳米金标准溶液的颜色由红色变为紫色时双氧水的阈值浓度;
提供可与被检测病毒结合的免疫磁球,将所述免疫磁球加入被检测样本溶液中进行孵育、磁分离,得到包含所述免疫磁球的第一复合物;
向所述第一复合物中加入所述被检测病毒的多克隆抗体进行孵育、磁分离后,再加入生物素标记的二抗进行孵育、磁分离,得到包含所述免疫磁球的第二复合物;
向所述第二复合物中加入链霉亲和素-过氧化氢酶复合物,进行孵育、磁分离,得到包含所述免疫磁球的第三复合物;
向所述第三复合物中分别加入阈值浓度的双氧水和氯金酸进行反应,生成纳米金溶液,根据所述纳米金溶液的颜色,确定所述被检测样本溶液中是否含有所述被检测病毒:
当所述纳米金溶液呈红色时,所述被检测样本不含所述被检测病毒;
当所述纳米金溶液呈紫色或蓝色时,所述被检测样本含所述被检测病毒。
本发明提供的病毒检测方法具有如下有益效果:
1、本发明将免疫磁分离技术以及纳米金的表面等离子体共振效应应用于病毒的检测中,有效地解决了免疫分析方法容易受到复杂样品干扰的问题,具有抗干扰能力强的特点。
2、本发明进一步构建基于免疫磁球的层层信号放大策略,提高了免疫分析方法的灵敏度。
3、本发明利用免疫复合物中的酶催化作用影响纳米金的合成及其等离子体共振效应引起的裸眼可视化的颜色变化,实现对被检测病毒的可视化检测;检测结果,无需任何仪器,节省时间、降低成本,且能够实现临床样品的准确检测。这不仅为病毒的快速检测提供了新方法,同时也为面向基层的快速可视化病毒检测提供了新思路,有望为疾病的早期诊断提供新策略。
附图说明
图1为本发明实施例提供的病毒检测方法原理示意图;
图2为本发明实施例中双氧水的浓度与形成的纳米金颜色的相关性实验结果图;
图3为本发明实施例中不同浓度过氧化氢酶与形成的纳米金颜色的相关性实验结果图;
图4为本发明实施例提供的病毒检测方法的特异性研究结果图;
图5为本发明实施例提供的病毒检测方法定量检测研究结果图;
图6为本发明实施例中临床样本的检测验证结果图。
具体实施方式
为了使本发明要解决的技术问题、技术方案及有益效果更加清楚明白,以下结合附图和实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
本发明实施例提供了一种病毒检测方法。该方法包括如下步骤:
S01:利用不同浓度的双氧水还原同一浓度的氯金酸制备纳米金,获取纳米金标准溶液的颜色由红色变为紫色时双氧水的阈值浓度;
S02:提供可与被检测病毒结合的免疫磁球,将该免疫磁球加入被检测样本溶液中进行孵育、磁分离,得到包含该免疫磁球的第一复合物;
S03:向上述第一复合物中加入被检测病毒的多克隆抗体进行孵育、磁分离后,再加入生物素标记的二抗进行孵育、磁分离,得到包含上述免疫磁球的第二复合物;
S04:向上述第二复合物中加入链霉亲和素-过氧化氢酶复合物,进行孵育、磁分离,得到包含上述免疫磁球的第三复合物;
S05:向上述第三复合物中分别加入阈值浓度的双氧水和氯金酸进行反应,生成纳米金溶液,根据该纳米金溶液的颜色,确定被检测样本溶液中是否含有被检测病毒:
当纳米金溶液呈红色时,被检测样本不含被检测病毒;
当纳米金溶液呈紫色或蓝色时,被检测样本含被检测病毒。
本发明实施例的病毒检测方法基于免疫磁放大的构建以及纳米金表面等离子体共振效应引起的裸眼可视化信号的产生。图1为本发明实施例提供的病毒检测方法原理示意图,根据图1所示,当存在被检测病毒(本实施例为EV71病毒)时,免疫反应能有序进行,过氧化氢酶能够通过免疫反应结合在病毒表面,水解加入的双氧水,从而影响双氧水还原3价态的金离子,形成紫色到蓝色的团聚型的纳米金溶液;当不存在被检测病毒(EV71病毒)时,病毒无法被修饰有被检测病毒的多克隆抗体(本实施例为抗VP1单克隆抗体)的免疫磁球捕获,后续的免疫反应无法发生,过氧化氢酶也在加入后被洗脱,无法催化水解后续加入的双氧水,从而不影响双氧水还原纳米金,所形成的纳米金为分散的红色溶液,最终实现裸眼可视化的被检测病毒(EV71病毒)检测。
本实施例提供的病毒检测方法具有简单、快速、高灵敏且无需任何仪器的可视化病毒检测的特点,并且能够应用于实际样品的准确检测。这不仅为病毒的快速检测提供了新方法,同时也为面向基层的快速可视化病毒检测提供了新思路,有望为疾病的早期诊断提供新策略。
优选地,上述步骤S01中,在室温条件下,根据不同浓度双氧水还原一定浓度的氯金酸,考察其合成纳米金颜色的变化,寻找颜色由分散的红色纳米金到紫色时双氧水的浓度阈值,该浓度阈值作为后续实验的双氧水加入浓度以及氯金酸的加入浓度。同时还可以进一步考察该浓度阈值条件下,双氧水与不同浓度过氧化氢酶孵育,考察所形成的纳米金颜色变化情况,说明过氧化氢酶水解双氧水,影响双氧水还原氯金酸,进而影响纳米金的尺寸和形貌,引起基于纳米金表面等离子体共振效应的裸眼可视化颜色的变化
优选地,上述步骤S02中,免疫磁球制备过程为:利用EDC/NHS活化法将被检测病毒的单克隆抗体偶联到磁性纳米球表面,并用含有牛血清白蛋白和叠氮化钠的磷酸盐缓冲溶液保存该免疫磁球。且该磁性纳米球表面表面带羧基,该磁性纳米球为超顺磁球,直径为500nm。
EDC/NHS活化法是常见的磁性纳米球表面活化法。本实施中,将EDC(1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐)和NHS(N-羟基琥珀酰亚胺)分别溶解在MES缓冲液(0.1M MES,0.15M NaCl,pH=6.5)中,再依次加入到超顺磁球中活化表面的羧基。优选地,将免疫磁球保存在含有1%牛血清白蛋白和0.05%叠氮化钠的磷酸盐缓冲溶液中,最终免疫磁球的在磷酸盐缓冲溶液中浓度为1-2mg/mL,并于4℃保存备用。上述优选的制备方法,使该免疫磁球具有更好的免疫吸附效果,既可以将被检测病毒的单克隆抗体更好偶联到磁性纳米球表面,更能在后续阶段更有效地免疫吸附被检测病毒。
优选地,上述步骤S02中,该免疫磁球加入被检测样本溶液中进行孵育的条件为:37℃,150rpm摇床30min。上述步骤S03中,第一复合物中加入被检测病毒的多克隆抗体进行孵育的条件为:37℃,150rpm摇床30min,再加入生物素标记的二抗进行孵育条件为:37℃,150rpm摇床1h。上述步骤S04中,第二复合物中加入链霉亲和素-过氧化氢酶复合物,进行孵育条件为:37℃,150rpm摇床1h。该优选的孵育条件选择相结合的条件下,产生协同作用,能获得特异性更强的包含上述免疫磁球的第三复合物,进一步提高后续双氧水和氯金酸进行反应生成纳米金的颜色观察准确性,从而有效地提高该病毒检测的抗干扰能力。本实施例中,第三复合物即为:免疫磁球-病毒-多抗-生物素二抗-链霉亲和素-过氧化氢酶的免疫夹心复合物。
优选地,上述步骤S03中,该被检测病毒的多克隆抗体和生物素标记的二抗质量比为:1:2。本实施例中,优选100μL 5μg/mL的多克隆抗体和100μL10μg/mL的生物素标记的二抗。在该优选的质量比范围内,可提高包含上述免疫磁球的第三复合物的浓度控制,进一步适应后续纳米金的颜色观察。
优选地,上述步骤S05中,向第三复合物中分别加入阈值浓度的双氧水和氯金酸的体积相等,且氯金酸的浓度为0.40mM时,双氧水的阈值浓度为0.36mM。该条件下,更能准确地观察后续纳米金的颜色变化。
优选地,本发明实施例提供的病毒检测方法中,被检测病毒为EV71病毒(Enteroviruse 71,即人肠道病毒71型),且单克隆抗体为抗VP1(viral protein1,即病毒蛋白1型)单克隆抗体,而多克隆抗体为抗VP1多单克隆抗体。同时,定量检测EV71病毒浓度的吸收波长为540nm。EV71病毒的检测方法不仅为该病毒的快速检测提供了新方法,同时为疾病的早期诊断提供新策略。
本发明先后进行过多次试验,现举一部分试验结果作为参考对发明进行进一步详细描述,下面结合具体实施例进行详细说明。
实施例1双氧水浓度与合成纳米金颜色变化的相关性构建
用1mM,pH=6.5的2-(N-吗啉)乙磺酸缓冲液配制不同浓度的双氧水,同时用该缓冲液配制0.40mM的氯金酸溶液。分别取100μL新配制的不同浓度的双氧水加入到96孔板中,每个孔中再加入100μL新配制的氯金酸溶液,混合均匀,室温下孵育30min,观察溶液的颜色,并用酶标仪记录其紫外可见吸收光谱以及540nm处的吸光度变化情况。
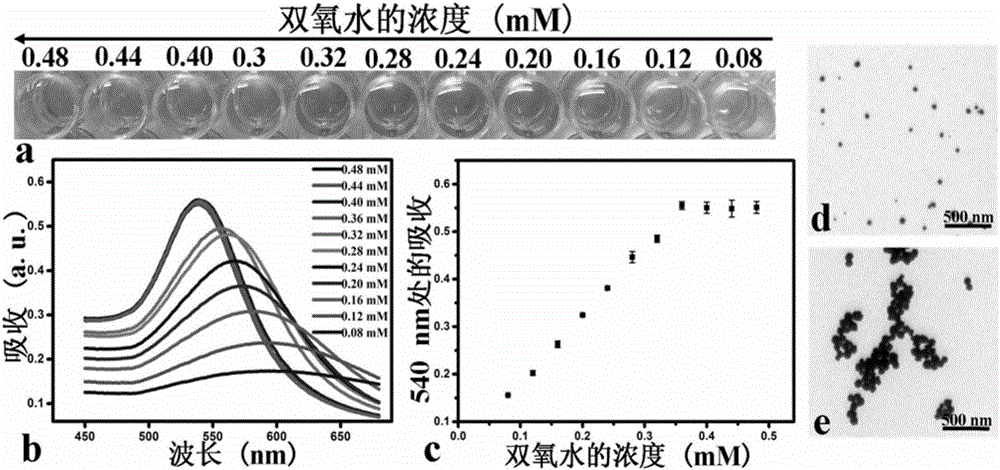
其结果如图2所示,不同浓度的双氧水与0.4mM氯金酸共孵育,观察最后双氧水还原氯金酸后的溶液颜色。图2(a)为孵育30min后,已合成的纳米金溶液显示不同的颜色。并且从红色到紫色再到蓝色产生了一个显著的颜色变化:当双氧水浓度为0.36mM时,则合成的纳米金为红色溶液,当双氧水浓度低于0.36mM时,溶液呈现出从红色到蓝色最后到蓝色的显著性变化,并且随着双氧水浓度越低,溶液颜色越往蓝色波段移动。图2(b)为不同纳米金溶液的紫外可见吸收光谱,当双氧水浓度高于0.36mM时,最大吸收为540nm,且峰形较尖,当双氧水浓度低于0.36mM时,最大吸收发生红移且峰形变宽,吸收光谱的结果与生成纳米金溶液颜色的变化一一对应当双氧水浓度低于0.36mM时,纳米金的表面等离子体共振吸收峰会发生显著地红移。图2(c)为紫外可见吸收光谱中吸收波长为540nm处的吸光度值,当双氧水浓度低于0.36mM时,540nm处的吸光度会逐渐降低。图2(d)和图2(e)是双氧水浓度分别为0.36mM和0.32mM时,形成的纳米金电镜结果,电镜结果表明,双氧水浓度低于0.36mM时,形成的纳米金为团聚型纳米金,当双氧水浓度为0.36mM时,所形成的纳米金为分散型纳米金。
同时进一步探讨了过氧化氢酶水解双氧水,影响纳米金的形成,将一定浓度的双氧水与不同浓度过氧化氢酶孵育,其它实验过程与上述保持一致。
其实验结果如图3所示:图3(a)为不同浓度的过氧化氢酶与相同浓度的双氧水孵育后,再与0.4mM氯金酸反应所形成的纳米金。基于过氧化氢酶可以催化水解双氧水,降低了双氧水的浓度,从而产生了肉眼可见的纳米金颜色的从红色到紫色再到蓝色的显著变化。图3(b)为上述不同纳米金溶液的紫外可见吸收光谱。随着过氧化氢酶的增加,纳米金的表面等离子体共振吸收峰逐渐发生红移。图3(c)为吸收波长在540nm处的吸光度,与图3(b)和图3(a)吻合。
实施例2EV71病毒的检测方法
一种EV71病毒的检测方法,包括如下步骤:
S11:利用实施例1提供的方法,当双氧水和氯金酸的等体积反应,氯金酸的浓度为0.40mM时,双氧水的阈值浓度为0.36mM。
S12:制备可与被检测EV71病毒结合的免疫磁球,将该免疫磁球加入被检测样本溶液中进行孵育、磁分离,得到包含该免疫磁球的第一复合物即免疫磁球-病毒复合物。具体过程如下:
取10μL 50mg/mL表面带羧基的超顺磁球(500nm)用pH为7.2,0.1M磷酸盐缓冲液洗涤三次,将50mM EDC(1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐)和50mM NHS(N-羟基琥珀酰亚胺)分别溶解在MES缓冲液(0.1M MES,0.15M NaCl,pH=6.5)中,再依次加入到超顺磁球中(终体积为400μL)于37℃反应30min活化表面的羧基。活化的磁球用pH为7.2,0.1M磷酸盐缓冲液洗涤三次。接下来将20μL(0.50mg/mL)单克隆抗VP1抗体加入到活化的磁球中(终体积400μL)于37℃,150rpm摇床上反应4h,用pH为7.2,0.1M磷酸盐缓冲液洗涤三次出去多余的抗体,将免疫磁球保存在含有1%牛血清白蛋白和0.05%叠氮化钠的磷酸盐缓冲溶液中(终体积500μL),则免疫磁球的浓度为1mg/mL,于4℃保存备用。
取50μL 1mg/mL的上述免疫磁球用PBST(1×PBS缓冲液中包含0.1%的吐温20,pH为7.4)洗涤三次;将不同浓度的EV71病毒样品加入到免疫磁球中(终体积100μL),于37℃,150rpm摇床上反应30min,磁分选,再用PBST洗涤三次,得到免疫磁球-病毒复合物(第一复合物)。
S13:向上述第一复合物中加入被检测病毒的多克隆抗体进行孵育、磁分离后,再加入生物素标记的二抗进行孵育、磁分离,得到包含上述免疫磁球的第二复合物即免疫夹心复合物。具体过程如下:
向第一复合物中加入100μL 5μg/mL的抗VP1的兔多克隆抗体,于37℃,150rpm摇床上反应30min,磁分选,再用PBST洗涤三次,再向其加入100μL10μg/mL的生物素标记的羊抗兔二抗,于37℃,150rpm摇床上反应1h,所得到的免疫夹心复合物磁分选后,再用PBST洗涤3次。
S14:向上述第二复合物中加入链霉亲和素-过氧化氢酶复合物,进行孵育、磁分离,得到包含上述免疫磁球的第三复合物即免疫磁球-病毒-多抗-生物素二抗-链霉亲和素-过氧化氢酶免疫夹心复合物。具体过程如下:
向第二复合物(免疫夹心复合物)中加入用2%牛血清白蛋白的磷酸盐缓冲液稀释的链霉亲和素-过氧化氢酶复合物,于37℃,150rpm摇床上反应1h,磁分选后,用PBST洗涤三次,再用磷酸盐缓冲洗涤二次,最后用超纯水洗涤一次,得到免疫磁球-病毒-多抗-生物素二抗-链霉亲和素-过氧化氢酶免疫夹心复合物(即第三复合物)。
S15:向上述第三复合物中分别加入阈值浓度的双氧水和氯金酸进行反应,生成纳米金溶液,根据该纳米金溶液的颜色,确定被检测样本溶液中是否含有被检测病毒。具体过程如下:
1mM,pH=6.5的2-(N-吗啉)乙磺酸缓冲液新鲜配制0.36mM的双氧水,取100μL 0.36mM的双氧水加入到上述连接有过氧化氢酶的第三复合物中,室温下孵育30min,磁分选后,吸取清液加入到96孔板中,再向该液体中加入新鲜配制的100μL 0.40mM氯金酸溶液,孵育30min后,裸眼观察检测液的颜色以及用酶标仪测量其紫外可见吸收光谱以及540nm处的吸光度。
同时,本实施例还采用了对照实验。对于对照实验,使用其它常见的肠道病毒,如柯萨奇A2、柯萨奇A6、柯萨奇A16以及埃可病毒18作为阴性对照样品,2%牛血清白蛋白的磷酸盐缓冲液作为试剂空白,其它操作步骤与上述一致。
本实施例的检测结果如图4所示,图4(a)为阴性对照以及阳性组实验的检测结果,很明显可以看出,只有被检测病毒为为EV71病毒时,所形成的纳米金颜色为蓝紫色,其它病毒及试剂空白组为红色。图4(b)为其对应的形成纳米金的电镜结果,标尺为200nm。当为其它病毒及试剂空白时,所形成的纳米金为分散的纳米金颗粒,而当被检测病毒为EV71时,则为团聚型的较大纳米金,该电镜结果与纳米金的颜色是完全一致的。图4(c)为所形成的纳米金的紫外可见吸收光谱,当被检测病毒为其它病毒以及试剂空白时,其最大吸收峰为540nm,吸收峰较窄,而当被检测病毒为EV71病毒时,最大发射峰发生明显红移,且峰形变宽。统计了吸收波长在540nm处的降低值,可以发现,只有被检测病毒为EV71时,其在540nm处吸收波长的变化值最大,说明了方法的特异性好。
图5为本实施例提供发病毒检测方法的定量检测研究结果图。其实现不同浓度EV71病毒的检测,用以考察该方法的检出限。如图5所示,随着EV71病毒浓度的降低,所形成的纳米金颜色从红色到蓝色,最后到紫色图5(a),并且能够与紫外可见吸收光谱的结果一一对应;吸收光谱结果图5(b)显示,当病毒浓度升高时,最大吸收波长发生红移,峰形变宽,这个结果是因为随着病毒浓度升高,偶联在免疫复合物上的过氧化氢酶会增加,则能够水解更多的双氧水,导致双氧水浓度降低,影响了后续氯金酸的还原,导致形成了团聚型的纳米金,颜色的改变是由于吸收光谱的变化。为了定量检测EV71病毒的浓度,将吸收波长在540nm处的吸光度降低值作为记录的标准,其540nm处的吸光度的降低值图5(c)随着病毒浓度的增加逐渐升高,其线性范围为0.8-10ng/mL,线性相关系数为0.997,其检出限为0.65ng/mL。
实施例3临床样品的检测验证
采集30个手足口病患儿的咽拭子和肛拭子,包括10例EV71病毒感染的样本和20例其它病毒感染的样本,用Hank’s平衡盐溶液处理后,按照实施例1和实施例2中已构建的检测体系实现对EV71病毒的检测,并与临床检测的金标准荧光定量PCR方法进行对比,说明本实施例提供的方法的可靠性和准确性。
该检测结果如图6所示,其中图6左边为检测液产生的颜色,可以看出有20个样品检测液为红色,有10个样品检测液为紫色或者蓝紫色。图6右边的表格与左图的a,b,c是统一的,荧光定量PCR的结果与本发明实施例提供的方法的检测结果是完全一致的,并且与吸收波长在540nm处吸光度的降低值是一致的,说明了该发明能够有效避免复杂体系的干扰,具有较强的抗干扰能力且具有高的精准性,能够实现临床样品的检测。
通过上述实施例可知,本发明提供的病毒检测方法可以实现高灵敏的被检测病毒可视化检测,其操作简单快速,具有抗干扰性强、灵敏度高特点,且无需任何仪器,为面向基层的病毒检测提供了新思路,有望为疾病的早期诊断提供新策略。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!