对样品中的靶分子进行检测和定量的方法与流程
本申请为国际申请日2012年3月19日、国际申请号pct/ep2012/054768于2013年9月23日进入中国国家阶段、申请号201280014694.3、发明名称“对样品中的靶分子进行检测和定量的方法”的分案申请。
本发明涉及一种通过质谱法对样品中的至少一种靶分子进行检测和定量的方法。更具体地,本发明提供一种直接在样品表面上通过使用质谱法成像、特别是基质辅助的激光解吸/电离(maldi)成像对靶分子进行检测和定量的方法。
通常,本发明可以应用在其中对样品中的分子进行定量是有用或必要的任何领域中。本发明可以应用在例如药物领域中以对药物在各种生物组织中的分布和药动学进行研究。另外,本发明可以应用在农业化学领域中,特别是用于对诸如除草剂的分子在植物和/或环境(土壤、周围地下水等)中的毒性和降解进行评估。
背景技术:
质谱法是化学和生物化学分析中广泛已知并用于检测和鉴定样品中的目标分子的技术。近年来已经开发了质谱法分子成像例如maldi成像,使得可以直接在生物组织切片上将目标分子的分布可视化。maldi成像,由于其高灵敏度,使得可以直接在样品表面上将非常大量的不同分子的分布同时可视化。在药物领域中,这种技术使得例如可以对处理期间各种时间点处各种器官中的分子分布进行比较。
然而,如果希望对在时间t处由此检测到的分子进行定量,则需要将该成像技术通过传统方法或仪器方法与定量化学分析进行偶联。该第二定量步骤可能是处理和解释错误的来源。而且,它不能使目标分子的存在与其在样品中的定量分布直接关联。
技术实现要素:
本发明提出一种在单一分析期间通常使用质谱法来检测并任选地定量样品中的靶分子的方法。优先地,本发明的方法使用质谱法成像,所述质谱法成像使得能够直接在样品上自动获取与分子的质谱相关的信号,从而重建所述靶分子在样品中的分布图像和至少相对量。
为此,根据本发明,对靶分子的消光系数(tec)(对给定样品中的每种靶分子特异性的)进行限定并将其整合到所述方法中。事实上,在给定浓度下的给定分子不发出相同强度的信号,这依赖于所检测的分子所处在其中的样品。类似地,给定样品中相同浓度的两种不同分子具有不同的信号强度。tec的计算和整合使得可以识别并考虑到与待分析的样品中靶分子的质谱相关的信号强度变化。然后,可以使用tec对所述分子得到的信号进行归一化,从而使其代表其浓度,与样品的性质及其在所述样品中的位置无关。由此可以根据所得到的分析样品中靶分子的质谱法结果直接对分子进行定量。
由此本发明的一个目的涉及通过质谱法对样品中的至少一种靶分子进行鉴定和/或定量的方法,所述方法包括以下步骤:
a)将待分析的样品沉积在支持物上;
b)通过质谱法对所述样品进行分析,从而得到所述样品中靶分子的质谱;
c)通过对靶分子和样品特异性的消光系数(tec)对与所述样品中靶分子的质谱相关的信号进行加权;以及任选地
d)使用靶分子的加权信号来确定样品中靶分子的量。
本发明的方法可以应用于能够通过质谱仪分析的任何类型的样品,无论所述样品为有机或无机的液体或固体。本发明的方法还适用于质谱法中可使用的任何类型的支持物(载玻片、板、膜等)。所述方法由此特别适用于分析生物组织。在此情形中,制备组织切片,典型地在数微米厚的数量级上,并将其沉积在支持物如载玻片上,使其能够引入质谱仪中。本发明的方法还可以用于分析所有生物液体如血液、血浆、血清、唾液、脑脊液、尿等。本发明的方法还可以用于分析环境样品如土壤、水、植物等的样品。
在步骤a)期间,可以通过任何已知技术即手动(例如利用移液管)或自动(例如通过使用成斑装置或通过喷雾或升华)地沉积样品。可以在沉积到样品支持物上之前对样品进行稀释或处理。
可以通过任何质谱法、特别是使用直接质谱法(ms)或串联质谱法(msn、mrm、srm)进行靶分子的分析的步骤b)。
对实验参数例如质量范围和/或激光强度进行有利设定,从而在强度、灵敏度和分辨率方面优化靶分子的检测。
然后获取质谱。
对于步骤c),各种光谱特性可以被用作信号,特别是质谱的峰强度、信噪比(s/n)、峰面积等。
所述方法的重要步骤在于测得的信号的归一化。为此,通过对分子和样品特异性的消光系数(tec)对被选择作为样品中靶分子的信号的光谱特性进行加权。这种加权将信号归一化并使其仅取决于信号起源处分子的量。
tec代表与惰性样品支持物上靶分子的信号相比或与标准分子的信号相比,靶分子的信号强度随样品性质和/或其在样品上的位置而变的损失或增加。tec取决于数种因素,特别是样品的起源(动物、植物、细菌、无机物质)、表面类型(组织、植物细胞、金属等)、化学环境、是否存在样品的化学处理等。在生物组织样品的情形中,分子的消光系数对应于组织的消光系数。
有利地,对样品进行初步组织学、化学或其他研究,以限定各种目标区域并将其用于计算tec。事实上,tec可以与样品的特定区域相关联,特别是在非均质样品上。
在一个实施方案中,可通过如下关系得到tec:
或相反地:
所述信号对应于所选择的靶分子的质谱的光谱特性,例如在质谱仪上得到的所述分子的峰强度。当然,对于参比介质中和样品上的分子,所使用的光谱特性必须相同。
使用参比介质中和待分析的样品上相同浓度的靶分子来计算tec。也可以使用与靶分子具有类似物理化学性质的相关分子来代替参比介质中的靶分子。
对于该tec的计算,参比介质有利地对应于单独的样品支持物。为此,例如,将分子溶解在合适的介质(有机溶剂、水等)中,然后沉积在样品支持物上。在沉积之后,蒸发溶剂,从而得到分子在所述支持物上的干燥沉积物。得到样品支持物上所述分子的信号,然后将其用于tec。
tec值通常是相同条件下靶分子的数次测量结果的平均值,从而得到可靠的系数。
优先地,对于给定类型的样品中给定的靶分子,消光系数(tec)仅计算一次,并将其重复用于给定类型的样品中所述靶分子的每个分析。由此,对于给定的靶分子,可以有利地产生tec数据库,并将所述tec数据库用于各种样品中所述分子的每个分析,所述数据库列出了数种不同样品中靶分子的tec。
或者,可以在每个分析之前确定tec值。
在另一个实施方案中,通过如下关系得到tec:
或相反地:
所述信号对应于所选择的分子的质谱的光谱特性,例如在质谱仪上得到的所述分子的峰强度。当然,对于标准分子和靶分子,所使用的光谱特性必须相同。
在本发明的上下文中,“标准分子”是指结构上类似于靶分子的分子。优先地,标准分子的分子量与靶分子的分子量不同,从而可以容易地分析得到的质谱。例如,标准分子的分子量与靶分子的分子量相差1至17道尔顿(dalton)。有利地,为了不使总信号饱和,对标准分子的浓度进行限定,所述标准分子被容纳在增溶溶液(水性或含有溶剂)中。
在具体实施方案中,标准分子是靶分子的氘化分子,即用氘标记的分子或用任何其它合适的同位素标记的分子,以作为标准分子。对分析样品中的靶分子及其氘化补体(或标记有同位素的相应分子)同时进行评估。考虑到它们的电离是相同的,所以通过质谱法对它们进行分析将得到相同的信号,其中质量方面的差异是由于存在同位素而造成的。因为标记有同位素的分子的浓度是已知的,于是可以计算比率以得到相对量。
有利地,在分析步骤b)之前,将已知浓度的标准分子添加到待分析的样品,所述标准分子的分子量也是已知的。当本发明的方法使用需要使用基质的质谱法成像技术如maldi或基质增强的次级离子质谱法(me-sims)成像时,可以在使用前将标准分子添加到基质。将基质/标准分子的混合物均匀沉积到样品上以及样品外围即样品支持物上,以使得能够计算tec。在干燥期间,可以利用裸眼对混合物的共结晶进行观察。
优先地,在沉积之前,将混合物匀化。
使用标准分子的这种tec还可以与不需要基质溶液的成像技术如激光解吸/电离(ldi)、解吸电喷雾电离(desi)、激光消融电喷雾电离(laesi)或次级离子质谱法(sims)一起使用。在此情形中,可以通过使用相同的沉积装置,在不与基质混合的条件下,将标准分子沉积到样品和支持物上。因此样品被标准分子浸渍,所述标准分子可以被用作参比以供研究用。
浓度已知的标准分子所得到的信号被用于将靶分子的光谱特性归一化,从而在考虑到抑制效应的同时得到靶分子分布的真正可视化。另外,通过将靶分子的信号与标准分子的信号进行比较,标准分子所得到的信号至少可用于推导出样品中靶分子的相对量。还可以补偿基质效应,如同下面所进一步详细描述的。
在步骤d)期间,样品中测得的加权信号可以用于对所述分子进行定量。加权信号对应于作为相应计算的tec的函数增加或减少的靶分子所得到的信号强度。更精确地,加权信号对应于样品中靶分子的信号与相关tec之比,或者加权信号对应于相关tec与样品中靶分子的信号之比。
加权信号的值仅取决于分子的浓度。由此,例如通过参照靶分子的参比信号可确定靶分子的量。
表述“靶分子的参比信号”是指代表已知浓度、与样品的性质及其在样品中的位置无关的信号。参比信号可以是针对已知量的给定分子预先确定或建立的平均值或中值(或平均值或中值的范围)。其还可以是标准曲线。
根据所选择的方法,并且如果需要的话,根据所使用的参比信号,可以以相对或绝对方式确定靶分子的量。
例如,通过使用在参比介质例如其上已沉积有溶解分子的样品支持物中的至少三种不同已知浓度的靶分子(或具有与靶分子类似的物理化学性质的另一种分子)制备标准范围,来得到参比信号。如果将分子沉积在组织样品上,在沉积并蒸发溶解介质之后将分子有利地吸附在所述组织上。
可以在所述标准范围内引入不同于靶分子的内标,从而将所述靶分子的信号归一化。用作内标的分子有利地具有与靶分子类似的物理化学性质。在沉积之前向靶分子的标准范围添加恒定浓度的这种内标。
接下来,对每个浓度的质谱进行分析。对于每个所述浓度,读取被选择作为比较信号的光谱特性。有利地,在得到每个浓度点的质谱之后,所选择的相关光谱特性可以用于建立所述分子的校准曲线。于是足以参考该校准曲线来精确确定分析样品中的浓度。
本发明的方法可以有利地与质谱法成像一起使用。在此情形中,可使用与各种类型的分析仪如飞行时间(tof)、orbitrap、傅里叶变换离子回旋共振(fouriertransformioncyclotronresonance)(ft-icr)等组合的各种电离源如maldi、激光解吸/电离(ldi)、解吸电喷雾电离(desi)等。这种成像技术使得可以直接在样品所得到的离子密度图上对靶分子进行定量,所述离子密度图对应于所述样品中靶分子的空间分布。所述离子密度图上的加权信号可以真正与目标分子的特定参比信号进行比较。
某些质谱法成像技术如maldi或me-sims要求利用基质预先对待分析的样品进行覆盖,所述基质包含小的吸收uv的有机分子。这种基质使得存在于样品上的分子能够解吸并电离。
无论所选择的基质如何,都可以使用本发明的方法。这些基质以固体形式(在样品上结晶)或液体形式被提供,并且为离子的或非离子的。根据分析的质量范围选择基质。通常在使用前片刻将它们制备在溶剂/水性溶液混合物中。
用于沉积基质的数种方法是可能的,特别是使用移液管的手动沉积,所述手动沉积使得可以将精确体积的基质直接沉积在样品上。也可以通过喷雾或通过雾化来沉积基质,其中通过机器人系统或手动地将基质直接喷雾或雾化在组织上。类似地,可以设想通过微滴进行的沉积,其中通过压电、声音或注射泵系统将基质点在样品上。还可以通过筛分来沉积基质,从而以固体形式沉积基质。
有利地,如果本发明的方法使用maldi质谱法成像,则可以预期的是对样品上基质沉积的均匀性进行评估的步骤。事实上,与所使用的基质对应的信号可以指示所述基质的沉积的量/均匀性。于是,样品表面上的基质缺陷可以与所研究的样品中无法检测到靶分子信号相关联或与靶分子信号强度损失相关联。
可以根据定性标准通过在光学显微镜下对样品表面上的沉积均匀性进行观察,和/或根据定量标准通过监测样品上与基质自身相关的信号变化,来对基质的均匀性进行评估。
关于定性标准,必须确保基质已尽可能均匀地沉积在所研究的表面上,并且不存在不含基质的区域且其结晶是最佳的。
对于基质沉积均匀性的定量评估,基质被认为是其信号在样品分析期间以与靶分子信号相同的方式进行检测的分子自身。然后,将基质分子的信号与其参比信号进行比较。在此情形中,基质的参比信号对应于由参比基质沉积物上即样品上和特定用于测量基质参比信号的样品支持物上的基质所发出的信号。
通过这些附加步骤,靶分子的信号得到验证并被归一化以将基质沉积品质的变化考虑在内,所述变化能够影响基质沉积物的光谱特性。
当希望对靶分子的存在随时间的变化进行监测时,基质效应的这种考虑是特别有利的,因为基质沉积品质可以在一个样品与下一个样品之间变化。
本发明的方法可以用于分析任何类型的分子如肽、多肽、蛋白质、氨基酸、核酸、脂质、代谢物等,总的来说是在药物学或其他方面具有活性并能够通过质谱法电离的任何分子。本发明的方法对于分析小分子(特别是药物)即分子量小于2000da的分子是特别有利的。
如果靶分子是高分子量的蛋白质,则可对靶分子进行酶和/或化学预处理以将其切割成数个肽(图2)。然后对代表所述蛋白质的从酶消化和/或化学降解/修饰得到的肽中的至少一种进行检测和定量。例如,胰蛋白酶可以用作酶以将靶蛋白质切割成预先鉴定到的数个肽。化学预处理可以由通过酸或碱的化学水解、美拉德(maillard)反应、异构肽或赖丙氨酸的形成等构成。
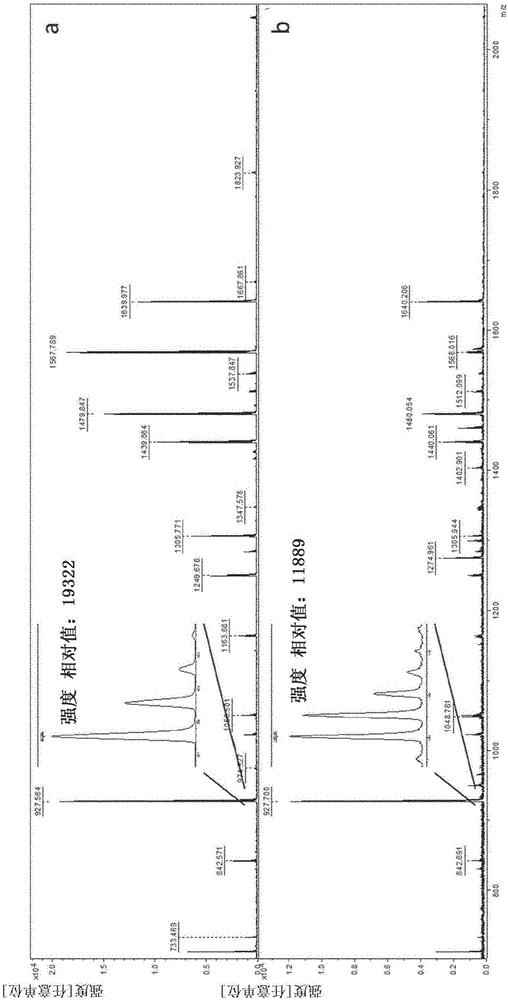
类似地,可在检测步骤b)之前使用至少一种溶剂和/或至少一种洗涤剂对待分析的样品进行处理,从而优化靶分子的检测。例如,使用氯仿进行洗涤(图1-a)去除了某些种类的脂质。使用乙醇进行洗涤(图1-b)能够更好地检测低质量分子。图1所示的实验中的这两种洗涤去除了某些分子,特别是脂质,由此促进直接在组织上检测新离子。
本发明的方法还能够用于同时或顺序检测和定量同一样品上的至少两种不同的靶分子。
本发明的方法特别适合于检测和定量生物、植物或动物组织切片上的靶分子。特别地,在整个动物的切片上的分析能够使得可以在同一样品上对所述动物的各种组织中靶分子的分布进行比较。
根据本发明,为了进行定量,可以通过整合了全部或部分这些因素的计算机程序将源数据即靶分子的tec和基质效应归一化。该计算机程序或数据分析软件有利地使用根据需要在质谱法成像的情形中在处理图像期间用基质效应进行加权的tec值。
因此,本发明的另一个目的涉及计算机可读的数据介质,其包含计算机可执行的指令,例如读取从质谱法分析得到的原始数据、和/或确定tec和/或确定校准曲线、和/或使用所述tec或所述校准曲线将所述原始数据归一化以得到靶分子的定量值。有利地,这些计算机可执行的指令适合于使得计算机系统能够至少执行本发明方法的步骤c)。
数据介质有利地包含在至少两种不同样品类型中的至少一种靶分子的至少一个tec数据库。优先地,在生物样品如整个动物的切片的情形中,数据库列出了在所述样品的各种组织中的至少一种靶分子的tec。
数据介质还可以包含质谱法成像中使用的至少一种基质的参比信号的数据库。由此,通过使用利用数据介质的成像方法,可以在样品分析期间将基质效应考虑在内。
附图说明
图1.心脏组织的质谱法直接分析中两种洗涤的效应的实施例。(a):在对基质沉积物不进行任何初步洗涤的条件下从心脏组织得到的信号。(b):在沉积基质之前使用90%乙醇进行洗涤而从与(a)相邻的切片上的心脏组织得到的信号。(c):在沉积基质之前使用100%氯仿进行洗涤而从与(a)相邻的切片上的胃组织得到的信号。
图2.消化的模型蛋白质(牛血清白蛋白,其中使用胰蛋白酶作为消化酶)在(a)参比支持物(载玻片)和(b)组织(大鼠的肝)上的maldi-tof质谱。m/z928片段(ylyeiar)的实施例:观察到与组织上的肽相关的质量信号的消光,其中tec等于1.62。
图3.根据使用质谱法成像实施的实施例,本发明方法的基本步骤的示意图。
图4.在研究普萘洛尔在小鼠全身中的分布中用于计算组织消光系数的方法。(a)用于将各种器官或靶区域(1-单独的载玻片、2-脑、3-肾、4-肺、5-肝、6-心脏)可视化的对照小鼠的矢状切片的光学图像。(b)与样品上和样品以外的基质混合的内标(普萘洛尔,在m/z260下的[m+h]+离子)的分布的质谱法图像,以及强度比例尺。
图5.用于计算肾中普萘洛尔的组织消光系数的方法。图5a:肾的光学图像,在靶器官内界定出相等尺寸的数个目标区域(roi)或点的区域。图5b:roi和roi之间的内标的平均强度(roi平均值)的表。
图6.图6a:总结了器官或靶区域的普萘洛尔强度的表。图6b:器官或靶区域的普萘洛尔强度的柱状图。
图7.计算组织的消光系数。图7a:数学关系:总结了按靶器官计算的普萘洛尔的tec的表。图7b:按靶器官计算的普萘洛尔的tec的柱状图。
图8.确定靶分子的校准曲线。图8a:标准范围沉积物的光学图像。图8b:标准范围的质谱法图像,靶分子的分布。
图9.图9a:总结了标准范围的靶分子的roi的平均强度的表。图9b:校准线的图。图9c:相关系数和直线方程。
图10.在全身中靶分子(普萘洛尔)的质谱法图像上的定量。图10a:在注射靶分子后20分钟时小鼠矢状切片的光学图像以及各种器官或靶区域(2-脑、3-肾、4-肺、5-肝、6-心脏)的可视化。图10b:在注射靶分子(在m/z260下的[m+h]+离子)后t=60分钟时按强度表示的分布的质谱法图像。图10c:在注射靶分子后t=20分钟时通过tec归一化并与校准线相关联之后的分布的质谱法图像,得到每单位面积的靶分子的量。
图11.在靶分子的ms图像上的定量,表总结了各种器官中靶分子的量。利用tec从按器官和像素表示的平均强度计算靶分子的量的方法的说明。
图12.用于计算肾中奥氮平的组织消光系数的方法。图12a:对照小鼠的肾的矢状切片的光学图像。图12b:与样品上和样品以外的基质混合的内标(奥氮平,在m/z313.3下的[m+h]+离子)的分布的质谱法图像,以及强度比例尺。图12c:肾中奥氮平所计算得到的tec的柱状图。
图13.确定靶分子的校准曲线。图13a:标准范围的质谱法图像,靶分子的分布。图13b:示出了与奥氮平的ms图像相关的校准线、其方程、其相关系数及其以fmol/mm2为单位的检测限和定量限。
图14.使用处理2小时的肾中靶分子(奥氮平)的质谱法图像进行的定量。图14a:在施用靶分子后2小时小鼠肾的矢状切片的光学图像。图14b:在施用靶分子(在m/z313.3下的[m+h]+离子)后t=2小时按强度表示的分布的质谱法图像。
具体实施方式
现在使用具体实施例和上述图对本发明方法进一步进行详细描述。仅出于示例性目的提供这些实施例,并且这些实施例不以任何方式限制本发明的范围。
实施例1
在实施例1中,通过maldi质谱法成像对药物(普萘洛尔)在小鼠的各种器官中的分布进行研究。当然,可以以几乎相同的方式使用除maldi以外的成像装置,例如以下源:sims、desi、dios、icp、maldi显微镜、snom、smaldi、la-icp、esi(在组织上的液体萃取)、mildi、jedi、eldi等。
材料和方法
材料
-2,5-二羟基苯甲酸(dhb)(sigma-aldrich,saint-quentinfallavier,france)
-三氟乙酸(tfa)(sigma-aldrich)
-甲醇(sigma-aldrich)
-普萘洛尔(sigma-aldrich)
动物
使用重25-40g的雄性swiss小鼠(charlesriver,france)。通过静脉内途径在7.5mg/kg的浓度下注射被容纳在0.9%nacl溶液中的普萘洛尔。
在注射后20分钟通过co2窒息将动物处死。
然后将动物投入通过液氮冷却的100%异戊烷溶液中以进行快速冷冻。
然后将动物储存在-80℃下。
制备用于质谱法的样品
使用在-26℃下冷却的cm1510s低温恒温器(leicamicrosystems,nanterre,france)将样品(对照和给药后的组织)切片成20μm厚的层。然后将切片沉积在导电ito(铟锡氧化物)载玻片(brukerdaltonics,bremen,germany)上。
最后,将切片置于干燥器中20分钟。
准备通过maldi成像进行获取
dhb基质被用于分析组织切片中的靶分子(普萘洛尔)。将该基质以40mg/ml的浓度制备在甲醇/0.1%tfa(1:1,v/v)中。使用suncollect喷雾系统(sunchrome,germany)沉积基质溶液。
在相同载玻片上,但在给药后的组织切片以外的位置,在沉积基质之前使用移液管(每个点1μl)手动沉积一系列被容纳在水中的普萘洛尔的稀释液。该范围的稀释液从10pmol/μl延伸到0.02pmol/μl,并包括七个点。
准备计算tec
在来自于另一个整个动物的对照组织切片上,也制备了在acn/0.1%tfa(7:3,v/v)中的10mg/mlchca基质溶液,向其中加入10pmol/μl的普萘洛尔溶液。使用suncollect喷雾系统(sunchrome,germany)沉积所述基质溶液以覆盖组织切片的表面。
maldi图像获取
使用安装有smartbeam激光器的autoflexspeedmaldi-tof质谱仪(brukerdaltonics,bremen,germany)得到了图像。以正反射模式产生数据。以1000hz的激光频率和300×300μm2的图像空间分辨率在100da至1000da的质量范围上对每个斑点获得了总共700个光谱。使用2.1版的fleximaging软件来重建图像。
1-计算对照样品上靶分子(普萘洛尔)的tec
将按上述制备的并被用作对照样品的整个动物的矢状切片沉积在载玻片上。
将用作内标的普萘洛尔溶液与上述基质混合,然后将得到的混合物沉积在对照样品上。
然后,通过质谱法成像对对照样品进行分析,从而得到内标在对照样品上和在支持物载玻片上的分布的图像(图4-b)。
可以预先通过对照样品的光学成像有利地定位各种目标器官(图4-a)。
然后,对于载玻片上的每个器官,在对照样品的质谱法图像上界定出相等尺寸的数个目标区域(roi)。选择质谱的峰强度作为参比信号。对于每个roi和每个目标器官,记录内标的平均强度。对于每个器官,从所有相应roi所获得的强度计算得到平均强度(roi平均值)。该roi平均值被用于计算所研究的每个器官中普萘洛尔的消光系数。
图5显示了对于肾而言的这些各种步骤的示意图。
图6a总结了对照样品的各种目标器官中普萘洛尔所得到的roi平均值,并且图6b显示了得到的相应信号强度的柱状图。
然后,可以根据下面的数学式使用来自于载玻片和来自于每个器官的roi平均值计算tec(图7a):
由此,对于相同浓度的普萘洛尔,与预期的信号即在载玻片上的信号相比,肾中的相关信号被除以接近13。另一方面,肝中的信号仅被除以4.82,心脏中的信号被除以7.96。肺中的信号被除以小于8,脑中的信号被除以6.18。
2-普萘洛尔校准曲线
在本文中使用图8和9描述的实施例中,靶分子(普萘洛尔)的参比信号对应于七种浓度的普萘洛尔的标准范围所得到的信号。
使用移液管将对应于七种不同浓度的普萘洛尔(0至3pmol/μl)的七滴普萘洛尔和基质的溶液手动沉积在载玻片上并使其干燥。为了更易于读取结果,以逐渐升高的浓度沉积这些液滴,并将其充分隔开以避免重叠的任何风险。
对于使用相同尺寸的roi的范围内的所有点,将这些各种浓度所得到的质谱法图像归一化(图8b),从所述相同尺寸的roi限定了普萘洛尔的平均参比强度或参比信号。然后可以绘制校准线(图9b),其后使得可以在分析期间将普萘洛尔所得到的任何信号强度与按像素表示的浓度相关联。
3-直接在样品的质谱法图像上对普萘洛尔进行定量
将按上述制备的且如果可能与在计算tec期间被用作对照样品的切片在相同平面内的整个动物的矢状切片沉积在载玻片上,从而通过质谱法成像进行分析(图10b)。
在每个目标器官中,普萘洛尔所得到的信号强度作为每个器官所计算得到的tec的函数而增大。
得到了整个动物的切片的质谱法图像,其中信号强度对应于绝对强度,即单独普萘洛尔浓度的强度(图10c)。可以将该图像与先前为普萘洛尔所计算得到的校准线相关联,从而直接通过将图像可视化来确定样品中普萘洛尔的量。
由此,在本文中所述的实施例中,注意到,普萘洛尔几乎不存在于肝和肺中,这与脑形成对比,在脑中普萘洛尔的分布最大,其中靶分子的总量为约5ng。在肾和肺中也观察到普萘洛尔,其量在1.28ng至2ng的范围内。
实施例2
在第二个实施例中,通过maldi质谱法成像对另一种药物(奥氮平)在小鼠的肾中的分布进行研究。可以以几乎相同的方式使用任何其他成像装置。
材料和方法
材料:
-羟基肉桂酸(chca)(sigma-aldrich,saint-quentinfallavier,france)
-三氟乙酸(tfa)(sigma-aldrich)
-乙腈、dmso、水(sigma-aldrich)
-奥氮平(lillyresearchlaboratories,elilillyandco.,indianapolis,in)
动物
使用重25-40g的雄性swiss小鼠(charlesriver,france)。在8mg/kg的浓度下口服施用奥氮平。
在施用后2小时通过co2窒息将动物处死。
然后将动物投入通过液氮冷却的100%异戊烷溶液中以进行快速冷冻。
然后将动物储存在-80℃下。
制备用于质谱法的样品
在与上述实施例1相同的条件下将样品切片成10μm厚的层(对照和给药后的肾切片)。
准备通过maldi成像进行获取:
chca基质被用于分析给药后的组织切片中的靶分子(奥氮平)。将该基质以10mg/ml的浓度制备在acn/0.1%tfa(7:3,v/v)中。使用suncollect喷雾系统沉积基质溶液。
在相同载玻片上,但在给药后的组织切片以外的位置,在沉积基质之前使用移液管(每个点1μl)手动沉积一系列被容纳在dmso中的奥氮平的稀释液。该范围的稀释液从60pmol/μl延伸到1pmol/μl,并包括七个点。
准备计算tec:
在(来自于另一个动物的)肾的对照组织切片上,也制备了在acn/0.1%tfa(7:3,v/v)中的10mg/mlchca基质溶液,向其中加入10pmol/μl的奥氮平溶液。使用suncollect喷雾系统沉积所述基质溶液以覆盖组织切片的表面。
maldi图像获取:
以与实施例1相同的方式获得了图像,但利用200×200μm2的图像空间分辨率。
1-计算对照样品上靶分子(奥氮平)的tec
将按上述制备的并被用作对照样品的肾的对照矢状切片沉积在载玻片上。将用作内标的奥氮平溶液与上述基质混合,然后将得到的混合物沉积在对照样品上。
然后,通过质谱法成像对对照样品进行分析,从而得到内标在对照样品上和在支持物载玻片上的分布的图像(图12b)。图12a中所示对照样品的光学图像使得可以将目标器官即肾可视化。
然后,在对照样品的质谱法图像上界定出肾上和载玻片上相等尺寸的数个目标区域(roi)。选择质谱的峰强度作为参比信号。如同实施例1计算平均强度(roi平均值)。该roi平均值被用于计算肾中奥氮平的消光系数。
根据与实施例1相同的方法计算tec(图12c)。由此观察到,对于相同浓度的奥氮平,与预期的信号即在载玻片上的信号相比,肾中的相关信号被除以接近22.2。
2-奥氮平校准曲线
图13中所示的奥氮平的参比信号对应于七种浓度的奥氮平的标准范围所得到的信号。
使用移液管将对应于七种不同浓度的奥氮平(0至60pmol/μl)的七滴奥氮平和基质的溶液手动沉积在载玻片上并使其干燥。为了更易于读取结果,以逐渐升高的浓度沉积这些液滴,并将其充分隔开以避免重叠的任何风险。
对于使用相同尺寸的roi的范围内的所有点,将这些各种浓度所得到的质谱法图像归一化(图13a),从所述相同尺寸的roi限定了奥氮平的平均参比强度或参比信号。然后可以绘制校准线(图13b),其后使得可以在分析期间将奥氮平所得到的任何信号强度与以pmol/mm2为单位的浓度相关联。
3-使用样品的质谱法图像对奥氮平进行定量
将按上述制备的且如果可能与在计算tec期间被用作对照样品的切片在相同平面内的经奥氮平处理的肾的矢状切片沉积在载玻片上,从而通过质谱法成像进行分析(图14a)。由此得到了肾切片的质谱法图像,在所述图像上,通过检测主要在髓质中的m/z313.3离子来定位奥氮平(图14b)。
肾中奥氮平所得到的信号强度被归一化作为预先计算得到的tec的函数。然后,可以将该数据与先前为奥氮平所计算得到的校准线相关联,从而得到其在肾中的总浓度,单位为pmol/mm2。
然后,利用所分析的肾切片的厚度和表面积,可以确定样品中以每克组织的克数为单位的奥氮平的量。
由此,在本文中所述的实施例中,可以计算得到奥氮平的平均浓度(经三次实验),其为41.1μg/g组织。
- 还没有人留言评论。精彩留言会获得点赞!