一种非损伤检测脑片神经元钙离子跨膜流动的方法与流程
本发明属于钙离子跨膜流动检测方法技术领域,特别涉及一种非损伤检测脑片神经元钙离子跨膜流动的方法。
背景技术:
ca2+作为细胞内一种重要的第二信使,参与神经细胞的一系列活动,对神经细胞的代谢和功能产生广泛的影响。安静情况下,神经元胞浆内游离ca2+的浓度很低,这使得细胞在受到刺激时能够通过显著的ca2+内流改变功能活动。当大量ca2+流入神经元内可使胞内出现钙超载,继而激活某些磷脂酶、蛋白酶、内切酶和一氧化氮合酶等,损害神经元功能,最终使神经元出现凋亡或死亡。为维持细胞内的ca2+稳态,神经元主要是通过质膜钠钙交换体(na+/ca2+exchanger;ncx)和质膜钙离子atp酶(plasmamembranecalciumatpase;pmca)两种途径实现质膜对ca2+的主动转运,即ca2+外排。因此在神经科学的研究中,对生理和病理状态下神经元跨膜ca2+流的动态变化进行快速、准确的检测,不仅可以帮助了解细胞维持ca2+稳态和正常功能活动的原理,也有助于揭示ca2+信号扰乱相关疾病的发生机制。目前,测定神经元跨膜ca2+流的技术手段主要有:细胞内离子成像和电生理记录膜电流。然而,受技术所限,这些方法均有不到之处。细胞内ca2+离子成像需要使用能与ca2+结合的光敏染料(如fura-2/am和fluo-4/am等),但存在荧光染料对细胞活性的影响、荧光染料随着时间的延长有不同程度的淬灭等缺点,且仅限于在培养细胞水平上观察胞内的ca2+变化。电生理技术可以直接测定跨膜ca2+电流,但该技术仅限于单一离子通道的记录和分析,不适合从整体上分析跨膜分子/离子的信息,并且存在封接成功率低、破膜过程会对细胞产生损害而记录时间短和封接不稳等问题。
非损伤微测技术(non-invasivemicro-testtechnique,nmt)是近年发展起来的一种以非接触方式直接获取离子跨膜内流或外流流速的最新技术手段,其根据fick第一扩散定律和nernst方程,通过检测细胞外两点间电位差的改变从而测得紧邻细胞膜的胞外离子变化情况。其优势在于:测量时,微电极不接触被测样品,不会对样品造成任何损伤;其空间分辨率高,可实现微米级的测量;测量数据精度高,对离子流动速率的测量可达到picomole·cm-2·sec-1。然而,目前针对动物组织特别是脑组织进行的nmt实时、动态ca2+流研究尚未见报道,特别是记录ca2+外排的研究尚未见报道。
技术实现要素:
为了解决现有技术中存在的不足,为开展实验动物脑功能的跨膜ca2+信号转导研究提供新的技术手段,本发明提供一种非损伤检测脑片神经元钙离子跨膜流动的方法。
本发明通过以下技术方案予以实现。
一种非损伤检测脑片神经元钙离子跨膜流动的方法,它包括测试电极与参比电极,所述测试电极中测试电极丝的材质为agcl丝,参比电极材质为ag/agcl固态电极,按以下步骤依次进行:
a、测试电极的设置:
测试电极还包括锥形管,首先,向锥形管尖嘴部填充ca2+液态离子交换剂;其次,再向锥形管中添加ca2+电解质溶液;最后,将测试电极丝从锥形管圆口端插入锥形管内并与电解质溶液接触,形成测试电极;
b、测试电极与参比电极位置的设置:
在培养皿上方设置电极固定架,所述参比电极固定设置于电极固定架的一端,参比电极下端部延伸至培养皿内部并可以与脑片营养液接触;测试电极设置于电极固定架的另一端,测试电极与驱动装置连接,驱动装置精确驱动测试电极产生位移;测试电极与参比电极之间通过电位测试装置连接;
c、电压/浓度校正曲线的获得:为保证测试电极正常工作,在待测范围内以10为倍数改变浓度作为常规背景浓度,采用含有3毫摩尔ca2+的人工脑脊液作为测试电极的校正液a,含有0.3毫摩尔ca2+的人工脑脊液作为校正液b,分别将测试电极和参比电极一起放入校正液a或者校正液b中,分别获得校正液a中的电极电位值和校正液b中的电极电位值,通过nernst方程获取电压/浓度校正曲线;
d、ca2+跨膜运动的观测及ca2+流动速率的确定:首先,在培养皿中分别添加含淀粉样β蛋白的正常ca2+浓度的人工脑脊液或者低ca2+浓度的人工脑脊液作为测试液;其次,取脑片置于培养皿中;再次,将参比电极放入测试液中,并将测试电极移动至脑片的近端位置,通过驱动装置驱动测试电极移动至脑片的远端位置,获得位移差dx,同时采集近端位置与远端位置电极电位差dv,然后通过电压/浓度校正曲线得出近端位置与远端位置之间ca2+的浓度差dc,将浓度差dc和位移差dx代入fick第一扩散定律公式j=-d·dc/dx,式中d为离子/分子特异的扩散常数,其单位是cm-2·sec-1;j为ca2+的流动速率,其单位为picomole·cm-2·sec-1,其中j正值代表ca2+外排,负值代表ca2+内流。
进一步地,所述测试液为急性给予的浓度分别为含10微摩尔、30微摩尔、50微摩尔的31-35片段淀粉样β蛋白的人工脑脊液。
进一步地,所述测试液为急性给予的细胞外低钙人工脑脊液,其中ca2+浓度为0.35毫摩尔。
进一步地,所述测试液为浓度为含50微摩尔的31-35片段淀粉样β蛋白的人工脑脊液,将脑片放入所述测试液中并记录2分钟时间内测试液的基础流速,然后给予细胞外低钙人工脑脊液。
进一步地,所述测试液为质膜钙泵抑制剂或质膜钠钙交换体抑制剂预处理后给予细胞外低钙人工脑脊液。
进一步地,所述步骤a中ca2+液态离子交换剂的添加量的高度为40~50微米,添加的ca2+电解质溶液的添加量的高度为1厘米。
进一步地,所述电解质溶液为cacl2溶液,其浓度为100毫摩尔cacl2。
进一步地,所述步骤b中驱动装置驱动测试电极与脑片之间的距离为50微米。
进一步地,所述步骤d中测试电极沿竖直方向进行自动往复式运动的距离为30微米,采样频率为0.3赫兹。
本发明与现有技术相比具有以下有益效果。
本发明利用nmt方法对小鼠海马神经元钙离子跨膜流动进行观测,其实验结果显示,
1)aβ对小鼠海马神经元钙离子稳态的扰乱,不仅涉及到ca2+内流增加,也与ca2+外排的抑制有关,两者共同作用可能加速了细胞的钙超载;
2)nmt可方便、实时、动态且非损伤性地用于检测动物脑组织细胞的ca2+内流或ca2+外排。因此,本研究为探讨aβ神经毒性作用机制的钙超载学说提供了又一新的实验证据;同时,本实验在检测动物脑组织跨膜ca2+流中显示出的快速、方便和非损伤特征,特别是低ca2+液可靠诱发ca2+外排的结果也为开展脑功能ca2+信号转导机制的研究提供了一个新的技术方法和手段。
附图说明
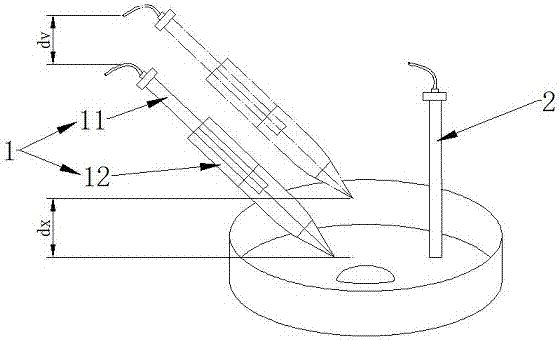
图1为基于nmt法测定海马脑片ca2+跨膜流动的测定原理示意图;
图中,1为测试电极,11为测试电极丝,12为锥形管,2为参比电极;其中实线绘制的测试电极表示测试电极处于脑片的近端位置,虚线绘制的测试电极表示测试电极处于脑片的远端位置,dx表示脑片近端位置与远端位置之间的位移差,dv表示脑片近端位置与远端位置之间的电位差。
图2为ca2+选择测试电极尖端充灌了lix之后的显微镜照片图。
图3为ca2+选择测试电极移动至脑片边缘时的显微镜照片图。
图4为ca2+选择测试电极移动至海马脑片ca1区正上方时的显微镜照片图。
图5为正常人工脑脊液中急性给予不同浓度aβ31-35诱发海马脑片ca1区神经元ca2+内流的趋势图。
图6为不同浓度aβ31-35诱发海马脑片ca1区神经元ca2+内流的统计直方图。
图7为经aβ或tfh或kb-r7943处理后,脑片在低钙人工脑脊液中ca2+外流的趋势图。
图8为经aβ或tfh或kb-r7943处理后,脑片在低钙人工脑脊液中下ca2+外流的统计直方图。
图中,*的含义为p<0.05,***的含义为p<0.001,p的含义为根据统计学中显著性检验方法计算得到显著性水平,对照的含义为正常人工脑脊液,药物的含义为aβ或者为tfh或者为kb-r7943。
具体实施方式
下面结合实施例对本发明做详细说明:本实施例是以本发明技术方案为前提进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下面的实施例。
本发明应用nmt方法检测了aβ31-35寡聚体对c57bl/6小鼠海马脑片ca1区神经元谷氨酸(glutamate,glu)诱发的ca2+内流以及细胞外液低钙引起的ca2+外排,并初步探讨了aβ扰乱神经元钙稳态的相关机制。
实施例一
如图1~图4所示,为非损伤微测技术测定海马脑片钙离子流的电极推进过程和测定原理示意图。一种非损伤检测脑片神经元钙离子跨膜流动的方法,它包括测试电极1与参比电极2,所述测试电极1中测试电极丝11的材质为为agcl丝,参比电极2材质为ag/agcl固态电极,按以下步骤依次进行:
a、测试电极1的设置:
测试电极1包括锥形管12,首先,向锥形管12尖嘴部填充ca2+液态离子交换剂,添加量的高度为40~50μm(μm即微米);其次,再向锥形管12中添加ca2+电解质溶液,添加量的高度为1cm(cm即厘米);最后,将测试电极丝11从锥形管12圆口端插入锥形管12内并与电解质溶液接触,形成测试电极1;所述电解质溶液为cacl2溶液,其浓度为100mm(mm即毫摩尔)cacl2;
b、测试电极1与参比电极2位置的设置:
在培养皿上方设置电极固定架,所述参比电极2固定设置于电极固定架的一端,参比电极2下端部延伸至培养皿内部并可以与脑片营养液接触;测试电极1设置于电极固定架的另一端,测试电极1与驱动装置连接,驱动装置精确驱动测试电极1产生位移;测试电极1与参比电极2之间通过电位测试装置连接;
c、电压/浓度校正曲线的获得:为保证测试离子选择性电极正常工作,在待测范围内以10为倍数改变浓度作为常规背景浓度。采用含有3mmca2+的人工脑脊液作为测试电极1的校正液a,含有0.3mmca2+的人工脑脊液作为校正液b。分别将测试电极1和参比电极2一起放入校正液a或者校正液b中,分别获得校正液a的电极电位值和校正液b的电极电位值,通过nernst方程获取电压/浓度校正曲线;
d、ca2+跨膜流动的观测及ca2+流动速率的确定:首先,在培养皿中添加测试液为急性给予的浓度分别由31-35片段的淀粉样β蛋白溶液;其次,取脑片置于培养皿中;再次,将参比电极2放入测试液中,并将测试电极1移动至脑片的近端位置,驱动装置驱动测试电极1与脑片之间的距离为50μm,通过驱动装置匀速驱动测试电极1移动至远端位置,并以固定距离30μm在竖直方向进行自动往复式运动,设定驱动装置移动频率为0.3hz(hz即赫兹)即采样频率,获得位移差dx,同时分别采集近端位置与远端位置电极电位,获得电位差dv。然后通过电压/浓度校正曲线得出近端位置与远端位置之间ca2+的浓度差dc,将浓度差dc和位移差dx代入fick第一扩散定律公式j=-d·dc/dx,式中d为离子/分子特异的扩散常数,其单位是cm-2·sec-1;j为ca2+的流动速率,其单位为picomole·cm-2·sec-1,其中j正值代表ca2+外排,负值代表ca2+内流。
实施例二
如图5~6所示为非损伤微测技术测定急性给予不同浓度aβ31-35引起海马脑片ca1区神经元ca2+内流流速图和直方图。本实施例二中测试液为正常人工脑脊液和含不同浓度(10μm、30μm、50μm)(μm即微摩尔)的31-35片段淀粉样β蛋白的人工脑脊液。操作步骤与实施例一相同,获得的实验结果进行如下分析:在正常人工脑脊液中,海马脑片ca1区神经元未记录到明显的ca2+内流或外流。急性给予不同浓度的aβ31-35诱发了海马脑片神经元出现先快后慢的内向跨膜ca2+流,并具有持续稳定的特征,如图5展现了ca2+流的趋势。如图6显示的统计直方图,与对照组5分钟内ca2+流速(2.912±2.466picomole·cm-2·sec-1)相比,10μm、30μm和50μmaβ31-35组给药后5分钟内出现的内向ca2+流平均流速分别为-32.262±17.347picomole·cm-2·sec-1(n=12)(p>0.05)、-129.838±26.610picomole·cm-2·sec-1(n=14)(p<0.05)和-310.297±35.231picomole·cm-2·sec-1(n=15)(p<0.001),表明aβ31-35诱发的海马脑片ca1区神经元跨膜ca2+内流具有浓度依赖性(p<0.05)。
实施例三
如图7~8所示为非损伤微测技术测定aβ31-35联合kb-r7943或tfh预处理后给予低钙人工脑脊液(artificialcerebrospinalfluid,acsf)诱发的海马脑片神经元ca2+外流流速图和直方图。本实施例三中测试液为分别含50μm的31-35片段淀粉样β蛋白、tfh(质膜钙泵抑制剂)、kb-r7943(质膜钠钙交换体抑制剂)的正常人工脑脊液和低钙人工脑脊液(含0.35mmca2+的人工脑脊液)。操作步骤与实施例一相同,获得的实验结果进行如下分析:
图7中实心圆点显示在正常人工脑脊液中(正常对照组)基础状态下2分钟内的脑片ca2+流速接近零水平,给予vehicle(正常人工脑脊液)后5分钟内ca2+流速平均值也基本没有变化(0.837±0.499picomole·cm-2·sec-1,n=10);空心圆点显示给予低钙人工脑脊液(对照+低钙液)急性灌流脑片,可引起海马ca1区神经元产生明显的外向ca2+流,峰值快速达到5186.969±300.595picomole·cm-2·sec-1,随后逐渐回落但保持持续性外向ca2+流,5分钟时基本稳定在3337.39±231.405picomole·cm-2·sec-1上下;实心三角形显示aβ31-35寡聚体预处理可部分抑制低钙人工脑脊液引起的ca2+的外排;空心三角形显示质膜钙泵抑制剂预处理可部分抑制低钙人工脑脊液引起的ca2+的外排;实心正方形显示低钙人工脑脊液引起的ca2+的外排可被质膜钠钙交换体拮抗剂kb-r7943大部分阻断。
图8显示了各组在5分钟内的平均ca2+外排流速的统计学比较直方图。单纯低钙人工脑脊液(对照+低钙液)诱发的ca2+外排5分钟内平均流速为3867.868±244.502picomole·cm-2·sec-1(p<0.001)。aβ31-35(50μm)预处理(aβ+低钙液)可部分阻断这种低钙人工脑脊液诱发的ca2+外排,5分钟内平均ca2+流速只有2541.532±440.146picomole·cm-2·sec-1(p<0.05,n=11)。接着,我们用质膜钙泵阻断剂tfh或质膜钠钙交换体阻断剂kb-r7943分别预处理,以检查这种低钙人工脑脊液诱发的ca2+外流机制。我们发现,两种阻断剂在正常人工脑脊液中并不影响基础性的ca2+流,但用tfh(100μm)预处理(tfh+低钙液)后,低钙人工脑脊液引起的ca2+流速较tfh未处理组明显减少,平均流速降低到1954.733±327.616picomole·cm-2·sec-1(p<0.001,n=11);用kb-r7943(100nm)(nm即纳摩尔)预处理(kb-r7943+低钙液)后,低钙人工脑脊液引起的ca2+流则大幅度减少,平均流速只有352.828±75.665picomole·cm-2·sec-1(p<0.001,n=10),抑制程度远大于tfh。
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
- 还没有人留言评论。精彩留言会获得点赞!