一种微流控芯片荧光免疫快速检测试剂盒及其制备和检测方法与流程
本发明属于免疫检测领域,具体涉及一种微流控芯片荧光免疫快速检测试剂盒及其制备和检测方法。
背景技术:
近年来微流控芯片(microfluidicchips)技术发展迅速,在医学、生命科学等领域的应用得到不断扩展。微流控芯片是指采用微细加工技术,将微通道网络结构及其他功能元件集成在数平方厘米的基片上,通过对微通道中的流体进行控制,以实现进样、稀释、混合、反应、分离、检测等多种功能的微全分析系统,具有微型化、集成化、分析速度快、试剂消耗少等显著优点。
免疫标记技术是以抗原抗体特异性反应为基本原理,采用荧光素、同位素或酶等示踪物质标记抗体(或抗原)进行抗原-抗体反应,通过对免疫复合物中的标记物的测定,达到对免疫反应进行检测的目的。
免疫标记技术按检测反应体系的物理状态分为均相免疫反应和非均相免疫反应。
非均相免疫反应是指将抗原或抗体固定在固相载体(微孔板或滤纸)表面,通过特异性免疫反应,将所需检测的抗体或抗原结合在固相表面,继经清洗,即可实现抗原抗体复合物与游离的抗原、抗体之间的物理分离。通常使用的免疫层析法、酶联免疫法、板式化学发光法均为非均相免疫分析方法。
“微流控芯片免疫分析抗体固定方法比较”(《中国医药生物技术》2015年第1期)、“微流控芯片免疫分析技术及其研究进展”(《检验医学》2007第22卷第4期)等文献报道利用微流控芯片通道壁为固相载体来包被抗体(或抗原)的方法,就是一种简便的微流控芯片与微孔板免疫技术相结合的非均相免疫分析方法。
专利“双层微流控芯片器件及其在免疫检测中的用途”(cn102749433)使用了微流控技术与传统的免疫标记技术(非均相)相结合。使用上下两个微流控芯片,分别通入抗原和抗体,通过抽真空,使抗原和抗体分别富集在聚酯膜上并发生免疫反应。该专利有以下不足:(1)所用的抗原和抗体试剂仍需分别保存在试剂瓶中(与传统方法相同),试验过程中通过抽真空驱动液体流动、混合、反应,不能使反应集成化;(2)所用固相载体—聚酯膜代替微孔板(或试纸),成本高;(3)聚酯膜孔径影响抗原或抗体的富集;(3)非均相反应是在固相载体的表面进行反应,反应不充分,灵敏度和重复性受到限制。
均相免疫反应是指抗原和抗体在同一介质(液态体系)中进行的免疫反应。目前应用较广的磁微粒化学发光免疫方法就是均相免疫反应,即将抗体(或抗原)偶联在包裹了磁微粒的微球上,在反应过程中将这种偶联了抗体(或抗原)的磁微球悬浮在反应液中,使得这种磁微球抗体(或抗原)与溶液中待测物质充分接触,使免疫反应更加充分、完全。在外加磁场作用下,将免疫反应形成的复合物与未结合的其它物质分离。该方法由于采用了均相反应体系,使反应的精密度和重复性进一步提高。但该技术需要匹配大型检测仪器,检测费用大,耗时时间长,试剂和样品用量大。
“基于磁珠技术的微流控生物芯片系统的研究”(《上海交通大学》2007年)是将免疫磁珠置于微流控通道中,由于受流体流动速度以及抗原和抗体只有一过性接触的影响,抗原和抗体不能保证充分、彻底反应。
微流控技术、磁微粒免疫技术与荧光免疫技术相结合技术研究目前还没有更多的文献报道。
因此,研制一种方便、快捷、高通量、灵敏度高、集成化高、适合工业化生产的微流控芯片均(液)相荧光免疫快速检测试剂盒是目前亟待解决的问题。
技术实现要素:
本发明的目的在于提供一种微流控芯片荧光免疫快速检测试剂盒,该试剂盒以荧光物质为标记物,以磁性微球为捕获物,试剂用量少,集成化高,所有试剂均事先固化于芯片中;标记荧光微球和捕获磁珠固化简便、易复溶、易悬浮;可在相对闭合的空间内进行抗原抗体反应,无交叉污染,不污染环境。具有高效率、高通量、高灵敏度、快速、灵敏、稳定等优点。
本发明的目的是这样实现的:一种微流控芯片荧光免疫快速检测试剂盒,其特征在于:该试剂盒含有微流控芯片,所述微流控芯片包括一条或多条检测单元,所述检测单元位于微流控芯片的半径轴上,以微流控芯片中心点发散排列,所述检测单元自芯片中心点向边缘依次排列有加样槽、荧光探针槽、反应检测槽和废液槽,以及相互连接的微通道;所述荧光探针槽底部固化有荧光探针,该荧光探针是聚苯乙烯荧光(flu)微球偶联抗体(或抗原或二抗)的复合物;所述反应检测槽中固化有捕获磁珠微球,该捕获磁珠微球是聚苯乙烯磁珠微球偶联抗体(或抗原或二抗)的复合物。
所述微流控芯片只有加样槽通过加样孔与外界相通,其余槽均是封闭的。
所述加样槽、荧光探针槽、反应检测槽和废液槽的容积相等或不相等,相邻两个槽的间距相等或不相等。
所述微流控芯片的驱动力为离心力。
所述的聚苯乙烯荧光微球的直径为10~300nm,优选50~200nm;聚苯乙烯荧光微球内包裹荧光物质,所述荧光物质包括罗丹明、异硫氰酸荧光素、藻红蛋白、镧系元素(钐sm、铕eu、钆gd、铽tb等)、量子点等;所述聚苯乙烯磁珠微球的直为1~10um,优选2um~5um,微球内包裹超顺磁四氧化三铁微粒(mag),微粒平均直径10nm。
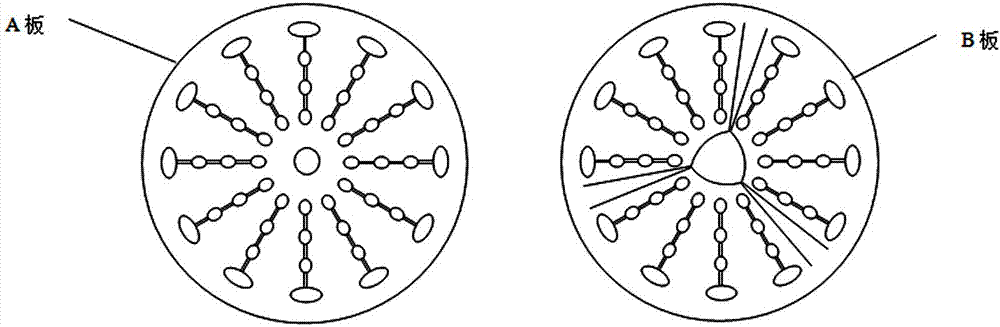
所述微流控芯片是由上下两块板(a板、b板)键合而成,所述微流控芯片的材料为石英、玻璃或pdms、pmma、ps、pc、coc、cop等高聚物,所述微流控芯片的形状为圆形或外接圆的多边形。
所述微流控芯片中心位置有一与离心机转轴相匹配的固定孔,所述微流控芯片的厚度为4mm~10mm,直径为50~200mm,优选80~100mm,所述槽表面可以是圆形、椭圆形、水滴形或其他不规则形,槽的容积为5~200ul。
所述检测试剂盒的检测样本为全血、血清、血浆、唾液、痰液、泪液、尿液或其他人体分泌物,以及上述液体的提取液或稀释液或洗脱液;所述检测试剂盒可同时进行1个样品的多因子分别检测,也可同时进行多个样品的1个或多个因子的分别检测。
一种微流控芯片荧光免疫快速检测试剂盒的制备方法,该方法包括如下步骤。
(1)制备a板和b板。
a板和b板含有相互对应的一条或多条检测单元,a板上的检测单元含有加样孔、荧光探针槽上部分、反应检测槽上部分和废液槽上部分,以及相互连接的通道,b板上的检测单元含有与a板相对应的的加样槽、荧光探针槽下部分、反应检测槽下部分和废液槽下部分。
(2)荧光探针聚苯乙烯荧光微球的制备。
取包裹荧光物质的聚苯乙烯荧光微球经洗涤、超声、搅拌处理后,与抗体1(或抗原1或二抗)偶联,加入bsa缓冲液对荧光微球作封闭处理,即得“抗体(或抗原或二抗)-荧光微球”[ab1(ag1)-flu]。
(3)捕获抗体2(或抗原2或二抗)磁性微球的制备。
取聚苯乙烯磁性微球经洗涤、超声、搅拌处理后,与抗体2(或抗原2或二抗)混合,加入bsa缓冲液对微球作封闭处理,即得“捕获抗体(或抗原或二抗)-磁性微球”[ab2(ag2)-mag]。
(4)将“抗体1(或抗原1或二抗)-荧光微球”与“捕获抗体2(或抗原2或二抗)-磁性微球””各1~20ul分别加入到b板的荧光探针槽和反应检测槽中,37°c干燥固化。
(5)采用超声键合机将芯片a、b板键合成一块完整的芯片。
(6)用特殊粘合封口膜将样品孔封闭,封铝箔袋中,即得。
一种微流控芯片荧光免疫快速检测试剂盒的检测方法,该方法包括如下步骤。
(1)待测物质溶液加入到加样孔中,通过离心驱动待测溶液到达至荧光探针槽并溶解探针微球,待测物质与相应的抗体1(或抗原1或二抗)特异性结合,形成抗原-抗体-荧光微球(flu-ab-ag)复合物。
(2)在离心驱动下,继续将荧光探针槽中的复合物等溶液全部输送至反应检测槽中,并溶解反应检测槽中捕获抗体磁珠微球,溶液中的抗原-抗体-荧光微球1(flu-ab-ag)复合物与捕获抗体2(或抗原2或二抗)-磁性微球发生特异性免疫反应,形成“荧光微球-抗体1-抗原-抗体2-磁珠微球”的双抗体夹心磁性复合物(flu–ab1-ag–ab2-mag)或“荧光微球-抗原1-抗体-抗原2-磁珠微球”的双抗原夹心磁性复合物(flu–ag1-ab-ag2-mag),并悬浮在溶液中。
(3)在外加磁场的作用下,磁性复合物被吸附在反应检测槽的底部,在离心驱动下,将不含磁性微球的溶液输送到废液槽,磁性荧光复合物则留在检测槽的底部。
(4)通过加样孔加入清洗缓冲液,离心,清洗反应检测槽中的磁性荧光复合物,加入外磁场,离心去除清洗液,反复操作。
(5)通过荧光检测仪检测,以一定波长的光照射反应检测槽中的磁性荧光复合物,检测荧光微球的发光强度,荧光强度与待测物浓度呈相关性。
与现有技术相比,本发明具有以下优点。
(1)以荧光物质为标记物,以磁性微球为捕获物,试剂用量少,集成化高。
(2)所有试剂均事先固化于芯片中,省却传统试剂盒大量试管的使用,并省却反复取样操作。
(3)固化的聚苯乙烯荧光微球和聚苯乙烯磁珠微球当样品溶液或清洗缓冲液流经时易复溶并悬浮于液体中。
(4)样品需样量极少,单个指标仅需要10ul。
(5)检测时间短,操作简单。加入样品后,放入检测仪,5~10分钟即可完成全部自动检测。
(6)全封闭系统,可以进行最少1个样本的检测,不污染其余的检测单元。
(7)可以进行多样本或多因子同时检测,实现检测的高通量。
(8)均相反应体系使检测结果灵敏度高(10-15mol/ml)、精密度高(cv<5%)、重复性更高(cv<5%)。
附图说明
附图1为微流控芯片荧光免疫试剂盒的检测单元结构示意图。
图中,1:加样孔,2:加样槽,3:荧光探针槽,4:反应检测槽,5:废液槽,
6:微通道。
附图2为微流控芯片荧光免疫试剂盒的微流控芯片内部结构示意图。
附图3为3样本、4因子微流控芯片荧光免疫试剂盒的微流控芯片结构示意图。
附图4为微流控芯片荧光免疫试剂盒的荧光免疫检测原理示意图。
附图5为本发明与罗氏磁微粒电化学发光试剂盒一致性的比较结果图。
具体实施方式
以下是对本发明的进一步说明,而不是对本发明的限制。
实施例1:n端脑钠肽前体(nt-probnp)微流控芯片荧光免疫试剂盒试剂(多种样本,1项指标检测试剂盒)的制备及检测。
1、制备a板和b板。
制备a板和b板,二者均含有相互对应12条检测单元,a板上的检测单元含有加样孔、荧光探针槽上部分、反应检测槽上部分和废液槽上部分,以及相互连接的通道,b板上的检测单元含有与a板相对应的的加样槽、荧光探针槽下部分、反应检测槽下部分和废液槽下部分。
2、标记抗体荧光微球的制备。
取直径为100nm的聚苯乙烯包裹量子点(qd,荧光探针)的荧光微球经洗涤、超声、搅拌处理后,与nt-probnp单克隆抗体1偶联,偶联反应后形成“标记抗体1-荧光微球”,加入bsa缓冲液对荧光微球作封闭处理,得“荧光标记的nt-probnp单克隆抗体1微球”(qd-ab1)。
3、捕获抗体磁性微球的制备。
取直径为5um的聚苯乙烯磁性微球经洗涤、超声、搅拌处理后,与nt-probnp单克隆抗体2混合,偶联反应形成“捕获抗体2-磁性微球”,加入bsa缓冲液对微球作封闭处理,得到用于捕获的“nt-probnp单克隆抗体2-磁性微球”(ab2-mag)。
4、将“量子点标记的nt-probnp单克隆抗体1微球”与“nt-probnp单克隆抗体2-磁性微球”各10ul分别加到b板的荧光探针槽和反应检测槽中,37°c干燥固化1小时。
5、采用超声键合机将芯片a、b板键合成一块完整的芯片,芯片结构如图2;芯片直径80mm,厚度6mm,每个芯片上有12组相同的检测单元。
6、封口,用特殊粘合封口膜将样品孔封闭,封铝箔袋中,贮存。
7、检测,取出包装完好的微流控芯片试剂盒,撕开样品孔的封口膜,放入自制的全自动液相微流控芯片荧光分析检测仪的芯片室内,机器自动采集全血样品加入微流控芯片的加样槽中,自动离心、清洗、检测、打印结果,全部检测10分钟完成。
8、检测结果与重复,见下表。
检测结果与罗氏磁微粒电化学发光试剂盒一致性的比较结果。
对两种方法的检测结果进行线性回归分析,建立线性回归方程:y=a+bx。相关系数r值>0.90。由结果可知,两种方法的检测结果有很好的相关性,见图5。
实施例2:术前4项(乙肝表面抗原/丙肝抗体/人类免疫缺陷病毒抗体/梅毒螺旋体抗体)联检试剂盒(3份样本、4项指标联检试剂盒)的制备及检测。
1、标记抗体(或抗原)荧光微球的制备:取直径为200nm的聚苯乙烯包裹铕金属螯合物(eu,荧光探针)的荧光微球经洗涤、超声、搅拌处理后,分别与①乙肝表面抗体1②丙肝重组抗原1③人类免疫缺陷病毒重组抗原1④梅毒螺旋体重组抗原1进行偶联,偶联反应后分别形成4种荧光微球标记物,备用。
2、捕获抗体(或抗原)微球的制备:取直径为3um的聚苯乙烯磁性微球经洗涤、超声、搅拌处理后,分别与①乙肝表面抗体2②丙肝重组抗原2③人类免疫缺陷病毒重组抗原2④梅毒螺旋体重组抗原2进行偶联,偶联反应后形成4种捕获抗体(或抗原)磁性微球,备用。
3、以聚甲基丙烯酸甲酯(pmma)为材料,芯片直径100mm,a、b板均由3组结构相同的微通道组成3组检测单元,每组检测单元又由4组结构相同的微结构组成,可以同时、分别进行3样本的各4种指标的同时检测,芯片结构如图3所示。
4、分别将4种标记抗体(或抗原)荧光微球固化于b板的每组相对应的荧光探针槽底部,37°c干燥固化40分钟。
5、分别将4种捕获抗体(或抗原)磁珠微球固化于b板的每组相对应的反应检测槽底部,37°c干燥固化40分钟。
6、采用超声键合机将芯片a、b板键合成一块完整的芯片,芯片厚度5mm。
7、封口,用特殊粘合封口膜将各样品孔封闭,封铝箔袋中,贮存。
8、检测,取出包装完好的微流控芯片试剂盒,撕开样品孔的封口膜,放入自制的全自动液相微流控芯片荧光分析检测仪的芯片室内,机器自动采集全血样品加入微流控芯片的加样孔中,自动离心、清洗、检测、打印结果。全部检测10分钟完成。
结果比较:本试剂盒与雅培architect-i2000system微粒子化学发光试剂盒(乙肝表面抗原、丙肝抗体、人类免疫缺陷病毒抗体、梅毒螺旋体抗体4种)比较,见表2。
表2荧光免疫法和化学发光法检测检测结果比较。
由结果可知,hbsag、anti-tp、anti-hiv、anti-hcv比对结果为阳性符合率为100%,阴性符合率为100%,k=1。两种方法检测结果具有高度的一致性。
- 还没有人留言评论。精彩留言会获得点赞!