一种细胞牵引力与粘弹性的同时定量测定方法与流程
本发明涉及一种细胞牵引力与粘弹性的同时定量测定方法,以实现对细胞结构与功能的定量分析。
背景技术:
细胞是生物体结构和功能的基本单位,生物体对于疾病、伤害、药物(治疗)等的响应其实是细胞响应的综合体现。活细胞通过调节其形态结构和生理机能以适应其对外界的刺激。显然,通过实时监测这些刺激下细胞与组织层次结构形态和功能的动态变化可以预测生物体对病理与药物(治疗)的响应。目前用于活细胞功能及整体结构观察的主要方法是光学显微境技术,如活细胞成像技术被用于细胞形态与数目的实时观察,亚细胞结构的变化往往依赖于生物标记物的间接测定。目前缺乏对细胞功能直接定量的方法。美国国家基金委前主任surash在有关细胞结构-性质-功能-疾病相互关系的论述中指出:无论是细胞内部或外部环境改变及药物等刺激下细胞结构、功能、形态的变化都将引起或伴随细胞的力学性质,包括变形或粘弹性与黏附特性的变化。此外,细胞在与所接触基质黏附及其极化、运动、迁移、分裂、分化过程中,将向基质施加牵引力和/或伴随牵引力的改变。
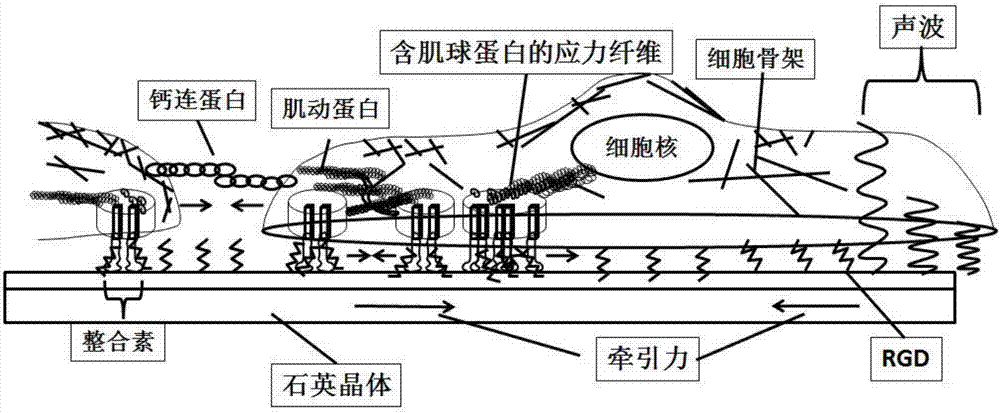
细胞力学性能与细胞骨架的成分和结构直接相关,细胞骨架通过黏着斑复合物(focaladhesioncomplex)和钙黏蛋白(cadherin)等分别与细胞外基质及相邻细胞进行物理耦合。参与细胞力传导的主要细胞结构包括细胞膜和与细胞膜紧密相连的细胞皮质(cortex)刚性薄层(由肌动蛋白、肌球蛋白及相关蛋白构成),cortex通过整合素(integrin)与细胞外基质相连,随着细胞的逐渐铺展而与细胞外基质形成黏着斑(focaladhesions)。细胞质的肌动球蛋白(actomyosin)网络通过与细胞核相连而对细胞外基质施加收缩或牵引力(图1)。衡量细胞力学性能的定量参数包括细胞粘弹性与牵引力。细胞的变形、粘弹性主要是由细胞皮质刚性薄层与细胞骨架结构决定的。细胞黏附、细胞牵引力的大小与黏着斑的结构与胞内肌动蛋白、分子马达(如肌球蛋白)及肌动球蛋白网络结构—应力纤维有关。
基于细胞力学与细胞结构功能的紧密关系,我们提出通过包括细胞粘弹性与牵引力在内细胞力学参数的定量测定来定量测定和表征细胞的结构与功能。
目前用于细胞力学参数测定的方法主要有大类,包括1)用于细胞弹性与粘弹性测定的力施加方法和2)用于细胞牵引力测定的力敏感方法。前者向细胞施加一固定的或带正弦交变的应力,通过测定应力引起的细胞形变或比较应力与应变的相位与振幅而求出细胞的弹性/剪切模量或一定频率下的粘弹性存贮与损耗模量。基于全细胞变形生物力学方法,包括微吸吮、光镊、基质或微盘伸展可得到很好解释的单细胞硬度测量数据,可是这些方法需要将本来黏附的细胞解吸或置于与生物环境不太相关的基质上。原子力显微镜(afm)、磁力扭转细胞仪利用纳米到亚微米大小的探头来获得目标亚细胞区域的生物力学参数及空间分辨率信息。但在这种尺度下,细胞内部非均匀性导致所测得的生物力学响应具有一定差异性。更为重要的是,这些方法由于需向细胞施加力因而对细胞有所伤害,不利于测量或获取细胞的动态力学性质、特别是需较长时间才能观察到的细胞功能变化过程中的力学信息。此外,这些方法主要适于单细胞测定,不适合细胞群研究。粒子示踪微流变技术可在细胞生理环境测试细胞内部粘弹性且不需向细胞施加力,但需向细胞内注入外来荧光粒子。
目前用于细胞牵引力测定主要方法的一个共同特点是采用软弹性基底,通过细胞与弹性基底相互作用引起的基底变形来计算细胞牵引力。弹性基底有连续基底与不连续基底两种形式,前者包括可起皱的薄硅膜和荧光微珠嵌入聚丙烯酰胺凝胶,后者有微加工悬臂阵列和微柱阵列。以微柱阵列为例,细胞主要黏附于与基底垂直微柱的上面,可以直接根据微柱的弯曲变形程度与方向测定与细胞接触点牵引力的大小与方向。这些基底制作工艺相对复杂,且由于细胞与基底之间属于非完全接触,微结构的形貌可能影响贴壁细胞的形态与功能,显然这种技术只能测得这些非连续、预定接触点的细胞牵引力。软凝胶牵引力显微镜并非对牵引力的直接测定,而是利用荧光显微镜观察埋在凝胶下荧光标记微珠的位移来计算。由于包括细胞牵引力显微镜在内的方法仅限于单细胞测定,而细胞与细胞之间存在异质性,为了比较并得出细胞在不同生理病理或不同激励下细胞牵引力统计意义上的变化规律,需要分析大量样本,因此需花大量时间。这些技术都是基于细胞力引起柔性基底或传感器的变形,所以必须通过照相和冗长的图像处理、模型建立与计算来求得细胞牵引力的大小。近年,细胞力显微镜已被扩展到几个细胞及细胞单层牵引力(单层牵引力显微镜,monolayertractionmicroscopy(mtm))的测定。最新的进展还包括96通道细胞单层牵引力用于药物筛选方法的建立,其依据的是细胞单层与加药1小时后牵引力的相对变化,因此只是实现了对固定终点的测试,而细胞黏附及药物作用过程的动态牵引力变化未能跟踪。
综上,细胞层次结构与功能之间的定量关系,由于缺乏合适的研究方法与手段远远落后于分子层次的研究。细胞力学性能与细胞结构、细胞功能宻切相关,可望成为定量表征细胞结构与功能的最佳参数。可目前的细胞力学技术:1)大多非无损,需对细胞施加一定的力而实现测定,而外力作用下会导致复杂的细胞呴应;2)大多仅能测单细胞力学性能,不适合细胞群;3)很难区分不同细胞结构的力学性能;4)不能对细胞力学参数进行无损、长期监测而实现对细胞功能的实时研究与定量;5)尚无技术可同时监测多个细胞力学参数,如细胞牵引力与粘弹性的同时测定。
总之,目前尚无可同时测定细胞黏附过程及药物等外部激励下伴随的细胞牵引力与细胞粘弹性变化的定量方法。
技术实现要素:
本发明旨在克服现有技术的不足,提供一种细胞牵引力与粘弹性的同时定量测定方法。
为了达到上述目的,本发明提供的技术方案为:
所述细胞牵引力与粘弹性的同时定量测定方法包括如下步骤:
(1)将at切石英晶体与bt切石英晶体置于培养皿或检测池内,所述at切石英晶体与bt切石英晶体具有相同频率、表面形态和/或修饰了相同的表面黏附分子;
(2)向培养皿或检测池中加入待测细胞,通过如下公式测定出细胞在黏附时间为t时的细胞牵引力δst:
δst=(kat-kbt)-l[tqatδftat/frat-tqbtδftbt/frbt](ⅰ)
式(ⅰ)中,kat=2.75×10-l2cm2dyn-1,kbt=-2.65×10-l2cm2dyn-1分别为at切石英晶体与bt切石英晶体的应力系数;frat为at切石英晶体的谐振频率、frbt为bt切石英晶体的谐振频率,tqat为at切石英晶体的厚度、tqbt为bt切石英晶体的厚度,两种切型的厚度与其频率之间的关系由各自的频率常数n决定,at切与bt切石英晶体的频率常数分别为nat=1.661mhz·mm=0.1661mhz·cm与nbt=2.536mhz·mm=0.2536mhz·cm,因此对于频率确定的石英晶体,其厚度tq也就相应确定了,具体地:tqat=0.1661/frat;tqbt=0.2536/frbt。δftat,δftbt分别为at切、bt切石英晶体在任意时间t相对于其参考点(如在培养基中的稳定值或是黏附后的稳定值)的频移。
当δst为负号时,表明细胞本身受到的应力是压应力,细胞处于收缩状态,对应细胞外基质受到一大小相等方向相反的张应力;当δst为正号时细胞本身受到的力为张应力,细胞处于铺展状态,对应细胞外基质受到一大小相等方向相反的压应力,即通常讲的细胞收缩牵引力,已知动物细胞微管主要对细胞施加压应力,而包含应力纤维的肌动蛋白丝对细胞施加的为张应力;
由δs引起的at切与bt切晶体频移变化分别为:
δf,sat=fratkatδs/tqat(ⅱ)
δf,sbt=frbtkbtδs/tqbt(ⅲ)
细胞黏附引起的总的频移由三部分组成:
δfat=δf,sat+δf,mat+δf,viscoat(ⅳ)
δfbt=δf,sbt+δf,mbt+δf,viscobt(ⅴ)
式(ⅳ)和式(ⅴ)中,s,m,visco分别为表面应力、质量与粘弹性引起的频移;已知了表面应力引起的频移后,质量与粘弹性引起的频移变化为:
δf,mat+δf,viscoat=δfat-δf,sat(ⅵ)
δf,mbt+δf,viscobt=δfbt-δf,sbt(ⅶ)
在电极上修饰了细胞黏附分子而使细胞与传感器形成黏着斑与紧密接触,细胞-传感器距离大为减小致可忽略,细胞层厚度相对于声波探测深度为半无限粘弹性介质时,细胞层存储模量与损耗模量通过如下公式求出:
细胞存储模量g′=π2zq2(δr2/16π2lq2-δf2)/ρliqfr2(ⅷ)
细胞损耗模量g″=-πzq2δfδr/2lqρliqfr2(ⅸ)
式(ⅷ)和式(ⅸ)中zq、lq、fr分别为石英晶体的声阻抗、动态电感与谐振频率,为常数;ρliq为培养基的密度、近似为水的宻度,为常数;δr为at或bt切石英晶体在任意时间相对于其参考点(如在培养基中的稳定值或是黏附后的稳定值)的动态电阻变化,反映了石英晶体振荡时的能量耗散程度,其它qcm技术用于表征能量耗散的参数有耗散因子、品质因数;δf是at或bt切石英晶体扣除了由式(ⅵ)或式(ⅶ)计算的表面应力部分引起频移之后的频移;
细胞的粘弹性还可用细胞粘弹性指数cvi由式(ⅹ)来半定量表征:
cvi=δr/δf(ⅹ);
式(ⅹ)中δr是扣除了表面应力部分之后的动态电阻变化、δf是扣除了表面应力部分之后的频移,作为近似,可忽略表面应力引起的动态电阻变化。cvi可用于当细胞-传感器距离不确定或不能忽略的情形,比如裸电极或没有形成黏着斑时。
优选地,所述细胞黏附分子包括能与跨膜蛋白、力敏分子整合素相互作用的细胞外基质分子;能与跨膜蛋白、力敏分子整合素相互作用的细胞外基质生物模拟分子;能与细胞表面受体相互作用的分子;与细胞表面作用而促进细胞黏附的分子。
优选地,所述能与跨膜蛋白、力敏分子整合素相互作用的细胞外基质分子为纤黏连蛋白、层黏连蛋白、玻璃黏连蛋白或胶原蛋白等;所述能与跨膜蛋白、力敏分子整合素相互作用的细胞外基质生物模拟分子为含有rgd黏附序列多肽等;所述能与细胞表面受体相互作用的分子为能与细胞表面钙黏蛋白等其他受体相互作用的分子;所述与细胞表面作用而促进细胞黏附的分子为poly-l-lysine(聚赖氨酸)等。由于细胞培养基中一般添加有一定成分的胎牛血清,而胎牛血清本身含有促进细胞贴壁、铺展与生长的痕量蛋白,因此传感器表面即便没有修饰细胞黏附分子(如祼金电极),也可通过吸附培养基中的这些成分而实现对细胞的黏附,此外,细胞本身也具备分泌细胞外基质的功能而促进其在传感器表面的黏附。
优选地,步骤(2)所述公式中,tqat=0.1661/frat;tqbt=0.2536/frbt。
下面对本发明做进一步说明:
我们认为用于细胞粘弹性与牵引力的理想测定方法是测定芯片或装置本身可作为细胞黏附的基质,这样不仅可跟踪细胞的黏附过程,而且可最灵敏地对细胞黏着斑与皮质刚性薄层结构进行探测,更理想地是方法可延伸探测到细胞骨架等结构的粘弹性并可同时测定细胞牵引力。本发明提出以高等石英晶体微天平(qcm)技术来实现上述目标。qcm由于对其所接触界面的质量与粘弹性敏感,已被用于多种细胞黏附与粘弹性的测定。我们曾提出细胞粘弹性参数(cvi)来半定量表征细胞的粘弹性,并用于大鼠h9c2心肌细胞收缩功能及心血管肌力药物评估。wu等基于双层负荷压电传输线模型与高频导纳测定,成功实现了利用qcm技术定量测定与比较年老大鼠与年幼大鼠肌腱干细胞的复数剪切模量,表明年老大鼠的细胞刚度与粘度都变大。此外,也有qcm技术用于细胞黏附过程所伴随的表面应力测定变化的报道。可目前尚无基于qcm技术同时测定细胞粘弹性与牵引力的报道。
虽然细胞牵引力一般指的是通过细胞与基质形成黏着斑而施加给基质的力,但只要细胞能黏附于基质上,不管是否形成黏着斑,甚至不管黏附是通过化学作用还是机械作用,都能对所黏附基质施加表面应力。在无黏着斑形成的情况下,细胞与基质的相互作用力叫做细胞黏附力。此外,细胞生长、运动、分化等过程对基质也将产生程度不一的力。一般来说,细胞在基质上可能产生力的大小顺序为:分裂时产生的力>牵引力>黏附力。所有这些力都可用本发明的技术进行实时、定量、连续测定与研究。而这些不同细胞力伴随的细胞粘弹性变化亦可同时经ⅷ与ⅸ式定量测定或由ⅹ式半定量测定。此外,通过与其它技术,如电化学阻抗联用,可测定不同细胞过程伴随的细胞-传感器距离的动态变化以确定是否可经ⅷ与ⅸ式来求取细胞的存储与损耗模量。一旦求取了细胞-传感器距离,通过在压电模型中增加一细胞与传感器间隙层,仍可能经压电高频阻抗测量而定量求出。上面ⅷ-ⅹ式计算的前题是假设细胞的粘弹性是均匀的,实际上细胞不同结构,如细胞皮质刚性薄层与细胞骨架的粘弹性是不同的,为探测不同细胞结构的粘弹性,可采用不同频率的声波(见图1),高的基频或泛音频率主要探测的是细胞膜与细胞皮层,而较低频率可探测到细胞骨架。
与现有技术相比,本发明的有益效果为:
(1)该方法首次实现了对细胞黏附过程及包括药物等作用下细胞牵引力与粘弹性的同时、连续、动态测定,从而填补了细胞牵引力与粘弹性同时定量测定方法的空白。依据的是对高频at与bt切石英晶体频率与动态电阻的监测,无需使用光学显微镜。由于该技术无损、且能与培养皿结构相兼容而放置co2培养箱中长期监测,从而可实现对细胞运动、生长与分化等细胞功能所伴随细胞牵引力与粘弹性的连续与长期监测。所提出的方法所拥有的快速响应时间与采样速度和连续、动态、长期监测能力,是现有其它细胞力学方法无法达到的。
(2)该方法可用于不同细胞数目(如100-60000)或不同细胞密度下细胞总的牵引力大小与方向及粘弹性的定量测定。通过提高晶体频率和/或采用细胞图案化可使检测细胞的数目进一步减少甚至可实现单细胞的测定。即本发明可望实现从单细胞到细胞单层细胞牵引力与粘弹性的定量测定。
(3)动物贴壁细胞不仅与其相邻的细胞产生细胞间相互作用,同时也与细胞外基质相互接触和作用。本发明技术的另一特点是可通过在传感器表面修饰不同的细胞外基质成分与细胞黏附分子并改变它们的表面密度从而定量考察对细胞牵引力与粘弹性的影响并与细胞的功能与行为联系起来。此外,采用光透传感器电极与荧光标记黏着斑蛋白与细胞骨架蛋白分子,可将传感器测得的细胞牵引力、细胞粘弹性与细胞形态(铺展程度)及黏着斑、细胞皮层与细胞骨架结构及细胞的功能与行为联系起来。因此本发明通过建立细胞牵引力与粘弹性的同时定量测定方法,为定量研究细胞结构与功能奠定了坚实基础,为应用于细胞生物学等领域提供了一种新的有效工具。
总之,本发明基于高等双谐振qcm技术与qcm传感器表面修饰细胞黏附分子,首次实现了细胞黏附过程伴随的细胞牵引力与细胞粘弹性的同时、无损、连续、定量测定,并应用于影响细胞牵引力与粘弹性药物的检测。本发明可用于研究与比较不同细胞黏附分子及各种机械形貌对细胞力与粘弹性响应的动态影响。此外,本发明可用于研究细胞处于不同内外环境激励下细胞力与粘弹性的动态变化规律,如药物的影响,药物可在细胞黏附前或黏附后加入。本发明适用于所有贴壁细胞,包括原代细胞与传代细胞。
附图说明
图1为细胞结构-力学与qcm声波检测示意图;
图2为用双谐振qcm技术同时定量测定细胞牵引力与细胞粘弹性参数及与光学/荧光显微镜联用示意图;
图3:实例:20,000人脐静脉内皮细胞在不同krgd浓度下修饰的9mhzat与bt切石英晶体金电极上黏附过程的qcm频移与动态电阻响应曲线及同时定量测得的细胞牵引力与粘弹性动态变化。1~5分别为0μg/ml、25μg/ml、50μg/ml、75μg/ml、100μg/ml的krgd浓度。(a)黏附过程rgd修饰at切晶体上的频移响应;(b)黏附过程rgd修饰bt切晶体上的频移响应;(c)黏附过程rgd修饰at切晶体上的动态电阻响应;(d)黏附过程rgd修饰bt切晶体上的动态电阻响应;(e)黏附过程rgd修饰晶体上的细胞牵引力动态变化;(f)黏附过程rgd修饰at切晶体上的细胞存储模量动态变化;(g)黏附过程rgd修饰bt切晶体上的细胞存储模量动态变化;(h)黏附过程rgd修饰at切晶体上的细胞损耗模量动态变化;(i)黏附过程rgd修饰bt切晶体上的细胞损耗模量动态变化;(j)黏附过程rgd修饰at切晶体上的细胞粘弹性指数动态变化;(k)黏附过程rgd修饰bt切晶体上的细胞粘弹性指数动态变化。
图4:实例:20,000人脐静脉内皮细胞在不同fibronectin浓度下修饰的9mhzat与bt切石英晶体金电极上黏附过程的qcm频移、动态电阻变化及同时定量测得的细胞牵引力与粘弹性动态变化。1~6分别为0μg/ml、10μg/ml、20μg/ml、30μg/ml、40μg/ml、50μg/ml的fibronectin浓度。(a)黏附过程fibronectin修饰at切晶体上的频移响应;(b)黏附过程fibronectin修饰bt切晶体上的频移响应;(c)黏附过程fibronectin修饰at切晶体上的动态电阻响应;(d)黏附过程fibronectin修饰bt切晶体上的动态电阻响应;(e)黏附过程fibronectin修饰晶体上的细胞牵引力动态变化;(f)黏附过程fibronectin修饰at切晶体上的细胞存储模量动态变化;(g)黏附过程fibronectin修饰at切晶体上的细胞损耗模量动态变化。
图5:实例:20,000人脐静脉内皮细胞在50μg/mlkrgd浓度下修饰的9mhzat与bt切石英晶体金电极上黏附过程及1.22μmblebbistatin药物作用下的qcm频移、动态电阻变化及同时定量测得的细胞牵引力与粘弹性动态变化。(a)at切晶体上的频移与动态电阻响应;(b)bt切晶体上的频移与动态电阻响应;(c)细胞牵引力或表面应力动态变化;(d)at切晶体上的细胞存储模量动态变化;(e)bt切晶体上的细胞存储模量动态变化;(f)at切晶体上的细胞损耗模量动态变化;(g)bt切晶体上的细胞损耗模量动态变化;(h)at切晶体上的细胞粘弹性指数动态变化;(i)bt切晶体上的细胞粘弹性指数动态变化。
图6:实例:20,000人脐静脉内皮细胞在50μg/mlkrgd浓度下修饰的9mhzat与bt切石英晶体金电极上黏附过程及0.5μmnocodazole药物作用下的qcm频移、动态电阻变化及同时定量测得的细胞牵引力与粘弹性动态变化。(a)at切晶体上的频移与动态电阻响应;(b)bt切晶体上的频移与动态电阻响应;(c)细胞牵引力或表面应力动态变化;(d)at切晶体上的细胞存储模量动态变化;(e)at切晶体上的细胞损耗模量动态变化。
图7:实例:20,000h9c2大鼠心肌细胞(第一个箭头处加入)在at切与bt切两种裸金电极上黏附及在125nm正性肌力药物异丙肾上腺素和25nm负性肌力药物维拉帕米作用下(第二个箭头处加入)的qcm频移、动态电阻变化及同时测得的细胞牵引力与粘弹性动态变化。(a)细胞黏附与异丙肾上腺素作用下at切晶体上的频移与动态电阻响应;(b)细胞黏附与维拉帕米作用下at切晶体上的频移与动态电阻响应;(c)细胞黏附与异丙肾上腺素作用下bt切晶体上的频移与动态电阻响应;(d)细胞黏附与维拉帕米作用下bt切晶体上的频移与动态电阻响应;(e)细胞黏附与异丙肾上腺素作用下细胞牵引力或表面应力动态变化;(f)细胞黏附与维拉帕米作用下细胞牵引力或表面应力动态变化;(g)细胞黏附与异丙肾上腺素作用下细胞粘弹性指数动态变化,at切;(h)细胞黏附与维拉帕米作用下细胞粘弹性指数动态变化,at切;(j)细胞黏附与异丙肾上腺素作用下细胞粘弹性指数动态变化,bt切;(j)细胞黏附与维拉帕米作用下细胞粘弹性指数动态变化,bt切。
具体实施方式
图2给出了用at与bt切双谐振技术定量测定细胞牵引力与粘弹性参数及与荧光显微镜联用的示意图。at切与bt切晶体为相同频率与表面形态和/或修饰了相同的表面黏附分子,在向两个池子加入了相同数目与质量的同一批细胞后,通过实时检测两晶体的频率变化后便可由式(ⅰ)定量求出细胞的牵引力。当传感器表面修饰有细胞黏附分子rgd或fibronectin后,细胞-传感器的距离大为减少而可忽略,此时细胞层的平均存贮模量与损耗模量可由式(ⅷ)与式(ⅸ)分别定量求出。当细胞-传感器的距离不能忽略或不确定时,细胞的粘弹性可由式(ⅹ)的细胞粘弹性指数半定量表征。本发明所提出的细胞牵引力与粘弹性的同时测定方法不需要显微镜,因此石英晶体表面所被金属电极及所修饰分子与材料不要求透明、可为任何材料、这是该方法的又一优势。具体地石英晶体表面可被有与细胞生物相容的金属金或非金属sio2等。理想地,为获得伴随细胞牵引力与粘弹性变化的细胞形态与黏着斑、细胞骨架结构等动态信息,qcm晶体可与光学或荧光显微镜联用,此时需用到光透qcm电极,比如ito电极。这样可进一步验证本发明方法,将细胞力学参数与细胞结构功能定量联系起来。
所述细胞牵引力的实时与定量测定方法包括如下步骤:
(1)将at切石英晶体与bt切石英晶体置于培养皿或检测池内,所述at切石英晶体与bt切石英晶体具有相同频率、表面形态和/或修饰了相同的表面黏附分子;
(2)向培养皿或检测池中加入待测细胞,通过如下公式测定出细胞牵引力δs:
δst=(kat-kbt)-l[tqatδftat/frat-tqbtδftbt/frbt]
式中,δst为细胞在粘附时间为t时的牵引力,kat=2.75×10-l2cm2dyn-1,kbt=-2.65×10-l2cm2dyn-1分别为给定晶体取向at与bt切石英晶体的应力系数;frat与frbt分别为at切与bt切石英晶体的谐振频率;tqat与tqbt分别为at切与bt切石英晶体的厚度,均为常数。δftat,δftbt分别为at切、bt切石英晶体在任意时间t相对于其参考点(在培养基中的稳定值)的频移。
由表面应力δs引起的at切与bt切晶体频移变化分别为:
δf,sat=fratkatδs/tqat
δf,sbt=frbtkbtδs/tqbt
(3)经在电极上修饰细胞黏附分子,如rgd或fibronectin而使细胞与传感器距离可忽略、细胞层厚度相对于声波探测深度为半无限粘弹性介质时,细胞层存储模量与损耗模量可按下面两式分别求出,
细胞存储模量g′=π2zq2(δr2/16π2lq2-δf2)/ρliqfr2
细胞损耗模量g″=-πzq2δfδr/2lqρliqfr2
式中zq、lq、fr分别为石英晶体的声阻抗、动态电感与谐振频率,为常数或可测定的常数。ρliq为培养基的密度、可看成水的宻度,亦为常数。δf、δr为at与bt切晶体所测得总的频移中扣除了表面应力部分引起频移之后的频移及动态电阻变化。本发明中作为一级近似,忽略了细胞表面应力或牵引力引起的动态电阻变化。
本发明实验中采用的晶体频率为9mhz,此时tqat=0.0185cm,tqbt=0.0282cm。因此(ⅰ)式可简化为:
δst=2.058×104(0.0185δftat-0.0282δftbt)(dyne/cm)(ⅺ)。
细胞牵引力与细胞粘弹性同时定量测定实验
修饰有特异性细胞黏附分子rgd或fibronectin的at与bt切石英晶体同时定量测定细胞牵引力与细胞粘弹性的步骤如下:
(1)无水乙醇、millipore清洗,氮气吹干at与bt切9mhz晶体。
(2)滴加1滴piranha溶液(80℃1:3(v:v)30%h2o2:h2so4)于石英晶体金电极上处理30s,用millipore水、无水乙醇清洗,氮气吹干,重复3次。将无水乙醇滴到电极上静置几分钟,灭菌水冲洗,氮气吹干。
(3)将表面处理好的at与bt切石英晶体安装至teflon井型池中。
(4)室温下向池中加入20mm的3-巯基丙酸与1mm的三乙二醇单-11-巯基十一烷基醚的混合无水乙醇溶液,避光静置过夜。
(5)取出溶液,用无菌水冲洗;加入溶有150mmedc和30mmnhs的pbs缓冲溶液(ph=5.5),静置约30-60min。
(6)取出溶液,用pbs缓冲溶液(ph=5.5)、灭菌水冲洗;加入不同浓度的krgd或fibronectin的pbs溶液,静置反应1-2h(rgdk)或过夜(fibronectin)。
(7)取出溶液,用灭菌后的pbs、无菌水冲洗,得到krgd或fibronectin修饰的金电极。加入20,000人脐静脉内皮细胞,开启qcm进行监测。
(8)实验完毕,收集培养基,用pbs轻轻清洗,加入胰蛋白酶消化处理,对所收集成分中细胞用细胞计数仪测定。
(9)细胞黏附过程细胞牵引力或表面应力的动态变化δs、细胞存储模量g′、细胞损耗模量g″、细胞粘弹性指数cvi分别据(xi)式、(ⅷ)式、(iv)式、(x)式定量求出。
药物blebbistatin与nocodazole验证试验步骤如下:
按前述修饰rgd的at与bt切石英晶体同时定量测定细胞牵引力与细胞粘弹性的步骤采用50μg/ml浓度的krgd修饰9mhzat与bt切晶体后,加入20,000人脐静脉内皮细胞,qcm检测黏附过程约17h后,分别向at与bt切晶体检测池加入最终浓度为1.22μm的blebbistatin或0.5μm的nocodazole,继续监测约10或5小时,收集数据并求出细胞黏附过程及blebbistatin与nocodazole药物作用下细胞牵引力与粘弹性参数的变化规律。
祼金电极at与bt切石英晶体定量测定细胞牵引力与半定量测定细胞粘弹性及心血管激动药物异丙肾上腺素isoprenaline(iso)和抑制药物维拉帕米verapamil(vrp)的影响实验步骤如下:
(1)取四个teflon井型池,两个相同的9mhzat切和两个相同的9mhzbt切被金电极晶体,将1滴piranha溶液(80℃1:3(v:v)30%h2o2:h2so4)滴到石英晶体金电极中央,处理约30s,然后用蒸馏水冲洗,氮气干燥,重复该步骤3次。
(2)将晶体组装于teflon井型池。
(3)在用蒸馏水清洗池两次后,加约300μl灭菌水,置于37℃,5%.培养箱中。
(4)检查确定8通道qcm仪器qca922有晶体谐振频率与动态电阻输出,依次连接检测池,确定每一检测池(如两个at切、两个bt切晶体检测池)都工作,启动软件开始采集数据。
(5)待每一通道对应的数据稳定后,移除灭菌水,再用灭菌水清洗两次后用pbs清洗,后加入52μl含有胎牛血清的dmem培养基,采集qcm谐振频率(f)与动态电阻(r)数据2h;再加入250μl含一定数量(如20000个)的h9c2大鼠心肌细胞的培养基后,连续采集f与r数据约20h。每一通道细胞黏附不同时间引起的qcm相对频移δf与动态电阻变化δr以该通道在时间(t)时的qcm响应值减去其在培养基中的相应稳定值而求出。
(6)细胞在qcm电极上黏附约20h后,从四个池中分别取出5μl培养液,向其中的两个at与bt切晶体检测池分别加入5μl10μmiso和5μl2μmvrp,继续监测20h,收集数据。
(7)实验完毕,收集培养基,用pbs轻轻清洗,加入胰蛋白酶消化处理,对所收集成分中细胞用细胞计数仪测定。
(8)按式(ⅺ)与式(ⅹ)求出细胞粘附过程及药物iso与vrp作用下细胞牵引力与细胞粘弹性指数的动态变化δs与cvi。
人脐静脉内皮细胞在krgd与fibronectin修饰金电极上黏附伴随的细胞牵引力与粘弹性变化
在9mhzat与bt切石英晶体金电极上于不同krgd浓度(0μg/ml、25μg/ml、50μg/ml、75μg/ml、100μg/ml)下修饰qcm金电极晶体对人脐静脉内皮细胞(huvecs)的qcm响应及细胞牵引力与粘弹性变化规律如图3所示,在五种不同rgd表面密度修饰的金电极上,huvecs的响应不同。通过qcm监测的频率、动态电阻的变化不同。at切与bt切的频移响应曲线都表明在中等krgd浓庋(50μg/ml)下修饰的石英晶体对细胞的黏附效果最好、频移最大(图3a与图3b)。图3c的结果表明细胞牵引力δs为正,且随着时间增加、δs很快增大于8小时左右达到极值,之后有所降低。因此细胞在修饰有rgd分子的表面能很好铺展,细胞受到的为张应力得以铺展,δs为正。该结论与qcm频移响应结果及双谐振qcm技术理论一致。50μg/mlkrgd浓度下修饰的rgd表面的最后稳态牵引力(图3e),粘弹性参数,包括细胞存储模量(图3f、图3g)与损耗模量(图3h、图3i),细胞粘弹性指数(图3j、图3k)均最大。因此可认为在该rgd表面密度下,细胞与rgd有很好的相互作用并使细胞得以顺利铺展,电极对huvec细胞的黏附效果最佳,该rgd浓度下细胞粘弹性指数也最大,表明细胞应力纤维量最多与最强,所搭建的细胞骨架结构最稳定、细胞最硬。这是目前为止首次实验证实了最佳细胞黏附对应最大细胞牵引力与最大细胞粘弹性。该结论得益于本发明对细胞黏附、细胞牵引力与细胞粘弹性的同时定量测定方法的突破。在裸金电极(0μg/mlrgd浓度)下,传感器的响应最小。细胞在较高浓度(75μg/ml和100μg/ml)rgd下修饰的rgd表面上所产生的qcm响应处于中间值,这可能是由于在较高rgd浓度下,细胞与传感器的相互作用由于rgd的取向受空间位阻影响较之对细胞具最佳黏附效果的50μg/mlrgd下有所减弱。
我们也比较了不同fibronectin浓度(0μg/ml、10μg/ml、20μg/ml、30μg/ml、40μg/ml、50μg/ml)下huvec细胞黏附过程的细胞牵引力(图4e)、细胞存贮模量(图4f)、细胞损耗模量(图4g)的动态变化结果,当fibronectin浓度为20μg/ml中间浓度时的稳态细胞牵引力、细胞存贮与损耗模量为最大。
药物blebbistatin与nocodazole作用下的细胞力学性能变化
为验证所建立的压电细胞力传感方法,我们采用50μg/mlrgd浓度下修饰石英晶体,考察了肌球蛋白ii抑制剂blebbistatin作用下的qcm响应。图5表明在blebbistatin作用下,细胞牵引力δs下降;同时细胞粘弹性指数cvi下降、细胞存贮模量与损耗模量均降低、细胞变软。blebbistatin是一种非肌肉肌球蛋白ii型atp酶抑制剂,这里的结果与文献中其它方法报道的blebbistatin使细胞牵引力降低、细胞变软的结论是一致的。此外我们还考察了微管抑制剂nocodazole对细胞力学性能的影响,表明在0.5μmnocodazole作用下,细胞牵引力增加、细胞存储模量与损耗模量均增加、细胞变硬(图6),同样与文献中其它方法报道的主要结论一致。
心血管激动药物异丙肾上腺素isoprenaline(iso)和抑制药物维拉帕米verapamil(vrp)对细胞力学性能的影响
图7给出了用裸金9mhzat与bt切石英晶体检测大鼠h9c2心肌细胞黏附及随后受正性肌力药物iso和负性肌力药物vrp作用下的动态qcm响应。由双谐振at与bt切频移据式(ⅺ)定量求出了细胞黏附过程及药物作用下细胞所施加给石英晶体表面应力或牵引力δs的动态变化(见图7e、f)。式(ⅺ)结果表明如δs为负号时,细胞受到的是压应力(细胞收缩或正性肌力作用时),正号时受到的为张应力(细胞铺展或负性肌力作用时)。由于裸金电极对细胞的黏附能力有限,图7的结果显示δs稍大于为零,即细胞在裸金电极上只能有限地铺展。在正性肌力药物iso作用下,细胞收缩更为加强、δs减小向负的方向变化(图7e),cvi增加(图7g、i)、细胞变硬。在负性肌力或舒张试剂vrp作用下,细胞变软(图7h、j)、舒张力增加(图7f)。这些结果表明双谐振qcm技术可望用于不同收缩、舒张试剂对细胞收缩与舒张功能的影响研究。
- 还没有人留言评论。精彩留言会获得点赞!