基于核酸层析生物传感技术检测阪崎肠杆菌的方法与流程
本发明涉及生物传感检测技术领域,具体地说,涉及一种基于核酸层析生物传感技术检测阪崎肠杆菌的方法。
背景技术:
阪崎肠杆菌(克罗诺杆菌属)是一种革兰氏阴性、依靠周生鞭毛运动、无芽孢的兼性厌氧细菌。它是肠杆菌属的一种条件致病菌,该菌引起的食源性疾病可导致婴儿(尤其是新生儿)的脑膜炎、小肠结肠炎和菌血症,报告病例的死亡率达20%-50%,幸存者常遗留严重的神经系统疾病。近年来对食品(奶粉、巧克力、谷类食品、马铃薯、意大利面等)加工厂原料、生产环境及家庭中阪崎肠杆菌污染率的研究发现,阪崎肠杆菌在自然界中分布广泛。在多起阪崎肠杆菌的暴发事件中发现,新生儿阪崎肠杆菌感染与婴儿配方粉密切相关。
传统的细菌检测方法主要根据生理生化特征,但是传统的检测方法需要经过前增菌、选择性平板分离、生物化学鉴定等步骤,从取样到确定结果需要5-7天,检测周期长,操作繁琐,工作量大;利用抗原抗体反应的特异性,对细菌进行鉴别,已有半个多世纪的历史,但是微生物抗体的筛选十分繁琐,并且最终的检测特异性不高;分子生物学检测技术的不断完善和发展,克服了传统检测方法实验操作繁琐、耗时长等问题,也使得针对微生物开展的快速检测方法得到迅速发展,但是分子生物学方法的缺点在于不容易分析结果。随着现代生物技术的发展,比传统方法更快捷、更灵敏的生物传感器新技术在食品安全检测领域崭露头角。生物传感器具备特异性强、灵敏度高等优点,可以简化分析检测步骤,缩短分析时间,更重要的是使在线实时检测成为可能,便于携带和野外作业,在食品安全领域得到了较快的发展。近年来,众多新材料、新技术的开发和应用正成为研究的热点,为生物传感器的发展注入了新的活力,在微生物检测领域显示出巨大的应用潜力。因此建立阪崎肠杆菌可靠的、快速的传感器检测方法,特别是能够鉴定死活菌的方法,在日常监控、市场筛查等方面具有重要意义。
技术实现要素:
本发明的目的是提供一种基于核酸层析生物传感技术检测阪崎肠杆菌的方法。
本发明构思如下:开发一种阪崎肠杆菌的快速和超灵敏检测方法,特别是能够鉴定死活菌的方法,建立基于叠氮碘化丙啶(pma),环介导等温扩增反应(lamp)和纳米酶试纸的活菌检测的连续级联纳米酶生物传感器。在lamp反应中,使用荧光素(fitc)修饰的和生物素(bio)修饰的引物测定阪崎肠杆菌的ompa基因。将pma与lamp组合,应用于死活阪崎肠杆菌的分离。然后,使用纳米酶探针制备基于磁性颗粒的免疫层析条(纳米酶条)用于检测扩增信号,通过目视检测或利用条形读出器进行结果判读或定量,为现场检测阪崎肠杆菌活菌提供快速、超灵敏和便捷的工具。
为了实现本发明目的,本发明首先提供用于检测阪崎肠杆菌(enterobactersakazakii)的lamp引物组,包括(seqidno:1-4):
外侧正向引物f3:5’-tggtcccagttccacgata-3’;
外侧反向引物b3:5’-acgccctgagctttgaaag-3’;
内侧正向引物fip:5’-taacctggtaaccaccgaacgctattcctaacgacggtccga-3’;
内侧反向引物bip:5’-gtacgttggcttcgaaatgggccagtgtcgcctttatacggc-3’。
其中,引物fip的5’端标记生物素,引物bip的5’端标记荧光素fitc。
本发明还提供一种纳米酶核酸层析试纸条,所述试纸条的制备方法包括以下步骤:
1)fe3o4磁颗粒的制备;
2)纳米酶探针(mnp)的制备:将fe3o4磁颗粒与生物素二抗进行孵育,得到生物素二抗纳米酶探针;
3)纳米酶核酸层析试纸条的组装:所述试纸条包括样品垫、结合垫、硝酸纤维素膜和吸收垫,其中,所述硝酸纤维素膜上设有至少1条检测线和1条质控线;所述结合垫上固定有生物素二抗纳米酶探针;
①分别用fitc抗体和生物素抗体在硝酸纤维素膜上划出检测线和质控线,烘干;
②将上述样品垫、结合垫、带有检测线和质控线的硝酸纤维素膜以及吸收垫依次粘贴在底板(塑料衬板)上,完成试纸条的组装。组装好的试纸条的结构示意图见图5。
步骤1)中利用水热法合成fe3o4磁颗粒,具体为:将0.6-0.8gfecl3·6h2o溶解在20ml乙二醇中,然后加入1.5-2.0g醋酸钠,剧烈搅拌30-40min,然后密封在高压釜中,200℃加热16-18h;磁颗粒产物用乙醇洗涤几次,并在60℃下干燥;将二氯乙烷和n-羟基琥珀酰亚胺各5-8mg通过涡旋溶解在1ml去离子水中,制得混合液,然后将5-8mg磁颗粒加入混合液中,室温下孵育30-40min,然后用磁铁收集磁颗粒,用超纯水洗涤两次,即得fe3o4磁颗粒。
步骤2)具体为:将浓度100μg/ml的生物抗体加入50mmph6.0的醋酸钠缓冲液中,然后与5-8mg的fe3o4磁颗粒混合,将混合物涡旋混合,4℃孵育过夜;用ph7.0的pbs液洗涤两次混合物,然后在50mmph7.2的tris缓冲液中室温孵育30min;再用ph7.0的pbs液洗涤,即得到生物素二抗纳米酶探针。
步骤3)中检测线设在距硝酸纤维素膜下边缘1.1cm的位置上,质控线设在距硝酸纤维素膜下边缘1.6cm的位置上。检测线与质控线之间的距离为4.5mm。按1.0μl/cm将fitc抗体和生物素抗体分别喷涂在硝酸纤维素膜的检测线和质控线上。其中检测线和质控线上包被的抗体的浓度均为0.5-2mg/ml。抗体的最佳浓度为1mg/ml。
本发明中使用的生物素抗体购自sigma公司,商品编号b7653,fitc抗体购自sigma公司,商品编号f5636。生物素二抗为羊抗鼠igg。所用硝酸纤维素膜为millipore135s。
在本发明的一个优选实施方式中,所述纳米酶核酸层析试纸条的制备如下:
步骤1)中利用水热法合成fe3o4磁颗粒,具体为:将0.6gfecl3·6h2o溶解在20ml乙二醇中,然后加入1.5g醋酸钠,剧烈搅拌30min,然后密封在高压釜中,200℃加热16h;磁颗粒产物用乙醇洗涤几次,并在60℃下干燥;将二氯乙烷和n-羟基琥珀酰亚胺各5mg通过涡旋溶解在1ml去离子水中,制得混合液,然后将5mg磁颗粒加入混合液中,室温下孵育30min,然后用磁铁收集磁颗粒,用超纯水洗涤两次,即得fe3o4磁颗粒。
步骤2)具体为:将浓度100μg/ml的生物素二抗加入50mmph6.0的醋酸钠缓冲液中,然后与5mg的fe3o4磁颗粒混合,将混合物涡旋混合,4℃孵育过夜;用ph7.0的pbs液洗涤两次混合物,然后在50mmph7.2的tris缓冲液中室温孵育30min;再用ph7.0的pbs液洗涤,即得到生物素二抗纳米酶探针。最后将纳米酶探针分散到1ml的5%bsa-pbs溶液中。使用jeol2000fx200kv透射电子显微镜(tem)观察纳米酶探针的粒径,mnp的尺寸分布显示平均直径为200nm,可用于纳米酶传感器的构建。
将样品垫、固定有生物素二抗纳米酶探针的结合垫、带有检测线和质控线的硝酸纤维素膜以及吸收垫依次粘贴在底板上,即完成试纸条的组装。
本发明还提供基于核酸层析生物传感技术检测阪崎肠杆菌的方法,包括以下步骤:
s1、提取待测样品dna,以dna为模板,利用上述lamp引物组进行lamp-pcr扩增反应;
s2、取10μl步骤s1的lamp-pcr扩增产物,与50μl反应缓冲液混合后滴加到上述纳米酶核酸层析试纸条的样品垫上,5-20min(优选反应时间不小于15min)后,在测试线和质控线上滴加2滴底物缓冲液,反应5min后然后通过肉眼观察显色情况,判读结果:阴性反应:质控线显色,检测线不显色;阳性反应:质控线、检测线均显色;失效反应:若质控线不显色,则检测失败或试纸条失效。
对于定量测量,采用与条带读取器软件组合的便携式条带读取器记录条带的光学强度,根据光学强度计算出待测样品中阪崎肠杆菌的含量。
其中,步骤s2中所述反应缓冲液为:4×ssc,0.2m/m%吐温-20。
本发明中使用的底物缓冲液为商品化试剂(购自北京中杉金桥生物技术有限公司),含有20×dab和20×h2o2。
本发明中,lamp-pcr扩增反应的体系为:1×bstthermalbuffer,0.6mbetaine,0.5mmdntps溶液,1.6μmfip,1.6μmbip,0.2μmf3,0.2μmb3,3.6mmmgso4,8ubstdna聚合酶大片段,2μl模板,ddh2o补足至25μl。
lamp-pcr反应程序为:65℃30min,然后85℃3min。
在步骤s1之前,还包括对待测样品进行叠氮碘化丙锭处理的步骤,具体为:向1μl含有活菌或热灭活细菌的待测样品中加入终浓度为10μg/ml的叠氮碘化丙锭,避光孵育5min,然后使用500w卤素光源将样品曝光5min,将样品管放置在远离光源20cm处并水平放置在冰上,每隔30s摇动样品管以保持对光源的均匀暴露;然后进行dna提取。
本发明进一步提供含有所述用于检测阪崎肠杆菌的lamp引物组和/或所述纳米酶核酸层析试纸条的试剂盒。
本发明具有以下优点:
(一)本发明首次开发出pma、lamp与纳米酶试纸相结合的纳米酶生物传感器。
(二)纳米酶试纸首次成功地用于区分活菌细胞和死菌细胞。
(三)本发明的纳米酶生物传感器可用于阪崎肠杆菌活菌的现场诊断测试。
(四)提供一组新的lamp引物,可用于检测阪崎肠杆菌的ompa基因。
(五)纳米酶传感器对阪崎肠杆菌的检测下限可达10cfu/ml。
附图说明
图1为本发明实施例1中阪崎肠杆菌lamp扩增结果;其中,m为dnamarker,泳道1-3为阪崎肠杆菌阳性扩增,泳道4为阴性扩增。
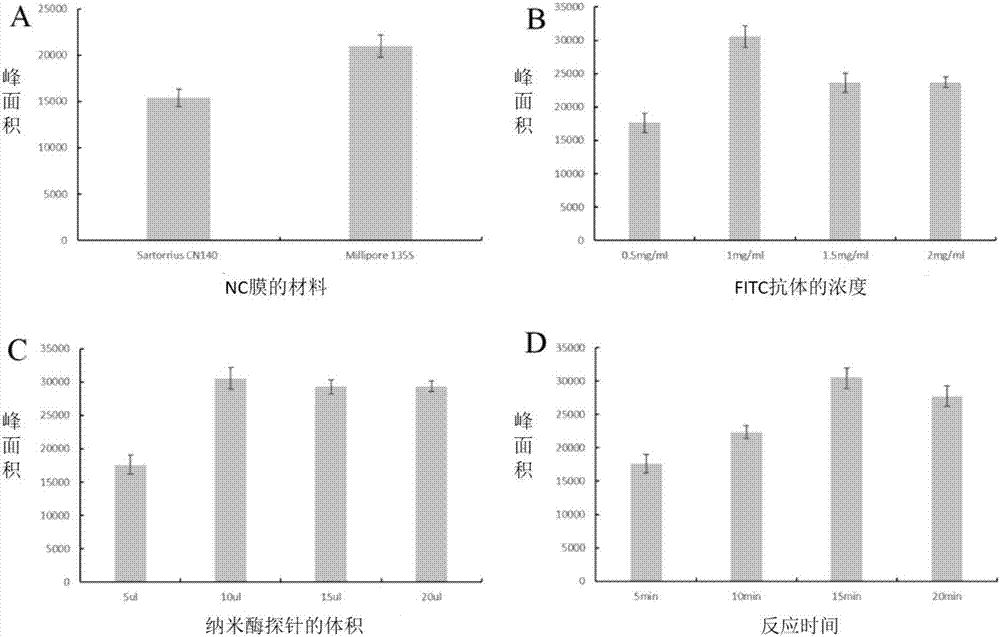
图2为本发明实施例2中对生物传感器的优化;其中,(a)膜材料对生物传感器峰面积的影响;(b)检测线上fitc抗体浓度对生物传感器峰面积的影响;(c)纳米酶探针的用量体积对生物传感器的峰面积的影响;(d)反应时间对生物传感器的峰面积的影响。
图3为本发明实施例3中生物传感器性能分析结果图;其中,(a)传感器重现性分析结果图。(b)传感器特异性分析结果图。从左至右样本分别是:双蒸水,其他肠杆菌dna扩增产物,其他非阪崎肠杆菌菌株dna扩增产物,死阪崎肠杆菌菌株dna扩增产物,活阪崎肠杆菌菌株dna扩增产物;(c)传感器稳定性分析结果图。从左至右为同一批传感器每隔一周的测试结果。
图4为本发明实施例4中阪崎肠杆菌检测的线性曲线:峰面积随lg(阪崎肠杆菌浓度)的变化。
图5为本发明纳米酶核酸层析试纸条的结构示意图。其中,1-样品垫,2-硝酸纤维素膜,3-结合垫,4-吸收垫,5-测试线,6-质控线,7-底板。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例均按照常规实验条件,如sambrook等分子克隆实验手册(sambrookj&russelldw,molecularcloning:alaboratorymanual,2001),或按照制造厂商说明书建议的条件。
实施例1基于核酸层析生物传感技术检测阪崎肠杆菌的方法
1、实验材料
本实施例中所用阪崎肠杆菌与非阪崎肠杆菌菌株信息见表1。
表1所用的阪崎肠杆菌与非阪崎肠杆菌的信息
使用阪崎肠杆菌和其他细菌菌株来测定纳米酶传感器的特异性。在使用前将所有菌株储存在-80℃的20%(v/v)甘油溶液中。随后将其在lb培养基中过夜培养活化。通过分光光度法测定阪崎肠杆菌浓度。
2、阪崎肠杆菌基因组提取
采用newindustry公司的细菌基因组dna提取试剂盒,具体步骤如下:
(1)取细菌培养液1.5ml,12000g离心1min,尽量吸尽上清。
(2)向细菌沉淀中加入200μl溶液a,振荡至菌体充分悬浮。
(3)向管中加入20μl10mg/ml的蛋白酶k,充分混匀,期间可颠倒离心管混匀次数,直至样品消化完全为止。消化完全的标志是液体清亮及黏稠。
(4)向管中加入2000μl溶液b,充分混匀。如出现白色沉淀,可置于75℃15-30min,沉淀即会消失,不影响后续实验。
(5)向管中加入220μl无水乙醇,充分混匀,此时可能会出现絮状沉淀,不影响dna的提取,可将溶液和絮状沉淀都加入吸附柱中,静置2min。
(6)12000g离心1min,废弃液,将吸附柱放入收集管中。
(7)向吸附柱中加入700μl漂洗液,12000g离心1min,废弃液,将吸附柱放入收集管中。
(8)向吸附柱中加入500μl漂洗液,12000g离心1min,废弃液,将吸附柱放入收集管中。
(9)12000g离心2min,将吸附柱置于室温或50℃温箱放置数分钟,去除吸附柱中残留的漂洗液。
(10)将吸附柱放入一个干净的离心管中,向吸附膜中央悬空滴加500-200μl经75℃水浴预热的洗脱液,室温放置2min,12000g离心2min。
(11)离心所得洗脱液再加入吸附柱中,室温放置2min,12000g离心2min,即可得到高质量的细菌基因组dna。
3、叠氮碘化丙锭处理
将1μl活菌或热灭活细菌,加入终浓度为10μg/ml的pma。将样品避光孵育5min,并混合使pma穿透进入死细胞。然后使用500w卤素光源将样品曝光5min。将样品管放置在远离光源20cm处并水平放置在冰上以避免过度加热。每30s摇动样品管以保持对光源的均匀暴露。采用newindμstry公司的细菌基因组dna提取试剂盒分离阪崎肠杆菌的基因组dna,提取的基因组dna在制备后立即进行lamp反应。在pma处理的热灭活阪崎肠杆菌样品中,没有提取出基因组dna,并且样品不能使用lamp进行扩增。而未采用pma处理的死活菌基因组dna都可以进行扩增。可见,通过pma处理消除了死菌的扩增条带,仅留下活菌的扩增条带。由此证明pma处理可以有效地消除死细菌的dna信号。
4、引物设计
根据文献公布的阪崎肠杆菌基因ompa的保守区,通过日本荣岩株式会社环介导引物在线设计软件lampprimerdesigningsoftwareprimerexplorerv4.0(https://primerexplorer.jp/lamp4.0.0/index.html)针对基因设计引物,包括2条外引物f3、b3和2条内引物fip、bip(表2)。在fip的5’端标记生物素,bip的5’端标记荧光素(fitc)。引物由上海英维捷基生物有限公司合成,用于后续的筛选优化。
表2lamp所用的引物序列
5、阪崎肠杆菌基因组的扩增
使用环介导等温扩增法对阪崎肠杆菌基因组进行扩增(表3)。
表3lamp反应体系
lamp反应程序为:在65℃反应30min,在85℃反应3min使酶失活。本实验采用每管25μl的体系,其中作为阴性对照组不加阪崎肠杆菌基因组。取扩增产物5μl,与1μl上样缓冲液混合均匀,用2%琼脂糖凝胶进行电泳,阪崎肠杆菌出现典型dna扩增条带(图1),非阪崎肠杆菌菌株不产生任何条带,由此证明设计的引物对阪崎肠杆菌具有100%的特异性。
6、磁颗粒和纳米酶探针的制备
根据水热法合成磁颗粒。具体地,将0.6gfecl3·6h2o溶解在20ml乙二醇中,然后加入1.5g醋酸钠,剧烈搅拌30min,然后密封在高压釜中,200℃加热16h;磁颗粒产物用乙醇洗涤几次,并在60℃下干燥;将二氯乙烷和n-羟基琥珀酰亚胺各5mg通过涡旋溶解在1ml去离子水中,制得混合液,然后将5mg磁颗粒加入混合液中,室温下孵育30min,然后用磁铁收集磁颗粒,用超纯水洗涤两次,即得fe3o4磁颗粒。
将浓度100μg/ml的生物素二抗(羊抗鼠igg)加入50mmph6.0的醋酸钠缓冲液中,然后与5mg的fe3o4磁颗粒混合,将混合物涡旋混合,4℃孵育过夜;用ph7.0的pbs液洗涤两次混合物,然后在50mmph7.2的tris缓冲液中室温孵育30min;再用ph7.0的pbs液洗涤,得到生物素二抗纳米酶探针。最后将纳米酶探针分散到1ml的5%bsa-pbs溶液中。使用jeol2000fx200kv透射电子显微镜(tem)观察纳米酶探针的粒径,mnp的尺寸分布显示平均直径为200nm,可用于纳米酶传感器的构建。
7、纳米酶传感器的制备
纳米酶核酸层析试纸条(纳米酶试纸)的组装:所述试纸条包括样品垫、结合垫、硝酸纤维素膜和吸收垫,其中,所述硝酸纤维素膜上设有至少1条检测线和1条质控线。
①样品垫和结合垫的制备:先在底板上粘贴双面胶,然后粘贴结合垫,然后在结合垫之上粘贴样品垫,样品垫与结合垫重叠2-4mm。其中结合垫上固定有生物素二抗纳米酶探针。
②分别将fitc抗体和生物素抗体用最佳缓冲液稀释至最佳浓度1mg/ml。将稀释好的fitc抗体溶液装入biodot划膜机喷头2,固定在距nc膜下边缘1.1cm的位置上,稀释好的生物素二抗溶液装入biodot划膜机喷头1,固定在距nc膜下边缘1.6cm的位置上。检测线(t线)与质控线(c线)之间的距离为4.5mm,按1.0μl/cm分别喷涂在nc膜的t线和c线上。将已喷好的nc膜37℃烘干过夜后备用。用切条机切成3.8mm宽的试纸,将切好的试纸放入装有干燥剂的包装袋内。
③将上述样品垫、结合垫、带有t线和c线的nc膜以及吸收垫依次粘贴在底板上,完成试纸条的组装。
8、阪崎肠杆菌的检测
在完成pma和lamp操作步骤之后,用纳米酶试纸进行检测。检测包含两个反应步骤:(1)杂交反应;(2)信号增强。
取10μllamp-pcr扩增产物,与50μl反应缓冲液(4×ssc,0.2m/m%吐温-20)混合后滴加到上述纳米酶核酸层析试纸条的样品垫上,反应15min后,在测试线和质控线上滴加2滴底物缓冲液(含有20×dab和20×h2o2的商品化试剂),反应5min然后通过肉眼观察显色情况,判读结果:阴性反应:质控线显色,检测线不显色;阳性反应:质控线、检测线均显色;失效反应:若质控线不显色,则检测失败或试纸条失效。
对于定量测量,使用与条带读取器软件组合的便携式条带读取器记录条带的光学强度,根据光学强度计算出待测样品中阪崎肠杆菌的含量。
为了验证本发明所建立的生物传感器在实际样品检测过程中的准确性,本发明对一定浓度的阪崎肠杆菌进行加标回收验证。从当地超市购买婴幼儿奶粉通过标准培养和菌落计数法检测阪崎肠杆菌阴性。然后将阪崎肠杆菌以10,103和105cfu/ml的浓度掺入奶粉中混匀。依次进行pma处理、基因组提取、lamp扩增、核酸试纸条显色,峰面积读取、定量分析,结果显示阪崎肠杆菌的回收率在105±2.5%至108.7±6.4%的范围内,表明本发明建立的传感器检测方法可以用于实际样品的检测(表4)。
表4纳米酶传感器检测奶粉阪崎肠杆菌含量
实施例2纳米酶核酸试纸条的优化
根据水热法合成fe3o4磁颗粒,然后将磁颗粒与生物素二抗(羊抗鼠igg)进行孵育,制备纳米酶探针。分别利用fitc抗体和生物素抗体在nc膜上的t线和c线位置划线,烘干后组装成纳米酶核酸试纸条。为了提高纳米酶传感器的灵敏度,通过比较包括膜材料的性能,检测区fitc抗体的浓度,纳米酶探针的量,反应时间来系统地分析。结果证明使用millipore135s硝酸纤维素膜的纳米酶传感器的性能更好(图2a)。使用1mg/mlfitc抗体和1mg/ml羊抗鼠igg,获得的信号峰面积最高(图2b)。此外,纳米酶探针的量影响纳米酶探针和样品之间的杂交效率,并且使用10μl的纳米酶探针是最佳体积(图2c)。试纸条显色反应时间不小于15min(图2d)。
实施例3纳米酶传感器的性能检测
该纳米酶传感器的原理如下:首先,用pma处理样品(步骤1)。pma可以选择性地穿透死细胞损伤的细胞膜,与细胞内的dna结合,并使其不能用于随后的lamp扩增,但是如果是活细胞完整的细胞膜时,pma就不能进入细胞。然后,使用lamp在短时间内产生许多bio-和fitc-连接的双链体dna(步骤2)。在靶物质ompa特异性序列存在下,被四种引物识别并扩增。第三是纳米酶核酸试纸的可视化判读(步骤3)。通过物理吸附将fitc抗体和羊抗鼠igg固定在硝酸纤维素膜上,以分别形成检测区(tl)和质控区(cl)。如果样品是阳性的,经过lamp扩增,靶物质的5’末端用生物素标记,3’端用fitc标记,样品溶液再与纳米酶探针结合。然后,结合物与检测区的fitc抗体杂交。所形成的结合物继续沿条带迁移并通过纳米酶探针和羊抗鼠igg反应,在质控区显色。在将dab/h2o2酶底物应用于检测区和质控区时,纳米酶和dab/h2o2酶底物之间的酶促反应将产生颜色反应以增强视觉效果。在不存在活阪崎肠杆菌的情况下,只有质控区显色。
通过以下几个方面评估纳米酶传感器的性能。第一,重现性在评价生物传感器中具有重要的意义。通过使用100cfu/ml的活阪崎肠杆菌(图3a)测试生物传感器的再现性,共测试五次。光学响应的相应rsd值为1.5%,表明该纳米酶传感器具有优异的再现性。由于样品在实际中总是不同细菌种类的混合物,我们试图使检测方法具有更高的特异性。为了评价纳米酶传感器的特异性,使用双蒸水,阪崎肠杆菌死菌的dna,阪崎肠杆菌活菌的dna和其他肠杆菌属细菌菌株dna和其它非肠杆菌属细菌菌株dna。结果如图3b所示,未观察到假阳性。非阪崎肠杆菌和阪崎肠杆菌死菌的响应保持与背景信号一样低,表明非特异性吸附在该实验条件下对反应系统没有显著影响阪崎肠杆菌活菌检测。前期通过利用lamp扩增也进一步提升了纳米酶传感器的高特异性。对于稳定性(寿命)研究,是在室温下储存1-5周后测试纳米酶传感器的性能。结果如图3c所示,纳米酶传感器对100cfu/ml阪崎肠杆菌的反应保持几乎相同,表明该纳米酶传感器稳定性良好。
实施例4纳米酶传感器灵敏度验证
为了评定纳米酶传感器的灵敏度,在最佳实验条件下测量含有不同浓度的阪崎肠杆菌活菌(范围从0至105cfu/ml)的样品溶液,然后测量tl线的吸收峰面积,三个平行实验。在最小至最大范围内,对阪崎肠杆菌浓度的响应的所得图是线性的,并且相关方程为峰面积=18854lg阪崎肠杆菌浓度+3115.6,相关系数r2为0.9818,适合定量检测。其中,阪崎肠杆菌浓度单位为cfu/ml。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
序列表
<110>中国农业大学
<120>基于核酸层析生物传感技术检测阪崎肠杆菌的方法
<130>khp171113515.5
<160>4
<170>patentinversion3.3
<210>1
<211>19
<212>dna
<213>人工序列
<400>1
tggtcccagttccacgata19
<210>2
<211>19
<212>dna
<213>人工序列
<400>2
acgccctgagctttgaaag19
<210>3
<211>42
<212>dna
<213>人工序列
<400>3
taacctggtaaccaccgaacgctattcctaacgacggtccga42
<210>4
<211>42
<212>dna
<213>人工序列
<400>4
gtacgttggcttcgaaatgggccagtgtcgcctttatacggc42
- 还没有人留言评论。精彩留言会获得点赞!