肾功能评价装置、用于预测肾病并发症发病的装置以及磷摄入量估算装置的制作方法
本发明涉及用于评价肾功能的装置、用于评价肾功能的方法、以及使计算机执行肾功能评价功能的程序。本发明还涉及用于预测肾病并发症发病的装置、用于预测肾病并发症发病的方法、以及使计算机执行用于预测肾病并发症发病的功能的程序。本发明还涉及用于估算磷摄入量的装置、用于估算磷摄入量的方法、以及使计算机执行磷摄入量预测功能的程序。
背景技术:
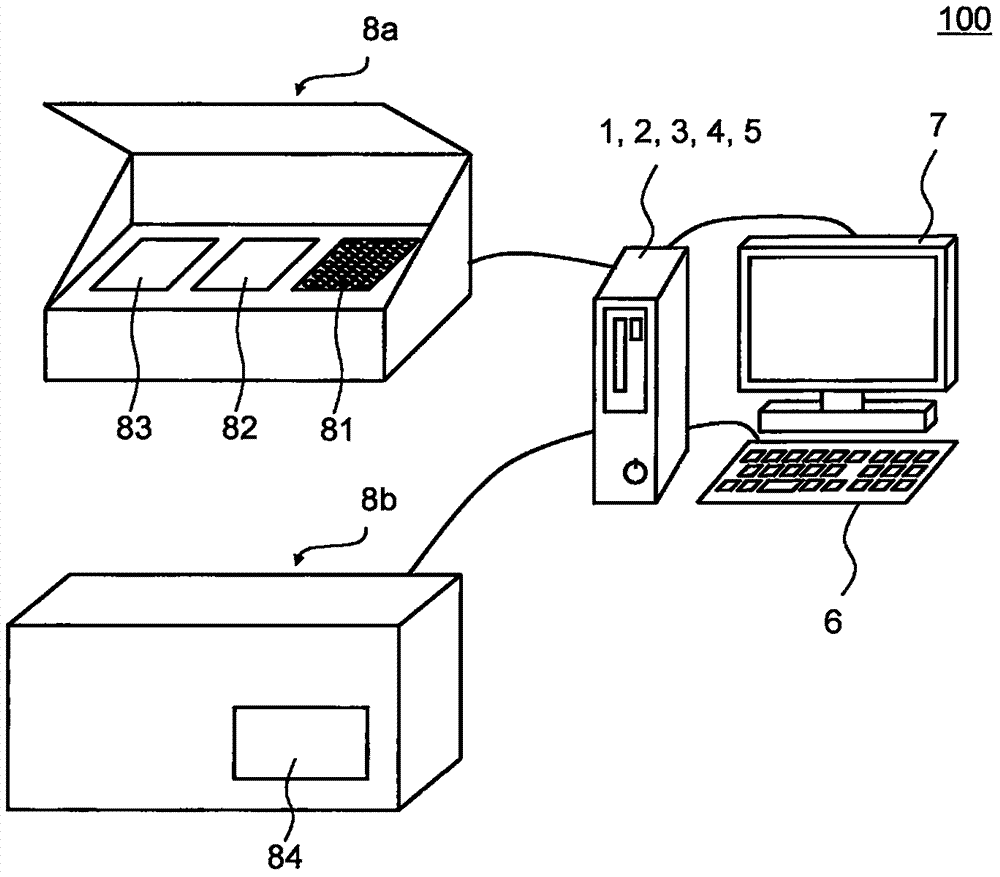
疾病包括处于能够被可逆治疗的状态的疾病以及处于不能被可逆治疗的状态的疾病,即处于不可逆状态的疾病。在可逆状态期间异常的早期检测和治疗或预防这种状态出现对于健康维护是必不可少的。即使在可逆状态下,疾病的早期检测直接导致较温和的治疗、较短的治疗期和较好的预后健康。在心脏病、脑疾病、癌症和糖尿病中,众所周知的是一个器官或组织中的异常导致其他器官的疾病状态(通常称为“并发症”)。在这些疾病中,必须尽可能早地预防一个器官或组织中的异常引起其他器官或组织的疾病。在包括人类在内的所有动物中,各个器官和组织形成功能网络而不是作为单独的部分,并且实现个体水平的质量控制。通过遍布全身的血管网络输送内分泌因子(例如激素)以及通过神经网络协助调节器官功能是“器官间串扰系统(inter-organcross-talksystem)”的典型示例,并且系统化为生理学或内分泌学。同时,全世界需要透析或肾移植的终末期肾病(eskd)患者的数量一直在增加。在1990年至2000年的十年间,eskd患者的数量从430,000增加到1,065,000,并且在2008年进一步增加到至少约1,650,000(非专利文献1)。慢性肾病(ckd)发展为eskd。然而,在被称为“沉默器官”的肾脏中,即使发展肾脏损伤,其状况也不太可能出现在临床数据等中。因此,在慢性肾病发病之前肾功能降低的早期检测是困难的。引用的文献列表非专利文献npl1:lysaghtmj:jamsocnephrol.2002年1月;13suppl1;s37-40。技术实现要素:技术问题本发明的一个目的是提供一种用于评价肾功能的方法,以比常规的测试方法更早地检测肾功能的降低;以及用于预测肾病并发症的发病的方法。本发明的另一个目的是提供一种用于预测磷摄入量的方法,以及一种用于确定饮食疗法对预防肾功能降低或抑制肾功能降低发展的效果的方法。本发明的另一个目的是提供用于实现上述方法的装置和程序。问题的解决方案本发明人进行了广泛的研究并且发现某些肾功能预测标记物的表达在肾病动物模型中增加。发明人还发现,肾功能预测标记物的表达比血清肌酐浓度更早地开始增加,已知血清肌酐浓度在肾病中增加。本发明人进一步发现肾功能预测标记物反映磷摄入量,磷摄入量在观察血清无机磷浓度时未得到充分评价。基于这些发现完成了本发明,并且包括以下实施方式。i.肾功能的评价i-1.一种用于评价受试者的肾功能的装置,包括以下计算单元:用于获取与选自由包含在从所述受试者采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的测量值和/或选自由包含在从所述受试者采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的测量值的单元;和用于基于由所述获取单元获取的所述测量值而评价所述肾功能的单元。i-2.根据i-1所述的装置,其中,所述肾功能预测标记物是选自由富含脯氨酸的蛋白质(prp)、防御素和hamp2组成的组中的至少一种。i-3.根据项i-1或i-2所述的装置,其中,在所述肾功能预测标记物的表达随着肾功能的降低而增加的情况下,所述评价单元将所述测量值与预定的阈值进行比较,并且当所述测量值高于所述阈值时确定所述受试者的肾功能已经降低,或在所述肾功能预测标记物的表达随着肾功能的降低而降低的情况下,所述评价单元将所述测量值与预定的阈值进行比较,并且当所述测量值低于所述阈值时确定所述受试者的肾功能已经降低。i-4.根据项i-1至i-3中任一项所述的装置,其中,当从受试者采集的试样是血样或体液时,获取装置获取蛋白质和mrna的测量值,当从受试者采集的试样是组织时,获取单元获取mrna的测量值。i-5.根据项i-1至i-4中任一项所述的装置,用于获取所述受试者中的至少一种肾病标记物的测量值的单元;和用于将由肾病标记物值获取单元获取的所述肾病标记物的所述测量值与对应的肾病标记物的阈值进行比较,并且识别所述肾病标记物的所述测量值在所述肾病标记物的所述阈值的范围内的受试者的单元。i-6.根据项i-1至i-5中任一项所述的装置,其中,当所述肾功能预测标记物是选自由prp组成的组中的至少一种时,与选自由所述肾功能预测标记物组成的组中的至少一种蛋白质有关的所述测量值是脯氨酸的测量值。i-7.根据项i-1至i-6中任一项所述的装置,其中,当所述肾功能预测标记物是选自由prp组成的组中的至少一种时,所述试样是选自由唾液和唾液腺组成的组中的至少一种。i-8.根据项i-1至i-5中任一项所述的装置,其中,当肾功能预测标记物是选自由防御素和hamp2组成的组中的至少一种时,所述试样是选自由脂肪组织、发根、皮肤、皮肤分泌物和汗液组成的组中的至少一种。i-9.一种程序,当由计算机执行时,使所述计算机进行以下处理以评价受试者的肾功能:获取处理,获取与选自由包含在从所述受试者采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的测量值和/或选自由包含在从所述受试者采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的测量值;和评价处理,基于由所述获取处理获取的测量值评价所述肾功能。i-10.根据i-9所述的程序,其中,所述肾功能预测标记物是选自由prp、防御素和hamp2组成的组中的至少一种。i-11.根据项i-9或i-10所述的程序,其中,在所述评价处理中,在所述肾功能预测标记物的表达随着肾功能的降低而增加的情况下,将所述测量值与预定的阈值进行比较,并且当所述测量值高于所述阈值时确定所述受试者的肾功能已经降低,或在所述肾功能预测标记物的表达随着肾功能的降低而降低的情况下,将所述测量值与预定的阈值进行比较,并且当所述测量值低于所述阈值时确定所述受试者的肾功能已经降低。i-12.根据项i-9至i-11中任一项所述的程序,其中,当从受试者采集的试样是血样或体液时,在获取处理中获取蛋白质和mrna的测量值,当从受试者采集的试样是组织时,在获取处理中获取mrna的测量值。i-13.根据项i-9至i-12中任一项所述的程序,其中,所述程序还使所述计算机进行获取所述受试者中的至少一种肾病标记物的测量值的处理;和将在所述肾病标记物值获取处理中所获取的所述肾病标记物的所述测量值与对应的肾病标记物的阈值进行比较并且识别所述肾病标记物的所述测量值在所述肾病标记物的所述阈值的范围内的受试者的处理。i-14.根据项i-9至i-13中任一项所述的程序,其中,当所述肾功能预测标记物是选自由prp组成的组中的至少一种时,与选自由所述肾功能预测标记物组成的组中的至少一种蛋白质有关的所述测量值是脯氨酸的测量值。i-15.根据项i-9至i-14中任一项所述的程序,其中,当所述肾功能预测标记物是选自由prp组成的组中的至少一种时,所述试样是选自由唾液和唾液腺组成的组中的至少一种。i-16.根据项i-9至i-13中任一项所述的程序,其中,当肾功能预测标记物是选自由防御素和hamp2组成的组中的至少一种时,所述试样是选自由脂肪组织、发根、皮肤、皮肤分泌物和汗液组成的组中的至少一种。i-17.一种用于辅助评价受试者的肾功能的方法,包括以下步骤:获取与选自由包含在从所述受试者采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的测量值和/或选自由包含在从所述受试者采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的测量值;和基于由所述获取步骤获取的测量值而评价所述肾功能。i-18.根据项i-17所述的方法,其中,所述肾功能预测标记物是选自由prp、防御素和hamp2组成的组中的至少一种。i-19.根据项i-17或i-18所述的方法,其中,在所述评价步骤中,在所述肾功能预测标记物的表达随着肾功能的降低而增加的情况下,将所述测量值与预定的阈值进行比较,并且当所述测量值高于所述阈值时确定所述受试者的肾功能已经降低,或在所述肾功能预测标记物的表达随着肾功能的降低而降低的情况下,将所述测量值与预定的阈值进行比较,并且当所述测量值低于所述阈值时确定所述受试者的肾功能已经降低。i-20.根据项i-17至i-19中任一项所述的方法,其中,当从受试者采集的试样是血样或体液时,在获取步骤中获取蛋白质和mrna的测量值,当从受试者采集的试样是组织时,在获取步骤中获取mrna的测量值。i-21.根据项i-16至i-20中任一项所述的方法,还包括在所述获取步骤之前的以下步骤:获取所述受试者中的至少一种肾病标记物的测量值;和将在所述肾病标记物值获取步骤中所获取的所述肾病标记物的所述测量值与对应的肾病标记物的阈值进行比较并且识别所述肾病标记物的所述测量值在所述肾病标记物的所述阈值的范围内的受试者。i-22.根据项i-17至i-21中任一项所述的方法,其中,当所述肾功能预测标记物是选自由prp组成的组中的至少一种时,与选自由所述肾功能预测标记物组成的组中的至少一种蛋白质有关的所述测量值是脯氨酸的测量值。i-23.根据项i-17至i-22中任一项所述的方法,其中,当所述肾功能预测标记物是选自由prp组成的组中的至少一种时,所述试样是选自由唾液和唾液腺组成的组中的至少一种。i-24.根据项i-17至i-21中任一项所述的方法,其中当肾功能预测标记物是选自由防御素和hamp2组成的组中的至少一种时,所述试样是选自由脂肪组织、发根、皮肤、皮肤分泌物和汗液组成的组中的至少一种。i-25.一种在根据项i-17至i-21、i-23和i-24中任一项所述的方法中使用的测试试剂,包含:选自由肾功能预测标记物抗体组成的组中的至少一种抗体,或选自由用于肾功能预测标记物mrna检测的核酸组成的组中的至少一种核酸。ii.磷摄入量的估算ii-1.一种用于估算受试者的磷摄入量的装置,包括以下计算单元:用于获取与选自由包含在从所述受试者采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的测量值和/或选自由包含在从所述受试者采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的测量值的单元;和用于基于由所述获取单元所获取的测量值而估算所述受试者的磷摄入量的单元。ii-2.根据项ii-1的装置,其中,所述肾功能预测标记物是选自由prp、防御素和hamp2组成的组中的至少一种。ii-3.根据项ii-1或ii-2的装置,其中,在所述肾功能预测标记物的表达随着磷摄入量的增加而增加的情况下,所述估算单元将所述测量值与预定的阈值进行比较,并且当所述测量值高于所述阈值时确定所述受试者的磷摄入量为高,或在所述肾功能预测标记物的表达随着磷摄入量的增加而降低的情况下,所述估算单元将所述测量值与预定的阈值进行比较,并且当所述测量值低于所述阈值时确定所述受试者的磷摄入量为高。ii-4.根据项ii-1至ii-3中任一项所述的装置,还包括:当所述受试者的所述磷摄入量被确定为高时用于确定所述受试者处于未来肾功能降低风险的预测单元。ii-5.根据项ii-1至ii-4中任一项所述的装置,其中,当从受试者采集的试样是血样或体液时,获取装置获取蛋白质和mrna的测量值,当从受试者采集的试样是组织时,获取装置获取mrna的测量值。ii-6.根据项ii-1至ii-5中任一项所述的装置,在所述获取装置获取所述测量值之前,还包括用于以下目的单元:用于获取所述受试者中至少一种肾病标记物的测量值;和将由所述肾病标记物值获取单元所获取的所述肾病标记物的所述测量值与对应的肾病标记物的阈值进行比较,并且识别所述肾病标记物的所述测量值在所述肾病标记物的所述阈值的范围内的受试者。ii-7.根据项ii-1至ii-6中任一项所述的装置,其中,当所述肾功能预测标记物是选自由prp组成的组中的至少一种时,与选自由所述肾功能预测标记物组成的组中的至少一种蛋白质有关的所述测量值是脯氨酸的测量值。ii-8.根据项ii-1至ii-7中任一项所述的装置,其中,当所述肾功能预测标记物是选自由prp组成的组中的至少一种时,所述试样是选自由唾液和唾液腺组成的组中的至少一种。ii-9.根据项ii-1至ii-6中任一项所述的装置,其中,当肾功能预测标记物是选自由防御素和hamp2组成的组中的至少一种时,所述试样是选自由脂肪组织、发根、皮肤、皮肤分泌物和汗液组成的组中的至少一种。ii-10.一种程序,当由计算机执行时,使所述计算机进行以下处理以估算受试者的磷摄入量:获取处理,用于获取与选自由包含在从所述受试者采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的测量值和/或选自由包含在从所述受试者采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的测量值;和估算处理,用于基于由所述获取处理所获取的测量值而估算所述受试者的所述磷摄入量。ii-11.根据项ii-10所述的程序,其中,所述肾功能预测标记物是选自由prp、防御素和hamp2组成的组中的至少一种。ii-12.根据项ii-10或ii-11所述的程序,其中,在所述估算处理中,在所述肾功能预测标记物的表达随着磷摄入量的增加而增加的情况下,将所述测量值与预定的阈值进行比较,并且当所述测量值高于所述阈值时确定所述受试者的磷摄入量为高,或在所述肾功能预测标记物的表达随着磷摄入量的增加而降低的情况下,将所述测量值与预定的阈值进行比较,并且当所述测量值低于所述阈值时确定所述受试者的磷摄入量为高。ii-13.根据ii-10至ii-12中任一项所述的程序,其中,当所述受试者的所述磷摄入量被确定为高时,所述程序还使所述计算机进行确定所述受试者处于未来肾功能降低风险的处理。ii-14.根据项ii-10至ii-13中任一项所述的程序,其中,当从受试者采集的试样是血样或体液时,在获取处理中获取蛋白质和mrna的测量值,当从受试者采集的试样是组织时,在获取处理中获取mrna的测量值。ii-15.根据项ii-10至ii-14中任一项所述的程序,其中,在所述获取处理之前,所述程序还使所述计算机进行:获取所述受试者中至少一种肾病标记物的测量值的处理;和将在所述肾病标记物值获取处理中所获取的所述肾病标记物的所述测量值与对应的肾病标记物的阈值进行比较并且识别所述肾病标记物的所述测量值在所述肾病标记物的所述阈值的范围内的受试者的处理。ii-16.根据项ii-10至ii-15中任一项所述的程序,其中,当所述肾功能预测标记物是选自由prp组成的组中的至少一种时,与选自由所述肾功能预测标记物组成的组中的至少一种蛋白质有关的所述测量值是脯氨酸的测量值。ii-17.根据项ii-10至ii-16中任一项所述的程序,其中,当所述肾功能预测标记物是选自由prp组成的组中的至少一种时,所述试样是选自由唾液和唾液腺组成的组中的至少一种。ii-18.根据项ii-10至ii-15中任一项所述的程序,其中,当所述肾功能预测标记物是选自由防御素和hamp2组成的组中的至少一种时,所述试样是选自由脂肪组织、发根、皮肤、皮肤分泌物和汗液组成的组中的至少一种。ii-19.一种用于辅助估算受试者的磷摄入量的方法,包括以下步骤:获取与选自由包含在从所述受试者采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的测量值和/或选自由包含在从所述受试者采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的测量值;和基于由所述获取步骤所获取的测量值而估算所述受试者的磷摄入量。ii-20.根据项ii-19的方法,其中,所述肾功能预测标记物是选自由prp、防御素和hamp2组成的组中的至少一种。ii-21.根据项ii-19或ii-20所述的方法,其中,在所述估算步骤中,在所述肾功能预测标记物的表达随着磷摄入量的增加而增加的情况下,将所述测量值与预定的阈值进行比较,并且当所述测量值高于所述阈值时确定所述受试者的磷摄入量为高,或在所述肾功能预测标记物的表达随着磷摄入量的增加而降低的情况下,将所述测量值与预定的阈值进行比较,并且当所述测量值低于所述阈值时确定所述受试者的磷摄入量为高。ii-22.根据项ii-19至ii-21中任一项所述的方法,还包括:当所述受试者的所述磷摄入量被确定为高时,确定所述受试者处于未来肾功能降低风险的预测步骤。ii-23.根据项ii-19至ii-22中任一项所述的方法,其中,当从受试者采集的试样是血样或体液时,在获取步骤中获取蛋白质和mrna的测量值,当从受试者采集的试样是组织时,在获取步骤中获取mrna的测量值。ii-24.根据项ii-19至ii-23中任一项所述的方法,在所述获取步骤之前,还包括以下步骤:获取所述受试者中至少一种肾病标记物的测量值;和将在所述肾病标记物值获取步骤中所获取的所述肾病标记物的所述测量值与对应的肾病标记物的阈值进行比较,并且识别所述肾病标记物的所述测量值在所述肾病标记物的所述阈值的范围内的受试者。ii-25.根据项ii-19至ii-24中任一项所述的方法,其中,当所述肾功能预测标记物是选自由prp组成的组中的至少一种时,与选自由所述肾功能预测标记物组成的组中的至少一种蛋白质有关的所述测量值是脯氨酸的测量值。ii-26.根据项ii-19至ii-25中任一项所述的方法,其中,当所述肾功能预测标记物是选自由prp组成的组中的至少一种时,所述试样是选自由唾液和唾液腺组成的组中的至少一种。ii-27.根据项ii-19至ii-24中任一项所述的方法,其中,当所述肾功能预测标记物是选自由防御素和hamp2组成的组中的至少一种时,所述试样是选自由脂肪组织、发根、皮肤、皮肤分泌物和汗液组成的组中的至少一种。ii-28.一种用于根据项ii-19至ii-24,ii-26和ii-27中任一项所述的方法的测试试剂,包含肾功能预测标记物抗体或用于肾功能预测标记物mrna检测的核酸。iii.发展出并发症的可能性的预测(1)iii-1.一种用于预测未来在受试者中发展出与肾病相关的并发症的可能性的装置,包括以下计算单元:用于获取与选自由包含在从所述受试者采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的测量值和/或选自由包含在从所述受试者采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的测量值的单元;和用于基于由所述获取单元所获取的测量值而预测未来发展出与肾病相关的并发症的可能性的单元。iii-2.根据项iii-1所述的装置,其中,所述肾功能预测标记物是选自由prp、防御素和hamp2组成的组中的至少一种。iii-3.根据项iii-1或iii-2的装置,其中,在在所述肾功能预测标记物的表达随着肾功能的降低而增加的情况下,所述预测单元将所述测量值与预定的阈值进行比较,并且当所述测量值高于所述阈值时确定所述受试者在未来有发展出与肾病相关的并发症的可能性,或在所述肾功能预测标记物的表达随着肾功能的降低而降低的情况下,所述预测单元将所述测量值与预定的阈值进行比较,并且当所述测量值低于所述阈值时确定所述受试者在未来有发展出与肾病相关的并发症的可能性。iii-4.根据项iii-1至iii-3中任一项所述的装置,其中,所述并发症是选自由尿浓缩能力障碍、氮质血症、水/电解质异常、代谢性酸中毒、肾性贫血和继发性甲状旁腺功能亢进组成的组中的至少一种。iii-5.根据项iii-1至iii-4中任一项所述的装置,其中,当从受试者采集的试样是血样或体液时,获取装置获取蛋白质和mrna的测量值,当从受试者采集的试样是组织时,获取装置获取mrna的测量值。iii-6.根据项iii-1至iii-5中任一项所述的装置,在所述获取装置获取所述测量值之前,还包括用于以下目的单元:获取所述受试者中的至少一种肾病标记物的测量值;和将由所述肾病标记物值获取单元所获取的所述肾病标记物的所述测量值与对应的肾病标记物的阈值进行比较,并且识别所述肾病标记物的所述测量值在所述肾病标记物的所述阈值的范围内的受试者。iii-7.根据项iii-1至iii-6中任一项所述的装置,其中,所述受试者是被诊断为慢性肾病gfr类别g1或慢性肾病gfr类别g2的受试者。iii-8.根据项iii-1至iii-7中任一项所述的装置,其中,当所述肾功能预测标记物是选自由prp组成的组中的至少一种时,与选自由所述肾功能预测标记物组成的组中的至少一种蛋白质有关的所述测量值是脯氨酸的测量值。iii-9.根据项iii-1至iii-8中任一项所述的装置,其中,当所述肾功能预测标记物是选自由prp组成的组中的至少一种时,所述试样是选自由唾液和唾液腺组成的组中的至少一种。iii-10.根据项iii-1至iii-7中任一项所述的装置,其中,当所述肾功能预测标记物是选自由防御素和hamp2组成的组中的至少一种时,所述试样是选自由脂肪组织、发根、皮肤、皮肤分泌物和汗液组成的组中的至少一种。iii-11.一种程序,当由计算机执行时,使所述计算机进行以下处理以预测未来在受试者中发展出与肾病相关的并发症的可能性:获取处理,用于获取与选自由包含在从所述受试者采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的测量值和/或选自由包含在从所述受试者采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的测量值;和预测处理,基于在所述获取处理中所获取的所述测量值而预测未来发展出与肾病相关的并发症的可能性。iii-12.根据项iii-11所述的程序,其中,所述肾功能预测标记物是选自由prp、防御素和hamp2组成的组中的至少一种。iii-13.根据项iii-11或iii-12的程序,其中,在所述预测处理中,在所述肾功能预测标记物的表达随着肾功能的降低而增加的情况下,将所述测量值与预定的阈值进行比较,并且当所述测量值高于所述阈值时确定所述受试者在未来有发展出与肾病相关的并发症的可能性,或在所述肾功能预测标记物的表达随着肾功能的降低而降低的情况下,将所述测量值与预定的阈值进行比较,并且当所述测量值低于所述阈值时确定所述受试者在未来有发展出与肾病相关的并发症的可能性。iii-14.根据项iii-11至iii-13中任一项所述的程序,其中,所述并发症是选自由尿浓缩能力障碍、氮质血症、水/电解质异常、代谢性酸中毒、肾性贫血和继发性甲状旁腺功能亢进组成的组中的至少一种。iii-15.根据项iii-11至iii-14中任一项所述的程序,其中,当从受试者采集的试样是血样或体液时,在获取处理中获取蛋白质和mrna的测量值,当从受试者采集的试样是组织时,在获取处理中获取mrna的测量值。iii-16.根据项iii-11至iii-15中任一项所述的程序,其中,在所述获取处理之前,所述程序还使所述计算机进行获取所述受试者中至少一种肾病标记物的测量值的处理;和将在所述肾病标记物值获取处理中所获取的所述肾病标记物的所述测量值与对应的肾病标记物的阈值进行比较并且识别所述肾病标记物的所述测量值在所述肾病标记物的所述阈值的范围内的受试者的处理。iii-17.根据项iii-11至iii-16中任一项所述的程序,其中,所述受试者是被诊断为慢性肾病gfr类别g1或慢性肾病gfr类别g2的受试者。iii-18.根据项iii-11至iii-17中任一项所述的程序,其中,当所述肾功能预测标记物是选自由prp组成的组中的至少一种时,与选自由所述肾功能预测标记物组成的组中的至少一种蛋白质有关的所述测量值是脯氨酸的测量值。iii-19.根据项iii-11至iii-18中任一项所述的程序,其中,当所述肾功能预测标记物是选自由prp组成的组中的至少一种时,所述试样是选自由唾液和唾液腺组成的组中的至少一种。iii-20.根据项iii-11至iii-17中任一项所述的程序,其中,当所述肾功能预测标记物是选自由防御素和hamp2组成的组中的至少一种时,所述试样是选自由脂肪组织、发根、皮肤、皮肤分泌物和汗液组成的组中的至少一种。iii-21.一种用于辅助预测在受试者中未来发展出与肾病相关的并发症的可能性的方法,包括以下步骤:获取与选自由包含在从所述受试者采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的测量值和/或选自由包含在从所述受试者采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的测量值;和基于由所述获取步骤所获取的测量值而预测未来发展出与肾病相关的并发症的可能性。iii-22.根据项iii-21所述的方法,其中,所述肾功能预测标记物是选自由prp、防御素和hamp2组成的组中的至少一种。iii-23.根据项iii-21或iii-22所述的方法,其中,在所述预测步骤中,在所述肾功能预测标记物的表达随着肾功能的降低而增加的情况下,将所述测量值与预定的阈值进行比较,并且当所述测量值高于所述阈值时确定所述受试者在未来有发展出与肾病相关的并发症的可能性,或在所述肾功能预测标记物的表达随着肾功能的降低而降低的情况下,将所述测量值与预定的阈值进行比较,并且当所述测量值低于所述阈值时确定所述受试者在未来有发展出与肾病相关的并发症的可能性。iii-24.根据项iii-21至iii-23中任一项所述的方法,其中,所述并发症是选自由尿浓缩能力障碍、氮质血症、水/电解质异常、代谢性酸中毒、肾性贫血和继发性甲状旁腺功能亢进组成的组中的至少一种。iii-25.根据项iii-21至iii-24中任一项所述的方法,其中,当从受试者采集的试样是血样或体液时,在获取步骤中获取蛋白质和mrna的测量值,当从受试者采集的试样是组织时,在获取步骤中获取mrna的测量值。iii-26.根据项iii-21至iii-25中任一项所述的方法,在所述获取步骤之前,还包括以下步骤:获取所述受试者中的至少一种肾病标记物的测量值;和将在所述肾病标记物值获取步骤中所获取的所述肾病标记物的所述测量值与对应的肾病标记物的阈值进行比较,并且识别所述肾病标记物的所述测量值在所述肾病标记物的所述阈值的范围内的受试者。iii-27.根据项iii-21至iii-26中任一项所述的方法,其中,所述受试者是被诊断为慢性肾病gfr类别g1或慢性肾病gfr类别g2的受试者。iii-28.根据项iii-21至iii-27中任一项所述的方法,其中,当所述肾功能预测标记物是选自由prp组成的组中的至少一种时,与选自由所述肾功能预测标记物组成的组中的至少一种蛋白质有关的所述测量值是脯氨酸的测量值。iii-29.根据项iii-21至iii-28中任一项所述的方法,其中,当所述肾功能预测标记物是选自由prp组成的组中的至少一种时,所述试样是选自由唾液和唾液腺组成的组中的至少一种。iii-30.根据项iii-21至iii-27中任一项所述的方法,其中,当所述肾功能预测标记物是选自由防御素和hamp2组成的组中的至少一种时,所述试样是选自由脂肪组织、发根、皮肤、皮肤分泌物和汗液组成的组中的至少一种。iii-31.一种在根据项iii-19至iii-27、iii-29和iii-30中任一项所述的方法中使用的测试试剂,包含肾功能预测标记物抗体或用于肾功能预测标记物mrna检测的核酸。iv.发展出并发症的可能性的预测(2)iv-1.一种用于预测未来在受试者中发展出与肾病相关的并发症的可能性的装置,包括以下计算单元:第一获取单元,用于获取与选自由包含在从所述受试者较早采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的第一测量值和/或选自由包含在从所述受试者较早采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的第一测量值;第二获取单元,用于获取与选自由包含在从所述受试者较晚采集的试样中的肾功能预测标记物组成的组中的所述至少一种蛋白质有关的第二测量值和/或选自由包含在从所述受试者较晚采集的试样中的肾功能预测标记物组成的组中的所述至少一种mrna的第二测量值;和预测单元,基于由所述第一获取单元所获取的所述第一测量值和由所述第二获取单元所获取的所述第二测量值而预测未来发展出与肾病相关的并发症的可能性。iv-2.根据项iv-1所述的装置,其中,所述肾功能预测标记物是选自由prp、防御素和hamp2组成的组中的至少一种。iv-3.根据项iv-1或iv-2所述的装置,其中,在所述肾功能预测标记物的表达随着肾功能的降低而增加的情况下,所述预测单元将所述第一测量值与所述第二测量值进行比较,并且当所述第二测量值高于所述第一测量值时确定所述受试者在未来有发展出与肾病相关的并发症的可能性,或在所述肾功能预测标记物的表达随着肾功能的降低而降低的情况下,所述预测单元将所述第一测量值与所述第二测量值进行比较,并且当所述第二测量值低于所述第一测量值时确定所述受试者在未来有发展出与肾病相关的并发症的可能性。iv-4.根据项iv-1至iv-3中任一项所述的装置,其中,所述并发症是选自由尿浓缩能力障碍、氮质血症、水/电解质异常、代谢性酸中毒、肾性贫血和继发性甲状旁腺功能亢进组成的组中的至少一种。iv-5.根据项iv-1至iv-4中任一项所述的装置,其中,当从受试者采集的试样是血样或体液时,第一获取装置获取蛋白质和mrna的第一测量值,并且第二获取装置获取蛋白质和mrna的第二测量值,当从受试者采集的试样是组织时,第一获取装置获取mrna的第一测量值,第二获取装置获取mrna的第二测量值。iv-6.根据项iv-1至iv-5中任一项所述的装置,在所述第一获取装置和所述第二获取装置分别获取所述第一测量值和所述第二测量值之前,还包括用于以下目的单元:获取所述受试者中的至少一种肾病标记物的测量值;和将由所述肾病标记物值获取单元所获取的所述肾病标记物的所述测量值与对应的肾病标记物的阈值进行比较,并且识别所述肾病标记物的所述测量值在所述肾病标记物的所述阈值的范围内的受试者的单元。iv-7.根据项iv-1至iv-6中任一项所述的装置,其中,所述受试者是被诊断为慢性肾病gfr类别g1或慢性肾病gfr类别g2的受试者。iv-8.根据项iv-1至iv-7中任一项所述的装置,其中,当所述肾功能预测标记物是选自由prp组成的组中的至少一种时,与选自由所述肾功能预测标记物组成的组中的至少一种蛋白质有关的所述测量值是脯氨酸的测量值。iv-9.根据项iv-1至iv-8中任一项所述的装置,其中,当所述肾功能预测标记物是选自由prp组成的组中的至少一种时,所述试样是选自由唾液和唾液腺组成的组中的至少一种。iv-10.根据项iv-1至iv-7中任一项所述的装置,其中,当所述肾功能预测标记物是选自由防御素和hamp2组成的组中的至少一种时,所述试样是选自由脂肪组织、发根、皮肤、皮肤分泌物和汗液组成的组中的至少一种。iv-11.一种程序,当由计算机执行时,使所述计算机进行以下处理以预测未来在受试者中发展出与肾病相关的并发症的可能性:第一获取处理,用于获取与选自由包含在从所述受试者较早采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的第一测量值和/或选自由包含在从所述受试者较早采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的第一测量值;第二获取处理,用于获取与选自由包含在从所述受试者较晚采集的试样中的肾功能预测标记物组成的组中的所述至少一种蛋白质有关的第二测量值和/或选自由包含在从所述受试者较晚采集的试样中的肾功能预测标记物组成的组中的所述至少一种mrna的第二测量值;和预测处理,基于在所述第一获取处理中获取的所述第一测量值和在所述第二获取处理中获取的所述第二测量值而预测未来发展出与肾病相关的并发症的可能性。iv-12.根据项iv-11所述的程序,其中,所述肾功能预测标记物是选自由prp、防御素和hamp2组成的组中的至少一种。iv-13.根据项iv-11或iv-12所述的程序,其中,在所述预测处理中,在所述肾功能预测标记物的表达随着肾功能的降低而增加的情况下,将所述第一测量值与所述第二测量值进行比较,并且当所述第二测量值高于所述第一测量值时确定所述受试者在未来有发展出与肾病相关的并发症的可能性,或在所述肾功能预测标记物的表达随着肾功能的降低而降低的情况下,将所述第一测量值与所述第二测量值进行比较,并且当所述第二测量值低于所述第一测量值时确定所述受试者在未来有发展出与肾病相关的并发症的可能性。iv-14.根据项iv-11至iv-13中任一项所述的程序,其中,所述并发症是选自由尿浓缩能力障碍、氮质血症、水/电解质异常、代谢性酸中毒、肾性贫血和继发性甲状旁腺功能亢进组成的组中的至少一种。iv-15.根据项iv-11至iv-14中任一项所述的程序,其中,当从受试者采集的试样是血样或体液时,在第一获取处理中获取蛋白质和mrna的第一测量值,在第二获取处理中获取蛋白质和mrna的第二测量值,当从受试者采集的试样是组织时,在第一获取处理中获取mrna的第一测量值,并且在第二获取处理中获取mrna的第二测量值。iv-16.根据项iv-11至iv-15中任一项所述的程序,其中,在所述第一获取处理和所述第二获取处理之前,所述程序还使所述计算机进行:获取所述受试者中的至少一种肾病标记物的测量值的处理;和将在所述肾病标记物值获取处理中获取的所述肾病标记物的所述测量值与对应的肾病标记物的阈值进行比较,并且识别所述肾病标记物的所述测量值在所述肾病标记物的所述阈值的范围内的受试者的处理。iv-17.根据项iv-11至iv-16中任一项所述的程序,其中,所述受试者是被诊断为慢性肾病gfr类别g1或慢性肾病gfr类别g2的受试者。iv-18.根据项iv-11至iv-17中任一项所述的程序,其中,当所述肾功能预测标记物是选自由prp组成的组中的至少一种时,与选自由所述肾功能预测标记物组成的组中的至少一种蛋白质有关的所述测量值是脯氨酸的测量值。iv-19.根据项iv-11至iv-18中任一项所述的程序,其中,当所述肾功能预测标记物是选自由prp组成的组中的至少一种时,所述试样是选自由唾液和唾液腺组成的组中的至少一种。iv-20.根据项iv-11至iv-17中任一项所述的程序,其中,当所述肾功能预测标记物是选自由防御素和hamp2组成的组中的至少一种时,所述试样是选自由脂肪组织、发根、皮肤、皮肤分泌物和汗液组成的组中的至少一种。iv-21.一种用于辅助预测未来在受试者中发展出与肾病相关的并发症的可能性的方法,包括以下步骤:第一获取步骤,获取与选自由包含在从所述受试者较早采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的第一测量值和/或选自由包含在从所述受试者较早采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的第一测量值;第二获取步骤,获取与选自由包含在从所述受试者较晚采集的试样中的肾功能预测标记物组成的组中的所述至少一种蛋白质有关的第二测量值和/或选自由包含在从所述受试者较晚采集的试样中的肾功能预测标记物组成的组中的所述至少一种mrna的第二测量值;和预测步骤,基于在所述第一获取步骤中获取的所述第一测量值和在所述第二获取步骤中获取的所述第二测量值而预测未来发展出与肾病相关的并发症的可能性。iv-22.根据项iv-21所述的方法,其中,所述肾功能预测标记物是选自由prp、防御素和hamp2组成的组中的至少一种。iv-23.根据项iv-21或iv-22所述的方法,其中,在所述预测步骤中,在所述肾功能预测标记物的表达随着肾功能的降低而增加的情况下,将所述第一测量值与所述第二测量值进行比较,并且当所述第二测量值高于所述第一测量值时确定所述受试者在未来有发展出与肾病相关的并发症的可能性,或在所述肾功能预测标记物的表达随着肾功能的降低而降低的情况下,将所述第一测量值与所述第二测量值进行比较并且当所述第二测量值低于所述第一测量值时确定所述受试者在未来有发展出与肾病相关的并发症的可能性。iv-24.根据项iv-21至iv-23中任一项所述的方法,其中所述并发症是选自由尿浓缩能力障碍、氮质血症、水/电解质异常、代谢性酸中毒、肾性贫血和继发性甲状旁腺功能亢进组成的组中的至少一种。iv-25.根据项iv-21至iv-24中任一项所述的方法,其中,当从受试者采集的试样是血样或体液时,在第一获取步骤中获取蛋白质和mrna的第一测量值,并且在第二步获取步骤中获取蛋白质和mrna的第二测量值,当从受试者采集的试样是组织时,在第一获取步骤中获取mrna的第一测量值,并且在第二获取步骤中获取mrna的第二测量值。iv-26.根据项iv-21至iv-25中任一项所述的方法,在所述第一获取步骤和所述第二获取步骤之前还包括以下步骤:获取所述受试者中的至少一种肾病标记物的测量值的步骤;和将在所述肾病标记物值获取步骤中获取的所述肾病标记物的所述测量值与对应的肾病标记物的阈值进行比较,并且识别所述肾病标记物的所述测量值在所述肾病标记物的所述阈值的范围内的受试者的步骤。iv-27.根据项iv-21至iv-26中任一项所述的方法,其中,所述受试者是被诊断为慢性肾病gfr类别g1或慢性肾病gfr类别g2的受试者。iv-28.根据项iv-21至iv-27中任一项所述的方法,其中,当所述肾功能预测标记物是选自由prp组成的组中的至少一种时,与选自由所述肾功能预测标记物组成的组中的至少一种蛋白质有关的所述测量值是脯氨酸的测量值。iv-29.根据项iv-21至iv-28中任一项所述的方法,其中,当所述肾功能预测标记物是选自由prp组成的组中的至少一种时,所述试样是选自由唾液和唾液腺组成的组中的至少一种。iv-30.根据项iv-21至iv-29中任一项所述的方法,其中,当所述肾功能预测标记物是选自由防御素和hamp2组成的组中的至少一种时,所述试样是选自由脂肪组织、发根、皮肤、皮肤分泌物和汗液组成的组中的至少一种。v.饮食疗法的效果的确定v-1.一种用于确定饮食疗法在受试者中的效果的装置,包括以下计算单元:第一获取单元,用于获取与选自由包含在从所述受试者较早采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的第一测量值和/或选自由包含在从所述受试者较早采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的第一测量值;第二获取单元,用于获取与选自由包含在从所述受试者较晚采集的试样中的肾功能预测标记物组成的组中的所述至少一种蛋白质有关的第二测量值和/或选自由包含在从所述受试者较晚采集的试样中的肾功能预测标记物组成的组中的所述至少一种mrna的第二测量值;和确定单元,基于由所述第一获取单元所获取的所述第一测量值和由所述第二获取单元所获取的所述第二测量值而确定饮食疗法的效果。v-2.根据项v-1所述的装置,其中,所述肾功能预测标记物是选自由prp、防御素和hamp2组成的组中的至少一种。v-3.根据项v-1或v-2所述的装置,其中,在所述肾功能预测标记物的表达随着磷摄入量降低而降低的情况下,所述确定单元将所述第一测量值与所述第二测量值进行比较,并且当所述第二测量值低于所述第一测量值时确定所述饮食疗法是有效的,或在所述肾功能预测标记物的表达随着磷摄入量降低而增加的情况下,所述确定单元将所述第一测量值与所述第二测量值进行比较,并且当所述第二测量值高于所述第一测量值时确定所述饮食疗法是有效的。v-4.根据项v-1至v-3中任一项所述的装置,其中,当从受试者采集的试样是血样或体液时,第一获取装置获取蛋白质和mrna的第一测量值,并且第二获取装置获取蛋白质和mrna的第二测量值,当从受试者采集的试样是组织时,第一获取装置获取mrna的第一测量值,并且第二获取装置获取mrna的第二测量值。v-5.根据项v-1至v-4中任一项所述的装置,在所述第一获取单元和第二获取单元分别获取所述第一测量值和所述第二测量值之前,还包括用于以下目的单元:获取所述受试者中的至少一种肾病标记物的测量值;和将由所述肾病标记物值获取单元所获取的所述肾病标记物的所述测量值与对应的肾病标记物的阈值进行比较,并且识别所述肾病标记物的所述测量值在所述肾病标记物的所述阈值的范围内的受试者。v-6.根据项v-1至v-5中任一项所述的装置,其中,所述受试者是被诊断为慢性肾病gfr类别g1或慢性肾病gfr类别g2的受试者。v-7.根据项v-1至v-6中任一项所述的装置,其中,当所述肾功能预测标记物是选自由prp组成的组中的至少一种时,与选自由所述肾功能预测标记物组成的组中的至少一种蛋白质有关的所述测量值是脯氨酸的测量值。v-8.根据项v-1至v-7中任一项所述的装置,其中,当所述肾功能预测标记物是选自由prp组成的组中的至少一种时,所述试样是选自由唾液和唾液腺组成的组中的至少一种。v-9.根据项v-1至v-6中任一项所述的装置,其中,当所述肾功能预测标记物是选自由防御素和hamp2组成的组中的至少一种时,所述试样是选自由脂肪组织、发根、皮肤、皮肤分泌物和汗液组成的组中的至少一种。v-10.一种程序,当由计算机执行时,使所述计算机进行以下处理以确定饮食疗法在受试者中的效果:第一获取处理,获取与选自由包含在从所述受试者较早采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的第一测量值和/或选自由包含在从所述受试者较早采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的第一测量值;第二获取处理,获取与选自由包含在从所述受试者较晚采集的试样中的肾功能预测标记物组成的组中的所述至少一种蛋白质有关的第二测量值和/或选自由包含在从所述受试者较晚采集的试样中的肾功能预测标记物组成的组中的所述至少一种mrna的第二测量值;和确定处理,基于在所述第一获取处理中获取的所述第一测量值和在所述第二获取处理中获取的所述第二测量值而确定饮食疗法的效果。v-11.根据项v-10所述的程序,其中,所述肾功能预测标记物是选自由prp、防御素和hamp2组成的组中的至少一种。v-12.根据项v-10或v-11所述的程序,其中,在所述确定处理中,在所述肾功能预测标记物的表达随着磷摄入量降低而降低的情况下,将所述第一测量值与所述第二测量值进行比较,并且当所述第二测量值低于所述第一测量值时确定所述饮食疗法是有效的,或在所述肾功能预测标记物的表达随着磷摄入量降低而增加的情况下,将所述第一测量值与所述第二测量值进行比较,并且当所述第二测量值高于所述第一测量值时确定所述饮食疗法是有效的。v-13.根据项v-10至v-12中任一项所述的程序,其中,当从受试者采集的试样是血样或体液时,在第一获取处理中获取蛋白质和mrna的第一测量值,并且在第二获取处理中获取蛋白质和mrna的第二测量值,当从受试者采集的试样是组织时,在第一获取处理中获取mrna的第一测量值,并且在第二获取处理中获取mrna的第二测量值。v-14.根据项v-10至v-13中任一项所述的程序,其中,在所述第一获取处理和所述第二获取处理之前,所述程序还使所述计算机进行:获取所述受试者中的至少一种肾病标记物的测量值的处理;和将在所述肾病标记物值获取处理中获取的所述肾病标记物的所述测量值与对应的肾病标记物的阈值进行比较并且识别所述肾病标记物的所述测量值在所述肾病标记物的所述阈值的范围内的受试者的处理。v-15.根据项v-10至v-14中任一项所述的程序,其中,所述受试者是被诊断为慢性肾病gfr类别g1或慢性肾病gfr类别g2的受试者。v-16.根据项v-10至v-15中任一项所述的程序,其中,当肾功能预测标记物是选自由prp组成的组中的至少一种成员时,与选自由所述肾功能预测标记物组成的组中的至少一种蛋白质有关的所述测量值是脯氨酸的测量值。v-17.根据项v-10至v-16中任一项所述的程序,其中,当所述肾功能预测标记物是选自由prp组成的组中的至少一种时,所述试样是选自由唾液和唾液腺组成的组中的至少一种。v-18.根据项v-10至v-15中任一项所述的程序,其中,当肾功能预测标记物是选自由防御素和hamp2组成的组中的至少一种时,所述试样是选自由脂肪组织、发根、皮肤、皮肤分泌物和汗液组成的组中的至少一种。v-19.一种用于辅助确定饮食疗法在受试者中的效果的方法,包括以下步骤:第一获取步骤,获取与选自由包含在从所述受试者较早采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的第一测量值和/或选自由包含在从所述受试者较早采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的第一测量值;第二获取步骤,获取与选自由包含在从所述受试者较晚采集的试样中的肾功能预测标记物组成的组中的所述至少一种蛋白质有关的第二测量值和/或选自由包含在从所述受试者较晚采集的试样中的肾功能预测标记物组成的组中的所述至少一种mrna的第二测量值;和确定步骤,基于在所述第一获取步骤中获取的所述第一测量值和在所述第二获取步骤中获取的第二测量值而确定饮食疗法的效果。v-20.根据项v-19所述的方法,其中,所述肾功能预测标记物是选自由prp、防御素和hamp2组成的组中的至少一种。v-21.根据项v-19或v-20所述的方法,其中,在所述确定步骤中,在所述肾功能预测标记物的表达随着磷摄入量降低而降低的情况下,将所述第一测量值与所述第二测量值进行比较,并且当所述第二测量值低于所述第一测量值时确定所述饮食疗法是有效的,或在所述肾功能预测标记物的表达随着磷摄入量降低而增加的情况下,将所述第一测量值与所述第二测量值进行比较,并且当所述第二测量值高于所述第一测量值时确定所述饮食疗法是有效的。v-22.根据项v-19至v-21中任一项所述的方法,其中,当从受试者采集的试样是血样或体液时,在第一获取步骤中获取蛋白质和mrna的第一测量值,并且在第二步获取步骤中获取蛋白质和mrna的第二测量值,当从受试者采集的试样是组织时,在第一获取步骤中获取mrna的第一测量值,并且在第二获取步骤中获取mrna的第二测量值。v-23.根据项v-19至v-22中任一项所述的方法,在所述第一获取步骤和所述第二获取步骤之前,还包括以下步骤:获取所述受试者中的至少一种肾病标记物的测量值;和将在所述肾病标记物值获取步骤中获取的所述肾病标记物的所述测量值与对应的肾病标记物的阈值进行比较,并且识别所述肾病标记物的所述测量值在所述肾病标记物的所述阈值的范围内的受试者。v-24.根据项v-19至v-23中任一项所述的方法,其中,所述受试者是被诊断为慢性肾病gfr类别g1或慢性肾病gfr类别g2的受试者。v-25.根据项v-19至v-24中任一项所述的方法,其中,当所述肾功能预测标记物是选自由prp组成的组中的至少一种时,与选自由所述肾功能预测标记物组成的组中的至少一种蛋白质有关的所述测量值是脯氨酸的测量值。v-26.根据项v-19至v-25中任一项所述的方法,其中,当所述肾功能预测标记物是选自由prp组成的组中的至少一种时,所述试样是选自由唾液和唾液腺组成的组中的至少一种。v-27.根据项v-19至v-24中任一项所述的方法,其中,当肾功能预测标记物是选自由防御素和hamp2组成的组中的至少一种时,所述试样是选自由脂肪组织、发根、皮肤、皮肤分泌物和汗液组成的组中的至少一种。v-28.一种在根据项v-19至v-24,v-26和v-27中任一项所述的方法中使用的测试试剂,包含肾功能预测标记物抗体或用于肾功能预测标记物mrna检测的核酸。发明的有益效果本发明实现了检测肾功能的降低。本发明还实现了预测肾病并发症的发病。本发明进一步实现了确定磷摄入量和饮食疗法的效果,以预防肾功能降低或抑制肾功能降低的进展。附图说明图1是根据本发明的一个实施方式的系统100的概图。图2是示出根据本发明的一个实施方式的系统100的硬件配置的框图。图3是示出根据本发明第一实施方式的计算装置1的功能的框图。图4是示出由根据本发明第一实施方式的计算装置1执行的数据处理流程以执行肾功能评价方法的流程图。图5是示出根据本发明第二实施方式的计算装置2的功能的框图。图6是示出根据本发明第二实施方式的计算装置2执行的数据处理流程以执行磷摄入量估算方法的流程图。图7是示出根据本发明第三实施方式的计算装置3的功能的框图。图8是示出由根据本发明第三实施方式的计算装置3执行的数据处理流程以进行用于预测发展出并发症的可能性的方法的流程图。图9是示出根据本发明第四实施方式的计算装置4的功能的框图。图10是示出根据本发明第四实施方式的计算装置4执行的数据处理流程以进行用于预测发展并发症的可能性的方法的流程图。图11是示出根据本发明第五实施方式的计算装置5的功能的框图。图12是示出根据本发明第五实施方式的计算装置5执行的数据处理流程以进行用于确定饮食疗法效果的方法的流程图。图13是示出测试试剂盒的示例的概图。图14是通过例如rna-seq可以被检测到的小鼠中的rna列表。在图14中,“行号”表示列表中的行编号,“基因名称”表示在美国国家生物技术信息中心(ncbi)登记的基因名称,以及“参考序列号id”表示ncbi登记的参考序列id号。“染色体位点”表示以mm10登记的染色体位点。图15:检查其表达水平的rna如下进行分类。其中ckd/sham大于1或小于1的rna被分类为组2,其中ckd/sham大于1.5或小于0.67的rna被分类为组3,其中ckd/sham大于2的rna或者小于0.5被分类为组4,并且其中ckd/sham大于5或小于0.2的rna被分类为组5。在图15中,“行号”表示列表中的行编号,“组”表示基于ckd/sham值分类的每个组的组编号,“基因名称”表示用ncbi登记的基因名称,“人基因id”表示在ncbi登记的对应于该基因名称的人基因编号,以及“更新”表示ncbi中更新到人基因id的日期。在“子组”中,“v-1”表示组5的rna中的rna,其中ckd/sham大于5,以及“v-2”表示组5的rna中的rna,其中ckd/sham小于0.2。“iv-1”表示组4的rna中的rna,其中ckd/sham大于2且未包括在组5中,并且“iv-2”表示组4的rna中的rna,其中ckd/sham小于0.5并且未包括在组5中。“iii-1”表示组3中的rna中的rna,其中ckd/sham大于1.5并且不包括在组4或组5中,并且“iii-2”表示组3中的rna中的rna,其中ckd/sham小于0.67且不包括在组4或组5中。“ii-1”表示组2中的rna中的rna,其中ckd/sham大于1且不包括在组3-5中的任一组中,并且“ii-2”表示组2的rna中的rna,其中ckd/sham小于1且不包括在组3至5中的任一组中。没有组号的rna是ckd/sham为1的组。图16示出sham>1和ckd/sham>5的基因、sham<1和ckd/sham>10的基因、以及sham>10和ckd/sham<0.3的基因在早期和中期的表达水平。图17示出在摄入特别高的磷(高pi)的饮食的组中的唾液腺中的prp的表达水平,以及在摄入特别低的磷(低pi)的饮食的组的唾液腺中的prp的表达水平。a:prb1,b:prh1,c:prp2和d:prpmp5。图18示出a组和b组在测试的最后一天(第7天)唾液中hprb1浓度除以试验开始前一天(第-1天)中唾液中hprb1浓度的比率(第7天的hprb1/第-1天的hprb1的比率)。“磷摄入比率”是高磷饮食(或正常饮食)摄取试验开始后第7天的总磷摄入量除以高磷饮食(或正常饮食)摄取试验开始前7天的总磷摄入量的比率。图19示出被诊断为慢性肾病或被诊断为具有多发性骨髓瘤且有肾病风险的受试者(患者)和健康的受试者(对照受试者)的唾液中hprb1的浓度。图20示出摄入高磷饮食的组(a组:高pi)和摄入正常饮食的组(b组:低pi)中唾液中脯氨酸的浓度。具体实施方式1.术语解释首先解释本说明书、权利要求和摘要中所使用的术语。除非另有说明,否则本说明书、权利要求和摘要中所使用的术语均符合本部分中的定义。本文所用的“肾病”是指肾脏的任何疾病,并且不受特别限制,只要肾在功能上或生理上有一些损伤即可。具体示例包括:肾盂肾炎、肾小球肾炎等急性肾炎,糖尿病性肾病、肾小球纤维化等慢性肾炎,肾病综合征、肾肿瘤、急性肾衰竭、慢性肾衰竭等。肾病优选是导致肾功能降低的疾病。如本文所用的“肾功能降低”是指在人的情况下一种状况,其中,例如在下表1-1至1-4中所示的通常在临床检查中测量的至少一种肾病标记物(优选除尿蛋白之外)落在阈值范围之外。更优选地,肾病标记物是选自由血清尿素氮、血清肌酐、血清无机磷、尿中纤维蛋白原、肌酐清除率、24小时肌酐清除率所估算的肾小球滤过率(egfr)、尿素清除率、菊粉清除率、硫代硫酸钠清除率、肾血浆流量、过滤分数、钠的分次排泄、锂的分次排泄、苯酚磺酞试验、浓度试验、稀释试验、游离水清除率、游离水重吸收能力、最大管状排泄能力、最大管状重吸收能力、磷酸盐重吸收率、β2-微球蛋白和α1-微球蛋白组成的组中的至少一种。表1-1表1-2表1-3表1-4*在血浆中(抗凝血剂是柠檬酸盐)**ltia法:乳胶比浊法上述肾病标记物可根据例如kanai′smanualofclinicallaboratorymedicine(第32次修订版,(masamitsukanai编辑;kanehara&co.,ltd.))中所述的已知方法进行测量。如本文所用的“慢性肾病”是指根据“用于诊断和治疗慢性肾病的临床实践指南(2012)”(日本肾病学会编辑),当受试者是人时,肾损伤的病症(例如:尿异常,如包括微量白蛋白尿蛋白尿、异常尿沉渣、成像异常,如单肾和多囊肾疾病、肾功能降低,如血清肌酐升高、电解质异常,如由于肾小管损伤而导致的低钾血症、组织病理学检查异常,如肾活检)或肾功能降低(即,低于60ml/min/1.73m2的估算gfr(肾小球滤过率))持续3个月或更长时间。这里,估算的gfr(egfr)可以使用来自下表2中所示的血清肌酐值的估算公式(egfrcreat)来计算。基于血清胱抑素c的估算公式(egfrcys)可以应用于肌肉量极低的人,例如下肢截肢者。表2*对18岁或更大年龄的人进行该肾功能评价。例如,在蛋白质被用作指标的情况下,当在3个月或更早之前的尿测试结果和最近的尿测试结果表明受试者具有0.15g/gcr或更高的持续尿蛋白水平时,这种病症可以诊断为慢性肾病。当受试者患有糖尿病并且3个月或更早之前的蛋白尿测试结果和最近的白蛋白尿测试表明受试者具有30mg/gcr或更高的持续尿白蛋白水平时,这样的病症可以被诊断为慢性肾病。对于儿童,血清肌酐(cr)的阈值可以通过用于日本儿童的酶法来确定,并且用于评价具有肾功能异常的儿童。例如,2岁以上但11岁以下的儿童的egfr(%)可由下面的等式1表示。等式1egfr(%)=(0.3×身高(m)/受试者的血清cr值)×100在哺乳动物(例如猫和狗)的情况下,从例如平均每日水摄入量或尿比重可以预测非人类哺乳动物是否患有慢性肾病。慢性肾病的严重程度可以基于例如下文表3中人的情况来确定(表3是“用于诊断和治疗慢性肾病的临床实践指南(2012)’’中的表2)。表3如本文所用的“个体”不受特别限制,包括人和非人哺乳动物。非人哺乳动物的示例包括牛、马、绵羊、山羊、猪、狗、猫、兔、猴等。人、猫和狗是优选的。个体的年龄或性别没有限制。“受试者”可以是具有肾功能降低或其他肾病的病史的个体,或者可以是没有肾功能降低或其他肾病的病史的个体。受试者可以是具有症状(例如多尿、口渴、饮水量增加、胃液过多、呕吐、血尿和全身不适)的个体或者可以是没有症状的个体。此外,受试者还包括根据已知的诊断方法(例如医学问诊、尿测试、血液生化测试、肾脏诊断成像或肾活检)怀疑患有肾损伤或慢性肾病的受试者。本文所用的“试样”包括来自活体的细胞、组织(副肾、主动脉、脑、肺、胰腺、垂体、皮肤、颅骨、骨骼肌、脾、睾丸、甲状腺、肾、大肠、眼球、心脏、肝脏、唾液腺、胸腺、脂肪组织、胃、空肠、回肠等)、体液(汗液、皮肤分泌物、泪液、唾液、脊髓液、腹水、胸腔积液)、尿、血样等。作为试样,肾脏、脂肪组织、皮肤、发根、唾液腺(腮腺、下颌下腺和舌下腺,优选腮腺)、汗液、皮肤分泌物、泪液、唾液、尿和血样是优选的,肾脏、唾液、腮腺、脂肪组织、发根、皮肤、皮肤分泌物和汗液是更优选的。此外,当下文描述的肾功能预测标记物是prp时,优选使用唾液或唾液腺作为试样。当肾功能预测标记物是防御素和hamp2时,优选脂肪组织、发根、皮肤、皮肤分泌物和汗液作为试样。特别地,皮肤优选作为用于获取defb8的测量值的试样;胃、骨骼肌或睾丸优选作为用于获取defa24的测量值的试样;脂肪组织优选作为用于获取defb1、defb10、defb12、defb14、defb15、defb18、defb19、defb2、defb20、defb21、defb22、defb23、defb25、defb26、defb28、defb29、defb30、defb35、defb37、defb39、defb41、defb42、defb43、defb45、defb47和defb48的测量值的试样;颅骨优选作为用于获取oscar测量值的试样;唾液、唾液腺或腮腺优选作为用于获取prb1、prh1、prp2和prpmp5的测量值的试样;颅骨、肾脏或心脏优选作为用于获取spp1的测量值的试样;肾脏、唾液腺(优选腮腺)优选作为用于获取dnase1的测量值的试样;主动脉优选作为用于获取slc7a8的测量值的试样;甲状腺优选作为用于获取anpep测量值的试样;肾脏或肝脏优选作为用于获取slco1a1的测量值的试样;副肾、主动脉、肺、垂体、皮肤、颅骨、骨骼肌、脾、甲状腺、肾、心脏或脂肪组织优选作为用于获取aplnr的测量值的试样。在下文描述“2.用于获取每个测量值的方法”中,当获取与肾功能预测标记物蛋白质有关的测量值时,该试样优选为血样或体液。在同一部分中,当获取肾功能预测标记物mrna的测量值时,试样优选为组织、血样或体液。如本文所用的“血样”是指从受试者采集的血液(全血),或由血液制备的血清或血浆。血样优选为血清或血浆,更优选为血清。用于采集血浆的抗凝血剂的类型没有特别限制。用于测量的受试者的血样的类型和用于确定预定阈值的血样的类型可以相同或不同,并且优选地是相同的。当血浆用作血样时,优选的是,使用与用于受试者的血浆所使用的抗凝血剂相同的抗凝血剂所采集的血液,制备用于确定预定阈值的血浆。此外,试样可以是新鲜试样,或者可以是保存试样。当保存试样时,可将试样在室温环境、冷藏环境或冷冻环境下保存;并且深冷保存是优选的。本发明中慢性肾病的并发症没有特别限制,包括可在慢性肾病中发展出的任何并发症。慢性肾病的并发症优选为选自由尿浓缩能力障碍(包括多尿和低比重尿)、氮质血症(包括高血尿素氮、高肌酐血症、高尿酸血症和尿毒症)、水/电解质异常(包括体液超负荷和高钾血症)、代谢性酸中毒、肾性贫血和继发性甲状旁腺功能亢进(包括肾性骨病)组成的组中的至少一种。本文所用的“磷摄入量”是指从食品、饮料等中摄取的磷的量。“磷”没有特别限制,优选为无机磷。根据“日本膳食参考摄入量(2015年)”(ministryofhealth,labourandwelfare),对于男性来说,磷的膳食参考摄入量为18至70岁时1000mg/天,12至17岁时1200mg/天,10至11岁时1100mg/天,8至9岁时1100mg/天,6至7岁时的900mg/天。就女性而言,磷的膳食参考摄入量为18至70岁时800mg/天,15至17岁时900mg/天,12至14岁时1100mg/天,10至11岁时1000mg/天,6至9岁时900mg/天。在成年男性和女性中,磷的膳食参考摄入量的可耐受的摄入上限为3000mg/天。因此,高“磷摄入量”是指1500mg/天或更高,优选3000mg/天或更高。本发明中的饮食疗法没有特别限制。优选的示例包括旨在限制蛋白质摄入、限制盐摄入、限制钾摄入、限制液体摄入等的饮食疗法。如本文所用的“肾功能预测标记物”是指例如在受试者体内表达的蛋白质或mrna。具体地,“肾功能预测标记物”包括选自由图14(“组1”)中所示基因表达的肾功能预测标记物组成的组中的至少一种。更具体地,肾功能预测标记物包括选自由图15中所示基因表达的组2的肾功能预测标记物组成的组中的至少一种,优选地选自由图15中所示基因表达的组3的肾功能预测组成的组中的至少一种,更优选地选自由图15中所示的基因表达的组4的肾功能预测标记物组成的组中的至少一种,更优选地选自由图15中所示的基因表达的组5的肾功能预测标记物组成的组中的至少一种。最优选地,肾功能预测标记物是选自由图16中所示的基因表达的组6的肾功能预测标记物组成的组中的至少一种,特别是选自由富含脯氨酸的蛋白质、防御素(defa和defb)、aplnr、spp1、dnase1、slco1a1、anpep、slc7a8、oscar和hamp2组成的组中的至少一种。此外,这些组还可以包括个体肾功能预测标记物的剪接变体。如本文所用的“富含脯氨酸的蛋白质(prp)”包括:酸性prp(aprp),包括prh1和prh2;基本prp(bprp),包括prb1、prb2和prb4;糖基化prp(gprp),包括prb3;prpmp5;prp2;剪接变体;其翻译后修饰的变体;等。由在小鼠的情况下聚集在染色体6(mm10数据库:grcm38/mm10:2011年12月)的132055403至132601236周围的基因表达的prp、由在人类的情况下聚集在染色体12(hg38数据库:grch38/hg38:2013年12月)的10824960至11395565周围的基因表达的prp、其剪接变体、其翻译后修饰的变体等是优选的。选自由prh1、prp2、prb1、prp-mp5、其剪接变体及其翻译后修饰变体组成的组的至少一种成员是更优选的。prh1蛋白质优选在小鼠的情况下为ncbi参考序列id:np_035304.4,以及在人类的情况下为由ncbi基因id:5554(2015年11月22日更新)中所示的基因表达的蛋白质。prh1蛋白还可以包括其剪接变体、其翻译后修饰的变体等。prp2蛋白优选在小鼠的情况下为ncbi参考序列id:np_113687.2,并且还可以包括其剪接变体、其翻译后修饰的变体等。prb1蛋白质优选在小鼠的情况下为ncbi参考序列id:np_941071.1,而在人类的情况下为由ncbi基因id:5542(2016年1月3日更新)中所示的基因表达的蛋白质。prb1蛋白还可以包括其剪接变体、其翻译后修饰的变体等。prp-mp5蛋白优选在小鼠的情况下为ncbi参考序列id:np_001019876.2,并且还可以包括其剪接变体、其翻译后修饰的变体等。prh1mrna优选在小鼠的情况下为ncbi参考序列id:nm_011174.4,以及在人的情况下为由ncbi基因id:5554(2015年11月22日更新)中所示的基因表达的mrna。prh1mrna还可以包括其剪接变体等。prp2mrna优选为在小鼠的情况下的ncbi参考序列id:nm_031499.2,并且还可以包括其剪接变体等。prb1mrna优选在小鼠的情况下为ncbi参考序列id:nm_198669.1,以及在人的情况下为由ncbi基因id:5542(2016年1月3日更新)中所示的基因表达的mrna。prb1mrna还可以包括其剪接变体等。prp-mp5mrna优选在小鼠的情况下为ncbi参考序列id:nm_001024705.2,并且还可以包括其剪接变体等。“与选自由肾功能预测标记物组成的组中的至少一种蛋白质有关的测量值”是指一个值,其反映了选自由肾功能预测标记物组成的组中的至少一种蛋白质的量或浓度。与选自由肾功能预测标记物组成的组中的至少一种蛋白质有关的测量值不仅包括蛋白质本身的量或浓度,还包括反映通过由该蛋白质分解获取的肽或氨基酸的量或浓度的值。当测量值用“量”指示时,其可以以摩尔为基础或以质量为基础表达;但是,优选指示以质量为基础的量。当该值以“浓度”表达时,它可以是试样的摩尔浓度或每恒定体积的质量比(质量/体积),优选质量/体积比。反映量或浓度的值可以是上述值或信号(例如荧光或冷光)的强度。“选自由肾功能预测标记物组成的组中的至少一种mrna的测量值”可以由存在于一定量试样中的肾功能预测标记物mrna的拷贝数(绝对量)表示;或者可以是反映管家基因(例如β2-微球蛋白mrna、gapdhmrna、maeamrna或β-肌动蛋白mrna)的相对表达水平的值。该测量值还可以由信号(例如荧光或冷光)的强度表示。与肾功能预测标记物蛋白质有关的测量值的“预定的阈值”是指基于与具有肾功能降低的个体的试样中的肾功能预测标记物蛋白质有关的测量值和/或涉及健康个体的试样中的肾功能预测标记物蛋白质有关的测量值而确定的阈值。例如,获取了与使用具有肾功能降低的多个个体的试样所测量的肾功能预测标记物蛋白质相关的测量值,以及与使用多个健康个体的试样所测量的肾功能预测标记物蛋白质相关的测量值。基于这些多个值,允许最准确确定肾功能降低的存在或不存在的值可以被确定并被用作“阈值”。根据检查的目的,基于指标(如敏感性、特异性、阳性预测值和阴性预测值),可以适当地设置“允许最准确确定的值”。例如,在一个实施方式中,与从多个健康个体所获取的试样中的肾功能预测标记物蛋白质有关的测量值中的最高测量值可以用作阈值。在另一个实施方式中,当基于与具有肾功能降低的个体的试样中的肾功能预测标记物蛋白质有关的测量值而确定阈值时,与具有肾功能降低的多个个体的试样中的肾功能预测标记物蛋白质有关的测量值中的最低测量值可以被确定为阈值。在另一个实施方式中,阈值可以是与健康个体的试样中的肾功能预测标记物蛋白质有关的测量值本身;或者是与健康个体中的肾功能预测标记物蛋白质有关的多个测量值的平均值、中值或模式。此外,与在过去当受试者健康时从相同的受试者所获取的肾功能预测标记物有关的测量值(可以是一个值;或者多个值的平均值、中值或模式)可以被用作阈值。当使用旨功能预测标记物蛋白质mrna的测量值代替与肾功能预测标记物蛋白质有关的测量值时,肾功能预测标记物mrna的测量值的“阈值”可以类似于与肾功能预测标记物蛋白质有关的测量值的“阈值”来进行确定。“健康个体”没有特别限制。优选地,健康个体是人或非人哺乳动物,其在术语“个体”的解释中进行了描述,并且在生化测试、血液测试、尿测试、血清测试、生理测试等中未显示异常数据。健康个体的年龄和性别没有特别限制。“多个试样”是指两个或更多个、优选五个或更多个、更优选十个或更多个试样。这些可以是从不同个体所采集的试样,或者可以是在不同时间所采集的同一个体的多个试样。“多个值”是指两个或更多个、优选五个或更多个、更优选十个或更多个与肾功能预测标记物蛋白质有关的测量值或肾功能预测标记物mrna的测量值的测量值。“多个个体”是指两个或更多个、优选五个或更多个、更优选十个或更多个的个体。受试者的物种、年龄、性别等不一定与用于确定阈值而获取与肾功能预测标记物蛋白质有关的测量值和肾功能预测标记物mrna的测量值的个体的种类、年龄、性别等相同。优选的是,受试者的物种与个体的物种相同。还优选的是,个体与受试者具有相同的年龄和/或性别。“肾功能预测标记物抗体”不受限制,只要该抗体与选自由上述肾功能预测标记物组成的组中的至少一种蛋白质特异性结合即可;以及可以使用通过用至少一种选自由肾功能预测的蛋白质或其一部分作为抗原而使非人动物免疫而获取的多克隆抗体、单克隆抗体及其片段(例如,fab、f(ab)2等)中的任一种。另外,免疫球蛋白类和亚类没有特别限制。此外,肾功能预测标记物抗体可以是嵌合抗体。此外,肾功能预测标记物抗体可以是scfv等。用作用于制备肾功能预测标记物抗体的抗原的肾功能预测标记物蛋白质的示例包括选自由上述肾功能预测标记物组成的组中的至少一种蛋白质的全部或一部分。本文所用的“用于肾功能预测标记物mrna检测的核酸”不受限制,只要其含有与选自由上述肾功能预测标记物组成的组中的至少一种mrna或者与mrna的逆转录产物特异性杂交的序列。用于检测的核酸可以是dna或rna,以及用于检测的核酸中包含的核苷酸可以是天然存在的核苷酸或人工合成的核苷酸。用于检测的核酸的长度没有特别限制。当用于检测的核酸用作例如微阵列中的捕获探针时,与靶核酸杂交的序列长度优选为约100mer,更优选约60mer,甚至更优选约20mer至30mer。捕获探针可以用例如已知的寡核苷酸合成器生产。捕获探针可含有不与靶核酸杂交的序列。当用于检测的核酸是用于pcr反应的引物时,与靶核酸杂交的序列的长度优选为约50mer,更优选约30mer,甚至更优选约15-25mer。引物可以用例如已知的寡核苷酸合成器生产。引物可含有不与靶核酸杂交的序列。引物可以用荧光染料等标记。除了引物之外,在pcr反应期间分解的用于定量的探针也可以用于rt-pcr中pcr产物的实时定量。用于定量的探针不受限制,只要其与靶核酸杂交即可。用于定量的探针优选是长度约5至20mer的含有与靶核酸杂交的序列的核酸。此外,优选的是,用于定量的探针在一端用荧光染料标记,在另一端用荧光染料的猝灭剂标记。2.用于获取各个测量值的方法用于获取与选自由肾功能预测标记物组成的组中的至少一种蛋白质有关的测量值和选自由本发明中的肾功能预测标记物组成的组中的至少一种mrna的测量值的方法不受限制,只要可以获取测量值即可。例如,它们可以根据下述方法获取。2-1.获取与肾功能预测标记物蛋白质有关的测量值2-1-1.获取肾功能预测标记物蛋白质的测量值当获取与选自由肾功能预测标记物组成的组中的至少一种蛋白质有关的测量值(下文中可以简称为本说明书中的“肾功能预测标记物蛋白质的测量值”)时,在用于获取测量值的过程中可以使用在“1.术语解释”部分中所描述的肾功能预测标记物抗体。替代地,可以使用下文描述的“9-1.包含肾功能预测标记物抗体的测试试剂”。通过使用例如已知elisa方法的方法,可以获取肾功能预测标记物蛋白质的测量值。在该实施方式中,用于抗原捕获的肾功能预测标记物抗体可以预先固定在固相(例如,微板)上,并且在固定的肾功能预测标记物抗体和肾功能预测标记物蛋白质之间可以形成复合物。通过用本领域已知的方法,通过检测固定在固相上的复合物或在固相上形成的复合物,可以测量包含在试样中的肾功能预测标记物蛋白质的量或浓度。将用于抗原捕获的肾功能预测标记物抗体固定在固相上的方法没有特别限制。通过使用已知方法,可以将肾功能预测标记物抗体直接固定或在其间插入另一种物质来间接固定。直接接合的示例包括物理吸附等。优选地,例如,免疫板可以用于将肾功能预测标记物抗体直接物理接合到微板上。固相的材料没有特别限制。示例包括聚苯乙烯、聚丙烯等。固相的形状没有特别限制。示例包括微板、微管、试管等。在形成复合物之后,该方法可包括洗涤固相的操作。在洗涤中,例如,可以使用含有表面活性剂等的pbs。在该方法中,通过使用由标记物质标记的用于检测的肾功能预测标记物抗体,或使用未标记的肾功能预测标记物抗体、用标记物质标记且能够结合未标记的肾功能预测标记物抗体的抗免疫球蛋白抗体等,可以检测复合物。优选的是,使用标记的用于检测的肾功能预测标记物抗体。还优选的是,用于检测的肾功能预测标记物抗体的肾功能预测标记物蛋白质中的表位不同于用于抗原捕获的肾功能预测标记物抗体的肾功能预测标记物蛋白质中的表位。用于检测的肾功能预测标记物抗体或标记的抗免疫球蛋白抗体的标记物质没有特别限制,只要标记物质能够生成可检测信号即可。示例包括荧光物质、放射性同位素、酶等。酶的示例包括碱性磷酸酶、过氧化物酶等。荧光物质的示例包括荧光染料,例如异硫氰酸荧光素(fitc)、罗丹明和alexafluor(注册商标)、荧光蛋白(例如gfp)等。放射性同位素的示例包括125i、14c、32p等。其中,优选碱性磷酸酶或过氧化物酶作为标记物质。用于检测的肾功能预测标记物抗体通过用本领域已知的标记方法用上述标记物质标记肾功能预测标记物抗体而获取。替代地,可以使用市售的标记试剂盒等进行这种标记。对于标记的免疫球蛋白抗体,可以使用与标记物肾功能预测标记物抗体相同的方法,或者可以使用市售产品。在该方法中,通过检测由复合物中包含的标记的肾功能预测标记物抗体的标记物质所生成的信号,可以获取试样中包含的肾功能预测标记物的测量值。这里,“检测信号”包括定性地检测信号的是否存在、定量地检测信号强度以及半定量地检测信号强度。这种半定量检测意味着以阶段(例如“无信号生成”、“弱”、“中等”和“强”)指示信号强度。在该步骤中,优选的是定量或半定量地检测信号强度。可以使用已知方法作为用于检测信号的方法。在该方法中,可以根据源自上述标记物质的信号类型适当地选择测量方法。例如,当标记物质是酶时,通过使用已知装置(例如发光计或分光光度计)测量由酶与底物反应生成的信号(例如光或颜色),可以进行信号的检测。根据酶的种类从已知的底物中可以适当地选择酶的底物。例如,当碱性磷酸酶用作酶时,底物的示例包括化学发光底物,例如cdp-star(注册商标)(4-氯-3-(甲氧基螺[1,2-二氧杂环丁烷-3,2′-(5′-氯)三环[3.3.1.13,7]癸烷]-4-基)苯基磷酸二钠)和显色底物(如5-溴-4-氯-3-吲哚基磷酸酯(bcip)、5-溴-6-氯-3-吲哚基磷酸二钠和对硝基苯基磷酸酯)。当标记物质是过氧化物酶时,底物的示例包括四甲基联苯胺(tmb)等。当标记物质是放射性同位素时,可以使用已知装置(例如闪烁计数器)测量信号(即辐射)。当标记物质是荧光物质时,可以使用已知装置(例如荧光酶标仪)测量信号(即荧光)。可以根据使用的荧光物质的类型适当地确定激发波长和荧光波长。信号的检测结果可以用作肾功能预测标记物蛋白质的测量值。例如,当定量检测信号强度时,信号强度的测量值本身或从信号强度的测量值计算的值可以用作肾功能预测标记物蛋白质的测量值。2-1-1.获取源自肾功能预测标记物蛋白质的肽或氨基酸的测量值在本发明中,也可以获取源自肾功能预测标记物蛋白质的肽或氨基酸的测量值,而不是获取肾功能预测标记物蛋白质本身的测量值。例如,可以用酸、碱、蛋白水解酶等分解试样(预处理),并且可以测量分解产物中包含的肽或氨基酸。获取的测量值可以用作与选自由肾功能预测标记物组成的组中的至少一种蛋白质有关的测量值。优选地,由于prp是富含脯氨酸的蛋白质,因此试样可以用酸、碱、蛋白水解酶等分解;可以测量分解产物中含有的脯氨酸和脯氨酸。获取的测量值可以用作与选自由prp组成的组中的至少一种蛋白质有关的测量值。当试样用酸预处理时,试样可以用例如盐酸、优选6n盐酸在约100至150℃下处理约12至24小时(参见j.j.wren和p.h.wiggall;biochem.j.(1965)94,216-220)。当试样用碱预处理时,试样可以用例如氢氧化钠、优选4n氢氧化钠在约80至100℃下处理约4至10小时。当试样被蛋白水解酶分解时,蛋白水解酶没有特别限制,只要它是能够将蛋白质分解成氨基酸的酶即可。示例包括链霉蛋白酶、蛋白酶k等。链霉蛋白酶是优选的。在下列条件下,试样可以用蛋白水解酶分解:在约4至80℃下处理约1至90小时。试样可以未经修饰地预处理,或者可以用例如生理盐水、pbs或缓冲液稀释用于酶促反应。当试样是体液时,可以在预处理之前通过离心分离或过滤去除固体(例如细胞)。获取肽或氨基酸的测量值的方法不受限制,只要该方法是可以测量目标肽或氨基酸的方法即可。用于测量脯氨酸的测量值的方法的示例包括使用质谱仪(例如gcms、lcms或cems)的测量方法以及使用显色反应(包括使用荧光染料的显色反应)的测量方法,例如使用茚三酮反应的方法(batesl等,1973,rapiddeterminationoffreeprolineforwater-stressstudies.plantandsoil,39,205-207),靛红纸检测(abraham等,第20章:methodsfordeterminationofprolineinplants,methodinmolecularbiology,2010,639,317-331),yingzhou和juyoungyoon(chem.soc.rev.,2012,41,52-67)描述的方法,或使用genipin反应的方法(fujikawa等,brilliantskybluepigmentformationfromgardeniafruits.j.ferment.technol.,1987,65,419)。当通过质谱法测量脯氨酸时,脯氨酸的量或浓度可以例如由已知浓度的内标的峰面积和质谱中的试样计算。计算值可以用作脯氨酸的测量值。当通过使用显色反应(例如茚三酮反应)测量脯氨酸时,可以用吸收光谱仪等测量试样中脯氨酸显示的反应液的颜色强度(吸光度),并且吸光度值可以用作脯氨酸的测量值。此外,可以通过使用校准曲线等从吸光度值计算脯氨酸的量或浓度,并且计算的值可以用作脯氨酸的测量值。更具体地,当通过gcms测量脯氨酸时,其可以通过例如以下方法测量。(1)预处理唾液以例如800至1200×g在2至10℃下将唾液离心分离约10至20分钟以去除固体,并将所得唾液用作测量中的唾液样品。用例如含有0.1mtris-hcl(ph7.5)和0.5%sds的缓冲液将10至20μl唾液样品稀释约10至30倍。将链霉蛋白酶加入50至200μl稀释的唾液样品中,最终浓度为1至10μg/ml,然后在约室温至60℃下在阴凉处培养约1至90小时。培养后的反应液用作链霉蛋白酶反应液。每ml色谱级甲醇加入1.5μl的2-异丙基苹果酸(内标),制备所需量的得到的溶液。将500μl含有2-异丙基苹果酸的甲醇溶液加入到链霉蛋白酶反应液中,通过涡旋搅拌混合物约30秒以自旋减慢。将混合物在室温下放置约5分钟后,加入200μl超纯水,通过涡旋搅拌混合物约30秒,并在4℃下以约4600×g离心分离5分钟。离心分离后,将约400μl的第一上清液从混合物中转移到新管中。向第一上清液中加入约200μl超纯水,通过涡旋搅拌混合物约30秒,并在4℃下以约4600×g离心分离约5分钟,并采集约400μl第二上清液。将第二上清液转移至超滤单元杯(亲水性ptfe膜,0.2μm;millipore),并在4℃下以约9100×g离心分离约15分钟,从而获取超滤液。将超滤液在约65℃下减压干燥约90分钟,向剩余物中加入50μl含有20mg/ml甲氧基胺盐酸盐的吡啶溶液,并将混合物用振动器在37c下振动90分钟。此后,进一步加入50μl的n-甲基-n-三甲基甲硅烷基三氟乙酰胺(mstfa),并将混合物用振动器在37℃下振动30分钟并进行三甲基甲硅烷基化,从而获取gc试样。(2)gcms测量例如,gcms-tq8030(shimadzucorporation)用于gcms;例如,db-5(30m×0.25mm(内径)×1.00μm(膜厚))(agilenttechnologies)用作gc的毛细管柱。gc在例如以下升温条件下进行:温度以4℃/min的速率从100℃升至320℃。喷射器端口温度例如是280℃。氦气用作载气,并以约39.0cm/秒的速度流动。电子电离的能量例如是150ev,离子源温度例如是200℃,并且以mrm模式测量脯氨酸-2tms{142.10/73.0}和2-异丙基苹果酸{216.10/147.10}。注入1μl的gc试样,使用不分流模式,并且在例如1.50kv的检测器电压下进行测量。(3)gcms数据的分析对于gcms数据的分析,例如,可以使用gcms方案版本4.2的数据分析软件和gcms代谢物数据库(shimadzucorporation)。制备例如在以下六点处的稀释系列的纯化脯氨酸:0.02、0.01、0.005、0.0005、0.00005和0.000005(nmol/μl),由此制备校准曲线。脯氨酸的浓度可以通过以下来确定:将试样中脯氨酸的峰面积除以内标(2-异丙基苹果酸)的峰面积以获取比值,并将该比值应用于校准曲线。2-2.获取肾功能预测标记物mrna的测量值可以使用已知方法,例如微阵列方法、rna-seq分析方法或定量rt-pcr方法,以获取选自由肾功能预测标记物组成的组中的至少一种mrna的测量值(下文中可以缩写为在本说明书中的“肾功能预测标记物mrna的测量值”)。作为用于微阵列方法的探针,可以合成和使用一种选择的探针或已知的探针;或者可以使用市售的微阵列芯片。替代地,可以使用“9-2.包含用于肾功能预测标记物mrna检测的核酸的测试试剂”。在该方法中,可以使用从试样中提取的总rna和mrna中的任何一种。用于总rna和mrna提取的试样优选在从个体采集后立即进行rna提取;或者在从个体采集后立即冷冻(优选在-196℃或更低的气氛下(在液氮中快速冷却)),并在-80℃或更低温度下储存直至rna提取。从试样中提取总rna和mrna的方法没有特别限制,可以使用已知的提取方法。根据已知方法可以进行微阵列方法的定量。肾功能预测标记物mrna的表达水平可以表达为管家基因的相对表达水平;或者表达为例如荧光染料的信号强度的测量值。rt-pcr定量通过通过以下来进行:使用从试样中提取的总rna或mrna作为模板进行逆转录反应,并通过使用肾功能预测标记物mrna的特定引物通过实时pcr方法等以获取的cdna作为模板。在这种情况下,肾功能预测标记物mrna的表达水平可以表达为管家基因的表达水平的相对表达水平,或表达为例如荧光染料的信号强度的测量值。在rna-seq分析方法中,从试样中提取的mrna被片段化,使用这些片段作为模板通过逆转录反应合成edna,并制备文库。通过使用下一代测序仪确定每个文库中包含的每个片段的核苷酸序列,将获取的信息映射到参考基因序列,并且将mrna的表达水平表达为rpkm(每百万中每千碱基长度的reads数,readsperkilobasepermillion)。rpkm可以表达为例如热图中的信号强度。信号的检测结果可以用作肾功能预测标记物mrna的表达水平。例如,当定量检测信号强度时,信号强度的测量值本身或根据信号强度的测量值计算的值可以用作肾功能预测标记物mrna的表达水平。由信号强度的测量值计算出的值的示例包括:通过从信号强度的测量值中减去阴性对照样品的信号强度的测量值而获取的值;通过将信号强度的测量值除以阳性对照样品的信号强度的测量值而获取的值;它们的组合;等等。阴性对照样品的示例包括健康受试者的试样等。阳性对照样品的示例包括含有在预定表达水平的肾功能预测标记物mrna的试样。3.系统配置在本发明中,使用在上述“2.用于获取每个测量值的方法”中获得的测量值进行下面描述的“4.肾功能的评价”、“5.磷的摄入量的估算”、“6.发展出与肾病相关的并发症的可能性的预测”和“7.饮食疗法效果的确定”。首先,描述用于进行这些处理的系统配置。图1是根据本发明的一个实施方式的系统100的概图,图2是示出系统100的硬件配置的框图。系统100包括计算装置(因为下文提及具有相同硬件配置但具有不同功能配置的计算装置,下面将具有不同功能配置的计算装置在下文中统称为“计算装置1、2、3、4、5”)、输入单元6、显示单元7、测量装置8a和测量装置8b。计算装置1、2、3、4、5包括例如通用个人计算机,并且包括用于执行之后描述的数据处理的cpu101、用作数据处理的工作区的存储器102、用于存储处理数据的存储单元103、用于在单元之间传输数据的总线104以及用于在计算装置和外部装置之间执行数据输入和输出的接口单元105(下文称为“i/f单元”)。输入单元6和显示单元7连接到计算装置1、2、3、4、5。输入单元6包括例如键盘;显示单元7包括例如液晶显示器。输入单元6和显示单元7可以集成并实现为具有触控板的显示器。计算装置1、2、3、4、5不需要是单一装置,并且cpu101、存储器102、存储单元103等可以位于单独的位置并且经由网络连接。计算装置也可以是省略输入单元6和显示单元7的装置,并且不需要操作员。计算装置1、2、3、4、5,测量装置8a和测量装置8b也不一定位于同一个位置,并且可以配置成使得位于单独的位置的装置通过网络通信地彼此连接。在下面的说明中,除非另有说明,由计算装置1、2、3、4、5执行的处理表示基于存储在存储单元103或存储器102中的程序,由计算装置1、2、3、4、5的cpu101执行的处理。cpu101将必要数据(例如正在处理的中间数据)临时存储在用作工作区的存储器102中,并且适当地将长时间存储的数据(例如计算结果)存储在存储单元103中。测量装置8a是用于获取与选自由肾功能预测标记物组成的组中的至少一种蛋白质有关的测量值的装置,并且包括样品放置区域81、反应单元82和检测单元83。将置于样品放置区域81中的从受试者采集的试样分配到微板并在微板中培养,在微板被置于反应单元82中并在其上固定有用于抗原捕获的肾功能预测标记物抗体。如果需要,去除未反应的抗原。此后,将检测抗体分配到微板中,然后培养。如果需要,去除未反应的抗原,并将用于检测检测抗体的底物分配到微板中。将微板转移到检测单元83,并测量通过与底物反应所生成的信号。测量装置8a的另一个实施方式是用于通过微阵列分析获取选自由肾功能预测标记物组成的组中的至少一种mrna的测量值的装置。将设置在样品放置区域81中的逆转录反应产物分配到反应单元82中的微阵列芯片组中,然后进行杂交。在洗涤微阵列芯片后,将其转移到检测单元83,并测量荧光信号。此外,测量装置8a的另一个实施方式是用于通过rt-pcr获取选自由肾功能预测标记物组成的组中的至少一种mrna的测量值的装置。将设置在样品放置区域81中的逆转录反应产物分配到设置在反应单元82中的微管中,随后将用于定量pcr的试剂分配到微管中。在反应单元82中进行pcr反应,并且在pcr反应期间由检测单元83检测管中的荧光信号。此外,测量装置8a的另一个实施方式是用于通过显色反应获取脯氨酸的测量值的装置,该脯氨酸的测量值作为与选自由肾功能预测标记物组成的组中的至少一种蛋白质有关的测量值。将设置在样品放置区域81中的预处理试样分配到设置在反应单元82中的微管中,随后将用于显色反应的试剂分配到微管中。在反应单元82中进行培养,并且在检测单元83中检测管中的吸光度。测量装置8b是用于测量选自由肾功能预测标记物组成的组中的至少一种mrna的装置,并且包括分析单元84。在分析单元84中设置经受rna-seq反应的样品,并且在分析单元84中进行核苷酸序列的分析。测量装置8b的另一个实施方式是用于通过质量分析测量脯氨酸来获取与选自由肾功能预测标记物组成的组中的至少一种蛋白质有关的测量值的装置,并且包括分析单元84。在分析单元84中设置经受质量分析的处理的样品,并且在分析单元84中进行质量分析。测量装置8a和8b通过有线连接或无线连接而连接到计算装置1、2、3、4、5。测量装置8aa/d转换与选自由肾功能预测标记物组成的组中的至少一种蛋白质有关的测量值,或者选自由肾功能预测标记物组成的组中的至少一种mrna的测量值,并将其作为数字数据发送到计算装置1、2、3、4、5。类似地,测量装置8ba/d转换选自由肾功能预测标记物组成的组中的至少一种mrna的测量值,并将其作为数字数据发送到计算装置1、2、3、4、5。因此,由于可以计算的数字数据,计算装置1、2、3、4、5可以获取与选自由肾功能预测标记物组成的组中的至少一种蛋白质有关的测量值以及选自由肾功能预测标记物组成的组中的至少一种mrna的测量值。与选自由肾功能预测标记物组成的组中的至少一种蛋白质有关的测量值和选自由肾功能预测标记物组成的组中的至少一种mrna的测量值例如经由互联网从医疗结构(未示出)作为数字数据传输。因此,计算装置1、2、3、4、5可以获取与选自由肾功能预测标记物组成的组中的至少一种蛋白质有关的测量值以及选自由肾功能预测标记物组成的组中的至少一种mrna的测量值作为数字数据。肾病标记物的测量值作为数字数据例如经由互联网从医疗机构(未示出)传输到计算装置1、2、3、4和5;因此,计算装置1、2、3、4、5可以获取肾病标记物的测量值作为数字数据。4.评价肾功能4-1.概述在该实施方式中,使用通过执行在上述“2.用于获取每个测量值的方法”部分中描述的方法而获取的测量值,评价受试者的肾功能。具体地,该实施方式是包括以下步骤的用于评价受试者的肾功能的方法;或包括以下步骤的用于辅助评价受试者的肾功能的方法:获取步骤,获取与选自由从受试者采集的试样中包含的肾功能预测标记物组成的组中的至少一种蛋白质有关的测量值和/或选自由从受试者采集的试样中包含的肾功能预测标记物组成的组中的至少一种mrna的测量值;和评价步骤,基于在获取步骤中所获取的测量值评价肾功能。更具体地,通过“2.获取每个测量值的方法”所获取的测量值与预定阈值进行比较,以及当测量值等于或高于阈值时,可以确定受试者的肾功能降低。此外,当从受试者采集的试样是血样或体液时,在获取步骤中可以获取肾功能预测标记物蛋白质的测量值和肾功能预测标记物mrna的测量值。当从受试者采集的试样是组织时,在获取步骤中可以获取肾功能预测标记物mrna的测量值。此外,在该实施方式中,在上述“1.术语解释”部分中描述的至少一种肾病标记物的值落在阈值范围之外之前,可以检测肾功能的降低。因此,即使从受试者获取的肾病标记物的测量值在对应的肾病标记物的阈值的范围内相互比较时,当肾功能预测标记物蛋白质和/或肾功能预测标记物mrna的测量值高于该蛋白质和/或mrna的阈值时,也可以确定受试者的肾功能已经降低。随着肾功能的降低,defb8、slco1a1和aplnr的表达降低;因此,关于这些肾功能预测标记物中的每一个,当肾功能预测标记物蛋白质和/或肾功能预测标记物mrna的测量值低于该蛋白质和/或mrna的阈值时,可以确定受试者的肾功能已经降低。4-2.用于评价肾功能的装置和程序本发明包括作为第一实施方式的用于评价受试者的肾功能的装置,该装置由cpu101执行以下计算功能:获取功能,获取与选自由包含在从受试者采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的测量值和/或选自由包含在从受试者采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的测量值;和评价功能,用于基于由获取功能所获取的测量值评价肾功能。优选地,该装置还包括用于获取受试者中的至少一种肾病标记物的测量值的功能;和用于将由肾病标记物值获取功能所获取的肾病标记物的测量值与对应的肾病标记物的阈值进行比较并且识别肾病标记物的测量值在肾病标记物的阈值的范围内的受试者的功能。在该实施方式中,肾功能可以由包括作为上述装置的计算装置1的系统100(图1和图2)进行评价。图3是示出根据本发明第一实施方式的计算装置1的功能的框图。计算装置1包括肾病标记物值获取单元11,受试者识别单元12,测量值获取单元13和肾功能评价单元14。肾病标记物值获取单元11和受试者识别单元12可以是可选的。通过将根据本发明的程序安装在计算装置1的存储单元103或存储器102中,并使cpu101执行该程序来实现这些功能块。权利要求中记载的肾病标记物值获取单元、识别单元、获取单元和评价单元分别对应于如图3所示的肾病标记物值获取单元11、受试者识别单元12、测量值获取单元13和肾功能评价单元14。在该实施方式中,将受试者中的肾功能预测标记物蛋白质的测量值m2从测量装置8a或测量装置8b输入计算装置1中,并且将肾功能预测标记物mrna的测量值m3从测量装置8a或测量装置8b输入计算装置1。受试者中的肾病标记物的测量值m1、肾病标记物的阈值r1、肾功能预测标记物蛋白质的阈值r2和肾功能预测标记物mrna的阈值r3存储在计算装置1的外部并且经由例如互联网输入计算装置1中。肾功能预测标记物蛋白质的测量值m2和受试者中肾功能预测标记物mrna的测量值m3可以经由网络从医疗机构(未示出)输入装置中。肾病标记物的阈值r1、肾功能预测标记物蛋白质的阈值r2和肾功能预测标记物mrna的阈值r3可以预先存储在计算装置1的存储单元103或存储器102中。此外,功能块(即,肾病标记物值获取单元11、受试者识别单元12、测量值获取单元13和肾功能评价单元14)不一定由单一cpu执行,并且可以由多个cpu以分布式方式处理。例如,这些功能块可以被配置成使得肾病标记物值获取单元11和受试者识别单元12的功能由第一计算机的cpu执行,并且使得测量值获取单元13和肾功能评价单元14的功能由第二计算机(即另一计算机)的cpu执行。此外,为了执行下面描述的图4中的步骤s11至s14,计算装置1预先将根据本发明的程序存储在存储单元103中,例如,以可执行的格式(例如,在这样的格式中,程序可以通过使用编译器从编程语言转换而生成)。计算装置1使用存储在存储单元103中的程序执行处理。上述程序可以从计算机可读的非暂时性有形存储介质109(例如cd-rom)安装在计算装置1中。替代地,计算装置1可以连接到互联网(未示出)以经由互联网下载程序的程序代码。4-3.用于评价肾功能的方法根据本发明第一实施方式的计算装置1执行以下本发明的肾功能评价方法。本发明的肾功能评价方法包括用于评价受试者的肾功能的方法,包括以下步骤:获取与选自由包含在从受试者采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的测量值和/或选自由包含在从受试者采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的测量值;和基于由获取步骤所获取的测量值而评价肾功能。优选地,上述方法在获取步骤之前还包括以下步骤:获取受试者中的至少一种肾病标记物的测量值;和将在肾病标记物值获取步骤中所获取的肾病标记物的测量值与对应的肾病标记物的阈值进行比较并且识别肾病标记物的测量值在肾病标记物的阈值的范围内的受试者。图4是示出由根据本发明第一实施方式的计算装置1执行的数据处理流程以执行上述方法的流程图。图4所示的步骤s11、s12、s13和s14的处理分别由图3所示的肾病标记物值获取单元11、受试者识别单元12、测量值获取单元13和肾功能评价单元14执行。步骤s11和s12是可选步骤。步骤s11和s12可以在s14之后执行。在步骤s11中,肾病标记物值获取单元11获取受试者中的肾病标记物的测量值m1。肾病标记物的测量值m1是通过已知方法获取的测量值,并且经由互联网从外部的医疗机构(未示出)发送到计算装置1。在步骤s12中,受试者识别单元12将获取的肾病标记物的测量值m1与对应的肾病标记物的阈值r1进行比较,并识别肾病标记物的测量值m1在该阈值r1范围内的受试者。在步骤s13中,测量值获取单元13获取受试者中的肾功能预测标记物蛋白质的测量值m2和/或肾功能预测标记物mrna的测量值m3。具体地,当从受试者采集的试样是血样或体液时,测量值获取单元13获取肾功能预测标记物蛋白质的测量值m2和肾功能预测标记物mrna的测量值m3。当从受试者采集的试样是组织时,测量值获取单元13获取肾功能预测标记物mrna的测量值m3。肾功能预测标记物蛋白质的测量值m2和肾功能预测标记物mrna的测量值m3是通过“2.获取每个测量值的方法”获取的测量值。在步骤s14中,基于所获取的肾功能预测标记物蛋白质的测量值m2和/或所获取的肾功能预测标记物mrna的测量值m3,肾功能评价单元14评价受试者的肾功能。具体地,当将获取的肾功能预测标记物蛋白质的测量值m2与肾功能预测标记物蛋白质的阈值r2(预定的阈值)进行比较并且测量值m2大于阈值r2时,或者当将获取的肾功能预测标记物mrna的测量值m3与肾功能预测标记物mrna的阈值r3(预定的阈值)进行比较并且测量值m3大于阈值r3时,作为评价结果可以确定受试者的肾功能降低。所获取的评价结果显示在计算装置1的显示单元7上,或者存储在计算装置1中的存储单元103中。替代地,评价结果可以显示在计算机终端的显示单元(例如,医疗机构中的计算机终端的显示单元)上,该计算机终端经由互联网连接到计算装置1并且在计算装置1的外部。5.估算磷的摄入量5-1.概述在该实施方式中,使用通过执行在“2.用于获取每个测量值的方法”部分中描述的方法所获取的测量值来估算受试者的磷摄入量。具体地,该实施方式是一种包括以下步骤的用于估算受试者的磷摄入量的方法,或一种包括以下步骤的用于辅助估算受试者的磷摄入量的方法:获取步骤,获取与选自由包含在从受试者采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的测量值和/或选自由包含在从受试者采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的测量值;和估算步骤,基于由获取步骤所获取的测量值估算受试者的磷摄入量。更具体地,通过“2.用于获取各个测量值的方法”所获取的测量值与预定阈值进行比较,当测量值等于或高于阈值或高于阈值时,可以确定受试者的磷摄入量为高。已知高磷摄入量容易导致肾功能在未来降低。因此,当在该实施方式中确定受试者的磷摄入量为高时,可以确定受试者未来具有肾功能降低的风险。此外,当从受试者采集的试样是血样或体液时,在获取步骤中可以获取肾功能预测标记物蛋白质和肾功能预测标记物mrna的测量值。当从受试者采集的试样是组织时,在获取步骤中可以获取肾功能预测标记物mrna的测量值。此外,本发明是一种用于预测未来肾功能降低的风险的方法。因此,同样在其中在上述部分“1.术语解释”中描述的至少一种肾病标记物的测量值在对应的肾病标记物的阈值范围内受试者的情况下,当彼此比较时,当肾功能预测标记物蛋白质和/或肾功能预测标记物mrna的测量值高于对应的蛋白质和/或mrna的阈值时,可以确定受试者在未来具有肾功能降低的风险。随着磷摄入量的增加,defb8、slco1a1和aplnr的表达降低;因此,对于这些肾功能预测标记物中的每一个,当肾功能预测标记物蛋白质和/或肾功能预测标记物mrna的测量值低于相应的蛋白质和/或mrna的阈值时,可以确定受试者的磷摄入量为高。这里,“未来”是指在采集用于测量的试样日期之后的10年或更长、优选5年或更长、更优选1年或更长、甚至更优选6个月或更长。该实施方式也可以应用于在“1.术语解释”部分中描述的至少一种肾病标记物的测量值在阈值范围内的受试者。作为另一个实施方式,该实施方式可以应用于被诊断为肾病的受试者。该实施方式也可以应用于被诊断为上表3中所示的gfr类别g1或g2的受试者。5-2.用于估算磷摄入量的装置和程序本发明包括作为第二实施方式的用于估算受试者的磷摄入量的装置,该装置由cpu101执行以下计算功能:用于获取与选自由包含在从受试者采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的测量值和/或选自由包含在从受试者采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的测量值的功能;和用于基于由获取功能所获取的测量值而估算受试者的磷摄入量的功能。优选地,该装置还包括预测功能,用于当受试者的磷摄入量为高时确定受试者未来具有肾功能降低的风险。优选地,在获取功能获取测量值之前,装置还包括以下功能:获取受试者中至少一种肾病标记物的测量值;和将由肾病标记物值获取功能所获取的肾病标记物的测量值与对应的肾病标记物的阈值进行比较并且识别肾病标记物的测量值在肾病标记物的阈值的范围内的受试者。在该实施方式中,可以由包括计算装置2作为上述装置的系统100(图1和2)估算磷摄入量。图5是示出根据本发明第二实施方式的计算装置2的功能的框图。计算装置2包括肾病标记物值获取单元21、受试者识别单元22、测量值获取单元23、磷摄入量估算单元24和肾功能降低风险预测单元25。肾病标记物值获取单元21和受试者识别单元22可以是可选的。通过将根据本发明的程序安装在计算装置2的存储单元103或存储器102中,并使cpu101执行该程序来实现这些功能块。权利要求中记载的肾病标记物值获取单元、识别单元、获取单元、估算单元和预测单元分别对应于图5所示的肾病标记物值获取单元21、受试者识别单元22、测量值获取单元23、磷摄入量估算单元24和肾功能降低风险预测单元25。在该实施方式中,将受试者中的肾功能预测标记物蛋白质的测量值m2从测量装置8a或测量装置8b输入计算装置2中,并且将肾功能预测标记物mrna的测量值m3从测量装置8a或测量装置8b输入计算装置2中。受试者中的肾病标记物的测量值m1、肾病标记物的阈值r1、肾功能预测标记物蛋白质的阈值r2和肾功能预测标记物mrna的阈值r3存储在计算装置2的外部并且经由例如互联网输入计算装置2中。受试者中的肾功能预测标记物蛋白质的测量值m2和肾功能预测标记物mrna的测量值m3可以经由网络从医疗机构(未示出)输入到该装置中。肾病标记物的阈值r1、肾功能预测标记物蛋白质的阈值r2和mrna的阈值r3可以预先存储在计算装置2的存储单元103或存储器102中。此外,功能块(即,肾病标记物值获取单元21、受试者识别单元22、测量值获取单元23、磷摄入量估算单元24和肾功能降低风险预测单元25)不一定由单一cpu执行,并且可以由多个cpu以分布式方式处理。例如,这些功能块可以被配置成使得肾病标记物值获取单元21和受试者识别单元22的功能由第一计算机的cpu执行,并且使得测量值获取单元23、磷摄入量估算单元24和肾功能降低风险预测单元25的功能由第二计算机(即另一计算机)的cpu执行。此外,为了执行下面描述的图6中的步骤s21至s25,计算装置2预先将根据本发明的程序存储在存储单元103中,例如,以可执行的格式(例如,在这样的格式中,程序可以通过使用编译器从编程语言转换而生成)。计算装置2使用存储在存储单元103中的程序执行处理。上述程序可以从计算机可读的非暂时性有形存储介质109(例如cd-rom)安装在计算装置2中。替代地,计算装置2可以连接到互联网(未示出)以经由互联网下载程序的程序代码。5-3.用于估算磷摄入量的方法根据本发明第二实施方式的计算装置2执行以下本发明的磷摄入量估算方法。本发明的磷摄入量估算方法包括用于估算受试者的磷摄入量的方法,包括以下步骤:获取与选自由包含在从受试者采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的测量值和/或选自由包含在从受试者采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的测量值;和由获取步骤所获取的测量值而估算受试者的磷摄入量。优选地,上述方法还包括预测步骤,用于当确定受试者的磷摄入量为高时,确定受试者在未来具有肾功能降低的风险。优选地,上述方法在获取步骤之前还包括以下步骤:获取受试者中至少一种肾病标记物的测量值的单元;和将在肾病标记物值获取步骤中所获取的肾病标记物的测量值与对应的肾病标记物的阈值进行比较并且识别肾病标记物的测量值在肾病标记物的阈值的范围内的受试者。图6是示出由根据本发明第二实施方式的计算装置2执行的数据处理流程以执行上述方法的流程图。图6所示的步骤s21、s22、s23、s24和s25的处理分别由图5中所示的肾病标记物值获取单元21、受试者识别单元22、测量值获取单元23、磷摄入量估算单元24和肾功能降低风险预测单元25执行。步骤s21和s22是可选步骤。步骤s21和s22可以在s24或s25之后执行。计算装置2对步骤s21至s23的处理与计算装置1对步骤s11至s13的处理相同。在步骤s24中,基于所获取的肾功能预测标记物蛋白质的测量值m2和/或肾功能预测标记物mrna的测量值m3,磷摄入量估算单元24估算受试者的磷摄入量。具体地,当将获取的肾功能预测标记物蛋白质的测量值m2与肾功能预测标记物蛋白质的阈值r2(预定的阈值)进行比较并且测量值m2大于阈值r2时,或者当将获取的肾功能预测标记物mrna的测量值m3与肾功能预测标记物mrna的阈值r3(预定的阈值)进行比较并且测量值m3大于阈值r3时,可以确定受试者的磷摄入量为高。在步骤s25中,当在步骤s24中确定受试者的磷摄入量为高时,作为预测结果,肾功能降低风险预测单元25可以确定受试者在未来具有肾功能降低的风险。所获取的预测结果显示在计算装置2的显示单元7上,或者存储在计算装置2中的存储单元103中。替代地,预测结果可以显示在计算机终端的显示单元(例如,医疗机构中的计算机终端的显示单元)上,该计算机终端经由互联网连接到计算装置2并且在计算装置2的外部。6.发展出与肾病相关的并发症的可能性的预测6-1.概述在该实施方式中,使用通过执行在上述部分“2.用于获取每个测量值的方法”中描述的方法获取的测量值,预测受试者是否在未来具有发展出与肾病相关的并发症的可能性。具体地,第三实施方式是一种用于预测在受试者中未来发展出与肾病相关的并发症的可能性的方法;或者一种用于辅助预测在受试者中未来发展出与肾病相关的并发症的可能性的方法,包括以下步骤:获取步骤,获取与选自由包含在从受试者采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的测量值和/或选自由包含在从受试者采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的测量值;和预测步骤,基于由获取步骤所获取的测量值预测未来发展出与肾病相关的并发症的可能性。更具体地,在本发明的第三实施方式中,通过“2.获取每个测量值的方法”所获取的测量值与预定阈值进行比较,并且当测量值等于或高于阈值或者高于阈值时,可以确定受试者在未来有发展出与肾病相关的并发症的可能性。在本发明的第四实施方式中,通过执行“2.获取每个测量值的方法”部分中所述的方法至少两次,使用在不同时间从相同受试者获取的相同种类的试样的第一测量值和第二测量值,预测受试者在未来是否有发展出与肾病相关的并发症的可能性。具体地,第四实施方式是一种用于预测在受试者中未来发展出与肾病相关的并发症的可能性的方法,包括以下步骤:第一获取步骤,用于获取与选自由包含在从受试者较早采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的第一测量值和/或选自由包含在从受试者较早采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的第一测量值;第二获取步骤,用于获取与选自由包含在从受试者较晚采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的第二测量值和/或选自由包含在从受试者较晚采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的第二测量值;和预测步骤,用于基于由第一获取步骤所获取的第一测量值和由第二获取步骤所获取的第二测量值而预测未来发展出与肾病相关的并发症的可能性。更具体地,通过使用在“2.用于获取每个测量值的方法”部分中描述的方法所获取的第一测量值和第二测量值彼此进行比较,并且当第二测量值高于第一测量值时,可以确定受试者未来具有发展出与肾病相关的并发症的可能性。在这种情况下,采集时间没有特别限制,只要在采集用于获取第二测量值的试样之前1天或更长时间采集用于获取第一测量值的试样即可。优选在3至7天或更长时间之前、更优选在7至15天或更长时间之前、甚至更优选15至50天或更长之前采集用于获取第一测量值的试样。在第三实施方式和第四实施方式中,在上述“1.术语解释”部分中描述的至少一种肾病标记物的值之前落在阈值范围之外之前,可以预测未来发展出与肾病相关的并发症的可能性。因此,即使从受试者获取的肾病标记物的测量值在对应的肾病标记物的阈值的范围内,当相互比较时,可以确定:当肾功能预测标记物蛋白质和/或肾功能预测标记物mrna的测量值高于蛋白质和/或mrna的阈值时,受试者未来有发展出相关的并发症的可能性。随着肾功能的降低,defb8、slco1a1和aplnr的表达降低;因此,关于这些肾功能预测标记物中的每一个,可以确定:当肾功能预测标记物蛋白质和/或肾功能预测标记物mrna的测量值低于该蛋白质和/或mrna的阈值时,受试者未来有发展出与肾病相关的并发症的可能性。此外,当将第一测量值与第二测量值进行比较并且第二测量值低于第一测量值时,也可以确定受试者未来有发展出与肾病相关的并发症的可能性。此外,当从受试者采集的试样是血样或体液时,在第一获取步骤中可以获取肾功能预测标记物蛋白质和肾功能预测标记物mrna的第一测量值,以及在第二获取步骤中可以获取肾功能预测标记物蛋白质和肾功能预测标记物mrna的第二测量值。当从受试者采集的试样是组织时,在第一获取步骤中可以获取肾功能预测标记物mrna的第一测量值,并且在第二获取步骤中可以获取肾功能预测标记物mrna的第二测量值。作为其他实施方式,第三实施方式和第四实施方式可以应用于被诊断为肾病的受试者。第三实施方式和第四实施方式也可以应用于被诊断为上表3中所示的gfr类别g1或g2的受试者。6-2.用于预测发展出并发症的可能性的装置和程序(1)执行与预定的阈值的比较的实施方式本发明包括作为第三实施方式的用于预测在受试者中未来发展出与肾病相关的并发症的可能性的装置,该装置由cpu101执行以下计算功能:用于获取与选自由包含在从受试者采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的测量值和/或选自由包含在从受试者采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的测量值的功能;和用于基于由获取功能所获取的测量值而预测未来发展出与肾病相关的并发症的可能性的单元。优选地,在获取功能获取测量值之前,装置还包括以下功能:获取受试者中的至少一种肾病标记物的测量值;和将由肾病标记物值获取功能所获取的肾病标记物的测量值与对应的肾病标记物的阈值进行比较并且识别肾病标记物的测量值在肾病标记物的阈值的范围内的受试者。在该实施方式中,预测发展出并发症的可能性可以由包括计算装置3作为上述装置的系统100(图1和2)预测。图7是示出根据本发明第三实施方式的计算装置3的功能的框图。计算装置3包括肾病标记物值获取单元31、受试者识别单元32、测量值获取单元33和并发症发展预测单元34。肾病标记物值获取单元31和受试者识别单元32可以是可选的。通过将根据本发明的程序安装在计算装置3的存储单元103或存储器102中,并使cpu101执行该程序来实现这些功能块。权利要求中记载的肾病标记物值获取单元、识别单元、获取单元和预测单元分别对应于图7所示的肾病标记物值获取单元31、受试者识别单元32、测量值获取单元33和并发症发展预测单元34。在该实施方式中,将受试者中的肾功能预测标记物蛋白质的测量值m2从测量装置8a或测量装置8b输入计算装置3中,并且将肾功能预测标记物mrna的测量值m3从测量装置8a或测量装置8b输入计算装置3中。受试者中的肾病标记物的测量值m1、肾病标记物的阈值r1、肾功能预测标记物蛋白质的阈值r2和肾功能预测标记物mrna的阈值r3存储在计算装置的外部并且经由例如互联网输入计算装置3中。受试者中的肾功能预测标记物蛋白质的测量值m2和肾功能预测标记物mrna的测量值m3可以经由网络从医疗机构(未示出)输入装置中。肾病标记物的阈值r1、肾功能预测标记物蛋白质的阈值r2和mrna的阈值r3可以预先存储在计算装置3的存储单元103或存储器102中。此外,功能块(即肾病标记物值获取单元31、受试者识别单元32、测量值获取单元33和并发症发展预测单元34)不一定由单一cpu执行,并且可以由多个cpu以分布式方式处理。例如,这些功能块可以被配置成使得肾病标记物值获取单元31和受试者识别单元32的功能由第一计算机的cpu执行,并且使得测量值获取单元33和并发症发展预测单元34的功能由第二计算机(即另一计算机)的cpu执行。此外,为了执行下面描述的图8中的步骤s31至s34的处理,计算装置3预先将根据本发明的程序存储在存储单元103中,例如,以可执行的格式(例如,在这样的格式中,程序可以通过使用编译器从编程语言转换而生成)。计算装置3使用存储在存储单元103中的程序执行处理。上述程序可以从计算机可读的非暂时性有形存储介质109(例如cd-rom)安装在计算装置3中。替代地,计算装置3可以连接到互联网(未示出)以经由互联网下载程序的程序代码。(2)将在不同时间获取的测量值相互比较的实施方式本发明包括作为第四实施方式的用于预测未来在受试者中发展出与肾病相关的并发症的可能性的装置,该装置由cpu101执行以下计算功能:第一获取功能,用于获取与选自由包含在从受试者较早采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的第一测量值和/或选自由包含在从受试者较早采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的第一测量值;第二获取功能,用于获取与选自由包含在从受试者较晚采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的第二测量值和/或选自由包含在从受试者较晚采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的第二测量值;和预测功能,用于基于由第一获取功能所获取的第一测量值和由第二获取功能所获取的第二测量值而预测未来发展出与肾病相关的并发症的可能性。优选地,在第一获取装置和第二获取装置分别获取第一测量值和第二测量值之前,装置还包括以下功能:获取受试者中的至少一种肾病标记物的测量值;和将由肾病标记物值获取功能所获取的肾病标记物的测量值与对应的肾病标记物的阈值进行比较并且识别肾病标记物的测量值在肾病标记物的阈值的范围内的受试者。在该实施方式中,发展出并发症的可能性可以由包括计算装置4作为上述装置的系统100(图1和2)预测。图9是示出根据本发明第四实施方式的计算装置4的功能的框图。计算装置4包括肾病标记物值获取单元41、受试者识别单元42、第一测量值获取单元43、第二测量值获取单元44和并发症发展预测单元45。肾病标记物值获取单元41和受试者识别单元42可以是可选的。通过将根据本发明的程序安装在计算装置4的存储单元103或存储器102中,并使cpu101执行该程序来实现这些功能块。权利要求中记载的肾病标记物值获取单元、识别单元、第一获取单元、第二获取单元和预测单元分别对应于图9所示的肾病标记物值获取单元41、受试者识别单元42、第一测量值获取单元43、第二测量值获取单元44和并发症发展预测单元45。在该实施方式中,将受试者中的肾功能预测标记物蛋白质的测量值m21和m22从测量装置8a或测量装置8b输入计算装置4中,并且将肾功能预测标记物mrna的测量值m31和m32从测量装置8a或测量装置8b输入计算装置4中。受试者中的肾病标记物的测量值m1和肾病标记物的阈值r1存储在计算装置4的外部,并经由例如互联网输入计算装置4中。受试者中的肾功能预测标记物蛋白质的测量值m21和m22以及肾功能预测标记物mrna的测量值m31和m32可以经由网络从医疗机构(未示出)输入到该装置中。肾病标记物的阈值r1可以预先存储在计算装置4的存储单元103或存储器102中。此外,功能块(即,肾病标记物值获取单元41、受试者识别单元42、第一测量值获取单元43、第二测量值获取单元44和并发症发展预测单元45)不一定由单一cpu执行,并且可以由多个cpu以分布式方式处理。例如,这些功能块可以被配置成使得肾病标记物值获取单元41和受试者识别单元42的功能由第一计算机的cpu执行,并且使得第一测量值获取单元43、第二测量值获取单元44和并发症发展预测单元45的功能由第二计算机(即另一计算机)的cpu执行。此外,为了执行下面描述的图10中的步骤s41至s45的处理,计算装置4预先将根据本发明的程序存储在存储单元103中,例如,以可执行格式(例如,在这样的格式中,程序可以通过使用编译器从编程语言转换而生成)。计算装置4使用存储在存储单元103中的程序执行处理。上述程序可以从计算机可读的非暂时性有形存储介质109(例如cd-rom)安装在计算装置4中。替代地,计算装置4可以连接到互联网(未示出)以经由互联网下载程序的程序代码。6-3.用于预测发展并发症的可能性的方法(1)执行与预定阈值的比较的实施方式根据本发明第三实施方式的计算装置3执行以下根据本发明第三实施方式的用于预测发展并发症的可能性的方法。根据本发明第三实施方式的用于预测发展并发症的可能性的方法包括用于预测在受试者中未来发展出与肾病相关的并发症的可能性的方法,包括以下步骤:获取与选自由包含在从受试者采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的测量值和/或选自由包含在从受试者采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的测量值;和基于由获取步骤所获取的测量值而预测未来发展出与肾病相关的并发症的可能性。优选地,在获取步骤之前,上述方法还包括以下步骤:获取受试者中的至少一种肾病标记物的测量值;和将由肾病标记物值获取步骤所获取的肾病标记物的测量值与对应的肾病标记物的阈值进行比较并且识别肾病标记物的测量值在肾病标记物的阈值的范围内的受试者。图8是示出由根据本发明第三实施方式的计算装置3执行的数据处理流程以执行上述方法的流程图。图8所示的步骤s31、s32、s33和s34的处理分别由图7中所示的肾病标记物值获取单元31、受试者识别单元32、测量值获取单元33和并发症发展预测单元34执行。步骤s31和s32是可选步骤。步骤s31和s32可以在s34之后执行。计算装置3对步骤s31至s33的处理与计算装置1对步骤s11至s13的处理相同。在步骤s34中,基于所获取的肾功能预测标记物蛋白质的测量值m2和/或肾功能预测标记物mrna的测量值m3,并发症发展预测单元34预测在受试者中发展出并发症的可能性。具体地,当将获取的肾功能预测标记物蛋白质的测量值m2与肾功能预测标记物蛋白质的阈值r2(预定的阈值)进行比较并且测量值m2大于阈值r2时,或者当将获取的肾功能预测标记物mrna的测量值m3与肾功能预测标记物mrna的阈值r3(预定的阈值)进行比较并且测量值m3大于阈值r3时,作为预测结果,可以确定受试者在未来具有发展出与肾病相关的并发症的可能性。所获取的预测结果显示在计算装置3的显示单元7上,或者存储在计算装置3中的存储单元103中。替代地,预测结果可以显示在计算机终端的显示单元(例如,医疗机构中的计算机终端的显示单元)上,该计算机终端经由互联网连接到计算装置3并且在计算装置3的外部。(2)将在不同时间获取的测量值相互比较的实施方式根据本发明第四实施方式的计算装置4执行以下根据本发明第四实施方式的用于预测发展出并发症的可能性的方法。根据本发明第四实施方式的用于预测发展出并发症的可能性的方法包括用于预测未来在受试者中发展出与肾病相关的并发症的可能性的方法,包括以下步骤:第一获取步骤,获取与选自由包含在从受试者较早采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的第一测量值和/或选自由包含在从受试者较早采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的第一测量值;第二获取步骤,获取与选自由包含在从受试者较晚采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的第二测量值和/或选自由包含在从受试者较晚采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的第二测量值;和预测步骤,基于由第一获取单元所获取的第一测量值和由第二获取单元所获取的第二测量值预测未来发展出与肾病相关的并发症的可能性。优选地,在第一获取步骤和第二获取步骤之前,上述方法还包括以下步骤:获取受试者中的至少一种肾病标记物的测量值;和将在肾病标记物值获取步骤所获取的肾病标记物的测量值与对应的肾病标记物的阈值进行比较并且识别肾病标记物的测量值在肾病标记物的阈值的范围内的受试者。图10是示出由根据本发明第四实施方式的计算装置4执行的数据处理流程以执行上述方法的流程图。图10所示的步骤s41、s42、s43、s44和s45的处理分别由图9所示的肾病标记物值获取单元41、受试者识别单元42、第一测量值获取单元43、第二测量值获取单元44和并发症发展预测单元45执行。步骤s41和s42是可选步骤。步骤s41和s42可以在s45之后执行。计算装置4对步骤s41和s42的处理与计算装置1对步骤s11和s12的处理相同。在步骤s43中,第一测量值获取单元43获取在所识别的受试者的较早采集的试样中包含的肾功能预测标记物蛋白质的测量值m21和/或肾功能预测标记物mrna的测量值m31作为较早获取的第一测量值。具体地,当从受试者较早采集的试样是血样或体液时,第一测量值获取单元43获取肾功能预测标记物蛋白质的测量值m21和肾功能预测标记物mrna的测量值m31作为第一测量值。当较早从受试者采集的试样是组织时,第一测量值获取单元43获取mrna的测量值m31作为第一测量值。在步骤s44中,第二测量值获取单元44获取在被识别的受试者的较晚获取的试样中包含的肾功能预测标记物蛋白质的测量值m22和/或肾功能预测标记物mrna的测量值m32作为较晚获取的第二测量值。具体地,当从受试者较晚采集的试样是血样或体液时,第二测量值获取单元44获取肾功能预测标记物蛋白质的测量值m22和肾功能预测标记物mrna的测量值m32作为第二测量值。当从受试者较晚采集的试样是组织时,第二测量值获取单元44获取肾功能预测标记物mrna的测量值m32作为第二测量值。在步骤s45中,并发症发展预测单元45将较早获取的第一测量值与较晚获取的第二测量值进行比较,并预测在受试者中发展出并发症的可能性。具体地,在从受试者采集的试样是血样或体液的情况下,当肾功能预测标记物蛋白质的测量值m22(第二测量值)高于肾功能预测标记物蛋白质的测量值m21(第一测量值)时,或当肾功能预测标记物mrna的测量值m32(第二测量值)高于肾功能预测标记物mrna的测量值m31(第一测量值)时,作为预测结果,可以确定受试者具有未来发展出与肾病相关的并发症可能性。在从受试者采集的试样是组织的情况下,当肾功能预测标记物mrna的测量值m32(第二测量值)高于肾功能预测标记物mrna的测量值m31(第一测量值)时,作为预测结果,可以确定受试者具有未来发展出与肾病相关的并发症可能性。所获取的预测结果显示在计算装置4的显示单元7上,或者存储在计算装置4中的存储单元103中。替代地,预测结果可以显示在计算机终端的显示单元(例如,医疗机构中的计算机终端的显示单元)上,该计算机终端经由互联网连接到计算装置4并且在计算装置4的外部。7.饮食疗法效果的确定7-1.概述在该实施方式中,使用通过执行在上述“2.用于获取每个测量值的方法”部分中描述的方法确定受试者中的饮食疗法的效果。具体地,该实施方式是用于确定受试者中饮食疗法的效果的方法或用于辅助确定受试者饮食疗法效果的方法,包括以下步骤:第一获取步骤,获取与选自由包含在从受试者较早采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的第一测量值和/或选自由包含在从受试者较早采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的第一测量值;第二获取步骤,获取与选自由包含在从受试者较晚采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的第二测量值和/或选自由包含在从受试者较晚采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的第二测量值;和确定步骤,基于由第一获取处理所获取的第一测量值和由第二获取处理所获取的第二测量值确定饮食疗法的效果。更具体地,通过执行在“2.获取每个测量值的方法”部分中描述的方法至少两次,通过使用在不同时间从相同受试者获取的第一测量值和第二测量值,确定饮食疗法在受试者中的效果。更具体地,通过使用在“2.用于获取每个测量值的方法”部分中描述的方法获取的第一测量值和第二测量值相互比较,并且当第二测量值低于第一测量值时,可以确定饮食疗法在受试者中是有效的。在这种情况下,采集时间没有特别限制,只要在采集用于获取第二测量值的试样之前1周或更长时间采集用于获取第一测量值的试样。用于获取第一测量值的试样优选在2至7天或更长时间之前、更优选在1至4周或更长时间之前、甚至更优选1至3个月或更长之前采集。此外,当从受试者采集的试样是血样或体液时,在第一获取步骤中可以获取肾功能预测标记物蛋白质和肾功能预测标记物mrna的第一测量值并在第二获取步骤中可以获取肾功能预测标记物蛋白质和肾功能预测标记物mrna的第二测量值。当从受试者采集的试样是组织时,在第一获取步骤中可以获取肾功能预测标记物mrna的第一测量值并且在第二获取步骤中可以获取肾功能预测标记物mrna的第二测量值。随着磷摄入量的增加,defb8、slco1a1和aplnr的表达降低;因此,对于这些肾功能预测标记物中的每一个,当将第一测量值与第二测量值进行比较并且第二测量值高于第一测量值时,可以确定饮食疗法在受试者中是有效的。该实施方式也可以应用于其中在“1.术语解释”部分中描述的至少一种肾病标记物的测量值在阈值范围内的受试者。作为另一个实施方式,该实施方式可以应用于被诊断为肾病的受试者。该实施方式也可以应用于被诊断为上表3中所示的gfr类别g1或g2的受试者。7-2.用于确定饮食疗法效果的装置和程序作为第五实施方式,本发明包括用于确定受试者中的饮食疗法的效果的装置,该装置由cpu101执行以下计算功能:第一获取功能,用于获取与选自由包含在从受试者较早采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的第一测量值和/或选自由包含在从受试者较早采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的第一测量值;第二获取功能,获取与选自由包含在从受试者较晚采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的第二测量值和/或选自由包含在从受试者较晚采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的第二测量值的;和确定功能,基于由第一获取功能所获取的第一测量值和由第二获取功能所获取的第二测量值确定饮食疗法的效果。优选地,在第一获取功能和第二获取功能之前,上述装置还包括以下功能:获取受试者中的至少一种肾病标记物的测量值;和将由肾病标记物值获取功能所获取的肾病标记物的测量值与对应的肾病标记物的阈值进行比较并且识别肾病标记物的测量值在肾病标记物的阈值的范围内的受试者。在该实施方式中,饮食疗法的效果可以由包括计算装置5作为上述装置的系统100(图1和图2)进行确定。图11是示出根据本发明第五实施方式的计算装置5的功能的框图。计算装置5包括肾病标记物值获取单元51,受试者识别单元52,第一测量值获取单元53,第二测量值获取单元54和饮食疗法效果确定单元55。肾病标记物值获取单元51和受试者识别单元52可以是可选的。通过将根据本发明的程序安装在计算装置5的存储单元103或存储器102中并使cpu101执行该程序来实现这些功能块。权利要求中记载的肾病标记物值获取装置、识别装置、第一获取装置、第二获取装置和确定装置分别对应于如图11所示的肾病标记物值获取单元51、受试者识别单元52、第一测量值获取单元53、第二测量值获取单元54和饮食疗法效果确定单元55。在该实施方式中,将受试者中的肾功能预测标记物蛋白质的测量值m21和m22从测量装置8a或测量装置8b输入计算装置5中,并且将肾功能预测标记物mrna的测量值m31和m32从测量装置8a或测量装置8b输入计算装置5中。受试者中的肾病标记物的测量值m1和肾病标记物的阈值r1存储在计算装置5的外部,并经由例如互联网输入计算装置5中。受试者中的肾功能预测标记物蛋白质的测量值m21和m22以及肾功能预测标记物mrna的测量值m31和m32可以经由网络从医疗机构(未示出)输入到该装置中。肾病标记物的阈值r1可以预先存储在计算装置5的存储单元103或存储器102中。此外,功能块(即,肾病标记物值获取单元51、受试者识别单元52、第一测量值获取单元53、第二测量值获取单元54和饮食疗法效果确定单元55)不一定由单一cpu执行,并且可以由多个cpu以分布式方式处理。例如,这些功能块可以被配置成使得肾病标记物值获取单元51和受试者识别单元52的功能由第一计算机的cpu执行,并且使得第一测量值获取单元53、第二测量值获取单元54和饮食疗法效果确定单元55的功能由第二计算机(即另一计算机)的cpu执行。此外,为了执行下面描述的图12中的步骤s51至s55的处理,计算装置5预先将根据本发明的程序存储在存储单元103中,例如,以可执行的格式(例如,在这样的格式中,程序可以通过使用编译器从编程语言转换而生成)。计算装置5使用存储在存储单元103中的程序执行处理。上述程序可以从计算机可读的非暂时性有形存储介质109(例如cd-rom)安装在计算装置5中。替代地,计算装置5可以连接到互联网(未示出)以经由互联网下载程序的程序代码。7-3.用于确定饮食疗法效果的方法根据本发明第五实施方式的计算装置5执行以下根据本发明的用于确定饮食疗法的效果的方法。根据本发明的用于确定饮食疗法的效果的方法包括用于确定受试者中的饮食疗法的效果的方法,包括以下步骤:第一获取步骤,获取与选自由包含在从受试者较早采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的第一测量值和/或选自由包含在从受试者较早采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的第一测量值;第二获取步骤,获取与选自由包含在从受试者较晚采集的试样中的肾功能预测标记物组成的组中的至少一种蛋白质有关的第二测量值和/或选自由包含在从受试者较晚采集的试样中的肾功能预测标记物组成的组中的至少一种mrna的第二测量值;和确定步骤,基于由第一获取步骤所获取的第一测量值和由第二获取步骤所获取的第二测量值确定饮食疗法的效果。优选地,在第一获取步骤和第二获取步骤之前,上述方法还包括:获取受试者中的至少一种肾病标记物的测量值的步骤;和将在肾病标记物值获取步骤中所获取的肾病标记物的测量值与对应的肾病标记物的阈值进行比较并且识别肾病标记物的测量值在肾病标记物的阈值的范围内的受试者的步骤。图12是示出根据本发明第五实施方式的计算装置5执行的数据处理流程以执行上述方法的流程图。图12所示的步骤s51、s52、s53、s54和s55的处理分别由图11所示的肾病标记物值获取单元51、受试者识别单元52、第一测量值获取单元53、第二测量值获取单元54和饮食疗法效果确定单元55执行。步骤s51和s52是可选步骤。步骤s51和s52可以在s55之后执行。计算装置5对步骤s51至s54的处理与计算装置4对步骤s41至s44的处理相同。在步骤s55中,饮食疗法效果确定单元55将较早获取的第一测量值与较晚获取的第二测量值进行比较,并确定饮食疗法的效果。具体地,在从受试者采集的试样是血样或体液的情况下,当肾功能预测标记物蛋白质的测量值m22(第二测量值)低于肾功能预测标记物蛋白质的测量值m21(第一测量值)时,或者当肾功能预测标记物mrna的测量值m32(第二测量值)低于肾功能预测标记物mrna的测量值m31(第一测量值)时,作为预测结果,可以确定饮食疗法有效。在从受试者采集的试样是组织的情况下,当肾功能预测标记物mrna的测量值m32(第二测量值)低于肾功能预测标记物mrna的测量值m31(第一测量值)时,作为预测结果,可以确定饮食疗法有效。所获取的确定结果显示在计算装置5的显示单元7上,或者存储在计算装置5中的存储单元103中。替代地,确定结果可以显示在计算机终端的显示单元(例如,医疗机构中的计算机终端的显示单元)上,该计算机终端经由互联网连接到计算装置5并且在计算装置5的外部。8.针对受试者的治疗或饮食改善疗法对于在上述第4部分中描述的用于评价受试者的肾功能的方法或用于辅助评价受试者的肾功能的方法中被确定具有肾功能降低的受试者;对于在上述第5部分中描述的用于估算受试者的磷摄入量的方法或用于辅助估算受试者的磷摄入量的方法中被确定具有高磷摄入量或被确定未来具有肾功能降低风险的受试者;对于上述第6部分中描述的用于预测未来在受试者中有发展出与肾病相关的并发症的可能性的方法或者用于辅助预测未来在受试者中有发展出与肾病相关的并发症的可能性的方法中被确定未来具有发展出与肾病相关的并发症的可能性的受试者;以及对于在上述第7部分中描述的用于确定受试者中饮食疗法效果的方法或用于辅助确定受试者中饮食疗法效果的方法中被观察到饮食疗法没有效果的受试者,可以进行必要的治疗或疗法。对于被确定具有肾功能降低的受试者以及未来有发展出与肾病相关的并发症可能性的受试者,可以进行饮食疗法、休息治疗、药物疗法等以预防肾功能恶化。药物疗法不受限制,只要其不会使肾功能降低恶化。例如,药物疗法可以通过使用抗高血压药物进行,例如血管紧张素转换酶抑制剂(例如,卡托普利、马来酸依那普利、阿拉普利、盐酸地拉普利、西拉普利水合物、赖诺普利水合物、贝那普利、盐酸咪达普利、盐酸替莫普利、盐酸喹那普利、群多普利、培哚普利特丁胺)和血管紧张素受体阻滞剂(例如,氯沙坦钾、坎地沙坦酯、缬沙坦、替米沙坦、奥美沙坦酯、伊沙贝沙阿齐沙坦);利尿剂(例如,呋塞米、吡咯他尼、阿佐塞米、托拉塞米、坎利酸、钾)、尿毒症治疗剂(例如,克美静)、活性维生素d制剂(例如艾法罗、罗盖全)、磷酸盐结合剂(例如,caltan)、钾结合剂(例如,聚磺苯乙烯钠、聚苯乙烯磺酸钙、argamatejelly)、碱化剂(例如碳酸氢钠)等。根据已知方法按照受试者的状况可以确定药物的剂量和施用方法。对于未观察到饮食疗法的效果的受试者,除了进一步的饮食疗法之外,还可以进行上述药物疗法。此外,对于被确定具有高磷摄入量或被确定未来具有肾功能降低风险的受试者,可以进行饮食疗法。另外,如果需要,也可以进行上述药物疗法。9.测试试剂9-1.包含肾功能预测标记物抗体的测试试剂本发明提供一种测试试剂,其包含在上述“2.用于获取各个测量值的方法”、“4.肾功能的评价”、“5.磷摄入量的估算”、“6.未来发展出与肾病相关的并发症的可能性的预测”和“7.饮食疗法效果的确定”中使用的肾功能预测标记物抗体。作为肾功能预测标记物抗体,可以使用在“1.术语解释”中所描述的那些。该实施方式的测试试剂包含至少一种肾功能预测标记物抗体。当肾功能预测标记物抗体是多克隆抗体时,它可以是通过用一种抗原免疫所获取的多克隆抗体,或者可以是通过与两种或更多种抗原平行免疫同一个体而获取的多克隆抗体。此外,可以混合通过将两种或更多种抗原单独接种到不同动物中而获取的多克隆抗体。当肾功能预测标记物抗体是单克隆抗体时,它可以是由一种杂交瘤生成的单克隆抗体,或者可以是两种或更多种的多个单克隆抗体,每种抗体识别由可能包含的两种或更多种杂交瘤产生的相同或不同的表位。替代地,可以包含至少一种多克隆抗体和至少一种单克隆抗体作为混合物。测试试剂中包含的肾功能预测标记物抗体的形式没有特别限制,可以是例如含有肾功能预测标记物抗体的抗血清或腹水的干态或液态。替代地,肾功能预测标记物抗体的形式可以是纯化的肾功能预测标记物抗体的干态或水溶液、含有肾功能预测标记物抗体的免疫球蛋白部分的干态或水溶液或含有肾功能预测标记物抗体的igg的部分的干态或水溶液。当肾功能预测标记物抗体的形式为含有肾功能预测标记物抗体的抗血清或腹水的干态或液态时,可以进一步包含以下物质中的至少一种:稳定剂,如β-巯基乙醇和dtt;防护剂,如白蛋白;表面活性剂,如聚氧乙烯(20)脱水山梨糖醇单月桂酸酯和聚氧乙烯(10)辛基苯基醚;防腐剂,如叠氮化钠;等。当肾功能预测标记物抗体的形式是纯化的肾功能预测标记物抗体的干态或水溶液、含有肾功能预测标记物抗体的免疫球蛋白部分的干态或水溶液或含有肾功能预测标记物抗体的igg的部分的干态或水溶液时,可以进一步包含以下物质中的至少一种:缓冲组分,如磷酸盐缓冲液;稳定剂如β-巯基乙醇和dtt;防护剂,如白蛋白;盐类,如氯化钠;表面活性剂,如聚氧乙烯(20)脱水山梨糖醇单月桂酸酯和聚氧乙烯(10)辛基苯基醚;防腐剂,叠氮化钠等。在本发明中,肾功能预测标记物抗体可以是未标记的,或者可以用上述标记物质标记。肾功能预测标记物抗体优选用上述标记物质标记。作为标记物质,可以使用在“2.用于获取每个测量值的方法”部分中例举的那些。此外,在本发明中,用于抗原捕获的肾功能预测标记物抗体可以以固定在固相表面上等的状态而提供。固相和固定化如在“2.用于获取每个测量值的方法”部分中所例举。固相优选是微板。此外,测试试剂可以作为试剂盒而提供。更具体地,该试剂盒是用于上述“4.肾功能的评价”、“5.磷摄入量的估算”、“6.未来发展出与肾病相关的并发症的可能性的预测”和“7.饮食疗法效果的确定”的测试试剂盒,其包括在“2.用于获取每个测量值的方法”部分中所用的肾功能预测标记物抗体,包括用于抗原捕获的肾功能预测标记物抗体的测试试剂和含有用标记物质标记的用于检测的肾功能预测标记物抗体的测试试剂。当用于抗原捕获的肾功能预测标记物抗体预先与例如微板的固相结合时,该实施方式的测试试剂盒可以包含其上固定有用于抗原捕获的肾功能预测标记物抗体的固相以及用于检测的肾功能预测标记物抗体。此外,当标记物质是酶时,试剂盒可以包含用于酶的底物的液体。上述测试试剂盒例如是图13所示的试剂盒。测试试剂盒9包括:外部盒94、其上固定有用于抗原捕获的抗体的微板92、检测用标记物质标记的含有用于检测的肾功能预测标记物抗体的第一容器91a、包含与酶反应的底物的液体的第二容器91b和用于测试试剂盒的附件93。附件93可以描述测试单元包的处理方法、储存条件等。包含用于洗涤等的水性介质的容器可以装入外部盒94中。9-2.包含用于肾功能预测标记物mrna检测的核酸的测试试剂本发明提供用于上述“4.肾功能的评价”、“5.磷摄入量的估算”、“6.未来发展出与肾病相关的并发症的可能性的预测”和“6.饮食疗法效果的确定”中的测试试剂,其包括在“2.用于获取每个测量值的方法”部分中所用的用于肾功能预测标记物mrna检测的核酸。作为用于肾功能预测标记物mrna检测的核酸,可以使用在“1.术语解释”中所描述的那些。包含用于微阵列的肾功能预测标记物mrna检测的核酸的测试试剂可以处于冻干状态,或处于溶解在含有tris-hcl等缓冲液、edta、盐等的溶液中的状态。当存在多个靶向肾功能预测标记物mrna时,用于检测的核酸优选置于不同的容器中。用于肾功能预测标记物mrna检测的核酸可以通过将其固定在基础材料上而作为微阵列芯片提供。微阵列的基础材料没有特别限制,只要用于检测的核酸可以固定在其上即可。示例包括玻璃、聚合物(如聚丙烯、尼龙膜等)。根据已知方法,将这种用于检测的核酸固定在基础材料上。例如,可以使用含有反应基团的连接子或用于固定用于检测的核酸的交联剂。此外,包含用于肾功能预测标记物mrna检测的核酸的测试试剂可以作为试剂盒提供,试剂盒不仅包含试剂,还包含在其上方存储有关于核酸的信息或者用于访问该信息的信息的介质,例如纸或光盘。包含用于rt-pcr的肾功能预测标记物mrna检测的核酸的测试试剂可以处于冻干状态,或处于溶解在含有tris-hcl等缓冲液、edta、盐等的溶液中的状态。此外,关于引物,正向引物和反向引物可以在单独的容器中提供,或者可以以混合状态提供。此外,当包括定量探针时,定量探针可以在与每种引物分开的容器中提供,或者引物和定量探针可以以混合状态提供。此外,包含用于肾功能预测标记物mrna检测的核酸的测试试剂可以以包含试剂盒的形式提供;该试剂盒包括正向引物和反向引物、定量探针、以及附件(如果必要)。此外,试剂盒可以带有用于定量pcr的试剂。实施例下面结合实施例更详细地描述本发明。然而,本发明不应解释为限于这些实施例。实施例中的动物实验是在国际先进电信研究所动物护理和使用委员会(animalcareandusecommitteeofadvancedtelecommunicationsresearchinstituteinternational)的批准下进行的。获取人类数据得到了国际先进电信研究所人体组织研究伦理委员会(ethicscommitteeforhumantissuestudyofadvancedtelecommunicationsresearchinstituteinternational)的批准,并在获取受试者的完全知情同意后进行。实验实施例1:慢性肾病模型小鼠的建立通过在单侧肾切除术后通过高磷饮食饲养而获取慢性肾病模型小鼠。作为对照,在假手术后通过低磷饮食饲养而获取小鼠。1.单侧肾切除术通过腹膜内施用阿佛丁(250mg/kg)麻醉小鼠(c57bl/6j,8周龄,雄性)后,从背部切开皮肤。右肾动脉和静脉以及输尿管被结扎。在结扎的远侧切割后,右肾被摘除,并闭合切口。对照小鼠进行假手术。在假手术中,暴露右肾动脉、静脉以及输尿管,并且在没有结扎的情况下闭合切口。为了等待小鼠完全从手术应激中恢复,给小鼠进食0.54%含无机磷的正常饮食(ce-2,cleajapan,inc.)4周。2.磷超负荷手术完成后4周(12周龄),以2%含无机磷的高磷饮食(td.10662,orientalbioservice,inc.)饲养单侧肾切除小鼠(以下可称为“肾病组”)。以0.35%含无机磷的低磷饮食(td.10662改良型,orientalbioservice,inc.)饲养假手术小鼠(下文中可称为“假组”)。通过修改hum.c.等人描述的方法(jamsocnephrol22,124-136,2011)获取慢性肾病的模型小鼠。在hum.c.等的方法中,在上述第1项中,在单侧肾切除术时,剩余的肾(左肾)进行缺血-再灌注损伤。然而,在该修改中,未进行缺血-再灌注。实验实施例2:ckd评价1.高磷饮食开始后4周(16周龄)在高磷饮食开始后4周的肾脏组织学观察中,在苏木精-伊红(he)染色中观察到近端小管细胞对嗜酸性染料(伊红)的可染性降低,表明在线粒体发生了一些变化。在肾间质中未发现明显的纤维化;然而,观察到轻微程度的炎性细胞浸润。在生理观察中,观察到尿蛋白的增加;然而,未观察到血肌酐或磷的增加或肌酐清除率的降低。在通过后面描述的rna-seq分析进行的基因表达观察中,观察到纤维化标记物(collagen-1,tgf-1)和炎性标记物(il-1,mcp-1)的表达增强。2.高磷饮食开始后8周(20周龄)在高磷饮食开始后8周的肾脏的组织学观察中,观察到肾间质中的纤维化和细胞浸润,即肾纤维化。在生理观察中,观察到尿蛋白增加以及血肌酐、磷和fgf23增加;然而,肌酐清除率大幅增加,表明所谓的超滤状态。3.高磷饮食开始后12周(24周龄)在高磷饮食开始后12周,在高磷饮食开始后8周观察到的上述发现进一步发展。在一些示例中,在肾的皮质-髓质连接处及其周围观察到钙化。然而,老鼠都没有死亡。实施例1:多个器官的观察1.各个器官的采集在高磷饮食(在假组中的低磷饮食组)开始后1周(早期)和4周(中期)采集器官或组织(胰腺、颅骨、脑、垂体、肾、副肾(ag)、肝、脾、胸腺、心脏、肺、唾液腺(sg)、甲状腺(tg)、主动脉、骨骼肌(sm)、皮肤、睾丸、脂肪、眼睛、胃、空肠、回肠和结肠)。在麻醉下从眼眶采集血液后,通过颈脱位对从其采集器官或组织的动物实施安乐死,并采集器官和组织。在测量所采集的器官和组织的湿重后,将器官和组织在液氮中快速冷冻并在-80℃储存。2.rna分析(1)从各个组织提取rna将每种深冷保存的组织在trizolreagent(lifetechnologies)中用celldestroyerps1000(biomedicalscienceinc.)或pt10-35gtpolytron匀浆器(kineatica)单独均化。在室温下培养5分钟以分离蛋白质后,每ml的trizol加入0.2ml氯仿,并盖上管。随后,将混合物剧烈涡旋15秒。涡旋后,将混合物在室温下培养3分钟,并在4℃下以12,000g离心分离15分钟,并在新管中采集含rna的水层。向采集的水层中加入等量的70%乙醇并混合。然后,将700μl混合物施加到每个rneasymini柱(qiagen),并根据rneasymini试剂盒(qiagen)标准方案采集纯化的rna。通过1%琼脂糖电泳和nanodrop评价每种采集的rna的质量和浓度。(2)获取rna-seq数据使用上述测量样品通过macrogenjapancorp.的以下步骤获取rna-seq数据。i.质量检查基于以下项目进行样品的质量测试。·使用agilent2200tapestation系统进行浓度测量和质量检查ii.样品的制备使用500至1000ng的各个总rna样品制备用于测序的文库,所述样品以illumina的truseqrna样品制备试剂盒作为模板以如下方式根据标准方案通过质量测试。(a)使用oligo-dt珠,纯化poly(a)+rna(b)poly(a)+rna片段化(c)逆转录第二链cdna合成(d)终点修复和3′a添加(e)接头连接(adapterligation)注意:接头包含用于标识试样的索引标签。(f)pcr扩增(g)使用ampurexp珠,纯化和去除低分子量物质(<200bp)iii.使用下一代测序仪获取数据使用illuminahiseq4000下一代测序仪通过根据配对末端方法读取100个碱基,获取核苷酸序列数据。(3)rna-seq数据的分析(3-1)使用下一代测序仪获取的输出数据的分析对输出数据进行以下信息处理。i.碱基调用:从输出的分析原始数据(图像数据)获取核苷酸序列的文本数据。ii.过滤:通过预定过滤进行读取数据的选择。iii.基于索引序列的排序:基于索引信息对样品数据进行排序。(3-2)输出数据的二次分析使用illuminahiseq获取的数据文件(fastq格式)上传到下载到本地服务器的galaxy(https://usegalaxy.org/)。此后,使用bowtie2(http://bowtie-bio.sourceforge.net/bowtie2/index.shtml)进行分析以将每个序列映射到小鼠基因组图谱信息mm10。使用cufflinks(http://cole-trapnell-lab.github.io/cufflinks/)分析使用bowtie2所获取的bam文件以计算每个基因的fpkm(rpkm)。(3-3)结果通过将每个基因的rna表达水平(fpkm值)除以假组的小鼠中相应rna的表达水平(fpkm值)(下文中也称为“ckd/sham”)而计算数值。其中ckd/sham大于1或小于1的rna被分类为组2,其中ckd/sham大于1.5或小于0.67的rna被分类为组3,其中ckd/sham大于2或者小于0.5的rna被分类为组4,并且其中ckd/sham大于5或小于0.2的rna被分类为组5(图15)。所有小于1的fpkm值均被视为“1”。图16列出了其中sham>1且ckd/sham>5的基因,sham<1且ckd/sham>10的基因以及sham>10且ckd/sham<0.3的基因。特别地,图16中所示的基因被认为最能反映肾功能和磷摄入量的状态。特别是关于defb8,在高磷饮食中ckd/sham在皮肤中降低至0.2。关于defa24,在高磷饮食的早期,在胃中ckd/sham为2.5,而在中期阶段,在胃中ckd/sham为1.0。此外,关于defa24,在高磷饮食的中期阶段,在骨骼肌中ckd/sham为5.3,以及在睾丸中ckd/sham为4.5。在高磷饮食的早期,defb1、defb10、defb12、defb14、defb15、defb18、defb19、defb2、defb20、defb21、defb22、defb23、defb25、defb26、defb28、defb29、defb30、defb35、defb37、defb39、defb41、defb42、defb43、defb45、defb47和defb48的表达在脂肪组织中显著增加。同时,关于defb1、defb10、defb12、defb14、defb15、defb18、defb19、defb2、defb20、defb21、defb22、defb23、defb25、defb26、defb28、defb29、defb30、defb35、defb37、defb39、defb41、defb47和defb48,在高磷饮食的中期,在脂肪组织中ckd/sham为1.0。观察oscar显示出,在高磷饮食的早期和中期都显示出在颅骨中的表达增加。观察富含脯氨酸的蛋白质(prb1、prh1、prp2、prpmp5),在高磷饮食的早期和中期显示出唾液腺中的表达增加。观察spp1显示出在高磷饮食的早期和中期,在肺、颅骨、肾和心脏中的表达增加。观察dnase1显示出在高磷饮食的早期和中期,在唾液腺中表达增加并且在肾中表达降低。观察slc7a8显示出在高磷饮食的早期和中期均显示出在主动脉中的表达增加。关于anpep,在高磷饮食的早期,甲状腺中的表达观察到显著增加的表达(ckd/sham为28.3),但在中期阶段ckd/sham为4.0。关于hamp2,在高磷饮食的早期,在皮肤中观察到显著增加的表达(ckd/sham为46.1),但在中期阶段ckd/假为3.9。观察slco1a1显示出在高磷饮食的早期在肾和肝中表达降低。观察aplnr显示出在高磷饮食的早期和中期,在副肾、主动脉、肺、垂体、皮肤、颅骨、骨骼肌、脾、甲状腺、肾、心脏和脂肪组织中的表达降低。因此,认为这些基因的表达最好地反映了特别是肾功能和磷摄入量的状态。实施例2:在过量磷负荷的小鼠模型中prp的表达1.磷负荷小鼠模型的产生未经单侧肾切除术的小鼠(c57bl/6,7周龄,雄性)进食0.54%的含无机磷正常饮食(ce-2,cleajapan,inc.)持续1周。此后,作为低磷饮食,给予小鼠2%的含无机磷的高磷饮食(td.10662,orientalbioservice,inc.)作为高磷饮食或0.35%的含无机磷低磷饮食(td.10662改良型,orientalbioservice,inc.)。在每组中,n=10。2.分析唾液腺中富含脯氨酸蛋白(prp)的基因表达(1)组织的采集在小鼠中的高磷饮食或低磷饮食开始后1周(9周龄)和4周(12周龄)采集唾液腺和颅骨。关于唾液腺,分别单独采集下颌下腺、舌下腺、腮腺和周围结缔组织(包括淋巴结)。在通过腹膜内施用阿佛丁(250mg/kg)麻醉后,通过颈脱位使采集组织的动物安乐死,并采集组织。在测量所采集的组织的重量后,将组织在液氮中快速冷冻,并在-80℃下储存。(2)rna分析i.从每个组织中提取rna将每种深冷保存的组织在trizolreagent(lifetechnologies)中用celldestroyerps1000(biomedicalscienceinc.)单独匀浆。在室温下培养5分钟以分离蛋白质后,每ml的trizol加入0.2ml氯仿,并盖上管。随后,将混合物剧烈涡旋15秒。涡旋后,将混合物在室温下培养3分钟,并在4℃下以12000g离心分离15分钟,并在新管中采集含rna的水层。向采集的水层中加入等量的70%乙醇并混合。然后,将混合物施用到rneasymini柱(qiagen),并根据rneasymini试剂盒(qiagen)标准方案采集纯化的rna。通过1%琼脂糖电泳和nanodrop评价每种采集的rna的质量和浓度。ii.cdna合成和通过实时pcr量化相对表达水平将从各组织获取的1μg总rna用作cdna合成的模板,并根据superscriptiiifirst-strandsynthesissupermix(lifetechnologies)的标准方案使用oligodt20引物而合成cdna。用te缓冲液(10mmtris-hcl,ph8.0,0.1mmedta)将合成的cdna稀释20倍后,根据lightcycler480sybrgreenimaster(roche)的标准方案用lightcycler480ii(roche)进行实时pcr,以及测量了cp值。通过比较对于每个基因所获取的cp值与作为参照基因的用于β2-微球蛋白(b2m)或maea的cp值,每个基因与参照基因的相对表达水平(2-δcp)被量化。在每个唾液腺组织中检查prp基因(prp:prb1、prh1、prp2、prpmp5)的表达,并在颅骨中检查fgf23的表达。实时pcr中使用的引物对如表4所示。表4基因正向(seqidno)反向(seqidno)1b2mgctcggtgaccctggtcttt(1)aatgtgaggcgggtggaact(2)2maeaaagaccttgagtagttgccca(3)tgctcgatcctacgtttgcag(4)3prb1accccagcatggaaacaaag(5)aagaatggtattgaagtcatctgtc(6)4prh1accccgtgaagaaaatcagaa(7)taacaggcggtcttggttgg(8)5prp2tggtggtcctgtttacagtgg(9)ttctgaagttcttcacggggt(10)6prpmp5cctacgaagactcaaattctcagc(11)gaggaccatggtggtgtcc(12)(3)结果如图17所示,与进食低磷饮食(lowpi)的组中的腮腺中的prb1、prh1、prp2相比,进食高磷饮食(highpi)的组中的腮腺中的prb1(图17a)、prh1(图17b)、prp2(图17c)和prpmp5(图17d)的表达水平增加。实施例3:摄入高磷饮食的受试者中prp的表达(1)受试者根据以下入选标准选择受试者。i.能充分理解这个研究计划,能够自己同意的人ii.获取同意时年龄为20岁或更大的人但是,符合以下任一标准的人被排除在受试者之外。i.迄今为止有肾病史的人ii.有心血管风险因素的人(肥胖、高血压、糖尿病、吸烟)iii.被研究人员视为不适合作为受试者的人(2)高磷饮食摄取除了正常饮食外,还要求高磷饮食组(a组)摄取高磷饮食。正常饮食组(b组)是摄入正常饮食的受试者组;然而,正常饮食组被要求摄取尽可能少的富含磷的食品。a组和b组均被要求从第-7天开始尽可能避免摄入富含磷的食品(表5中列出的食品)。要求a组选择表6中所示的饮食模式之一,并从第1天到第7天摄取该饮食。b组被要求摄取正常饮食(尽可能避免摄取富含磷的食品)。表7示出饮食和唾液采集时间表。表5表6零食a:爆米花(seven&i),一袋(90g)零食b:巧克力棒(meiji牛奶巧克力),两根(116g)零食c:glicopucchinpurin*(布丁),67gx3(201g)星号(*)表示注册商标。表7(3)唾液样品的制备在第-1天、第1天、第3天、第5天和第7天用唾液收集辅助(sca)(salimetricsllc,carlsbad,ca)采集唾液。在测量之前将采集的唾液储存在冰箱中。唾液从受试者采集后被储存在冰箱中直至测量。在测量时,将深冷保存的唾液解冻,并将部分唾液转移至1.5ml管中,然后在4℃下以1000g离心分离15分钟。离心分离后,采集上清液,通过elisa量化通过将上清液在磷酸盐缓冲液(pbs)中稀释100至800倍(hprh2)或10000至80000倍(hprb1,hprb2)所获取的唾液样品中的prp。(4)elisa操作过程使用cloud-clonecorp.出售的elisa试剂盒(sed810hu(用于检测hprb1)、sed809hu(用于检测hprb2)、sed812hu(用于检测hprh2)),测量每个唾液样品中人prp的浓度。将100μl唾液样品或含有预定量的重组蛋白的校准曲线样品(随每个试剂盒提供)加入到随试剂盒提供的elisa板的每个孔中。将含有样品的板密封,然后在37℃下培养2小时。培养后,吸出每个孔中的样品并丢弃,并向每个孔中加入100μl的含有根据试剂盒操作流程制备的生物素标记的抗体的检测试剂a。将孔板密封,然后在37℃下培养1小时。培养后,吸出每个孔中的溶液并丢弃,每个孔用洗涤溶液洗涤三次。在彻底去除洗涤溶液后,向每个孔中加入100μl的含有根据试剂盒方案制备的酶标记的抗生物素蛋白的检测试剂b。将孔板密封,然后在37℃下培养30分钟。30分钟后,吸出每个孔中的溶液并丢弃,每个孔用洗涤溶液洗涤五次。彻底去除洗涤溶液后,向每个孔中加入90μl随试剂盒提供的底物溶液。将板密封,然后在37℃下培养20分钟(hprb1,hprb2)或40分钟(prh2)。此后,向每个孔中加入50μl随试剂盒提供的反应终止溶液,并用吸光度酶标仪(multiskango,thermofisherscientificinc.)测量450nm处的吸光度。通过使用试剂盒提供的每种重组蛋白制备校准曲线,计算每种蛋白质的浓度,即唾液中每种prp的浓度。(5)结果图18示出组a和组b中在测试最后一天(第7天)唾液中hprb1浓度除以测试开始前一天(第-1天)中唾液中hprb1浓度的比值(hprb1day7/day-1比值)。从摄取的饮食计算磷摄入量。图18中的“磷摄入量比”是高磷饮食(或正常饮食)摄取试验开始后7天的总磷摄入量除以高磷饮食(或正常饮食)摄取试验开始前7天的总磷摄入量的比率。在显示高磷摄入比的受试者(摄取高磷饮食的受试者)中,唾液中hprb1的量增加。这表明prp反映了肾功能和磷摄入量。实施例4:患有肾病的患者中prp的表达(1)受试者根据以下入选标准选择受试者。i.患者被诊断为慢性肾病或糖尿病性肾病关于慢性肾病,处于gfr类别g3至g5的患者关于糖尿病性肾病,处于临床阶段1至3的患者患有多发性骨髓瘤并具有肾病风险的患者替代地,健康受试者(包括具有生活方式相关疾病风险的受试者)ii.能充分理解这个研究计划,能够自己同意的人iii.获取同意时年龄为20岁或更大的人但是,符合以下任一标准的人被排除在受试者之外。i.被研究人员视为不适合作为受试者的人ii.hb抗原阳性的人,hcv抗体阳性的人iii.受试者正在进行透析表8示出被诊断为慢性肾病或糖尿病性肾病的受试者的临床数据。表8ckd:慢性肾病,mm:多发性骨髓瘤,mds:骨髓增生异常综合征,ml:恶性淋巴瘤(2)hprb1的测量根据实施例3(3)和(4)的方法测量每个受试者的唾液中hprb1的浓度。使用学生t检验进行统计学分析。(3)结果如图19所示,被诊断为慢性肾病或被诊断为具有多发性骨髓瘤且具有肾病风险的受试者(患者)的唾液中hprb1的浓度高于健康受试者(对照受试者)的唾液中hprb1的浓度(p=1.3×10-6)。这表明prp可用作肾功能预测标记物。实施例5:摄入高磷饮食的受试者(2)中prp的表达从实施例3(1)的受试者采集的唾液中的蛋白质用蛋白水解酶分解,并测量脯氨酸的浓度以检查脯氨酸浓度是否与高磷饮食相关。(1)唾液中蛋白质的分解和分解产物的衍生化在深冷保存的唾液被解冻后,将700μl唾液转移到1.5ml管中,在4℃下以1000×g离心分离15分钟,采集上清液。用199.5μl消化缓冲液(0.1mtris-hcl(ph7.5),0.5%sds)将10.5μl唾液上清液稀释20倍。将100μl稀释的唾液上清液转移至1.5ml管中。将20μl链霉蛋白酶(10μg/ml)加入到100μl稀释的唾液上清液中,用铝箔包裹管,然后在室温下反应1小时。每ml色谱级甲醇加入1.5μl的2-异丙基苹果酸(内标),制备所需量的得到的溶液。随后,将500μl含有2-异丙基苹果酸的甲醇溶液加入到链霉蛋白酶反应混合物中,并通过涡旋搅拌混合物30秒用于自旋减慢。将混合物在室温下放置5分钟后,加入200μl超纯水,通过涡旋搅拌混合物30秒,并在4℃下以4600×g离心分离5分钟。将400μl第一上清液从离心分离管转移至另一个1.5ml管。向第一上清液中加入200μl超纯水,通过涡旋搅拌混合物30秒,并在4℃下以4600×g离心分离5分钟。将400μl第二上清液从离心分离管转移至超滤单元杯(亲水性ptfe膜,0.2μm;millipore),并在4℃下以9100×g离心分离15分钟。将滤液在65℃下减压干燥1小时30分钟。干燥后,向剩余物中加入50μl含有20mg/ml甲氧基胺盐酸盐的吡啶溶液,并将混合物用振动器在37℃下振动90分钟。此后,进一步加入50μl的n-甲基-n-三甲基甲硅烷基三氟乙酰胺(mstfa),并将混合物用振动器在37℃下振动30分钟,并进行三甲基甲硅烷基化。(2)gcms测量gcms-tq8030(shimadzucorporation)用于gcms,db-5(30m×0.25mm(内径)×1.00μm(膜厚))(agilenttechnologies)用作gc的毛细管柱。gc在以下升温条件下进行:温度以4℃/min的速率从100℃升至320℃。注入口温度为280℃。氦气用作载气,并以39.0cm/s的速度流动。电子电离的能量为150ev,离子源温度为200℃,以mrm模式测量脯氨酸-2tms{142.10/73.0}和2-异丙基苹果酸{216.10/147.10}。注入1μl试样,使用不分流模式,并在1.50kv的检测器电压下进行测量。(3)gcms数据分析使用gcms方案版本4.2的数据分析软件和gcms代谢物数据库(shimadzucorporation)进行分析。制备以下六个点处的稀释系列的纯化脯氨酸:0.02、0.01、0.005、0.0005、0.00005和0.000005(nmol/μl),并通过使用已知浓度的脯氨酸制备校准曲线。通过将脯氨酸的峰面积除以内标(2-异丙基苹果酸)的峰面积以获取比值,并将该比值应用于校准曲线来确定脯氨酸的浓度。(4)量化结果如图20所示,与摄入正常饮食(低pi)的组中的脯氨酸浓度相比,摄入高磷饮食7天(highpi)的组中脯氨酸浓度增加。这表明通过分解唾液中的蛋白质并测量分解液中脯氨酸的浓度可以预测肾功能和磷摄入量。附图标记物的描述1-5计算装置6输入单元7显示单元8测量装置8a测量装置8b测量装置9测试盒11肾病标记物值获取单元12受试者识别单元13测量值获取单元14肾功能评价单元21肾病标记物值获取单元22受试者识别单元23测量值获取单元24磷摄入量估算单元25肾功能降低风险预测单元31肾病标记物值获取单元32受试者识别单元33测量值获取单元34并发症发展预测单元41肾病标记物值获取单元42受试者识别单元43第一测量值获取单元44第二测量值获取单元45并发症发展预测单元51肾病标记物值获取单元52受试者识别单元53第一测量值获取单元54第二测量值获取单元55膳食疗法效果确定单元82反应/电泳单元83检测单元84分析单元91a,91b容器92微板93附件94外箱100系统101cpu102存储器103存储单元104总线105接口单元109存储介质当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1