可用于治疗代谢病症的化合物的制作方法
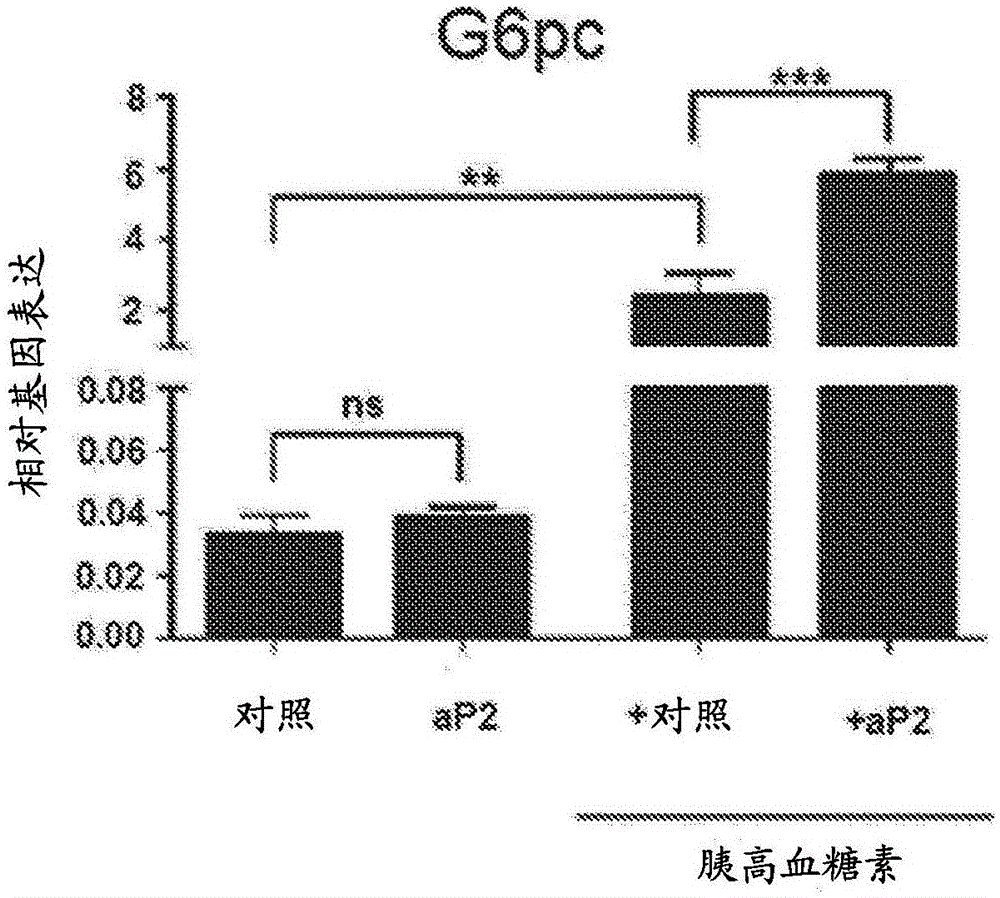
本发明是在美国国立卫生研究院授予的合同号dk064360和dk097145下由美国政府支持完成的。美国政府拥有本发明的某些权利。相关申请的交叉引用本申请要求2016年6月27日提交的临时美国申请第62/355,175号的权益。出于所有目的,该临时申请的全部内容在此通过引用并入。通过引用并入2017年6月27日创建并且大小为61kb的名称为“15020-017wo1_seqid_txt_st25"的文本文件的内容在此通过引用整体并入。发明领域本发明提供鉴定可用于抑制异常或失调的肝葡萄糖产生的化合物的化合物和方法,所述异常或失调的肝葡萄糖产生导致血糖水平升高和相关的代谢病症。发明背景肥胖以脂肪组织扩张为特征,增加了一系列疾病的风险,包括2型糖尿病(t2d)、非酒精性脂肪肝病(nafld)和血脂异常,这又增加了心血管疾病(cvd)的死亡率(prospectivestudiescollaboration,(2009)thelancet373,1083-1096;shimomura等,(2000)molecularcell6,77-86)。肥胖是导致脂肪组织质量过多积累的食欲调节和/或代谢的复杂医学病症。肥胖是一个重要的临床问题,并且正在成为西方文化中的流行病,影响超过三分之一的美国成年人口。据估计,美国有9700万成年人超重或肥胖。肥胖还与过早死亡以及中风、心肌梗塞、充血性心力衰竭、冠心病和猝死的发病率和死亡率的显著增加相关。肥胖症治疗的主要目标是减轻过重的体重,改善或预防肥胖相关的发病率和死亡率,并保持长期体重减轻。糖尿病是其中身体产生或响应激素胰岛素的能力受损,导致碳水化合物的异常代谢以及血液和尿液中葡萄糖水平升高的疾病。胰岛素是一种调节葡萄糖进入细胞的运动的激素。存在两种不同类型的糖尿病。对于1型糖尿病(t1d),胰腺不产生或几乎不产生胰岛素。约有125万美国人患有t1d,估计每年有40,000人被新诊断出来。2型糖尿病(t2d),也称为非胰岛素依赖性糖尿病,是一种影响身体代谢葡萄糖的方式的慢性病。对于2型糖尿病,身体要么抵抗胰岛素的作用,要么不能产生足够的胰岛素来维持正常的葡萄糖水平。没有足够的胰岛素,血液中的葡萄糖水平保持很高。大约2790万美国人,或9.3%的人口,患有t2d。2010年,糖尿病仍然是美国第七大年度死亡原因,其中69,071份死亡证明书将其列为死亡的潜在原因,共有234,051份死亡证明书将糖尿病列为死亡的潜在或促进原因。糖尿病的并发症和合并症(co-morbidities)包括低血糖症、高血糖症、高血压、血脂异常、心血管疾病(cvd)、心肌梗塞、中风、失明和视网膜病、肾病和截肢。低血糖症和高血糖症都可对人和其他哺乳动物造成伤害。人体已经产生了大量的激素反应,从而以维持身体的关键功能的方式对抗低血糖症,诸如只利用葡萄糖的大脑(tesfayen,seaquister.neuroendocrineresponsestohypoglycemia.annnyacadsci.2010nov;1212:12-28;martyn,dallaportam,thorensb.brainglucosesensing,counterregulation,andenergyhomeostasis.physiology.2007aug1;22(4):241-251;eiglern,saccàl,sherwinrs.synergisticinteractionsofphysiologicincrementsofglucagon,epinephrine,andcortisolinthedog.journalofclinicalinvestigation.1979jan1;63(1):114-123)。这些激素(例如胰高血糖素)的失调的分泌会显著促成与血糖水平过高相关的代谢异常(ungerrh,cherringtonad.glucagonocentricrestructuringofdiabetes:apathophysiologicandtherapeuticmakeover.jclininvest.2012jan3;122(1):4-12)。高血糖症(如对于糖尿病的发展可看到的)可导致严重的并发症,包括肾脏损伤、神经损伤、心血管损伤以及对视网膜的损伤或对脚和腿的损伤。糖尿病性神经病变可以是长期高血糖症的结果。与血糖水平过高相关的其他并发症包括多食症(常常饥饿,特别是明显的饥饿)、烦渴(经常口渴,尤其是过度口渴)、多尿症(排尿量增加(非排尿频率增加))、视力模糊、疲劳、伤口愈合不良或受损(割伤、擦伤等)、脚部或足跟的麻刺感、勃起功能障碍、反复感染、心律失常、空腹血糖受损、葡萄糖耐量降低、血脂异常、肥胖、肾病、视网膜病变、白内障、中风、动脉粥样硬化、糖尿病酮症酸中毒、高血糖高渗综合征、围手术期高血糖症、重症监护病房患者的高血糖症、胰岛素抵抗综合征和代谢综合征。目前用于过量血糖水平(包括慢性高血糖症)的治疗方式旨在通过适当饮食、定期运动和胰岛素或其他药物(诸如二甲双胍)的组合将血糖维持在尽可能接近正常的水平。然而,尽管采用这些方式,与血糖水平过高相关的疾病仍然是全球主要的健康问题。非酒精性脂肪肝病(nafld),包括其更具侵袭性形式非酒精性脂肪性肝炎(nash),与肥胖流行病同时也在流行病比例上增加(sowers等,(2011)cardiorenalmed.1:5-12)。肥胖和nafld的急剧上升似乎部分归因于消费含有大量脂肪和糖(例如,蔗糖或果糖)的西方饮食(wd),因为美国的果糖消费在过去30年中增加了一倍多(barrera等,(2014)clin.liverdis.18:91-112)。nafld的特征在于肝脏的大泡性脂肪变性,其在几乎不饮酒的个体中发生。nafld的组织学谱包括单独的脂肪变性、脂肪肝和炎症的存在。nash是一种更为严重的慢性肝病,其特征是肝脏中过多的脂肪堆积,由于仍未完全了解的原因,诱发慢性炎症,导致进行性纤维化,所述进行性纤维化可导致肝硬化、肝细胞癌,最终导致肝功能衰竭和死亡(brunt等,(1999)am.j.gastroenterol.,94:2467-2474;brunt等,(2001)semin.kiverdis.,21:3-16;takahashietal.,(2012)worldj.gastroenterol.,18:2300-2308)。尽管nash已经变得越来越普遍,现在影响了2-5%的美国人和在全球影响2-3%的人(neuschwander-tetri等,(2005)am.j.med.sci.,330:326-3350),但其根本原因尚不清楚。其最常在中年、超重或肥胖的人中发生。许多患有nash的受试者具有升高的血脂(例如,胆固醇和甘油三酯)、高胰岛素血症、胰岛素抗性,并且许多患有糖尿病或前驱糖尿病。并非每个肥胖者或每个糖尿病患者都患有nash。此外,一些患有nash的受试者不肥胖,没有糖尿病,并且具有正常的血液胆固醇和脂质。nash可以在没有任何明显风险因素的情况下发生,甚至可以在儿童中发生。因此,nash不仅仅是由肥胖引起的。目前,尚无针对nash的特定疗法。对这种疾病患者最重要的建议是有氧运动、饮食和饮食行为的操控,以及减轻体重。虽然有了持续的进步,但仍然存在对肥胖及其医疗后果背后的分子机制以及用于其治疗的新方法进行更多研究的未满足的需要。类似地,仍然迫切需要鉴定在糖尿病和非糖尿病受试者中治疗和预防nafld的新化合物和方法。本发明的一个目的是鉴定治疗血液中升高的葡萄糖水平的新化合物及其用途和组合物,所述血液中升高的葡萄糖水平导致肥胖、非酒精性脂肪性肝病(nafld)、非酒精性脂肪性肝炎(nash)和糖尿病(i型和ii型)。技术实现要素:本发明基于以下令人惊讶的发现:胰高血糖素通过其中胰高血糖素与脂肪细胞型脂肪酸结合蛋白(ap2)缔合的复合物表现其对胰高血糖素受体(gcgr)的活性。如本文中首次描述的,已经发现循环ap2是胰高血糖素的专性结合配偶体,支持肝脏中与葡萄糖代谢相关的作用。该蛋白质复合物的发现为调节葡萄糖代谢病症提供了新的治疗途径。如本文中首次描述的,循环ap2在细胞培养模型和体内均通过胰高血糖素g蛋白偶联受体增强胰高血糖素的作用,其中胰高血糖素/ap2复合物与胰高血糖素受体的结合导致腺苷酸环化酶的活化,这增加细胞内camp,增加糖原分解,以及增加糖异生酶(包括磷酸烯醇式丙酮酸羧激酶(pepck)、果糖-1,6-二磷酸酶(fbpase-1)和葡萄糖-6-磷酸酶(g-6-pase))的表达。另外,胰高血糖素信号传导激活糖原磷酸化酶并抑制糖原合酶。这导致肝葡萄糖产生和血糖水平升高。基于这一令人惊讶的发现,本文提供了鉴定化合物的方法,所述化合物中和胰高血糖素受体激动剂(与其专性结合配偶体脂肪细胞脂质结合蛋白(ap2)复合的胰高血糖素)激动胰高血糖素受体信号传导的能力。本文还提供了使用所鉴定的化合物通过抑制胰高血糖素受体激动剂(与其专性结合配偶体脂肪细胞脂质结合蛋白(ap2)复合的胰高血糖素)结合并激动胰高血糖素受体来治疗与失调或异常的肝葡萄糖产生和血糖水平升高相关的病症的方法。由于胰高血糖素/ap2复合物的这种基本发现,鉴定和设计了能够中和胰高血糖素/ap2蛋白复合物活性的化合物,例如优先与胰高血糖素/ap2复合物结合的抗体。在一个实施方案中,所述抗体相对于单独的ap2或胰高血糖素选择性地与胰高血糖素/ap2复合物结合。在一个实施方案中,抗体不与gcgr结合。此类抗体可用于治疗由胰高血糖素/ap2对胰高血糖素受体的激动作用介导的疾病。在本发明的第一方面,提供了鉴定能够结合胰高血糖素/脂肪细胞结合蛋白复合物(胰高血糖素/ap2)的化合物的方法,其包括:i.使所述化合物与和ap2复合的胰高血糖素(胰高血糖素/ap2)接触;和ii.确定所述化合物是否与胰高血糖素/ap2结合。在一个实施方案中,在不存在细胞的情况下在体外进行测定。该方法还可包括将化合物引入到利用ap2和胰高血糖素,或胰高血糖素/ap2,以及gcgr的测定中,并且确定胰高血糖素/ap2是否与gcgr结合,其中胰高血糖素/ap2与gcgr的非结合指示能够中和胰高血糖素/ap2对gcgr的激动作用的化合物。在另一个实施方案中,该方法包括在ap2和胰高血糖素和/或胰高血糖素/ap2存在的情况下将化合物引入细胞测定中,其中细胞测定包括表达gcgr的细胞群,并测量gcgr的生物活性。在一个实施方案中,表达gcgr的细胞群是肝细胞。在一个实施方案中,表达gcgr的细胞群是人细胞。在一个实施方案中,表达gcgr的细胞群是人肝细胞。在一个实施方案中,进一步对化合物进行竞争性结合测定以鉴定相对于ap2和/或胰高血糖素优先与胰高血糖素/ap2复合物结合的化合物。在本发明的第二方面,提供了鉴定能够中和胰高血糖素/ap2对gcgr的激动作用的化合物的方法,其包括:i.使化合物与ap2和胰高血糖素,和/或胰高血糖素与ap2的复合物(胰高血糖素/ap2)接触;ii.确定该化合物是否与ap2、胰高血糖素或胰高血糖素/ap2结合;iii.将化合物引入利用ap2和胰高血糖素,或胰高血糖素/ap2,以及gcgr的测定中,以及,iv.确定胰高血糖素/ap2是否与gcgr结合,其中无胰高血糖素/ap2与gcgr的结合指示能够中和胰高血糖素/ap2对gcgr的激动作用的化合物。在一个实施方案中,在不存在细胞的情况下在体外进行测定。该方法还可包括在ap2和胰高血糖素和/或胰高血糖素/ap2存在的情况下将化合物引入细胞测定中,其中细胞测定包括表达gcgr的细胞群,并测量gcgr的生物活性。在一个实施方案中,表达gcgr的细胞群是肝细胞。在一个实施方案中,表达gcgr的细胞群是人细胞。在一个实施方案中,表达gcgr的细胞群是人肝细胞。在一个实施方案中,进一步对化合物进行竞争性结合测定,以鉴定相对于ap2和/或胰高血糖素优先与胰高血糖素/ap2复合物结合的化合物。在本发明的第三方面,本文提供了鉴定能够中和胰高血糖素/ap2对gcgr的激动作用的化合物的方法,其包括:i.在化合物存在的情况下使ap2和胰高血糖素,和/或胰高血糖素/ap2与gcgr接触;ii.在化合物不存在的情况下使ap2和胰高血糖素,和/或胰高血糖素/ap2与gcgr接触;以及,iii.将在化合物存在的情况下与gcgr结合的胰高血糖素/ap2的量与该化合物不存在的情况下与gcgr结合的胰高血糖素/ap2的量进行比较;其中在化合物存在的情况下与gcgr结合的胰高血糖素/ap2的量减少表明能够中和gcgr激动作用的化合物。在一个实施方案中,在不存在细胞的情况下在体外进行测定。在一个实施方案中,进一步对化合物进行竞争性结合测定以鉴定相对于ap2和/或胰高血糖素优先与胰高血糖素/ap2复合物结合的化合物。测量或鉴定化合物与胰高血糖素/ap2的结合或胰高血糖素/ap2与gcgr的结合的方法不限于所述的说明性实施方案。可使用的方法的实例在本文和下面提供的实施例中进一步描述,并且包括利用ap2与生物素化的胰高血糖素的直接相互作用的生物层干涉测量法(参见实施例1;图3a)、闪烁迫近测定法,其中125i-胰高血糖素与生物素化的ap2相互作用(参见实施例1;图3b)、等温滴定量热法,其测量溶液中结合事件释放的热量(参见实施例1;图3c)和微型热泳(参见实施例1和图4a-d)。在本发明的第四方面,本文提供了鉴定能够中和胰高血糖素/ap2对gcgr的激动作用的化合物的方法,其包括:i.将ap2和胰高血糖素,和/或胰高血糖素/ap2引入包含表达gcgr的细胞的第一细胞测定中;ii.在第一细胞试验中测定细胞中gcgr的生物活性;iii.将ap2和胰高血糖素,和/或胰高血糖素/ap2引入包含表达gcgr的细胞的第二细胞测定中,其中在化合物存在的情况下引入ap2和胰高血糖素和/或胰高血糖素/ap2,iv.在第二细胞测定中测定细胞中gcgr的生物活性;以及,v.将第一细胞测定中gcgr的生物活性与第二细胞测定中gcgr的生物活性进行比较,其中与第一细胞测定中的gcgr生物活性相比,第二细胞测定中gcgr生物活性的降低表明中和胰高血糖素/ap2对gcgr的激动作用的化合物。在一个实施方案中,细胞群包含肝细胞。在一个实施方案中,细胞群包含人细胞。在一个实施方案中,细胞群包含人肝细胞。在一个实施方案中,进一步对化合物进行竞争性结合测定以鉴定相对于ap2和/或胰高血糖素优先与胰高血糖素/ap2复合物结合的化合物。在本发明的第五方面,本文提供了鉴定能够中和胰高血糖素/ap2对gcgr的激动作用的化合物的方法,其包括:i.在ap2和胰高血糖素和/或胰高血糖素/ap2和包含表达gcgr的细胞的细胞群存在的情况下将化合物引入第一细胞测定中,其中所述化合物以固定浓度存在,并且其中ap2和胰高血糖素和/或胰高血糖素/ap2以非饱和浓度存在;ii.在第一细胞测定中测定细胞群中gcgr的生物活性;iii.在ap2、胰高血糖素和/或胰高血糖素/ap2以及包含表达gcgr的细胞的细胞群存在的情况下将化合物引入第二细胞测定中,其中所述化合物以固定浓度存在,并且其中ap2和胰高血糖素,和/或胰高血糖素/ap2以饱和浓度存在;iv.在第二细胞测定中测定细胞群中gcgr的生物活性;以及,v.将第一细胞测定中gcgr的生物活性与第二细胞测定中gcgr的生物活性进行比较,其中第一细胞测定中gcgr生物活性的降低大于第二细胞测定中gcgr生物活性的降低表明中和胰高血糖素/ap2对gcgr的激动作用的化合物。在一个实施方案中,细胞群包含肝细胞。在一个实施方案中,细胞群包含人细胞。在一个实施方案中,细胞群包含人肝细胞。在本发明的第六方面,本文提供了鉴定能够中和胰高血糖素/ap2对gcgr的激动作用的化合物的方法,其包括:i.在ap2和胰高血糖素和/或胰高血糖素与ap2的复合物(胰高血糖素/ap2)和包含表达gcgr的细胞的细胞群存在的情况下将化合物引入第一细胞测定中,其中所述化合物以固定浓度存在,并且其中ap2和胰高血糖素和/或胰高血糖素/ap2以第一浓度存在;ii.在第一细胞测定中测定细胞群中gcgr的生物活性;iii.在ap2和胰高血糖素和/或胰高血糖素与ap2的复合物(胰高血糖素/ap2)和包含表达gcgr的细胞的细胞群存在的情况下将化合物引入一系列额外的细胞测定中,其中所述一系列额外的细胞测定包含以固定浓度存在的化合物和相较于第一细胞测定以连续递增的浓度存在的ap2、胰高血糖素和/或胰高血糖素/ap2;iv.在所述一系列额外的细胞测定中测定细胞群中gcgr的生物活性;以及,v.将第一细胞测定中的gcgr生物学活性与所述一系列额外细胞测定中的gcgr生物活性进行比较,其中第一细胞测定中gcgr生物学活性的降低大于所述一系列额外的细胞测定中gcgr生物学活性的降低表明中和胰高血糖素/ap2对gcgr的激动作用的化合物。在一个实施方案中,细胞群包含肝细胞。在一个实施方案中,细胞群包含人细胞。在一个实施方案中,细胞群包含人肝细胞。在第七方面,本文提供鉴定能够中和胰高血糖素/ap2对gcgr的激动作用的化合物的方法,其包括:i.使化合物与ap2接触;以及,ii.确定所述化合物是否在seq.idno.1或2的氨基酸phe58、asn60、glu62和/或lys80处与ap2结合;其中化合物在seq.idno.1或no.2的氨基酸phe58、asn60、glu62和/或lys80处与ap2结合表明能够中和胰高血糖素/ap2对gcgr的激动作用的化合物。在一个实施方案中,在不存在细胞的情况下在体外进行所述测定。在一个实施方案中,该方法还包括在ap2和胰高血糖素和/或胰高血糖素/ap2存在的情况下将化合物引入细胞测定中,其中细胞测定包括表达gcgr的细胞群,并测量gcgr的生物活性。在一个实施方案中,表达gcgr的细胞群是肝细胞。在一个实施方案中,表达gcgr的细胞群是人细胞。在一个实施方案中,表达gcgr的细胞群是人肝细胞。在第八方面,本文提供了鉴定能够中和胰高血糖素/ap2对gcgr的激动作用的化合物的方法,其包括:i.使化合物与胰高血糖素接触;以及,ii.确定所述化合物是否在seq.idno.82的氨基酸phe22、val23、gln24、trp25、leu26、met27、asn28和/或thr29处与胰高血糖素结合;其中所述化合物在seq.idno.82的氨基酸phe22、val23、gln24、trp25、leu26、met27、asn28和/或thr29处与ap2结合表示能够中和胰高血糖素/ap2对gcgr的激动作用的化合物。在一个实施方案中,在不存在细胞的情况下在体外进行所述测定。在一个实施方案中,该方法还包括在ap2和胰高血糖素和/或胰高血糖素/ap2存在的情况下将化合物引入细胞测定中,其中细胞测定包括表达gcgr的细胞群,并测量gcgr的生物活性。在一个实施方案中,表达gcgr的细胞群是肝细胞。在一个实施方案中,表达gcgr的细胞群是人细胞。在一个实施方案中,表达gcgr的细胞群是人肝细胞。在本发明的第九方面,本文提供了在受试者中中和胰高血糖素/ap2对gcgr的激动作用的方法,其包括向受试者施用化合物,包括但不限于中和胰高血糖素/ap2结合gcgr的能力的抗体。在一个实施方案中,该化合物通过在seq.idno.1或no.2的氨基酸phe58、asn60、glu62和/或lys80处与ap2结合来中和胰高血糖素与ap2形成复合物从而与gcgr结合的能力。在一个实施方案中,该化合物通过在seq.idno.82的氨基酸phe22、val23、gln24、trp25、leu26、met27、asn28和/或thr29处与胰高血糖素结合来中和胰高血糖素与ap2形成复合物、从而与gcgr结合的能力。在本发明的第十方面,本文提供了在受试者中中和胰高血糖素/ap2对gcgr的激动作用的方法,其包括向受试者施用化合物,包括但不限于抑制胰高血糖素/ap2形成的能力的抗体。在一个实施方案中,化合物通过相对于ap2和/或胰高血糖素优先与胰高血糖素/ap2复合物结合来中和胰高血糖素/ap2与gcgr结合的能力。在本发明的第十一方面,本文提供了抑制受试者中肝葡萄糖产生的方法,其包括向受试者施用化合物,包括但不限于中和胰高血糖素/ap2激动gcgr的能力的抗体,其中所述化合物不直接与gcgr结合。在一个实施方案中,化合物相对于ap2和/或胰高血糖素优先与胰高血糖素/ap2复合物结合。在一个实施方案中,化合物不结合gcgr。在本发明的第十二方面,本文提供了抑制受试者的肝脏选择性胰岛素抗性的方法,其包括向受试者施用化合物,包括但不限于中和胰高血糖素/ap2激动gcgr的能力的抗体,其中所述化合物不直接与gcgr结合。在一个实施方案中,所述化合物相对于ap2和/或胰高血糖素优先与胰高血糖素/ap2复合物结合。在一个实施方案中,所述化合物不结合gcgr。在本发明的第十三方面,本文提供了治疗患有由肝葡萄糖产生失调介导的病症的受试者的方法,其包括向受试者施用化合物,包括但不限于中和胰高血糖素/ap2激动gcgr的能力的抗体,其中所述化合物不直接与gcgr结合。在一个实施方案中,所述化合物相对于ap2优先结合胰高血糖素/ap2复合物。在一个实施方案中,所述化合物不直接与ap2和/或胰高血糖素结合,但优先与胰高血糖素/ap2复合物结合。当向有此需要的宿主施用时,使用能够靶向胰高血糖素/ap2复合物与gcgr的相互作用的化合物可降低肝葡萄糖的产生并降低血糖,从而改善葡萄糖谱。在一个实施方案中,由肝葡萄糖产生失调介导的病症选自饮食诱导的肥胖症、糖尿病(1型和2型)、高血糖症、糖尿病酮症酸中毒、高血糖高渗综合征、心血管疾病、糖尿病肾病或肾衰竭、糖尿病视网膜病变、空腹血糖受损、葡萄糖耐量降低、血脂异常、肥胖、白内障、中风、动脉粥样硬化、伤口愈合受损、围手术期高血糖症、重症监护病房患者高血糖症、胰岛素抵抗综合征、代谢综合征、纤维化,包括肺和肝纤维化以及非酒精性脂肪肝病(nafld),包括非酒精性脂肪性肝炎(nash)。在一个实施方案中,所述病症选自饮食诱导的肥胖症、ii型糖尿病和非酒精性脂肪肝病(nafld)。在一个实施方案中,所述病症选自肝细胞癌、肝硬化、胰高血糖素瘤和坏死性迁移性红斑(nme)。在本发明的第十四方面,本文提供了治疗患有由肝脏选择性胰岛素抗性介导的病症的受试者的方法,其包括向受试者施用化合物,包括但不限于中和胰高血糖素/ap2激动gcgr的能力的抗体,其中所述化合物不直接与gcgr结合。在一个实施方案中,所述化合物相对于ap2优先结合胰高血糖素/ap2复合物。在一个实施方案中,所述化合物不直接与ap2和/或胰高血糖素结合,但优先与胰高血糖素/ap2复合物结合。在一个实施方案中,所述病症是ii型-糖尿病。在本发明的第十五方面,本文提供了降低受试者中葡萄糖血液水平的方法,其包括向受试者施用化合物,包括但不限于中和胰高血糖素/ap2激动gcgr的能力的抗体,其中所述化合物不直接与gcgr结合。在一个实施方案中,所述化合物相对于ap2优先与胰高血糖素/ap2复合物结合。在一个实施方案中,所述化合物不结合gcgr。在一个实施方案中,抗体、试剂或片段是ap2的松散结合剂,例如kd大于10-7m。在各种实施方案中,能够中和胰高血糖素/ap2对gcgr的激动作用的化合物通过以下一种或多种方式起作用:(i)以通常会引起导致增加的细胞内camp的细胞内信号传导的方式阻止或降低胰高血糖素与胰高血糖素g蛋白偶联受体的结合;(ii)以通常会引起导致增加的细胞内camp的细胞内信号传导的方式阻止或减少ap2与胰高血糖素g蛋白偶联受体的结合;(iii)阻止或降低胰高血糖素/ap2蛋白复合物与受体结合并激活下游信号传导的能力;(iv)阻止或减少ap2与胰高血糖素g蛋白偶联受体的变构结合并改变受体的三维构象,使得胰高血糖素不能与受体结合,胰高血糖素受体结合减少,或者结合以阻止有效的细胞内camp信号传导的方式改变;(v)以阻止有效的受体介导的细胞内camp信号传导的方式阻止或减少胰高血糖素与胰高血糖素/ap2g偶联受体复合物的结合;(vi)以阻止有效的受体介导的细胞内camp信号传导的方式阻止或干扰胰高血糖素/ap2复合物的形成;和/或(vii)通过诱导构象变化来修饰胰高血糖素/ap2蛋白复合物,所述构象变化阻止胰高血糖素/ap2复合物有效结合胰高血糖素受体。上述任何一种或其组合在本文中被称为“胰高血糖素/ap2复合物介导的胰高血糖素受体活性破坏”。在一个实施方案中,该化合物不结合gcgr。能够中和胰高血糖素/ap2对gcgr的激动作用的化合物可以是阻止胰高血糖素/ap2与gcgr结合或破坏胰高血糖素/ap2激动gcgr的能力,导致gcgr生物活性的降低的任何化合物。gcgr生物活性通常是指由gcgr与其激动性结合配偶体胰高血糖素/ap2之间的相互作用产生的任何可观察到的作用。所述生物活性可以是胰高血糖素/ap2与gcgr的结合,gcgr介导的细胞内信号转导的检测;或终点生理效应的确定。在胰高血糖素/ap2的激动刺激后gcgr生物活性的代表性但非限制性的实例包括但不限于本文讨论的信号传导和过程的调节,例如,环腺苷-磷酸形成的抑制,肝葡萄糖生成减少,糖原分解减少,以及葡萄糖异生酶(包括磷酸烯醇式丙酮酸羧激酶(pepck)、果糖-1,6-二磷酸酶(fbpase-1)和葡萄糖-6-磷酸酶(g-6-pase))表达减少。另外,胰高血糖素信号传导激活糖原磷酸化酶并抑制糖原合酶。在一个实施方案中,化合物是小分子、配体、抗体、抗原结合剂或抗体片段,其结合ap2、胰高血糖素和/或胰高血糖素/ap2并中和胰高血糖素/ap2激动gcgr的能力。在一个实施方案中,化合物不直接结合ap2和/或胰高血糖素,但优先结合胰高血糖素/ap2复合物。检测gcgr生物活性的测定的实例在下面的实施例中进一步举例说明,包括与减少的葡萄糖异生酶(包括磷酸烯醇式丙酮酸羧激酶(pepck)、果糖-1,6-二磷酸酶(fbpase-1)和葡萄糖-6-磷酸酶(g-6-pase)(参见实施例1;图1a和1b;图2a、2c和2d))表达,减少的肝葡萄糖产生(参见实施例1;图1c),减少的糖原分解(参见实施例1;图1d),和环amp形成的抑制(参见实施例1;图1e和1f)相关的测定。这种脂肪组织-胰腺-肝脏轴对于治疗与异常胰高血糖素活性或失调的胰高血糖素信号传导相关的病况(例如失调的肝葡萄糖产生和升高的血糖水平,例如对于诸如糖尿病的病症所见的)具有重要意义。通过靶向胰高血糖素/ap2蛋白复合物,已经发现可以调节胰高血糖素对胰高血糖素受体的激活,可以抑制肝葡萄糖产生,并且在肥胖和糖尿病的小鼠模型中使血糖水平正常化。此外,通过减少肝葡萄糖的产生,胰岛素的反调节作用进一步提高。在一个实施方案中,通过向受试者施用靶向循环胰高血糖素/ap2蛋白复合物的抗体、抗原结合剂或抗体结合片段,使胰高血糖素/ap2蛋白复合物被抗体或抗原结合剂(诸如抗体片段)结合,以降低受试者(优选人)中的过量血糖水平。在一个实施方案中,胰高血糖素/ap2蛋白复合物的形成被ap2抗体或抗原结合剂破坏,其中所述抗体干扰胰高血糖素与ap2的复合。在一个实施方案中,所述化合物相对于ap2和/或胰高血糖素优先与胰高血糖素/ap2复合物结合。在一个实施方案中,所述化合物不结合gcgr。在任何上述方面的一个实施方案中,抗体相对于单独的ap2而言选择性地与胰高血糖素/ap2复合物结合。用于鉴定优先结合抗体的方法通常是本领域已知的。在一个实施方案中,本文提供了鉴定相对于ap2而言选择性地与胰高血糖素/ap2结合的抗体的方法,其通常包括向非人动物,例如兔、小鼠、大鼠或山羊施用异源胰高血糖素/ap2蛋白复合物,例如人胰高血糖素/ap2,以产生针对复合物中的异源胰高血糖素/ap2的抗体,分离所述抗体,使所述抗体经历一种或多种测量对胰高血糖素/ap2和单独的ap2的结合亲和力的结合测定,例如竞争性结合测定,其中分离相对于ap2而言优先与胰高血糖素/ap2结合的抗体以用于中和胰高血糖素/ap2对gcgr的激动作用。在一个实施方案中,优先结合的胰高血糖素/ap2抗体包含针对人胰高血糖素/ap2的cdr区。在一个实施方案中,根据已知方法将优先结合的胰高血糖素/ap2抗体人源化。描述抗体(包括人源化抗体)产生的方法,包括美国专利第7,223,392号、第6,090,382号、第5,859,205号、第6,090,382号、第6,054,297号、第6,881,557号、第6,284,471号和第7,070,775号。提供了预防或减轻由胰高血糖素/ap2蛋白复合物介导的宿主(诸如人)中的病症的严重性的方法,其包括施用有效量的靶向循环胰高血糖素/ap2蛋白复合物的抗体、抗原结合剂或抗体结合片段,例如人源化抗体,诸如本文所述的抗胰高血糖素/ap2单克隆抗体或抗原结合剂,导致胰高血糖素的生物活性降低或减弱。在一个实施方案中,相对于单独的ap2和/或胰高血糖素而言优先与胰高血糖素/ap2复合物结合。通过向有此需要的宿主施用有效量进行的所述抗胰高血糖素/ap2抗体和抗原结合剂的用途的非限制性实例包括以下一种或组合:(i)降低空腹血糖水平;(ii)减少肝葡萄糖产生;(iii)改善葡萄糖代谢;(iv)减少高胰岛素血症;(v)减少肝脏脂肪变性;和/或,(vi)增加胰岛素敏感性。在一个可选方面,本文还提供了包含与抗体、抗原结合剂或抗体片段结合的ap2复合的胰高血糖素的组合物。在一个实施方案中,所述抗体、抗原结合剂或抗体片段并非天然存在于人中。在一个实施方案中,分离与抗体结合的胰高血糖素/ap2。根据以下详细描述和权利要求,本发明的其他特征和优点将显而易见。附图简述图1a-1b是说明从12周龄雄性c57/bl6j小鼠分离的原代肝细胞中g6pc(图1a)和pck1(图1b)的标准化相对基因表达的条形图,如实施例1中所述,用胰高血糖素(100nm)和重组ap2(50μg/ml)同时或单独刺激所述小鼠。重复实验至少两次,得到相似的结果。条形图表示平均值±标准偏差(s.d.),每组n=4-5。*p≤0.05,**p≤0.01,***p≤0.001,****p≤0.0001,nsp>0.05。使用利用tukey测试后校正的单因素anova统计进行多组比较。图1c是说明在如上所述用ap2和/或胰高血糖素刺激4小时后使用amplex红葡萄糖氧化酶在无血清和无葡萄糖培养基(具有丙酮酸盐(1μm)和乳酸盐(2μm))中测定的从头葡萄糖产生的条形图(实施例1)。实验重复至少两次,结果相似。条形图表示平均值±标准偏差(s.d.),每组n=4-5。*p≤0.05,**p≤0.01,***p≤0.001,****p≤0.0001,nsp>0.05。使用利用tukey测试后校正的单因素anova统计进行多组比较。图1d是说明在刺激24小时后通过闪烁计数评估的葡萄糖释放的线图。在地塞米松(1μm)和胰岛素(10μm)过夜存在的情况下,向hepg2-c3a人肝瘤细胞系加载具有5mm葡萄糖和14c-u-葡萄糖(0.5μci/孔)的糖原(实施例1)。实验重复至少两次,结果相似。条形图表示平均值±标准偏差(s.d.),每组n=4-5。*p≤0.05,**p≤0.01,***p≤0.001,****p≤0.0001,nsp>0.05。使用利用tukey测试后校正的单因素anova统计进行多组比较。图1e是说明在单独的10μg/mlap2或指定浓度的胰高血糖素存在的情况下刺激的用人gcgr-gfp和4xcamp-应答元件稳定转染的cho-k1中在刺激后4小时测定的荧光素酶活性的线图(实施例1)。实验重复至少两次,结果相似。条形图表示平均值±标准偏差(s.d.),每组n=4-5。*p≤0.05,**p≤0.01,***p≤0.001,****p≤0.0001,nsp>0.05。使用利用tukey测试后校正的单因素anova统计进行多组比较。图表将数据显示为使用双因素anova分析的平均值±平均值的标准误差(s.e.m.)。图1f是说明在用camp报告腺病毒(5m.o.i.)感染并如上所述刺激的原代肝细胞中刺激后3小时测定的荧光素酶活性的条形图。实验重复至少两次,结果相似。条形图显示平均值±标准偏差(s.d.),每组n=4-5。*p≤0.05,**p≤0.01,***p≤0.001,****p≤0.0001,nsp>0.05。使用利用tukey测试后校正的单因素anova统计进行多组比较。图表将数据显示为使用双因素anova分析的平均值±平均值的标准误差(s.e.m.)。图2a是说明在gcgr或对照载体存在的情况下用g6pc启动子驱动的荧光素酶瞬时转染的hepg2细胞中g6pc启动子活性的条形图。刺激4小时后,从培养基中测定分泌的荧光素酶活性。图表将数据显示为平均值±s.e.m。所有实验重复至少两次,结果相似。图2b是说明使用生物层干涉测定法测定的在ap2存在或不存在的情况下针对链霉抗生物素传感器标准化的gcgr结合动力学,特别是gcgr-ecd与生物素-胰高血糖素结合的条形图。图表将数据显示为平均值±s.e.m。所有实验重复至少两次,结果相似。图2c-2d是说明在gcgr变构抑制剂l-168,049(100nm)存在或不存在的情况下用胰高血糖素或胰高血糖素和ap2刺激的原代肝细胞中g6pc(图2c)和pck1(图2d)的标准化相对基因表达的条形图。条形图显示平均值±s.d,每组n=4-5。*p≤0.05,**p≤0.01,***p≤0.001,****p≤0.0001,nsp>0.05。使用利用tukey测试后校正的单因素anova统计进行多组比较。图2e和2f是说明用胰高血糖素受体的变构抑制剂预孵育的细胞丧失对ap2和胰高血糖素起反应的能力的条形图。图3a说明使用生物层干涉测定法测定的未标记的ap2与固定在链霉抗生物素蛋白探针上的生物素胰高血糖素的结合亲和力(nm)。使用两种不同浓度的ap2与胰高血糖素饱和探针结合,然后使用全局拟合模型对此进行分析。实验重复至少三次,结果相似。图3b是说明125i-胰高血糖素与ap2结合的线图。在不同量的作为竞争剂的冷胰高血糖素存在的情况下,将生物素化的ap2与125i标记的胰高血糖素一起孵育。读取从闪烁体涂覆的板发射的发光,并将一个位点竞争性抑制剂模型用于曲线拟合。实验重复至少三次,结果相似。该图将数据显示为平均值±s.e.m。图3c说明等温滴定量热法实验中未标记的ap2和胰高血糖素的结合等温线的结果。每次注射胰高血糖素后在一个时间序列中散发的热量在左侧。在右侧,这些值的积分生成结合曲线。实验重复至少三次,结果相似。图3d是说明从野生型或ap2缺乏血清分离的血清中的胰高血糖素免疫反应性的条形图,在过量冷抗体(野生型血清)或重组ap2重建(200ng/ml)存在或不存在的情况下,将所述野生型或ap2缺乏血清与单克隆抗ap2涂覆的磁珠一起孵育以拉下ap2结合的复合物。洗涤后,将复合物与缀合有hrp的单克隆-胰高血糖素抗体一起孵育以检测胰高血糖素信号。条形图显示平均值±s.d,每组n=5。*p≤0.05。将配对t检验用于比较组内处理,单因素普通anova(one-wayordinaryanova)用于多组比较。实验重复至少三次,结果相似。图3e和3f是条形图,其显示可使用免疫沉淀法检测血清中作为复合物的胰高血糖素和ap2。用ca33预孵育野生型血清可防止共免疫沉淀。图3g是ap2与gcgr-ecd的配体结合曲线。图3h是ap2与胰高血糖素的配体结合曲线。图3i是胰高血糖素与gcgr-ecd的配体结合曲线。图3j显示ca33对ap2与胰高血糖素的配体结合曲线的影响。图3k是显示野生型和ap2缺陷小鼠中不同截短的胰高血糖素的结合的western印迹。图3l是显示生物素化的胰高血糖素从野生型和ap2缺乏小鼠的器官裂解物中拉下内源性ap2的western印迹。图4a是在浓度递增的ap2存在的情况下来自野生型和gcgr受体缺陷型小鼠的胰高血糖素与胰高血糖素受体的结合曲线。图4b-4d是显示胰高血糖素与gcgr受体的结合在体内需要ap2的条形图。向野生型、ap2缺乏、gcgr缺陷型和与重组型ap2组合的ap2缺乏的尾静脉施用125i标记的胰高血糖素。施用后5分钟收获器官,并用液体闪烁计数器计数辐射。图4b是显示所有组合的器官中125i胰高血糖素掺入的条形图。图4c是显示在收获的特定器官中125i胰高血糖素掺入的条形图。图4d和4e是显示胰高血糖素与分离的膜-spa的125i胰高血糖素结合作为体重的函数的条形图。图4f是显示ap2增加gcgr-ecd(细胞外结构域)与胰高血糖素的结合的western印迹。图4g是显示ap2与gcgr结合的western印迹。图4h是显示沉淀和上清液中的ap2信号的条形图。图4i是显示ap2增加gcgr-ecd与胰高血糖素的结合的western印迹。图5a是由微尺度热泳实验获得的fabp4与胰高血糖素的相互作用确定的结合曲线。图5b是由从微尺度热泳实验获得的gcgr-ecd与胰高血糖素的相互作用确定的结合曲线。图5c是由从微尺度热泳实验获得的具有标记的gcgr-ecd与hfabp4的相互作用确定的结合曲线。图5d是由从微尺度热泳实验获得的无标记的gcgr-ecd与hfabp4的相互作用确定的结合曲线。图5e是由ap2与胰高血糖素的相互作用确定的结合曲线。图6a是假设分子之间具有一比一化学计量关系的ap2与胰高血糖素结合的代表性模型。图6b是每个胰高血糖素分子的ap2的多个亚基的代表性模型。图6c说明使用预测服务器生成的模型的频率映射(以映射出ap2与胰高血糖素之间的高度可能的相互作用位点)。映射图上较暗的斑点表示提交的模型之间相互作用的较高出现频率。根据该分析,最可能的相互作用位点似乎是胰高血糖素的c末端,其具有簇集在第一α螺旋周围以及残基57和76周围(两个β-桶环)的潜在的对ap2的结合位点。用于该分析的晶体结构是1gcn(对于胰高血糖素)以及3p6c和1lic(对于二聚体ap2)。图7a是说明葡萄糖耐量测试期间的血糖(mg/dl)相对时间(分钟)的线图。在施用合成的胰高血糖素(16μg/kg)、ap2(50μg)或两者的组合之前,在经历4小时食物戒断的12周龄雄性同窝仔畜野生型或ap2缺乏小鼠中进行测试。图表将数据显示为平均值±s.e.m。实验重复至少三次,结果相似。图7b是显示根据图7a的胰高血糖素耐受性测试确定的曲线下面积的条形图。将利用tukey校正的单因素普通anova用于多组比较。实验重复至少三次,结果相似。图7c是说明在图7a的小鼠禁食24小时并再喂食后3小时(以防止可能由于餐后状态的任何差异)测量的糖原水平的条形图。条形图显示平均值±s.d,每组n=4-5。*p≤0.05,n.s.不显著。非配对t检验用于比较两组之间的处理。实验重复至少三次,结果相似。图7d是说明使用来自血液的荧光底物(promega)测量的图7a的小鼠中dppiv活性的条形图。条形图显示平均值±s.d,每组n=4-5。*p≤0.05,n.s.不显著。非配对t检验用于比较两组之间的处理。实验重复至少三次,结果相似。图7e以与图7c中所述相同的方式收获肝脏,并将其在ripa缓冲液中匀浆,在sds-page后进行western印迹。通过蛋白质印迹确定的标准化的信号强度的条形图示于下图中。条形图显示平均值±s.d,每组n=4-5。*p≤0.05,n.s.不显著。非配对t检验用于比较两组之间的处理。实验重复至少三次,结果相似。图7f是说明颈静脉插管的野生型或ap2缺乏的同窝小鼠(所述小鼠被限制并输注生长抑素以排除任何胰腺效应和基因型之间的固有差异,并且基础胰岛素水平为0.5mu/kg/min,胰高血糖素的药理剂量为1mg/kg/min)中的血糖(mg/dl)相对时间(分钟)的线图。野生型小鼠对胰高血糖素有反应,血糖过多增加,而ap2缺乏小鼠则没有这样的反应。在这60分钟的时期结束时,ap2缺乏小鼠需要葡萄糖输注以使它们保持在正常血糖,而野生型小鼠的血糖过多进一步增加。图表将数据显示为平均值±s.e.m。所有实验重复至少三次,结果相似。实验重复至少三次,结果相似。图7g是测量用pbs、胰高血糖素或胰高血糖素和ap2处理的ap2缺乏小鼠和野生型小鼠的葡萄糖耐量的线图。x轴是时间,y轴是以mg/dl测量的葡萄糖偏移(glucoseexcursion)。图7h是测量用pbs、胰高血糖素或胰高血糖素和ap2处理的ap2缺乏小鼠和野生型小鼠中的葡萄糖auc的条形图。x轴是不同的处理方案,y轴是auc。图7i是显示ap2缺乏小鼠的肝脏中基线处的糖原含量的条形图。x轴是野生型和ap2缺乏小鼠,y轴是糖原(mg)/干肝(mg)。图7j是显示ap2缺乏小鼠的肝脏中在安乐死时的糖原含量的条状图。x轴是野生型和ap2缺乏型小鼠,y轴是糖原(mg)/干肝(mg)。图7k是显示胰高血糖素施用后野生型和ap2缺乏小鼠中camp测量的线图。x轴是胰高血糖素施用后以分钟表示的时间,y轴是每μgdna的camppmol数。图8a是说明在有意识的颈静脉导管插入的ap2缺乏小鼠中hgp(mg/kg/min)水平的条形图,所述小鼠被限制并输注高水平的胰岛素(3mu/kg/min)。为了检查激素的反调节作用,给这些组输注了pbs、胰高血糖素(1mg/kg/min)、一起输注了ap2和基础胰高血糖素(8μg/kg/minap2,0.1mg/kg/min)或高水平的胰高血糖素和ap2。只有高水平胰高血糖素和ap2的组合施用才成功地抵消胰岛素的作用(最后一组,如通过肝葡萄糖产生的非显著的抑制所示的)。每组n=6-9。*p≤0.05,**p≤0.01,***p≤0.001,****p≤0.0001,nsp>0.05。使用利用tukey测试后校正的单因素anova统计在钳夹条件下进行多组比较。使用利用sidak校正的重复测量双因素anova比较组间的基础和钳夹条件。图表将数据显示为平均值±s.e.m。图8b是活小鼠中胰腺钳夹实验的线图。在恒定输注胰高血糖素的情况下,ap2缺乏小鼠中没有响应于胰高血糖素的葡萄糖产生。x轴是胰高血糖素输注的时间,y轴是以mg/dl测量的血糖。图9a是显示使用biacoret200系统通过生物分子相互作用分析测定的抗ap2单克隆抗体(ca33、ca13、ca15、ca23和h3)与人和小鼠ap2的结合亲和力(kd(m))的表。图9b是显示食用用媒介物或抗ap2单克隆抗体ca33、ca13、ca15、ca23或h3处理的高脂肪饮食(hfd)的肥胖小鼠在第0周(空心条)或第4周(实心条)的血糖水平(mg/dl)的条形图。在6小时的白天食物戒断后测量血糖水平。*p<0.05,**p<0.01。图9c是显示葡萄糖耐量测试(gtt)期间葡萄糖水平(mg/dl)相对时间(分钟)的线图。在2周的处理后在食用具有媒介物(菱形)或抗ap2单克隆抗体(0.75g/kg葡萄糖)(ca33;正方形)(ca15;三角形)的hfd的肥胖小鼠中进行所述测试。*p<0.05。图10a是与相关蛋白fabp3(灰色条)和fabp5/mal1(浅灰色条)相比,通过对针对ap2的抗ap2抗体ca33和h3(黑色条)的八位组分析确定的信号相互作用(nm)的条形图。图10b是通过biacore分析确定的h3相对ca33、ca13、ca15和ca23的抗体交叉阻断的表。++=完全阻断;+=部分阻断;-=无交叉阻断。图10c显示了通过氢-氘交换质谱法(hdx)鉴定的参与与ca33和h3的相互作用的ap2残基的表位序列。相互作用的残基加下划线。图10d是与ap2共结晶的ca33的fab和与a2共结晶的h3的fab的叠加图像。图10e是ap2上ca33表位的高分辨率作图。指示了两种分子中的相互作用残基。氢键显示为虚线。ap2中k10的侧链与y92的苯基侧链形成疏水相互作用。图10f是显示在igg对照抗体(圆圈)或ca33抗体(正方形)存在的情况下,哌啶酸对ap2的结合(相对荧光)相对于ph的线图。图10g是显示实施例2中论述的125i胰高血糖素结合的图。将抗小鼠iggspa珠与来自野生型或ap2敲除小鼠的血清及125i胰高血糖素一起孵育。x轴显示在野生型和ap2缺乏小鼠中不同抗αp2抗体的胰高血糖素结合,其中去除了背景cpm。图10h是显示如实施例2中所论述的125i胰高血糖素结合的图。将抗小鼠iggspa珠与来自野生型或ap2敲除小鼠的血清及125i胰高血糖素一起孵育。x轴显示野生型和ap2缺乏小鼠中以输入的百分比表示的不同抗αp2抗体的胰高血糖素结合。图11a是显示hfd诱导的肥胖ap2-/-小鼠在持续3周的ca33抗体或媒介物处理之前(空心条)和之后(实心条)的空腹血糖(mg/dl)的条形图图11b是显示在葡萄糖耐量测试(gtt)期间hfd诱导的肥胖ap2-/-小鼠中葡萄糖水平(mg/dl)相对时间(分钟)的线图。在2周的媒介物(三角形)或ca33抗体(正方形)处理后在ap2-/-小鼠中进行测试。图11c是显示在3周的ca33抗体或媒介物处理之前(空心条)和之后(实心条)ob/ob小鼠中的空腹血糖水平(mg/dl)的条形图(每组n=10只小鼠)。**p<0.01。图11d是显示在葡萄糖耐量测试(gtt)期间ob/ob小鼠中葡萄糖水平(mg/dl)相对时间(分钟)的线图。在2周的媒介物(三角形)或ca33抗体(正方形)处理后在ap2-/-小鼠中进行所述测试。*p<0.05。图11e是显示在葡萄糖耐量测试(gtt)期间ob/ob小鼠中葡萄糖水平(mg/dl)相对时间(分钟)的线图。在3周的媒介物(三角形)或ca33抗体(正方形)处理后在ap2-/-小鼠中进行所述测试。图11f是显示葡萄糖耐量测试(gtt)期间ob/ob小鼠中葡萄糖auc水平相对时间(分钟)的条形图。在3周的媒介物(三角形)或ca33抗体(正方形)处理后在ap2-/-小鼠中进行所述测试。图12a是显示在高脂饮食喂养的小鼠中在使用高亲和力抗体(ca13、ca15、ca23和h3)对比媒介物对照进行两周的选择性抗体处理后,葡萄糖耐量测试(gtt)中葡萄糖水平(mg/dl)相对时间(分钟)的线图。图12b是显示在高脂饮食喂养的小鼠中在使用高亲和力抗体(ca13、ca15、ca23和h3)对比媒介物对照进行3周的选择性抗体处理后,胰岛素耐量测试(itt)中葡萄糖水平(mg/dl)相对时间(分钟)的线图。图12c是显示对ap2敲除小鼠施用ap2和胰高血糖素拯救了胰高血糖素无应答性、而利用ca33和ap2预孵育则防止了这种情况的线图。图12d是显示对ap2敲除小鼠施用胰高血糖素和ap2拯救了胰高血糖素无应答性、而用ca33和ap2预孵育可防止这种情况的条形图。图13提供了抗人胰高血糖素/ap2复合物人源化κ轻链可变区抗体片段,其中909序列是兔可变轻链序列,909gl1、gl10、gl13、gl50、gl54和gl55序列是使用igkv1-17人种系作为受体框架的909可变轻链的人源化接枝物(humanizedgraft)。cdr以粗体/下划线显示,而适用的供体残基以粗体/斜体显示并突出显示:2v、3v、63k和70d。cdrl3中去除半胱氨酸残基的突变以粗体/下划线显示,并突出显示:90a。图14a提供了抗人胰高血糖素/ap2人源化重链可变区抗体片段,其中909序列是兔可变重链序列,并且909gh1、gh14、gh15、gh61和gh62序列是使用ighv4-4人种系作为受体框架的909可变重链的人源化接枝物。cdr以粗体/下划线显示。β片链d和e之间的环中的框架3中的两残基缺口以gh1:75和76突出显示。适用的供体残基以粗体/斜体显示并突出显示:23t、67f、71k、72a、73s、74t、77t、78v、79d、89t和91f。cdrh2中用于去除半胱氨酸残基的突变以粗体/下划线显示,并突出显示:59s。cdrh3中去除潜在的天冬氨酸异构化位点的突变以粗体/下划线显示并突出显示:98e。用谷氨酸替换n-末端谷氨酰胺残基,并以粗体显示并突出显示:1e。图14b是显示ap2与ca33的孵育阻断ap2的胰高血糖素增强作用(如此处通过camp对胰高血糖素的反应所示的)的条形图。x轴包括不同的抗ap2抗体,y轴是发光。图14c是显示丝氨酸突变体(c2s)不会降低ap2的作用(如此处通过camp对胰高血糖素的反应所示的)的条形图。x轴是野生型ap2和ap2突变体,y轴是发光。图15是说明在用媒介物或抗-α2-胰高血糖素单克隆抗体处理的具有饮食诱导的肥胖症的小鼠在胰高血糖素攻击测试期间的葡萄糖水平(mg/dl)相对时间(分钟)的线图。图16是说明栓系的ap2对胰高血糖素、单克隆抗体(mab)或胰高血糖素加mab的结合亲和力(nm)相对时间(秒)的图。图17a-17b是在用ap2但无胰高血糖素处理后15分钟,表达gcgr-gfp的u2-os细胞的活细胞显微镜图像。在无胰高血糖素处理的情况下,观察到ap2向细胞中的最小内化(实施例6)。图17c-17e是在用胰高血糖素和ap2处理后30分钟,表达gcgr的u2-os细胞的活细胞显微镜图像。gcg-gfp信号和ap2信号的共定位以白色显示。在胰高血糖素刺激存在的情况下,观察到ap2的内化大大增加(实施例6)。图17f是比较来自ap2+/+和ap2-/-细胞系的细胞的胰岛面积的显微镜图像的图。两个细胞系之间的像素计数差异不显著。如实施例7中所论述的,ap2缺乏不会引起α细胞增生。两个细胞系显示在x轴上,像素计数显示在y轴上。图17g是比较来自ap2+/+和ap2-/-细胞系的细胞的胰高血糖素阳性染色的显微镜图像的图(实施例7)。两个细胞系之间的像素计数差异不显著。两个细胞系显示在x轴上,像素计数显示在y轴上。图17h是比较来自ap2+/+和ap2-/-细胞系的细胞中的胰高血糖素阳性染色和胰岛面积的显微镜图像的图(实施例7)。两个细胞系之间的像素计数差异不显著。两个细胞系显示在x轴上,像素计数显示在y轴上。图17i是如实施例7中论述的来自ap2+/+细胞系的细胞的活细胞显微镜图像。图17j是来自ap2-/-细胞系的细胞的活细胞显微镜图像。与来自ap2+/+细胞系的细胞(图17i)相比,ap2-/-细胞不表现出增生(实施例7)。增生是胰高血糖素受体拮抗作用的结果,这是一种可与ap2缺乏区别开的性状。发明详述本发明基于以下发现:胰高血糖素与ap2形成复合物作为专性结合配偶体,其激活胰高血糖素受体并最终促进肝葡萄糖产生。在一个实施方案中,改变胰高血糖素-αp2复合物结合胰高血糖素受体的能力导致了破坏胰高血糖素信号传导活性并调节过量的肝葡萄糖产生,从而导致血糖水平降低。这种发现提供了处理受试者(例如人)的长期、升高的血糖水平的新方法,以及鉴定可用于治疗与长期、升高的血糖水平相关的病症的化合物的新方法。基于该发现,提供了用于鉴定能够干扰胰高血糖素/ap2复合物激动胰高血糖素受体(gcgr)的能力的化合物的方法。此类化合物能够通过靶向胰高血糖素/ap2蛋白复合物来降低人或其他哺乳动物中的胰高血糖素信号传导活性。在一个实施方案中,所述化合物是抗体、抗体结合剂或片段。在一个实施方案中,所述化合物相对于ap2和/或胰高血糖素而优先与胰高血糖素/ap2复合物结合。在一个实施方案中,所述抗体、试剂或片段是ap2的松散结合剂,例如结合的kd大于10-7m。当向有此需要的宿主施用时,靶向胰高血糖素/ap2蛋白复合物的抗体、抗原结合剂或抗体结合片段中和与ap2结合的胰高血糖素的活性,并且减少肝葡萄糖产生的产量,和/或降低血糖水平,和/或减少慢性高血糖症的发生。因此,通过靶向ap2与胰高血糖素的相互作用,可治疗与升高的血糖水平相关的代谢病症,包括但不限于糖尿病(1型和2型)、高血糖症、糖尿病酮症酸中毒、高血糖高渗综合征、心血管疾病、糖尿病肾病或肾衰竭、糖尿病视网膜病变、空腹血糖受损、葡萄糖耐量降低、血脂异常、肥胖、白内障、中风、伤口愈合受损、围手术期高血糖症、重症监护病房患者的高血糖症和胰岛素抵抗综合征。在某些实施方案中,当向有此需要的受试者施用时,抗体或抗原结合剂可用于减少受试者中的脂肪量、肝脏脂肪变性、改善血清脂质谱和/或减少致动脉粥样硬化斑块的形成或维持。因此,本文所述的抗体和抗原结合剂特别可特别地用于治疗与失调的胰高血糖素活性相关的代谢病症,所述失调的胰高血糖素活性导致异常或过量的血糖水平,包括但不限于糖尿病(1型和2型)、高血糖症、肥胖、脂肪肝或血脂异常。因此,本发明提供至少以下方法:(a)用于鉴定调节/影响并优选中和胰高血糖素/ap2对gcgr的激动活性的化合物以用于本文所述的疗法的方法。(b)通过施用靶向本文所述的胰高血糖素/ap2蛋白复合物的抗体、抗原结合剂或抗体结合片段或其所述的变体或缀合物来调节胰高血糖素受体信号传导活性的方法,所述抗体、抗原结合剂或抗体结合片段或其所述的变体或缀合物导致胰高血糖素/ap2复合物介导的g蛋白偶联受体活性破坏。(c)通过向受试者施用抗体、抗原结合剂或抗体结合片段或其所述的变体或缀合物来治疗具有上调的胰高血糖素介导的病症的受试者(特别是人)的方法,所述抗体、抗原结合剂或抗体结合片段或其所述的变体或缀合物导致胰高血糖素/ap2复合物介导的g蛋白偶联受体活性破坏。(d)通过向受试者施用抗体、抗原结合剂或抗体结合片段或其所述的变体或缀合物来治疗具有升高的血糖水平的受试者(特别是人)的方法,所述抗体、抗原结合剂或抗体结合片段或其所述的变体或缀合物导致胰高血糖素/ap2复合物介导的g蛋白偶联受体活性破坏。(e)包含与和抗体、抗原结合剂或抗体片段结合的ap2复合的胰高血糖素的组合物。根据以下详细描述和权利要求,本发明的其他特征和优点将显而易见。一般定义除非另外定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的含义相同的含义。尽管与本文描述的那些类似或等同的方法和材料可用于本发明的实践或测试,但下文描述了合适的方法和材料。本文提及的所有出版物、专利申请、专利和其他参考文献都通过引用整体并入。在冲突的情况下,以本说明书(包括定义)为准。另外,材料、方法和实施例仅是说明性的,而无意是限制性的。除非上下文另有要求,否则单数术语应包括复数,并且复数术语应包括单数。在本申请中,除非另有说明,否则“或”的使用意味着“和/或”。此外,术语“包括”以及其他形式诸如“包含”和“具有”的使用不是限制性的。此外,除非另外特别说明,否则术语诸如“元件”或“组件”包括包含一个单元的元件和组件以及包含不止一个亚单元的元件和组件。通常,与本文所述的细胞和组织培养、分子生物学、免疫学、微生物学、遗传学以及蛋白质和核酸化学和杂交相关的命名法和其技术是本领域公知和常用的那些命名法和技术。除非另有说明,否则本发明的方法和技术通常根据本领域熟知的以及在整个本说明书中引用和论述的各种一般和更专门的参考文献中所述的常规方法进行。酶促反应和纯化技术可根据制造商的说明书进行,如本领域通常实现的或如本文所述的。与本文所述的分析化学、合成有机化学以及药学和药物化学结合使用的命名法和其实验室程序和技术是本领域公知和常用的那些。标准技术用于化学合成、化学分析、药物制备、配制和递送以及患者的治疗。为了更容易地理解本发明,下面定义了所选择的术语。如本文中所用,术语“宿主”、“受试者”或“患者”通常是指人受试者,特别是当人或人源化框架用作受体结构时。在治疗另一种宿主的情况下,本领域技术人员应理解,可能需要针对该宿主定制抗体或抗原结合剂以避免排斥或使其更相容。已知如何使用本发明中的cdr并将它们工程化至适当的框架或肽序列中,以便为一系列宿主提供所需的递送和功能。其他宿主可包括其他哺乳动物或脊椎动物物种。因此,术语“宿主”可以替代地指动物,诸如小鼠、猴、狗、猪、兔、驯养的猪(猪和猪(hogs))、反刍动物、马、家禽、猫科动物、鼠、牛族动物、犬科动物等。如果需要,可适当地设计抗体或抗原结合剂以与宿主相容。如本文中所用,术语“多肽”是指氨基酸的任何聚合链。术语“肽”和“蛋白质”可与术语多肽互换使用,也指氨基酸的聚合链。术语“多肽”包括天然或人工蛋白质、蛋白质片段和蛋白质序列的多肽类似物。多肽可以是单体的或多聚体的。如本文中所用,术语“人ap2蛋白”或“人fabp4/ap2蛋白”是指由seq.id.no.1编码的蛋白质及其天然变体,如由c.a.,sha,r.s.,buelt,m.k.,smith,a.j.,matarese,v.,chinander,l.l.,boundy,k.l.,bernlohr,a.humanadipocytelipid-bindingprotein:purificationoftheproteinandcloningofitscomplementarydna.biochemistry28:8683-8690,1989所描述的。如本文中所用,术语“小鼠ap2蛋白”或“小鼠fab4p/ap2蛋白”是指由seq.id.no.2编码的蛋白质及其天然变体。该小鼠蛋白质已在swiss-prot中登记,编号为p04117。如本文中所用的“抗原结合剂”包括单链抗体(即全长重链和轻链);fab、经修饰的fab、fab'、经修饰的fab'、f(ab')2、fv、fab-fv、fab-dsfv、单结构域抗体(例如,vh或vl或vhh),例如如wo2001090190中所述的,任何上述抗体的scfv、二价、三价或四价抗体、双-scfv、双抗体、三抗体或四抗体和表位-抗原结合剂(参见例如holliger和hudson,2005,naturebiotech.23(9):1126-1136;adair和lawson,2005,drugdesignreviews-online2(3),209-217)。用于产生和制造这些抗体片段的方法是本领域熟知的(参见例如verma等,1998,journalofimmunologicalmethods,216,165-181)。fab-fv形式首次公开于wo2009/040562,并且其二硫化物稳定化形式fab-dsfv首次公开于wo2010/035012。用于本发明的其他抗体片段包括国际专利申请wo2005/003169、wo2005/003170和wo2005/003171中描述的fab和fab'片段。多价抗体可包含多种特异性,例如双特异性的,或可以是单特异性的(参见例如wo92/22583和wo05/113605)。后者的一个这样的实例是如wo92/22583中所述的tri-fab(或tfm)。典型的fab'分子包含重链和轻链对,其中重链包含可变区vh、恒定结构域ch1和天然或经修饰的铰链区,并且轻链包含可变区vl和恒定区cl。用于产生f(ab')2例如二聚化的fab'的二聚体可以通过本文所述的天然铰链序列,或其衍生物,或合成的铰链序列。如本文中所用,术语“特异性结合”或“特异地结合”涉及抗体、蛋白质或肽与第二化学物质的相互作用时,意指相互作用取决于化学种类上的特定结构(例如,如下定义的“抗原决定簇”或“表位”)的存在;例如,抗体识别并结合特定的蛋白质结构而不是蛋白质总体。如果抗体对于表位“a”具有特异性,含有表位a(或游离的、未标记的a)的分子在含有标记的“a”和抗体的反应中的存在将减少与抗体结合的标记a的量。如本文中所用,术语“抗体”广泛地指由四条多肽链(两条重链(h)和两条轻链(l))或其任何功能片段、突变体、变体或衍生物组成的任何免疫球蛋白(ig)分子,其保留ig分子的表位结合特征的至少一部分,使其特异性结合ap2。此类突变体、变体或衍生抗体形式是本领域已知的并在下文描述。下面讨论其非限制性实施方案。如果抗体能够与分子特异性反应从而将分子与抗体结合,则称所述抗体“能够结合”所述分子。如本文中所用,“单克隆抗体”意指抗体分子的制剂,与含有不同抗体的混合物的“多克隆”抗体制剂相反,其共享共同的重链和共同的轻链氨基酸序列,或至少保留ig分子的轻链表位结合特性的其任何功能片段、突变体、变体或衍生物。单克隆抗体可以通过几种已知技术产生,所述技术是如噬菌体、细菌、酵母或核糖体展示以及以杂交瘤衍生的抗体(例如,由通过杂交瘤技术(诸如标准kohler和milstein杂交瘤方法学((1975)nature256:495-497))制备的杂交瘤分泌的抗体)为例的经典方法。在全长抗体中,每条重链由重链可变区(本文中缩写为hcvr或vh)和重链恒定区(ch)组成。重链恒定区由四个结构域--ch1、铰链、ch2和ch3(重链γ、α和δ)或ch1、ch2、ch3和ch4(重链μ和ε)组成。每条轻链由轻链可变区(本文中缩写为lcvr或vl)和轻链恒定区(cl)组成。轻链恒定区由一个结构域cl组成。vh和vl区可以进一步细分为高变区(称为互补决定区(cdr)),其散布在更保守的称为框架区(fr)的区域之间。每个vh和vl由按照以下顺序从氨基末端到羧基末端排列的三个cdr和四个fr组成:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。免疫球蛋白分子可以是任何类型(例如igg、ige、igm、igd、iga和igy)、类别(例如igg1、igg2、igg3、igg4、iga1和iga2)或亚类。如本文中所用,术语“抗体构建体”是指包含与接头多肽或免疫球蛋白恒定结构域连接的本发明的一个或多个抗原结合部分的多肽。接头多肽包含通过肽键连接的两个或更多个氨基酸残基,并用于连接一个或多个抗原结合部分。此类接头多肽是本领域熟知的(参见例如holliger,p.等(1993)proc.natl.acad.sci.usa90:6444-6448;poljak,r.j.等(1994)structure2:1121-1123)。免疫球蛋白恒定结构域是指重链或轻链恒定结构域,例如人iga、igd、ige、igg或igm恒定结构域。重链和轻链恒定结构域氨基酸序列是本领域已知的。另外,抗体或其抗原结合部分可以是通过抗体或抗体部分与一种或多种其他蛋白质或肽的共价或非共价结合形成的较大免疫粘附分子的一部分。此类免疫粘附分子的实例包括使用链霉抗生物素蛋白核心区来制备四聚体scfv分子(kipriyanov,s.m,等(1995)humanantibodiesandhybridomas6:93-101)和使用半胱氨酸残基、标记肽和c末端多组氨酸标签制备二价和生物素化的scfv分子(kipriyanov,s.m.等(1994)mol.immunol.31:1047-1058)。抗体部分,诸如fab和f(ab')2片段,可以使用常规技术诸如分别用木瓜蛋白酶或胃蛋白酶消化完整抗体来从完整抗体制备。此外,如本文所述,可以使用标准重组dna技术获得抗体、抗体部分和免疫粘附分子。术语“cdr-移植的抗体”是指包含来自一个物种的重链和轻链可变区序列但其中vh和/或vl的一个或多个cdr区的序列被另一个物种的cdr序列替换的抗体,诸如具有其中一个或多个人cdr(例如,cdr3)已被鼠cdr序列替换的人重链和轻链可变区的抗体。术语“kabat编号”、“kabat定义”和“kabat标记”在本文中可互换使用。本领域公认的这些术语是指对氨基酸残基进行编号的系统,所述氨基酸残基比抗体的重和轻链可变区或其抗原结合部分中的其它氨基酸残基更可变(即高变)(kabat等(1971)ann.nyacad,sci.190:382-391和kabat,e.a.等(1991)sequencesofproteinsofimmunologicalinterest,第5版,u.s.departmentofhealthandhumanservices,nihpublicationno.91-3242)。对于重链可变区,根据kabat编号系统,高变区的范围为氨基酸位置31-35(cdr-h1)、残基50-65(cdr-h2)和残基95-102(cdr-h3)。然而,根据chothia(chothia等,(1987)j.mol.biol.,196,901-917(1987)),相当于cdr-h1的环从残基26延伸至残基32。因此,除非另有说明,否则,如本文所用的“cdr-h1”意指残基26至35,如通过kabat编号系统和chothia拓扑环定义的组合所述。对于轻链可变区,高变区的范围从氨基酸位置24至34(对于cdrl1)、氨基酸位置50至56(对于cdrl2)以及氨基酸位置89至97(对于cdrl3)。如本文中所用,术语“受者”和“受者抗体”是指提供或编码一个或多个框架区的氨基酸序列的至少80%、至少85%、至少90%、至少95%、至少98%或100%的抗体或核酸序列。在一些实施方案中,术语“受者”是指提供或编码所述恒定区的抗体氨基酸或核酸序列。在另一个实施方案中,术语“受者”是指提供或编码一个或多个框架区和恒定区的抗体氨基酸或核酸序列。在一个具体实施方案中,术语“受者”是指提供或编码一个或多个框架区的氨基酸序列的至少80%、优选至少85%、至少90%、至少95%、至少98%或100%的人抗体氨基酸或核酸序列。根据该实施方案,受者可含有不存在于人抗体的一个或多个特定位置的至少1个、至少2个、至少3个、至少4个、至少5个或至少10个氨基酸残基。受者框架区和/或一个或多个受体恒定区可以例如衍生自或获自种系抗体基因、成熟抗体基因、功能性抗体(例如,本领域众所周知的抗体、开发中的抗体或商购可得的抗体)。如本文中所用,术语“cdr”是指抗体可变序列内的互补决定区。在重链和轻链的每个可变区中存在三个cdr,对于重链cdr其被称为cdrh1、cdrh2和cdrh3,对于轻链cdr其被称为cdrl1、cdrl2和cdrl3。如本文中所用,术语“cdr组”是指存在于能够结合所述抗原的单个可变区中的三个cdr的组。根据不同的系统,这些cdr的确切边界已经被不同地定义。kabat描述的系统(kabat等sequencesofproteinsofimmunologicalinterest(nationalinstitutesofhealth,bethesda,md.(1987)和(1991))不仅提供了适用于抗体的任何可变区的明确的残基编号系统,而且还提供了界定3个cdr的精确残基边界。这些cdr可被称为kabatcdr。chothia和同事(chothia&lesk,j.mol.biol.196:901-917(1987)和chothia等,nature342:877-883(1989))发现kabatcdr中的某些子部分采用几乎相同的肽骨架构象,尽管在氨基酸序列水平上具有很大的多样性。这些子部分被指定为l1、l2和l3或h1、h2和h3,其中“l”和“h”分别表示轻链和重链区域。这些区域可被称为chothiacdr,其具有与kabatcdr重叠的边界。padlan(fasebj.9:133-139(1995))和maccallum(jmolbiol262(5):732-45(1996))已描述了定义与kabatcdr重叠的cdr的其他边界。其他cdr边界定义可能不严格遵循上述系统之一,但仍然会与kabatcdr重叠,尽管根据特定残基或残基组或甚至整个cdr不会显著影响抗原结合的预测或实验结果,它们可被缩短或延长。本文使用的方法可以利用根据这些系统中的任何系统定义的cdr,尽管优选实施方案使用kabat或chothia或其混合定义的cdr。如本文中所用,术语“规范”残基是指cdr或框架中定义如由chothia等(j.mol.biol.196:901-907(1987);chothia等,j.mol.biol.227:799(1992),两者均通过引用并入本文)定义的特定规范cdr结构的残基。根据chothia等,许多抗体的cdr的关键部分具有几乎相同的肽骨架构象,尽管在氨基酸序列水平上具有很大的多样性。每个规范结构主要指定一组肽骨架扭转角以用于氨基酸残基的连续区段形成环。如本文中所用,术语“供体”和“供体抗体”是指提供一个或多个cdr的抗体。在一个优选实施方案中,供体抗体是来自与从其获得或衍生框架区的抗体不同的物种的抗体。在人源化抗体的背景下,术语“供体抗体”是指提供一个或多个cdr的非人抗体。如本文中所用,术语“框架”或“框架序列”是指可变区除去cdr的剩余序列。因为cdr序列的确切定义可由不同系统确定,所以框架序列的含义相应地有不同的解释。六个cdr(轻链的cdr-l1、-l2和-l3以及重链的cdr-h1、-h2和-h3)还将轻链和重链上的框架区在每条链上划分为四个亚区(fr1、fr2、fr3和fr4),其中cdr1位于fr1与fr2之间,cdr2位于fr2与fr3之间,cdr3位于fr3与fr4之间。在没有将特定亚区指定为fr1、fr2、fr3或fr4的情况下,其他人所指的框架区表示单个天然存在的免疫球蛋白链的可变区域内的组合fr。如本文中所用,fr表示四个亚区中的一个,并且fr表示构成框架区的四个亚区中的两个或更多个。人重链和轻链受者序列是本领域已知的。如本文中所用,术语“种系抗体基因”或“基因片段”是指由未经历成熟过程的非淋巴样细胞编码的免疫球蛋白序列,所述成熟过程导致遗传重排和突变以表达特定免疫球蛋白。参见,例如,shapiro等,crit.rev.immunol.22(3):183-200(2002);marchalonis等,advexpmedbiol.484:13-30(2001)。本发明的各种实施方案提供的有利方面之一利用了种系抗体基因比成熟抗体基因更可能保持物种中个体特征的必需氨基酸序列结构的认识,因此当在该物种中被治疗性使用时,不太可能被识别为来自外部来源。如本文中所用,术语“关键”残基是指可变区内的某些残基,其对抗体,特别是人源化抗体的结合特异性和/或亲和力具有更大影响。关键残基包括但不限于以下的一个或多个:与cdr相邻的残基、潜在的糖基化位点(可以是n-或o-糖基化位点)、稀有残基、能够与抗原相互作用的残基、能够与cdr相互作用的残基、规范残基、重链可变区与轻链可变区之间的接触残基、游标区内的残基,以及在可变重链cdr1的chothia定义与第一重链框架的kabat定义之间重叠的区域中的残基。术语“人源化抗体”通常是指包含来自非人物种(例如,兔、小鼠等)的重链和轻链可变区序列但其中vh和/或vl序列的至少一部分已被改变为更加“人样”,即更类似于人种系可变序列的抗体。一种类型的人源化抗体是cdr-移植的抗体,其中人cdr序列被引入非人vh和vl序列内以替换相应的非人cdr序列。另一种类型的人源化抗体是cdr-移植的抗体,其中至少一个非人cdr被插入人框架中。后者通常是本发明的焦点。特别地,本文所用的术语“人源化抗体”是与目标抗原免疫特异性结合的抗体或其变体、衍生物、类似物或片段,其包含具有基本上人抗体的氨基酸的框架(fr)区和具有基本上非人抗体的氨基酸序列的互补决定区(cdr)。如本文中所用,术语“基本上”在cdr的上下文中是指具有与非人抗体cdr的氨基酸序列具有至少50%、55%、60%、65%、70%、75%或80%,优选至少85%,至少90%、至少95%、至少98%或至少99%同一性的氨基酸序列的cdr。在一个实施方案中,人源化抗体具有与非人抗体cdr相比具有一个或多个(例如1个、2个、3个或4个)氨基酸取代、添加和/或缺失的cdr区。另外,可使用已知技术将非人cdr工程化成更加“人样”或与人体相容。人源化抗体包含基本上全部的至少一个,通常两个可变结构域(fab、fab'、f(ab')2、f(ab')c、fv),其中所有或基本上所有cdr区对应于非人免疫球蛋白(即,供体抗体)的那些cdr区,并且所有或基本上所有框架区是人免疫球蛋白共有序列的那些框架区。优选地,人源化抗体还包含至少一部分的免疫球蛋白恒定区(fc),通常是人免疫球蛋白的恒定区。在一些实施方案中,人源化抗体含有轻链以及至少重链的可变结构域。抗体还可包括重链的ch1、铰链、ch2和ch3或ch1、ch2、ch3和ch4。在一些实施方案中,人源化抗体仅含有人源化轻链。在一些实施方案中,人源化抗体仅含有人源化重链。在具体的实施方案中,人源化抗体仅含有轻链的人源化可变结构域和/或人源化重链。人源化抗体可选自任何类别的免疫球蛋白,包括igy、igm、igg、igd、iga和ige,以及任何同种型,包括但不限于iga1、iga2、igg1、igg2、igg3和igg4。人源化抗体可以包含来自不止一种类别或同种型的序列,并且可以选择特定的恒定结构域以使用本领域熟知的技术优化所需的效应子功能。人源化抗体的框架和cdr区不需要与亲本序列精确对应,例如,可以通过取代、插入和/或缺失至少一个氨基酸残基使得该位点的cdr或框架残基与供体抗体或共有框架不完全一致来诱变供体抗体cdr或共有框架。然而,在一个优选实施方案中,这种突变不会很广泛。通常,人源化抗体残基的至少50%、55%、60%、65%、70%、75%或80%、优选至少85%、更优选至少90%、最优选至少95%、98%或99%将对应于亲本fr和cdr序列的那些。在一个实施方案中,与亲本fr和cdr序列相比,人源化抗体中可存在一个或多个(例如1、2、3或4个)氨基酸取代、添加和/或缺失。如本文中所用,术语“共有框架”是指共有免疫球蛋白序列中的框架区。如本文中所用,术语“共有免疫球蛋白序列”是指由相关免疫球蛋白序列家族中最常出现的氨基酸(或核苷酸)形成的序列(参见例如winnaker,fromgenestoclones(verlagsgesellschaft,weinheim,germany1987)。在免疫球蛋白家族中,共有序列中的每个位置被在该家族中该位置最常出现的氨基酸占据。如果两个氨基酸以同样频率出现,则任一个都可包括在共有序列中。如本文中所用,“游标”区是指框架残基的亚组,其可以调节cdr结构并微调与抗原的拟合,如foote和winter(1992,j.mol.biol.224:487-499,其通过引用并入本文)所述。游标区残基形成cdr下面的层,并且可影响cdr的结构和抗体的亲和力。如本文中所用,术语“中和”是指当化合物特异性地干扰胰高血糖素/ap2蛋白复合物激动gcgr的能力时,对胰高血糖素/ap2蛋白复合物活性的生物活性的中和。优选地,中和性结合蛋白,例如抗体,是其与ap2、胰高血糖素和/或胰高血糖素/ap2蛋白复合物的结合将导致胰高血糖素/ap2蛋白复合物的生物活性的中和的结合蛋白。优选地,中和性结合蛋白使胰高血糖素/ap2蛋白复合物的生物活性降低至少约5%、10%、15%、20%、25%、30%、35%、40%、50%、60%、80%、85%或更多。可通过测量本文所述的胰高血糖素/ap2蛋白复合物生物活性的一个或多个指标来评估中和性抗体对胰高血糖素/ap2蛋白复合物的生物活性的中和。如本文所用的“中和性单克隆抗体”意指抗体分子的制剂,其在与胰高血糖素/ap2蛋白复合物结合后能够部分或完全抑制或降低胰高血糖素/ap2蛋白复合物活性的生物活性,即胰高血糖素/ap2蛋白复合物激活胰高血糖素受体的能力。术语“血糖水平”应指血糖浓度。在某些实施方案中,血糖水平是血浆葡萄糖水平。血浆葡萄糖可根据例如etgen等(2000)metabolism,49(5):684-688测定,或根据d'orazio等(2006)clin.chem.lab.med.,44(12):1486-1490从全血葡萄糖浓度的转换计算。术语“正常葡萄糖水平”是指对于人中禁食水平小于约100mg/dl、对于餐后2小时水平小于145mg/dl或对于随机葡萄糖小于125mg/dl的平均血浆葡萄糖值。术语“升高的血糖水平”或“血糖的升高水平”应表示血糖水平升高,诸如在表现出临床上不适当的基础和餐后高血糖症的受试者中发现的血糖水平升高或者诸如在口服葡萄糖耐量测试(ogtt)中的受试者中发现的血糖水平升高,当在禁食条件下测试时,“血糖的升高水平”大于100mg/dl,在1小时测试时大于约200mg/dl。如本文中所用,术语“减毒(attenuation)”、“缓解”等是指由升高的血糖水平引起的症状或病症的严重性的减弱或减轻。术语“表位”或“抗原决定簇”包括能够特异性结合免疫球蛋白或t细胞受体的任何多肽决定簇。在某些实施方案中,表位决定簇包括分子的化学活性表面分组(grouping),诸如氨基酸、糖侧链、磷酰基或磺酰基,并且在某些实施方案中,可具有特定的三维结构特征和/或特定的电荷特征。表位是抗体结合的抗原区域。在某些实施方案中,当抗体优先识别蛋白质和/或大分子的复杂混合物中的其靶抗原时,称抗体特异性结合抗原。如本文所用,术语“kd”旨在表示亲和力(或亲和力常数),其是抗体与抗原之间结合(缔合和解离)速率的量度,其确定了抗体结合反应的内在结合强度。如本文中所用,术语“优先结合胰高血糖素/ap2”是指所述化合物对复合物中的胰高血糖素/ap2的亲和力大于对单独的ap2、胰高血糖素和/或gcgr的亲和力。例如,化合物对胰高血糖素/ap2的亲和力可比其对单独的胰高血糖素、ap2和/或gcgr的亲和力大1-2个数量级。因此,在一个实施方案中,相对于ap2、胰高血糖素和/或gcgr而言优先与胰高血糖素/ap2结合的化合物具有比其对单独的ap2、胰高血糖素和/或gcgr的结合亲和力高1个数量级的亲和力。在一个实施方案中,相对于ap2、胰高血糖素和/或gcgr而言优先结合胰高血糖素/ap2的化合物具有比其对单独的ap2、胰高血糖素和/或gcgr的结合亲和力高2个数量级的亲和力。在一个实施方案中,相对于ap2、胰高血糖素和/或gcgr而言优先与胰高血糖素/ap2结合的化合物具有比其对单独的ap2、胰高血糖素和/或gcgr的结合亲和力高3个数量级的亲和力。在抗体、抗原结合剂或抗体片段的情况下,可将亲和力测量为抗体与其抗原之间的平衡解离常数(kd)、koff/kon的比率。kd和亲和力成反比关系。kd值与抗体浓度(特定实验所需的抗体量)相关,因此kd值越低(浓度越低),抗体的亲和力越高。在一个实施方案中,化合物对胰高血糖素/ap2复合物的kd值小于10-7,并且对于ap2、胰高血糖素或gcgr的kd值大于10-7。在一个实施方案中,化合物与胰高血糖素/ap2结合的kd值在约10-10与10-8之间,而化合物对于胰高血糖素、ap2和/或gcgr结合的kd值大于10-8。在一个实施方案中,化合物对于ap2、胰高血糖素或gcgr结合的kd值大于10-7。本文所用的术语“晶体”和“结晶的”是指以晶体形式存在的抗体或其抗原结合部分。晶体是物质的一种固态形式,其不同于其他形式诸如无定形固态或液晶态。晶体由原子、离子、分子(例如蛋白质,诸如抗体)或分子组装体(例如,抗原/抗体复合物)的规则、重复的三维阵列组成。这些三维阵列按照本领域熟知的特定数学关系排列。在晶体中重复的基本单元或结构单元称为不对称单元。以符合给定的明确定义的晶体学对称性的排列重复不对称单元提供了晶体的“晶胞”。通过所有三个维度的常规平移重复晶胞提供了晶体。参见giege,r.和ducruix,a.barrett,crystallizationofnucleicacidsandproteins,apracticalapproach,第2版,第201-16页,oxforduniversitypress,newyork,n.y.,(1999).”。如本文中所用,术语“有效量”是指足以减少或改善病症的严重性和/或持续时间或其一种或多种症状,预防病症的进展,导致病症消退,防止与病症相关的一种或多种症状的复发、发展、发作或进展,检测病症,或者增强或改善另一种疗法(例如预防或治疗剂)的预防或治疗效果的治疗量。胰高血糖素和胰高血糖素受体(gcgr)胰高血糖素是通过激素原转化酶2(pc2)(一种参与激素原和前神经肽的细胞内成熟的神经内分泌特异性蛋白酶)的细胞特异性表达在胰腺α细胞中从其前原形式加工而来的29个氨基酸的激素(furuta等(2001)j.biol.chem.276:27197-27202)。在体内,胰高血糖素是胰岛素作用的主要反调节激素。在禁食期间,胰高血糖素分泌响应于葡萄糖水平的下降而增加。增加的胰高血糖素分泌通过促进肝糖原分解和糖异生来刺激葡萄糖的产生(dunning和gerich(2007)endocrinereviews28:253-283)。因此,胰高血糖素抵消了胰岛素在动物中维持正常葡萄糖水平方面的作用。胰高血糖素氨基酸序列是:hsqgtftsdyskyldsrraqdfvqwlmnt(seq.id.no.82.)胰高血糖素的生物作用是通过特异性细胞表面受体即胰高血糖素受体的结合和随后的活化来介导的。胰高血糖素受体(gcgr)是g蛋白偶联受体(gpcr)的分泌素亚家族(b家族)的成员。gpcr是位于细胞膜中的七次跨膜的受体,其结合细胞外物质并将信号传递给称为g蛋白的细胞内分子,所述g蛋白通常激活camp信号途径或磷脂酰肌醇信号途径。人gcgr是477个氨基酸的序列gpcr,并且gcgr的氨基酸序列在物种间高度保守(mayo等,(2003)pharmacologicalrev.55:167-194)。胰高血糖素受体主要在肝脏中表达,其中其调节肝葡萄糖输出,在肾脏和胰岛β细胞上表达,在糖异生、肠平滑肌、脑和脂肪组织中体现其作用。肝脏中胰高血糖素受体的激活刺激腺苷酸环化酶和磷酸肌醇周转的活性,随后导致肝葡萄糖产生水平升高,细胞内camp增加,糖原分解增加,以及包括磷酸烯醇丙酮酸羧激酶(pepck)果糖-1,6-二磷酸酶(fbpase-1)和葡萄糖-6-磷酸酶(g-6-pase)在内的糖异生酶表达增加。另外,胰高血糖素信号传导激活糖原磷酸化酶并抑制糖原合酶。研究表明,较高的基础胰高血糖素水平和缺乏对餐后胰高血糖素分泌的抑制促进了人中糖尿病状况(muller等,(1970)nejm283:109-115)。最近,有人认为是过量的胰高血糖素活性而非胰岛素缺乏导致了糖尿病表型(ungerrh,cherringtonad.glucagonocentricrestructuringofdiabetes:apathophysiologicandtherapeuticmakeover.jclin.invest.2012jan3;122(1):4-12)。脂肪细胞蛋白2(ap2)人脂肪细胞脂质结合蛋白(ap2),也称为脂肪酸结合蛋白4(fabp4),属于参与脂质运输和储存的细胞内脂质结合蛋白家族(banzszak等,(1994)adv.proteinchem.45,89-151)。ap2蛋白参与脂肪分解和脂肪生成,并已在脂质和能量代谢疾病诸如糖尿病、动脉粥样硬化和代谢综合征中得到证实。ap2也已在代谢和炎症反应系统的整合中得到证实。(ozcan等,(2006)science313(5790):1137-40;makowski等(2005)jbiolchem.280(13):12888-95;和erbay等,(2009)natmed.15(12):1383-91)。最近,已显示ap2在某些软组织肿瘤诸如某些脂肪肉瘤中差异表达(kashima等,(2013)virchowsarch.462,465-472)。ap2在脂肪细胞中高度表达并受过氧化物酶体增生激活型受体γ(ppar-γ)激动剂、胰岛素和脂肪酸调节(hertzel等,(2000)trendsendocrinol.metab.11,175-180;hunt等,(1986)pnasusa83,3786-3790;melki等,(1993)j.lipidres.34,1527-1534;distel等,(1992)j.biol.chem.267,5937-5941)。ap2缺乏小鼠(fabp4-/-)的研究显示,抗与遗传或饮食诱导的肥胖相关的胰岛素抵抗的发展的保护作用以及具有升高水平的c16:1n7-棕榈油酸酯水平的脂肪组织中改善的脂质特征谱、减少的脂肪肝以及对肝葡萄糖产生和外周葡萄糖处置的改善的控制(hotamisligil等(1996)science274,1377-1379;uysal等(2000)endocrinol.141,3388-3396;cao等,(2008)cell134,933-944)。另外,ap2的遗传缺陷或药理学阻断减少了载脂蛋白e缺乏(apoe-/-)小鼠模型中的早期和晚期动脉粥样硬化病变(furuhashi等,(2007)nature,june21;447(7147):959-65;makowski等,(2001)naturemed.7,699-705;layne等,(2001)faseb15,2733-2735;boord等,(2002)arteriosclerosis,thrombosis和vas.bio.22,1686-1691)。此外,ap2缺乏导致抗载脂蛋白e缺乏(apoe-/-)小鼠的早期和晚期动脉粥样硬化的显著保护作用(makowski等,(2001)naturemed.7,699-705;fu等(2000)j.lipidres.41,2017-202)。因此,ap2在临床前模型中在代谢疾病发展的许多方面起着关键作用。在过去二十年中,总体上fabp以及特别地ap2的生物学功能主要归因于它们作为细胞内蛋白质的作用。由于脂肪细胞中ap2蛋白的丰度极高,占细胞总蛋白质的高达百分之几(cao等,(2013)cellmetab.17(5):768-78),利用常规方法治疗性靶向ap2具有挑战性,并且在临床前模型中获得的有希望的成功(furuhashi等,(2007)nature447,959-965;won等,(2014)naturemat.13,1157-1164;cai等,(2013)actapharm.sinica34,1397-1402;hoo等,(2013)j.ofhepat.58,358-364)在临床转化方面进展缓慢。除了其在细胞质中的存在以外,最近已经显示ap2通过非经典调节途径从脂肪组织中主动分泌(cao等(2013)cellmetab.17(5),768-778;ertunc等(2015)j.lipidres.56,423-424)。ap2的分泌形式作为新型脂肪因子起作用,并响应于禁食和禁食相关信号而调节小鼠的肝葡萄糖产生和全身葡萄糖动态平衡。血清ap2水平在肥胖小鼠中显著升高,并且阻断循环ap2在具有饮食诱导的肥胖的小鼠中改善了葡萄糖动态平衡(cao等(2013)cellmetab.17(5):768-78)。重要的是,在人群中也观察到相同的模式,其中分泌的ap2水平在肥胖中增加并且在多个独立的人研究中与代谢和心血管疾病强烈相关(xu等,(2006)clin.chem.53,405-413;yoo等,(2011)j.clin.endocrin.&metab.96,488-492;voneynatten等,(2012)arteriosclerosis,thrombosis和vas.bio.32,2327-2335;suh等,(2014)scandinavianj.gastro.49,979-985;furuhashi等,(2009)metabolism:clinicalandexperimental58,1002-1007;kaess等,(2012)j.endocrin.&metab.97,e1943-47;cabre等,(2007)atherosclerosis195,e150-158)。最后,携带导致ap2表达降低的单倍不足等位基因(haploinsufficiencyallele)的人被保护免受糖尿病和心血管疾病侵害(tuncman等,(2006)pnasusa103,6970-6975;saksi等,(2014)circulation,cardiovasculargenetics7,588-598)。属于harvarduniversity校长和研究员的标题为secretedap2andmethodsofinhibitingsame的wo2010/102171,以及属于harvarduniversity校长和研究员以及ucbbiopharmasprl的标题为anti-ap2antibodiesandantigenbindingagentstotreatmetabolicdisorders的wo2016/176656,描述了靶向循环ap2的抗体用于调节代谢病症的用途。脂肪酸结合蛋白(fabp)是脂质结合蛋白(lbp)超家族的成员。迄今已鉴定出9种不同的fabp,每种均显示相对组织富集:l(肝脏)、i(肠)、h(肌肉和心脏)、a(脂肪细胞)、e(表皮)、il(回肠)、b(脑)、m(髓磷脂)和t(睾丸)。所有fabp家族成员的主要作用是调节脂肪酸摄取和细胞内转运。所有fabp的结构都相似-表征这些蛋白质的基本基序是β-桶,以及在其内部充满水的腔中结合的脂肪酸配体或配体(例如脂肪酸、胆固醇或类视黄醇)。属于harvardcollege校长和研究员并且标题为“anti-ap2antibodiesandantigenbingingagentstotreatmetabolicdisorders”的wo2016/176656描述了针对ap2的单克隆抗体用于治疗病症诸如糖尿病、肥胖症、心血管疾病、脂肪肝疾病和/或癌症等等。人ap2蛋白是14.7kda的细胞内和细胞外(分泌的)脂质结合蛋白,其由包含表1的氨基酸序列(seq.idno.1)的132个氨基酸组成。人ap2的cdna序列先前描述于baxa,c.a.,sha,r.s.,buelt,m.k.,smith,a.j.,matarese,v.,chinander,l.l.,boundy,k.l.,bernlohr,a.humanadipocytelipid-bindingprotein:purificationoftheproteinandcloningofitscomplementarydna.biochemistry28:8683-8690,1989中,并且提供于seq.idno.5中。将该蛋白质在swiss-prot中注册,编号为p15090。表1:ap2蛋白和cdna序列鉴定中和胰高血糖素/ap2对gcgr的激动作用的化合物的方法本发明的一个方面涉及鉴定用于本文所述的疗法的调节/影响并优选中和胰高血糖素/ap2对gcgr的激动活性的化合物的方法。在一个实施方案中,所述化合物与胰高血糖素、ap2和/或胰高血糖素/ap2相互作用,而不直接拮抗gcgr。作为非限制性实例,本发明的化合物可包括通过在宿主细胞中表达合适的核酸序列或使用合成有机化学法产生的肽(例如,抗体、抗体片段或抗原结合剂),或使用本领域熟知的常规合成有机化学法产生的非肽小分子。可使鉴定测定自动化以便于同时鉴定大量的小分子。用于鉴定化合物的方法可以是基于细胞的或无细胞的。在一个实施方案中,筛选是无细胞的,筛选化合物以测定它们与ap2、胰高血糖素和/或胰高血糖素/ap2相互作用或结合的能力。例如,使化合物与ap2、胰高血糖素和/或胰高血糖素/ap2接触,然后进行测定以检测化合物与ap2、胰高血糖素和/或胰高血糖素/ap2的结合。在另外的实施方案中,可使化合物在gcgr存在的情况下与ap2、胰高血糖素和/或胰高血糖素/ap2接触,然后可测量所述胰高血糖素/ap2与gcgr的结合并将其与在化合物存在的情况下所述胰高血糖素/ap2在外部的结合进行比较。检测化合物的结合的测定法是本领域熟知的,例如如mcfedries等,methodsfortheelucidationofprotein-smallmoleculeinteractions.chemistry&biology(2013);第20卷(5):667-673;pollard,aguidetosimpleandinformativebindingassays,mol.biol.cell(2010)第21卷,4061-4067(两者均通过引用整体并入本文)中所描述的。例如,该测定可以测量ap2、胰高血糖素和/或胰高血糖素/ap2与待测化合物之间复合物的形成,或检测胰高血糖素/ap2与gcgr之间复合物的形成受到被测试的化合物干扰的程度。因此,本发明提供鉴定化合物的方法,其包括使化合物与ap2、胰高血糖素和/或胰高血糖素/ap2接触,并测定(i)ap2、胰高血糖素和/或胰高血糖素/ap2与化合物之间的复合物的存在或(ii)胰高血糖素/ap2与gcgr之间的复合物的存在。在这种竞争性结合测定中,可以标记ap2、胰高血糖素和/或胰高血糖素/ap2。将游离胰高血糖素/ap2与存在于复合物中的胰高血糖素/ap2分离,游离(即未复合的)标记的量分别为待测化合物与ap2、胰高血糖素和/或胰高血糖素/ap2的结合的量度或其对结合的干扰的量度。可使用的竞争性结合测定的实例包括利用ap2与生物素化的胰高血糖素的直接相互作用的生物层干涉测量法(参见实施例1;图3a),其中125i-胰高血糖素与生物素化的ap2相互作用的闪烁迫近测定法(参见实施例1;图3b)、测量溶液中从结合事件释放的热量的等温滴定量热法(参见实施例1;图3c)和微型热泳(参见实施例1;图4a-4d)。可在另外的测定(例如,基于细胞的生物测定或无细胞的磷酸化测定)中进一步确认能够中和对胰高血糖素/ap2对gcgr的激动作用的化合物的鉴定。用于促进结合的胰高血糖素/ap2:gcgr复合物或胰高血糖素/ap2:化合物复合物的检测或纯化的序列,诸如含有组氨酸残基或其连续序列(poly-his)的序列、c-myc部分肽(myc-标签)、血凝素部分肽(ha标签)、flag部分肽(flag标签)、谷胱甘肽-s-转移酶(gst)、麦芽糖结合蛋白(mbp)、生物素化、利用荧光物质(诸如荧光素)、eu螯合剂、发色团、发光体、酶或放射性同位素(诸如125i或氚)的标记;或者,有羟基琥珀酰亚胺残基、乙烯基吡啶残基等的化合物的结合等(用于促进与固相(诸如容器或载体)的结合),可被引入到ap2、gcgr、胰高血糖素或化合物(如果化合物是抗体或其片段的话)的氨基酸序列的氨基末端、羧基末端或中间区域,并且可在筛选期间使用此类蛋白质。在一个实施方案中,本发明提供了利用表达gcgr的真核细胞鉴定能够中和胰高血糖素/ap2对gcgr的激动作用的化合物,并分析该化合物对胰高血糖素/ap2对gcgr的激动作用的生物作用的方法。此类细胞(活的或呈固定形式的)可用于标准结合测定。例如,该测定可以在化合物存在的情况下测量胰高血糖素/ap2与gcgr之间复合物的形成,或检查在胰高血糖素/ap2存在的情况下gcgr的生物活性受化合物干扰的程度。因此,本发明提供了鉴定化合物的方法,其包括使化合物与ap2、胰高血糖素和/或胰高血糖素/ap2接触,并通过测量gcgr的生物作用而测定(i)胰高血糖素/ap2与gcgr之间的复合物的存在或(ii)胰高血糖素/ap2对gcgr的激动作用的抑制。化合物对gcgr的生物活性的影响可以通过本领域熟知的方法测定。在这种活性测定中,通常通过提供报道系统来监测gcgr的生物活性。例如,这可涉及提供天然或合成底物,其产生与gcgr刺激的生物活性对其施加作用的程度成比例的可检测信号,例如环amp形成、糖异生酶(包括磷酸烯醇丙酮酸羧激酶(pepck)、果糖-1,6-二磷酸酶(fbpase-1)和葡萄糖-6-磷酸酶(g-6-pase))、糖原磷酸化酶和糖原合酶的表达水平、肝葡萄糖生成和糖原分解的测量。基于细胞的测定包括内源或重组表达gcgr的细胞。如所表达的,gcgr可以处于单体、二聚体或多聚体的状态,只要其能够在通过胰高血糖素/ap2结合刺激时引发可测量的生物作用即可。gcgr可源自任何生物诸如人、小鼠、大鼠、牛、猪或兔。在一个实施方案中,表达的gcgr是人性质的并且源自内源性人gcgr蛋白(uniprotkb-p47871(glr_human))。gcgr可以从自然界中存在的细胞或组织中提取,并且可以通过遗传工程方法从表达该亚基的细胞或组织中提取。gcgr可以是纯化的或未纯化的。可使用通过遗传工程方法产生的gcgr(其具有报道的氨基酸序列或通过遗传突变获得的变体氨基酸序列),只要其基本上保持活性即可。在一个实施方案中,所述测定是无细胞测定,并且使所述化合物在液相中与ap2、胰高血糖素和/或胰高血糖素/ap2接触,或者可选地将ap2、胰高血糖素和/或胰高血糖素/ap2固定于固相(诸如柱子),然后与化合物接触。例如,可通过使用可反应的氨基(诸如羟基琥珀酰亚胺基),通过在表面上使用反应性羧基(诸如肼基),或通过使用可与表面上的硫醇基团反应的基团(诸如乙烯基吡啶基团)将胰高血糖素/ap2通过生物素/链霉抗生物素蛋白固定到固相上。例如,可通过使用静电吸引力或分子间力附着到由聚苯乙烯树脂或玻璃组成的固相上,通过将胰高血糖素/ap2与通过固定针对添加到ap2和/或胰高血糖素/ap2的氨基酸序列(诸如poly-his、myc标签、ha标签、flag标签、gst或mbp)的抗体获得的固相结合,通过将连接有poly-his的胰高血糖素/ap2与在表面上具有金属螯合剂的固相结合,通过将连接有gst的胰高血糖素/ap2与在表面上具有谷胱甘肽的固相结合,或通过将连接有mbp的胰高血糖素/ap2与在表面上具有糖诸如麦芽糖的固相结合来将胰高血糖素/ap2固定到固相(诸如柱子)上。胰高血糖素/ap2也可以通过另一种通常已知的方法固定到固相上。化合物与胰高血糖素/ap2的接触步骤可以例如通过混合含有它们的溶液来进行。或者,如果例如将胰高血糖素/ap2或可选地化合物固定到固相诸如柱子、管或多孔板上,则加入含有未结合的化合物的溶液。可以在无细胞测定中进一步测试发现与ap2、胰高血糖素和/或胰高血糖素/ap2结合的化合物,以测定阻止gcgr的胰高血糖素/ap2结合的能力。例如,在一个实施方案中,可以在所述化合物存在和不存在的情况下分别测量包含在液相中或固定于固相(诸如柱子、容器或载体)的胰高血糖素/ap2与gcgr的结合,并且观察取决于该化合物的添加的结合变化,以评价该化合物对胰高血糖素/ap2与gcgr结合的抑制作用。胰高血糖素/ap2与gcgr的结合可以在分离或不分离它们的情况下测量。例如,可以通过凝胶过滤方法,使用亲和树脂、离子交换树脂等的柱方法,离心方法或洗涤方法分离胰高血糖素/ap2、gcgr和与gcgr结合的胰高血糖素/ap2(胰高血糖素/ap2:gcgr)。例如,可在通过凝胶过滤法或柱方法(亲和树脂、离子交换树脂等)从液相中分离与gcgr结合的胰高血糖素/ap2、gcgr和未结合的胰高血糖素/ap2后,测量与gcgr结合的胰高血糖素/ap2的量,或未与gcgr结合的胰高血糖素/ap2的量。在将胰高血糖素/ap2固定到固相(诸如柱子、容器或载体)的情况下,可在所述化合物存在和不存在的情况下通过离心、洗涤、分配分离、沉淀等将固相(例如柱,容器或载体)与液相分离。在这种情况下,结合量可通过测量与分离的固相(诸如柱子、容器或载体)结合的gcgr的量直接获得,或通过测量保留在液相中的gcgr的量间接获得,两者都在该化合物存在和不存在的情况下进行。可通过使用可与gcgr特异性反应的蛋白质或抗体的免疫沉淀方法,以及通过凝胶过滤方法,使用亲和树脂、离子交换树脂等的柱方法,离心方法或洗涤方法分离液相中的gcgr。胰高血糖素/ap2和gcgr的结合量可以通过测量分离的胰高血糖素/ap2或gcgr的量直接获得,或通过测量与含有结合的胰高血糖素/ap2和gcgr的级分分离的级分中包含的胰高血糖素/ap2或gcgr的量间接获得。在上述方法中,溶液中所含的胰高血糖素/ap2:gcgr和胰高血糖素/ap2:化合物的量可使用例如用生物素标记、放射性同位素、荧光团、发色团或化学发光部分标记的胰高血糖素/ap2来测量。例如,生物素标记的胰高血糖素/ap2的量可通过使用能够以高亲和力结合生物素的蛋白质(诸如抗生物素蛋白、链霉抗生物素蛋白或其变体蛋白(以下称为抗生物素蛋白)),使得抗生物素蛋白被可被容易地检测到的放射性同位素、荧光团、发光体或酶标记并且结合于生物素标记的化合物来测量。放射性物质可使用普通的辐射测量装置诸如闪烁计数器、伽马计数器或gm计来测量。荧光团、发色团和发光体可分别使用荧光测量装置、吸光光度计和发光测量装置测量。可使用通过酶转化为生色、荧光或发光化合物的化合物容易地测量酶标记的化合物的量。可以如下测量溶液中包含的结合或未结合的胰高血糖素/ap2的量。例如,可以以与以上相同的方式测量用生物素、荧光物质(诸如荧光素)、eu螯合剂、发色团、发光体或放射性同位素(诸如125i或氚)标记的胰高血糖素/ap2。可以通过免疫沉淀法、western印迹法、固相酶免疫测定法(酶联免疫吸附测定法:elisa)或夹心测定法(诸如放射免疫测定法),通过使用蛋白质诸如链霉抗生物素蛋白、针对胰高血糖素/ap2的抗体、针对添加到ap2的氨基酸序列(诸如poly-his、myc标签、ha标签、flag标签、gst或mbp)的抗体、具有针对添加聚-his的胰高血糖素/ap2的金属螯合剂的分子、具有针对添加gst的胰高血糖素/ap2的谷胱甘肽的分子、具有糖诸如针对添加mbp的胰高血糖素/ap2的麦芽糖的分子等来测量生物素化的胰高血糖素/ap2。在一个更具体的实例中,在化合物存在/不存在的情况下,在抗myc抗体(小鼠来源的单克隆抗体)和固定有抗小鼠免疫球蛋白抗体的spa珠存在的情况下,使用96-多孔板使具有myc标签序列的胰高血糖素/ap2与氚标记的gcgr接触,并在一定时间后,使用闪烁计数器测量胰高血糖素-ap2与氚标记的gcgr的结合量,并比较在所述化合物存在/不存在的情况下获得的计数值,由此测量化合物对胰高血糖素/ap2与gcgr的结合的抑制作用。用于测量化合物对胰高血糖素/ap2与gcgr的结合的抑制活性的方法没有特别限制。例如,可通过以下方式测量抑制活性:将胰高血糖素/ap2固定于固相;在化合物存在或不存在的情况下使胰高血糖素/ap2与gcgr接触;以及测量与固相上的胰高血糖素/ap2键合的gcgr的量,以测量化合物对胰高血糖素/ap2与gcgr的结合的抑制活性。或者,该方法包括将gcgr固定于固相;在化合物存在或不存在的情况下使gcgr与胰高血糖素/ap2接触;测量与固相键合的胰高血糖素/ap2的量,以测量所述化合物对胰高血糖素/ap2与gcgr的结合的抑制活性。另一种选择包括在化合物存在或不存在的情况下使胰高血糖素/ap2与gcgr接触;和测量胰高血糖素/ap2和gcgr的结合量,以测量所述化合物对胰高血糖素/ap2与gcgr的结合的抑制活性。在任何上述方法中,例如,可以将在化合物存在的情况下通过接触获得的结合量与在化合物不存在时通过接触获得的结合量进行比较,以测量该化合物对胰高血糖素/ap2与gcgr的结合的抑制活性。在一个实施方案中,该测定是基于细胞的测定,其中通过测量所述化合物对胰高血糖素/ap2与gcgr的结合的抑制活性来鉴定化合物的方法使用含有gcgr的细胞、组织或其提取物。基本上含有gcgr的细胞或组织可以源自任何生物,并且可以是任何细胞或组织,尽管优选为哺乳动物细胞或组织,包括人细胞或组织。所述细胞或组织可以是其中内源表达gcgr或通过基因工程程序表达gcgr的细胞或组织。在一个实施方案中,使表达gcgr的细胞群与包含胰高血糖素、ap2和/或胰高血糖素/ap2的溶液接触,并在化合物存在和不存在的情况下测量gcgr的生物活性。gcgr生物活性通常是指由gcgr与其激动性结合配偶体胰高血糖素/ap2之间的相互作用产生的任何可观察到的作用。生物活性可以是胰高血糖素/ap2与gcgr的结合、gcgr介导的细胞内信号转导的检测;或终点生理效应的确定。胰高血糖素/ap2激动性刺激后gcgr生物活性的代表性但非限制性实例包括但不限于本文论述的过程的信号传导和调节,例如环amp形成的抑制,糖原分解的减少,减少的糖异生酶(包括磷酸烯醇丙酮酸羧激酶(pepck)、果糖-1,6-二磷酸酶和葡萄糖-6-磷酸酶)的表达和糖原磷酸化酶的失活以及糖原合酶活性的增加。在一个实施方案中,所述化合物是小分子、配体、抗体、抗原结合剂或抗体片段,其结合ap2、胰高血糖素和/或胰高血糖素/ap2并中和胰高血糖素/ap2激动gcgr的能力。测量gcgr刺激的生物效应的方法是本领域已知的,检测gcgr生物活性的测定的非限制性实例在下面的实施例中进一步举例说明,并且包括与减少的葡萄糖异生酶(包括磷酸烯醇丙酮酸羧激酶(pepck)、果糖-1,6-二磷酸酯(fbpase-1)和葡萄糖-6-磷酸酶(g-6-pase))的表达(参见实施例1;图1a和1b;图2a,2c和2d)、减少的肝葡萄糖产生(参见实施例1;图1c)、减少的糖原分解(参见实施例1;图1d)和对环amp形成的抑制(参见实施例1;图1e和1f)相关的测定。在一个非限制性的说明性实例中,细胞测定可以用不同浓度的胰高血糖素/ap2、gcgr和/或化合物进行,以确认例如所述化合物干扰胰高血糖素/ap2激动gcgr的能力的功效。例如,如上本发明的第五方面所述,本发明的第五方面的第一细胞测定可以如下进行。在1当量的ap2和1当量的胰高血糖素存在的情况下,将1当量的目标化合物加入到表达gcgr的细胞溶液中。然后使用本文描述的或本领域已知的任何方法测量gcgr的活性。在一个典型的实施方案中,目标化合物的浓度等于或高于细胞测定中ap2和胰高血糖素的浓度。在一个实施方案中,目标化合物的浓度为约1当量、2当量、3当量、4当量、5当量、10当量、15当量或20当量,并且ap2和胰高血糖素的浓度为约1当量。在目标化合物存在的情况下测量gcgr活性的方法包括本文所述的和在thomasd.pollard的论文“aguidetosimpleandinformativebindingassays”,mboc;2010;第21卷no.234061中所述的那些方法。在一个非限制性的说明性实例中,本发明第五方面的第二细胞测定可以如下进行。在20当量的ap2和20当量的胰高血糖素存在的情况下,将1当量的目标化合物加入到表达gcgr的细胞溶液中。然后使用本文描述的或本领域已知的任何方法测量gcgr的活性。在一个典型的实施方案中,目标化合物的浓度小于细胞测定中ap2和胰高血糖素的浓度(即ap2和胰高血糖素相对于目标化合物是饱和的)。在一个实施方案中,ap2和胰高血糖素的浓度为约5当量、10当量、15当量、20当量、25当量、30当量、35当量或40当量,并且目标化合物的浓度为1当量。在一个实施方案中,目标化合物对胰高血糖素和ap2的当量是未知的,取而代之使用化合物的浓度。在一个非限制性的说明性实例中,本发明的第六方面的细胞测定可以如下进行。在1当量的ap2和1当量的胰高血糖素存在的情况下,将0.5当量的目标化合物加入到表达gcgr的细胞溶液中。然后使用本文描述的或本领域已知的任何方法测量gcgr的活性。然后使用1当量,然后1.5当量,2当量等的目标化合物连续重复测定。在一个实施方案中,上述程序通过连续稀释进行,从最高浓度的化合物开始并将其重复稀释至达到最低浓度。在目标化合物存在的情况下测量gcgr活性的方法包括本文所述的和在thomasd.pollard的论文“aguidetosimpleandinformativebindingassays”,mboc;2010;第21卷no.234061中所论述的那些方法。在一个实施方案中,目标化合物的浓度以对数方式变化,例如100当量、10当量、1当量和0.1当量的化合物。在另一个实施方案中,化合物的当量是未知的,取而代之改变化合物的浓度,例如100mm、10mm、1mm、100nm、10nm和1nm可以是所用的浓度。还提供了选择相对于单独的ap2而言选择性与胰高血糖素/ap2结合的化合物(例如抗体)的方法。用于鉴定优选结合抗体的方法通常是本领域已知的。在一个实施方案中,本文提供了鉴定相对于ap2而言选择性与胰高血糖素/ap2结合的抗体的方法,其通常包括向非人动物,例如兔、小鼠、大鼠或山羊施用异源胰高血糖素/ap2蛋白复合物,例如人胰高血糖素/ap2,以产生针对复合物中的异源胰高血糖素/ap2的抗体,分离所述抗体,使所述抗体经受一种或多种测量对胰高血糖素/ap2和单独的ap2的结合亲和力的结合测定,例如竞争性结合测定,其中分离相对于ap2而言优先与胰高血糖素/ap2结合的抗体以用于中和胰高血糖素/ap2对gcgr的激动作用。例如,可使用通过免疫学领域的技术人员熟知的标准方法完成的杂交瘤来产生针对胰高血糖素/ap2的抗体。通过竞争性抑制测定mab特异性和亲和力的优选方法可见于harlow等,antibodies:alaboratorymanual,coldspringharborlaboratorypress,coldspringharbor,n.y.,1988),colligan等,编辑,currentprotocolsinimmunology,greenepublishingassoc.andwileyinterscience,n.y.,(1992,1993)和muller,meth.enzymol.92:589-601(1983),所述参考文献通过引用整体并入本文。融合配偶体细胞系和用于融合和选择杂交瘤以及筛选mab的方法是本领域熟知的。通过将分泌抗体的杂交瘤或转染瘤细胞注射到小鼠的腹膜腔中,并在适当的时间后收获含有高滴度的mab的腹水并从其分离mab,可以大量生产胰高血糖素/ap2特异性mab。对于此类利用非鼠杂交瘤(例如,大鼠或人)的mab的体内产生,将杂交瘤细胞优选在经辐射或无胸腺裸鼠中生长。或者,可通过体外培养杂交瘤或转染瘤细胞并从细胞培养基中分离分泌的mab来产生抗体,或在真核或原核细胞中重组地产生抗体。应注意,用于鉴定上述化合物的方法被认为是说明性的而非限制性的。ap2和/或胰高血糖素-ap2复合物中和性化合物在本发明的一个方面,提供了调节gcgr信号传导的方法,其包括向受试者施用化合物,所述化合物通过抑制胰高血糖素/ap2复合物的形成或通过直接靶向胰高血糖素/ap2、胰高血糖素或ap2,有效中和胰高血糖素/ap2刺激gcgr的能力以抑制胰高血糖素/ap2复合物与gcgr的相互作用来中和胰高血糖素/ap2复合物对gcgr的激动作用。在一个实施方案中,化合物是抗ap2和/或抗胰高血糖素/ap2复合物抗体、抗体片段或抗原结合剂,包括例如单克隆抗体、抗体片段或抗原结合剂。在一个实施方案中,化合物是人源化单克隆抗体或抗原结合剂。在一个实施方案中,抗体、抗体片段或抗原结合剂相对于ap2和胰高血糖素而言优先与胰高血糖素/ap2结合。在一个实施方案中,所述抗体、抗体片段或抗原结合剂相对于ap2和胰高血糖素而言优先与胰高血糖素/ap2结合。在一个实施方案中,所述抗体、抗体片段或抗原结合剂不结合gcgr。产生抗体、抗体片段或抗原结合剂的方法是本领域已知的。参见,例如,us2011/0129464。例如,优选通过多次皮下(sc)或腹膜内(ip)注射相关抗原和佐剂(例如,ap2、胰高血糖素,或优选与ap2复合的胰高血糖素(胰高血糖素/ap2))在动物中产生多克隆抗体。使用双功能或衍生剂例如马来酰亚胺苯甲酰磺基琥珀酰亚胺酯(通过半胱氨酸残基缀合)、n-羟基琥珀酰亚胺(通过赖氨酸残基)、戊二醛、琥珀酸酐、socl2或r1n=c=nr(其中r和r1是不同的烷基)将相关抗原缀合于在待免疫物种中具有免疫原性的蛋白质(例如,匙孔血蓝蛋白、血清白蛋白、牛甲状腺球蛋白或大豆胰蛋白酶抑制剂)可能是有用的。例如,通过将例如100μg或5μg的蛋白质或缀合物(分别用于兔或小鼠)与3体积的弗氏完全佐剂组合并在多个部位皮内注射该溶液,用抗原、免疫原性缀合物或衍生物免疫动物。一个月后,通过在多个部位皮下注射,用1/5至1/10原始量的在弗氏完全佐剂中的肽或缀合物加强动物。7至14天后,将动物放血并测定血清的抗体滴度。将动物加强至滴度平稳。优选地,用相同抗原(但缀合于不同的蛋白质和/或通过不同的交联剂)的缀合物加强动物。还可在重组细胞培养物中作为蛋白质融合物产生缀合物。此外,凝聚剂诸如明矾适合用于增强免疫应答。单克隆抗体获自基本上均质的抗体群,即该群中包含的各种抗体是相同的,除了可能以极小量存在的潜在天然发生的突变以外。因此,修饰语“单克隆”表示抗体的特征不是不同抗体的混合物。例如,可以使用杂交瘤方法制造单克隆抗体,所述方法首次描述在kohler等,nature,256:495(1975)中,或者可以通过重组dna方法(美国专利号4,816,567)制造。在杂交瘤方法中,如上所述免疫小鼠或其他合适的宿主动物,诸如仓鼠,以引发产生或能够产生特异性结合用于免疫的蛋白质的抗体的淋巴细胞。或者,可以在体外免疫淋巴细胞。然后使用合适的融合剂(诸如聚乙二醇)将淋巴细胞与骨髓瘤细胞融合以形成杂交瘤细胞(goding,monoclonalantibodies:principlesandpractice,第59-103页(academicpress,1986))。将如此制备的杂交瘤细胞接种并生长在合适的培养基中,所述培养基优选含有一种或多种抑制未融合的亲本骨髓瘤细胞生长或存活的物质。例如,如果亲本骨髓瘤细胞缺乏次黄嘌呤鸟嘌呤磷酸核糖基转移酶(hgprt或hprt),则杂交瘤的培养基通常包括次黄嘌呤、氨基喋呤和胸苷(hat培养基),所述物质可防止hgprt缺乏细胞的生长。优选的骨髓瘤细胞是高效融合,支持选择的抗体生成细胞的稳定高水平抗体产生,并且对诸如hat培养基的培养基敏感的那些细胞。其中,优选的骨髓瘤细胞系是鼠骨髓瘤细胞系,诸如源自可从salkinstitutecelldistributioncenter,sandiego,calif.usa获得的mopc-21和mpc-11小鼠肿瘤以及可从美国典型培养物保藏中心,rockville,md.usa获得的sp-2或x63-ag8-653细胞的那些细胞系。已经描述了人骨髓瘤和小鼠-人异源骨髓瘤细胞系用于产生人单克隆抗体(kozbor,j.immunol.,133:3001(1984);和brodeur等,monoclonalantibodyproductiontechniquesandapplications,第51-63页(marceldekker,inc.,newyork,1987))。测定杂交瘤细胞在其中生长的培养基以产生针对抗原的单克隆抗体。优选地,由杂交瘤细胞产生的单克隆抗体的结合特异性通过免疫沉淀或通过体外结合测定法(诸如放射免疫测定法(ria)或酶联免疫吸附测定法(elisa))来测定。单克隆抗体的结合亲和力可以例如通过munson等,anal.biochem.,107:220(1980)的scatchard分析来测定。在鉴定产生具有所需特异性、亲和力和/或活性的抗体的杂交瘤细胞后,可通过有限稀释法对克隆进行亚克隆并通过标准方法(goding,monoclonalantibodies:principlesandpractice,第59-103页(academicpress,1986))进行培养。用于此目的的合适培养基包括例如d-mem或rpmi-1640培养基。另外,可将杂交瘤细胞在体内作为动物的腹水瘤生长。由亚克隆分泌的单克隆抗体通过常规抗体纯化方法(诸如蛋白a-sepharose、羟基磷灰石层析、凝胶电泳、透析或亲和层析)适当地与培养基、腹水或血清分离。编码单克隆抗体的dna易于使用常规方法(例如,通过使用能够与编码鼠抗体的重链和轻链的基因特异性结合的寡核苷酸探针)分离和测序。杂交瘤细胞用作这种dna的优选来源。分离后,可将dna置于表达载体中,然后将其转染到原来不会产生抗体蛋白的宿主细胞(诸如大肠杆菌细胞、猿猴cos细胞、中国仓鼠卵巢(cho)细胞或骨髓瘤细胞)中,获得重组宿主细胞中单克隆抗体的合成。关于编码所述抗体的dna在细菌中重组表达的综述文章包括skerra等,curr.opinioninimmunol.,5:256-262(1993)和plückthun,immunol.revs.,130:151-188(1992)。在一个另外的实施方案中,单克隆抗体或抗体片段可从使用mccafferty等,nature,348:552-554(1990)中描述的技术产生的抗体噬菌体文库中分离。clackson等,nature,352:624-628(1991)和marks等,j.mol.biol.,222:581-597(1991)分别描述了使用噬菌体文库分别分离鼠和人抗体。随后的出版物描述了通过链改组(marks等,bio/technology,10:779-783(1992))以及组合感染和体内重组(作为用于构建非常大的噬菌体文库的策略)(waterhouse等,nuc.acids.res.,21:2265-2266(1993)产生高亲和力(nm范围)人抗体。因此,这些技术是用于分离单克隆抗体的常规单克隆抗体杂交瘤技术的可行替代方案。还可以例如通过用人重链和轻链恒定结构域的编码序列代替同源鼠序列(美国专利号4,816,567;和morrison等,proc.natl.acad.sci.usa,81:6851(1984)),或通过将全部或部分非免疫球蛋白多肽的编码序列共价连接于免疫球蛋白编码序列来修饰dna。通常,将这种非免疫球蛋白多肽取代抗体的恒定结构域,或者将它们取代抗体的一个抗原结合部位的可变结构域以产生嵌合二价抗体,所述嵌合二价抗体包含一个对抗原具有特异性的抗原结合部位和另一个对不同抗原具有特异性的抗原结合部位。本领域已经描述了用于人源化非人抗体的方法。优选地,人源化抗体具有从非人来源引入其中的一个或多个氨基酸残基。这些非人氨基酸残基通常称为“输入”残基,其通常取自“输入”可变结构域。人源化可以基本上按照winter和同事的方法(jones等,nature,321:522-525(1986);riechmann等,nature,332:323-327(1988);verhoeyen等,science,239:1534-1536(1988)),通过将高变区序列替换为人抗体的相应序列来进行。因此,这种“人源化”抗体是嵌合抗体(美国专利第4,816,567号),其中明显小于完整的人可变结构域已被来自非人物种的相应序列取代。在实践中,人源化抗体通常是人抗体,其中一些高变区残基和可能的一些fr残基被来自啮齿动物抗体中类似位点的残基取代。用于制备人源化抗体的人可变结构域(轻链和重链)的选择对于降低抗原性非常重要。根据所谓的“最佳拟合”方法,针对已知的人可变域序列的整个文库筛选啮齿动物抗体的可变结构域的序列。然后将最接近啮齿动物的人序列接受为人源化抗体的人框架区(fr)(sims等,j.immunol.,151:2296(1993);chothia等,j.mol.biol.,196:901(1987))。另一种方法使用衍生自特定轻链或重链亚组的所有人抗体的共有序列的特定框架区。相同的框架可用于几种不同的人源化抗体(carter等,proc.natl.acad.sci.usa,89:4285(1992);presta等,j.immunol.,151:2623(1993))。更重要的是,抗体被人源化,保留对抗原的高亲和力和其他有利的生物特性。为了实现该目标,根据一种优选方法,通过使用亲本和人源化序列的三维模型分析亲本序列和各种概念性人源化产物的方法制备人源化抗体。三维免疫球蛋白模型通常是可获得的并且是本领域技术人员熟悉的。可获得说明和显示所选候选免疫球蛋白序列的可能的三维构象结构的计算机程序。检查这些展示允许分析残基在候选免疫球蛋白序列功能中的可能作用,即分析影响候选免疫球蛋白结合其抗原的能力的残基。这样,可以从受者和输入序列中选择并组合fr残基,使得能够获得所需的抗体特征,诸如对一种或多种靶抗原的增强的亲和力。通常,高变区残基直接且最实质性地参与影响抗原结合。设想了各种形式的人源化抗体或亲和力成熟抗体。例如,人源化抗体或亲和力成熟抗体可以是抗体片段,例如fab,其任选地与一种或多种细胞毒性剂缀合以产生免疫缀合物。或者,人源化抗体或亲和力成熟抗体可以是完整抗体,诸如完整的igg1抗体。作为人源化的替代,可以产生人抗体。例如,现在有可能产生在免疫后能够在不存在内源性免疫球蛋白产生的情况下产生完整的人抗体库的转基因动物(例如,小鼠)。例如,已经描述了嵌合和种系突变小鼠中抗体重链连接区(jh)基因的纯合缺失导致内源性抗体产生的完全抑制。在这种种系突变小鼠中转移人种系免疫球蛋白基因阵列将导致在抗原攻击后产生人抗体。参见,例如,jakobovits等,proc.natl.acad.sci.usa,90:2551(1993);jakobovits等,nature,362:255-258(1993);bruggermann等,yearinimmunol.,7:33(1993)和美国专利第5,591,669号、第5,589,369号和第5,545,807号。或者,噬菌体展示技术(mccafferty等,nature348:552-553(1990))可用于从未免疫供体的免疫球蛋白可变(v)结构域基因库中体外产生人抗体和抗体片段。根据该技术,将抗体v结构域基因框内克隆到丝状噬菌体诸如m13或fd的主要或次要外壳蛋白基因中,并在噬菌体颗粒的表面上展示为功能性抗体片段。因为丝状颗粒含有噬菌体基因组的单链dna拷贝,所以基于抗体功能特性的选择也导致编码展示这些特性的抗体的基因的选择。因此,噬菌体模拟b细胞的一些特性。噬菌体展示可以以多种形式进行;关于它们的综述,参见例如johnson,kevins.和chiswell,davidj.,currentopinioninstructuralbiology3:564-571(1993)。几种v基因区段的来源可用于噬菌体展示。clackson等,nature,352:624-628(1991)从源自免疫小鼠脾脏的v基因的小随机组合文库中分离出多种抗噁唑酮抗体。可以构建来自未免疫的人供体的v基因库,并且可以基本上按照marks等,j.mol.biol.222:581-597(1991)或griffith等,emboj.12:725-734(1993)所述的技术分离针对一批不同的抗原(包括自身抗原)的抗体。还参见美国专利第5,565,332号和第5,573,905号。如上所述,人抗体也可以通过体外活化的b细胞产生(参见美国专利第5,567,610号和第5,229,275号)。各种技术已被开发来用于产生抗体片段。常规地,这些片段是通过完整抗体的蛋白水解消化得到的(参见,例如,morimoto等,journalofbiochemicalandbiophysicalmethods24:107-117(1992);和brennan等,science,229:81(1985))。然而,现在可以通过重组宿主细胞直接产生这些片段。例如,可以从上面论述的抗体噬菌体文库中分离抗体片段。或者,可直接从大肠杆菌中回收fab'-sh片段并将其化学偶联以形成f(ab')2片段(carter等,bio/technology10:163-167(1992))。根据另一种方法,可以直接从重组宿主细胞培养物中分离f(ab')2片段。用于产生抗体片段的其他技术对于技术人员来说是显而易见的。在其他实施方案中,所选择的抗体是单链fv片段(scfv)。参见wo93/16185;美国专利第5,571,894号;和美国专利第5,587,458号。抗体片段也可以是“线性抗体”,例如,如美国专利第5,641,870号中所述的。此类线性抗体片段可以是单特异性的或双特异性的。上文已经描述了用于产生抗体的技术。可以根据需要进一步选择具有某些生物特征(例如,相对于ap2和/或胰高血糖素/和/或gcgr而言优先与胰高血糖素/ap2复合物结合)的抗体。为了鉴定抑制胰高血糖素/ap2对gcgr受体的激动作用的抗体,可以测定抗体阻断胰高血糖素/ap2配体与表达gcgr的细胞的结合的能力。例如,可将天然表达或经转染以表达gcgr受体的细胞与抗体一起孵育,然后暴露于标记的胰高血糖素/ap2。然后评估抗胰高血糖素/ap2抗体阻断与gcgr的结合的能力。例如,抗胰高血糖素/ap2单克隆抗体对胰高血糖素/ap2与肝细胞中gcgr结合的抑制可以以24孔板形式在冰上使用单层肝细胞培养物来进行。可向每个孔中加入抗胰高血糖素/ap2单克隆抗体并孵育30分钟。然后可加入125i标记的胰高血糖素或ap2或胰高血糖素/ap2,并且可将孵育持续4至16小时。可以制备剂量响应曲线,并且可以计算目标抗体的ic50值。在一个实施方案中,阻断gcgr受体的配体活化的抗体在该测定中具有约50nm或更低,更优选10mm或更低的抑制胰高血糖素/ap2与肝细胞结合的ic50。当抗体是抗体片段诸如fab片段时,在该测定中抑制胰高血糖素/ap2与肝细胞上gcgr结合的ic50可以是例如约100nm或更低,更优选50nm或更低。可选择地/另外地,可以评估抗胰高血糖素/ap2抗体通过gcgr阻断胰高血糖素/ap2配体刺激的camp产生的能力。例如,可将内源性表达gcgr或经转染以表达gcgr的细胞与抗体一起孵育,然后测定胰高血糖素/ap2配体依赖性camp活性。在一个实施方案中,施用的抗体和片段含有具有可变区的轻链或轻链片段,其中所述可变区包含独立地选自seq.idno.7、seq.idno.8和seq.idno.9、seq.idno.10、seq.idno.11、seq.idno.12和seq.idno.13的一个、两个或三个cdr。或者,可通过取代一个或多个氨基酸(例如,1个、2个、3个、4个、5个、6个、7个或8个氨基酸)来改变一个或多个公开和选择的cdr,如本文中进一步描述的,所述取代不会不利地影响或能够改善抗体或抗原结合剂的性质。在一个实施方案中,将选择的一个或多个cdr置于人免疫球蛋白框架中。在一个实施方案中,进一步修饰或改变人免疫球蛋白框架以维持移植的cdr区的结合亲和力特异性。在本发明的一个方面,向受试者施用抗体或抗原结合剂,其中所述抗体包含表2中提供的cdr区中的至少一个或不止一个cdr区。表2:抗ap2/ap2-胰高血糖素蛋白复合物抗体互补决定区蛋白质seq.idno.sequencecdrl17qasedisrylvcdrl1变体122svsssisssnlhcdrl28kastlascdrl2变体123gtsnlascdrl39qctygtyagsffyscdrl3变体110qatygtyagsffyscdrl3变体211qqtygtyagsffyscdrl3变体312qhtygtyagsffyscdrl3变体413qqashypltcdrl3变体524qqwshypltcdrh114gfslstyymscdrh1变体115gytftsnaitcdrh1变体225gytftsnwitcdrh216iiypsgstycaswakgcdrh2变体117iiypsgstysaswakgcdrh2变体218dispgsgsttnnekfkscdrh2变体326diypgsgsttnnekfkscdrh319pdndgtsgylsgfglcdrh3变体120pdnegtsgylsgfglcdrh3变体221lrgfydyfdfcdrh3变体327lrgyydyfdf在一个实施方案中,胰高血糖素/ap2中和性抗体或抗原结合片段是包含轻链的单克隆抗体或抗原结合片段,其中可变结构域包含独立地选自cdrl1(qasedisrylv)(seq.idno.7),cdrl1变体1(svsssisssnlh)(seq.idno.22)、cdrl2(kastlas)(seq.idno.8)、cdrl2变体1(gtsnlas)(seq.idno.23)、cdrl3(qctygtyagsffys)(seq.id.no.9)、cdrl3变体1(qatygtyagsffys)(seq.idno.10)、cdrl3变体2(qqtygtyagsffys)(seq.idno.11)、cdrl3变体3(qhtygtyagsffys)(seq.idno.12)、cdrl3变体4(qqashyplt)(seq.idno.13)或cdrl3变体5(qqwshyplt)(seq.idno.24)的一个、二个或三个cdr。在一个实施方案中,所述抗体或抗原结合剂包含轻链可变区,其包含cdrl1(seq.idno.7)、cdrl2(seq.idno.8)和cdrl3(seq.idno.9)。在一个实施方案中,所述抗体或抗原结合剂包含轻链可变区,其包含cdrl1(seq.idno.7)、cdrl2(seq.idno.8)和cdrl3变体1(seq.idno.10)。在一个实施方案中,所述抗体或抗原结合剂包含轻链可变区,其包含cdrl1(seq.idno.7)、cdrl2(seq.idno.8)和cdrl3变体2(seq.idno.11)。在一个实施方案中,所述抗体或抗原结合剂包含轻链可变区,其包含cdrl1(seq.idno.7)、cdrl2(seq.idno.8)和cdrl3变体3(seq.idno.12)。在一个实施方案中,抗体或抗原结合剂包含轻链可变区,其包含cdrl3变体4(seq.idno.13),其中抗体具有约≥10-7m的kd。在一个实施方案中,抗体或抗原结合剂包含轻链可变区,其包含cdrl1变体1(seq.idno.22)、cdrl2变体1(seq.idno.23)和cdrl3变体4(seq.idno.13)。在一个实施方案中,抗体或抗原结合剂包含含有cdrl3变体4(seq.idno.13)的轻链可变区和含有cdhr1变体1(gytftsnait)(seq.idno.15)、cdrh2变体2(dispgsgsttnnekfks)(seq.idno.18),以及在一个实施方案中,cdrh3变体2(lrgfydyfdf)(seq.idno.21)的重链可变区。在一个实施方案中,抗体或抗原结合剂包含选自cdrl1(seq.idno.7)、cdrl2(seq.idno.8)、cdrl3(seq.idno.9)、cdrl3变体1(seq.idno.10)、cdrl3变体2(seq.idno.11)、cdrl3变体3(seq.idno.12)和cdrl3变体4(seq.idno.13)的一个、两个或三个cdr,并且kd为约≥10-7m。在一个实施方案中,将上文鉴定的cdr序列移植到人免疫球蛋白框架中。在一个实施方案中,进一步修饰或改变人免疫球蛋白框架(例如在游标区内),以维持移植的cdr区的结合亲和力特异性。在一个实施方案中,抗体或抗原结合剂包含轻链,其中可变结构域包含独立地选自与cdrl1(seq.idno.7)、cdrl2(seq.idno.8)、cdrl3(seq.idno.9)、cdrl3变体1(seq.idno.10)、cdrl3变体2(seq.idno.11)、cdrl3变体3(seq.idno.12)或cdrl3变体4(seq.idno.13)具有至少80%、85%、90%或95%同源性的氨基酸序列的一个、两个或三个cdr。在一个实施方案中,抗体或抗原结合剂的kd约≥10-7m。在一个实施方案中,将上文鉴定的cdr序列移植到人免疫球蛋白框架中。在一个实施方案中,进一步修饰或改变人免疫球蛋白框架(例如在游标区内),以维持移植的cdr区的结合亲和力特异性。在一个实施方案中,抗体或抗原结合剂包含轻链,其中可变结构域包含独立地选自与cdrl1(seq.idno.7)、cdrl2(seq.idno.8)、cdrl3(seq.idno.9)、cdrl3变体1(seq.idno.10)、cdrl3变体2(seq.idno.11)、cdrl3变体3(seq.idno.12)或cdrl3变体4(seq.idno.13)相比具有一个或多个(例如,1个、2个、3个或4个)氨基酸取代、添加或缺失的氨基酸序列的一个、两个或三个cdr。在一个实施方案中,抗体或抗原结合剂包含轻链,其中可变结构域包含选自cdrl1(seq.idno.7)、cdrl2(seq.idno.8)、cdrl3(seq.idno.9)、cdrl3变体1(seq.idno.10)、cdrl3变体2(seq.idno.11)、cdrl3变体3(seq.idno.12)或cdrl3变体4(seqid号13)的的一个、两个或三个cdr,以及选自cdrh1(gfslstyyms)(seq.idno.14)、cdrh1变体1(seq.idno.15)、cdrh1变体2(gytftsnwit)(seq.idno.25)、cdrh2(iiypsgstycaswakg)(seq.idno.16)、cdrh2变体1(iiypsgstysaswakg)(seq.idno.17)、cdrh2变体2(seq.idno.18)、cdrh2变体3(diypgsgsttnnekfks)(seq.idno.26)、cdhr3(pdndgtsgylsgfgl)(seq.idno.19)、cdrh3变体1(pdnegtsgylsgfgl)(seq.idno.20)、cdrh3变体2(seq.idno.21)或cdrh3变体3(lrgyydyfdfw)(seq.idno.27)的一个、二个或三个cdr。在一个实施方案中,抗体或抗原结合剂包含重链可变区,其包含cdrh1变体1(seq.idno.15)、cdrh2变体2(seq.idno.18)和cdrh3变体3(seq.idno.27)。在一个实施方案中,抗体或抗原结合剂包含重链可变区,其包含cdrh1变体1(seq.idno.15)、cdrh2变体2(seq.idno.18)和cdrh3变体2(seq.idno.21)。在一个实施方案中,抗体或抗原结合剂的kd约≥10-7m。在一个实施方案中,将上文鉴定的cdr序列移植到人免疫球蛋白框架中。在一个实施方案中,进一步修饰或改变人免疫球蛋白框架(例如在游标区内),以维持移植的cdr区的结合亲和力特异性。在一个实施方案中,抗体或抗原结合剂包含选自cdrh1(seq.idno.14)、cdrh1变体1(seq.idno.15)、cdrh2(seq.idno.16)、cdrh2变体1(seq.idno.17)、cdrh2变体2(seq.idno.18)、cdrh3(seq.idno.19)、cdrh3变体1(seq.idno.20)或cdrh3变体2(seq.idno.21)的一个、两个或三个cdr,并且kd约≥10-7m。在一个实施方案中,抗体或抗原结合剂包含cdr:cdrh1(seq.idno.14)、cdrh2(seq.idno.16)和cdrh3(seq.idno.19)。在一个实施方案中,抗体或抗原结合剂包含cdr:cdrh1(seq.idno.14)、cdrh2变体1(seq.idno.17)和cdhr3变体1(seq.idno.20)。在一个实施方案中,抗体包含cdr:cdrh1变体1(seq.idno.15)和cdrh2变体2(seq.idno.18)。在一个实施方案中,抗体包含cdr:cdrh1变体1(seq.idno.15)和cdrh2变体2(seq.idno.18)和cdrh3变体2(seq.idno.21)。在一个实施方案中,将上文鉴定的cdr序列移植到人免疫球蛋白框架中。在一个实施方案中,进一步修饰或改变人免疫球蛋白框架(例如在游标区内),以维持移植的cdr区的结合亲和力特异性。在一个实施方案中,抗体或抗原结合剂包含选自与cdrh1(seq.idno.14)、cdrh1变体1(seq.idno.15)、cdrh2(seq.idno.16)、cdrh2变体1(seq.idno.17)、cdrh2变体2(seq.idno.18)、cdrh3(seq.idno.19)、cdrh3变体1(seq.idno.20)或cdrh3变体2(seq.idno.21)相比具有一个或多个(例如,1个、2个、3个或4个)氨基酸取代、添加或缺失的氨基酸序列的一个、两个或三个cdr。在一个实施方案中,抗体或抗原结合剂包含重链,其中可变结构域包含选自与cdrh1(seq.idno.14)、cdrh1变体1(seq.idno.15)、cdrh2(seq.idno.16)、cdrh2变体1(seq.idno.17)、cdrh2变体2(seq.idno.18)、cdrh3(seq.idno.19)、cdrh3变体1(seq.idno.20)或cdrh3变体2(seq.idno.21)具有至少80%、85%、90%或95%同源性的氨基酸序列的一个、两个或三个cdr。在一个实施方案中,抗体或抗原结合剂的kd约≥10-7m。在一个实施方案中,将上文鉴定的cdr序列移植到人免疫球蛋白框架中。在一个实施方案中,进一步修饰或改变人免疫球蛋白框架(例如在游标区内),以维持移植的cdr区的结合亲和力特异性。可以改变或修饰cdr以提供改善的结合亲和力,当移植到不同的骨架中时最小化结合亲和力的丧失,或者减少cdr与杂合框架之间的不需要的相互作用,如下文进一步描述的。在本发明的一个方面,将用于施用的抗体和片段人源化。cdr-移植抗体的构建一般性地描述于欧洲专利申请ep-a-0239400(并且并入本文)中,其公开了其中通过使用长寡核苷酸进行定点诱变,将小鼠单克隆抗体的cdr移植到人免疫球蛋白可变结构域的框架区上的方法。cdr确定抗体的抗原结合特异性,并且是在可变结构域的框架区上携带的相对短的肽序列。人可变重链和轻链种系亚家族分类可以源自kabat种系亚组名称:vh1、vh2、vh3、vh4、vh5、vh6或vh7(对于特定的vh序列)和jh1、jh2、jh3、jh4、jh5和jh6(以于框架4的特定可变重链连接基团);vk1、vk2、vk3、vk4、vk5或vk6(对于框架1、2和3的特定vlκ序列),和jk1、jk2、jk3、jk4或jk5(对于框架4的特定κ连接基团);或vl1、vl2、vl3、vl4、vl5、vl6、vl7、vl8、vl9或vl10(对于框架1、2和3的特定vlλ序列)以及jl1、jl2、jl3或jl7(对于框架4的特定λ连接基团)。轻链的一般框架包含选自fr1-cdrl1-fr2-cdrl2-fr3-cdrl3-fr4和fr1-cdrl1-fr2-cdrl2-fr3-cdrl3-fr4-cl及其变型的结构,其中cdr区选自选自seq.idno.7-13的至少一个可变轻链cdr,框架区选自免疫球蛋白κ轻链可变框架区或免疫球蛋白λ轻链可变框架区,以及来自κ轻链恒定区(当框架区是κ轻链可变框架区时)或λ轻链恒定区(当框架区是λ轻链可变框架区时)的免疫球蛋白轻链恒定区。在一个实施方案中,本文设想的重链区的一般框架包含选自fr1-cdrh1-fr2-cdrh2-fr3-cdrh3-fr4、fr1-cdrh1-fr2-cdrh2-fr3-cdrh3-fr4-ch1、fr1-cdrh1-fr2-cdrh2-fr3-cdrh3-fr4-ch1-铰链-ch2(对于igg、igd和iga免疫球蛋白类别)和fr1-cdrh1-fr2-cdrh2-fr3-cdrh3-fr4-ch1-ch2(对于igm和ige免疫球蛋白类别)、fr1-cdrh1-fr2-cdrh2-fr3-cdrh3-fr4-ch1-铰链-ch2-ch3(对于igg、igd和iga免疫球蛋白类别)、fr1-cdrh1-fr2-cdrh2-fr3-cdrh3-fr4-ch1-ch2-ch3(对于igm和ige免疫球蛋白类别)以及fr1-cdrh1-fr2-cdrh2-fr3-cdrh3-fr4-ch1-ch2-ch3-ch4(对于igm和ige免疫球蛋白类别)及其变体的结构,其中cdr区选自选自seq.idno.14-21的至少一个可变重链cdr,框架区选自重链可变框架区和重链恒定区。iga和igm类别还可包含连接多肽,其分别用于将igm或iga的两个单体单元连接在一起。在igm的情况下,j链连接的二聚体是igm五聚体的成核单元,在iga的情况下它诱导更大的多聚体。可以考虑所提出的抗体分子的功能,特别是可能需要的效应子功能来选择用于施用的抗体分子的恒定区结构域(如果存在的话)。例如,恒定区结构域可以是人iga、igd、ige、igg或igm结构域。在特定的实施方案中,当抗体分子用于治疗用途并且需要抗体效应子功能时,可以使用人igg恒定区结构域,尤其是igg1和igg3同种型的恒定区结构域。或者,当抗体分子用于治疗目的并且不需要抗体效应子功能时,可以使用igg2和igg4同种型。在一个实施方案中,施用的抗体包含选自seq.id.no.28-36或37-40(下表3)的可变轻链。在一个实施方案中,施用的抗体包含选自seq.id.nos.41-51(下表4)的可变重链。在一个实施方案中,施用的抗体包含选自seq.id.no.28-36或487-490的可变轻链和/或选自seq.id.no.41-51或与seq.id.no.28-36、37-40具有80%或更多相似性或同一性的抗体序列的可变重链和/或选自seq.id.no.41-51的可变重链,例如相关序列的85%、90%、91%、92%、93%、94%、95%96%、97%、98%或99%的部分或全部,例如可变结构域序列、cdr序列或除cdr外的可变结构域序列。表3.人源化抗-ap2/胰高血糖素/ap2蛋白复合物轻链区的序列表4.人源化ap2/胰高血糖素/ap2蛋白复合物重链区的序列在一个实施方案中,施用的抗体分子是fab、fab'或f(ab')2抗体片段,其包含选自seq.idno.29、31、37、38、33或35的轻链可变区,和选自seq.idno.42、44、46、48或50的重链可变区。在一个实施方案中,本公开的抗体分子是全长igg1抗体,其包含seq.idno.29、31、37、38、33或35(对于轻链)和seq.idno.42、44、46、48或50(对于重链)中所示的可变区。在一个实施方案中,本公开的抗体分子是全长igg4抗体,其包含seq.idno.29、31、37、38、33或35(对于轻链)和seq.idno.42、44、46、48或50(对于重链)中所示的可变区。在一个实施方案中,本公开的抗体分子是全长igg4p抗体,其包含seq.idno.29、31、37、38、33或35(对于轻链)和seq.idno.42、44、46、48或50(对于重链)中所示的可变区。在一个实施方案中,施用的融合蛋白包含两个结构域抗体,例如作为任选地通过二硫键连接的可变重链(vh)和可变轻链(vl)配对。施用的抗体片段可包括fab、fab′、f(ab′)2、scfv、双抗体、scfab、dfv、单结构域轻链抗体、dsfv、包含cdr的肽等。治疗与gcgr激动相关的病症的方法提供了通过肝脏内(其中胰高血糖素/ap2复合物(胰高血糖素/ap2)调节肝葡萄糖输出)以及肾脏和胰岛β细胞上的胰高血糖素/ap2复合物(胰高血糖素/ap2)来中和gcgr激动的方法,反映了其在糖异生、肠平滑肌、大脑和脂肪组织中的作用。由于胰高血糖素/ap2复合物在通过激动gcgr诱导肝葡萄糖产生中起显著作用,因此完全或部分中和gcgr激动作用具有调节与失调的gcgr刺激相关的潜在病况和病症的严重性的能力。在一个实施方案中,向具有与过量或失调的gcgr刺激相关的潜在病况或病症的受试者施用干扰胰高血糖素/ap2复合物形成或胰高血糖素/ap2复合物激动gcgr的能力的化合物。在一个实施方案中,如本文所述的单克隆抗体用于中和胰高血糖素/ap2激动gcgr的能力。靶向胰高血糖素/ap2蛋白复合物的抗体、抗原结合剂或抗体结合片段,包括抗胰高血糖素/ap2蛋白复合物人源化抗体、抗原结合剂或抗体结合片段,可用于治疗涉及导致慢性升高的血糖水平的失调的胰高血糖素信号传导的代谢病症,包括但不限于糖尿病(i型和ii型)、肥胖和非酒精性脂肪性肝病(nafld)、非酒精性脂肪性肝炎(nash)、代谢病症、心血管疾病、动脉粥样硬化、纤维化、肝硬化、肝细胞癌、胰岛素抵抗、血脂异常、高血糖症、hyperglucanemia、高胰岛素血症。例如,本文所述的抗-胰高血糖素/ap2蛋白复合物抗体、抗原结合剂或抗体结合片段能够以低结合亲和力结合分泌的ap2和/或胰高血糖素/ap2蛋白复合物,当向有此需要的宿主施用时,在宿主中中和胰高血糖素受体活性并提供较低的空腹血糖水平、改善的全身性葡萄糖代谢、增加的全身性胰岛素敏感性、减少的脂肪量、肝脏脂肪变性、改善的血清脂质谱和/或减少的致动脉粥样硬化斑块形成。在本发明的一个方面,提供了通过施用有效量的靶向胰高血糖素/ap2蛋白复合物的抗体、抗原结合剂或抗体结合片段来治疗由失调的胰高血糖素活性(导致宿主血液中过量葡萄糖的异常水平)引起的疾病或病症的方法。在一个实施方案中,该病症是代谢病症。在一个实施方案中,该病症是糖尿病。在一个实施方案中,该病症是i型糖尿病。在一个实施方案中,该病症是ii型糖尿病。在一个实施方案中,该病症是高血糖症。在一个实施方案中,该病症是肥胖症。在一个实施方案中,该病症是血脂异常。在一个实施方案中,该病症是非酒精性脂肪肝病(nafld)。在一个实施方案中,该病症是非酒精性脂肪性肝炎(nash)。糖尿病糖尿病是全世界最常见的代谢疾病。每天,美国诊断出1700例新发糖尿病病例,而1600万美国糖尿病患者中至少有三分之一没有意识到这一点。糖尿病是成人失明、肾功能衰竭和下肢截肢的主要原因,并且是心血管疾病和中风的主要危险因素。在本发明的一个方面,提供了通过向宿主施用有效量的靶向胰高血糖素/ap2蛋白复合物的抗体、抗原结合剂或抗体结合片段来治疗糖尿病的方法。在一个实施方案中,该病症是i型糖尿病。在一个实施方案中,该病症是ii型糖尿病。i型糖尿病由胰岛β细胞的自身免疫性破坏引起,导致胰岛素缺乏。ii型或非胰岛素依赖型糖尿病(niddm)占病例的90%以上,其特征是对胰岛素在外周组织,尤其是骨骼肌和脂肪细胞的葡萄糖摄取方面的作用的抵抗性,抑制肝葡萄糖产生的胰岛素作用受损和错误调节的胰岛素分泌。在本发明的一个实施方案中,本文提供了通过与胰岛素联合地或与胰岛素交替地向宿主施用有效量的靶向胰高血糖素/ap2蛋白复合物的抗体、抗原结合剂或抗体结合片段来治疗宿主中的i型糖尿病的方法。在本发明的一个实施方案中,本文提供了通过与合成胰岛素类似物联合或交替地向宿主施用有效量的靶向胰高血糖素/ap2蛋白复合物的抗体、抗原结合剂或抗体结合片段来治疗宿主的i型糖尿病的方法。一些患有ii型糖尿病的人可通过单独的饮食和运动达到其目标血糖水平,但许多人还需要糖尿病药物或胰岛素治疗。在本发明的一个实施方案中,本文提供了通过向宿主施用有效量的靶向胰高血糖素/ap2蛋白复合物的抗体、抗原结合剂或抗体结合片段来治疗宿主的ii型糖尿病的方法。在一个实施方案中,本文提供了通过向宿主施用有效量的靶向胰高血糖素/ap2蛋白复合物的抗体、抗原结合剂或抗体结合片段来治疗与糖尿病相关的疾病或病况的方法。与糖尿病相关的疾病和病况可包括但不限于高血糖症、高胰岛素血症、高脂血症、胰岛素抵抗、葡萄糖代谢受损、肥胖、糖尿病性视网膜病、黄斑变性、白内障、糖尿病性肾病、肾小球硬化、糖尿病性神经病、勃起功能障碍、经前期综合征、血管再狭窄和溃疡性结肠炎。此外,与糖尿病相关的疾病和病况包括但不限于:冠心病、高血压、心绞痛、心肌梗塞、中风、皮肤和结缔组织病症、足溃疡、代谢性酸中毒、关节炎、骨质疏松症,特别是葡萄糖耐量降低的病况。体重病症在本发明的一个实施方案中,提供了通过施用有效量的靶向胰高血糖素/ap2蛋白复合物的抗体、抗原结合剂或抗体结合片段来治疗宿主中由于失调的胰高血糖素活性引起的肥胖的方法。肥胖代表了最常见的体重病症,影响了西方世界中据估计30%至50%的中年人口。在本发明的一个实施方案中,提供了通过施用有效量的靶向胰高血糖素/ap2蛋白复合物的抗体、抗原结合剂或抗体结合片段来治疗宿主的肥胖症的方法。在一个实施方案中,提供了通过施用有效量的靶向胰高血糖素/ap2蛋白复合物的抗体、抗原结合剂或抗体结合片段来减少或抑制由宿主中失调的胰高血糖素活性引起的体重增加的方法。非酒精性脂肪性肝病(nafld)需要用于治疗和预防脂肪肝的发展以及源自脂肪肝的病症(诸如非酒精性脂肪性肝炎(nash)、肝脏炎症、肝硬化和由胰高血糖素失调引起的肝衰竭)和慢性高血糖症的组合物和方法。在本发明的一个实施方案中,提供了通过施用有效量的靶向胰高血糖素/ap2蛋白复合物的抗体、抗原结合剂或抗体结合片段来治疗宿主的nafld的方法。非酒精性脂肪性肝炎(nash)非酒精性脂肪性肝炎(nash)是非酒精性脂肪性肝病(nafld)的晚期形式,是指不是由于过量饮酒导致的肝脏脂肪变性的积累。nash是肝脏疾病,其特征在于肝脏炎症并伴有脂肪堆积。nash也常见于患有糖尿病和肥胖症的人中,并且与代谢综合征有关。nash是相对良性的非酒精性脂肪肝疾病的进行性形式,因为其可以缓慢恶化,导致肝脏中的纤维化累积,这导致肝硬化(综述于smith等,(2011),crit.rev.clin.lab.sci.,48(3):97-113中)。目前,还没有针对nash的批准疗法。在本发明的一个实施方案中,提供了通过施用有效量的靶向胰高血糖素/ap2蛋白复合物的抗体、抗原结合剂或抗体结合片段来治疗宿主的nash的方法。胰高血糖素瘤和坏死松解性游走性红斑胰高血糖素瘤是胰腺α细胞的罕见肿瘤,其导致激素胰高血糖素的过量产生。胰高血糖素瘤的主要生理效应是肽激素胰高血糖素的过量产生。坏死松解性游走性红斑(nme)是在胰高血糖素瘤患者中观察到的典型症状,并且在70%的病例中呈现出问题(vanbeek等,(2004年11月)。"theglucagonomasyndromeandnecrolyticmigratoryerythema:aclinicalreview".eur.j.endocrinol.151(5):531-7)。相关的nme的特征在于红斑水疱的扩散和跨越受到更大摩擦和压力的区域(包括下腹部、臀部、会阴和腹股沟)的肿胀。在本发明的一个实施方案中,提供了通过施用有效量的靶向胰高血糖素/ap2蛋白复合物的抗体、抗原结合剂或抗体结合片段来治疗宿主的胰高血糖素瘤和/或坏死松解性游走性红斑(nme)的方法。在一个实施方案中,抗体或抗体结合剂含有具有可变区的轻链或轻链片段,其中所述可变区包含独立地选自seq.idno.7、seq.idno.8和seq.idno.9的一个、两个或三个互补决定区(cdr)。在另一个实施方案中,向受试者施用的抗体或抗原结合剂包含具有可变区的轻链或轻链片段,其中所述可变区包含独立地选自seq.idno.10、seq.idno.11、seq.idno.12、seq.idno.13、seq.idno.22、seq.idno.23或seq.idno.24的一个、两个或三个cdr。在另一个实施方案中,施用的抗体或抗体结合剂包含具有可变区的轻链或轻链片段,其中所述可变区包含独立地选自seq.idno.7、seq.idno.8和seq.idno.9、seq.idno.10、seq.idno.11、seq.idno.12、seq.idno.13、seq.idno.22、seq.idno.23或seq.idno.24的一个、两个或三个cdr。在一个实施方案中,向受试者施用的抗体或抗体结合剂包含具有可变区的轻链或轻链片段,其中所述可变区包含seqidno:7、seqidno:8,以及选自seq.id.no.9、seq.idno.10、seq.idno.11、seq.idno.12、seq.idno.13、seq.idno.22、seq.idno.23或seq.idno.24的至少一个cdr。或者,如本文进一步描述的,可以通过不会不利地影响或能够改善抗体或抗原结合剂的性质的一个或多个氨基酸的取代来改变一个或多个公开和选择的cdr。在一个实施方案中,将选择的一个或多个cdr置于人免疫球蛋白框架中。在一个实施方案中,进一步修饰或改变人免疫球蛋白框架以维持移植的cdr区的结合亲和力特异性。在一个实施方案中,施用的抗体或抗体结合剂对于人ap2的kd≥10-7m。在一个实施方案中,向受试者施用的抗体或抗体结合剂包括选自seq.idno.7-13或seq.idno.22-24的至少一个cdr,和选自cdrh1(seq.idno.14)、cdrh1变体1(seq.idno.15)、cdrh1变体2(seq.idno.25)、cdrh2(seq.idno.16)、cdrh2变体1(seq.idno.17)、cdrh2变体2(seq.idno.18)、cdrh2变体3(seq.idno.26)、cdhr3(seq.idno.19)、cdhr3变体1(seq.idno.20)、cdrh3变体2(seq.idno.21)或cdrh3变体3(seq.idno.27)的至少一个cdr,其中cdr序列被移植到人免疫球蛋白框架内。在一个实施方案中,进一步修饰或改变人免疫球蛋白框架以维持移植的cdr区的结合亲和力特异性。在某些实施方案中,所施用的抗体或抗原结合剂至少包括轻链可变序列909gl1(seq.idno.29)、轻链序列909gl1vl+cl(seq.idno.30)、轻链可变序列909gl10(seq.idno.31)、轻链序列909gl10vl+cl(seq.idno.32)、轻链可变序列909gl13(seq.idno.37)、轻链序列909gl13vl+cl(seq.idno.39)、轻链可变序列909gl50(seq.idno.38)、轻链序列909gl50vl+cl(seq.idno.40)、轻链可变序列909gl54(seq.idno.33)、轻链序列909gl54vl+cl(seq.idno.34)、轻链可变序列909gl55(seq.idno.35)或轻链序列909gl55vl+cl(seq.idno.36)。在其他实施方案中,施用的抗体或抗原结合剂包括选自909gl1(seq.idno.29)、909gl10(seq.idno.31)、909gl13(seq.idno.37)、909gl50(seq.idno.38)、909gl54(seq.idno.33)或909gl55(seq.idno.35)的轻链可变序列,以及选自909gh1(seq.idno.42)、909gh14(seq.idno.44)、909gh15(seq.idno.46)、909gh61(seq.idno.48)或909gh62(seq.idno.50)的重链可变序列。例如,抗体或抗原结合剂可至少包括轻链可变序列909gl1(seq.idno.29)和重链可变序列909gh1(seq.id.no.42)。代谢病症在本发明的一个方面,提供了通过施用有效量的靶向胰高血糖素/ap2蛋白复合物的抗体、抗原结合剂或抗体结合片段来治疗由失调的胰高血糖素活性介导的宿主的代谢病症的方法。代谢病症包括由受试者中异常代谢(即,活细胞中的化学变化,通过其为生命过程和活动提供能量)引起的或特征在于所述异常代谢的病况、疾病或病症。代谢病症包括与高血糖症相关的疾病、病症或病况。代谢病症可以不利地影响细胞功能诸如细胞增殖、生长、分化或迁移、体内平衡的细胞调节、细胞间或细胞内通讯;组织功能诸如肝功能、肾功能或脂肪细胞功能;生物体中的系统反应诸如激素反应(例如,胰高血糖素反应)。代谢病症的实例包括肥胖症、糖尿病、摄食过度、内分泌异常、甘油三酯贮积病、bardet-biedl综合征、laurence-moon综合征、prader-labhart-willi综合征和脂质代谢病症。减轻胰高血糖素受体介导的疾病严重性的方法通过向宿主施用治疗有效量的靶向胰高血糖素/ap2蛋白复合物的抗体、抗原结合剂或抗体结合片段来提供预防或治疗由胰高血糖素活性失调(导致宿主(通常是人)中过量葡萄糖的异常水平)引起的疾病或病症的方法。以足以部分或完全抑制或降低胰高血糖素/ap2蛋白复合物的生物活性的剂量施用抗体、抗原结合剂或抗体结合片段。在一个方面,通过施用有效量的靶向胰高血糖素/ap2蛋白复合物的抗体、抗原结合剂或抗体结合片段来提供预防或减轻宿主的胰高血糖素介导的病症的严重性的方法,所述抗体、抗原结合剂或抗体结合片段的施用导致胰高血糖素的生物活性降低或减弱,并且降低了失调的胰高血糖素的相关生理作用,例如空腹血糖水平的降低、脂肪量水平的降低、肝葡萄糖产生的减少、脂肪细胞脂肪分解的减少、高胰岛素血症的减少和/或肝脏脂肪变性的减少。在一个实施方案中,胰高血糖素的生物活性的减弱导致胰岛素敏感性的提高、葡萄糖代谢的增加和/或胰岛β细胞死亡、功能障碍或丧失的预防。在本发明的其他方面,提供了用于下述的方法:降低空腹血糖水平;降低脂肪量;减少肝葡萄糖生成;减少脂肪细胞脂肪分解;减少高胰岛素血症;减少肝脏脂肪变性;增加葡萄糖代谢;提高胰岛素敏感性;防止β细胞死亡、功能障碍或丧失;和/或确定宿主中循环分泌ap2水平;包括给有此需要的宿主(通常是人)施用有效量的靶向胰高血糖素/ap2蛋白复合物的抗体、抗原结合剂或抗体结合片段。联合疗法能够干扰胰高血糖素/ap2对gcgr的激动作用的化合物可用于治疗通过过量gcgr激动介导的潜在病症。在一个实施方案中,将化合物与另外的活性成分组合或交替向有此需要的受试者施用。在一些实施方案中,本文提供了利用联合疗法的方法,在所述联合疗法中将能够干扰胰高血糖素/ap2对gcgr的激动作用的化合物与另一种治疗剂一起向受试者施用。可以与本发明的化合物组合施用(分开地施用或在同一药物组合物中施用)的其他治疗剂的实例包括但不限于:(a)抗糖尿病药,诸如(1)pparγ激动剂,诸如格列酮类(例如环格列酮;达格列酮;恩格列酮;伊曲格列酮(mcc-555);吡格列酮(actos);罗格列酮(avandia);曲格列酮;利福格列酮、brl49653;clx-0921;5-btzd、gw-0207、lg-100641、r483和ly-300512等以及wo97/10813、97/27857、97/28115、97/28137、97/27847、03/000685和03/027112中公开的化合物和spparms(选择性pparγ调节剂)诸如t131(amgen)、fk614(fujisawa)、萘格列酮和美塔格列生;(2)双胍类如丁福明;二甲双胍;和苯乙双胍等;(3)蛋白酪氨酸磷酸酶-1b(ptp-1b)抑制剂诸如isis113715、a-401674、a-364504、idd-3、idd2846、kp-40046、kr61639、mc52445、mc52453、c7、oc-060062、oc-86839、oc29796、ttp-277bc1以及wo04/041799、04/050646、02/26707、02/26743、04/092146、03/048140、04/089918、03/002569、04/065387、04/127570和us2004/167183中公开的那些试剂;(4)磺酰脲类诸如乙酰己酰胺;氯磺丙脲;氯磺丙脲;格列本脲;格列吡嗪;格列本脲;格列美脲;格列齐特;格列戊脲;格列喹酮;格列索脲;妥拉磺脲;和甲苯磺丁脲等;(5)氯茴笨酸类例如瑞格列奈、美格列奈(glufast)和那格列奈等;(6)α葡糖苷水解酶抑制剂诸如阿卡波糖;脂解素;卡格列波;乙格列酯;米格列醇;伏格列波糖;普拉米星-q;沙玻制菌素;ckd-711;mdl-25637;mdl-73945;和mor14等;(7)α-淀粉酶抑制剂诸如淀粉酶抑肽、萃他丁和al-3688等;(8)胰岛素利诺格列(linogliride)那格列奈、米格列奈(glufast)、id1101a-4166等;(9)脂肪酸氧化抑制剂诸如氯莫克舍、乙莫克舍等;(10)a2拮抗剂诸如咪格列唑;伊格列哚;德格列哚;咪唑克生;earoxan;和氟洛克生等;(11)胰岛素或胰岛素模拟物,诸如biota、lp-100、诺和锐適(novarapid)、地特胰岛素、赖脯胰岛素、甘精胰岛素、inulindegludec、胰岛素锌悬浮液(缓慢的(lente)和超慢作用(ultralente));lys-pro胰岛素、glp-1(17-36)、glp-1(73-7)(胰岛素原);glp-1(7-36)-nh2)艾塞那肽(exenatide)/艾塞那肽(exendin)-4、艾塞那肽lar、利巴鲁肽、ave0010、cjc1131、bim51077、cs872、th0318、bay-694326、gp010、albugon(与白蛋白融合的glp-1)、hgx-007(epac激动剂)、s-23521和wo04/022004、wo04/37859等中公开的化合物等;(12)非噻唑烷二酮类如jt-501和法格列扎(gw-2570/gi-262579)等;(13)pparα/γ双重激动剂诸如ave0847、clx-0940、gw-1536、gw1929、gw-2433、krp-297、l-796449、lbm642、lr-90、ly510919、mk-0767、ono5129、sb219994、tak-559、tak-654、677954(glaxosmithkline)、e-3030(eisai)、ly510929(lilly)、ak109(asahi)、drf2655(dr.reddy)、drf8351(dr.reddy)、mc3002(maxocore)、ty51501(toaeiyo)、阿格列扎、法格立他扎、那格列扎、莫格列扎、培格列扎、替格列扎(galida)、瑞格列扎(jt-501)、西格列他、以及wo99/16758、wo99/19313、wo99/20614、wo99/38850、wo00/23415、wo00/23417、wo00/23445、wo00/50414、wo01/00579、wo01/79150、wo02/062799、wo03/033481、wo03/033450、wo03/033453中公开的那些;(14)胰岛素、胰岛素模拟物和其他胰岛素增敏药物;(15)vpac2受体激动剂;(16)glk调节剂诸如psn105、ro281675、ro274375和wo03/015774、wo03/000262、wo03/055482、wo04/046139、wo04/045614、wo04/063179、wo04/063194、wo04/050645公开的那些等;(17)类视黄醇调节剂、例如wo03/000249中公开的那些;(18)gsk3β/gsk3抑制剂诸如4-[2-(2-溴苯基)-4-(4-氟苯基-1h-咪唑-5-基]吡啶、ct21022、ct20026、ct-98023、sb-216763、sb410111、sb-675236、cp-70949、xd4241和wo03/037869、03/03877、03/037891、03/024447、05/000192、05/019218等中公开的那些化合物;(19)糖原磷酸化酶(hglpa)抑制剂诸如ave5688、psn357、gpi-879、wo03/037864、wo03/091213、wo04/092158、wo05/013975、wo05/013981、us2004/0220229和jp2004-196702中公开的那些等;(20)atp消耗促进剂诸如wo03/007990中公开的那些;(21)pparγ激动剂与二甲双胍诸如avandamet的固定组合;(22)ppar泛激动剂诸如gsk677954;(23)gpr40(g蛋白偶联受体40)也称为snorf55诸如bg700,以及wo04/041266、04/022551、03/099793中公开的那些;(24)gpr119(g蛋白偶联受体119、也称为rup3;snorf25)诸如rup3、hgprbmy26、pfi007、snorf25;(25)腺苷受体2b拮抗剂诸如atl-618、at1-802、e3080等;(26)肉毒碱棕榈酰转移酶抑制剂诸如st1327和st1326等;(27)果糖1,6-二磷酸酶抑制剂诸如cs-917、mb7803等;(28)胰高血糖素拮抗剂诸如at77077、bay694326、gw4123x、nn2501以及wo03/064404、wo05/00781、us2004/0209928、us2004/029943等中公开的那些;(30)葡萄糖-6-磷酸酶抑制剂;(31)磷酸烯醇丙酮酸羧激酶(pepck)抑制剂;(32)丙酮酸脱氢酶激酶(pdk)激活剂;(33)rxr激动剂诸如mc1036、cs00018、jnj10166806以及wo04/089916、美国专利第6,759,546号中公开的那些等;(34)sglt抑制剂诸如ave2268、kgt1251、t1095/rwj3947188;(35)blx-1002;(36)α葡萄糖苷酶抑制剂;(37)胰高血糖素受体激动剂;(38)葡萄糖激酶活化剂;39)gip-1;40)胰岛素促分泌素;41)gpr-40激动剂诸如tak-875、5-[4-[[(1r)-4-[6-(3-羟基-3-甲基丁氧基)-2-甲基吡啶-3-基]-2,3-二氢-1h-茚-1-基]氧基]苯基]-异噻唑-3-醇1-氧化物、5-(4-((3-(2,6-二甲基-4-(3-(甲基磺酰基))丙氧基)-苯基)苯基)-甲氧基)苯基)异、5-(4-((3-(2-甲基-6-(3-羟基丙氧基)吡啶-3-基)-2-甲基苯基)甲氧基)苯基)异噻唑-3-醇1-氧化物和5-[4-[[3-[4-(3-氨基丙氧基)-2,6-二甲基苯基]苯基]甲氧基]苯基]异噻唑-3-醇1-氧化物)、和wo11/078371中公开的那些;42)sglt-2抑制剂诸如坎格列净、达格列净、托伏列净、恩格列净、埃帕列净、卢斯列净(ts-071)、依托列净(pf-04971729)和瑞格列净;和43)sglt-1/sglt-2抑制剂诸如lx4211;(b)抗血脂异常剂,诸如(1)胆汁酸螯合剂诸如消胆胺、考来维仓、考来替泊、交联葡聚糖的二烷基氨基烷基衍生物;和等;(2)hmg-coa还原酶抑制剂诸如阿托伐他汀、伊伐他汀、匹伐他汀、氟伐他汀、洛伐他汀、普伐他汀、利伐他汀、辛伐他汀、罗苏伐他汀(zd-4522)和其他他汀类药物,特别是辛伐他汀;(3)hmg-coa合酶抑制剂;(4)胆固醇吸收抑制剂诸如fmvp4(forbesmedi-tech)、kt6-971(kotobukipharmaceutical)、fm-va12(forbesmedi-tech)、fm-vp-24(forbesmedi-tech)、甾烷醇酯、β-谷甾醇、甾醇糖苷如替奎安;和氮杂环丁酮类诸如依泽替米贝以及wo04/005247等中公开的那些等;(5)酰基辅酶a-胆固醇酰基转移酶(acat)抑制剂诸如阿伐西米、依非米贝、帕替麦布(ky505)、smp797(sumitomo)、sm32504(sumitomo)以及wo03/091216中公开的那些等。(6)cetp抑制剂诸如安塞曲匹、jtt705(日本烟草)、托塞曲匹、cp532,632、bay63-2149(bayer)、sc591、sc795等;(7)角鲨烯合成酶抑制剂;(8)抗氧化剂诸如普罗布考等;(9)pparα激动剂诸如贝氟贝特、苯扎贝特、环丙贝特、氯贝特、乙氧贝特、非诺贝特、吉卡宾和吉非贝齐、gw7647、bm170744(kowa)、ly518674(lilly)、gw590735(葛兰素史克)、krp-101(kyorin)、drf10945(reddy博士)、ns-220/r1593(nipponshinyaku/roche,st1929(sigmatau)mc3001/mc3004(maxocorepharmaceuticals,吉卡宾钙,其他纤维酸衍生物诸如和以及美国专利第6,548,538号中公开的那些等;(10)fxr受体调节剂诸如gw4064(glaxosmithkline)、sr103912、qrx401、ln-6691(lionbioscience)以及wo02/064125、wo04/045511中公开的那些等;(11)lxr受体调节剂诸如gw3965(glaxosmithkline)、t9013137和xtco179628(x-ceptortherapeutics/sanyo)以及wo03/031408、wo03/063796、wo04/072041中公开的那些等;(12)脂蛋白合成抑制剂诸如烟酸;(13)肾素血管紧张素系统抑制剂;(14)pparδ部分激动剂诸如wo03/024395中公开的那些;(15)胆汁酸再吸收抑制剂诸如bari1453、sc435、pha384640、s8921、azd7706等;和胆汁酸螯合剂诸如考来维仑(welchol/cholestagel)、考来替泊、考来烯胺和交联葡聚糖的二烷基氨基烷基衍生物、(16)pparδ激动剂诸如gw501516(ligand,gsk)、gw590735、gw-0742(glaxosmithkline)、t659(amgen/tularik)、ly934(lilly)、nnc610050(novonordisk)以及wo97/28149、wo01/79197、wo02/14291、wo02/46154、wo02/46176、wo02/076957、wo03/016291、wo03/033493、wo03/035603、wo03/072100、wo03/097607、wo04/005253、wo04/007439和jp10237049中描述的那些等;(17)甘油三酯合成抑制剂;(18)微粒体甘油三酯转运(mttp)抑制剂诸如英普他派、lab687、jtt130(日本烟草)、cp346086以及wo03/072532中公开的那些等;(19)转录调节剂;(20)角鲨烯环氧酶抑制剂;(21)低密度脂蛋白(ldl)受体诱导剂;(22)血小板聚集抑制剂;(23)5-lo或flap抑制剂;和(24)烟酸受体激动剂,包括hm74a受体激动剂;(25)ppar调节剂诸如wo01/25181、wo01/79150、wo02/79162、wo02/081428、wo03/016265、wo03/033453中公开的那些;(26)烟酸结合的铬诸如wo03/039535中所公开的;(27)wo03/040114中公开的取代的酸衍生物;(28)输注的hdl诸如luv/etc-588(pfizer)、apo-a1milano/etc216(pfizer)、etc-642(pfizer)、isis301012、d4f(bruinpharma)、靶向泡沫细胞的合成三聚体apoa1、bioralapoa1等;(29)ibat抑制剂诸如bari143/hmr145a/hmr1453(sanofi-aventis、pha384640e(pfizer)、s8921(shionogi)azd7806(astrazeneca)、ak105(asahkasei)等;(30)lp-pla2抑制剂诸如sb480848(glaxosmithkline)、659032(glaxosmithkline)、677116(glaxosmithkline)等;(31)影响脂质组成的其他药剂,包括etc1001/esp31015(pfizer)、esp-55016(pfizer)、agi1067(atherogenics)、ac3056(amylin)、azd4619(astrzeneca);和(c)抗高血压药,诸如(1)利尿剂诸如噻嗪类,包括氯噻酮、氯噻嗪、二氯苯酰胺、氢氟噻嗪、吲达帕胺和氢氯噻嗪;髓袢利尿剂诸如布美他尼、依他尼酸、呋塞米和托拉塞米;保钾利尿剂诸如阿米洛利和三氨蝶呤;和醛固酮拮抗剂诸如螺内酯、epirenone等;(2)β-肾上腺素能受体阻滞剂诸如醋丁洛尔、阿替洛尔、倍他洛尔、贝他洛尔、比索洛尔、博多洛尔、卡替洛尔、卡维地洛、塞洛洛尔、艾司洛尔、茚并洛尔、异丙醇、纳多洛尔、奈比洛尔、喷布洛尔、吲哚洛尔、普萘洛尔、索他洛尔、特他洛尔、替利洛尔和噻吗洛尔等;(3)钙通道阻滞剂诸如氨氯地平、阿雷地平、阿折地平、巴尼地平、贝尼地平、苄普地尔、cinaldipine、氯维地平、地尔硫卓、依福地平、非洛地平、戈洛帕米、伊拉地平、拉西地平、来米地平、乐卡地平、尼卡地平、硝苯地平、尼伐地平、尼莫地平、尼索地平、尼群地平、马尼地平、普拉尼地平和维拉帕米等;(4)血管紧张素转换酶(ace)抑制剂如苯那普利;卡托普利;西拉普利;地拉普利;依那普利;福辛普利;咪达普利;赖诺普利;莫昔普利;喹那普利;喹普利拉;雷米普利;培哚普利;培哚普利;喹那普利;螺普利;替莫普利;群多普利和佐芬普利等;(5)中性内肽酶抑制剂诸如奥马曲拉、坎沙曲和依卡曲尔、法西多曲、山帕曲拉、ave7688、er4030等;(6)内皮素拮抗剂如替唑生坦、a308165和ym62899等;(7)血管扩张剂诸如肼苯哒嗪、可乐定、米诺地尔、烟酰醇、烟酸或其盐等;(8)血管紧张素ii受体拮抗剂如坎地沙坦、依普罗沙坦、厄贝沙坦、氯沙坦、普拉沙坦、塔沙坦、替米沙坦、缬沙坦和exp-3137、fi6828k和rnh6270等;(9)α/β肾上腺素能阻滞剂诸如尼普地洛、阿罗洛尔和氨磺洛尔等;(10)α1受体阻滞剂诸如特拉唑嗪、乌拉地尔、哌唑嗪、布那唑嗪、三甲氧唑嗪、多沙唑嗪、萘哌地尔、吲哚胺、whip164和xen010等;(11)α2激动剂诸如洛非西定、噻美尼定、莫索尼定、利美尼定和胍那苄(guanobenz)等;(12)醛固酮抑制剂等;(13)血管生成素-2-结合剂诸如wo03/030833中公开的那些;和(d)抗肥胖剂,诸如(1)5ht(5-羟色胺)转运蛋白抑制剂诸如帕罗西汀、氟西汀、芬氟拉明、氟伏沙明、舍曲林和丙咪嗪以及wo03/00663中公开的那些、以及5-羟色胺/去甲肾上腺素再摄取抑制剂诸如西布曲明(meridia/reductil)和多巴胺摄取抑制剂/去氧肾上腺素摄取抑制剂诸如盐酸雷帕霉素、353162(葛兰素史克)等;(2)ne(去甲肾上腺素)转运蛋白抑制剂诸如gw320659、地塞米松、他舒普仑和诺米芬辛;(3)cb1(大麻素-1受体)拮抗剂/反向激动剂诸如利莫那班(accompliasanofisynthelabo)、sr-147778(sanofisynthelabo)、ave1625(sanofi-aventis)、bay65-2520(bayer)、slv319(solvay)、slv326(solvay)、cp945598(pfizer)、e-6776(esteve)、01691(organix)、org14481(organon)、ver24343(vernalis)、ness0327(univofsassari/univofcagliari)以及美国专利第4,973,587号、第5,013,837号、第5,081,122号、第5,112,820号、第5,292,736号、第5,532,237号、第5,624,941号、第6,028,084号和第6,509,367号和wo96/33159、wo97/29079、wo98/31227、wo98/33765、wo98/37061、wo98/41519、wo98/43635、wo98/43636、wo99/02499、wo00/10967、wo00/10968、wo01/09120、wo01/58869、wo01/64632、wo01/64633、wo01/64634、wo01/70700、wo01/96330、wo02/076949、wo03/006007、wo03/007887、wo03/020217、wo03/026647、wo03/026648、wo03/027069、wo03/027076、wo03/027114、wo03/037332、wo03/040107、wo04/096763、wo04/111039、wo04/111033、wo04/111034、wo04/111038、wo04/013120、wo05/000301、wo05/016286、wo05/066126和ep-658546中公开的那些等;(4)葛瑞林激动剂/拮抗剂诸如bvt81-97(biovitrum)、rc1291(rejuvenon)、srd-04677(sumitomo)、未酰化的葛瑞林(theratechnologies)以及wo01/87335,wo02/08250,wo05/012331中公开的那些等;(5)h3(组胺h3)拮抗剂/反向激动剂诸如硫代丙酰胺、3-(1h-咪唑-4-基)丙基n-(4-戊烯基)氨基甲酸酯)、clobenpropit、碘苯丙酸、imoproxifan、gt2394(gliatech)和a331440以及wo02/15905中公开的那些;和o-[3-(1h-咪唑-4-基)丙醇]氨基甲酸酯(kiec-kononowicz、k.等,pharmazie,55:349-55(2000))、含有哌啶的组胺h3-受体拮抗剂(lazewska,d.etal.,pharmazie,56:927-32(2001))、二苯甲酮衍生物和相关化合物(sasse,a.etal.,arch.pharm.(weinheim)334:45-52(2001))、取代的n-苯基氨基甲酸酯(reidemeister,s.etal.,pharmazie,55:83-6(2000))以及proxifan衍生物(sasse,a.etal.,j.med.chem.43:3335-43(2000))和组胺h3受体调节剂诸如wo03/024928和wo03/024929中公开的那些;(6)黑色素浓缩激素1受体(mch1r)拮抗剂诸如t-226296(takeda),t71(takeda/amgen),amgn-608450,amgn-503796(amgen),856464(glaxosmithkline),a224940(abbott),a798(abbott),atc0175/ar224349(arenapharmaceuticals),gw803430(glaxosmithkline),nbi-1a(neurocrinebiosciences),ngx-1(neurogen),snp-7941(synaptic),snap9847(synaptic),t-226293(scheringplough),tpi-1361-17(saitamamedicalschool/universityofcaliforniairvine)和wo01/21169,wo01/82925,wo01/87834,wo02/051809,wo02/06245,wo02/076929,wo02/076947,wo02/04433,wo02/51809,wo02/083134,wo02/094799,wo03/004027,wo03/13574,wo03/15769,wo03/028641,wo03/035624,wo03/033476,wo03/033480,wo04/004611,wo04/004726,wo04/011438,wo04/028459,wo04/034702,wo04/039764,wo04/052848,wo04/087680和日本专利申请号jp13226269,jp1437059,jp2004315511中公开的那些等;(7)mch2r(黑色素浓缩激素2r)激动剂/拮抗剂;(8)npy1(神经肽yy1)拮抗剂诸如bms205749、bibp3226、j-115814、bibo3304、ly-357897、cp-671906和gi-264879a;以及美国专利第6,001,836号和wo96/14307、wo01/23387、wo99/51100、wo01/85690、wo01/85098、wo01/85173和wo01/89528中公开的那些;(9)npy5(神经肽yy5)拮抗剂诸如152,804、s2367(shionogi)、e-6999(esteve)、gw-569180a、gw-594884a(glaxosmithkline)、gw-587081x、gw-548118x;fr235,208;fr226928、fr240662、fr252384;1229u91、gi-264879a、cgp71683a、c-75(fasgen)ly-377897、ly366377、pd-160170、sr-120562a、sr-120819a、s2367(shionogi)、jcf-104和h409/22;和美国专利第6,140,354、6,191,160、6,258,837、6,313,298、6,326,375、6,329,395、6,335,345、6,337,332、6,329,395和6,340,683号以及ep-01010691、ep-01044970和fr252384以及pct公开号wo97/19682、wo97/20820、wo97/20821、wo97/20822、wo97/20823、wo98/27063、wo00/107409、wo00/185714、wo00/185730、wo00/64880、wo00/68197、wo00/69849、wo01/09120、wo01/14376、wo01/85714、wo01/85730、wo01/07409、wo01/02379、wo01/02379、wo01/23388、wo01/23389、wo01/44201、wo01/62737、wo01/62738、wo01/09120、wo02/20488、wo02/22592、wo02/48152、wo02/49648、wo02/051806、wo02/094789、wo03/009845、wo03/014083、wo03/022849、wo03/028726、wo05/014592、wo05/01493和norman等j.med.chem.43:4288-4312(2000)中公开的那些;(10)瘦素诸如重组人瘦蛋白(peg-ob,hoffmanlaroche)和重组甲硫氨酰人瘦素(amgen);(11)瘦素衍生物诸如美国专利第5,552,524号、第5,552,523号、第5,552,522号、第5,521,283号以及wo96/23513、wo96/23514、wo96/23515、wo96/23516、wo96/23517、wo96/23518、wo96/23519和wo96/23520中公开的那些;(12)阿片类拮抗剂诸如纳美芬3-甲氧基纳曲酮、纳洛酮和纳曲酮;和wo00/21509中公开的那些;(13)食欲素(orexin)拮抗剂诸如sb-334867-a(glaxosmithkline)以wo01/96302、01/68609、02/44172、02/51232、02/51838、02/089800、02/090355、03/023561、03/032991、03/037847、04/004733、04/026866、04/041791、04/085403中公开的那些等;(14)brs3(蛙皮素受体亚型3)激动剂;(15)cck-a(缩胆囊素-a)激动剂诸如aar-r15849、gi181771、jmv-180、a-71378、a-71623、pd170292、pd149164、sr146131、sr125180、布它宾代以及美国专利第5,739,106号中公开的那些;(16)cntf(睫状神经营养因子)诸如gi-181771(glaxo-smithkline);sr146131(sanofisynthelabo);布它宾代;和pd170,292,pd149164(pfizer);(17)cntf衍生物诸如阿索开(axokine)(regeneron);以及wo94/09134、wo98/22128和wo99/43813中公开的那些;(18)ghs(生长激素促分泌素受体)激动剂诸如nn703、海沙瑞林、mk-0677、sm-130686、cp-424,391、l-692,429和l-163,255以及美国专利第6,358,951号、美国专利申请第2002/049196号和第2002/022637号以及wo01/56592和wo02/32888中公开的那些;(19)5ht2c(5-羟色胺受体2c)激动剂诸如apd3546/ar10a(arenapharmaceuticals)、ath88651(athersys)、ath88740(athersys)、bvt933(biovitrum/gsk)、dpca37215(bms)、ik264;ly448100(lilly)、pnu22394;way470(wyeth)、way629(wyeth)、way161503(biovitrum)、r-1065、vr1065(vernalis/roche)ym348;以及美国专利号第3,914,250号和pct出版物01/66548、02/36596、02/48124、02/10169、02/44152;02/51844、02/40456、02/40457、03/057698、05/000849中公开的那些等;(20)mc3r(黑皮质素3受体)激动剂;(21)mc4r(黑皮质素4受体)激动剂诸如chir86036(chiron)、chir915(chiron);me-10142(melacure)、me-10145(melacure)、hs-131(melacure)、nbi72432(neurocrinebiosciences)、nnc70-619(novonordisk)、ttp2435(transtech)和pct公开wo99/64002、00/74679、01/991752、01/0125192、01/52880、01/74844、01/70708、01/70337、01/91752、01/010842、02/059095、02/059107、02/059108、02/059117、02/062766、02/069095、02/12166、02/11715、02/12178、02/15909、02/38544、02/068387、02/068388、02/067869、02/081430、03/06604、03/007949、03/009847、03/009850、03/013509、03/031410、03/094918、04/028453、04/048345、04/050610、04/075823、04/083208、04/089951、05/000339以及ep1460069和us2005049269和jp2005042839等中公开的那些等;(22)单胺再摄取抑制剂诸如西布曲明及其盐、以及美国专利第4,522,569号、第4,806,570号和第5,436,272号以及美国专利公开号2002/0006964,以及wo01/27068和wo01/62341中公开的那些化合物;(23)血清素再摄取抑制剂诸如右芬氟拉明、氟西汀以及美国专利第6,365,633号和wo01/27060以及wo01/162341中公开的那些;(24)glp-1(胰高血糖素样肽1)激动剂;(25)托吡酯(26)植物药化合物57(cp644,673);(27)acc2(乙酰辅酶a羧化酶-2)抑制剂;(28)β3(β肾上腺素能受体3)激动剂诸如rafebergron/ad9677/tak677(dainippon/takeda)、cl-316,243、sb418790、brl-37344、l-796568、bms-196085、brl-35135a、cgp12177a、bta-243、grc1087(glenmarkpharmaceuticals)gw427353(盐酸索拉贝隆)、曲卡君、zenecad7114、n-5984(nisshinkyorin)、ly-377604(lilly)、kt07924(kissei)、sr59119a、以及美国专利第5,705,515号、美国专利第5,451,677号以及wo94/18161、wo95/29159、wo97/46556、wo98/04526wo98/32753、wo01/74782、wo02/32897、wo03/014113、wo03/016276、wo03/016307、wo03/024948、wo03/024953、wo03/037881、wo04/108674中公开的那些等;(29)dgat1(二酰基甘油酰基转移酶1)抑制剂;(30)dgat2(二酰基甘油酰基转移酶2)抑制剂;(31)fas(脂肪酸合酶)抑制剂诸如变蓝菌素和c75;(32)pde(磷酸二酯酶)抑制剂诸如茶碱、己酮可可碱、扎普司特、西地那非、氨力农、米力农、西洛他胺、咯利普兰和西洛司特,以及wo03/037432、wo03/037899中描述的那些;(33)甲状腺激素β受体激动剂诸如kb-2611(karobiobms),以及wo02/15845和日本专利申请号jp2000256190中公开的那些;(34)ucp-1(解偶联蛋白1)、2或3活化剂诸如植烷酸、4-[(e)-2-(5,6,7,8-四氢-5,5,8,8)-四甲基-2-萘基)-1-丙烯基]苯甲酸(ttnpb)和视黄酸;和wo99/00123中公开的那些;(35)酰基-雌激素诸如油酰基-雌酮,公开于mar-grasa,m.等,obesityresearch,9:202-9(2001)中;(36)糖皮质激素受体拮抗剂诸如cp472555(pfizer)、kb3305,以及wo04/000869、wo04/075864中公开的那些等;(37)11βhsd-1(11-β羟基类固醇脱氢酶1型)抑制剂诸如ly-2523199、bvt3498(amg331)、bvt2733、3-(1-金刚烷基)-4-乙基-5-(乙基硫代)-4h-1,2,4-三唑、3-(1-金刚烷基)-5-(3,4,5-三甲氧基苯基)-4-甲基-4h-1,2,4-三唑、3-金刚烷基-4,5,6,7,8,9,10,11,12,3a-十氢-1,2,4-三唑并[4,3-a][11]轮烯,以及wo01/90091、01/90090、01/90092、02/072084、04/011410、04/033427、04/041264、04/027047、04/056744、04/065351、04/089415、04/037251中公开的那些化合物等;(38)scd-1(硬脂酰辅酶a去饱和酶-1)抑制剂;(39)二肽基肽酶iv(dpp-4)抑制剂诸如异亮氨酸噻唑烷、缬氨酸吡咯烷、西他列汀(januvia)、奥马瑞平、沙格列汀、阿格列汀、利格列汀、nvp-dpp728、laf237(维达列汀)、p93/01、tsl225、tmc-2a/2b/2c、fe999011、p9310/k364、vip0177、sdz274-444、gsk823093、e3024、syr322、ts021、ssr162369、grc8200、k579、nn7201、cr14023、phx1004、phx1149、pt-630、sk-0403,以及wo02/083128、wo02/062764、wo02/14271、wo03/000180、wo03/000181、wo03/000250、wo03/002530、wo03/002531、wo03/002553、wo03/002593、wo03/004498、wo03/004496、wo03/005766、wo03/017936、wo03/024942、wo03/024965、wo03/033524、wo03/055881、wo03/057144、wo03/037327、wo04/041795、wo04/071454、wo04/0214870、wo04/041273、wo04/041820、wo04/050658、wo04/046106、wo04/067509、wo04/048532、wo04/099185、wo04/108730、wo05/009956、wo04/09806、wo05/023762、us2005/043292和ep1258476中公开的那些化合物;(40)脂肪酶抑制剂诸如四氢尼泊司他汀(奥利司他/xenical)、atl962(alizyme/takeda)、gt389255(genzyme/peptimmune)tritonwr1339、rhc80267、泥泊司它汀、茶叶皂苷和二乙基伞形基磷酸酯、fl-386、way-121898、bay-n-3176、缬基内酯(valilactone)、esteracin、抑脂酶免疫酮a(ebelactonea)、抑脂酶免疫酮b(ebelactoneb)和rhc80267,以及wo01/77094,wo04/111004和美国专利第4,598,089号、第4,452,813号、第5,512,565号、第5,391,571号、第5,602,151号、第4,405,644号、第4,189,438号和第4,242,453号中公开的那些等;(41)脂肪酸转运蛋白抑制剂;(42)二羧酸转运蛋白抑制剂;(43)葡萄糖转运蛋白抑制剂;和(44)磷酸转运蛋白抑制剂;(45)厌氧双环化合物诸如1426(aventis)和1954(aventis),以及wo00/18749、wo01/32638、wo01/62746、wo01/62747和wo03/015769中公开的化合物;(46)肽yy和pyy激动剂诸如pyy336(nastech/merck)、ac162352(icinnovations/curis/amylin)、tm30335/tm30338(7tmpharma)、pyy336(emispheretechnologies)、聚乙二醇化肽yy3-36,以及wo03/026591、04/089279中公开的那些等;(47)脂质代谢调节剂诸如山楂酸、古柯二醇、熊果酸、桦木酸、桦木醇等,以及wo03/011267中公开的化合物;(48)转录因子调节剂诸如wo03/026576中公开的那些;(49)mc5r(黑皮质素5受体)调节剂诸如wo97/19952、wo00/15826、wo00/15790、us20030092041中公开的那些等;(50)脑源性神经营养因子(bdnf);(51)mc1r(黑皮质素1受体调节剂诸如lk-184(proctor&gamble)等;(52)5ht6拮抗剂诸如bvt74316(biovitrum)、bvt5182c(biovitrum))、e-6795(esteve)、e-6814(esteve)、sb399885(glaxosmithkline)、sb271046(glaxosmithkline)、ro-046790(roche)等;(53)脂肪酸转运蛋白4(fatp4);(54)乙酰辅酶a羧化酶(acc)抑制剂诸如cp640186、cp610431、cp640188(pfizer);(55)c-末端生长激素片段诸如aod9604(monashuniv/metabolicpharmaceuticals)等;(56)胃泌酸调节素;(57)神经肽ff受体拮抗剂诸如wo04/083218中公开的那些等;(58)胰岛淀粉样多肽激动剂诸如symlin/普兰林肽/ac137(amylin);(59)火地亚属(hoodia)和亚罗汉属(trichocaulon)植物提取物;(60)bvt74713和其他肠道脂质食欲抑制剂;(61)多巴胺激动剂诸如安非他酮(wellbutrin/glaxosmithkline);(62)唑尼沙胺(zonegran/dainippon/elan)等;和(e)适合与本发明化合物组合使用的食欲抑制剂,包括但不限于aminorex、安非他酮、苯丙胺、苯并苯丙胺、氯苯丁胺、氯苯哒嗪、cloforex、氯氨雷司、氯特胺、环己异丙甲胺、右芬氟拉明、右旋安非他命、安非拉酮、二苯甲哌啶乙醇、n-乙基安非他明、芬布酯、芬氟拉明、非尼雷司、芬普雷司、氟多雷司、氟氨雷司、呋甲苯丙胺、左苯丙胺、左芬氟拉明、马吲哚、美芬雷司、甲胺苯丙酮、甲基苯丙胺、去甲伪麻黄碱、喷托雷司、苯甲曲秦、芬美曲秦、芬特明、苯丙醇胺、匹西雷司和西布曲明;及其药学上可接受的盐。一类特别合适的食欲抑制剂是卤代苯丙胺衍生物,包括氯苯丁胺、氯噻嗪、氯噻嗪、右芬氟拉明、芬氟拉明、匹西雷司和西布曲明;及其药学上可接受的盐。与本发明化合物组合使用的特定卤代苯丙胺衍生物包括:芬氟拉明和右芬氟拉明,及其药学上可接受的盐;(f)cb1(大麻素-1受体)拮抗剂/反向激动剂,诸如利莫纳班(acomplia;sanofi)、sr-147778(sanofi)、sr-141716(sanofi)、bay65-2520(bayer)和slv319(solvay),以及在专利公开美国专利第4,973,587号、美国专利第5,013,837号、美国专利第5,081,122号、美国专利第5,112,820号、美国专利第5,292,736号、美国专利第5,532,237号、美国专利第5,624,941号、美国专利第6,028,084号、美国专利第6,509,367号、美国专利第6,509,367、wo96/33159、wo97/29079、wo98/31227、wo98/33765、wo98/37061、wo98/41519、wo98/43635、wo98/43636、wo99/02499、wo00/10967、wo00/10968、wo01/09120、wo01/58869、wo01/64632、wo01/64633、wo01/64634、wo01/70700、wo01/96330、wo02/076949、wo03/006007、wo03/007887、wo03/020217、wo03/026647、wo03/026648、wo03/027069、wo03/027076、wo03/027114、wo03/037332、wo03/040107、wo03/086940、wo03/084943和ep658546中公开的那些药剂;(g)cb1受体拮抗剂,诸如1,5-二芳基吡唑类似物,诸如利莫那班(sr141716、和)、舒立纳班(sr147778)和am251;3,4-二芳基吡唑啉类诸如slv-319(伊匹纳班);4,5-diarylimidazoles;1,5-二芳基吡咯-3-甲酰胺、二芳基-吡唑的双环衍生物和咪唑如cp-945,598(奥太纳班);甲磺酰胺氮杂环丁烷衍生物;tm38837;β-内酰胺大麻素调节剂;苯并呋喃衍生物。cb1受体拮抗剂可包括或排除1,5-二芳基吡唑类似物,诸如利莫那班(sr141716、和)、舒立纳班(sr147778)和am251;3,4-二芳基吡唑啉类如slv-319(伊匹纳班);4,5-diarylimidazoles;1,5-二芳基吡咯-3-甲酰胺、二芳基-吡唑的双环衍生物和咪唑诸如cp-945,598(奥太纳班);甲磺酰胺氮杂环丁烷衍生物;tm38837;β-内酰胺大麻素调节剂;和苯并呋喃衍生物。药物组合物例如,可以以有效量将可在治疗和/或预防病理状态中使用的抑制胰高血糖素/ap2复合物激动gcgr的化合物,例如小分子、配体、抗体、抗原结合剂或抗体结合片段作为药物组合物施用,所述药物组合物包含该化合物与一种或多种药学上可接受的赋形剂、稀释剂或载体的组合。该组合物通常作为无菌药物组合物的部分提供,所述无菌药物组合物通常包括药学上可接受的载体。本发明的药物组合物可另外包含药学上可接受的赋形剂。破坏胰高血糖素/ap2复合物对gcgr的激动作用的化合物可以是药物组合物中唯一的活性成分,或者可以伴随其他活性成分,包括其他成分。药物组合物合适地包含治疗有效量的中断胰高血糖素/ap2复合物对gcgr的激动作用的化合物。如本文中所用的术语“治疗有效量”是指以这样的方式抑制胰高血糖素/ap2复合物对gcgr的激动作用(以便治疗、改善或预防靶向疾病或病症,或表现出由gcgr介导的可检测的治疗或预防作用)所需的治疗剂的量。对于任何合适的化合物,治疗有效量最初可以在细胞培养测定中或在动物模型中,通常在啮齿动物、兔、狗、猪或灵长类动物中进行估计。动物模型也可用于确定合适的浓度范围和施用途径。然后,可将此类信息用于确定用于人中施用的有用剂量和途径。因此,本公开提供了包含有效量的化合物或药学上可接受的盐以及至少一种药学上可接受的载体的药物组合物,以用于本文所述的任何用途。药物组合物可含有化合物或盐作为唯一的活性剂,或者在替代实施方案中,可含有化合物和至少一种另外的活性剂。当然,施用剂量将根据已知因素而变化,所述因素是诸如特定药剂的药效学特征,及其施用方式和途径;受者的年龄、健康和体重;症状的性质和程度、同时治疗的种类、治疗的频率和所需的效果。在某些实施方案中,药物组合物的剂型为在单位剂型中包含约0.1mg至约2000mg、约10mg至约1000mg、约100mg至约800mg或约200mg至约600mg的活性化合物和任选地约0.1mg至约2000mg、约10mg至约1000mg、约100mg至约800mg或约200mg至约600mg的另外的活性剂。实例是具有至少0.1mg、1mg、5mg、10mg、25mg、50mg、100mg、200mg、250mg、300mg、400mg、500mg、600mg、700mg或750mg活性化合物或其盐的剂型。作为非限制性实例,可使用每24小时、12小时、8小时、6小时、4小时或2小时或其任何组合的单剂量或分剂量,在第1天、第2天、第3天、第4天、第5天、第6天、第7天、第8天、第9天、第10天、第11天、第12天、第13天、第14天、第15天、第16天、第17天、第18天、第19天、第20天、第21天、第22天、第23天、第24天、第25天、第26天、第27天、第28天、第29天、第30天、第31天、第32天、第33天、第34天、第35天、第36天、第37天、第38天、第39天或第40天中的至少一天,或可选择地在第1周、第2周、第3周、第4周、第5周、第6周、第7周、第8周、第9周、第10周、第11周、第12周、第13周、第14周、第15周、第16周、第17周、第18周、第19周或第20周中的至少一周,以0.1至100mg/kg/天,诸如0.5mg/kg/天、0.9mg/kg/天、1.0mg/kg/天、1.1mg/kg/天、1.5mg/kg/天、2mg/kg/天、3mg/kg/天、4mg/kg/天、5mg/kg/天、6mg/kg/天、7mg/kg/天、8mg/kg/天、9mg/kg/天、10mg/kg/天、11mg/kg/天、12mg/kg/天、13mg/kg/天、14mg/kg/天、15mg/kg/天、16mg/kg/天、17mg/kg/天、18mg/kg/天、19mg/kg/天、20mg/kg/天、21mg/kg/天、22mg/kg/天、23mg/kg/天、24mg/kg/天、25mg/kg/天、26mg/kg/天、27mg/kg/天、28mg/kg/天、29mg/kg/天、30mg/kg/天、40mg/kg/天、45mg/kg/天、50mg/kg/天、60mg/kg/天、70mg/kg/天、80mg/kg/天、90或100mg/kg/天的日剂量的本发明的抗胰高血糖素/ap2单克隆抗体提供人或动物中gcgr介导的病症的治疗。药物组合物还可包含一定摩尔比的活性化合物和另外的活性剂。例如,药物组合物可含有为约0.5:1、约1:1、约2:1、约3:1、或约1.5:1至约4:1的摩尔比的抗炎或免疫抑制剂。本文公开的化合物可以含有常规药学上可接受的载体的剂量单位制剂通过口服、局部、肠胃外、通过吸入或喷雾、舌下、通过植入(包括眼部植入)、透皮、通过口腔、直肠、作为眼用溶液、注射(包括眼部注射)、静脉内、主动脉内、颅内、真皮下、腹膜内、皮下、经鼻、舌下或直肠或通过其他方式施用。药物组合物可以配制成任何药学上有用的形式,例如气溶胶、乳膏、凝胶、丸剂、注射或输注液、胶囊、片剂、糖浆、透皮贴剂、皮下贴剂、干粉、吸入制剂、在医疗器械中、栓剂、口腔或舌下制剂、肠胃外制剂或眼用溶液。一些剂型,诸如片剂和胶囊,被细分为适当大小的单位剂量,其含有适当量的活性成分,例如达到所需目的的有效量。载体包括赋形剂和稀释剂,并且必须具有足够高的纯度和足够低的毒性,以使它们适合于对待治疗的患者施用。载体可以是惰性的,或者其可具有其自身的药物益处。与化合物结合使用的载体的量足以提供每单位剂量化合物施用的实际量的材料。载体的类别包括但不限于粘合剂、缓冲剂、着色剂、稀释剂、崩解剂、乳化剂、矫味剂、助流剂、润滑剂、防腐剂、稳定剂、表面活性剂、压片剂和润湿剂。一些载体可以列入不止一类中,例如植物油可以在一些制剂中用作润滑剂而在其它制剂中可以用作稀释剂。示例性的药学上可接受的载体包括糖、淀粉、纤维素、粉末黄蓍胶、麦芽、明胶;滑石粉和植物油。任选的活性剂可以包含在药物组合物中,其基本上不会干扰本发明化合物的活性。可以配制药物组合物/组合用于口服施用。这些组合物可含有获得所需结果的任何量的活性化合物,例如0.1至99重量%(wt.%)的化合物,通常至少约5wt.%的化合物。一些实施方案含有约25wt.%至约50wt.%或约5wt.%至约75wt.%的化合物。适合于直肠施用的制剂通常以单位剂量栓剂的形式提供。这些可以通过将活性化合物与一种或多种常规固体载体(例如可可脂)混合,然后将所得混合物成型来制备。适于局部施用于皮肤的制剂优选采用软膏、霜剂、洗剂、糊剂、凝胶、喷雾剂、气雾剂或油的形式。可以使用的载体包括凡士林、羊毛脂、聚乙二醇、醇、透皮增强剂以及其中两种或更多种的组合。适合于透皮施用的制剂可以作为离散的贴剂提供,其适于与受者的表皮保持长时间的紧密接触。适于透皮施用的制剂也可通过离子电渗疗法递送(参见,例如,pharmaceuticalresearch3(6):318(1986)),并且通常采取任选缓冲的活性化合物水溶液的形式。在一个实施方案中,提供微针贴片或装置用于将药物递送穿过或进入生物组织,特别是皮肤。微针贴片或装置允许药物以临床相关的速率穿过或进入皮肤或其他组织屏障,对组织的损伤、疼痛或刺激最小或没有。适于对肺部施用的制剂可以通过各种被动呼吸驱动和有效动力驱动的单/多剂干粉吸入器(dpi)来递送。最常用于呼吸递送的装置包括雾化器、计量吸入器和干粉吸入器。有几种类型的雾化器可供选择,包括喷射雾化器、超声雾化器和振动筛网雾化器。合适的肺部递送装置的选择取决于参数诸如药物的性质及其制剂、作用部位和肺的病理生理学、每剂量含有预定量的本发明活性剂的形式。有利地,通过施用连续剂量的根据本公开的干扰胰高血糖素/ap2对gcgr的激动作用的化合物,可将体内胰高血糖素/ap2对gcgr的激动作用的水平维持在适当降低的水平。可将组合物单独向患者施用,或者可将其与其他药剂、药物或激素组合(例如同时、依次或分开)向患者施用。在一个实施方案中,连续施用化合物,例如,可将该化合物用无针皮下注射装置诸如例如美国专利第5,399,163号、第5,383,851号、第5,312,335号、第5,064,413号、第4,941,880号、第4,790,824号或第4,596,556号中公开的装置施用化合物。可用于本发明的植入物和模块的实例包括:美国专利第4,487,603号,其公开了用于以受控速率分配药物的可植入微输注泵;美国专利第4,486,194号,其公开了通过皮肤施用药剂的治疗装置;美国专利第4,447,233号,其公开了用于以精确输注速率递送药物的药物输注泵;美国专利第4,447,224号,其公开了用于连续药物输送的可变流动植入式输注装置;美国专利第4,439,196号,其公开了具有多室隔室的渗透药物输送系统;和美国专利第4,475,196号,其公开了渗透性药物递送系统。许多其他此类植入物、递送系统和模块是已知的。实施例导致慢性高血糖症的失调的胰高血糖素活性和升高的血糖水平涉及许多代谢疾病(诸如糖尿病)的病理学。实施例1:循环ap2直接与胰高血糖素相互作用并且是胰高血糖素生物活性所必需的材料所有dna和寡核苷酸合成均由idtdnatechnologies完成。l-169047(胰高血糖素受体拮抗剂ii)购自tocrisbiosciences。除非另有说明,否则所有其他试剂和化学品均购自sigma-aldrich并按原样使用。生物层干涉测量法(bli)测量通过blitzbio-layer干涉测量系统(bli,fortébioinc.)在25℃下测量ap2与生物素-胰高血糖素的结合亲和力。生物层干涉测量法测量当溶液中的配体与生物传感器探针上的固定化靶标结合(从而产生表观kd)时光的干涉图案的变化。简言之,将链霉抗生物素蛋白blitzdip和readtm-动力学生物传感器探针(fortébioinc.)加载pbs缓冲液中的20μg/ml生物素化胰高血糖素,在pbs缓冲液中洗涤,并在pbs中进行基线读数30秒。在pbs中于3.4μm和34μm浓度下进行ap2的缔合相读数200秒,然后在相同缓冲液中进行解离相读数300秒。通过响应的全局曲线拟合获得解离常数,得到kon和koff值,然后将其kon和koff值用于计算kdapp。与模拟负载探针相互作用的ap2的背景结合(表观亲和力)小于与白蛋白负载探针的结合的2%,并且从总结合中减去背景结合。闪烁迫近测定使用pierce胺反应性生物素化试剂盒将ap2生物素化。将125i标记的胰高血糖素(perkinelmer)在链霉抗生物素蛋白包被的闪光板(perkinelmer)中于5mmmgcl2,1mm油酸,5%甘油pbs缓冲液中孵育1小时,然后在betalux(perkinelmer)中读数。质粒和病毒构建体人胰高血糖素受体-gfp构建体购自origene。通过扩增克隆在nano-luc的最小基础报告基因的近端位点处的camp应答元件的四个串联重复来克隆camp应答元件荧光素酶构建体。用于原代肝细胞的camp-luc腺病毒购自vectorbiolabs。将gcgr细胞外结构域克隆到pfastbac穿梭载体中。在克隆过程中,加入六组氨酸和welq蛋白酶位点以用于蛋白质纯化。将鼠ap2基因在六组氨酸标记和tev蛋白酶位点之后克隆到pet21+载体中以便于纯化。rna提取和定量pcr使用制造商的说明书,利用trizol试剂(invitrogen)提取rna,并使用先前公开的引物序列进行定量pcr(cao等,cellmetab.2013年5月7日;17(5):768-778)。动物和细胞根据联邦、州、地方和nih动物护理指南,在美国农业部监管的harvardanimalfacility对动物进行护理。雄性c57bl/6小鼠(10-12周)获自jackson实验室。hepg2-c3a细胞获自美国典型培养物保藏中心(atcc)。将细胞在完全培养基(dmem,4.5g/l葡萄糖,10%胎牛血清(atlantabio))和mem丙酮酸钠(1mm)中培养。从c57bl/6j小鼠分离原代肝细胞,并在100u/ml青霉素g钠和100μg/ml链霉素(pen/strep)中培养。将cho/k1细胞在dmem:f12和5%加强型小牛血清(thermoscientific)中培养。所有培养基补充剂均来自invitrogen。细胞转染、稳定细胞系的生成和病毒感染根据制造商的说明使用lipofectamine(invitrogen)转染质粒。将瞬时转染的细胞在适用于稳定的细胞系生成的适当的选择抗生素中生长。在选择培养基下进行三次传代后,挑选单细胞集落并在验证后扩增以用于实验。统计分析所有图均显示平均值,误差条表示sem(对于线图)和sd(对于条形图)。除非另有说明,否则使用非配对student’st检验进行两组的平均值的比较。使用单因素方差分析(anova),然后进行bonferroni事后检定来比较超过2个组。进行标准重复测量测试,其中从单个动物获取多次测量。*,p<0.05;**,p<0.01;***,p<0.001,ns.,除非另有说明,否则表示“不显著的”。使用graphpadprism软件v6.0(sandiego,ca)进行统计学分析。ap2协同激活胰高血糖素作用的糖异生程序已经确定低血糖症反调节激素(主要是胰高血糖素、肾上腺素、皮质醇和生长激素)协同作用并共享共同的β-肾上腺素能刺激用于分泌(bolli等,diabetes.1982jul;31(7):641-647)。还注意到β肾上腺素能激活后的脂解信号有助于这种协同活性(souza等,brazjmedbiolres.1994dec;27(12):2883-2887),但脂质输注未能起到这种作用(haywood等,amjphysiolendocrinolmetab.2009jul;297(1):e50-56;和antoniades等,thelancet.1967mar;289(7490):602-604),表明脂肪组织衍生的因子可能会减轻这些影响。由于循环ap2水平受β-肾上腺素能信号传导调节(cao等,cellmetab.2013may7;17(5):768-778)并且有助于肝葡萄糖产生(cao等,cellmetab.2013may7;17(5):768-778),因此测试了ap2与胰高血糖素协同作用以激活肝葡萄糖产生这一假设。为了直接测试该假设,首先检查主要胰岛素反调节激素胰高血糖素在分离的原代肝细胞中的作用以及ap2和胰高血糖素在所述原代肝细胞中的组合作用(图1a和1b)。在这种设置中,向胰高血糖素中加入ap2进一步增加了糖异生基因的表达,超过了单独的胰高血糖素。不希望受任何一种理论束缚,这支持ap2在糖异生程序化中的协同作用。该糖异生基因表达也与功能测定一致,所述功能测定中原代肝细胞中的肝葡萄糖产生(图1c)和肝细胞瘤细胞系(图1d)中的糖原分解通过与胰高血糖素协同作用的ap2增加。为了进一步检查该过程中涉及的下游信号传导事件,以及研究ap2对胰高血糖素作用的影响,在cho-k1细胞中构建了表达camp报告系统的人胰高血糖素受体。如图1e所示,ap2添加使胰高血糖素的效力增加超过一个数量级(log10ec50胰高血糖素-8.215±0.1556;胰高血糖素+ap2-9.698±0.1448m±s.e.m.)。当使用腺病毒介导的camp报道荧光素酶测定camp活性时,该观察结果也与原代肝细胞中的结果一致(图1f)。ap2是胰高血糖素受体的变构增强子。鉴于ap2增强胰高血糖素信号转导和代谢作用的能力,进行了进一步的研究以确定ap2是否在胰高血糖素受体的激活中具有上游作用。使用g6pc启动子驱动的报道分子测定。如图2a所示,仅当报告质粒与胰高血糖素受体共转染时,ap2和胰高血糖素对g6pc启动子活性的协同作用才存在。使用杆状病毒表达系统测试ap2是否可以作为胰高血糖素的变构增强子对其受体起作用。表达gcgr的细胞外结构域(gcgr-ecd)(wu等,proteinexprpurif.2013jun;89(2):232-240),并使用blitz生物层干涉测量系统检查ap2对胰高血糖素与gcgr-ecd的结合动力学的影响。添加ap2导致胰高血糖素与gcgr-ecd的缔合显著增加以及解离速率减小(图2b),导致解离常数降低一个数量级(kdapp胰高血糖素1.76e-007m;kdapp胰高血糖素+ap25.41e-008m)。这些结果与在体外对于camp活性观察到的效果一致。不希望受任何一种理论束缚,这提供了在ap2存在的情况下胰高血糖素作用的活性增加的直接证据(图1e)。为了进一步理解ap2作为胰高血糖素作用的变构调节剂的作用,评估胰高血糖素受体l-168,049的变构抑制剂(cascieri等,jbiolchem.1999mar26;274(13):8694-8697)抑制ap2作用的能力。添加l-168,049减弱了ap2对于胰高血糖素对胰高血糖素受体的作用的协同作用(图2c和2d)。l-168,049的添加还导致对ap2和胰高血糖素的反应能力的丧失。不希望受任何一种理论束缚,这表明ap2可以与胰高血糖素受体的变构位点结合(图2e和2f)。ap2与胰高血糖素直接相互作用为了理解ap2籍以增强胰高血糖素作用的机制,探索了ap2与胰高血糖素的物理相互作用的可能性。使用一系列结合测定。首先,使用生物层干涉测量法,证明了ap2与生物素化的胰高血糖素的直接相互作用(图3a)。接下来,使用闪烁迫近测定法,其中125i-胰高血糖素与生物素化的ap2相互作用(图3b)。使用这些互补标记的蛋白质(complimentarytaggedprotein),获得了相似的亲和力((kdapp分别为2.34μm和2.62μm)。为了在无标记系统中进一步研究这种蛋白质-肽相互作用,采用等温滴定量热法作为测量溶液中结合事件释放的热量的金标准结合测定法。该方法揭示了直接胰高血糖素/ap2结合(图3c)。这些测量结果也与先前描述的结合研究一致。为了解决这种相互作用的生理相关性,首先尝试将内源性复合物从循环中拉下来。在用抗ap2抗体包被的磁珠孵育后,使用缀合有hrp的抗胰高血糖素抗体在野生型小鼠的血清中检测到胰高血糖素信号(图3d,3e和3f)。在不存在ap2(ap2-/-血清或抗体耗尽的野生型血清)的情况下,存在最小量的胰高血糖素信号(与非特异性结合信号无法区分)。向ap2-/-血清中添加重组ap2导致由抗-ap2抗体恢复的明显更高的胰高血糖素信号,但未达到统计学显著性。这些结果与野生型和ap2-/-血清中各自的胰高血糖素水平(分别为189±20、210±41pg/ml)无关。另外,生物素化的胰高血糖素用作诱饵以从野生型和ap2-/-血清中拉下内源性ap2(图3m)。总的来说,不希望受任何一种理论束缚,这些结果表明ap2结合胰高血糖素的能力具有生理学相关性,并且胰高血糖素/ap2蛋白质复合物天然存在。微尺度热泳(mst)允许使用热泳进行生物分子的相互作用分析,其证实了缺乏额外的体内衔接蛋白。由于分子之间的结合导致的分子性质(例如,分子的大小、电荷和溶剂化熵)的变化改变了分子的热泳。mst可以通过直接在溶液中测量相互作用而不用将分子固定到表面来基于分子的热泳运动测量分子之间的结合亲和力。通过使用mst,显示了ap2与胰高血糖素结合(kd为约214nm),胰高血糖素与胰高血糖素受体结合(kd为约36.7nm),ap2与胰高血糖素受体结合(kd为约15.4至约120nm)(图5a-ed)。为了给出可能的相互作用残基的起始点,已经采用生物信息学工具来帮助设计点突变。对于完全无偏的预测,已经采用了几种预测算法(pierce等,bioinformatics.2014mar12;cheng等,proteins.2007aug1;68(2):503-515;comeau等,bioinformatics.2004jan1;20(1):45-50和jiménez-garcía等,bioinformatics.2013jul1;29(13):1698-1699)来给出所有可能的预测模式。此外,由于已经报道了ap2的多种晶体构象(lalonde等,biochemistry.1994apr26;33(16):4885-4895),ap2和胰高血糖素的多个化学计量比的可能性也被包括在搜索中。由于蛋白质-蛋白质对接的不同算法具有预测不同三级结构的不同效率(janin等,proteins.2003jul1;52(1):2-9),具有已知结合配偶体的ap2和胰高血糖素的已知结构已被验证。发现用于预测的所有三个服务器预测ap2与胰高血糖素的结合,rmsd具有99.7%的置信度或更好,表明服务器的预测将产生尽可能接近观察到的相互作用的结果。在三个服务器之间产生的约14,000个预测和两个可能的相互作用比率(interactionratios)中,cons-cocomaps(vangone等,bioinformatics.2011aug27;btr484)服务器已用于映射可能的相互作用位点的分布频率(图6c)。第一个α螺旋和phe57位点已被确定为潜在的相互作用位点。为了进一步阐明潜在的相互作用位点,制备了具有三个点突变的三重突变ap2(n59、e61和k79)。使用人ap2、突变ap2与胰高血糖素和抗ap2抗体产生结合曲线。已显示,如用octet系统所测量的,该突变蛋白具有较低的结合亲和力(图3g-3j)。另外,对胰高血糖素蛋白进行截短,并在野生型和ap2-/-小鼠中测试与ap2的结合。从这些实验中可以看出,胰高血糖素的残基22-29对于结合ap2是重要的(图3l)。为了阐明ap2在胰高血糖素与gcgr结合中的作用,通过差速离心分离来自野生型和gcgr缺陷型(gcgrfl/fl-albcre)小鼠肝脏的富集质膜级分。将质膜与固定的生物素化的胰高血糖素浓度(20nm)和递增量的ap2一起孵育。然后将质膜以及+/-ap2和胰高血糖素在小麦胚芽凝集素包被的平板中孵育并充分洗涤以除去未结合的蛋白质。缀合有hrp的链霉抗生物素蛋白用于检测胰高血糖素(图4a)。为了显示胰高血糖素与gcgr受体的结合在体内需要ap2,通过野生型、ap2-/-(具有和不具有重组ap2)和gcgrfl/fl-albcre小鼠的门静脉施用125i标记的胰高血糖素。将动物安乐死并在施用后5分钟经心脏灌注冷pbs5分钟。在灌注结束时收获器官,消化器官,并用液体闪烁计数器计数辐射(图4b、4c、4d和4e)。如图4f所示,ap2增加gcgr.ecd与胰高血糖素的结合。下拉实验也已完成。使用gcgr作为诱饵下拉ap2。将来自野生型小鼠的肝脏在裂解缓冲液中匀浆,并与重组ap2(10ug)、胰高血糖素(1ug)和与磁珠偶联的gcgr抗体一起孵育过夜。离心后,在沉淀和上清液中测量ap2、胰高血糖素和胰高血糖素+ap2信号(图4g和4h)。然后使用生物素化的胰高血糖素作为诱饵下拉gcgr。将来自野生型小鼠的肝脏在裂解缓冲液中匀浆,并与重组ap2(10ug)、生物素-胰高血糖素(1ug)和中性抗生物素蛋白偶联的磁珠一起孵育过夜。测量gcgr信号,并且对于ap2显示所述信号显著更高(图4i)。胰高血糖素作用在体内需要ap2将胰高血糖素注射到ap2缺乏和野生型小鼠中,并追踪它们的血糖作为胰高血糖素作用的量度(gelling等,proc.natl.acad.sci.usa.2003feb4;100(3):1438-1443)。令人惊讶的是,ap2缺乏动物对单独的胰高血糖素和ap2施用几乎没有反应,而对ap2敲除小鼠同时注射胰高血糖素和重组ap2能够恢复胰高血糖素应答性(图7a、7b)。图7g和7h显示用pbs、胰高血糖素或胰高血糖素和ap2处理的ap2敲除和野生型小鼠的葡萄糖耐量测试。不希望受任何一种理论束缚,这表明ap2敲除小鼠仅响应于添加ap2的胰高血糖素处理。在除胰高血糖素信号传导或糖原含量方面的固有缺陷之外,在ap2-/-小鼠的肝脏中观察到基线处的肝糖原含量或胰高血糖素受体的表达(图7c、7e和7i)没有差异。图7j显示了安乐死时剩余的糖原。当与基线测量相比时,图7g中看到的葡萄糖偏移归因于糖原分解。此外,在胰高血糖素施用后,循环胰高血糖素水平在wt和ap2-ko小鼠中均达到超生理水平,排除了胰高血糖素的快速降解或降低的生物利用度是ap2-ko小鼠中缺乏胰高血糖素作用的原因(未公开的结果)。此外,dpp4(主要胰高血糖素肽酶)的活性(hinke等,jbiolchem.2000feb11;275(6):3827-3834)在ap2-ko小鼠的血清中没有增加,进一步排除了快速降解的情况(图7d)。此外,通过颈静脉导管输注基线胰岛素水平和胰腺钳夹条件下的胰高血糖素的药理剂量(图7f)。在这些条件下,野生型动物的血糖水平与其无应答性ap2缺乏的同窝仔(尽管在基线时具有增加的血糖)相比不断增加。总之并且不希望受任何一种理论束缚,这些结果排除了肝脏缺陷作为在ap2缺乏小鼠中观察到的胰高血糖素低应答性作为似乎合理的机制的可能。最后,进行高胰岛素-胰腺钳夹(hyper-insulinemic-pancreaticclamp)研究以测量胰高血糖素、ap2以及胰高血糖素和ap2在ap2缺乏背景中的反调节活性(图8a)。在该设置中,未观察到与媒介物施用相比在单独施用胰高血糖素或ap2的情况下肝葡萄糖产生的显著增强,而同时施用ap2和胰高血糖素完全恢复了对胰岛素的反调节反应。另外,显示即使在恒定输注胰高血糖素的情况下,在ap2缺乏小鼠中也没有响应于胰高血糖素的葡萄糖产生,这表明ap2是体内胰高血糖素作用所必需的(图8b)。实施例2:靶向分泌的ap2/胰高血糖素/ap2蛋白质复合物的示例性单克隆抗体的制备。动物经哈佛大学动物护理委员会批准进行动物护理和实验程序。雄性小鼠(瘦素缺乏型(ob/ob)和具有c57bl/6j背景的饮食诱导型肥胖(dio)小鼠)购自thejacksonlaboratory(barharbor,me)并保持12小时光照/黑暗周期。除钳夹研究(对于所述研究给它们喂食hfd20周)外,在开始治疗之前将具有c57bl/6j背景的dio小鼠维持高脂肪饮食(60%kcal脂肪,researchdiets,inc.,d12492i)12至15周。瘦素缺乏(ob/ob)小鼠维持常规饲料(rd,picolab5058labdiet)。使用的动物为18至31周龄(对于饮食模型)和9至12周龄(对于ob/ob模型)。在所有实验中,除非文中另有说明,否则使用每组中至少7只小鼠。用150μlpbs(媒介物)或1.5mg/小鼠(~33mg/kg)的抗ap2单克隆抗体(于150μlpbs中)通过每周两次皮下注射处理小鼠3至5周。在治疗之前和之后,在6小时的白天食物戒断后从尾部收集血液样品。在进食状态下每周测量体重。在6小时的食物戒断后或在16小时的过夜禁食后每周测量血糖水平。在2周的处理后,通过腹膜内葡萄糖注射(对于dio为0.75g/kg,对于ob/ob小鼠为0.5g/kg)进行葡萄糖耐量测试。治疗3周后,通过腹膜内胰岛素注射(0.75iu/kg)在dio小鼠中进行胰岛素耐量测试。治疗5周后,如前所述(furuhashi等,(2007)nature447,959-965;maeda等,(2005)cellmetabolism1,107-119),在dio小鼠中进行高胰岛素-正常血糖钳夹(hyperinsulinemic-euglycemicclamp)实验。如前所述(furuhashi等,(2007)nature447,959-965)进行代谢笼(oxymax,columbusinstruments)和通过双能x射线吸收测定法(dexa;piximus)进行的全身脂肪测量。抗ap2/胰高血糖素/ap2蛋白复合物抗体的产生和施用通过ucb产生和纯化ca13、ca15、ca23和ca33(rabbitab909)。用含有重组人和小鼠ap2(内部在大肠杆菌(e.coli)中产生的:登录号分别为cag33184.1和caj18597.1)的混合物免疫新西兰白兔。从免疫的兔子收获脾细胞、外周血单核细胞(pbmc)和骨髓,随后在-80℃下储存。使用与zubler等(“mutantel-4thymomacellspolyclonallyactivatemurineandhumanbcellsviadirectcellinteraction”,jimmunol134,3662-3668(1985))描述的方法类似的方法来制备来自免疫动物的b细胞培养物。孵育7天后,使用均质荧光联免疫吸附测定,利用固定在superavidintm珠粒(bangslaboratories)上的生物素化小鼠或人ap2和山羊抗兔iggfcγ特异性cy-5缀合物(jacksonimmunoresearch)鉴定含有抗原特异性抗体的孔。为了从目标孔中鉴定、分离和回收抗原特异性b细胞,使用荧光焦点方法(clargo等,(2014)mabs6,143-159)。该方法涉及从阳性孔中收获b细胞并与涂有生物素化的小鼠和人ap2以及山羊抗兔fc片段特异性fitc缀合物(jacksonimmunoresearch)的顺磁性链霉抗生物素蛋白珠(newenglandbiolabs)混合。在37℃下静置孵育1小时后,由于b细胞周围存在荧光晕,从而可以鉴定抗原特异性b细胞。使用olympusix70显微镜观察分泌单个抗原特异性抗体的b细胞,用eppendorf显微操作器挑选所述细胞,并将其沉积到pcr管中。使用对重链和轻链可变区特异的引物,通过rt-pcr回收来自这些单个b细胞的可变区基因。进行两轮pcr,其中嵌套的2°pcr在3'和5'末端掺入限制性位点,允许将可变区克隆到多种表达载体中:小鼠γ1igg、小鼠fab、兔γ1igg(vh)或小鼠κ和兔κ(vl)。使用fectin293(invitrogen)将重链和轻链构建体转染到hek-293细胞中,并在6孔板中表达重组抗体。表达5天后,收获上清液,并使用biacore系统通过生物分子相互作用分析对抗体进行进一步筛选,以确定亲和力和表位箱。小鼠抗ap2单克隆抗体h3由danafarbercancerinstituteantibodycorefacility生产。通过注射全长人ap2/fabp4-gst重组蛋白免疫4-6周龄的雌性c57bl/6ap2-/-小鼠,所述人ap2/fabp4-gst重组蛋白悬浮在dulbecco磷酸盐缓冲盐水(pbs;gibco,grandisland,ny)中,并用等体积的完全弗氏佐剂(sigmachemicalco.,st.louis,mo)乳化。从免疫小鼠收获脾脏,制备细胞悬浮液并用pbs洗涤。计数脾细胞并以2:1的脾:骨髓瘤比将其与sp2/0骨髓瘤细胞(atccno.crl8-006,rockville,md)混合,所述sp2/0骨髓瘤细胞不能分泌重链或轻链免疫球蛋白(kearney等,(1979)journalofimmunology123,1548-1550)。按照标准程序(kohler等,(1975)nature256,495-497),将细胞在12个96孔组织培养板中与聚乙二醇1450(atcc)在hat选择培养基中融合。融合后10至21天,杂交瘤集落变得可见,收获培养物上清液,然后通过western印迹在strep-his-人-ap2/fabp4上筛选所述培养物上清液。使用涂有50μl/孔的2μg/ml溶液(0.1μg/孔)的strep-his-人-ap2/fabp4或不相关的gst-蛋白并在4℃下孵育过夜的高蛋白结合96孔eia板(costar/corning,inc.corning,ny)对17个选择的阳性孔进行二次筛选。通过有限稀释亚克隆阳性杂交瘤并通过elisa筛选。用isostrip试剂盒(rochediagnosticcorp.,indianapolis,in)对上清液融合物进行同种型分型。使用ucb专有的chosxe细胞系和电穿孔表达平台进行大规模瞬时转染。在37℃下在补充有8%co2的振荡培养箱(kuhnerag,birsfelden,switzerland)中,在补充有2mmglutamax的cdcho培养基(lifetech)中以140rpm将细胞维持在对数生长期。在转染之前,使用cedex细胞计数器(innovatisag.bielefeld,germany)测定细胞数和活力,并将2x108个细胞/ml以1400rpm离心10分钟。将沉淀的细胞在hyclonemaxcyte缓冲液(thermoscientific)中洗涤并再旋转10分钟,将沉淀物以2x108个细胞/ml重悬于新鲜缓冲液中。然后以400μg/ml加入用qiagenplasmidplusgiga纯化的质粒dna。使用maxcyte流式电穿孔仪器进行电穿孔后,将细胞转移到含有2mmglutamax和抗生素抗有丝分裂溶液的procho培养基(lonza)中,并在置于设置为37℃和5%co2的生物反应器平台上的波包(wavebag)(cellbag,gehealthcare)中培养,其中通过25rpm振荡诱导波动。转染后24小时,加入丸剂补料(bolusfeed)并将温度降至32℃并保持培养期的持续时间(12-14天)。在第4天,向培养物中加入3mm丁酸钠(正-丁酸钠盐,sigmab-5887)。在第14天,将培养物以4000rpm离心30分钟,并将保留的上清液通过0.22μmsartobran-p(millipore)过滤,然后用0.22μmgamma金过滤器过滤。通过添加nacl(至4m)来条件化表达小鼠单克隆抗体(mab)的chosxe收获物。将样品加载到用0.1m甘氨酸+4mnaclph8.5以15ml/min平衡的蛋白质amabselectsure填充柱(ge-healthcare)上。用0.1m甘氨酸+4mnaclph8.5洗涤样品,并用0.15mna2hpo4ph9进行另外的洗涤步骤。在使用0.1m柠檬酸钠ph3.4洗脱缓冲液从柱洗脱期间收集a280nm处的uv吸收峰,然后加入2mtris-hclph8.5中和至ph7.4。然后使用minisette切向流过滤装置将来自蛋白a的mab混合物浓缩至合适的体积,然后在hiloadxk50/60superdex200制备级凝胶过滤柱(ge-healthcare)上进一步纯化。然后通过分析型凝胶过滤技术对收集的级分分析单体峰,并将清洁的单体级分合并为终产物。然后通过还原和非还原sds-page以及分析型凝胶过滤对最终产物样品进行表征,以进行最终纯度检查。还使用用于内毒素测量的lal测定方法测试样品并且发现其对于内毒素为阴性。用于所有测试的mab的最终缓冲液是pbs。对于体内分析,将纯化的抗体在盐水中稀释至10mg/ml,并将所述抗体以1.5mg/小鼠(33mg/kg)的剂量注射到高脂肪饮食的ob/ob和wt小鼠中。抗体亲和力的测量使用biacoret200系统(gehealthcare),通过生物分子相互作用分析测定抗-ap2与ap2(如下所述在大肠杆菌中重组产生的)结合的亲和力。使用hbs-ep+(gehealthcare)作为运行缓冲液,通过胺偶联化学将10mmnaac,ph5缓冲液中的affinipuref(ab')2片段山羊抗小鼠igg(fc片段特异性的)(jacksonimmunoresearchlab,inc.)固定在cm5传感器芯片上至4500-6000个反应单位(ru)的捕获水平。在运行缓冲液中将抗ap2igg稀释至1-10μg/ml。将以10μl/分钟进行的抗ap2igg的60秒注射用于被固定的抗小鼠igg,fc捕获,然后以30μl/min持续180s在捕获的抗ap2上方将ap2从25nm滴定至3.13nm,然后进行300s解离。通过2x60s40mmhcl和1x30s5mmnaoh以10μl/min再生表面。使用biacoret200评估软件(1.0版),利用具有局部rmax的1:1结合模型分析数据。对于ca33,将以10μl/min进行的抗体的60s注射用于被固定的抗小鼠igg,fc捕获,然后以30μl/min持续180s在捕获的抗ap2上方将ap2从40nm滴定至0.625nm,然后进行300s解离。通过1x60s40mmhcl、1x30s5mmnaoh和1x60s40mmhcl以10μl/min再生表面。将稳态拟合用于确定亲和力值。抗体交叉阻断通过在小鼠抗-ap2igg存在或不存在的情况下注射小鼠ap2而在捕获的兔抗-ap2igg上进行测定。使用biacoret200(gehealthcarebio-sciencesab)进行生物分子相互作用分析。使用10μl/min的流速和60s注射,在固定的抗兔fc表面(每个流通池一种上清液)上捕获抗ap2兔igg瞬时上清液,以给出高于200ru的反应水平。然后将100nm、0nm的小鼠ap2或100nm的小鼠ap2加上500nm的小鼠抗-ap2igg通过120秒,然后进行120s解离。用2x60s40mmhcl和1x30s5mmnaoh再生表面。fabp交叉反应性将重组人蛋白ap2(在ucb于大肠杆菌中产生(参见下面的方法))、hfabp3(sinobiologicalinc.)和hfabp5/hmal1(sinobiologicalinc.)在5倍摩尔过量的ez-sulfo-nhs-lc-生物素(thermofisherscientific)中生物素化,使用zeba脱盐柱(thermofisherscientific)将其从未结合的生物素中纯化出来。所有结合研究使用fortébiooctetred384系统(pallfortébiocorp.)在25℃下进行。在含有0.05%tween20,ph7.4(pbs-t)的pbs中进行120s基线步骤后,将60nm的生物素化的重组hap2、hfabp3或hfabp5/hmal1加载到dip和readtm链霉抗生物素蛋白(sa)生物传感器(pallfortébiocorp.),持续90s。在pbs-t中进行60s稳定化步骤后,将每个加载有fabp的生物传感器转移至800nm的单克隆抗体样品,并测量缔合5min。然后将生物传感器转移回pbs-t进行5min以测量解离。使用未加载的生物传感器尖端监测抗体的非特异性结合。对于每种抗体/fabp组合,绘制最大缔合结合,即一旦信号已达到平台,则减去背景结合。ap2的表达和纯化经优化用于在大肠杆菌中表达的小鼠(或人)ap2cdna购自dna2.0(menlopark,california)并被直接亚克隆到含有框内n-末端10his-标签(后接烟草蚀刻病毒(tev)蛋白酶位点)的经修饰的pet28a载体(novagen)中。蛋白质在大肠杆菌菌株bl21de3中表达并如下纯化。通常,用冷却的细胞破碎剂(constantsystemsltd.)在50ml裂解缓冲液(含有20mm咪唑的pbs(ph7.4))/升大肠杆菌培养物(roche,burgesshill)中裂解细胞,所述培养物补充有完全蛋白酶抑制混合物片剂,不含edta。然后通过高速离心(60000g,30分钟,4℃)澄清裂解物。每100ml澄清的裂解物中加入4ml/ni-nta珠粒(qiagen),并在4℃下翻滚1小时。将珠子包装在连接至aktafplc(gelifesciences)的tri-corn柱(gehealthcare)中,并在含有250mm咪唑的缓冲液中洗脱蛋白质。将通过4-12%bis/trisnupage(lifetechnologiesltd.)凝胶电泳判断含有目标蛋白质的级分进行透析以除去咪唑,并用tev蛋白酶以1mg/100mg蛋白质的比例处理。在4℃孵育过夜后,将样品重新通过tri-corn柱中的ni/nta珠粒。未标记的(即tev切割的)ap2蛋白不与珠粒结合并在柱流过物中被收集。浓缩蛋白质,并将其加载到在pbs,1mmdtt中预平衡的s7526/60凝胶过滤柱(gehealthcare)上。合并峰值级分并浓缩至5mg/ml。然后提取6ml该蛋白质并用乙腈以2:1的比例沉淀以除去任何脂质。在以16,000g离心15分钟后,除去乙腈+缓冲液以用于分析原始脂质含量。然后将变性蛋白质沉淀重悬于6ml6mguhclpbs+2μmole棕榈酸(棕榈酸与ap2的比例为5:1)中,然后在4℃下用5lpbs透析2次,持续20小时,以允许重折叠。离心除去沉淀(16000g,15分钟)后,使用pbs中的s7526/20柱凝胶过滤蛋白质以除去聚集物。合并峰值级分并浓缩至13mg/ml。ap2晶体学如下将纯化的小鼠ap2与ca33和h3fab(在ucb通过常规方法产生的)复合。通过将0.5ml的13mg/ml的ap2与0.8ml的21.8mg/ml的ca33fab或1.26ml的13.6mg/ml的h3fab(ap2:fab摩尔比为1.2:1)混合来制备复合物。将蛋白质在室温下孵育30分钟,然后在50mmtrisph7.2,150mmnacl+5%甘油中的s7516/60凝胶过滤柱(gehealthcare)上运行。合并峰值级分并浓缩至10mg/ml以用于结晶。使用商购可得的筛选试剂盒(qiagen)建立了坐滴结晶试验。在初始晶化(primarycrystallization)筛选中直接获得衍射质量的晶体,而无需优化结晶条件。对于ap2/ca33复合物,孔溶液含有0.1mhepesph7.5,0.2m(nh4)2so4,16%peg4k和10%异丙醇。对于ap2/h3复合物,孔溶液含有0.1mmesph5.5,0.15m(nh4)2so4和24%peg4k。在i02上的金刚石同步加速器(λ=0.97949)上采集数据,得到ap2/ca33的数据集和ap2/h3的数据集。使用phaser(44)(ccp4),利用ap2和fab结构域起始模型通过分子置换确定结构。发现两种复合物在ap2/ca33的不对称单元中,一种在ap2/h3中。使用cns(brunger等,(2007)natureprotocols2,2728-2733)和coot(emsley等,(2004)actacrystallographica.sectiond,biologicalcrystallography60,2126-2132)(ccp4)进行精制和模型构建的循环直至两个模型的所有细化统计收敛。上述表位信息是通过考虑ap2/fab接触表面上距离内的原子得到的。数据收集和细化统计数据如下所示。括号中的值指的是高分辨率外壳(high-resolutionshell)。括号中的值是指高分辨率壳。rsym=σ|(i-<i>)|/σ(i),其中i是观察到的积分强度,<i>是从多次测量获得的平均积分强度,并且总和是对于所有观察到的反射。rwork=σ||fobs|-k|fcalc||/σ|fobs|,其中fobs和fcalc分别是观察到的和计算的结构因子。rfree使用随机选择的5%反射数据计算为rwork,并从细化计算中省略。通过考虑在ap2/fab接触表面处距离内的原子来得到表位信息。高胰岛素-正常血糖钳夹研究和肝脏生化测定通过改进报道的方法(cao等,(2013)cellmetab.17,768-778)进行高胰岛素-正常血糖钳夹。具体地,在禁食5小时后夹住小鼠并输注5mu/kg/min胰岛素。以10分钟的间隔收集血液样品以立即测量血浆葡萄糖浓度,并且以可变的速率输注25%葡萄糖以将血浆葡萄糖维持在基础浓度。通过连续输注[3-3h]-葡萄糖(0.05μci/min)估计基线全身葡萄糖处置。然后测定胰岛素刺激的全身葡萄糖处置,由此以0.1μci/min输注[3-3h]-葡萄糖。根据bligh-dyer方案(bligh等,(1959)canadianj.biochem.andphys.37,911-917)提取肝脏中的总脂质,并按照制造商的说明(sigmaaldrich)通过商业试剂盒使用用于测量甘油三酯含量的比色法。通过改进报道的方法(petrescu等,(1979)analyticalbiochem.96,279-281)测量糖异生酶pck1活性。通过改进sigma方案[ec3.1.3.9]测量葡萄糖-6-磷酸酶(g6pc)活性。简言之,将肝脏在含有250mm蔗糖,trishcl和edta的裂解缓冲液中匀浆。将裂解物全速离心15分钟,分离上清液(主要是细胞质)。然后通过超速离心细胞质样品分离微粒体级分。通过商业bca试剂盒(thermoscientificpierce)测量微粒体蛋白质浓度。将200mm葡萄糖-6-磷酸(sigmaaldrich)在bis-tris中预孵育。加入150μg微粒体蛋白或重组g6p酶的连续稀释液,并在37℃下在该溶液中孵育20分钟。然后加入20%tca,混合并在室温下孵育5分钟。将样品在4℃下全速离心10分钟,并将上清液转移到单独的uv板中。加入显色试剂并测量660nm处的吸光度,并针对用重组葡萄糖-6-磷酸酶(g6pc)的连续稀释液制备的标准曲线进行标准化。血浆ap2、mal1、fabp3、脂联素、胰高血糖素和胰岛素elisa在白天6小时的食物戒断或16小时的过夜食物戒断后通过尾部出血从小鼠收集血液。通过心脏穿刺收集末端血液样品或从尾静脉收集末端血液样品。将样品在微量离心机中以3,000rpm在4℃下旋转15分钟。按照制造商的说明书进行血浆ap2(biovendorr&d)、mal1(circulexmousemal1elisa,cyclexco.,ltd.,japan)、fabp3(hycultbiotech,plymouthmeeting,pa)胰高血糖素、脂联素(quantikineelisa,r&dsystems,minneapolis,mn)和胰岛素(胰岛素-小鼠超灵敏elisa,alpcodiagnostics,salem,nh)测量。定量实时pcr分析在6小时的白天食物戒断后收集组织,立即冷冻并在-80℃下储存。按照制造商的方案使用trizol(invitrogen,carlsbad,ca)进行rna分离。对于第一链cdna合成,使用0.5-1ngrna和5xiscriptrtsupermix(bioradlaboratories,herculus,ca)。使用powersybrgreenpcr预混合物(appliedbiosystems,lifetechnologies,grandisland,ny)进行定量实时pcr(q-pcr),并使用viia7pcr机(appliedbiosystems,lifetechnologies,grandisland,ny)分析样品。用于q-pcr的引物如下:统计分析结果表示为平均值±sem。通过重复测量anova或student'st检验确定统计学显著性。*表示p<0.05的显著性,**表示p<0.01的显著性。抗ap2/胰高血糖素/ap2蛋白复合物单克隆抗体的开发和筛选肥胖与循环ap2水平升高相关,所述循环ap2水平的升高促成肝葡萄糖产生的升高和降低的外周葡萄糖处置和胰岛素抵抗(2型糖尿病的特征)。因此,中和血清ap2或破坏胰高血糖素/ap2蛋白复合物激活胰高血糖素受体代表了治疗糖尿病和可能的其他代谢疾病的高效方法。产生并筛选针对人和小鼠ap2肽产生的小鼠和兔-小鼠杂合单克隆抗体。使用biacore系统通过生物分子相互作用分析评估结合亲和力证明了这些抗体从微摩尔浓度到低纳摩尔浓度范围的广泛亲和力(图9a)。有趣的是,ca33也显著降低空腹血糖(图9b),而所测试的另外抗体并未改善血糖。不希望受任何一种理论的束缚,这表明ca33降低了与hfd相关的胰岛素抗性并改善了葡萄糖代谢。使用葡萄糖耐量测试(gtt)进一步验证了葡萄糖代谢的系统性改善。ca33疗法导致葡萄糖耐量显著改善(图9c),而其他抗体没有改善葡萄糖耐量,并且与媒介物相比,葡萄糖处置曲线没有差异(图12a)。此外,如胰岛素耐量测试中所证明的,仅ca33治疗显著改善胰岛素敏感性,而测试的其他抗体与媒介物相似(图12b)。另外,向ap2敲除小鼠施用ap2和胰高血糖素挽救了胰高血糖素无应答性,而利用ca33与ap2的预孵育防止了这种情况(图12c和12d)。总之并且不希望受任何一种理论束缚,这些结果证明ca33独特地具有抗糖尿病特性。ca33是中和ap2/胰高血糖素/ap2蛋白复合物活性的低亲和力抗体进一步表征ca33以更好地了解其独特的治疗特性。在八分体结合测定中,所有测试的抗体显示出与ap2的可饱和结合。与相关蛋白质fabp3(约25%的ap2/fabp4相互作用)存在可测量但低的相互作用,并且与mal1/fabp5仅具有与对照igg相似的微小相互作用(图10a)。在开始表征靶位点的交叉阻断实验中,我们发现ca33部分阻断无效小鼠抗体h3与ap2的结合,而h3结合被杂合抗体ca13和ca15完全阻断(图10b)。在进一步分析中,基于氢-氘交换质谱实验的表位鉴定(例如,如pandit等,(2012)j.mol.recognit.mar;25(3):114-24(通过引用并入本文)所述)表明ca33与ap2的第一α螺旋和第一β折叠的相互作用在残基9-14、20-28和118-132上,所述残基与针对h3鉴定的表位部分重叠(图10c)。然后进行ca33和h3的fab片段与ap2的共结晶(图10d)。对晶体的分析表明,ca33结合在二级结构元件β1和β10上展开的表位以及将α2与β2连接以及将β3与β4连接的无规卷曲区域,并包括ap2氨基酸57t、38k、11l、12v、10k和130e(图10e)。尽管ca33部分阻断了h3,但我们观察到实际上它们的表位没有直接重叠。相反,在竞争实验中,围绕ap2phe58的区域的显著运动可以部分阻断一种抗体与另一种抗体的结合。另外,ca33fab的低亲和力可以通过晶体结构来解释。不同寻常的是,ca33重链中只有一个氨基酸与ap2接触,并且大多数接触是通过轻链(图10d和10e)。相反,h3-ap2接触更常规,两条fab链与ap2相互作用。该结构还显示ca33不与β-桶的“盖子”(14s至37a)结合,所述“盖子”已被假定为控制脂质进入结合袋或含有e15、n16和e17的“铰链”。kl外,发现脂质(香叶酸)与ap2的结合基本上未被ca33的存在改变(图10f)。h3确实直接与'盖子'结合但活性有限。还使用生化分析(biacore)检查ca33与脂质结合的ap2或无脂质ap2的结合。ca33以以下亲和力与脂质结合的ap2和无脂质的ap2结合:小鼠ap2kd加载脂质的9.3μm去脂质的4.7μm另外,将抗小鼠iggspa珠粒与来自野生型或ap2敲除小鼠的血清和125i胰高血糖素一起孵育,这显示ap2在生理学相关条件/动物血清中与125i胰高血糖素相互作用(图10g和10h)。不希望受任何一种理论束缚,这些结果表明ca33活性可能与ap2脂质结合无关。鉴于ca33对ap2的亲和力相对较低,检查了脱靶效应。测试了喂食hfd的ap2-/-小鼠中ca33处理的效果。在这些实验中,抗体疗法未能在该模型中诱导体重或空腹葡萄糖的任何变化(图11a)。此外,ca33不影响肥胖ap2-/-小鼠的葡萄糖耐量(图11b),清楚地证明抗体的作用是由于靶向ap2。最后,检测了ca33在使用瘦素缺乏ob/ob小鼠的严重遗传性肥胖和胰岛素抵抗的第二模型中的作用。引人注目的是,与对照相比,在ca33处理的小鼠中ob/ob小鼠中的高血糖得以正常化(图11c)。正常葡萄糖和较低的胰岛素水平表明在中和ap2后改善的葡萄糖代谢。实际上,在施用外源葡萄糖后,尽管存在大量肥胖,但ca33处理的ob/ob小鼠与媒介物处理的小鼠相比也显示出显著改善的葡萄糖耐受性(图11d)。还显示ca33处理在3周的处理后使ob/ob小鼠中的胰高血糖素响应变钝(图11e和11f)并通过阻止胰高血糖素的作用来模拟ap2缺乏。实施例3:ca33的人源化通过将来自兔cdr/小鼠框架杂合抗体v区cdr的cdr移植到人种系抗体v区框架上来人源化兔抗体909(ca33)。为了恢复抗体的活性,来自兔/小鼠杂合v区的许多框架残基也保留在人源化序列中。使用adair等(1991)(humanizedantibodies.wo91/09967)概述的方案选择这些残基。兔/小鼠杂合抗体(供体)v区序列与人种系(受体)v区序列的比对与设计的人源化序列一起显示在图13(vl)和图14a(vh)中。从供体移植到受体序列的cdr是如由kabat(kabat等,1987)所定义的,但其中使用组合的chothia/kabat定义(参见adair等,1991humanisedantibodies.wo91/09967)的cdrh1除外。编码许多变体重链和轻链v区序列的基因通过dna2.0inc.的自动化合成方法设计和构建。通过寡核苷酸定向诱变修饰vh和vk基因产生重链和轻链v区的另外变体,在某些情况下包括cdr内的突变以修饰潜在的天冬氨酸异构化位点或去除未配对的半胱氨酸残基。将这些基因克隆到载体中,使得能够在哺乳动物细胞中表达人源化的909igg4p(含有铰链稳定化突变s241p的人igg4,angal等,molimmunol.1993,30(1):105-8)抗体。表达变体人源化抗体链及其组合,并评估它们相对于亲本抗体的效力、它们的生物物理特性和对下游加工的适合性,从而导致重链和轻链移植物的选择。选择人v区igkv1-17(a30)加jk4j区作为抗体909轻链cdr的受体。除其中分别保留供体残基缬氨酸(2v)、缬氨酸(3v)、赖氨酸(63k)和天冬氨酸(70d)的残基2、3、63和70(kabat编号)外,移植物gl1(seq.idno.29)、gl10(seq.idno.31)、gl54(seq.idno.33)和gl55(seq.idno.35)中的轻链框架残基均来自人种系基因。保留残基2、3、63和70的保留对于人源化抗体的完全效力是必需的。将gl10移植物、gl54移植物和gl55移植物的cdrl3中的残基90分别从半胱氨酸(90)突变为丝氨酸(90s)、谷氨酰胺(90q)和组氨酸(h90)残基,从而从gl10、gl54和gl55序列除去未配对的半胱氨酸残基。选择人v区ighv4-4加jh4j区作为抗体909的重链cdr的受体。与许多兔抗体一样,抗体909的vh基因比选择的人受体短。当与人受体序列比对时,来自抗体909的vh区的框架1(seq.idno.41)缺少n-末端残基,所述n-末端残基保留在人源化抗体中(图14a)。909兔vh区的框架3在β折叠链d和e之间的环中也缺少两个残基(75和76):在移植物gh1(seq.idno.42)中,框架3中的缺口是保守的,而在移植物gh14(seq.idno.44)、gh15(seq.idno.46)、gh61(seq.idno.48)和gh62(seq.idno.50)中,缺口充满来自选择的人受体序列的相应残基(赖氨酸75,75k;天冬酰胺76,76n)(图14a)。除其中分别保留供体残基苏氨酸(23t)、苯丙氨酸(67f)、赖氨酸(71k)、丙氨酸(72a)、丝氨酸(73s)、苏氨酸(74t)、苏氨酸(77t)、缬氨酸(78v)、天冬氨酸(79d)、苏氨酸分别保留(89t)和苯丙氨酸(91f)的残基23、67、71、72、73、74、77、78、79、89和91(kabat编号)外,移植物gh1和gh15中的重链框架残基均来自人种系基因。除其中分别保留供体残基苏氨酸(23t)、苯丙氨酸(67f)、赖氨酸(71k)、丙氨酸(72a)、丝氨酸(73s)、苏氨酸(74t)、苏氨酸(77t)、缬氨酸(78v)、天冬氨酸(79d)、苏氨酸(89t)和苯丙氨酸(91f)的残基67、71、72、73、74、77、78、79、89和91(kabat编号)外,移植物gh14中的重链框架残基来自人种系基因。除其中分别保留供体残基赖氨酸(71k)、丝氨酸(73s)和缬氨酸(78v)的残基71、73和78(kabat编号)外,移植物gh61和gh62中的重链框架残基来自人种系基因。将人框架的位置1处的谷氨酰胺残基用谷氨酸(1e)置换,得到均质产物的表达和纯化:广泛报道了在抗体和抗体片段的n-末端处谷氨酰胺向焦谷氨酸的转化。将gh15移植物和gh62移植物的cdrh2(seq.idno.19)中的残基59从半胱氨酸(59c)突变为丝氨酸(59s)残基,从而从gh15序列中除去未配对的半胱氨酸残基。将移植物gh15和移植物gh62的cdrh3(seq.idno.20)中的残基98从天冬氨酸(98d)突变为谷氨酸(98e)残基,从而从gh15序列中除去潜在的天冬氨酸异构化位点。为了在哺乳动物细胞中表达人源化ab909,将人源化轻链v区基因与编码人c-κ恒定区(k1m3同种异型)的dna序列连接,以产生连续的轻链基因。利用铰链稳定化突变s241p将人源化重链v区基因与编码人γ-4重链恒定区的dna序列连接(angal等,molimmunol.1993,30(1):105-8),以产生连续的重链基因。将重链和轻链基因克隆到哺乳动物表达载体1235-pgl3a(1)-srha(3)-srla(3)-dhfr(3)(cellcagmbh)中。为了进一步检查受抗ap2抗体抑制影响的下游信号传导事件,使用在cho-k1细胞中构建的表达camp报道系统的人胰高血糖素受体。图14b显示ap2抑制对荧光素酶活性的影响,在刺激后4小时在用人gcgr-gfp和4xcamp-应答元件稳定转染的并在1ug/mlap2、25nm胰高血糖素以及20ug/ml的ca33和ca15存在的情况下刺激的cho-k1中测定所述荧光素酶活性。图14c显示在ap2中将半胱氨酸残基突变为丝氨酸不影响荧光素酶活性,表明图14b中所见的效果不是由于半胱氨酸诱导的二聚化引起的。实施例4:ap2中和对胰高血糖素反应的体内作用循环ap2的中和导致饮食诱导的肥胖小鼠中胰高血糖素作用的降低。在实验前给小鼠喂食高脂肪饮食20周。从第20周开始,以33mg/kg的剂量每周2次向小鼠i.p.注射媒介物或抗ap2mab,持续3周。在三周结束时,进行胰高血糖素激发试验,其中在白天禁食4小时后给小鼠注射150μg/kg胰高血糖素。经抗ap2mab处理的小鼠对胰高血糖素注射的反应显著低于经媒介物处理的小鼠(图15)。因此,中和循环ap2是降低胰高血糖素活性的有效方法。实施例5:ca33能够结合胰高血糖素/ap2复合物使用blitz仪器(palllifesciences,menlopark,ca)进行结合亲和力研究。将生物素化的ap2连接至链霉抗生物素蛋白探针。然后在胰高血糖素、单克隆抗体(mab)(ca33)或胰高血糖素加mab的溶液中测试栓系的ap2的结合亲和力(图16)。胰高血糖素本身表现出与ap2的结合,并且单克隆抗体显示出与胰高血糖素/ap2复合物的强结合。不希望受任何一种理论的束缚,有可能该单克隆抗体与胰高血糖素/ap2复合物的结合是单克隆抗体的抗糖尿病作用和降低胰高血糖素作用的能力的关键要素。实施例6.胰高血糖素处理改善ap2内化在暴露于ap2处理或ap2+胰高血糖素处理后,对用gcgr-gfp转染的u2-os细胞进行活细胞成像。如图17a和图17b所示,当细胞未用胰高血糖素处理时,观察到ap2至细胞中的最小内化。但当用胰高血糖素刺激细胞时(图17c-17e),ap2的内化大大增加。gcgr-gfp信号和ap2信号的共定位在照片中以白色显示。实施例7.ap2缺乏与胰高血糖素受体拮抗作用不同胰高血糖素受体拮抗作用的区别特征是α细胞增生,但ap2缺乏不引起α细胞增生,如图17f-17j所示。来自ap2+/+细胞系与ap2-/-细胞系的细胞的显微镜图像以及如以像素测量的来自ap2+/+细胞系与ap2-/-细胞系的细胞的胰岛面积没有显著不同。当对胰高血糖素染色时,两种细胞系的图像也没有显著差异。两个细胞的图像显示在图17i(ap2+/+细胞系)和图17j(ap2-/-细胞系)中。已经参考本发明的实施方案描述了该说明书。然而,本领域普通技术人员认识到,在不脱离如下面的权利要求所阐述的本发明的范围的情况下,可以进行各种修改和改变。因此,本说明书应被视为说明性而非限制性意义,并且所有这些修改旨在包括在本发明的范围内。序列表<110>presidentandfellowsofharvarduniversity<120>可用于治疗代谢病症的化合物<130>15020-017wo1<160>82<170>patentinversion3.5<210>1<211>132<212>prt<213>人(homosapiens)<400>1metcysaspalaphevalglythrtrplysleuvalsersergluasn151015pheaspasptyrmetlysgluvalglyvalglyphealathrarglys202530valalaglymetalalysproasnmetileileservalasnglyasp354045valilethrilelyssergluserthrphelysasnthrgluileser505560pheileleuglyglnglupheaspgluvalthralaaspasparglys65707580vallysserthrilethrleuaspglyglyvalleuvalhisvalgln859095lystrpaspglylysserthrthrilelysarglysarggluaspasp100105110lysleuvalvalglucysvalmetlysglyvalthrserthrargval115120125tyrgluargala130<210>2<211>132<212>prt<213>小鼠(musmusculus)<400>2metcysaspalaphevalglythrtrplysleuvalsersergluasn151015pheaspasptyrmetlysgluvalglyvalglyphealathrarglys202530valalaglymetalalysproasnmetileileservalasnglyasp354045leuvalthrileargsergluserthrphelysasnthrgluileser505560phelysleuglyvalglupheaspgluilethralaaspasparglys65707580vallysserileilethrleuaspglyglyalaleuvalglnvalgln859095lystrpaspglylysserthrthrilelysarglysargaspglyasp100105110lysleuvalvalglucysvalmetlysglyvalthrserthrargval115120125tyrgluargala130<210>3<211>11<212>prt<213>人<400>3lysgluvalglyvalglyphealathrarglys1510<210>4<211>3<212>prt<213>人工序列<220><223>ap2脂肪酸结合结构域氨基酸序列<400>4argvaltyr1<210>5<211>399<212>dna<213>人<400>5atgtgtgatgcttttgtaggtacctggaaacttgtctccagtgaaaactttgatgattat60atgaaagaagtaggagtgggctttgccaccaggaaagtggctggcatggccaaacctaac120atgatcatcagtgtgaatggggatgtgatcaccattaaatctgaaagtacctttaaaaat180actgagatttccttcatactgggccaggaatttgacgaagtcactgcagatgacaggaaa240gtcaagagcaccataaccttagatgggggtgtcctggtacatgtgcagaaatgggatgga300aaatcaaccaccataaagagaaaacgagaggatgataaactggtggtggaatgcgtcatg360aaaggcgtcacttccacgagagtttatgagagagcataa399<210>6<211>399<212>dna<213>小鼠<400>6atgtgtgatgcctttgtgggaacctggaagcttgtctccagtgaaaacttcgatgattac60atgaaagaagtgggagtgggctttgccacaaggaaagtggcaggcatggccaagcccaac120atgatcatcagcgtaaatggggatttggtcaccatccggtcagagagtacttttaaaaac180accgagatttccttcaaactgggcgtggaattcgatgaaatcaccgcagacgacaggaag240gtgaagagcatcataaccctagatggcggggccctggtgcaggtgcagaagtgggatgga300aagtcgaccacaataaagagaaaacgagatggtgacaagctggtggtggaatgtgttatg360aaaggcgtgacttccacaagagtttatgaaagggcatga399<210>7<211>11<212>prt<213>人工序列<220><223>cdrl1<400>7glnalasergluaspileserargtyrleuval1510<210>8<211>7<212>prt<213>人工序列<220><223>cdrl2<400>8lysalaserthrleualaser15<210>9<211>14<212>prt<213>人工序列<220><223>cdrl3<400>9glncysthrtyrglythrtyralaglyserphephetyrser1510<210>10<211>14<212>prt<213>人工序列<220><223>cdrl3变体1<400>10glnalathrtyrglythrtyralaglyserphephetyrser1510<210>11<211>14<212>prt<213>人工序列<220><223>cdrl3变体2<400>11glnglnthrtyrglythrtyralaglyserphephetyrser1510<210>12<211>14<212>prt<213>人工序列<220><223>cdrl3变体3<400>12glnhisthrtyrglythrtyralaglyserphephetyrser1510<210>13<211>9<212>prt<213>人工序列<220><223>cdrl3变体4<400>13glnglnalaserhistyrproleuthr15<210>14<211>10<212>prt<213>人工序列<220><223>cdrh1<400>14glypheserleuserthrtyrtyrmetser1510<210>15<211>10<212>prt<213>人工序列<220><223>cdrh1变体1<400>15glytyrthrphethrserasnalailethr1510<210>16<211>16<212>prt<213>人工序列<220><223>cdrh2<400>16ileiletyrproserglyserthrtyrcysalasertrpalalysgly151015<210>17<211>16<212>prt<213>人工序列<220><223>cdrh2变体1<400>17ileiletyrproserglyserthrtyrseralasertrpalalysgly151015<210>18<211>17<212>prt<213>人工序列<220><223>cdrh2变体2<400>18aspileserproglyserglyserthrthrasnasnglulysphelys151015ser<210>19<211>15<212>prt<213>人工序列<220><223>cdrh3<400>19proaspasnaspglythrserglytyrleuserglypheglyleu151015<210>20<211>15<212>prt<213>人工序列<220><223>cdrh3变体1<400>20proaspasngluglythrserglytyrleuserglypheglyleu151015<210>21<211>10<212>prt<213>人工序列<220><223>cdrh3变体2<400>21leuargglyphetyrasptyrpheaspphe1510<210>22<211>12<212>prt<213>人工序列<220><223>cdrl1变体1<400>22servalserserserileserserserasnleuhis1510<210>23<211>7<212>prt<213>人工序列<220><223>cdrl2变体1<400>23glythrserasnleualaser15<210>24<211>9<212>prt<213>人工序列<220><223>cdrl3变体5<400>24glnglntrpserhistyrproleuthr15<210>25<211>10<212>prt<213>人工序列<220><223>cdrh1变体2<400>25glytyrthrphethrserasntrpilethr1510<210>26<211>17<212>prt<213>人工序列<220><223>cdrh2变体3<400>26aspiletyrproglyserglyserthrthrasnasnglulysphelys151015ser<210>27<211>10<212>prt<213>人工序列<220><223>cdrh3变体3<400>27leuargglytyrtyrasptyrpheaspphe1510<210>28<211>112<212>prt<213>人工序列<220><223>兔ab909vl-区<400>28aspvalvalmetthrglnthrproalaservalsergluprovalgly151015glythrvalthrilelyscysglnalasergluaspileserargtyr202530leuvaltrptyrglnglnlysproglyglnproprolysargleuile354045tyrlysalaserthrleualaserglyvalproserargphelysgly505560serglyserglythraspphethrleuthrileseraspleuglucys65707580aspaspalaalathrtyrtyrcysglncysthrtyrglythrtyrala859095glyserphephetyrserpheglyglyglythrgluvalvalvalglu100105110<210>29<211>112<212>prt<213>人工序列<220><223>909gl1vl-区<400>29aspvalvalmetthrglnserproserserleuseralaservalgly151015aspargvalthrilethrcysglnalasergluaspileserargtyr202530leuvaltrptyrglnglnlysproglylysalaprolysargleuile354045tyrlysalaserthrleualaserglyvalproserargphelysgly505560serglyserglythraspphethrleuthrileserserleuglnpro65707580gluaspphealathrtyrtyrcysglncysthrtyrglythrtyrala859095glyserphephetyrserpheglyglyglythrlysvalgluilelys100105110<210>30<211>219<212>prt<213>人工序列<220><223>909gl1vl+cl-区<400>30aspvalvalmetthrglnserproserserleuseralaservalgly151015aspargvalthrilethrcysglnalasergluaspileserargtyr202530leuvaltrptyrglnglnlysproglylysalaprolysargleuile354045tyrlysalaserthrleualaserglyvalproserargphelysgly505560serglyserglythraspphethrleuthrileserserleuglnpro65707580gluaspphealathrtyrtyrcysglncysthrtyrglythrtyrala859095glyserphephetyrserpheglyglyglythrlysvalgluilelys100105110argthrvalalaalaproservalpheilepheproproseraspglu115120125glnleulysserglythralaservalvalcysleuleuasnasnphe130135140tyrproargglualalysvalglntrplysvalaspasnalaleugln145150155160serglyasnserglngluservalthrgluglnaspserlysaspser165170175thrtyrserleuserserthrleuthrleuserlysalaasptyrglu180185190lyshislysvaltyralacysgluvalthrhisglnglyleuserser195200205provalthrlysserpheasnargglyglucys210215<210>31<211>112<212>prt<213>人工序列<220><223>909gl10vl-区<400>31aspvalvalmetthrglnserproserserleuseralaservalgly151015aspargvalthrilethrcysglnalasergluaspileserargtyr202530leuvaltrptyrglnglnlysproglylysalaprolysargleuile354045tyrlysalaserthrleualaserglyvalproserargphelysgly505560serglyserglythraspphethrleuthrileserserleuglnpro65707580gluaspphealathrtyrtyrcysglnalathrtyrglythrtyrala859095glyserphephetyrserpheglyglyglythrlysvalgluilelys100105110<210>32<211>219<212>prt<213>人工序列<220><223>909gl10vl+cl-区<400>32aspvalvalmetthrglnserproserserleuseralaservalgly151015aspargvalthrilethrcysglnalasergluaspileserargtyr202530leuvaltrptyrglnglnlysproglylysalaprolysargleuile354045tyrlysalaserthrleualaserglyvalproserargphelysgly505560serglyserglythraspphethrleuthrileserserleuglnpro65707580gluaspphealathrtyrtyrcysglnalathrtyrglythrtyrala859095glyserphephetyrserpheglyglyglythrlysvalgluilelys100105110argthrvalalaalaproservalpheilepheproproseraspglu115120125glnleulysserglythralaservalvalcysleuleuasnasnphe130135140tyrproargglualalysvalglntrplysvalaspasnalaleugln145150155160serglyasnserglngluservalthrgluglnaspserlysaspser165170175thrtyrserleuserserthrleuthrleuserlysalaasptyrglu180185190lyshislysvaltyralacysgluvalthrhisglnglyleuserser195200205provalthrlysserpheasnargglyglucys210215<210>33<211>112<212>prt<213>人工序列<220><223>909gl54vl-区<400>33aspvalvalmetthrglnserproserserleuseralaservalgly151015aspargvalthrilethrcysglnalasergluaspileserargtyr202530leuvaltrptyrglnglnlysproglylysalaprolysargleuile354045tyrlysalaserthrleualaserglyvalproserargphelysgly505560serglyserglythraspphethrleuthrileserserleuglnpro65707580gluaspphealathrtyrtyrcysglnglnthrtyrglythrtyrala859095glyserphephetyrserpheglyglyglythrlysvalgluilelys100105110<210>34<211>219<212>prt<213>人工序列<220><223>909gl54vl+cl-区<400>34aspvalvalmetthrglnserproserserleuseralaservalgly151015aspargvalthrilethrcysglnalasergluaspileserargtyr202530leuvaltrptyrglnglnlysproglylysalaprolysargleuile354045tyrlysalaserthrleualaserglyvalproserargphelysgly505560serglyserglythraspphethrleuthrileserserleuglnpro65707580gluaspphealathrtyrtyrcysglnglnthrtyrglythrtyrala859095glyserphephetyrserpheglyglyglythrlysvalgluilelys100105110argthrvalalaalaproservalpheilepheproproseraspglu115120125glnleulysserglythralaservalvalcysleuleuasnasnphe130135140tyrproargglualalysvalglntrplysvalaspasnalaleugln145150155160serglyasnserglngluservalthrgluglnaspserlysaspser165170175thrtyrserleuserserthrleuthrleuserlysalaasptyrglu180185190lyshislysvaltyralacysgluvalthrhisglnglyleuserser195200205provalthrlysserpheasnargglyglucys210215<210>35<211>112<212>prt<213>人工序列<220><223>909gl55vl-区<400>35aspvalvalmetthrglnserproserserleuseralaservalgly151015aspargvalthrilethrcysglnalasergluaspileserargtyr202530leuvaltrptyrglnglnlysproglylysalaprolysargleuile354045tyrlysalaserthrleualaserglyvalproserargphelysgly505560serglyserglythraspphethrleuthrileserserleuglnpro65707580gluaspphealathrtyrtyrcysglnhisthrtyrglythrtyrala859095glyserphephetyrserpheglyglyglythrlysvalgluilelys100105110<210>36<211>219<212>prt<213>人工序列<220><223>909gl55vl+cl-区<400>36aspvalvalmetthrglnserproserserleuseralaservalgly151015aspargvalthrilethrcysglnalasergluaspileserargtyr202530leuvaltrptyrglnglnlysproglylysalaprolysargleuile354045tyrlysalaserthrleualaserglyvalproserargphelysgly505560serglyserglythraspphethrleuthrileserserleuglnpro65707580gluaspphealathrtyrtyrcysglnhisthrtyrglythrtyrala859095glyserphephetyrserpheglyglyglythrlysvalgluilelys100105110argthrvalalaalaproservalpheilepheproproseraspglu115120125glnleulysserglythralaservalvalcysleuleuasnasnphe130135140tyrproargglualalysvalglntrplysvalaspasnalaleugln145150155160serglyasnserglngluservalthrgluglnaspserlysaspser165170175thrtyrserleuserserthrleuthrleuserlysalaasptyrglu180185190lyshislysvaltyralacysgluvalthrhisglnglyleuserser195200205provalthrlysserpheasnargglyglucys210215<210>37<211>112<212>prt<213>人工序列<220><223>909gl13vl-区<400>37aspileglnmetthrglnserproserserleuseralaservalgly151015aspargvalthrilethrcysglnalasergluaspileserargtyr202530leuvaltrptyrglnglnlysproglylysalaprolysargleuile354045tyrlysalaserthrleualaserglyvalproserargphesergly505560serglyserglythrgluphethrleuthrileserserleuglnpro65707580gluaspphealathrtyrtyrcysglnalathrtyrglythrtyrala859095glyserphephetyrserpheglyglyglythrlysvalgluilelys100105110<210>38<211>219<212>prt<213>人工序列<220><223>909gl13vl+cl-区<400>38aspileglnmetthrglnserproserserleuseralaservalgly151015aspargvalthrilethrcysglnalasergluaspileserargtyr202530leuvaltrptyrglnglnlysproglylysalaprolysargleuile354045tyrlysalaserthrleualaserglyvalproserargphesergly505560serglyserglythrgluphethrleuthrileserserleuglnpro65707580gluaspphealathrtyrtyrcysglnalathrtyrglythrtyrala859095glyserphephetyrserpheglyglyglythrlysvalgluilelys100105110argthrvalalaalaproservalpheilepheproproseraspglu115120125glnleulysserglythralaservalvalcysleuleuasnasnphe130135140tyrproargglualalysvalglntrplysvalaspasnalaleugln145150155160serglyasnserglngluservalthrgluglnaspserlysaspser165170175thrtyrserleuserserthrleuthrleuserlysalaasptyrglu180185190lyshislysvaltyralacysgluvalthrhisglnglyleuserser195200205provalthrlysserpheasnargglyglucys210215<210>39<211>112<212>prt<213>人工序列<220><223>909gl50vl-区<400>39aspvalvalmetthrglnserproserserleuseralaservalgly151015aspargvalthrilethrcysglnalasergluaspileserargtyr202530leuvaltrptyrglnglnlysproglylysalaprolysargleuile354045tyrlysalaserthrleualaserglyvalproserargphelysgly505560serglyserglythraspphethrleuthrileserserleuglnpro65707580gluaspphealathrtyrtyralaglnalathrtyrglythrtyrala859095glyserphephetyrserpheglyglyglythrlysvalgluilelys100105110<210>40<211>219<212>prt<213>人工序列<220><223>909gl50vl+cl-区<400>40aspvalvalmetthrglnserproserserleuseralaservalgly151015aspargvalthrilethrcysglnalasergluaspileserargtyr202530leuvaltrptyrglnglnlysproglylysalaprolysargleuile354045tyrlysalaserthrleualaserglyvalproserargphelysgly505560serglyserglythraspphethrleuthrileserserleuglnpro65707580gluaspphealathrtyrtyralaglnalathrtyrglythrtyrala859095glyserphephetyrserpheglyglyglythrlysvalgluilelys100105110argthrvalalaalaproservalpheilepheproproseraspglu115120125glnleulysserglythralaservalvalcysleuleuasnasnphe130135140tyrproargglualalysvalglntrplysvalaspasnalaleugln145150155160serglyasnserglngluservalthrgluglnaspserlysaspser165170175thrtyrserleuserserthrleuthrleuserlysalaasptyrglu180185190lyshislysvaltyralacysgluvalthrhisglnglyleuserser195200205provalthrlysserpheasnargglyglucys210215<210>41<211>120<212>prt<213>人工序列<220><223>兔ab909vh区<400>41glnservalglugluserglyglyargleuvalthrproglythrpro151015leuthrleuthrcysthrvalserglypheserleuserthrtyrtyr202530metsertrpvalargglnalaproglylysglyleuglutrpilegly354045ileiletyrproserglyserthrtyrcysalasertrpalalysgly505560argphethrileserlysalaserthrthrvalaspleulysilethr65707580serprothrthrgluaspthralathrtyrphecysalaargproasp859095asnaspglythrserglytyrleuserglypheglyleutrpglygln100105110glythrleuvalthrvalserser115120<210>42<211>121<212>prt<213>人工序列<220><223>909gh1vh区<400>42gluvalglnleuglngluserglyproglyleuvallysprosergly151015thrleuserleuthrcysthrvalserglypheserleuserthrtyr202530tyrmetsertrpvalargglnproproglylysglyleuglutrpile354045glyileiletyrproserglyserthrtyrcysalasertrpalalys505560glyargphethrileserlysalaserthrthrvalaspleulysleu65707580serservalthralaalaaspthralathrtyrphecysalaargpro859095aspasnaspglythrserglytyrleuserglypheglyleutrpgly100105110glnglythrleuvalthrvalserser115120<210>43<211>448<212>prt<213>人工序列<220><223>909gh1igg4vh+人?-4p恒定区<400>43gluvalglnleuglngluserglyproglyleuvallysprosergly151015thrleuserleuthrcysthrvalserglypheserleuserthrtyr202530tyrmetsertrpvalargglnproproglylysglyleuglutrpile354045glyileiletyrproserglyserthrtyrcysalasertrpalalys505560glyargphethrileserlysalaserthrthrvalaspleulysleu65707580serservalthralaalaaspthralathrtyrphecysalaargpro859095aspasnaspglythrserglytyrleuserglypheglyleutrpgly100105110glnglythrleuvalthrvalserseralaserthrlysglyproser115120125valpheproleualaprocysserargserthrsergluserthrala130135140alaleuglycysleuvallysasptyrpheprogluprovalthrval145150155160sertrpasnserglyalaleuthrserglyvalhisthrpheproala165170175valleuglnserserglyleutyrserleuserservalvalthrval180185190proserserserleuglythrlysthrtyrthrcysasnvalasphis195200205lysproserasnthrlysvalasplysargvalgluserlystyrgly210215220proprocysproprocysproalaproglupheleuglyglyproser225230235240valpheleupheproprolysprolysaspthrleumetileserarg245250255thrprogluvalthrcysvalvalvalaspvalserglngluasppro260265270gluvalglnpheasntrptyrvalaspglyvalgluvalhisasnala275280285lysthrlysproargglugluglnpheasnserthrtyrargvalval290295300servalleuthrvalleuhisglnasptrpleuasnglylysglutyr305310315320lyscyslysvalserasnlysglyleuproserserileglulysthr325330335ileserlysalalysglyglnproarggluproglnvaltyrthrleu340345350proproserglngluglumetthrlysasnglnvalserleuthrcys355360365leuvallysglyphetyrproseraspilealavalglutrpgluser370375380asnglyglnprogluasnasntyrlysthrthrproprovalleuasp385390395400seraspglyserphepheleutyrserargleuthrvalasplysser405410415argtrpglngluglyasnvalphesercysservalmethisgluala420425430leuhisasnhistyrthrglnlysserleuserleuserleuglylys435440445<210>44<211>123<212>prt<213>人工序列<220><223>909gh14vh区<400>44gluvalglnleuglngluserglyproglyleuvallysprosergly151015thrleuserleuthrcysalavalserglypheserleuserthrtyr202530tyrmetsertrpvalargglnproproglylysglyleuglutrpile354045glyileiletyrproserglyserthrtyrcysalasertrpalalys505560glyargphethrileserlysalaserthrlysasnthrvalaspleu65707580lysleuserservalthralaalaaspthralathrtyrphecysala859095argproaspasnaspglythrserglytyrleuserglypheglyleu100105110trpglyglnglythrleuvalthrvalserser115120<210>45<211>450<212>prt<213>人工序列<220><223>909gh14igg4vh+人?-4p恒定区<400>45gluvalglnleuglngluserglyproglyleuvallysprosergly151015thrleuserleuthrcysalavalserglypheserleuserthrtyr202530tyrmetsertrpvalargglnproproglylysglyleuglutrpile354045glyileiletyrproserglyserthrtyrcysalasertrpalalys505560glyargphethrileserlysalaserthrlysasnthrvalaspleu65707580lysleuserservalthralaalaaspthralathrtyrphecysala859095argproaspasnaspglythrserglytyrleuserglypheglyleu100105110trpglyglnglythrleuvalthrvalserseralaserthrlysgly115120125proservalpheproleualaprocysserargserthrsergluser130135140thralaalaleuglycysleuvallysasptyrpheprogluproval145150155160thrvalsertrpasnserglyalaleuthrserglyvalhisthrphe165170175proalavalleuglnserserglyleutyrserleuserservalval180185190thrvalproserserserleuglythrlysthrtyrthrcysasnval195200205asphislysproserasnthrlysvalasplysargvalgluserlys210215220tyrglyproprocysproprocysproalaproglupheleuglygly225230235240proservalpheleupheproprolysprolysaspthrleumetile245250255serargthrprogluvalthrcysvalvalvalaspvalserglnglu260265270aspprogluvalglnpheasntrptyrvalaspglyvalgluvalhis275280285asnalalysthrlysproargglugluglnpheasnserthrtyrarg290295300valvalservalleuthrvalleuhisglnasptrpleuasnglylys305310315320glutyrlyscyslysvalserasnlysglyleuproserserileglu325330335lysthrileserlysalalysglyglnproarggluproglnvaltyr340345350thrleuproproserglngluglumetthrlysasnglnvalserleu355360365thrcysleuvallysglyphetyrproseraspilealavalglutrp370375380gluserasnglyglnprogluasnasntyrlysthrthrproproval385390395400leuaspseraspglyserphepheleutyrserargleuthrvalasp405410415lysserargtrpglngluglyasnvalphesercysservalmethis420425430glualaleuhisasnhistyrthrglnlysserleuserleuserleu435440445glylys450<210>46<211>123<212>prt<213>人工序列<220><223>909gh15vh区<400>46gluvalglnleuglngluserglyproglyleuvallysprosergly151015thrleuserleuthrcysthrvalserglypheserleuserthrtyr202530tyrmetsertrpvalargglnproproglylysglyleuglutrpile354045glyileiletyrproserglyserthrtyrseralasertrpalalys505560glyargphethrileserlysalaserthrlysasnthrvalaspleu65707580lysleuserservalthralaalaaspthralathrtyrphecysala859095argproaspasngluglythrserglytyrleuserglypheglyleu100105110trpglyglnglythrleuvalthrvalserser115120<210>47<211>450<212>prt<213>人工序列<220><223>909gh15igg4vh+人?-4p恒定区<400>47gluvalglnleuglngluserglyproglyleuvallysprosergly151015thrleuserleuthrcysthrvalserglypheserleuserthrtyr202530tyrmetsertrpvalargglnproproglylysglyleuglutrpile354045glyileiletyrproserglyserthrtyrseralasertrpalalys505560glyargphethrileserlysalaserthrlysasnthrvalaspleu65707580lysleuserservalthralaalaaspthralathrtyrphecysala859095argproaspasngluglythrserglytyrleuserglypheglyleu100105110trpglyglnglythrleuvalthrvalserseralaserthrlysgly115120125proservalpheproleualaprocysserargserthrsergluser130135140thralaalaleuglycysleuvallysasptyrpheprogluproval145150155160thrvalsertrpasnserglyalaleuthrserglyvalhisthrphe165170175proalavalleuglnserserglyleutyrserleuserservalval180185190thrvalproserserserleuglythrlysthrtyrthrcysasnval195200205asphislysproserasnthrlysvalasplysargvalgluserlys210215220tyrglyproprocysproprocysproalaproglupheleuglygly225230235240proservalpheleupheproprolysprolysaspthrleumetile245250255serargthrprogluvalthrcysvalvalvalaspvalserglnglu260265270aspprogluvalglnpheasntrptyrvalaspglyvalgluvalhis275280285asnalalysthrlysproargglugluglnpheasnserthrtyrarg290295300valvalservalleuthrvalleuhisglnasptrpleuasnglylys305310315320glutyrlyscyslysvalserasnlysglyleuproserserileglu325330335lysthrileserlysalalysglyglnproarggluproglnvaltyr340345350thrleuproproserglngluglumetthrlysasnglnvalserleu355360365thrcysleuvallysglyphetyrproseraspilealavalglutrp370375380gluserasnglyglnprogluasnasntyrlysthrthrproproval385390395400leuaspseraspglyserphepheleutyrserargleuthrvalasp405410415lysserargtrpglngluglyasnvalphesercysservalmethis420425430glualaleuhisasnhistyrthrglnlysserleuserleuserleu435440445glylys450<210>48<211>123<212>prt<213>人工序列<220><223>909gh61vh区<400>48gluvalglnleuglngluserglyproglyleuvallysprosergly151015thrleuserleuthrcysalavalserglypheserleuserthrtyr202530tyrmetsertrpvalargglnproproglylysglyleuglutrpile354045glyileiletyrproserglyserthrtyrcysalasertrpalalys505560glyargvalthrileserlysaspserserlysasnglnvalserleu65707580lysleuserservalthralaalaaspthralavaltyrtyrcysala859095argproaspasnaspglythrserglytyrleuserglypheglyleu100105110trpglyglnglythrleuvalthrvalserser115120<210>49<211>450<212>prt<213>人工序列<220><223>909gh61igg4vh+人?-4p恒定区<400>49gluvalglnleuglngluserglyproglyleuvallysprosergly151015thrleuserleuthrcysalavalserglypheserleuserthrtyr202530tyrmetsertrpvalargglnproproglylysglyleuglutrpile354045glyileiletyrproserglyserthrtyrcysalasertrpalalys505560glyargvalthrileserlysaspserserlysasnglnvalserleu65707580lysleuserservalthralaalaaspthralavaltyrtyrcysala859095argproaspasnaspglythrserglytyrleuserglypheglyleu100105110trpglyglnglythrleuvalthrvalserseralaserthrlysgly115120125proservalpheproleualaprocysserargserthrsergluser130135140thralaalaleuglycysleuvallysasptyrpheprogluproval145150155160thrvalsertrpasnserglyalaleuthrserglyvalhisthrphe165170175proalavalleuglnserserglyleutyrserleuserservalval180185190thrvalproserserserleuglythrlysthrtyrthrcysasnval195200205asphislysproserasnthrlysvalasplysargvalgluserlys210215220tyrglyproprocysproprocysproalaproglupheleuglygly225230235240proservalpheleupheproprolysprolysaspthrleumetile245250255serargthrprogluvalthrcysvalvalvalaspvalserglnglu260265270aspprogluvalglnpheasntrptyrvalaspglyvalgluvalhis275280285asnalalysthrlysproargglugluglnpheasnserthrtyrarg290295300valvalservalleuthrvalleuhisglnasptrpleuasnglylys305310315320glutyrlyscyslysvalserasnlysglyleuproserserileglu325330335lysthrileserlysalalysglyglnproarggluproglnvaltyr340345350thrleuproproserglngluglumetthrlysasnglnvalserleu355360365thrcysleuvallysglyphetyrproseraspilealavalglutrp370375380gluserasnglyglnprogluasnasntyrlysthrthrproproval385390395400leuaspseraspglyserphepheleutyrserargleuthrvalasp405410415lysserargtrpglngluglyasnvalphesercysservalmethis420425430glualaleuhisasnhistyrthrglnlysserleuserleuserleu435440445glylys450<210>50<211>123<212>prt<213>人工序列<220><223>909gh62vh区<400>50gluvalglnleuglngluserglyproglyleuvallysprosergly151015thrleuserleuthrcysalavalserglypheserleuserthrtyr202530tyrmetsertrpvalargglnproproglylysglyleuglutrpile354045glyileiletyrproserglyserthrtyrseralasertrpalalys505560glyargvalthrileserlysaspserserlysasnglnvalserleu65707580lysleuserservalthralaalaaspthralavaltyrtyrcysala859095argproaspasngluglythrserglytyrleuserglypheglyleu100105110trpglyglnglythrleuvalthrvalserser115120<210>51<211>450<212>prt<213>人工序列<220><223>909gh62igg4vh+人?-4p恒定区<400>51gluvalglnleuglngluserglyproglyleuvallysprosergly151015thrleuserleuthrcysalavalserglypheserleuserthrtyr202530tyrmetsertrpvalargglnproproglylysglyleuglutrpile354045glyileiletyrproserglyserthrtyrseralasertrpalalys505560glyargvalthrileserlysaspserserlysasnglnvalserleu65707580lysleuserservalthralaalaaspthralavaltyrtyrcysala859095argproaspasngluglythrserglytyrleuserglypheglyleu100105110trpglyglnglythrleuvalthrvalserseralaserthrlysgly115120125proservalpheproleualaprocysserargserthrsergluser130135140thralaalaleuglycysleuvallysasptyrpheprogluproval145150155160thrvalsertrpasnserglyalaleuthrserglyvalhisthrphe165170175proalavalleuglnserserglyleutyrserleuserservalval180185190thrvalproserserserleuglythrlysthrtyrthrcysasnval195200205asphislysproserasnthrlysvalasplysargvalgluserlys210215220tyrglyproprocysproprocysproalaproglupheleuglygly225230235240proservalpheleupheproprolysprolysaspthrleumetile245250255serargthrprogluvalthrcysvalvalvalaspvalserglnglu260265270aspprogluvalglnpheasntrptyrvalaspglyvalgluvalhis275280285asnalalysthrlysproargglugluglnpheasnserthrtyrarg290295300valvalservalleuthrvalleuhisglnasptrpleuasnglylys305310315320glutyrlyscyslysvalserasnlysglyleuproserserileglu325330335lysthrileserlysalalysglyglnproarggluproglnvaltyr340345350thrleuproproserglngluglumetthrlysasnglnvalserleu355360365thrcysleuvallysglyphetyrproseraspilealavalglutrp370375380gluserasnglyglnprogluasnasntyrlysthrthrproproval385390395400leuaspseraspglyserphepheleutyrserargleuthrvalasp405410415lysserargtrpglngluglyasnvalphesercysservalmethis420425430glualaleuhisasnhistyrthrglnlysserleuserleuserleu435440445glylys450<210>52<211>21<212>dna<213>人工序列<220><223>36b4正向引物<400>52cactggtctaggacccgagaa21<210>53<211>21<212>dna<213>人工序列<220><223>36b4反向引物<400>53agggggagatgttcagcatgt21<210>54<211>21<212>dna<213>人工序列<220><223>fas正向引物<400>54ggaggtggtgatagccggtat21<210>55<211>21<212>dna<213>人工序列<220><223>fas反向引物<400>55tgggtaatccatagagcccag21<210>56<211>22<212>dna<213>人工序列<220><223>scd1正向引物<400>56cgggattgaatgttcttgtcgt22<210>57<211>22<212>dna<213>人工序列<220><223>scd1反向引物<400>57cgggattgaatgttcttgtcgt22<210>58<211>21<212>dna<213>人工序列<220><223>pck1正向引物<400>58ctgcataacggtctggacttc21<210>59<211>19<212>dna<213>人工序列<220><223>pck1反向引物<400>59cagcaactgcccgtactcc19<210>60<211>21<212>dna<213>人工序列<220><223>g6pc正向引物<400>60cgactcgctatctccaagtga21<210>61<211>20<212>dna<213>人工序列<220><223>g6pc反向引物<400>61gttgaaccagtctccgacca20<210>62<211>21<212>dna<213>人工序列<220><223>acc1正向引物<400>62atgtctggcttgcacctagta21<210>63<211>23<212>dna<213>人工序列<220><223>acc1反向引物<400>63ccccaaagcgagtaacaaattct23<210>64<211>23<212>dna<213>人工序列<220><223>tnf正向引物<400>64ccctcacactcagatcatcttct23<210>65<211>19<212>dna<213>人工序列<220><223>tnf反向引物<400>65gctacgacgtgggctacag19<210>66<211>22<212>dna<213>人工序列<220><223>il-1b正向引物<400>66gcaactgttcctgaactcaact22<210>67<211>21<212>dna<213>人工序列<220><223>il-1b反向引物<400>67atcttttggggtccgtcaact21<210>68<211>22<212>dna<213>人工序列<220><223>il-6正向引物<400>68acaaccacggccttccctactt22<210>69<211>23<212>dna<213>人工序列<220><223>il-6反向引物<400>69cacgatttcccagagaacatgtg23<210>70<211>18<212>dna<213>人工序列<220><223>ccl2正向引物<400>70catccacgtgttggctca18<210>71<211>23<212>dna<213>人工序列<220><223>ccl2反向引物<400>71gatcatcttgctggtgaatgagt23<210>72<211>20<212>dna<213>人工序列<220><223>cxcl1正向引物<400>72gactccagccacactccaac20<210>73<211>18<212>dna<213>人工序列<220><223>cxcl1反向引物<400>73tgacagcgcagctcattg18<210>74<211>21<212>dna<213>人工序列<220><223>f4/80正向引物<400>74tgactcaccttgtggtcctaa21<210>75<211>22<212>dna<213>人工序列<220><223>f4/80反向引物<400>75cttcccagaatccagtctttcc22<210>76<211>21<212>dna<213>人工序列<220><223>cd68正向引物<400>76tgtctgatcttgctaggaccg21<210>77<211>22<212>dna<213>人工序列<220><223>cd68反向引物<400>77gagagtaacggcctttttgtga22<210>78<211>22<212>dna<213>人工序列<220><223>tbp正向引物<400>78agaacaatccagactagcagca22<210>79<211>21<212>dna<213>人工序列<220><223>tbp反向引物<400>79gggaacttcacatcacagctc21<210>80<211>107<212>prt<213>人工序列<220><223>igkv1-17<400>80aspileglnmetthrglnserproserserleuseralaservalgly151015aspargvalthrilethrcysargalaserglnglyileargasnasp202530leuglytrptyrglnglnlysproglylysalaprolysargleuile354045tyralaalaserserleuglnserglyvalproserargphesergly505560serglyserglythrgluphethrleuthrileserserleuglnpro65707580gluaspphealathrtyrtyrcysleuglnhisasnsertyrprotyr859095thrpheglyglnglythrlysleugluilelys100105<210>81<211>113<212>prt<213>人工序列<220><223>ighv4-4<400>81glnvalglnleuglngluserglyproglyleuvallysprosergly151015thrleuserleuthrcysalavalserglyglyserileserserser202530asntrptrpsertrpvalargglnproproglylysglyleuglutrp354045ileglygluiletyrhisserglyserthrasntyrasnproserleu505560lysserargvalthrileservalasplysserlysasnglnpheser65707580leulysleuserservalthralaalaaspthralavaltyrtyrcys859095alaargtyrpheasptyrtrpglyglnglythrleuvalthrvalser100105110ser<210>82<211>29<212>prt<213>人<400>82hisserglnglythrphethrserasptyrserlystyrleuaspser151015argargalaglnaspphevalglntrpleumetasnthr2025当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1