金黄色葡萄球菌检测膜和制备方法及其细菌检测的方法与流程
本发明涉及金黄色葡萄球菌的检测,属于生物检测技术领域,具体地涉及一种金黄色葡萄球菌检测膜和制备方法及其检测方法。
背景技术
感染性疾病是全球第二大引起人类死亡的主要原因,而金黄色葡萄球菌(sau)是引起人类感染的主要病原体,可引起多中国类型的感染:如皮肤软组织感染、眼眶蜂窝组织炎、坏死性筋膜炎、坏死性肺炎、心内膜炎、骨髓炎和败血症等,自1961年耐甲氧西林金黄色葡萄球菌出现以来,目前,在全球范围内已成为医院和社区获得性感染的重要起因。
由于金黄色葡萄球菌对营养要求不高,且具备高度的耐盐性,容易污染肉类、水产品、乳品等食品,包括中国在内的多个国家均将金黄色葡萄球菌作为食品卫生标准的常规检查项目之一。目前为止尚未有研究能明确的表明金黄色葡萄球菌产毒与其菌数的定量联系,故无法得知金黄色葡萄球菌菌数水平与产毒之间的关系。国外通常采用食物中菌数含量达到103cfu/g
作为金黄色葡萄球菌定量风险评估标准,我国食品中金黄色葡萄球菌检验按照gbt4789.10-20010执行,其中定量检验是第二法金黄色葡萄球菌baird-parker平板计数和第三法金黄色葡萄球菌mpn计数,试验研究表明,单纯的采用上述两种方法,会由于人员差异引起测量结果的准确度。
菌落总数测试片(petrifilmtm)是在一定条件下(如培养基、培养温度和培养时间等)培养后,所得每g(ml)检样中形成的微生物菌落总数,该测试片能应用于所有的食品,但主要用于评估大多数食品的总的细菌含量水平。
技术实现要素:
为解决上述技术问题,本发明公开了一种成本低且定量检测金黄色葡萄球菌检测膜和制备方法及其细菌检测的方法。
为实现上述目的,本发明公开了一种金黄色葡萄球菌检测膜,包含基材层,它还包括检测层,所述检测层设置在所述基材层上,所述基材层为纳米纤维膜组成,所述检测层为氟硼荧类荧光分子功能化的糖基聚合物及苯硼酸聚合物组成,所述氟硼荧类荧光分子功能化的糖基聚合物和苯硼酸聚合物通过层层自组装的方式均匀交替组装设置在所述纳米纤维膜表面,所述氟硼荧类荧光分子功能化的糖基聚合物为葡萄糖基化合物和氟硼荧类荧光分子的共聚物,其分子结构式如下式i所示,具体制备过程为葡萄糖单体与氟硼荧类荧光分子在偶氮二异丁腈在引发下进行自由基聚合反应;
所述苯硼酸聚合物为3-丙烯酰胺基苯硼酸与甲基丙烯酸聚乙二醇酯的共聚物;所述苯硼酸聚合物的分子结构式如式ii所示;
上述式i中的n占90~95%,m占5~10%,n:m=9:1~19:1,即将氟硼荧类荧光分子与葡萄糖基化合物看成为总量为1,优选n:m=10:1、n:m=11:1、n:m=12:1、n:m=13:1、n:m=14:1、n:m=15:1、n:m=16:1、n:m=17:1、n:m=18:1;保证在对金黄色葡萄球菌的高精度识别基础上,分子的荧光强度较强,提高检测仪器的灵敏度。
上述式ii中,m占50~60%,n占40~50%,即m:n=1:1~3:2,将3-丙烯酰胺基苯硼酸分子与甲基丙烯酸聚乙二醇酯看成为总量为1,在此基础上,优选,m:n=1:1.1、m:n=1:1.2、m:n=1:1.3、m:n=1:1.4;其中,式ii中的3-丙烯酰胺基苯硼酸分子起到和糖基分子特异性结合的作用,较低的比例无法达到特异性结合作用,同时,3-丙烯酰胺基苯硼酸分子的水溶性较差,和甲基丙烯酸聚乙二醇酯共聚可以通过甲基丙烯酸聚乙二醇酯起到增强溶解度的作用。式ii中的m和n在上述比例下既可以达到较好的特异性结合能力,又能保证在水溶液中的溶解和分散能力较好。同时,上述式ii中的m和n只是编号,它还可为a、b、c、d等。
进一步地,所述层层自组装的作用力为静电吸附作用力,所述纳米纤维膜表面通过静电作用力吸附氟硼荧类荧光分子功能化的糖基聚合物分子的一端,所述氟硼荧类荧光分子功能化的糖基聚合物分子的另一端通过静电作用力吸附苯硼酸聚合物分子。
再进一步地,所述纳米纤维膜为聚乙烯-聚乙烯醇纳米纤维膜,所述聚乙烯-聚乙烯醇纳米纤维膜的厚度为100~300μm,克重为12~40gsm。
为了更好的实现本发明的目的,本发明还公开了制备上述金黄色葡萄球菌检测膜的方法,包括如下步骤:
1)制备纳米纤维膜:在普通无纺布的表面均匀喷淋聚乙烯-聚乙烯醇纳米纤维悬浮液,成膜后干燥,分离即制备得到聚乙烯醇-聚乙烯的纳米纤维膜;
2)制备表面活化的纳米纤维膜:将所述步骤1)制备得到的纳米纤维膜浸渍在氢氧化钠溶液中一段时间,即得到表面活化的纳米纤维膜;
3)制备细菌检测膜:将所述步骤2)制备得到的表面活化的纳米纤维膜浸渍于氟硼荧类荧光分子功能化的糖基聚合物水溶液中一段时间后,取出并采用清水洗净后,再置于苯硼酸聚合物水溶液中浸渍处理一段时间,取出并采用清水洗净,依次交替重复五次浸渍在氟硼荧类荧光分子功能化的糖基聚合物水溶液和苯硼酸聚合物水溶液中,最后干燥即制备得到细菌检测膜。
进一步地,所述步骤3)中,所述氟硼荧类荧光分子功能化的糖基聚合物的水溶液浓度为1~4g/l,浸渍处理时间为10~30min。
再进一步地,所述步骤3)中,所述苯硼酸聚合物的水溶液浓度为1~4g/l,浸渍处理时间为10~30min。
更进一步地,所述步骤2)中,所述氢氧化钠溶液的浓度为0.5~4.5mol/l,浸渍处理的时间为10~30min。
作为本发明的技术优选,所述氟硼荧类荧光分子功能化的糖基聚合物的水溶液浓度为2~3g/l,优选为3g/l,浸渍处理时间为20min;
所述苯硼酸聚合物的水溶液浓度为2~3.5g/l,优选为2.5g/l,浸渍处理时间为20min;
所述氢氧化钠溶液的浓度为1.5~3mol/l,优选为2mol/l,浸渍处理的时间为20min。
为了进一步地实现本发明的目的,本发明还公开了一种检测金黄色葡萄球菌的方法,包括如下步骤:
a)选用上述制备的检测膜并测定其表面的荧光强度值;
b)取待测样品滴加到所述步骤a)选用的检测膜上;
c)分别在相等的时间间隔之间测定检测膜表面的荧光强度变化值,并根据荧光强度变化值计算荧光强度的变化速率;
d)根据所述步骤c)荧光强度的变化速率,结合标准曲线得到待测样品中的细菌浓度。
进一步地,所述步骤d)中标准曲线的绘制过程为:
取五份金黄色葡萄球菌悬浮液的浓度为10cfu/ml、102cfu/ml、103cfu/ml、104cfu/ml、105cfu/ml的标准溶液,然后取5个完全相同的所述步骤a)的检测膜并测定其荧光强度值,再分别浸渍于上述标准溶液中,分别在相等的时间间隔之间测定检测膜表面的荧光强度值,由多个前后变化的荧光强度的差值计算荧光强度的变化速率,以荧光强度的变化速率为纵坐标,以对应的标准溶液浓度的对数值为横坐标,得到标准曲线。
本发明细菌检测膜的制备原理:
本发明的制备方法为将纳米纤维膜置于碱性溶液中,其中纳米纤维膜表面在碱性溶液中进行活化处理,使表面羟基更多的暴露在环境中,氟硼荧类荧光分子功能化的葡萄糖基聚合物利用氢键相互作用吸附在纳米纤维膜表面;再利用葡萄糖和硼酸间的相互作用使苯硼酸和甲基丙烯酸聚乙二醇酯聚合物吸附在纳米纤维膜表面,多次重复上述过程即可得到一种金黄色葡萄球菌专用检测膜。
本发明细菌检测膜的检测原理:
金黄色葡萄球菌表面带有可被葡萄糖基聚合物专一性识别的糖蛋白,在金黄色葡萄球菌存在的液态环境下,金黄色葡萄球菌能够通过该特异性的糖与蛋白相互作用,诱导聚合物在纳米纤维膜表面的解吸附,从而引起膜表面荧光强度的降低;并且金黄色葡萄球菌的菌落数与解吸附的速率呈正相关,即与纳米纤维膜表面的荧光强度降低速率呈正相关,而在无菌或者其他菌种而无金黄色葡萄球菌的环境中,该膜表面聚合物不发生解吸附,即膜表面荧光强度不降低。
附图说明
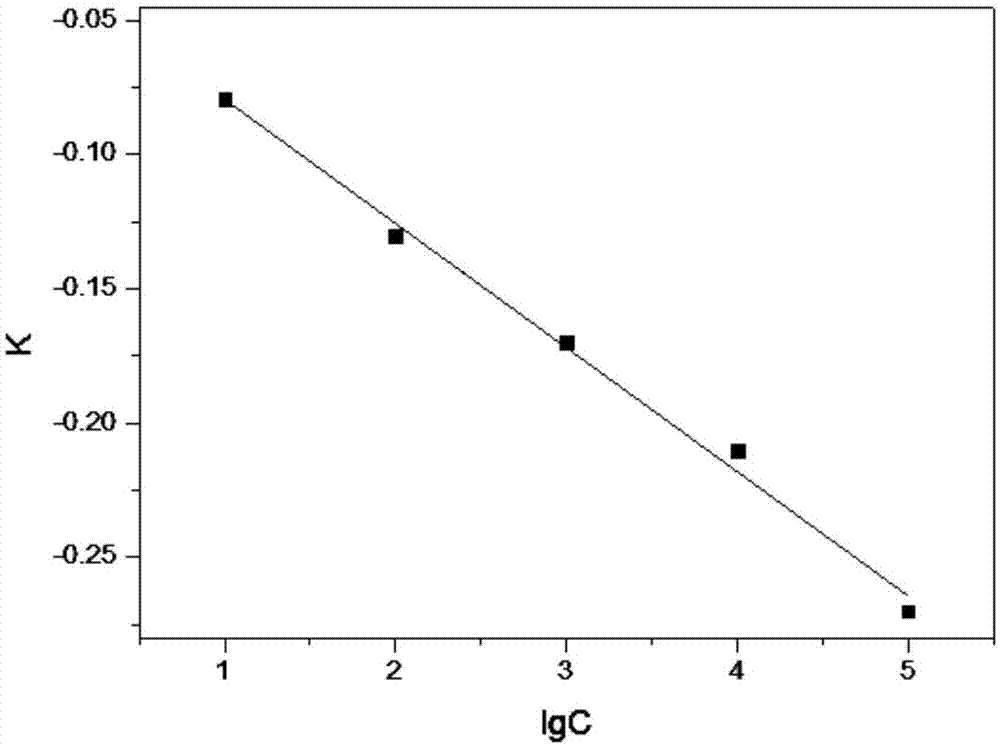
图1为本发明实施例的检测膜表面荧光强度降低速率与细菌浓度对数值之间的线性关系图;
图2为本发明实施例的检测膜对铜绿假单胞菌杆菌的响应关系图;
图3为本发明实施例的检测膜对大肠杆菌的响应关系图。
图4为本发明实施例的检测膜对金黄色葡萄球菌的响应关系图;
具体实施方式
本发明公开了一种金黄色葡萄球菌检测膜,其包含基材层,所述基材层为由聚乙烯-聚乙烯醇纳米纤维膜组成,且控制所述聚乙烯-聚乙烯醇纳米纤维膜的厚度为100~300μm,克重为12~40gsm;在基材层的上方设有检测层,所述检测层为氟硼荧类荧光分子功能化的糖基聚合物及苯硼酸聚合物组成,其中,在所述纳米纤维膜表面通过静电作用力吸附氟硼荧类荧光分子功能化的糖基聚合物分子的一端,所述氟硼荧类荧光分子功能化的糖基聚合物分子的另一端通过静电作用力吸附苯硼酸聚合物分子,依次交替重复吸附,最终,所述纳米纤维膜表面的最外层吸附的是氟硼荧类荧光分子功能化的糖基聚合物;所述氟硼荧类荧光分子功能化的糖基聚合物为葡萄糖基化合物和氟硼荧类荧光分子的共聚物,其分子结构式如下式i所示,所述苯硼酸聚合物为3-丙烯酰胺基苯硼酸与甲基丙烯酸聚乙二醇酯的共聚物,其分子结构式如下式ii所示;
为了更好地解释本发明,以下结合具体实施例进一步阐明本发明的主要内容,但本发明的内容不仅仅局限于以下实施例。
实施例1
1)制备纳米纤维膜:在普通无纺布的表面均匀喷淋聚乙烯-聚乙烯醇纳米纤维悬浮液,成膜后干燥,分离即制备得到厚度为250μm,克重为30gsm的聚乙烯醇-聚乙烯的纳米纤维膜;
2)制备表面活化的纳米纤维膜:将所述步骤1)制备得到的纳米纤维膜浸渍在浓度为1mol/l的氢氧化钠溶液中处理30min左右,即得到表面活化的纳米纤维膜;
3)制备细菌检测膜:将所述步骤2)制备得到的表面活化的纳米纤维膜浸渍于浓度为3g/l的氟硼荧类荧光分子功能化的糖基聚合物水溶液中处理20min后,取出并采用清水洗净后,再置于浓度为3g/l,的苯硼酸聚合物水溶液中浸渍处理20min后,取出并采用清水洗净,依次交替重复浸渍在上述氟硼荧类荧光分子功能化的糖基聚合物水溶液和苯硼酸聚合物水溶液中,重复处理的次数为5次,自然干燥制备得到细菌检测膜。
实施例2
1)制备纳米纤维膜:在普通无纺布的表面均匀喷淋聚乙烯-聚乙烯醇纳米纤维悬浮液,成膜后干燥,分离即制备得到厚度为100μm,克重为12gsm的聚乙烯醇-聚乙烯的纳米纤维膜;
2)制备表面活化的纳米纤维膜:将所述步骤1)制备得到的纳米纤维膜浸渍在浓度为0.5mol/l的氢氧化钠溶液中处理30min左右,即得到表面活化的纳米纤维膜;
3)制备细菌检测膜:将所述步骤2)制备得到的表面活化的纳米纤维膜浸渍于浓度为1g/l的氟硼荧类荧光分子功能化的糖基聚合物水溶液中处理30min后,取出并采用清水洗净后,再置于浓度为2g/l的苯硼酸聚合物水溶液中浸渍处理30min后,取出并采用清水洗净,依次交替重复浸渍在上述氟硼荧类荧光分子功能化的糖基聚合物水溶液和苯硼酸聚合物水溶液中,重复处理的次数为5次,自然干燥制备得到细菌检测膜。
实施例3
1)制备纳米纤维膜:在普通无纺布的表面均匀喷淋聚乙烯-聚乙烯醇纳米纤维悬浮液,成膜后干燥,分离即制备得到厚度为150μm,克重为15gsm的聚乙烯醇-聚乙烯的纳米纤维膜;
2)制备表面活化的纳米纤维膜:将所述步骤1)制备得到的纳米纤维膜浸渍在浓度为2.5mol/l的氢氧化钠溶液中处理30min左右,即得到表面活化的纳米纤维膜;
3)制备细菌检测膜:将所述步骤2)制备得到的表面活化的纳米纤维膜浸渍于浓度为4g/l的氟硼荧类荧光分子功能化的糖基聚合物水溶液中处理20min后,取出并采用清水洗净后,再置于浓度为4g/l的苯硼酸聚合物水溶液中浸渍处理20min后,取出并采用清水洗净,依次交替重复浸渍在上述氟硼荧类荧光分子功能化的糖基聚合物水溶液和苯硼酸聚合物水溶液中,重复处理的次数为5次,自然干燥制备得到细菌检测膜。
实施例4
1)制备纳米纤维膜:在普通无纺布的表面均匀喷淋聚乙烯-聚乙烯醇纳米纤维悬浮液,成膜后干燥,分离即制备得到厚度为250μm,克重为30gsm的聚乙烯醇-聚乙烯的纳米纤维膜;
2)制备表面活化的纳米纤维膜:将所述步骤1)制备得到的纳米纤维膜浸渍在浓度为4.5mol/l的氢氧化钠溶液中处理30min左右,即得到表面活化的纳米纤维膜;
3)制备细菌检测膜:将所述步骤2)制备得到的表面活化的纳米纤维膜浸渍于浓度为1.5g/l的氟硼荧类荧光分子功能化的糖基聚合物水溶液中处理30min后,取出并采用清水洗净后,再置于浓度为2.5g/l的苯硼酸聚合物水溶液中浸渍处理30min后,取出并采用清水洗净,依次交替重复浸渍在上述氟硼荧类荧光分子功能化的糖基聚合物水溶液和苯硼酸聚合物水溶液中,重复处理的次数为5次,自然干燥制备得到细菌检测膜。
将上述实施例4制备的细菌检测膜进行细菌检测,具体过程如下:
首先,取五份金黄色葡萄球菌悬浮液的浓度为10cfu/ml、102cfu/ml、103cfu/ml、104cfu/ml、105cfu/ml的标准溶液,然后取5个完全相同的长×宽=3cm×1cm的检测膜并测定其荧光强度值,再分别浸渍于上述标准溶液中,分别在1min,2min,3min,4min和5min的时间点上,采用荧光分光光度计测定检测膜表面的荧光强度变化,由前后变化的荧光强度的差值计算荧光强度的变化速率,以荧光强度的变化速率为纵坐标,以对应的标准溶液浓度的对数值lg值为横坐标,得到标准曲线,如图1所示,图1所示的线性关系图如下数学关系式所示:lgcbacterium=-24k-0.75,其中,cbacterium表示细菌浓度,k表示表面荧光强度的降低速率。
然后选用如上述相同的长×宽=3cm×1cm的检测膜并测定其膜表面的荧光强度值,取待测溶液滴加到上述检测膜上;
分别在1min,2min,3min,4min和5min的时间点上,采用荧光分光光度计测定检测膜表面的荧光强度变化,并根据荧光强度变化值计算荧光强度的变化速率k为-0.22;
根据上述荧光强度的变化速率,结合图1的标准曲线得到细菌浓度为3.4×104cfu/ml。
为了进一步地说明,本发明制备的细菌检测膜只对大肠杆菌具备特异性识别能力,选择将相同的检测膜分别浸入到金黄色葡萄球菌悬浮液、铜绿假单胞菌杆菌悬浮液及不同浓度的大肠杆菌悬浮液中,分别在1min,2min,3min,4min和5min的时间点上,采用荧光分光光度计测定各检测膜表面的荧光强度,得到了图2、图3和图4;
结合图2、图3和图4可知,本发明制备的检测膜在铜绿假单胞菌杆菌和大肠杆菌悬浮液内表面荧光强度降低不明显,说明该检测膜对这两种细菌无响应。而在金黄色葡萄球菌的悬浮液内,荧光强度逐渐降低,说明该检测膜对金黄色葡萄球菌具备响应能力;并且由图4可知,荧光强度的降低速率与金黄色葡萄球菌浓度成正比。
以上实施例仅为最佳举例,而并非是对本发明的实施方式的限定。除上述实施例外,本发明还有其他实施方式。凡采用等同替换或等效变换形成的技术方案,均落在本发明要求的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!