一种人非小细胞肺癌外周血髓源性抑制细胞的检测方法及其应用与流程
本发明属于肿瘤免疫学、细胞生物学领域,涉及一种人非小细胞肺癌外周血髓源性抑制细胞的检测方法;此外,本发明还涉及前述检测方法的应用。
背景技术
肺癌是发病人数和死亡人数增长最快、对人类健康和生命威胁最大的恶性肿瘤之一,已成为世界范围内亟需解决的公共卫生问题【torrela,brayf,siegelrl,etal.globalcancerstatistics,2012.[j].cacancerjclin,2015,65(2):87.;chenw,zhengr,baadepd,etal.cancerstatisticsinchina,2015[j].caacancerjournalforclinicians,2016,66(2):115-132.】。由于人口老龄化、吸烟、大气污染等环境问题导致肺癌高危人群迅速扩大,而早期诊断技术的发展导致早期肺癌术后患者的比例不断升高,故开展新的治疗方法刻不容缓。近二十年肺癌的治疗手段取得显著的进展,从手术、化疗、放疗到分子靶向治疗,再到目前的免疫治疗,使肺癌患者的生存期及生活质量均取得了明显的改善;肺癌的免疫治疗经历了免疫疫苗、分子靶向、免疫细胞、免疫检查点阻滞剂的发展,在2015年免疫治疗被评为十大科技进展之一;目前,免疫治疗成为研究的热点,主要是免疫编辑理论的机制研究的突破,而mdscs是免疫编辑理论中重要成分之一,具有免疫抑制功能。
在上世纪70年代,研究者发现存在一群细胞不论在体内还是体外均可抑制免疫功能,被称为“自然抑制细胞”(naturesuppressorcells,ns)【gabrilovichdi,hurwitzaa.tumor-inducedimmunesuppression[m].springer,2008.doi:10.1007/978-1-4899-8056-4】;至1995年,seung等首次证明mdscs可以导致免疫监视下调及促进肿瘤生长【seunglp,rowleyda,dubeyp,etal.synergybetweentcellimmunityandinhibitionofparacrinestimulationcausestumorrejection[j].procnatlacadsci,1995,92(14):6254-6258.】;至2007年,这一群具有免疫抑制功能的细胞被国际统一命名为髓源性抑制细胞【gabrilovichdi,brontev,chensh,etal.theterminologyissueformyeloid-derivedsuppressorcells[j].cancerres,2007,67(1):425.】。mdscs具有高度异质性,在不同的肿瘤之间其表面标志也存在差异。在人类中,mdscs可能分为三群,即表达cd14–cd11b+cd33+cd15+或cd66b+的多形核mdsc(pmn-mdsc)、表达cd14+hla-dr–/low的单核mdsc(m-mdsc)以及表达lin–hl-adr–cd33+的代表髓系祖细胞的mdsc【marveld,gabrilovichdi.myeloid-derivedsuppressorcellsinthetumormicroenvironment:expecttheunexpected[j].jclininvest,2015,125(9):3356-3364.】。尽管有很多表面标志被众多研究者提出,但是确切的标志尚待进一步探讨,而且在不同的肿瘤患者体内其表型亦可能存在差异。在肺癌中,vetsika等研究了表达cd14+cd15–cd11b+cd33+hla-dr–lin–和cd14+cd15+cd11b+cd33+hla-dr–lin–的单核类mdscs以及表达cd14–cd15+cd11b+cd33+hla-dr–lin–的pmn-mdsc,发现mdscs是未行治疗的非小细胞肺癌患者的独立预后因子【vetsikaek,koinisf,gioulbasanim,etal.acirculatingsubpopulationofmonocyticmyeloid-derivedsuppressorcellsasanindependentprognostic/predictivefactorinuntreatednon-smalllungcancerpatients[j].jimmunolres,2014:659294.】。
mdscs作为一类免疫抑制细胞,在各类恶性肿瘤中均存在,虽然已经明确其表面标志,但是由于其高度异质性,在不同肿瘤中其表面标志具有明显的差异性;而且,由于缺乏统一的国内外认可的表面标记,人肺癌外周血中髓源性抑制细胞的检测方法没有明确的标准,但鉴于其在肺癌临床治疗与疗效评估中的重要作用,亟需明确其检测方法及临床价值。
技术实现要素:
针对现有技术的上述不足,根据本发明的实施例,希望提供一种人非小细胞肺癌外周血髓源性抑制细胞的检测方法,旨在明确人肺癌外周血中mdscs的表面标记,进而提出其在临床中的应用。
根据实施例,本发明解决上述技术问题所采用的技术方案及试剂制备方法如下:
一、主要仪器与材料(如表1所示)
表1.主要仪器和材料
二、主要试剂(如表2所示)
表2.主要试剂
三、试剂配制(如表3所示)
表3.自配试剂
四、人非小细胞肺癌及健康对照组外周血的采取:
根据研究方案(取得医学伦理委员会审批)招募研究对象并取得其知情同意,清晨空腹在研究对象的右臂静脉采新鲜静脉血2ml备用;
五、流式细胞仪的检测步骤:
(501)按照配置要求配置红细胞裂解液;
(502)标记流式上样管:mdsc、空白、同型对照,并用移液器吸取100μl全血,加入上样管;
(503)采用移液枪在每个上样管中加fc封闭剂5μl,避光封闭5min;
(504)在标记mdsc字样的上样管中加入5μlhumanapc-cd11b抗体、humanfitc-cd14抗体、humanpe/cy7-cd15抗体和humanpe-cd33抗体;空白管加入纯水;同型对照分别加入iga/iγ;避光孵育15min;
(505)每支上样管加红细胞裂解液3ml,避光裂解10min;
(506)至上样管内液体澄清透明后,用离心机离心5min,转速1500r/min;
(507)弃上清,加入pbs重悬,重复上述(506)步骤离心2遍;
(508)弃上清后,加300μlpbs重悬并在涡旋震荡仪上轻微震荡;
(509)流式细胞仪上样检测;
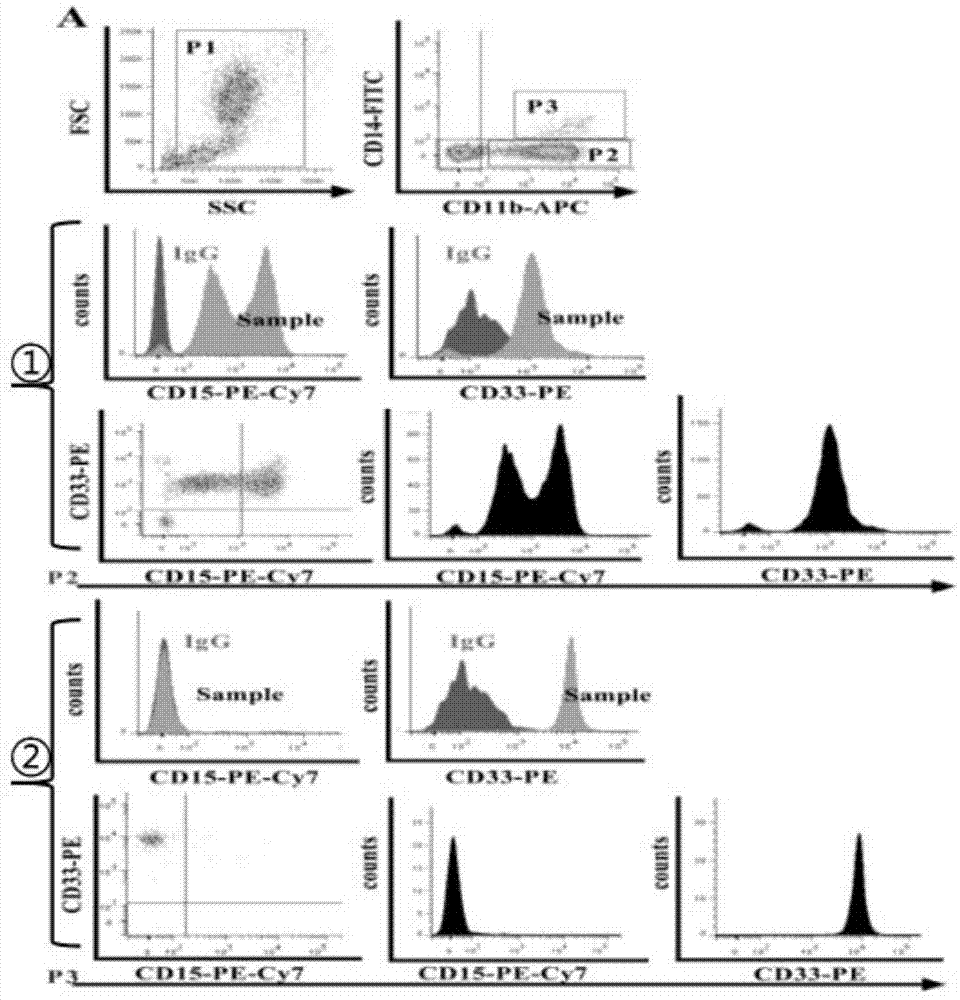
(510)mdsc检测的设门:mdsc检测的设门:根据空白管和同型对照,先圈定gate1表示外周血单个核细胞(pbmc),并设定细胞为10,000个;再设门根据cd14和cd11b的表达情况,圈定gate2和gate3分别表示细胞群cd14+cd11b+及cd14-cd11b+;再根据cd33和cd15的表达情况,以及同型对照的分布趋势,再进一步圈定pmn-mdsc(cd11b+cd15+cd33+cd14-)与m-mdsc(cd11b+cd15-cd33+cd14+)。
本发明提供的检测方法,可以用于人非小细胞肺癌外周血髓源性抑制细胞的表达水平检测,而且在不同临床分期中其分布具有一定的差异;而且其表达水平在患者中显著高于健康对照组(mmdsc4.68±1.63,p<0.05;pmn-mdsc21.12±11.24,p<0.05);同时发现单核系髓源性抑制细胞(m-mdsc)在预测非小细胞肺癌的临床分期中具有较高的敏感度与特异性(p<0.000,95%ci0.628~0.812)。
本发明研究了人非小细胞肺癌(non-smallcelllungcell,nsclc)外周血中髓源性抑制细胞(myeloid-derivedsuppressorcells,mdscs)的检测方法及其在肺癌临床中的应用;研究中涉及的抗体如下:
本发明检测方法采用非小细胞肺癌患者外周静脉血制备流式细胞仪检测的样本,利用流式细胞仪(美国bd公司,型号:facsversetm)检测样本中髓源性抑制细胞(粒系[pmn-mdsc]和髓系[m-mdsc])比例,本发明检测方法在检测过程中确定了mdscs表面标记,明确了mdscs不同亚群在非小细胞肺癌外周血中的表达比例,本发明检测方法操作简便、性价比高、易于推广,具有较大的临床应用价值;运用本发明的检测方法,检测了294例临床确诊为非小细胞肺癌患者的外周血样本中mdscs表达水平,发现其表达水平显著高于健康对照组,同时应用spss统计发现,m-mdsc在预测非小细胞肺癌临床分期中具有更高的敏感性及特异性。
本发明检测方法的关键应用如下:首先,评估非小细胞肺癌患者外周血中的免疫状态,进而预测其临床病情发展程度,为临床治疗方案的制定提供依据;其次,为非小细胞肺癌的免疫治疗提供一定的靶点,可以筛选抑制mdscs功能的小分子抑制剂或中药复方。因此,本发明具有重要的临床应用价值及推广意义,有助于提高非小细胞肺癌的临床疗效,延长患者的生存时间。
附图说明
图1为流式细胞仪检测人非小细胞肺癌外周血中髓源性抑制细胞的检测示意图;
图2为流式细胞仪检测健康对照组外周血中髓源性抑制细胞的检测示意图;
图3为采用spss软件对运用本检测方法获得的人非小细胞肺癌与健康对照组外周血中髓源性抑制细胞表达水平的比较结果示意图;
图4为采用roc曲线法判断人非小细胞肺癌外周血中不同亚型的mdscs预测非小细胞肺癌临床分期的灵敏度与特异性的结果示意图;
具体实施方式
下面结合附图和具体实施例,进一步阐述本发明。这些实施例应理解为仅用于说明本发明而不用于限制本发明的保护范围。在阅读了本发明记载的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等效变化和修改同样落入本发明权利要求所限定的范围。
实施例1(非小细胞肺癌外周血样本中髓源性抑制细胞的表达水平检测)
1.主要仪器与材料:
如表4所示。
表4.主要仪器和材料
2.主要试剂:
如表5所示。
表5.主要试剂
3.试剂配制:
如表6所示。
表6.自配试剂
4.人非小细胞肺癌及健康对照组外周血的采取:
根据研究方案(取得医学伦理委员会审批)招募研究对象并取得其知情同意,清晨空腹在研究对象的右臂静脉采新鲜静脉血2ml备用;
5.流式细胞仪检测的步骤:
(501)配置红细胞裂解液;
(502)标记流式上样管:mdsc、空白、同型对照,并用移液器吸取100μl全血,加如上样管;
(503)采用移液枪在每个上样管中加fc封闭剂5μl,避光封闭5min;
(504)在标记mdsc字样的上样管中加入5μlhumanapc-cd11b抗体、humanfitc-cd14抗体、humanpe/cy7-cd15抗体和humanpe-cd33抗体;空白管加入纯水;同型对照分别加入iga/iγ;避光孵育15min;
(505)每支上样管加红细胞裂解液3ml,避光裂解10min;
(506)至上样管内液体澄清透明后,用离心机离心5min,转速1500r/min;
(507)弃上清,加入pbs重悬,重复上述(506)步骤离心2遍;
(508)弃上清后,加300μlpbs重悬并在涡旋震荡仪上轻微震荡;
(509)流式细胞仪上样检测;mdsc检测的设门:如图1-2所示,根据空白管和同型对照,先圈定gate1表示外周血单个核细胞(pbmc)【如图1-2中p1所示】,并设定细胞为10,000个;再设门根据cd14和cd11b的表达情况,圈定gate2和gate3分别表示细胞群cd14+cd11b+【如图1-2中p3所示】及cd14-cd11b+【如图1-2中p2所示】;再根据cd33和cd15的表达情况,以及同型对照的分布趋势,再进一步圈定pmn-mdsc(cd11b+cd15+cd33+cd14-)【如图1-2中①所示】与m-mdsc(cd11b+cd15-cd33+cd14+)【如图1-2中②所示】。
实施例2(非小细胞肺癌外周血样本中mdscs的表达水平显著高于健康人)
本实施例根据本发明所提供的检测方法,检测了人非小细胞肺癌外周血样本中髓源性抑制细胞的表达水平,结果发现在不同临床分期中其分布具有一定的差异;而且其表达水平在患者中显著高于健康对照组(mmdsc4.68±1.63,p<0.05;pmn-mdsc21.12±11.24,p<0.05),具体见图3。
实施例3(非小细胞肺癌外周血样本中mdscs表达水平可以预测其临床分期,且mmdsc具有较高的特异性与灵敏度)
本实施例根据本发明所提供的检测方法,可以检测人非小细胞肺癌外周血髓源性抑制细胞的表达水平检测中同时发现单核系髓源性抑制细胞(m-mdsc)在预测非小细胞肺癌的临床分期中具有较高的敏感度与特异性(p<0.000,95%ci0.628~0.812),具体见图4。
如图4所示,本结论表明通过检测非小细胞肺癌外周血样本中mdsc的表达水平可以预测其临床分期,而非小细胞肺癌的临床是临床预后关键指标,因此通过检测非小细胞肺癌外周血中mdscs的表达水平可以评估患者的外周免疫状态,进而提示将mdsc作为干预靶点,可能为筛选有效的小分子抑制剂或中药复方为临床肺癌的治疗提供新的方法。
本实施例通过运用本发明的检测方法检测了临床确诊的294例非小细胞肺癌外周血样本中髓源性抑制细胞的表达水平,同时检测健康对照组;结果发现本方法可以有效的检测非小细胞肺癌外周血中髓源性抑制细胞的表达比例,将本发明检测方法获得的数据运用spss软件进行分析,发现非小细胞肺癌外周血中mdscs的表达水平显著高于健康对照组,同时对mdsc预测非小细胞肺癌临床分期的意义,采用了roc分析,结果显示m-mdsc的表达水平在预测非小细胞肺癌的临床分期时具有更高的敏感度与特异性。
- 还没有人留言评论。精彩留言会获得点赞!