基于群体的免疫原性肽鉴定平台的制作方法
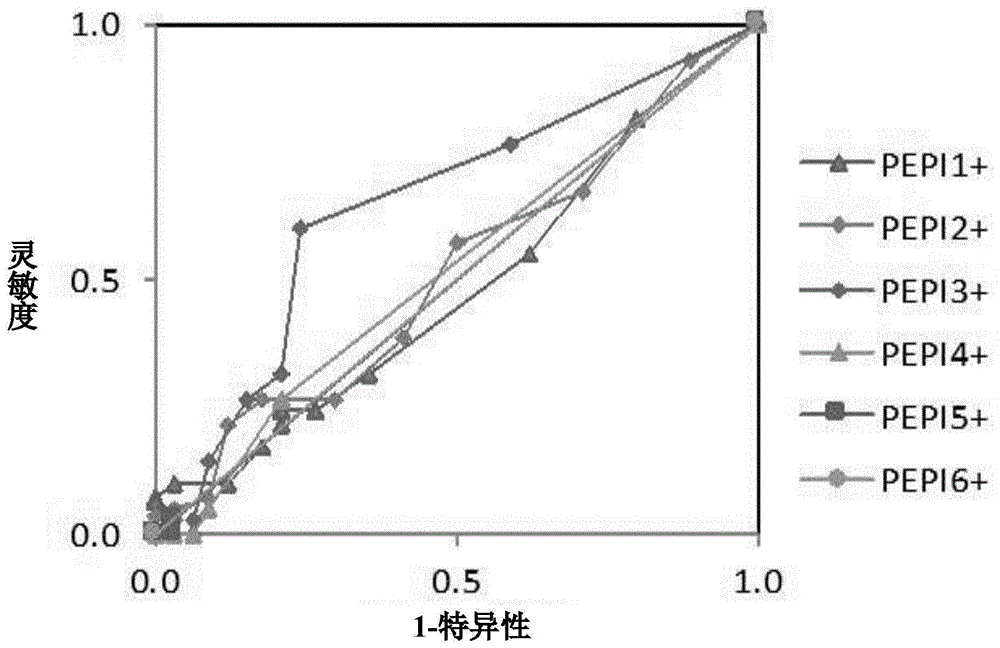
本公开涉及预测多肽是否对特定人类受试者具有免疫原性的方法,鉴定对特定人类受试者具有免疫原性的多肽片段的方法,制备包含所述多肽片段的精确药物组合物或试剂盒的方法,包含所述多肽片段的人类受试者特异性药物组合物以及使用所述组合物的治疗方法。
背景技术:
:几十年来,科学家们一直认为慢性疾病超出了人们自然防御的范围。然而,最近,在用阻断免疫抑制分子的抗体治疗的个体中观察到的显著肿瘤消退加速了癌症免疫疗法的领域。这些临床发现证明现有t细胞应答的再激活对个体产生有意义的临床益处。这些进展重新激发了开发诱导肿瘤特异性t细胞应答的癌症疫苗的热情。尽管有希望,目前的免疫疗法仅在一部分个体中有效。此外,由于个体中肿瘤消退和抗肿瘤t细胞应答的比率低,大多数癌症疫苗试验没有证明统计学上显著的效力。用试图包括hiv和变态反应领域的t细胞应答的治疗性和预防性疫苗也报告了类似的失败。需要克服免疫疗法和疫苗的临床失败。技术实现要素:在抗原呈递细胞(apc)中,蛋白质抗原被加工成肽类。这些肽类与人白细胞抗原分子(hlas)结合,并作为肽-hla复合物呈递给t细胞的细胞表面。不同的个体表达不同的hla分子,不同的hla分子呈递不同的肽类。因此,根据现有技术,如果一种肽或一种较大多肽的片段由受试者表达的hla分子呈递,则将其鉴定为对特定人类受试者具有免疫原性。换句话说,现有技术将免疫原性肽类描述为hla限制性表位。然而,hla限制性表位仅在一部分表达hla分子的个体中诱导t细胞应答。尽管hla等位基因匹配,在一个个体中激活t细胞应答的肽在其他个体中是无活性的。因此,未知个体hla分子如何呈递正激活t细胞应答的抗原衍生表位。如本文提供的,个体表达的多种hla需要呈递相同的肽以触发t细胞应答。因此,对特定个体具有免疫原性的多肽抗原的片段是那些可以与该个体表达的多个i类(激活细胞毒性t细胞)或ii类(激活辅助性t细胞)hla结合的片段。因此,在第一方面,本公开提供了预测特定或目标人类群体对施用多肽或施用包含一种或多种多肽作为活性成分的药物组合物、试剂盒或多肽组(panel)的细胞毒性t细胞应答率及/或辅助性t细胞应答率的方法,该方法包括:(i)选择或定义包含多个受试者的相关模型人类群体,每个受试者由hlai类基因型及/或hlaii类基因型定义;(ii)为上述模型人类群体中的每个受试者确定上述多肽或多肽类是否一起包含(a)至少一种氨基酸序列,其为能够结合受试者的至少二种hlai类分子的t细胞表位;及/或(b)至少一种氨基酸序列,其为能够结合受试者的至少二种hlaii类分子的t细胞表位;以及(iii)预测a.上述人类群体的细胞毒性t细胞应答率,其中满足步骤(ii)(a)要求的较高比例的模型人类群体预测上述人类群体中较高的细胞毒性t细胞应答率;及/或b.上述人类群体的辅助性t细胞应答率,其中满足步骤(ii)(b)的要求的较高比例的模型人类群体预测上述人类群体中较高的辅助性t细胞应答率。本公开还提供了预测特定或目标人类群体对施用包含一种或多种多肽作为活性成分的药物组合物、试剂盒或多肽组的临床应答率的方法,该方法包括:(i)选择或定义包含多个受试者的相关模型人类群体,每个受试者由hlai类基因型定义;(ii)确定(a)对于上述模型人类群体中的每个受试者,一种或多种活性成分多肽是否一起包含至少二种不同的氨基酸序列,该至少二种氨基酸序列各自是能够结合上述受试者的至少二种hlai类分子的t细胞表位,任选地,其中该至少二种不同的氨基酸序列包含在由活性成分多肽靶向的二种不同多肽抗原的氨基酸序列中;(b)上述模型群体中包含至少一个氨基酸序列的靶多肽抗原的平均数,该至少一个氨基酸序列为a.能够结合上述模型群体的个体受试者的至少三种hlai类分子的t细胞表位;且b.包含在上述活性成分多肽的氨基酸序列中;及/或(c)上述模型群体中包含至少一个氨基酸序列的表达的靶多肽抗原的平均数,该至少一个氨基酸序列为a.能够结合上述模型群体的个体受试者的至少三种hlai类分子的t细胞表位;且b.包含在所述活性成分多肽的氨基酸序列中;以及(iii)预测上述人类群体的临床应答率,其中满足步骤(ii)(a)的要求的模型人类群体的较高比例,或步骤(ii)(b)中的靶多肽的较高平均数,或步骤(ii)(c)中表达的靶多肽的较高平均数预测上述人类群体中较高的临床应答率。本公开还提供了治疗有此需要的人类受试者的方法,该方法包括向受试者施用基于如上所述测定的预测的免疫应答率或临床应答率来鉴定或选定的,多肽、药物组合物或多肽试剂盒或多肽组;它们在治疗相关人类受试者的方法中的用途;以及它们在制备用于治疗相关受试者的药物中的用途。本公开还提供了设计或制备多肽或编码多肽的多核酸的方法,它用于在特定或目标人类群体的受试者中诱导免疫应答的方法,该方法包括:(i)选择或定义(a)包含多个各自由hlai类基因型及/或hlaii类基因型定义的受试者的相关模型人类群体;及/或(b)包含多个各自由hlai类基因型定义的受试者的相关模型人类群体,和各自由hlaii类基因型定义的受试者的相关模型人类群体;(ii)鉴定靶多肽抗原的至多50个连续氨基酸的片段,它包含或由其组成a.一种t细胞表位,它在由hlai类基因型定义的步骤(i)中选择或定义的模型群体的高百分比的受试者中能够结合上述个体受试者的至少三种hlai类分子;b.一种t细胞表位,它在由hlaii类基因型定义的步骤(i)中选择或定义的模型群体的高百分比受试者中能够结合上述体受试者的至少三种hlaii类分子;或c.一种t细胞表位,它在由hlai类基因型定义的步骤(i)中选择或定义的模型群体的高百分比受试者中能够结合上述个体受试者的至少三种hlai类分子,以及一种t细胞表位,它在由hlaii类基因型定义的步骤(i)中选择或定义的模型群体的高百分比受试者中能够结合上述个体受试者的至少三种hlaii类分子;(iii)如果步骤(ii)中选择的多肽片段是hlai类分子结合表位,任选地选择上述靶多肽抗原的较长片段,该较长片段包含或由氨基酸序列组成,该氨基酸序列d.包含步骤(ii)中选择的片段;且e.是hlaii类分子结合t细胞表位,它在由hlaii类基因型定义的步骤(i)中选择或定义的模型群体的高百分比受试者中能够结合至少三种、或最可能的上述个体受试者的hlaii类分子;以及(iv)设计或制备多肽或编码多肽的多核酸,该多肽包含步骤(ii)或步骤(iii)中鉴定的一种或多种多肽片段,任选地,其中多肽片段通过不是靶多肽抗原序列的一部分的额外氨基酸侧接于n末端及/或c末端。本公开提供了一种在特定或目标人类群体的受试者中诱导免疫应答的方法,该方法包括设计或制备如上所述的用于所述特定或目标人类群体的多肽、多肽组、编码多肽的多核酸、或药物组合物或试剂盒,以及将上述多肽、多核酸、药物组合物或试剂盒的活性成分多肽施用于受试者。本公开提供了用于在特定或目标人类群体的受试者中诱导免疫应答的方法中的多肽,多肽、多核酸、药物组合物或试剂盒,其中如上所述设计或制备上述多肽、多肽组、多核酸、药物组合物或试剂盒以用于上述特定或目标人类群体,并且其中上述组合物或试剂盒任选地包含至少一种药学上可接受的稀释剂、载体或防腐剂。本公开提供了用于在人类受试者中诱导免疫应答的方法中的药物组合物、多肽组或试剂盒,其中上述药物组合物、多肽组或试剂盒包含作为活性成分的第一肽和第二肽及任选的一种或多种额外肽,其中每种肽包含一种作为t细胞表位的氨基酸序列,该t细胞表位能够结合至少10%的受试者的至少三种hlai类分子,其中第一区域、第二区域和任选的任何额外区域的t细胞表位彼此不同,并且其中上述药物组合物或试剂盒任选地包含至少一种药学上可接受的稀释剂、载体或防腐剂。本公开提供了用于诱导人类受试者免疫应答的方法中的药物组合物、多肽组或试剂盒,其中上述药物组合物、多肽组或试剂盒包含活性成分多肽,该活性成分多肽包含第一区域和第二区域及任选的一个或多个额外区域,其中每个区域包含一种作为t细胞表位的氨基酸序列,该t细胞表位能够结合至少10%的受试者的至少三种hlai类分子,其中第一区域、第二区域和任选的任何额外区域的t细胞表位彼此不同,并且其中上述药物组合物或试剂盒任选地包含至少一种药学上可接受的稀释剂、载体或防腐剂。本公开提供了用于治疗有此需要的受试者的癌症的方法中的药物组合物、多肽组或试剂盒,其中上述药物组合物、多肽组或试剂盒包含作为活性成分的第一肽和第二肽以及任选的一种或多种额外肽,其中每种肽包含一种作为hlai类结合t细胞表位的氨基酸序列,并且其中患有癌症的至少10%的人类受试者既i.表达包含上述t细胞表位的选自表2或表5中所列抗原的肿瘤相关抗原;又ii.具有至少三种能够结合上述t细胞表位的hlai类分子;其中上述第一肽、第二肽和任选的任何额外肽的t细胞表位彼此不同,并且其中上述药物组合物或试剂盒任选地包含至少一种药学上可接受的稀释剂、载体或防腐剂。本公开提供了用于治疗有此需要的受试者的癌症的方法中的一种药物组合物、多肽组或试剂盒,其中上述药物组合物、多肽组或试剂盒包含含有第一区域和第二区域及任选的一个或多个额外区域的活性成分多肽,其中每个区域包含一种作为hlai类结合t细胞表位的氨基酸序列,其中患有癌症的至少10%的人类受试者既(a)表达包含上述t细胞表位的选自表2或表5中所列抗原的肿瘤相关抗原;又(b)具有至少三种能够结合所述t细胞表位的hlai类分子;其中上述第一区域、第二区域和任选的任何额外区域的t细胞表位彼此不同,并且其中上述药物组合物或试剂盒任选地包含至少一种药学上可接受的稀释剂、载体或防腐剂。本公开提供了用于治疗癌症的方法中的一种药物组合物、多肽组或试剂盒,上述癌症选自有此需要的受试者中的结肠直肠癌、乳腺癌、卵巢癌、黑色素瘤、非黑色素瘤皮肤癌、肺癌、前列腺癌、肾癌、膀胱癌、胃癌、肝癌、子宫颈癌、食道癌、非霍奇金淋巴瘤、白血病、胰腺癌、子宫体癌、唇癌、口腔癌、甲状腺癌、脑癌、神经系统癌、胆囊癌、喉癌、咽癌、骨髓瘤癌、鼻咽癌、霍奇金淋巴瘤、睾丸癌和卡波西肉瘤,其中,上述药物组合物、多肽组或试剂盒包含作为活性成分的第一肽和第二肽及任选的一种或多种额外肽,其中每种肽包含一种作为hlai类结合t细胞表位的氨基酸序列,其中患有上述癌症的至少10%的人类受试者既(a)表达包含所述t细胞表位的选自表2或表5中所列抗原的肿瘤相关抗原;又(b)具有至少三种能够结合所述t细胞表位的hlai类分子;其中上述第一肽、第二肽和任选的任何额外肽的t细胞表位彼此不同,并且其中上述药物组合物或试剂盒任选地包含至少一种药学上可接受的稀释剂、载体或防腐剂。本公开提供了用于治疗癌症的方法中的一种药物组合物、多肽组或试剂盒,上述癌症选自有此需要的受试者中的结肠直肠癌、乳腺癌、卵巢癌、黑色素瘤、非黑色素瘤皮肤癌、肺癌、前列腺癌、肾癌、膀胱癌、胃癌、肝癌、子宫颈癌、食道癌、非霍奇金淋巴瘤、白血病、胰腺癌,子宫体癌、唇癌、口腔癌、甲状腺癌、脑癌、神经系统癌、胆囊癌、喉癌、咽癌、骨髓瘤癌、鼻咽癌、霍奇金淋巴瘤、睾丸癌和卡波西肉瘤,其中上述药物组合物、多肽组或试剂盒包含含有第一区域和第二区域及任选的一个或多个额外区域的活性成分多肽,其中每个区域包含一种作为hlai类结合t细胞表位的氨基酸序列,其中患有上述癌症的至少10%的人类受试者既(a)表达包含所述t细胞表位的选自表2或表5中所列抗原的肿瘤相关抗原;又(b)具有至少三种能够结合所述t细胞表位的hlai类分子;其中上述第一多肽、第二多肽和任选的任何额外多肽的t细胞表位彼此不同,并且其中上述药物组合物或试剂盒任选地包含至少一种药学上可接受的稀释剂、载体或防腐剂。本公开提供了一种治疗有此需要的人类受试者的方法,该方法包括向受试者施用上述多肽、多肽组、药物组合物或试剂盒的活性成分多肽,其中已经确定上述受试者表达能够结合上述多肽或药物组合物或试剂盒的一种或多种活性成分多肽的至少三种hlai类分子及/或至少三种hlaii类分子。在另一方面,本公开提供了一种系统,包括:(a)存储模块,它被配置为存储包括人类受试者的模型群体的每个受试者的i类及/或ii类hla基因型的数据;和一种或多种测试多肽的氨基酸序列;其中上述模型群体代表测试目标人类群体;以及(b)计算模块,它被配置为鉴定及/或量化上述一种或多种测试多肽中的氨基酸序列,该氨基酸序列能够结合模型群体中的每个受试者的多个i类hla分子;且/或一种或多种测试多肽中的氨基酸序列,该氨基酸序列能够与模型群体中每个受试者的多种ii类hla分子结合。现在将通过示例而非限制并参考附图更详细地描述本公开。当给出本公开时,许多等同的修改和变化对于本领域技术人员将是显而易见的。因此,所阐述的本发明的示范性实施例被认为是说明性的而非限制性的。在不脱离本公开的范围的情况下,可以对所描述的实施例进行各种改变。本文引用的所有文献,无论是上文还是下文,均明确地以全文引用的方式并入本文中。本公开包括所描述的方面和优选特征的组合,除了这种组合明显是不允许的或被声明为明确避免的情况之外。如在本说明书和所附权利要求书中所使用的,单数形式“一种(a、an)”包括复数指示物,除非内容另有明确说明。因此,例如,提及“一种肽(apeptide)”包括二或更多种这样的肽。本文中使用的章节标题仅仅是为了方便,而不应被解释为以任何方式进行限制。附图说明图1hla限制性pepi生物标志物的roc曲线。图2测定诊断准确性的≥1pepi3+测试的roc曲线。图3相对于通过t细胞应答试验中使用的肽库中的现有技术试验所测量cd8+t细胞应答的,hlai类pepi3+的分布。a:hlai类限制性pepi3+。t细胞应答和pepi3+肽中90%协议总百分比(opa)证明了所公开的肽在个体中预测疫苗诱导的t细胞应答集合的用途。b:hlai类限制性表位(pepi1+)。预测表位和cd8+t细胞应答之间的opa为28%(无统计学意义)。最深灰色:真阳性(tp),检测到肽和t细胞应答;浅灰色:假阴性(fn),仅检测到t细胞应答;最浅灰色:假阳性(fp),仅检测到肽;深灰色:真阴性(tn):肽和t细胞应答均未检测到。图4相对于通过试验中使用的肽库中的现有技术试验来测量的cd4+t细胞应答的hlaii类pepi的分布。a:hlaii类限制性pepi4+。pepi4+和cd4+t细胞应答之间的opa为67%(p=0.002)。b:hlaii类限制性表位。hlaii类限制性表位和cd4+t细胞应答之间的opa为66%(无统计学意义)。最深灰色:真阳性(tp),检测到肽和t细胞应答;浅灰色:假阴性(fn),仅检测到t细胞应答;最浅灰色:假阳性(fp),仅检测到肽;深灰色:真阴性(tn):肽和t细胞应答均未检测到。图5定义18例vin-3和5例宫颈癌患者的hpv-16lpv疫苗特异性t细胞应答组的多种hla结合肽。衍生自每个患者lpv抗原的hlai类限制性pepi3计数(a和b)和hlaii类限制性pepi3计数(c和d)。浅灰色:临床试验中疫苗接种后测量的免疫应答者;深灰色:临床试验中疫苗接种后测量的免疫无应答者。结果显示≥3种hlai类结合肽预测cd8+t细胞反应性,且≥4种hlaii类结合肽预测cd4+t细胞反应性。图6定义2例患者的hpv疫苗特异性t细胞应答组的多种hlai类结合肽。a:hpv疫苗中的四种hpv抗原。方框表示氨基酸序列从n末端到c末端的长度。b:鉴定2例患者的多种hla结合肽的方法:患者的hla序列标记为患者id的4位hla基因型。可以用线表示分别可与患者12-11和患者14-5hla(pepi1+)结合的54和91个表位的第一个氨基酸的位置。pepi2代表选自可以结合患者的多种hla(pepi2+)的pepi1+的肽。pepi3代表可与患者的≥3种hla结合的肽(pepi3+)。pepi4代表可与患者的≥4种hla结合的肽(pepi4+)。pepi5代表可与患者的≥5种hla结合的肽(pepi5+)。pep16代表可与患者的6种hla结合的肽(pep16)。c:2例患者的dna疫苗特异性pepi3+组表征其疫苗特异性t细胞应答。图7临床试验中测定的肽靶标的≥1pepi3+评分与ctl应答率之间的相关性。图8免疫疗法疫苗的≥1pepi3+评分与临床免疫应答率(irr)之间的相关性。虚线:95%置信带。图9免疫疗法疫苗的≥2pepi3+评分与疾病控制率(dcr)的关系。虚线:95%置信带。图10模型群体中受试者的hla等位基因上rindoppimut的hla图谱。图11患者xyz肿瘤细胞中疫苗抗原表达的可能性。疫苗方案中12种靶抗原中有5种在患者肿瘤中表达的概率超过95%。因此,12种肽疫苗可以一起以95%的概率诱导针对至少5种卵巢癌抗原的免疫应答(agp95)。每种肽在患者xyz中诱导免疫应答的概率为84%。agp50是平均值(期望值)=7.9(它是疫苗攻击患者xyz肿瘤的有效性的量度)。图12用个性化(pit)疫苗治疗患者xyz的mri表现。这种晚期、高度预处理的卵巢癌患者在pit疫苗治疗后具有意想不到的客观应答。这些mri表现表明,pit疫苗与化疗相结合可显著降低肿瘤负荷。患者现在继续pit疫苗治疗。图13患者abc肿瘤细胞中疫苗抗原表达的可能性。疫苗中13种靶抗原中的4种在患者肿瘤中表达的可能性超过95%。因此,12种肽疫苗可以一起以95%的概率诱导针对至少4种乳腺癌抗原的免疫应答(agp95)。每种肽在患者abc中诱导免疫应答的概率为84%。agp50是离散概率分布的平均值(期望值)=6.45(它是疫苗攻击患者abc肿瘤的有效性的量度)。图14肽热点分析实例:模型群体的433例患者的prame抗原热点。y轴是模型群体的433例患者,x轴是prame抗原(cta)的氨基酸序列。每个数据点代表从指定氨基酸位置开始的一例患者的≥3hlai类代表的pepi。prame抗原的二种最常见的pepi(称为bestepi)以深灰色突出显示(肽热点=pepi热点)。图15通过分析人乳腺癌组织中肿瘤特异性抗原(cta)的表达频率数据计算cta表达曲线。(不包括细胞系数据。)图16基于从所选10种不同cta的表达频率计算多抗原应答的乳腺癌抗原表达分布。a:计算表达抗原(ag50)数量的期望值的非累积分布。该值表明将由乳腺肿瘤细胞可能表达6.14种疫苗抗原。b:最小数量表达抗原的累积分布曲线(cta表达曲线)。这表明最少4种疫苗抗原将在乳腺癌细胞(ag95)中以95%的概率表达。图17pepi代表抗原:≥1pepi的乳腺癌疫苗特异性cta抗原(称为“ap”)在乳腺癌疫苗的模型群体(n=433)中的分布。a:ap的非累积分布,其中ap的平均数量是:ap50=5.30,意味着平均几乎6个cta将在模型群体中具有pepi。b:模型群体(n=433)中最小数量ap的累积分布曲线。这表明至少一种疫苗抗原在95%的模型群体(n=433)中具有pepi(ap95=1)。图18pepi代表用乳腺癌cta表达率计算的模型群体(n=433)内表达的抗原(由肿瘤表达的乳腺癌疫苗特异性cta抗原,其中预测≥1pepi,称为“agp”)分布。a:agp的非累积分布,其中由pepi表示的用数字表示的cta的期望值是agp50=3.37。agp50是所公开的乳腺癌疫苗在未选择的患者群体中攻击乳腺肿瘤中的有效性的量度。agp50=3.37是指来自疫苗的至少3种cta可能由乳腺肿瘤细胞表达并在模型群体中呈递pepi。b:模型群体(n=433)中最小数量agp的累积分布曲线表明,至少一种疫苗cta将在92%的群体中呈递pepi,其余8%的群体可能根本没有agp(agp95=0,agp92=1)。图19通过分析人大肠癌组织中肿瘤特异性抗原(cta)的表达频率数据计算cta表达曲线。(不包括细胞系数据。)图20基于从所选7种不同cta的表达频率计算多抗原应答的结肠直肠癌抗原表达分布。a:计算结直肠癌(ag50)中表达的疫苗抗原数量的预期值的非累积分布。该值显示结直肠肿瘤细胞可能表达4.96个疫苗抗原。b:最小数量表达抗原的累积分布曲线(cta表达曲线)。这表明最少3种抗原将在结直肠癌细胞(ag95)中以95%的概率表达。图21pepi代表抗原(结肠直肠癌疫苗特异性cta抗原,其中预测≥1pepi,称为“ap”)在结肠直肠癌的模型群体(n=433)内分布。a:ap的非累积分布,其中ap的平均数量为:ap50=4.73,意味着平均5个cta将由模型群体中的pepi表示。b:模型群体(n=433)中最小数量的ap的累积分布曲线。这表明在95%的模型群体(n=433)(ap95=2)中pepi将代表2种或更多种抗原。图22pepi代表在用结肠直肠癌cta表达率计算的模型群体(n=433)内表达的抗原(由肿瘤表达的结肠直肠癌疫苗特异性cta抗原,其中预测≥1pepi,称为“agp”)的分布。a:agp的非累积分布,其中由pepi表示的用数字表示的cta的期望值是agp50=2.54。agp50是公开的结肠直肠癌疫苗在未选择患者群体中攻击结肠直肠肿瘤的有效性的量度。agp50=2.54意味着来自疫苗的至少2-3个cta可能由结肠直肠肿瘤细胞表达并且在模型群体中呈递pepi。b:模型群体(n=433)中最小数量的agp的累积分布曲线显示至少1种疫苗cta将被表达,并且在群体的93%中也呈递pepi(agp93=1)。图23示意图显示了30-mer肽中重叠的hlai类和hlaii类结合表位中氨基酸的示例性位置。图24polypep1018crc疫苗在一般人类群体中的抗原性。polypep1018在受试者中的抗原性由ap计数测定,ap计数指示在受试者中诱导t细胞应答的疫苗抗原的数量。使用pepi测试在模型群体中的433名受试者中的每一名中测定polypep1018的ap计数,然后计算模型群体的ap50计数。模型群体中polypep1018的ap50为4.73。一般群体中polypep1018中免疫原性抗原(即≥1pepi的抗原)的平均数为4.73。缩写:ap=具有≥1pepi的抗原。左图:累积分布曲线。右侧面板:显著的分布曲线。图25polypep1018crc疫苗在一般人类群体中的效力。如果疫苗中的pepi由肿瘤细胞呈递,则疫苗诱导的t细胞可以识别并杀死肿瘤细胞。agp(用pepi表达的抗原)的数量是个体中疫苗效力的指标,并且取决于polypep1018的效力和抗原性。polypep1018在模型群体中的免疫原性cta(即ap[具有≥1pepi的表达抗原])的平均数量为2.54。polypep1018在模型群体中诱导针对受试者中多种抗原的t细胞应答的可能性(即magp)为77%。序列描述seqidno:1-20列出了表30中所述的9-mert细胞表位。seqidno:21-40列出了表33中所述的9-mert细胞表位。seqidno:41-71(81-111)列出了表31中所述的乳腺癌疫苗肽。seqidno:72-102(112-142)列出了表34中所述的结肠直肠癌疫苗肽。seqidno:103-115(159-171)列出了表17中所述的额外肽序列。seqidno:116-128(362-374)列出了设计用于表26中所述的患者xyz的个性化疫苗肽。seqidno:129-140(375-386)列出了设计用于表29中所述的患者abc的个性化疫苗肽。seqidno:141-188(387-434)进一步列出了表41中所述的9-mert细胞表位。具体实施方式hla基因型hla由人基因组的大多数多态性基因编码。每个人具有三种hlai类分子(hla-a*,hla-b*,hla-c*)和四种hlaii类分子(hla-dp*,hla-dq*,hla-drb1*,hla-drb3*/4*/5*)的母系和父系等位基因。实际上,每个人表达6种hlai类分子和8种hlaii类分子的不同组合,它们呈递来自相同蛋白质抗原的不同表位。hla分子的功能是调节t细胞应答。然而,迄今为止还不知道人的hla如何调节t细胞激活。用于表示hla分子的氨基酸序列的命名法如下:基因名称*等位基因:蛋白质编号,例如,其可以看起来像:hla-a*02:25。在该实例中,“02”指等位基因。在大多数情况下,等位基因由血清型c定义,这意味着给定等位基因的蛋白质在血清学测定中不会相互反应。蛋白质编号(上述实例中的25)在发现蛋白质时连续分配。为具有不同氨基酸序列的任何蛋白质指定新的蛋白质编号(例如,甚至序列中的一个氨基酸改变被认为是不同的蛋白质编号)。关于给定基因座的核酸序列的进一步信息可以附加到hla命名法,但是这种信息对于本文所述的方法不是必需的。个体的hlai类基因型或hlaii类基因型可以指个体的每种i类或ii类hla的实际氨基酸序列,或者可以指如上所述的命名法,其最低限度地指定每个hla基因的等位基因和蛋白质编号。可以使用任何合适的方法获得或确定hla基因型。例如,可以使用本领域已知的方法和方案通过对hla基因座测序来确定序列。或者,可以将个体的hla组存储在数据库中,并使用本领域已知的方法进行访问。hla表位结合给定的受试者的hla将仅向t细胞呈递通过在apc中加工蛋白质抗原产生的有限数量的不同肽。如本文所用,当与hla相关使用时,“显示(display)”或“呈递(present)”是指肽(表位)和hla之间的结合。在这方面,“显示”或“呈递”肽与“结合(binding)”肽同义。如本文所用,术语“表位(epitope)”或“t细胞表位(tcellepitope)”是指包含在蛋白质抗原内的连续氨基酸序列,其具有对(能够结合)一种或多种hla的结合亲和力。表位是hla和抗原特异性的(hla表位对,用已知方法预测),但不是受试者特异性的。如果能够在特定人类受试者中诱导t细胞应答(细胞毒性t细胞应答或辅助性t细胞应答),则表位、t细胞表位、多肽、多肽片段或包含多肽或其片段的组合物对该受试者具有免疫原性。在一些情况下,辅助性t细胞应答是th1型辅助性t细胞应答。在一些情况下,如果比能够仅结合受试者的一种hla分子的不同t细胞表位(或在一些情况下各自二个不同的t细胞表位)更可能在受试者中诱导t细胞应答或免疫应答,则表位、t细胞表位、多肽、多肽片段或包含多肽或其片段的组合物特定人类受试者是“免疫原性的”。术语“t细胞应答(tcellresponse)”和“免疫应答(immuneresponse)”在本文中可互换使用,并且是指在鉴定一种或多种hla表位结合对之后t细胞的激活及/或一个或多个效应子功能的诱导。在一些情况下,“免疫应答”包括抗体应答,因为hlaii类分子刺激参与诱导持久ctl应答和抗体应答的辅助应答。效应子功能包括细胞毒性、细胞因子产生和增殖。根据本公开,如果多肽的表位、t细胞表位或片段能够与受试者的至少二种,或在一些情况下至少三种i类或至少二种,或在一些情况下至少三种或至少四种ii类hla结合,则其对特定受试者具有免疫原性。为了本公开的目的,我们提出了术语“人表位”或“pepi”来区分受试者特异性表位和hla特异性表位。“pepi”是由多肽的连续氨基酸序列组成的多肽片段,所述多肽是能够结合特异性人类受试者的一种或多种hlai类分子的t细胞表位。在其他情况下,pepi是由多肽的连续氨基酸序列组成的多肽片段,所述多肽是能够结合特异性人类受试者的一种或多种hlaii类分子的t细胞表位。换句话说,“pepi”是被特定个体的hla组鉴定的t细胞表位。与“表位”相反,pepi是个体特异性的,因为不同个体具有各自结合不同t细胞表位的不同hla分子。本文所用的“pepi1”是指可与个体的一种hlai类分子(或在特定情况下,hlaii类分子)结合的肽或多肽片段。“pepi1+”是指可以与个体的一种或多种hlai类分子结合的肽或多肽片段。“pepi2”指能够结合个体的二种hlai类(或ii类)分子的肽或多肽片段。“pepi2+”是指可以结合个体的二或更多种hlai类(或ii类)分子的肽或多肽片段,即根据本公开的方法鉴定的片段。“pepi3”是指能够结合个体的三种hlai类(或ii类)分子的肽或多肽片段。“pepi3+”是指可以结合个体的三或更多种hlai类(或ii类)分子的肽或多肽片段。“pepi4”是指能够结合个体的四种hlai类(或ii类)分子的肽或多肽片段。“pepi4+”是指可以结合个体的四或更多种hlai类(或ii)分子的肽或多肽片段。“pepi5”是指能够结合个体的五种hlai类(或ii类)分子的肽或多肽片段。“pepi5+”是指能够结合个体的五种或多种hlai类(或ii类)分子的肽或多肽片段。“pepi6”是指能够结合个体的所有六种hlai类(或六种hlaii类)分子的肽或多肽片段。一般而言,由hlai类分子呈递的表位长度约9个氨基酸,由hlaii类分子呈递的表位长约15个氨基酸。然而,为了本公开的目的,只要表位能够结合hla,表位长度可以多于或少于9个(对于hlai类)或多于或少于15个(对于hlaii类)氨基酸。例如,能够结合i类hla的表位长度可以是7或8或9至9或10或11个氨基酸。能够结合ii类hla的表位长度可以是13或14或15至15或16或17个氨基酸。因此,本公开包括,例如,一种预测多肽是否对于人类受试者的相关群体或组群(例如,在模型人类群体中)具有免疫原性,或鉴定多肽片段是否对于人类受试者的相关群体或组群(例如,在模型人类群体中)具有免疫原性的方法,该方法包括以下步骤:(i)确定上述多肽是否包括:a.能够结合受试者的至少二种hlai类分子的7至11个连续氨基酸的序列;或b.其能够结合受试者的至少二种hlaii类分子的13至17个连续氨基酸的序列;以及(ii)如果上述多肽包含至少一个满足步骤(i)的要求的序列,则预测上述多肽对受试者具有免疫原性;或如果上述多肽不包含满足步骤(i)的要求的至少一种序列,则预测上述多肽对所述受试者不具有免疫原性;或将上述连续氨基酸序列鉴定为对受试者具有免疫原性的多肽片段的序列。使用本领域已知的技术,可以确定将与已知hla结合的表位。可以使用任何合适的方法,条件是使用相同的方法来确定直接比较的多种hla表位结合对。例如,可以使用生化分析。也可以使用已知由给定hla结合的表位列表。还可以使用预测或建模软件来确定哪些表位可以被给定的hla结合。表1中提供l实例。在一些情况下,如果t细胞表位的ic50或预测的ic50小于5000nm,小于2000nm,小于1000nm或小于500nm,则t细胞表位能够与给定hla结合。表1用于确定表位—hla结合的示例软件如本文提供的,通常需要通过个体的多种hla呈递t细胞表位以触发t细胞应答。因此,本公开的方法包括确定多肽是否具有能够结合人类受试者(例如,在模型人类群体中)的至少二种hlai类分子或至少二种hlaii类(pepi2+)分子的t细胞表位的序列。对给定多肽的细胞毒性t细胞应答的最佳预测因子是存在至少一个由个体的三或更多种hlai类分子呈递的t细胞表位(≥1pepi3+)。因此,在一些情况下,该方法包括确定多肽是否具有能够结合特定人类受试者的至少三种hlai类分子的t细胞表位序列。在一些情况下,该方法包括确定多肽是否具有能够结合人类受试者(例如,在模型人类群体中)的仅三种hlai类分子的t细胞表位的序列。辅助性t细胞应答可以通过存在至少一个t细胞表位来预测,该t细胞表位由个体的三种或更多种(≥1pepi3+)或四种或更多种(≥1pepi4+)hlaii类分子呈递。因此,在一些情况下,该方法包括确定多肽是否具有能够结合人类受试者(例如,在模型人类群体中)的至少三种hlaii类分子的t细胞表位的序列。在其他情况下,该方法包括确定多肽是否具有能够结合人类受试者的至少四种hlaii类分子的t细胞表位序列。在其他情况下,该方法包括确定多肽是否具有能够与人类受试者的仅三种及/或仅四种hlaii类分子结合的t细胞表位的序列。在一些情况下,所公开的方法和组合物可用于预测多肽/片段是否将在人类受试者中诱导细胞毒性t细胞应答和辅助性t细胞应答。该多肽/片段包含能够与受试者的多种hlai类分子结合的t细胞表位的氨基酸序列和能够与受试者的多种hlaii类分子结合的t细胞表位的氨基酸序列。hlai类结合表位和hlaii类结合表位可以完全或部分重叠。在一些情况下,可以通过选择能够与受试者的多种(例如至少二种或至少三种)hlai类分子结合的t细胞表位的氨基酸序列来鉴定这种多肽的片段,然后筛选一个或更长的多肽片段,它们在n-及/或c末端延伸以与受试者或群体中高百分比受试者的一种或多种或最可能的(即,当没有合适的hlaii类结合pepi3+可用时)hlaii类分子结合。一些受试者可以具有编码相同hla分子的二个hla等位基因(例如,在纯合性的情况下hla-a*02:25的二个拷贝)。由这些等位基因编码的hla分子结合所有相同的t细胞表位。为了本公开的目的,如本文所用,“与受试者的至少二种hla分子结合”包括在单个受试者中与由二个相同hla等位基因编码的hla分子结合。换句话说,“与受试者的至少二种hla分子的结合”等可以另外表示为“与受试者的至少二个hla等位基因编码的hla分子的结合”。多肽抗原如本文所用,术语“多肽”是指全长蛋白质、蛋白质的一部分、或表征为一串氨基酸的肽。如本文所用,术语“肽”是指包含2、或3、或4、或5、或6、或7、或8、或9、或10、或11、或12、或13、或14、或15至10、或11、或12、或13、或14、或15、或20、或25、或30、或35、或40、或45、或50个氨基酸的短多肽。如本文所用,术语“片段”或“多肽的片段”是指氨基酸串或氨基酸序列,它们相对于上述或一种参考多肽通常具有减少的长度并且在共同部分上包含与参考多肽相同的氨基酸序列。在适当的情况下,根据本公开的这种片段可以包括在其作为组分的较大多肽中。在一些情况下,片段可以包含多肽的全长,例如整个多肽,例如9个氨基酸的肽,是单个t细胞表位。在一些情况下,多肽是或者由全部或部分抗原组成,该抗原由病原生物(例如细菌或寄生虫)、病毒或癌细胞表达,与自身免疫病症或应答或疾病相关细胞相关,或者是过敏原、或药物或药物组合物的成分,例如疫苗或免疫疗法组合物。在一些情况下,本公开的方法包括鉴定或选择合适的多肽,例如下文进一步描述的多肽的初始步骤。多肽或抗原可以在细胞中表达,或在特定或目标人类群体的患病细胞中特异性表达(例如肿瘤相关抗原,由病毒、细胞内细菌或寄生虫表达的多肽,或疫苗或免疫疗法组合物的体内产物),或从环境(例如食物、过敏原或药物)中获得。多肽或抗原可以存在于取自特定或目标人类群体受试者的样本中。多肽抗原和hla都可以通过氨基酸或核苷酸序列精确定义,并使用本领域已知的方法测序。多肽或抗原可以是癌症或肿瘤相关抗原(taa)。taa是在癌症或肿瘤细胞中表达的蛋白质。癌症或肿瘤细胞可以存在于获自特定或目标人类群体的受试者的样本中。taa的实例包括在肿瘤发生过程中表达的新抗原(新抗原)、癌基因和肿瘤抑制基因的产物、过表达或异常表达的细胞蛋白(例如her2、muc1)、致癌病毒(例如ebv、hpv、hcv、hbv、htlv)产生的抗原、癌睾丸抗原(cta)(例如mage家族,ny-eso)和细胞类型特异性分化抗原(例如mart-1)。taa序列可以通过实验、或已发表的科学论文、或公众可获得的数据库找到,如路德维希癌症研究所(www.cta.lncc.br/),癌症免疫数据库(cancerimmunity.org/peptide/)和tantigen肿瘤t细胞抗原数据库(cvc.dfci.harvard.edu/tadb/)。在一些情况下,多肽或抗原在正常健康细胞或组织中不表达或最低限度地表达,但在具有特定疾病或病症(例如癌症类型或衍生自特定细胞类型或组织的癌症,例如乳腺癌、卵巢癌或黑色素瘤)的高比例(高频率)受试者中表达(在那些细胞或组织中)。另一个实例是结肠直肠癌。其他非限制性癌症实例包括非黑色素瘤皮肤癌、肺癌、前列腺癌、肾癌、膀胱癌、胃癌、肝癌、子宫颈癌、食道癌、非霍奇金淋巴瘤、白血病、胰腺癌、子宫体癌、唇癌、口腔癌、甲状腺癌、脑癌、神经系统癌、胆囊癌、喉癌、咽癌、骨髓瘤癌、鼻咽癌、霍奇金淋巴瘤、睾丸癌和卡波西肉瘤。或者,多肽可在正常健康细胞中以低水平表达,但在患病(例如癌症)细胞或患有上述疾病或病症的受试者中以高水平表达(过量表达)。在一些情况下,上述多肽相对于正常健康细胞或受试者在至少2%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或更多的此类个体或受试者匹配的人类亚群或模型或目标群体中以高水平表达。例如,所述群体可以通过种族、地理位置、性别、年龄、疾病、疾病类型或阶段、基因型或一种或多种生物标志物的表达与受试者匹配。在一些情况下,表达频率可以从出版的数字和科学出版物中确定。在一些情况下,本公开的方法包括鉴定或选择这种多肽的步骤。在一些情况下,多肽与癌细胞或实体瘤相关或在癌细胞或实体瘤中高度(过度)表达。示例性的癌症包括癌、肉瘤、淋巴瘤、白血病、生殖细胞肿瘤或母细胞瘤。癌症可以是或不是激素相关或依赖性癌症(例如雌激素或雄激素相关癌症)。肿瘤可以是恶性的或良性的。癌症可以是或不是转移性的。在一些情况下,多肽是癌睾丸抗原(cta)。cta通常不会在健康细胞的胚胎发育之外表达。在健康成人中,cta表达限于不表达hla且不能向t细胞呈递抗原的雄性生殖细胞。因此,当在癌细胞中表达时,cta被认为是表达的新抗原。cta的表达(i)对肿瘤细胞是特异性的,(ii)在转移瘤中比在原发肿瘤中频率更高,以及(iii)在同一患者的转移肿瘤中是保守的(gajewskied.targetedtherapeuticsinmelanoma.springernewyork.2012)。多肽可以是突变的新抗原,其由个体的细胞(例如癌细胞)表达,而在正常或健康细胞中由类似蛋白变异而来。在一些情况下,本公开的方法包括鉴定多肽或者鉴定新表位的步骤,所述多肽是突变新抗原是,或者是特定人类受试者中的突变新抗原。例如,新抗原可以存在于获自受试者的样本中。突变的新抗原或新表位可用于靶向表达上述新抗原或包含新表位的一种新抗原的疾病相关细胞,如癌细胞。可以通过例如测序检测由细胞(例如取自受试者的样本中的细胞)表达的多肽中的突变,但是大多数不诱导针对新抗原表达细胞的免疫应答。目前,鉴定确实诱导免疫应答的突变新抗原是基于预测突变hla限制性表位并进一步体外测试个体血液样本中预测表位的免疫原性。该过程不准确,冗长且昂贵。与多种hla分子结合的突变表位(例如新表位)的鉴定可重复地定义突变新抗原的免疫原性。因此,在根据本公开的一些情况下,多肽是突变的新抗原,并且多肽的免疫原性片段包含新抗原特异性突变(或由新表位组成)。多肽可以是细胞内表达的病毒蛋白。实例包括hpv16e6、e7,hivtat、rev、gag、pol、env,htlv-tax、rex、gag、env、人疱疹病毒蛋白、登革热病毒蛋白。上述多肽可以是细胞内表达的寄生虫蛋白,例如疟疾蛋白。多肽可以是药物组合物的活性成分,例如疫苗或免疫疗法组合物,任选是新药物组合物的候选活性成分。本文所用的术语“活性成分”是指旨在诱导免疫应答的多肽,并且可包括在施用受试者后体内产生的疫苗或免疫疗法组合物的多肽产物。对于dna或rna免疫疗法组合物,多肽可由施用所述组合物的受试者的细胞体内产生。对于基于细胞的组合物,多肽可由所述组合物的细胞加工及/或呈递,例如自体树突细胞或用该多肽脉冲的或包含编码多肽的表达构建体的抗原呈递细胞。药物组合物可包含编码一种或多种活性成分多肽的多核苷酸或细胞。在其他情况下,多肽可以是药物、疫苗或免疫疗法组合物的靶多肽抗原。如果组合物旨在或设计为诱导靶向或针对多肽的免疫应答(例如细胞毒性t细胞应答),则该多肽是靶多肽抗原。靶多肽抗原通常是由病原生物、病毒或患病细胞如癌细胞表达的多肽。靶多肽抗原可以是taa或cta。目前,>200项临床试验正在研究肿瘤抗原的癌症疫苗。多肽可以是通过例如皮肤、肺或口服途径进入个体身体的过敏原。合适多肽的非限制性实例包括表2至表6中的一个或多个中所列的那些。遗传序列可以从生物材料的测序中获得。测序可以通过确定dna及/或rna及/或氨基酸序列的任何合适的方法进行。本公开内容利用hla基因型和氨基酸序列。然而,从个体的遗传序列鉴定hla基因型的方法和获得来自dna或rna序列数据的氨基酸序列的方法不是本公开的主题。预测个体对多肽抗原的免疫应答特异性多肽抗原仅在一小部分人类受试者中诱导免疫应答。目前,还没有能够预测多肽抗原是否可能在个体中诱导免疫应答的诊断测试。特别地,需要一种能够预测人是否是疫苗或免疫疗法组合物的免疫应答者的测试。根据本公开,个体的多肽抗原特异性t细胞应答通过在多肽内存在的一个或多个片段来定义,所述片段可由个体的多种hlai类或多种hlaii类分子呈递。在一些情况下,本公开涉及预测受试者是否将对多肽的施用具有免疫应答的方法,其中根据本文所述的任何方法,如果多肽具有免疫原性,则预测免疫应答。如果多肽包含至少一个氨基酸序列,即能够与受试者的至少二种hlai类分子结合的t细胞表位,则预测细胞毒性t细胞应答。如果多肽包含至少一个氨基酸序列,即能够结合受试者的至少二种ii类hla分子的t细胞表位,则预测辅助性t细胞应答。如果多肽不包含任何氨基酸序列,即能够结合受试者的至少二种hlai类分子的t细胞表位,则不预测细胞毒性t细胞应答。如果多肽不包含任何氨基酸序列,即能够结合受试者的至少二种hlaii类分子的t细胞表位,则不预测辅助性t细胞应答。在一些情况下,上述多肽是药物组合物的活性成分,并且该方法包括预测多肽的抗药物抗体(ada)的发展或产生。药物组合物可以是选自表8中所列那些药物。根据本公开,如果活性成分多肽被受试者的多种hlaii类分子鉴定,或者达到活性成分多肽被受试者的多种hlaii类分子鉴定的程度,将发生ada发展,导致辅助性t细胞应答以支持对活性成分的抗体应答。这些表位(pepi)的存在可以预测受试者中ada的发展。该方法可以进一步包括选择或推荐向受试者施用预期诱导低ada或不诱导ada的药物组合物来治疗人类受试者,并且任选地进一步向受试者施用该组合物。在其他情况下,该方法预测药物组合物将诱导不可接受的ada,并且该方法进一步包括用不同的治疗或疗法选择或推荐或治疗受试者。该多肽可以是检查点抑制剂。该方法可包括预测受试者是否对检查点抑制剂的治疗有应答。表8与ada相关的不良事件相关的示例药物目前还没有能够预测人对疫苗或免疫疗法组合物具有临床应答或从中获得临床益处的可能性的测试。这是很重要的,因为目前在参与疫苗或免疫疗法临床试验的个体组群中测量的t细胞应答与临床应答相关性较差。即,临床应答者亚群基本上小于免疫应答者亚群。因此,为了实现疫苗和免疫疗法的个性化,重要的是不仅预测特定受试者中免疫应答的可能性,还要预测药物诱导的免疫应答是否具有临床疗效(例如可以杀死癌细胞或病原体感染的细胞或病原体)。在疫苗或免疫疗法组合物中存在至少二个可以结合个体的至少三种hlai类(≥2ppi3+)的多肽片段(表位)可以预测临床应答。换句话说,如果可以在疫苗或免疫疗法组合物的活性成分多肽中鉴定出≥2ppei3+,则个体可能是临床应答者。本文所用的“临床应答”或“临床益处”可以是预防或延迟疾病或病症的发作,改善一种或多种症状,诱导或延长缓解,或延迟复发或再发或恶化,或受试者疾病状态的任何其他改善或稳定。在适当的情况下,“临床应答”可以与“实体瘤应答评估标准”(recist)指南中定义的“疾病控制”或“客观应答”相关。在一些情况下,本公开涉及预测受试者是否将对施用药物组合物如包含一种或多种多肽作为活性成分的疫苗或免疫疗法组合物具有临床应答的方法。该方法可以包括确定上述一种或多种多肽是否一起包含至少二种不同的序列,其中每种序列是能够结合该受试者的至少二种,或在一些情况下至少三种hlai类分子的t细胞表位;以及如果上述一种或多种多肽一起包含至少二种不同的序列,其中每种序列是能够结合受试者的至少二种或在一些情况下至少三种hlai类分子的t细胞表位,则预测受试者将对药物组合物的施用具有临床应答;或者,如果一种或多种多肽一起包含不超过一种序列,该序列是能够与受试者的至少二种,或在一些情况下至少三种hlai类分子结合的t细胞表位,则受试者将对药物组合物的施用没有临床应答。为了该方法的目的,如果二个t细胞表位具有不同的序列,并且在一些情况下如果它们具有在靶多肽抗原中重复的相同序列,则它们彼此“不同”。在一些情况下,靶多肽抗原中的不同t细胞表位彼此不重叠。在一些情况下,使用本文所述的方法鉴定对人类受试者具有免疫原性的一种或多种多肽或活性成分多肽的所有片段。鉴定出一种或多种多肽的至少一个片段,即能够与受试者的至少二种或至少三种hlai类分子结合的t细胞表位,预测该多肽将在受试者中引起或可能引起细胞毒性t细胞应答。鉴定出一种或多种多肽的至少一个片段,即能够与受试者的至少二种、或至少三种、或至少四种hlaii类分子结合的t细胞表位,预测该多肽将在受试者中引起或可能引起辅助性t细胞应答。鉴定不出一种或多种多肽中的片段,即能够与受试者的至少二种或至少三种hlai类分子结合的t细胞表位,预测该多肽不会引起或不可能引起受试者中的细胞毒性t细胞应答。鉴定不出一种或多种多肽中的片段,即能够与受试者的至少二种、或至少三种、或至少四种hlaii类分子结合的t细胞表位,预测该多肽在受试者中不会引起或不可能引起辅助性t细胞应答。鉴定出疫苗或免疫疗法组合物的一种或多种活性成分多肽的至少二个片段,其中每个片段是能够与受试者的至少二种或至少三种hlai类分子结合的t细胞表位,预测受试者更可能具有或将具有对组合物的临床应答。鉴定出一种或多种多肽的少于二个片段是能够与受试者的至少二种或至少三种hlai类分子结合的t细胞表位,预测受试者不太可能具有或不具有对组合物的临床应答。不希望受理论的束缚,从包含至少二种多种hla结合pepi的疫苗/免疫疗法中获得临床益处的可能性增加的一个原因是患病细胞群体,例如癌症或肿瘤细胞或被病毒或病原体例如hiv感染的细胞在受影响的受试者内和受影响的受试者之间通常是异源的。例如,特定癌症患者可能表达或可能不表达或过表达疫苗的特定癌症相关靶多肽抗原,或者其癌症可能包含异质细胞群,其中一些(过度)表达抗原,而一些不表达抗原。此外,当通过疫苗/免疫疗法包括或靶向更多的多种hla结合pepi时,产生抗性的可能性降低,因为患者不太可能通过靶pepi的突变产生对组合物的抗性。因此,通过(i)在活性成分多肽中呈递更多的多种hla结合pepi;(ii)在更多靶多肽抗原中呈递pepi;和(iii)靶多肽抗原在受试者或受试者的患病细胞中的(过度)表达增加了受试者对治疗具有应答的可能性。在一些情况下,靶多肽抗原在受试者中的表达可能是已知的,例如如果靶多肽抗原存在于获自受试者的样本中。在其他情况下,可以使用群体表达频率数据来确定特定受试者或特定受试者的患病细胞,(过度)表达靶多肽抗原的特定或任何组合的概率。群体表达频率数据可以涉及受试者及/或疾病匹配的群体或意向治疗的群体。例如,特定癌症相关抗原在特定癌症或患有特定癌症(例如乳腺癌)的受试者中表达的频率或概率可以通过检测肿瘤(例如乳腺癌肿瘤样本)中的抗原来确定。在一些情况下,这种表达频率可以从出版的数字和科学出版物中确定。在一些情况下,本发明的方法包括测定相关群体中相关靶多肽抗原的表达频率的步骤。所公开的是预测个体人类受试者以及人类受试者群体中疫苗的活性/效果的一系列药效学生物标志物。生物标志物已被专门开发用于癌症疫苗,但类似的生物标志物可用于其他疫苗或免疫疗法组合物。这些生物标志物加速了更有效的疫苗开发并且还降低了开发成本,并且可以用于评估和比较不同的组合物。示例性生物标志物如下。·ag95——疫苗效力:癌症疫苗中特异性肿瘤类型以95%概率表达的抗原数量。ag95是疫苗效力的指标,并且不依赖于疫苗抗原的免疫原性。根据肿瘤抗原表达率数据计算ag95。这些数据可以从在同行评审的科学期刊上发表的实验中获得。技术上,ag95由疫苗中抗原的二项式分布确定,并考虑了所有可能的变化和表达率。·pepi3+计数——受试者中疫苗的免疫原性:疫苗衍生的pepi3+是与受试者的至少3种hla结合并诱导t细胞应答的个人表位。可在已知完整4位hla基因型的受试者中使用pepi3+测试来确定pepi3+。·ap计数——受试者中疫苗的抗原性:具有pepi3+的疫苗抗原的数量。疫苗含有来自患病细胞表达的靶多肽抗原的序列。ap计数是疫苗中含有pepi3+的抗原数量,ap计数代表疫苗中可以在受试者中诱导t细胞应答的抗原数量。ap计数表征了受试者的疫苗—抗原特异性t细胞应答,因为其仅依赖于受试者的hla基因型并且独立于受试者的疾病、年龄和药物治疗。正确的值在0(没有抗原呈递pepi)和抗原的最大数量(所有抗原均呈递pepi)之间。·ap50——群体中疫苗的抗原性:群体中具有pepi的疫苗抗原的平均数量。ap50适于在给定群体中表征疫苗—抗原特异性t细胞应答,因为它取决于群体中受试者的hla基因型。·agp计数——受试者中的疫苗效力:具有pepi的肿瘤中表达的疫苗抗原的数量。agp计数表示疫苗鉴定并诱导t细胞应答(击中靶标)的肿瘤抗原的数量。agp计数取决于受试者肿瘤中的疫苗—抗原表达率和受试者的hla基因型。正确的值在0(没有表达抗原呈递的pepi)和抗原的最大数量(所有抗原都表达并呈递pepi)之间。·agp50——群体中癌症的疫苗效力:群体中具有pepi(即agp)的指定肿瘤中表达的疫苗抗原的平均数。agp50表示疫苗诱导的t细胞应答能够鉴定的肿瘤抗原的平均数。agp50取决于所示肿瘤类型中抗原的表达率和目标群体中抗原的免疫原性。agp50可评估不同群体中的疫苗效力,并可用于比较相同群体中的不同疫苗。agp50的计算类似于用于ag50的计算,除了表达通过受试者中表达的疫苗抗原上pepi3+的出现加权。在每个受试者具有来自每种疫苗抗原的pepi的理论群体中,agp50将等于ag50。在另一个理论群体中,其中没有受试者具有来自任何疫苗抗原的pepi,agp50将为0。通常,以下陈述有效:0≤agp50≤ag50。·magp——用于选择可能应答者的候选生物标志物:癌症疫苗诱导针对在指定肿瘤中表达的多种抗原的t细胞应答的可能性。magp由例如肿瘤中疫苗—抗原的表达率和受试者中疫苗衍生的pepi的呈递率来计算。在技术上,基于agp分布,magp是多个agp(≥2agp)的概率之和。上述预测的结果可用于通知医生关于受试者治疗的决定。因此,在一些情况下,多肽是活性成分,例如疫苗或免疫疗法组合物的活性成分,本公开的方法预测受试者将具有、可能具有或具有高于阈值的最小可能性,即对包括向受试者施用活性成分多肽的治疗具有免疫应答及/或临床应答,并且该方法还包括选择用于治疗特定人类受试者的疗法或选择用于治疗特定人类受试者的疫苗或免疫疗法组合物。还提供了用包含一种或多种多肽作为活性成分的受试者特异性药物组合物、试剂盒或多肽组治疗的方法,其中已经确定所述药物组合物、试剂盒或多肽组具有在受试者中诱导临床应答的阈值最小可能性,其中已经使用本文所述的方法确定了应答的可能性。在一些情况下,最小阈值由本文所述的一种或多种药效学生物标志物定义,例如最小pepi3+计数(例如2、3、4、5、6、7、8、9、10、11或12或更多pepi3+),最小agp计数(例如agp=至少2或至少3、4、5、6、7、8、9、10、11或12或更高)及/或最小magp(例如agp=至少2或至少3、4、5、6、7、8、9、10、11或12或更高)。例如,在一些情况下,如果靶向预定数量的靶多肽抗原(任选地其中靶多肽抗原被(预测)表达)的应答的可能性高于预定阈值(例如2、3、4、5、6、7、8、9、10、11或12或更高),则选择受试者进行治疗。或者,该方法可以预测该组合物的一种或多种多肽不会在受试者中引起t细胞应答及/或临床应答,并且还包括为受试者选择不同的治疗。预测对多肽抗原的自身免疫或毒性免疫应答hla之间的差异可能影响受试者因施用给受试者的药物或多肽而经历免疫毒性的可能性。如果施用于受试者的多肽包含对应于在受试者正常健康细胞中表达的抗原片段,并且包含能够结合受试者的多种hlai类分子的t细胞表位的氨基酸的片段,则可能存在毒性免疫应答。因此,根据本公开的一些情况涉及鉴定多肽的毒性免疫原性区域或片段,或鉴定可能响应于一种或多种多肽或其片段的施用而经历免疫毒性的受试者。多肽可以是本文所述疫苗或免疫疗法组合物的活性成分。该方法可以包括确定多肽是否包含能够与受试者的至少二种或在其他情况下与至少三种hlai类分子结合的t细胞表位的序列。在一些情况下,该方法包括确定多肽包含能够与受试者的至少四种或至少五种hlai类分子结合的t细胞表位的序列;或者是能够与受试者的至少四种、或至少五种、或至少六种或至少七种hlaii类分子结合的t细胞表位的氨基酸序列。该方法可进一步包括将所述序列鉴定为对受试者具有毒性免疫原性或预测受试者中的毒性免疫应答。在其他情况下,没有鉴定出这样的氨基酸序列,并且该方法还包括预测受试者中没有毒性免疫应答。该方法还可以包括选择或推荐施用一种或多种多肽或预测不诱导免疫毒性或低免疫毒性的药物组合物治疗受试者,并且任选地通过施用多肽进一步治疗受试者。本公开还提供了通过向受试者施用这种多肽或组合物来治疗有需要的受试者的方法。在一些情况下,本文所述的方法还包括突变多肽,该多肽被预测对受试者具有免疫原性,或被预测在人类群体中一定比例的受试者中具有免疫原性。还提供了降低多肽的免疫原性的方法,该多肽已经在如本文所述的受试者或一定比例的人类群体中被鉴定为具有免疫原性。可以对多肽进行突变以减少多肽中pepi的数量,或减少受试者或群体的hlai类或ii类分子的数量,所述hlai类或ii类分子与受试者或一定比例的的群体中鉴定为免疫原性的多肽片段结合。在一些情况下,突变可以减少或阻止毒性免疫应答,或者可以通过阻止受试者中或一定比例的群体中的ada发展来增加效力。可以进一步选择或推荐突变的多肽用于治疗受试者或所述群体的受试者。可以通过施用突变的多肽进一步治疗受试者。本公开还提供了通过向受试者施用这种突变的多肽来治疗有此需要的受试者的方法。预测人类群体对多肽抗原的免疫应答本文所述的方法可用于预测更广泛的人类群体对施用一种或多种多肽或包含一种或多种多肽的组合物的应答或应答率。在一些情况下,可以针对多个人类受试者重复本公开的方法以预测这些受试者中的应答或应答率。在其他情况下,可以针对受试者的相关样本或模型群体中的每个受试者重复本公开的方法,并且该结果用于预测或定义由样本或模型群体代表的更广泛的人类群体中的应答或应答率。样本/模型群体可能与治疗药物组合物的意向群体相关。相关群体是代表或类似于预期用药物组合物治疗的群体。在一些情况下,样本/模型群体代表整个人类种族。在其他情况下,例如通过种族、地理位置、性别、年龄、疾病或癌症、疾病或癌症类型或阶段、基因型、一种或多种生物标志物的表达,部分通过hla基因型(例如受试者具有一种或多种特定hla等位基因),样本/模型群体可能与更广泛的群体(亚群)疾病或受试者匹配。例如,样本/模型群体可以具有hlai类及/或ii类基因组,其代表在世界群体中,或在具有来自特定地理位置的特定疾病或病症、或种族背景、或具有特定疾病相关生物标志物(例如,乳腺癌疫苗的brca突变的妇女)的受试者中发现的那些。在一些情况下,样本/模型群体通过hla多样性及/或hla频率代表至少70%、或75%或80%或84%或85%或86或90%或95%的更广泛群体。该方法可以包括选择或定义相关样本或模型群体的步骤。样本/模型群体中的每个受试者最低限度地由其hlai类或ii类基因型,例如完整的4位hlai类基因型来定义。关于样本/模型群体的hla基因型的数据可被存储或记录在数据库中或从数据库中检索,或者可以是计算机模拟(insilico)模型人类群体。在一些情况下,本文所述的方法可用于进行计算机临床试验,该试验预测给定药物(例如疫苗或免疫疗法组合物)的群体中免疫应答者的比例或临床应答者的比例。这对于预先选择可能具有高效力的药物进行临床试验是有用的。个体群体或个体亚群可包括用药物进行的计算机模拟临床试验的研究组群。研究组群中的每个个体都以其hla基因型为特征。可以计算研究组群中具有衍生自药物多肽的≥1pepi2+、或≥1pepi3+、或≥1pepi4+、或≥1pepi5+的个体在药物多肽中的比例。为了本公开的目的,我们将其称为“pepi评分”。除非另有说明,“pepi评分”具体指≥1pepi3+评分。该pepi评分预测在相关受试者组群中用相同药物进行的临床试验中具有t细胞应答的受试者的比例。本公开提供了对具有一种或多种多肽活性成分的疫苗或免疫疗法组合物进行计算机模拟试验的方法。计算机模拟试验可预测人类群体的细胞毒性t细胞应答率。该方法可以包括:(i)选择或定义包含各自由hlai类基因型定义的多个受试者的计算机模拟模型人类群体,其中该计算机模拟模型人类群体可以对应于或代表或相关于意向治疗的人类群体,在所述人类群体中将预测细胞毒性t细胞应答率;(ii)确定计算机模拟模型人类群体的每个受试者一种或多种活性成分多肽是否包含至少一种序列,即pepi2+、pepi3+、pepi4+或pepi5+(取决于所述多肽组合物的大小、给药途径和佐剂);以及(iii)预测(所述人类群体的)细胞毒性t细胞应答率,其中满足步骤(ii)要求的更高比例的计算机模拟模型人类群体预测更高的细胞毒性t细胞应答率。符合步骤(ii)要求的计算机模拟人类模型群体的比例可以与意向治疗群体中的预测应答率相关或对应。现有技术的临床试验尚未证实hla限制性表位的呈递与免疫应答率及/或临床应答率之间的相关性。这就提出了有关免疫疗法作用机制的问题。本文提供的实例显示,对于临床上有意义的应答,例如针对异质性肿瘤,可能需要针对多个靶标的细胞毒性t淋巴细胞(ctl)的激活。迄今为止,临床试验中报告的ctl应答既没有考虑多个靶标也没有考虑多种hla。例如,靶向二种抗原(酪氨酸酶和gp100)的黑色素瘤肽疫苗在52%的患者中引起ctl应答,但只有12%具有临床益处。使用433名受试者的计算机模拟模型群体,我们确定≥1pepi3+评分为42%(在42%中,可以鉴定至少一种疫苗衍生的表位,其可以由受试者的至少三种hlai类分子呈递)和≥2pepi3+评分为6%(在6%中,可以鉴定至少二种疫苗衍生的表位,其可以由受试者的至少三种hlaii类分子呈递)。这解释了为什么临床研究者在他们的试验中没有发现ctl应答率和临床应答率之间的相关性:疫苗中的肽在试验中表现较差,因为只有少数患者中二种不同的疫苗肽都能激活ctl应答。临床试验结果与我们的计算机模拟试验结果之间的差异是基于不同的群体,因为每个群体的受试者具有不同的hla基因型。然而,由计算机模拟试验对模型群体提供的应答率结果是对临床试验群体中的应答率结果的良好预测。因此,本文公开了对具有一种或多种活性成分多肽的疫苗或免疫疗法组合物进行计算机模拟试验的方法。计算机模拟试验可预测人类群体的临床应答率。该方法可以包括(i)选择或定义包括由hlai类基因型定义的多个受试者的模型人类群体,其中计算机模拟模型人类群体可以对应于或代表其中预测临床应答率的所述人类群体(与意向治疗群体相关);(ii)针对计算机模拟模型人类群体中的每个受试者确定所述一种或多种活性成分多肽是否包含至少二种不同的序列,其中每种序列是能够结合至所述受试者的至少三种、或至少四种、或至少五种hlai类分子的t细胞表位;以及(iii)预测(所述人类群体的)临床应答率,其中满足步骤(ii)的要求的更高比例的所述计算机模拟模型人类群体预测更高的临床应答率。符合步骤(ii)要求的计算机模拟模型人类群体的比例可以与意向治疗群体中的预测应答率相关或对应。等效方法用来预测,例如,人类群体(或亚群)对施用多肽或包含一种或多种多肽作为活性成分的药物组合物的免疫毒性率、检查点抑制剂应答率、ada发展率或辅助性t细胞应答率。在一些情况下,可以对一种或多种其他多肽或其片段或疫苗或药物或免疫疗法组合物重复该方法。多肽、片段或组合物可以根据它们在所述人类群体中的预测应答率进行分级。该方法可用于为意向治疗人类群体选择最有效或最安全的多肽药物。药物组合物的设计和制备在一些方面,本公开提供了一种设计或制备多肽或编码多肽的多核酸的方法,所述多肽或多核酸用于在人类受试者中(例如在目标或意向治疗群体中)诱导免疫应答、细胞毒性t细胞应答或辅助性t细胞应答。本公开还提供了一种免疫原性组合物或药物组合物、试剂盒或多肽组,设计或制备它们的方法,可通过这些方法获得的组合物,以及它们在诱导受试者中的免疫应答、细胞毒性t细胞应答或辅助性t细胞应答的方法中的用途,或对受试者进行治疗、疫苗接种或提供免疫疗法的方法中的用途。该方法涉及鉴定及/或选择在整个目标群体中与个体受试者的多种,例如至少三种hlai类分子以高频率结合的t细胞表位,以及设计或/或制备包含一种或多种这样的表位(pepi3+)的多肽。这种高频群体pepi3+在本文中可以称为“bestepi”。根据本公开,bestepi在特定或目标人类群体中的高比例人类受试者中诱导免疫应答。所述多肽可以是用于治疗特定或目标人类群体的受试者的方法中,药物组合物、试剂盒或多肽组中的活性成分。组合物/试剂盒可以任选地更包括至少一种药学上可接受的稀释剂、载体或防腐剂及/或不包含任何bestepi的额外多肽。多肽可以是工程化的或非天然存在的。试剂盒可以包括一个或多个单独的容器,每个容器含有一种或多种活性成分肽。组合物/试剂盒可以是预防、诊断、缓解、治疗或治愈个体疾病如癌症的个性化药物。在一些情况下,bestepi能够结合样本或模型群体中高百分比受试者的多种,例如至少三种hlai类及/或至少三种hlaii类分子,如本文所述。在一些情况下,“高”百分比可以是至少或大于1%、2%、5%、10%、12%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%或50%的人类受试者的相关群体或亚群。在一些情况下,“高”百分比是相对于具有其他pepi3+的群体中受试者的百分比。例如,pepi3+在群体中可能是最常见的,或在一种或多种参照靶多肽抗原中,频率超过所有pepi3+及/或pepi4+及/或pepi4+中的50%、或55%或60%或65%或70%或75%或80%或85%或90%或95%或97%或99%。在一些情况下,考虑靶多肽抗原在特定或目标群体的受试者中表达的可能性,以确定bestepi诱导靶向由特定或目标人类群体的受试者表达的多肽抗原的免疫应答的总体可能性。在一些情况下,预测bestepi表达相关靶多肽抗原和多种,例如至少三种hlai类分子或至少三种hlaii类分子,其能够在至少或超过1%、2%、5%、10%、12%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%或50%的相关人类受试者群体中结合bestepi。在一些情况下,任选地来自一种或多种靶多肽抗原的多个t细胞表位/pepi3+可以通过具有能够结合每个片段的多种,例如至少三种hlai类或至少三种hlaii类分子的模型或意向治疗群体中受试者的百分比来分级;或者通过预测表达包含该片段的靶多肽抗原和能够与该片段结合的多种,例如至少三种hlai类分子或至少三种hlaii类分子的模型或意向治疗群体中受试者的百分比来分级。肽或组合物可以被设计成包含一种或多种基于分级进行选择的pepi3+。通常,每个bestepi是靶多肽抗原的片段,且包含一个或多个bestepi的多肽是用于治疗、疫苗接种或免疫疗法的靶多肽抗原。该方法可以包括鉴定一种或多种合适的靶多肽抗原的步骤。通常,每个靶多肽抗原将与相同的疾病或病症、病原生物或病原生物体或病毒的组、或癌症类型相关。组合物、试剂盒或组可包含,或者该方法可包含为每个bestepi选择靶多肽抗原(例如本文所述的多肽)的至多50、45、40、35、30、25、20、19、18、17、16、15、14、13、12、11、10或9个连续氨基酸的序列。所述连续氨基酸包含bestepi的氨基酸序列。在一些情况下,氨基酸序列通过不是靶多肽抗原的连续序列的一部分的额外氨基酸侧接于n末端及/或c末端。在一些情况下,序列通过至多41或35或30或25或20或15或10、或9或8或7或6或5或4或3或2或1个额外氨基酸侧接于n末端及/或c末端或靶多肽片段之间。在其他情况下,每种多肽或者由靶多肽抗原的片段组成,或者由单肽中首尾相连排列(首尾相连排列在肽中)或者重叠的二或更多个这样的片段组成(其中二或更多个片段包含部分重叠的序列,例如其中相同多肽中的二个bestepi在彼此的50个氨基酸内)。当不同多肽的片段或来自相同多肽的不同区域的片段在工程化肽中连接在一起时,在连接处(join)或接头处(junction)周围可能产生新表位。这样的新表位包括来自连接处或接头处二侧的每个片段的至少一个氨基酸,并且在本文中可以称为连接氨基酸序列。该新表位可诱导针对健康细胞的不希望的t细胞应答(自身免疫)。可以设计肽、或者可以筛选多肽,以避免、消除或最小化对应于在正常健康人类细胞中表达的蛋白质片段的新表位及/或能够结合受试者的至少二种、或在一些情况下至少三种、或至少四种hlai类分子,或在一些情况下至少二种、或至少三种、四种或五种hlaii类分子的新表位。在一些情况下,设计上述肽或筛选上述多肽以消除具有连接新表位的多肽,该连接新表位能够在特定、目标或模型群体中超过阈值百分比的人类受试者中与所述群体的个体受试者表达的至少二种hlai类分子结合。在一些情况下,阈值是所述群体的30%、或20%、或15%、或10%、或5%、或2%、或1%、或0.5%。本公开的方法可用于鉴定或筛选本文所述的新表位。可以使用已知方法如blast算法确定比对。用于进行blast分析的软件可通过美国国家生物技术信息中心(nationalcenterforbiotechnologyinformation)(http://www.ncbi.nlm.nih.gov/)公开获得。组合物多肽的至少二个bestepi既可以靶向单一抗原(例如多肽疫苗,其包含衍生自单一抗原,例如通过疫苗/免疫疗法靶向的肿瘤相关抗原的二个多种hla结合pepi),也可以靶向不同的抗原(例如多肽疫苗,其包含衍生自一种抗原(例如肿瘤相关抗原)的一个多种hla结合pepi,和衍生自不同抗原(例如不同的肿瘤相关抗原)的第二个多种hla结合pepi,二者均由疫苗/免疫疗法靶向)。在一些情况下,活性成分多肽一起包含或该方法包括选择总计或至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39或40个或更多个不同的bestepi。bestepi可以是一个或多个不同靶多肽抗原的片段。通过鉴定对目标群体中的高比例受试者具有免疫原性的每种靶多肽抗原的特异性片段,有可能将多个这样的片段,任选地来自多个不同的靶多肽抗原,掺入打算组合使用的单个活性成分多肽或多个活性成分多肽中,或使可被一种或多种特定长度的多肽激活的t细胞克隆的数量最大化。目前大多数疫苗和免疫疗法组合物仅靶向单一多肽抗原。然而,根据本公开,在一些情况下,提供靶向二或更多种不同多肽抗原的药物组合物或活性成分多肽是有益的。例如,大多数癌症或肿瘤是异质性的,意味着受试者的不同癌症或肿瘤细胞(过度)表达不同的抗原。不同癌症患者的肿瘤细胞也表达肿瘤相关抗原的不同组合。最可能有效的抗癌免疫原性组合物是靶向个体人类受试者或群体中肿瘤表达的多种抗原并因此靶向更多癌症或肿瘤细胞的那些。可通过下文实例15和16中描述的个性化疫苗多肽来说明在单一治疗(施用一起包含多个pepi的一种或多种药物组合物)中组合多种bestepi的有益效果。卵巢癌中的示例性cta表达概率如下:bage:30%;magea9:37%;magea4:34%;magea10:52%。如果用只包含bage和magea9中pepi的疫苗治疗患者xyz,那么具有magp(具有pepi的多种表达抗原)的概率将是11%。如果用只包含magea4和magea10cta中pepi的疫苗治疗患者xyz,那么具有magp的概率将是19%。然而,如果疫苗含有所有4种这些cta(bage、magea9、magea4和magea10),那么具有magp的概率将是50%。换句话说,对于二种pepi治疗,效果将大于magp的组合概率(bage/mage的概率magp,加上magea4和magea10的概率magp)。实例15中描述的患者xyzspit疫苗含有另外9种pepi,因此具有magp的概率超过99.95%。同样,乳腺癌中的示例性cta表达概率如下:magec2:21%;magea1:37%;spc1:38%;magea9:44%。用只包含magec2:21%和magea1中pepi的疫苗治疗患者abc的magp概率为7%。用只包含spc1:38%和magea9中pepi的疫苗治疗患者abc的magp概率为11%。用包含magec2:21%;magea1:37%;spc1:38%;magea9中pepi的疫苗治疗患者abc的magp概率为44%(44>7+11)。实例16中描述的患者abc的pit疫苗含有另外8种pepi,因此具有magp的概率超过99.93%。因此,在一些情况下,活性成分多肽的bestepi来自二或更多种不同的靶多肽抗原,例如与特定疾病或病症相关的不同抗原,例如不同的癌症或肿瘤相关抗原或由靶病原体表达的抗原。在一些情况下,pepi来自总计或至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39或40种或更多种不同的靶多肽抗原。不同的靶多肽抗原可以是可用于靶向或可以用不同的pepi3+选择性靶向的任何不同的多肽。在一些情况下,不同的靶多肽抗原是非同源物或非旁系同源物,或者在每个多肽的全长上具有小于95%、或90%、或85%或80%或75%或70%或60%或50%的序列同一性。在一些情况下,不同的多肽是不共享任何pepi3+的那些。或者,在一些情况下,当pepi3+与活性成分多肽靶向的其他多肽抗原不共享时,pepi3+来自不同的靶多肽抗原。在一些情况下,一个或多个或每个免疫原性多肽片段来自存在于取自人类受试者(例如,目标群体)的样本中的多肽。这表明多肽在受试者中表达,例如受试者癌细胞表达的癌症或肿瘤相关抗原或癌睾丸抗原。在一些情况下,一种或多种或每种多肽是受试者的突变新抗原或表达新抗原。一个或多个或每个片段可包含新抗原特异性突变。在其他情况下,一种或多种或每种免疫原性多肽片段来自靶多肽抗原,如上所述,所述靶多肽抗原通常不在正常健康细胞或组织中表达或最低限度地表达,但在患有特定疾病或病症的受试者的高比例(以高频率)或患病细胞中表达。该方法可以包括鉴定或选择这样的靶多肽抗原。在一些情况下,二或更多种或每种免疫原性多肽片段/bestepi来自不同的癌症或肿瘤相关抗原,它们各自在患有癌症类型或来自特定细胞类型或组织的癌症的受试者中以高频率(过度)表达。在一些情况下,免疫原性多肽片段来自总计或至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39或40种不同的癌症或肿瘤相关多肽。在一些情况下,一种或多种或每种或至少一种、至少二种、至少三种、至少四种、至少五种或至少六种或至少七种多肽选自表2至表7中任一项列出的抗原。在一些情况下,一种或多种或每种靶多肽抗原是癌睾丸抗原(cta)。在一些情况下,免疫原性多肽片段/bestepi来自至少1、或至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25种cta,或来自总计3种或更多种不同的靶多肽抗原。任选地其中1、2或所有3种或至少3种是cta,或来自4种或更多种不同的多肽抗原,任选地其中1、2、3或所有4种或至少1、2、3或4种是cta,或来自5种或更多种不同的多肽抗原,任选地其中1、2、3、4或所有5种或至少1、2、3、4或5种是cta,或来自6种或更多种不同的多肽抗原,任选地其中1、2、3、4、5种或所有6种或至少1、2、3、4、5或6种是cta,或来自7种或更多种不同的多肽抗原,任选地其中1、2、3、4、5、6或全部7或至少1、2、3、4、5、6或7种是cta,或来自8种或更多种不同多肽抗原,任选地其中1、2、3、4、5、6、7或全部8或至少1、2、3、4、5、6、7或8是cta。在一些情况下,一种或多种或每种靶多肽抗原由细菌、病毒或寄生虫表达。在一些情况下,一种或多种多肽片段包含一种作为t细胞表位的氨基酸序列,该t细胞表位能够结合群体受试者中高百分比受试者的至少二种或至少三种hlai类分子;且一种或多种多肽片段包含一种作为t细胞表位的氨基酸序列,该t细胞表位能够结合群体受试者中高百分比受试者的至少二种、或至少三种、或至少四种hlaii类分子,其中结合hlai类和hlaii类分子的片段可以任选地重叠。通过这种方法制备的组合物可在受试者中引起细胞毒性t细胞应答和辅助性t细胞应答。免疫原性和药物组合物、治疗方法和给药方式在一些方面,本公开涉及具有一种或多种多肽作为活性成分的上述的药物组合物、试剂盒或多肽组。这些可以用于诱导免疫应答、治疗、疫苗接种或向受试者提供免疫疗法的方法中,并且药物组合物可以是疫苗或免疫疗法组合物。这种治疗包括向受试者施用一种或多种多肽或药物组合物,所述多肽或药物组合物一起包含治疗中所有的活性成分多肽。多种多肽或药物组合物可以一起或顺序施用,例如所有的药物组合物或多肽可以在1年、或6个月、或3个月、或60或50或40或30天内施用给受试者。除了一种或多种免疫原性肽之外,本文所述的免疫原性或药物组合物或试剂盒还可包含药学上可接受的赋形剂、载体、稀释剂、缓冲剂、稳定剂、防腐剂、佐剂或本领域技术人员熟知的其他物质。这些物质优选是无毒的,并且优选不干扰活性成分的药物活性。药物载体或稀释剂可以是例如含水溶液。载体或其他物质的确切性质可取决于给药途径,例如口服途径、静脉途径、皮肤或皮下途径、鼻内途径、肌内途径、皮内途径和腹膜内途径。本公开的药物组合物可以包含一种或多种“药学上可接受的载体”。这些载体通常是大的、代谢缓慢的大分子,例如蛋白质、糖、聚乳酸、聚乙醇酸、聚合氨基酸、氨基酸共聚物、蔗糖(paolettietal.,2001,vaccine,19:2118)、海藻糖(wo00/56365)、乳糖和脂质聚集体(例如油滴或脂质体)。这些载体是本领域普通技术人员公知的。药物组合物还可以含有稀释剂,如水、盐水、甘油等。另外,可以存在辅助物质,例如润湿剂或乳化剂、ph缓冲物质等。无菌无热原的磷酸盐缓冲生理盐水是典型的载体(gennaro,2000,remington:thescienceandpracticeofpharmacy,20thedition,isbn:0683306472)。本公开的药物组合物可以是冻干的或水性形式,即溶液或悬浮液。这种类型的液体制剂允许组合物直接以它们的包装形式给药,而不需要在水性介质中重构,因此是注射的理想选择。药物组合物可以存在于小瓶中,或者它们可以存在于预填充的注射器中。注射器可以带有或不带针头。注射器包括单剂量,而小瓶可包括单剂量或多剂量。本公开的液体制剂还适于从冻干形式重构其他药物。当药物组合物用于这种临时重构时,本公开提供了一种试剂盒,其可以包括二个小瓶,或者可以包括一个预填充的注射器和一个小瓶,注射器的内容物用于在注射之前重构小瓶的内容物。本公开的药物组合物可以包括抗微生物剂,特别是当以多剂量形式包装时。可以使用抗微生物剂,例如2-苯氧基乙醇或对羟基苯甲酸酯(对羟基苯甲酸甲酯、对羟基苯甲酸乙酯、对羟基苯甲酸丙酯)。任何防腐剂优选以低水平存在。防腐剂可以外源加入及/或可以是混合形成组合物的大量抗原的组分(例如作为防腐剂存在于百日咳抗原中)。本公开的药物组合物可以包含洗涤剂,例如,吐温(聚山梨醇酯)、dmso(二甲基亚砜)、dmf(二甲基甲酰胺)。洗涤剂通常以低水平存在,例如<0.01%,但也可以以更高水平使用,例如0.01–50%。本公开的药物组合物可以包括溶液中的钠盐(例如氯化钠)和游离磷酸根离子(例如通过使用磷酸根缓冲液)。在某些实施例中,可以将药物组合物包封在合适的载体中以将肽递送到抗原呈递细胞中或增加稳定性。如本领域技术人员将理解的,多种载体适用于递送本公开的药物组合物。合适的结构化流体递送系统的非限制性实例可包括纳米颗粒、脂质体、微乳液、胶束、树枝状聚合物和其他含磷脂的系统。将药物组合物掺入递送载体的方法是本领域已知的。为了增加组合物的免疫原性,药物组合物可以包含一种或多种佐剂及/或细胞因子。合适的佐剂包括铝盐如氢氧化铝或磷酸铝,但也可以是钙、铁或锌的盐,或者可以是酰化酪氨酸或酰化糖的不溶性悬浮液,或者可以是阳离子或阴离子衍生的糖、聚磷腈、生物可降解的微球、单磷酰脂质a(mpl)、脂质a衍生物(例如毒性降低)、3-o-脱酰化单磷酰脂质a(3d-mpl)、quila、皂苷、qs21、弗氏不完全佐剂(difco实验室,密歇根州底特律市)、merck佐剂65(默克公司,新泽西州罗威市)、as-2(史克必成公司,宾夕法尼亚州费城)、cpg寡核苷酸、生物粘合剂和粘膜粘着剂、微粒、脂质体、聚氧乙烯醚制剂、聚氧乙烯酯制剂、胞壁酰肽或咪唑并喹诺酮化合物(例如咪喹莫特及其同系物)。适合用作本公开的佐剂的人免疫调节剂包括细胞因子,例如白细胞介素(例如il-1、il-2、il-4、il-5、il-6、il-7、il-12等),巨噬细胞集落刺激因子(m-csf)、肿瘤坏死因子(tnf)、粒细胞巨噬细胞集落刺激因子(gm-csf)也可用作佐剂。在一些实施例中,所述组合物包含佐剂,选自于由montanideisa-51(赛比克公司,美国新泽西州费尔菲尔德)、qs-21(安奎拉(aquila)生物制药公司,美国马萨诸塞州列克星敦)、粒细胞—巨噬细胞集落刺激因子(gm-csf)、环磷酰胺、卡介苗(bcg)、短小棒状杆菌(corynbacteriumparvum)、左旋咪唑、azimezone、异丙吡酮、二硝基氯苯(dncb)、匙孔血蓝蛋白(klh)、弗氏佐剂(完全和不完全)、矿物凝胶、氢氧化铝、溶血卵磷脂、复合多元醇(pluronicpolyols)、聚阴离子、油乳剂、二硝基苯酚、白喉毒素(dt)所组成的群组。例如,细胞因子可为选自于由,例如但不限于tgf-β和tgf-β的转化生长因子(tgf)、胰岛素样生长因子-i及/或胰岛素样生长因子-ii、促红细胞生成素(epo)、骨诱导因子,例如但不限于干扰素-α、干扰素-β和干扰素-γ的干扰素,例如但不限于巨噬细胞集落刺激因子、粒细胞—巨噬细胞集落刺激因子和粒细胞集落刺激因子的集落刺激因子,所组成的群组。在一些实施例中,细胞因子可为选自于由,神经生长因子如ngf-β、血小板生长因子、例如但不限于tgf-α和tgf-β的转化生长因子、胰岛素样生长因子-i和胰岛素样生长因子-ii、促红细胞生成素、骨诱导因子,例如但不限于ifn-α、ifn-β和ifn-γ的干扰素(ifn),例如巨噬细胞集落刺激因子、粒细胞—巨噬细胞集落刺激因子和粒细胞集落刺激因子的集落刺激因子,例如但不限于il-1、il-1α、il-2、il-3、il-4、il-5、il-6、il-7、il-8、il-9、il-10、il-11、il-12、il-13、il-14、il-15、il-16、il-17、il-18的白介素(ii)、lif、试剂盒-配体或flt-3、血管抑素;血小板反应蛋白;内皮抑素;肿瘤坏死因子(tnf),以及lt,所组成的群组。预期佐剂或细胞因子可以以每剂量约0.01mg至约10mg的量加入,优选以每剂量约0.2mg至约5mg的量加入。或者,佐剂或细胞因子的浓度可以是约0.01至50%,优选约2%至30%。在某些方面,本公开的药物组合物通过根据已知技术在适当的无菌条件下将佐剂及/或细胞因子与pepi物理混合以产生最终产物来制备。esseku&adeye(2011)和vandenmooterg(2006)中提供了多肽片段的合适组合物和施用方法的实例。疫苗和免疫疗法组合物的制备一般描述于《疫苗设计》(“thesubunitandadjuvantapproach”(edspowellm.f.&newmanm.j.(1995)plenumpressnewyork)中。fullerton在美国专利4,235,877中描述了脂质体内的包封,这也是可设想的。在一些实施例中,本文公开的组合物被制备为核酸疫苗。在一些实施例中,核酸疫苗是dna疫苗。在一些实施例中,dna疫苗或基因疫苗包含具有启动子和合适的转录和翻译控制元件的质粒以及编码本公开的一种或多种多肽的核酸序列。在一些实施例中,质粒还包括增强例如表达水平、细胞内靶向或蛋白酶体加工的序列。在一些实施例中,dna疫苗包含含有编码本公开的一种或多种多肽的核酸序列的病毒载体。在另外的方面,本文公开的组合物包含一种或多种编码经测定与生物样本具有免疫反应性(immunoreactivity)的肽的核酸。例如,在一些实施例中,组合物包含编码1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或更多种肽的一个或多个核苷酸序列,所述肽包含能够结合患者的至少三种hlai类分子及/或至少三种hlaii类分子的t细胞表位片段。在一些实施例中,肽衍生自在癌症中表达的抗原。在一些实施例中,dna或基因疫苗还编码免疫调节分子以操纵产生的免疫应答,例如增强疫苗效力、刺激免疫系统或减少免疫抑制。增强dna或基因疫苗免疫原性的策略包括异种抗原的编码,抗原与激活t细胞或触发缔合识别分子的融合,用dna载体引发、然后用病毒载体加强,以及免疫调节分子的利用。在一些实施例中,dna疫苗通过针头、基因枪、气溶胶注射器、贴片、微针、磨擦以及其他形式导入。在一些形式中,将dna疫苗掺入脂质体或其他形式的纳米抗体中。在一些实施例中,dna疫苗包括递送系统,选自于由转染剂、鱼精蛋白、鱼精蛋白脂质体、多糖颗粒、阳离子纳米乳液、阳离子聚合物、阳离子聚合物脂质体、阳离子纳米颗粒、阳离子脂质和胆固醇纳米颗粒、阳离子脂质、胆固醇和peg纳米颗粒、树枝状聚合物纳米颗粒所组成的群组。在一些实施例中,dna疫苗通过吸入或摄取施用。在一些实施例中,将dna疫苗导入血液、胸腺、胰腺、皮肤、肌肉、肿瘤或其他部位。在一些实施例中,本文公开的组合物被制备为rna疫苗。在一些实施例中,rna是非复制mrna或病毒来源的自扩增rna。在一些实施例中,非复制mrna编码本文公开的肽,并含有5′和3′非翻译区(utr)。在一些实施例中,病毒来源的自扩增rna不仅编码本文公开的肽,而且编码能够进行细胞内rna扩增和大量蛋白质表达的病毒复制机制。在一些实施例中,将rna直接导入个体。在一些实施例中,rna在体外化学合成或转录。在一些实施例中,使用t7、t3或sp6噬菌体rna聚合酶从线性dna模板产生mrna,所得产物含有编码本文公开的肽的可读框、侧翼utr、5′帽和poly(a)尾。在一些实施例中,使用痘苗病毒加帽酶或通过掺入合成帽或抗逆转录帽类似物,在转录反应期间或之后添加各种形式的5′帽。在一些实施例中,将poly(a)尾的最佳长度直接从编码dna模板或通过使用poly(a)聚合酶添加到mrna中。rna编码一种或多种肽,所述肽包含能够结合患者的至少三种hlai类分子及/或至少三种hlaii类分子的t细胞表位的片段。在一些实施例中,所述片段衍生自在癌症中表达的抗原。在一些实施例中,rna包括增强稳定性和翻译的信号。在一些实施例中,rna还包括增加半衰期的非天然核苷酸或改变免疫刺激谱的修饰核苷。在一些实施例中,rna通过针头、基因枪、气溶胶注射器、贴片、微针、磨擦以及其他形式导入。在一些形式中,将rna疫苗掺入脂质体或其他形式的纳米抗体中,所述纳米抗体促进rna的细胞摄取并保护其免于降解。在一些实施例中,rna疫苗包括递送系统,选自于由转染剂、鱼精蛋白、鱼精蛋白脂质体、多糖颗粒、阳离子纳米乳液、阳离子聚合物、阳离子聚合物脂质体、阳离子纳米颗粒、阳离子脂质和胆固醇纳米颗粒、阳离子脂质、胆固醇和peg纳米颗粒、树枝状聚合物纳米颗粒,及/或裸mrna、体内电穿孔的裸mrna、鱼精蛋白复合mrna、与带正电荷的水包油阳离子纳米乳液相关的mrna、与化学修饰的树枝状聚合物缔合并与聚乙二醇(peg)-脂质复合的mrna、peg-脂质纳米颗粒中的鱼精蛋白复合的mrna、与阳离子聚合物例如聚乙烯亚胺(pei)缔合的mrna、与阳离子聚合物如pei和脂质组分缔合的mrna、与多糖(例如壳聚糖)颗粒或凝胶缔合的mrna、阳离子脂质纳米颗粒(例如,1,2-二油酰氧基-3-三甲基铵丙烷(dotap)或二油酰磷脂酰乙醇胺(dope)脂质)中的mrna、与阳离子脂质和胆固醇复合的mrna,或与阳离子脂质/胆固醇和peg-脂质复合的mrna所组成的群组。在一些实施例中,rna疫苗通过吸入或摄取施用。在一些实施例中,将rna导入血液、胸腺、胰腺、皮肤、肌肉、肿瘤或其他部位,及/或通过皮内、肌内、皮下、鼻内、结节内、静脉内、脾内、肿瘤内或其他递送途径。多核苷酸或寡核苷酸组分可以是裸核苷酸序列或与阳离子脂质、聚合物或靶向系统组合。它们可以通过任何可用的技术递送。例如,多核苷酸或寡核苷酸可以通过针注射导入,优选皮内、皮下或肌内。或者,可以使用递送装置如颗粒介导的基因递送将多核苷酸或寡核苷酸直接递送穿过皮肤。多核苷酸或寡核苷酸可以局部施用于皮肤或粘膜表面,例如通过鼻内、口服或直肠内施用。多核苷酸或寡核苷酸构建体的摄取可以通过几种已知的转染技术增强,例如那些包括使用转染剂的技术。这些试剂的实例包括阳离子试剂,例如磷酸钙和deae-葡聚糖以及脂质转染剂,例如lipofectam和transfectam。可以改变施用的多核苷酸或寡核苷酸的剂量。施用通常为“预防有效量”或“治疗有效量”(视情况而定,尽管预防可被视为治疗),这足以导致临床应答或对个体显示临床益处,例如预防或延迟疾病或病症发作、改善一种或多种症状、诱导或延长缓解或延迟复发或再发的有效量。剂量可以根据各种参数,特别是根据所使用的物质,待治疗个体的年龄、体重和状况,给药途径,以及所需的方案来确定。选择各剂量中抗原的量作为诱导免疫应答的量。医生能够确定任何特定个体所需的给药途径和剂量。剂量可以作为单剂量提供或可以作为多剂量提供,例如以规则的间隔服用,例如每小时施用2、3或4剂。通常,肽、多核苷酸或寡核苷酸通常在1pg至1mg,更通常1pg至10μg的范围内施用用于颗粒介导的递送,以及在1μg至1mg,更通常1μg至100μg,更通常5μg至50μg的范围内施用用于其他途径。通常,预期每种剂量将包含0.01mg至3mg抗原。特定疫苗的最佳量可以通过涉及观察受试者中免疫应答的研究来确定。上述技术和方案的实例可见于remington’spharmaceuticalsciences,20thedition,2000,pub.lippincott,williams&wilkins。在根据本公开的一些情况下,施用多于一种肽或肽组合物。二种或更多种药物组合物可以一起/同时及/或在不同时间或顺序给药。因此,本公开包括多组药物组合物及其用途。使用任选靶向不同抗原的不同肽的组合对于克服肿瘤遗传异质性和个体hla异质性的挑战是重要的。本公开的肽的组合使用扩展了可以从疫苗接种中体验临床益处的个体组。被制造用于一种方案的多种pepi的药物组合物可以定义药物产品。给药途径包括但不限于鼻内、口服、皮下、皮内和肌内。特别优选皮下给药。皮下给药可以例如通过注射到腹部、上臂或大腿的侧面和前面、背部的肩胛区域或上腹部臀肌区域。本公开的组合物还可以以一种或多种剂量以及通过其他施用途径施用。例如,这些其他途径包括皮内、静脉内、血管内、动脉内、腹膜内、鞘内、气管内、心内、叶内、髓内、肺内和阴道内。根据的治疗期望持续时间,根据本公开的组合物可以一次或多次给药,也可以间歇给药,例如每月给药数月或数年,并且以不同的剂量给药。用于口服给药的固体剂型包括胶囊、片剂、囊片、丸剂、粉剂、微丸剂和颗粒剂。在这样的固体剂型中,活性成分通常与一种或多种药学上可接受的赋形剂组合,其实例在上面详述。口服制剂也可以作为水性混悬剂、酏剂或糖浆剂给药。为此,活性成分可以与各种甜味剂或调味剂、着色剂和如果需要的乳化剂及/或悬浮剂,以及稀释剂如水、乙醇、甘油及其组合结合。可单独或与其他药理学组合物或治疗(例如化学疗法及/或免疫疗法及/或疫苗)组合施用本发明的一种或多种组合物,或可进行根据本发明的治疗方法和用途。其他治疗组合物或治疗可以是例如本文所讨论的那些中的一种或多种,并且可以与本公开的组合物或治疗同时或相继(之前或之后)施用。在一些情况下,所述治疗可以与检查点阻断疗法/检查点抑制剂、共刺激抗体、细胞毒性或非细胞毒性化疗及/或放疗、靶向疗法或单克隆抗体疗法联合施用。已经证明化疗使肿瘤对疫苗接种诱导的特异性细胞毒性t细胞杀死致敏(ramakrishnanetal.j.clin.invest.2010;120(4):1111-1124)。化疗剂的实例包括烷化剂,包括氮芥类,例如二氯甲基二乙胺(hn2)、环磷酰胺、异环磷酰胺、美法仑(l-肌氨酸蛋白酶)和苯丁酸氮芥;蒽环类药物;埃博霉素;亚硝基脲类,例如卡莫司汀(bcnu)、洛莫司汀(ccnu)、司莫司汀(甲基ccnu)和链脲霉素(链脲佐菌素);三氮烯类,例如达卡巴嗪(dtic);二甲基三氮烯咪唑甲酰胺;乙撑亚胺类/甲基三聚氰胺类,例如六甲基三聚氰胺、塞替哌;烷基磺酸盐,例如白消安;抗代谢物,包括叶酸类似物如甲氨蝶呤(氨甲蝶呤);烷基化剂、抗代谢物、嘧啶类似物如氟尿嘧啶(5-氟尿嘧啶;5-fu),氟尿苷(氟脱氧尿苷;fudr)和阿糖胞苷(胞嘧啶阿拉伯糖苷);嘌呤类似物和相关抑制剂,例如巯基嘌呤(6-巯基嘌呤;6-mp),硫鸟嘌呤(6-硫鸟嘌呤;tg)和喷司他丁(2′-脱氧助间型霉素);表鬼臼毒素类;酶类如l-天冬酰胺酶;生物反应调节剂,例如ifnα、il-2、g-csf和gm-csf;铂配位络合物如顺铂(cis-ddp)、奥沙利铂和卡铂;蒽二酮类,例如米托蒽醌和蒽环霉素;取代的脲如羟基脲;甲基肼衍生物,包括甲基苄肼(n-甲基肼,mih)和甲基苄肼;肾上腺皮质抑制剂,例如米托坦(o,p′-ddd)和氨鲁米特;紫杉醇和类似物/衍生物;激素/激素疗法和激动剂/拮抗剂,包括肾上腺皮质类固醇拮抗剂如泼尼松及其等效物、地塞米松和氨鲁米特,孕激素如己酸羟孕酮、醋酸甲羟孕酮和醋酸甲地孕酮,雌激素如己烯雌酚和炔雌醇等效物,抗雌激素如他莫昔芬,雄激素包括丙酸睾酮和氟甲睾酮/等效物,抗雄激素如氟他胺、促性腺激素释放激素类似物和亮丙瑞林,以及非甾体抗雄激素如氟他胺;天然产物包括长春花生物碱如长春碱(vlb)和长春新碱,表鬼臼毒素类如依托泊苷和替尼泊苷,抗生素类如更生霉素(放线菌素d)、柔红霉素(道诺霉素;红比霉素)、阿霉素、博来霉素、普卡霉素(光神霉素)和丝裂霉素(丝裂霉素c),酶类如l-天冬酰胺酶,以及生物反应调节剂如干扰素alphenome。在一些情况下,治疗方法是疫苗接种的方法或提供免疫疗法的方法。如本文所用,“免疫疗法”是通过在个体中诱导或增强免疫应答来治疗疾病或病症。在某些实施例中,免疫疗法是指包括向个体施用一种或多种药物以引起t细胞应答的疗法。在一个具体的实施例中,免疫疗法是指一种疗法,其包括对个体施用或表达含有一种或多种pepi的多肽,以引起t细胞应答,从而鉴定并杀死在其细胞表面上展示与i类hla结合的一种或多种pepi的细胞。在另一个具体的实施例中,免疫疗法包括向个体施用一种或多种pepi以引起针对细胞的细胞毒性t细胞应答,这些细胞在细胞其表面上展示包含一种或多种pepi的肿瘤相关抗原(taa)或癌睾丸抗原(cta)。在另一个实施例中,免疫疗法是指一种疗法,其包括向个体施用或表达含有一种或多种ii类hla呈递的pepi的多肽,以引起辅助性t细胞应答,从而向鉴定并杀死患病细胞的细胞毒性t细胞提供共刺激,这些患病细胞在其细胞表面上展示与i类hla结合的一种或多种pepi。在另一个具体的实施例中,免疫疗法是指一种疗法,其包括向个体施用再激活现有的t细胞以杀死靶细胞的一种或多种药物。该理论是细胞毒性t细胞应答将消除展示一种或多种pepi的细胞,从而改善个体的临床状况。在一些情况下,免疫疗法可用于治疗肿瘤。在其他情况下,免疫疗法可用于治疗基于细胞内病原体的疾病或病症。在一些情况下,本公开涉及癌症的治疗或实体瘤的治疗。治疗可以是任何细胞、组织或器官类型的癌症或恶性或良性肿瘤。癌症可能是或可能不是转移性的。示例性的癌症包括癌、肉瘤、淋巴瘤、白血病、生殖细胞肿瘤或母细胞瘤。癌症可能是或可能不是激素相关或依赖性癌症(例如,雌激素或雄激素相关癌症)。在其他情况下,本公开涉及治疗病毒、细菌、真菌或寄生虫感染,或可通过免疫疗法治疗的任何其他疾病或病症。系统本公开提供了一种系统,其包括存储模块,所述存储模块被配置为存储包括人类受试者的模型群体的每个受试者的i类及/或ii类hla基因型,以及一种或多种测试多肽的氨基酸序列的数据;其中上述模型种群代表测试目标人类群体;和计算模块,该被计算模块被配置为鉴定及/或定量一种或多种测试多肽中能够结合上述模型群体中的每个受试者的多种i类hla分子的氨基酸序列及/或上述一种或多种测试多肽中能够结合上述模型群体中的每个受试者的多种ii类hla分子的氨基酸序列。所述系统可更包括输出模块,其被配置为显示本文所述的任何输出预测或治疗选择或推荐或本文所述的任何药效学生物标志物的值。本公开的其他实施例1.一种用于治疗目标人类群体的受试者中的疾病或病症的药物组合物,包括一种或多种多肽,各个所述多肽包含至少第一区域和第二区域,(a)所述第一区域的长度为10至50个氨基酸,包含第一氨基酸序列,所述第一氨基酸序列是结合目标群体中至少10%的受试者的至少三种hlai类分子及/或目标群体中至少10%的受试者的至少三种hlaii类分子的t细胞表位;以及(b)所述第二区域的长度为10至50个氨基酸,包含第二氨基酸序列,所述第二氨基酸序列是结合目标群体中至少10%的受试者的至少三种hlai类分子及/或目标群体中至少10%的受试者的至少三种hlaii类分子的t细胞表位;其中,所述第一区域和所述第二区域各自的t细胞表位的氨基酸序列包含不同的序列。2.根据第1项所述的药物组合物,包括至少2种、至少3种、至少4种、至少5种、至少6种、至少7种、至少8种、至少9种、至少10种、至少11种或至少12种不同的多肽。3.根据第1项所述的药物组合物,包括2至40种不同的多肽。4.根据第1项所述的药物组合物,其中结合所述目标群体中至少10%的受试者的至少三种hlai类分子的所述t细胞表位包含7至11个氨基酸,且/或结合所述目标群体中至少10%的受试者的至少三种hlaii类分子的所述t细胞表位包含13至17个氨基酸。5.根据第1项所述的药物组合物,其中长度为10至50个氨基酸的所述第一区域来自抗原;长度为10至50个氨基酸的所述第二区域来自相同或不同的抗原。6.根据第1项所述的药物组合物,其中所述第一区域和所述第二区域的表位来自单一抗原。7.根据第1项所述的药物组合物,其中所述第一区域和所述第二区域的表位来自二或更多种不同的抗原。8.根据第5项所述的药物组合物,其中所述抗原是癌症相关抗原、肿瘤相关抗原、或由目标病原生物表达的抗原、由病毒表达的抗原、由细菌表达的抗原、由真菌表达的抗原、与自身免疫病症相关的抗原,或过敏原。9.根据第5项所述的药物组合物,其中抗原选自表2至表7中列出的所述抗原。10.根据第6项所述的药物组合物,其中所述二或更多种不同的抗原选自表2至表7中列出的所述抗原及/或不同的癌症相关抗原。11.根据第9项所述的药物组合物,其中一种或多种抗原是癌睾丸抗原(cta)。12.根据第1项所述的药物组合物,其中所述一种或多种多肽还包含侧接t细胞表位的至多10个氨基酸,所述氨基酸不是相应抗原中侧接所述表位的连续序列的一部分。13.根据第1项所述的药物组合物,其中所述一种或多种多肽已被筛选以基本上消除跨越所述第一区域和第二区域之间的接头处(junction)的所有新表位,所述新表位(i)对应于在健康细胞中表达的人多肽的片段;(ii)是能够结合目标群体中至少10%的受试者的至少三种hlai类分子的t细胞表位;或(iii)满足要求(i)和(ii)二者。14.根据第1项所述的药物组合物,其中所述目标群体是癌症患者并且其中所述第一区域和第二区域各自包含是结合hlai类分子的t细胞表位的氨基酸序列,并且其中对于每个t细胞表位,(i)目标群体中至少10%的受试者表达包含t细胞表位的选自表2中所列抗原的肿瘤相关抗原;以及(ii)目标群体中至少10%的受试者具有至少三种能够结合t细胞表位的hlai类分子;其中所述第一区域和第二区域的所述t细胞表位彼此不同。15.根据第1项所述的药物组合物,更包括药学上可接受的佐剂、稀释剂、载体、防腐剂或其组合。16.根据第15项所述的药物组合物,其中所述佐剂选自于由montanideisa-51、qs-21、gm-csf、环磷酰胺、卡介苗(bcg)、短小棒状杆菌、左旋咪唑、azimezone、异丙吡酮、二硝基氯苯(dncb)、匙孔血蓝蛋白(klh)、弗氏佐剂(完全)、弗氏佐剂(不完全)、矿物凝胶、氢氧化铝、溶血卵磷脂、复合多元醇(pluronicpolyols)、聚阴离子、油乳剂、二硝基苯酚、白喉毒素(dt)及其组合,所组成的群组。17.一种试剂盒,包含一个或多个单独的容器,每个所述容器包括:(i)一种或多种多肽,包含至少第一区域和第二区域,(a)所述第一区域的长度为10至50个氨基酸,包含第一氨基酸序列,所述第一氨基酸序列是结合目标群体中至少10%的受试者的至少三种hlai类分子及/或目标群体中至少10%的受试者的至少三种hlaii类分子的t细胞表位;和(b)所述第二区域的长度为10至50个氨基酸,包含第二氨基酸序列,所述第二氨基酸序列是结合目标群体中至少10%的受试者的至少三种hlai类分子及/或目标群体中至少10%的受试者的至少三种hlaii类分子的t细胞表位;其中所述第一区域和所述第二区域各自的t细胞表位的氨基酸序列包含不同的序列,以及(ii)药学上可接受的佐剂、稀释剂、载体、防腐剂或其组合。18.根据第19项所述的试剂盒,更包括说明书。19.一种药物组合物,包括:表达一种或多种多肽的一种或多种核酸分子,所述多肽包含至少第一区域和第二区域,(a)所述第一区域的长度为10至50个氨基酸,包含第一氨基酸序列,所述第一氨基酸序列是结合目标群体中至少10%的受试者的至少三种hlai类分子及/或目标群体中至少10%的受试者的至少三种hlaii类分子的t细胞表位;以及(b)所述第二区域的长度为10至50个氨基酸,包含第二氨基酸序列,所述第二氨基酸序列是结合目标群体中至少10%的受试者的至少三种hlai类分子及/或目标群体中至少10%的受试者的至少三种hlaii类分子的t细胞表位;其中所述第一区域和第二区域各自的t细胞表位的氨基酸序列包含不同的序列。20.一种制备多肽或编码多肽的多核酸的方法,所述多肽或多核酸用于在目标人类群体的受试者中诱导免疫应答的方法,所述方法包括:(i)选择:(a)相关模型人类群体,包括各自由hlai类基因型及/或hlaii类基因型定义的多个受试者;或(b)包括各自由hlai类基因型定义的多个受试者的一个相关模型人类群体及包括各自由hlaii类基因型定义的多个受试者的一个相关模型人类群体;(ii)鉴定抗原的至多50个连续氨基酸的片段,所述片段包括:(a)t细胞表位,能够在由hlai类基因型定义的步骤(i)中选择的模型群体的高百分比的受试者中结合至模型群体的个体受试者的至少三种hlai类分子;(b)t细胞表位,能够在由hlaii类基因型定义的步骤(i)中选择的模型群体的高百分比的受试者中结合所述模型群体的个体受试者的至少三种hlaii类分子;或(c)t细胞表位,能够在由hlai类基因型定义的在步骤(i)中选择的模型群体的高百分比的受试者中结合所述模型群体的个体受试者的至少三种hlai类分子;以及一种t细胞表位,能够在由hlaii类基因型定义的步骤(i)中选择的模型群体的高百分比的受试者中结合所述模型群体的个体受试者的至少三种hlaii类分子;以及(iii)制备编码包含步骤(ii)中鉴定的一个或多个片段的,多肽或多肽的多核酸。21.根据第20项所述的方法,更包括在步骤(iii)之前,如果在步骤(ii)中选择的片段是结合hlai类分子的表位,则选择抗原的较长片段,所述较长片段包含氨基酸序列,所述氨基酸序列(a)包含步骤(ii)中选择的片段;以及(b)是结合hlaii类分子的t细胞表位,其能够在由hlaii类基因型定义的步骤(i)中选择的模型群体的高百分比的受试者中结合所述模型群体的个体受试者的至少三种或最可能的hlaii类分子。22.根据第20项所述的方法,在步骤(iii)之前还包括重复步骤(i)至(ii)以鉴定与所述第一氨基酸序列相同或不同的多肽的至多50个连续氨基酸的一个或多个额外氨基酸序列。23.一种在目标人类群体的受试者中诱导免疫应答的方法,所述方法包括:向所述受试者施用包含一种或多种多肽的药物组合物,所述多肽包含至少第一区域和第二区域,(a)所述第一区域长度为10至50个氨基酸,其包含第一氨基酸序列,所述第一氨基酸序列是结合目标群体中至少10%的受试者的至少三种hlai类分子及/或目标群体中至少10%的受试者的至少三种hlaii类分子的t细胞表位;以及(b)所述第二区域长度为10至50个氨基酸,其包含第二氨基酸序列,所述第二氨基酸序列是结合目标群体中至少10%的受试者的至少三种hlai类分子及/或目标群体中至少10%的受试者的至少三种hlaii类分子的t细胞表位;其中所述第一区域和所述第二区域各自的t细胞表位的氨基酸序列包含不同的序列。24.根据第23项所述的方法,更包括在所述施用步骤之前,通过(i)测定所述受试者的生物样本以确定受试者的hla基因型;(ii)确定所述药物组合物包含二个或更多个序列,所述序列是能够结合所述受试者的至少三种hlai类分子的t细胞表位;及(iii)使用每种抗原的群体表达数据确定受试者的肿瘤表达对应于步骤(ii)中鉴定的t细胞表位的一种或多种抗原的概率,以鉴定受试者对施用药物组合物具有临床应答的可能性,来确定所述受试者是否可能对药物组合物的施用具有临床应答。25.根据第23项所述的方法,其中长度为10至50个氨基酸的所述第一区域来自抗原;长度为10至50个氨基酸的所述第二区域来自相同或不同的抗原。26.根据第23项所述的方法,其中所述第一区域和所述第二区域的表位来自二或更多种不同的抗原。27.根据第25项所述的方法,其中所述抗原是癌症相关抗原、肿瘤相关抗原、或由目标病原生物表达的抗原、由病毒表达的抗原、由细菌表达的抗原、由真菌表达的抗原、与自身免疫病症相关的抗原、或过敏原。28.根据第23项所述的方法,其中结合所述目标群体中至少10%的受试者的至少三种hlai类分子的t细胞表位包含7至11个氨基酸,且/或结合所述目标群体中至少10%的受试者的至少三种hlaii类分子的t细胞表位包含13至17个氨基酸。29.一种用于治疗目标人类群体的受试者中的疾病或病症的药物组合物,其包含(a)至少二种多肽,所述至少二种多肽中的每一种长度为10至50个氨基酸,包含一种作为t细胞表位的氨基酸序列,所述t细胞表位结合所述目标群体中的至少10%受试者的至少三种hlai类分子,及/或所述目标群体中至少10%的受试者的至少三种hlaii类分子,其中所述至少二种多肽中的每一种的t细胞表位的氨基酸序列彼此不同;以及(b)药学上可接受的佐剂。30.根据第29项所述的药物组合物,包含至少3种、至少4种、至少5种、至少6种、至少7种、至少8种、至少9种、至少10种、至少11种或至少12种不同的多肽。31.根据第29项所述的药物组合物,包含3至40种不同的多肽。32.根据第29项所述的药物组合物,其中结合目标群体中至少10%的受试者的至少三种hlai类分子的所述t细胞表位包含7至11个氨基酸,且/或结合目标群体中至少10%的受试者的至少三种hlaii类分子的所述t细胞表位包含13至17个氨基酸。33.根据第29项所述的药物组合物,其中所述至少二种多肽的氨基酸序列的表位来自单一抗原。34.根据第29项所述的药物组合物,其中所述至少二种多肽的氨基酸序列的表位来自二或更多种不同的抗原。35.根据第33项所述的药物组合物,其中所述抗原是癌症相关抗原、肿瘤相关抗原、或由目标病原生物表达的抗原、由病毒表达的抗原、由细菌表达的抗原、由真菌表达的抗原、与自身免疫病症相关的抗原、或过敏原。36.根据第33项所述的药物组合物,其中所述抗原选自表2至表7中列出的所述抗原。37.根据第34项所述的药物组合物,其中所述二或更多种不同的抗原选自表2至表7中列出的所述抗原及/或不同的癌症相关抗原。38.根据第37项所述的药物组合物,其中一种或多种抗原是癌睾丸抗原(cta)。39.根据第29项所述的药物组合物,其中所述至少二种长度为10至50个氨基酸的多肽中的每一种来自相同或不同抗原的抗原。40.根据第29项所述的药物组合物,其中所述至少二种不同的多肽还包含侧接t细胞表位的至多10个氨基酸,所述t细胞表位不是相应抗原中侧接所述表位的连续序列的一部分。41.根据第29项所述的药物组合物,其中所述至少二种多肽中的二种在连接的多肽中首尾相连或重叠排列。42.根据第41项所述的药物组合物,包括二或更多种不同的连接多肽,其中所述二或更多种不同的连接的多肽包含彼此不同的表位。43.根据第42项所述的药物组合物,其中所述连接多肽已被筛选以基本上消除跨越所述二种多肽之间的连接处的所有新表位,所述新表位(i)对应于在健康细胞中表达的人多肽的片段;(ii)是能够结合目标群体中至少10%的受试者的至少三种hlai类分子的t细胞表位;或(iii)满足要求(i)和(ii)二者。44.根据第29项所述的药物组合物,其中所述目标群体是癌症患者并且其中每个多肽包含作为结合hlai类分子的t细胞表位的氨基酸序列,并且其中对于每个t细胞表位,(i)所述目标群体中至少10%的受试者表达包含t细胞表位的选自表2中所列抗原的肿瘤相关抗原;以及(ii)所述目标群体中至少10%的受试者具有至少三种能够结合t细胞表位的hlai类分子;其中所述至少二种多肽的所述t细胞表位彼此不同。45.根据第29项所述的药物组合物,其更包括药学上可接受的稀释剂、载体、防腐剂或其组合。46.根据第29项所述的药物组合物,其中该佐剂选自于由montanideisa-51、qs-21、gm-csf、环磷酰胺、卡介苗(bcg)、短小棒状杆菌、左旋咪唑、azimezone、异丙吡酮、二硝基氯苯(dncb)、匙孔血蓝蛋白(klh)、弗氏佐剂(完全)、弗氏佐剂(不完全)、矿物凝胶、氢氧化铝、溶血卵磷脂、复合多元醇、聚阴离子、油乳剂、二硝基苯酚、白喉毒素(dt)及其组合,所组成的群组。47.一种用于治疗目标人类群体的受试者中的疾病或病症的药物组合物,包括(a)长度为10至50个氨基酸并且包含t细胞表位的多肽,所述t细胞表位结合所述目标群体中至少10%的受试者的至少三种hlai类分子及/或所述目标群体中至少10%的受试者的至少三种hlaii类分子;以及(b)药学上可接受的佐剂。48.根据第47项所述的药物组合物,包括至少2种、至少3种、至少4种、至少5种、至少6种、至少7种、至少8种、至少9种、至少10种、至少11种或至少12种不同多肽,所述不同多肽中的每一种的长度为10至50个氨基酸,包含结合目标群体中至少10%受试者的至少三种hlai类分子及/或目标群体中至少10%受试者的至少三种hlaii类分子的t细胞表位,其中每种所述不同多肽的t细胞表位的氨基酸序列彼此不同。49.根据第48项所述的药物组合物,包括2至40种不同的多肽。50.根据第47项所述的药物组合物,其中结合受试者的至少三种hlai类分子的所述t细胞表位包含7至11个氨基酸,且/或结合至少三种hlaii类分子的所述t细胞表位包含13至17个氨基酸。51.根据第48项所述的药物组合物,包括至少二种不同的多肽,其中所述至少二种不同多肽的表位来自单一抗原。52.根据第48项所述的药物组合物,包括至少二种不同的多肽,其中所述至少二种不同多肽的表位来自二种或更多种不同的抗原。53.根据第51项所述的药物组合物,其中所述抗原是由癌细胞表达的抗原、由癌细胞表达的新抗原、癌症相关抗原、肿瘤相关抗原、或由目标病原生物表达的抗原、由病毒表达的抗原、由细菌表达的抗原、由真菌表达的抗原、与自身免疫病症相关的抗原、或过敏原。54.根据第51项所述的人类受试者特异性药物组合物,其中所述抗原选自表2至表7中列出的所述抗原。55.根据第51项所述的人类受试者特异性药物组合物,包括至少二种不同的多肽,其中所述多肽中的二种在连接的多肽中首尾相连或重叠排列。56.根据第47项所述的人类受试者特异性药物组合物,其中该佐剂选自于由montanideisa-51、qs-21、gm-csf、环磷酰胺、卡介苗(bcg)、短小棒状杆菌、左旋咪唑、azimezone、异丙吡酮、二硝基氯苯(dncb)、匙孔血蓝蛋白(klh)、弗氏佐剂(完全)、弗氏佐剂(不完全)、矿物凝胶、氢氧化铝、溶血卵磷脂、复合多元醇、聚阴离子、油乳剂、二硝基苯酚、白喉毒素(dt)及其组合,所组成的群组。57.根据第47项所述的人类受试者特异性药物组合物,包括至少二种不同的多肽,其中所述至少二种多肽中的二种在连接的多肽中首尾相连或重叠排列。58.根据第57项所述的人类受试者特异性药物组合物,包括二或更多种不同的连接多肽,其中所述二或更多种不同的连接的多肽包含彼此不同的表位。59.根据第58项所述的人类受试者特异性药物组合物,其中所述连接的多肽已被筛选以基本上消除跨越所述二种多肽之间的连接处的所有新表位,所述新表位(i)对应于在受试者的健康细胞中表达的人多肽的片段;(ii)是能够结合受试者的至少二种hlai类分子的t细胞表位;或(iii)满足要求(i)和(ii)二者。60.根据第48项所述的人类受试者特异性药物组合物,其中所述至少二种多肽不包含以下任何氨基酸序列:(i)对应于在健康细胞中表达的人多肽的片段;或(ii)对应于在健康细胞中表达的人多肽的片段,并且是能够结合受试者的至少二种hlai类分子的t细胞表位。61.一种鉴定和治疗可能对施用根据第1项所述的药物组合物具有临床应答的癌症患者的目标群体的受试者的方法,所述方法包括:(i)测定受试者的生物样本以确定受试者的hla基因型;(ii)确定所述药物组合物包含二个或更多个序列,所述序列是能够结合所述受试者的至少三种hlai类分子的t细胞表位;(iii)使用每种抗原的群体表达数据确定受试者的肿瘤表达对应于步骤(ii)中鉴定的t细胞表位的一种或多种抗原的概率,以鉴定受试者对施用药物组合物具有临床应答的可能性;以及(iv)向所鉴定的受试者施用第1项所述的组合物。62.根据第61项所述的方法,更包括在该施用步骤之前测定来自受试者的肿瘤样本以确定药物组合物的三种或更多种肽包含二种或更多种不同的氨基酸序列,每种是a.如步骤(i)中确定的受试者的癌细胞表达的癌症相关抗原的片段;和b.能够结合受试者的至少三种hlai类分子的t细胞表位;以及确认受试者可能对治疗方法有临床应答。63.根据第61项所述的方法,其中所述组合物包含至少2种、至少3种、至少4种、至少5种、至少6种、至少7种、至少8种、至少9种、至少10种、至少11种、或至少12种不同的多肽。64.根据第61项所述的方法,其中所述组合物包含2至40种不同的多肽。65.根据第61项所述的方法,其中结合所述目标群体中至少10%的受试者的至少三种hlai类分子的所述t细胞表位包含7至11个氨基酸,且/或结合所述目标群体中至少10%的受试者的至少三种hlaii类分子的所述t细胞表位包含13至17个氨基酸。66.根据第61项所述的方法,其中长度为10至50个氨基酸的第一区域来自一种抗原;长度为10至50个氨基酸的第二区域来自相同或不同的抗原。67.根据第61项所述的方法,其中所述第一区域和第二区域的表位来自单一抗原。68.根据第61项所述的方法,其中所述第一区域和第二区域的表位来自二或更多种不同的抗原。69.根据第67项所述的方法,其中所述抗原是癌症相关抗原或肿瘤相关抗原。70.根据第67项所述的方法,其中所述抗原选自表2中列出的所述抗原。71.根据第67项所述的方法,其中所述二种或更多种不同的抗原选自表2中列出的所述抗原及/或不同的癌症相关抗原。72.根据第71项所述的方法,其中一种或多种抗原是癌睾丸抗原(cta)。73.根据第61项所述的方法,其中所述一种或多种多肽还包含侧接t细胞表位的至多10个氨基酸,所述t细胞表位不是相应抗原中侧接所述表位的连续序列的一部分。74.根据第61项所述的方法,其中所述一种或多种多肽已被筛选以基本上消除跨越第一区域和第二区域之间的连接处的所有新表位,所述新表位(i)对应于在健康细胞中表达的人多肽的片段;(ii)是能够结合目标群体中至少10%的受试者的至少三种hlai类分子的t细胞表位;或(iii)满足要求(i)和(ii)二者。75.根据第61项所述的方法,其中所述目标群体是癌症患者并且其中所述第一区域和所述第二区域各自包含作为结合hlai类分子t细胞表位的氨基酸序列,并且其中对于每个t细胞表位,(iii)所述目标群体中至少10%的受试者表达包含t细胞表位的选自表2中所列抗原的肿瘤相关抗原;以及(iv)所述目标群体中至少10%的受试者具有至少三种能够结合t细胞表位的hlai类分子;其中所述第一和所述第二区域的所述t细胞表位彼此不同。76.根据第61项所述的方法,其中所述组合物更包括药学上可接受的佐剂、稀释剂、载体、防腐剂或其组合。77.根据第61项所述的方法,其中所述佐剂选自于由montanideisa-51、qs-21、gm-csf、环磷酰胺、卡介苗(bcg)、短小棒状杆菌、左旋咪唑、azimezone、异丙吡酮、二硝基氯苯(dncb)、匙孔血蓝蛋白(klh)、弗氏佐剂(完全)、弗氏佐剂(不完全)、矿物凝胶、氢氧化铝、溶血卵磷脂、复合多元醇、聚阴离子、油乳剂、二硝基苯酚、白喉毒素(dt)及其组合,所组成的群组。78.一种试剂盒,包括:(a)第一组合物,包括(i)长度为10至50个氨基酸且包含t细胞表位的第一多肽,所述t细胞表位结合所述目标群体中至少10%的受试者的至少三种hlai类分子及/或所述目标群体中至少10%的受试者的至少三种hlaii类分子;及(ii)药学上可接受的佐剂;(b)第二组合物,包括(i)长度为10至50个氨基酸且包含t细胞表位的第二多肽,所述t细胞表位结合所述目标群体中至少10%的受试者的至少三种hlai类分子及/或所述目标群体中至少10%的受试者的至少三种hlaii类分子;及(ii)药学上可接受的佐剂,其中所述第一多肽和第二多肽包含不同的t细胞表位。79.根据第78项所述的试剂盒,其中所述第一组合物及/或所述第二组合物包含一种或多种额外多肽,其中每种额外多肽长度为10至50个氨基酸,并包含作为t细胞表位的氨基酸序列,所述t细胞表位结合目标群体中至少10%受试者的至少三种hlai类分子及/或目标群体中至少10%受试者的至少三种hlaii类分子,其中所述氨基酸序列包含不同的t细胞表位。80.一种鉴定和治疗可能对施用根据第1项所述的药物组合物具有临床应答的癌症患者的目标群体的受试者的方法,所述方法包括:(i)测定所述受试者的生物样本以确定受试者的hla基因型;(ii)确定所述药物组合物包含二个或更多个序列,所述序列是能够结合所述受试者的至少三种hlai类分子的t细胞表位;(iii)向所鉴定的受试者施用第1项所述的组合物。81.一种药物组合物,包括:表达二或更多种多肽的核酸分子,每种多肽的长度为10至50个氨基酸,包含结合目标群体中至少10%的受试者的至少三种hlai类分子及/或目标群体中至少10%受试者的至少三种hlaii类分子的t细胞表位,其中所述二种或更多种多肽中的每一种包含不同的t细胞表位,其中所述多肽不包含在相应抗原中彼此相邻的氨基酸序列。实例实例1hla表位结合预测方法和验证特定hla和表位(9-mer肽)之间结合的预测是基于用于表位预测的免疫表位数据库工具(www.iedb.org)。通过与实验室实验测定的hlai表位对的比较,验证了hlai表位结合预测过程。将在同行评审的出版物或公共免疫学数据库中报告的hlai表位对的数据集进行汇编。测定了与实验测定的数据集(表9)的一致率。以93%的概率正确预测数据集的结合hlai表位对。巧合的是,非结合hlai表位对也被正确预测,概率为93%。表9hla表位结合预测方法的分析特异性和灵敏度测定了预测多种hla结合表位的准确性。基于使用真阳性和真阴性预测的93%概率和假阳性和假阴性预测的7%(=100%-93%)概率的分析特异性和灵敏度,可以计算人体内存在多种hla结合表位的概率。多种hla与表位结合的概率显示了hla结合表位的数量与预期的最小实际结合数量之间的关系。根据pepi定义,3是结合表位的hla的预期最小数值(粗体)。表10多种hla结合表位预测准确性验证的hla表位结合预测方法用于确定下面实例中描述的所有hla表位结合对。实例2多hla的表位呈递预测细胞毒性t淋巴细胞(ctl)应答确定了ctl应答的通过个体的一种或多种hlai对多肽抗原的一个或多个表位呈递是可预测的。通过对71例癌症和9例hiv感染患者(表11)1-7进行的6项临床试验的回顾性分析进行研究。来自用hpv疫苗、三种不同的ny-eso-1特异性癌症疫苗、一种hiv-1疫苗和一种ctla-4特异性单克隆抗体伊匹单抗(ipilimmab)治疗这些研究的患者,该抗体显示在黑色素瘤患者中重新激活针对ny-eso-1抗原的ctl。所有这些临床试验在疫苗接种后测量研究受试者中的抗原特异性cd8+ctl应答(免疫原性)。在一些情况下,报告了ctl应答与临床应答之间的相关性。没有患者因除数据可用性之外的任何原因被排除在追溯性研究之外。157例患者数据集(表11)用标准随机数发生器随机化以创建用于训练和评估研究的二个独立组群。在一些情况下,该组群包含来自同一患者的多个数据集,导致来自48例患者的76个数据集的训练组群和来自51例患者的81个数据集的测试/验证组群。表11患者数据集总结将所报告的训练数据集的ctl应答与疫苗抗原表位(9-mer)的hlai限制性图谱进行比较。从公众可获得的蛋白质序列数据库或同行评审的出版物获得每个患者的抗原序列和hlai基因型,hlai表位结合预测方法对患者的临床ctl应答数据不知情。确定预测与每位患者的至少1种(pepi1+)、或至少2种(pepi2+)、或至少3种(pepi3+)、或至少4种(pepi4+)、或至少5种(pepi5+)、或所有6种(pep16+)hlai类分子结合的每种抗原的表位数量,并将hla结合的数量用作报告的ctl应答的分类器。从训练数据集中分别确定每个分类器的真阳性率(灵敏度)和真阴性率(特异性)(hla结合的数量)。对每个分类器进行roc分析。在roc曲线中,将不同截止点的真阳性率(灵敏度)绘制成假阳性率(1-特异性)的函数(图1)。roc曲线上的每个点代表对应于特定判定阈值(表位(pepi)计数)的灵敏度/特异性对。roc曲线下的面积(auc)是分类器能够在二个诊断组(ctl应答者或非应答者)间区分程度的量度。该分析意外地揭示了由受试者的多种i类hla预测的表位呈递(pepi2+、pepi3+、pepi4+、pepi5+或pep16)在每种情况下都比仅仅一种或多种hlai类分子的表位呈递更好地预测ctl应答(pepi1+,auc=0.48,表12)。表12通过roc分析确定pepi生物标志物的诊断价值通过考虑可由个体的至少3种hlai类分子呈递的抗原表位,最佳地预测个体的ctl应答(pepi3+,auc=0.65,表12)。最佳预测阳性ctl应答的pepi3+(由个体的3种或更多种hla呈递的抗原特异性表位的数量)的阈值计数是1(表13)。换句话说,受试者的至少3种hlai类分子(≥1pepi3+)呈递至少一种抗原衍生的表位,然后该抗原可以触发至少一种ctl克隆,并且受试者是可能的ctl应答者。使用≥1pepi3+阈值预测可能的ctl应答者(“≥1pepi3+测试”)提供76%的诊断灵敏度(表13)。表13确定≥1pepi3+阈值以预测训练数据集中可能的ctl应答者实例3≥1pepi3+测试的验证来自51例患者的81个数据集的测试组群用于验证≥1pepi3+阈值以预测抗原特异性ctl应答。对于测试组群中的每个数据集,确定是否满足≥1pepi3+阈值(由个体的至少三种i类hla呈递的至少一个抗原衍生表位)。将其与临床试验报告的实验测定的ctl应答进行比较(表14)。临床验证证明pepi3+肽在个体中以84%的概率诱导ctl应答。84%是在pepi3+预测的分析验证中确定的相同值,预测中表位与个体的至少3种hla结合(表10)。这些数据提供了个体中pepi诱导免疫应答的有力证据。表14诊断性能特征≥1pepi3+测试(n=81)roc分析使用pepi3+计数作为临界值确定诊断准确度(图2)。auc值=0.73。对于roc分析,auc为0.7至0.8通常被认为是合理的诊断。至少为1(≥1pepi3+)的pepi3+计数最佳地预测了测试数据集中的ctl应答(表15)。该结果证实了在训练期间确定的阈值(表12)。表15确认≥1pepi3+阈值以预测测试/验证数据集中可能的ctl应答者。实例4≥1pepi3+测试预测cd8+ctl反应性(reactivities)将≥1pepi3+测试与先前报告的用于预测特异性人类受试者对肽抗原的ctl应答的方法进行比较。在二个不同临床试验中接受hpv-16合成长肽疫苗(lpv)的28例宫颈癌和vin-3患者的hla基因型由dna样本确定8910。lpv由覆盖hpv-16病毒癌蛋白e6和e7的长肽组成。lpv的氨基酸序列获自这些出版物。这些出版物还报告了每个接种患者对疫苗的重叠肽库的t细胞应答。对于每个患者,鉴定由至少三种患者i类hla(pepi3+)呈递的lpv表位(9-mer),并测定它们在肽库中的分布。预测包含至少一个pepi3+(≥1pepi3+)的肽诱导ctl应答。预测不包含pepi3+的肽不诱导ctl应答。≥1pepi3+测试正确地预测了512例阴性ctl应答中的489例和接种后测量的40例阳性ctl应答中的8例(图3a)。总之,≥1pepi3+测试与实验测定的cd8+t细胞反应性之间的一致性为90%(p<0.001)。对于每个患者,还测定了由至少一种患者i类hla(≥1pepi1+,hla限制性表位预测,现有技术方法)呈递的表位的肽库之间的分布。pepi1+正确地预测512例阴性ctl应答中的116例和接种后测量的40例阳性ctl应答中的37例(图3b)。总之,hla限制性表位预测(≥1pepi1+)和cd8+t细胞反应性之间的一致性为28%(不显著)。实例5hlaii类限制性cd4+辅助性t细胞表位的预测在二个不同临床试验(如实例4中详述)中接受hpv-16合成长肽疫苗(lpv)的28例宫颈癌和vin-3患者在lpv接种后进行cd4+辅助性t细胞应答的研究(图4)。hlaii类限制性表位预测的灵敏度为78%,因为现有技术工具预测了107例中的84例阳性应答(对人dp等位基因的肽库的阳性cd4+t细胞反应性)(灵敏度=78%)。特异性为22%,因为它可以排除31例中的7例阴性应答。总之,hla限制性ii类表位预测与cd4+t细胞反应性之间的一致性为66%,这在统计学上不显著。实例6≥1pepi3+测试预测t细胞对全长lpv多肽的应答使用与实例4和5相同的报告研究,使用≥1pepi3+测试来预测患者对lpv疫苗的全长e6和e7多肽抗原的cd8+和cd4+t细胞应答。将结果与实验测定的应答进行比较。该测试准确地预测了具有阳性cd8+t细胞反应性测试结果的15例vin-3患者中有11例患者具有cd8+t细胞反应性(灵敏度73%,ppv85%)及5例宫颈癌患者中有2例患者具有cd8+t细胞反应性(灵敏度40%,ppv100%)。vin-3和宫颈癌患者的cd4+t细胞反应性(pepi4+)均准确地预测为100%(图5)。还观察到i类和ii类hla限制性pepi3+计数与报告的lpv接种患者的临床益处相关。具有较高pepi3+计数的患者在3个月后已经具有完全或部分应答。实例7案例研究pgx3001是基于hpv16的dna疫苗,其含有全长e6和e7抗原,其间具有接头。pgx3002是基于hpv18的dna疫苗,其含有全长e6和e7抗原,其间具有接头。ii期临床试验研究了用pgx3001和pgx3002接种(vgx-3100接种)的17例hpv感染的宫颈癌患者的t细胞应答1。图5至6显示了二位示例性患者(患者12-11和患者14-5)在二种hpv-16和二种hpv-18抗原全长序列内由这些患者的至少1种(pepi1+)、至少2种(pepi2+)、至少3种(pepi3+)、至少4种(pepi4+)、至少5种(pepi5+)或所有6种(pep16)i类hla呈递的每个表位(9-mer)的位置。对于联合疫苗,患者12-11的总pepi1+计数为54(由一种或多种i类hla呈递的54个表位),患者14-5的pepi1+计数为91。因此,就四种hpv抗原而言,患者14-5比患者12-11具有更高的pepi1+计数。pepi1+代表患者12-11和14-5的不同疫苗抗原特异性hla限制性表位集合。在这二位患者中只有27种pepi1+是常见的。对于pepi3+计数(由三种或更多种患者i类hla呈递的表位数量),患者12-11和14-5的结果逆转。患者12-11的pepi3+计数为8,在四种hpv16/18抗原的每一种中包括至少一种pepi3+。患者14-5的pepi3+计数为0。所报告的这二位患者的免疫应答与pepi3+计数匹配,而与pepi1+计数不匹配。如通过elispot测量的,患者12-11在接种后对四种抗原中的每一种产生免疫应答,而患者14-5对疫苗的四种抗原中的任一种都不产生免疫应答。当比较试验中所有17例患者的pepi1+和pepi3+组时,观察到类似的模式。pepi1+计数与临床试验报告的实验测定的t细胞应答之间没有相关性。然而,我们观察到通过≥1pepi3+测试预测的t细胞免疫与报告的t细胞免疫之间的相关性。≥1pepi3+测试预测了hpvdna疫苗的免疫应答者。此外,患者pepi3+组的多样性类似于癌症疫苗试验中通常发现的t细胞应答的多样性。与患者14-5相似,患者12-3和12-6不具有预测hpv疫苗不能触发t细胞免疫的pepi3+。所有其他患者具有至少一个pepi3,其预测hpv疫苗可引起t细胞免疫的可能性。11例患者具有多种pepi3+,预测hpv疫苗可能触发多克隆t细胞应答。患者15-2、15-3对二种hpv的e6均产生高水平的t细胞免疫应答,而对e7的免疫应答较差。其他患者15-1和12-11分别对hpv18和hpv16的e7具有相同程度的应答。实例8设计模型群体进行计算机模拟试验和鉴定大量群体的候选精确疫苗靶标一个433名受试者的计算机模拟人类试验组群,具有完整的4位hlai类基因型(2×hla-a*xx:xx;2×hla-b*xx:xx;2×hla-c*xx:xx)并汇编了人口统计信息。该模型群体具有混合种族的受试者,具有总共152种不同的hla等位基因,代表>85%的目前已知的等位基因g组。还建立了含有7189名受试者的“大群体”数据库,这些受试者的特征在于4位hla基因型和人口统计信息。大群体具有328个不同的hlai类等位基因。模型群体的hla等位基因分布与大群体显著相关(表16)(pearsonp<0.001)。因此433例患者模型群体代表16倍大的群体。模型群体依据hla多样性和hla频率代表了85%的人类。表16“模型群体”与“大群体”hla分布的统计分析实例9基于鉴定多种hla结合表位的计算机模拟试验预测了所报告的临床试验的t细胞应答率本研究的目的是确定模型群题(例如实例8中描述的模型群体)是否可用于预测疫苗的ctl反应率(reactivityrates),即用于计算机模拟效力试验。从同行评审的出版物中鉴定了12种衍生自癌症抗原的肽疫苗,其在受试者亚群中诱导t细胞应答。已经在共招募了172例患者(4个种族)的临床试验中研究了这些肽。疫苗肽诱导的t细胞应答已经从血液样本中确定并报告。确定了作为临床试验中测量的具有阳性t细胞应答的研究受试者的百分比的免疫应答率(图7)。表17用肽疫苗进行的临床试验肽疫苗源抗原肽长度t细胞测定群体(n)种族参考文献mmnlmqpktqqtytydjup16-mer多聚体染色18加拿大人12grgstttnylldrddyrntsdada1721-mer多聚体染色18加拿大人12lkkgaadggkldgnaklnrslkbap3122-mer多聚体染色18加拿大人12fppkddhtlkflyddnqrpypptop2a22-mer多聚体染色18加拿大人12ryrkpdytlddghgllrfkstabl-221-mer多聚体染色18加拿大人12qrppfsqlhrfladalntddr118-mer多聚体染色18加拿大人12aldqcktscalmqqhydqtscfsspitgb825-mer多聚体染色18加拿大人12stappahgvtsapdtrpapgstappmuc-125-mer增殖80加拿大人13ylepgpvtagp1009-mer四聚体18美国人14mtpgtqspffllllltvltvvmuc-121-mer细胞毒性10以色列人15sskalqrpvbcr-abl9-merelispot4美国人16rmfpnapylwt-19-mer多聚体染色24美国人17rmfpnapyl(hla-a*0201)wt-19-mer细胞因子染色18北欧和西欧人18在实例8中描述的模型群体的433名受试者的每一个中,用≥1pepi3+测试研究了12种肽。每种肽的“≥1pepi3+评分”计算为具有至少一个疫苗衍生表位的模型群体中受试者的比例,所述表位可结合至少三种受试者特异性hlai类分子(≥1pepi3+)。如果相应的临床试验对hla等位基因选择群体的患者进行分层,则对具有相应等位基因的受试者也筛选模型群体(实例:wt1,hla-a*0201)。将实验确定的试验报告的应答率与≥1pepi3+评分进行比较。根据配对数据计算协议总百分比(opa)(表18)。观察到≥1pepi3+评分和应答率(r2=0.77)之间呈线性相关(图7)。该结果表明预测与个体的多种hla结合的肽的鉴定可用于预测计算机模拟临床试验的结果。表1912种多肽疫苗的pepi3+评分和ctl应答率的比较*具有≥1疫苗衍生pepi3+的模型群体中的受试者百分比实例10基于鉴定多种hla结合表位的计算机模拟试验预测了临床试验ii报告的t细胞应答率鉴定了19项基于肽或dna疫苗的已公布免疫应答率(irr)的临床试验(表19)。这些试验涉及604例患者(9个种族),涵盖了38种衍生自肿瘤和病毒抗原的疫苗。在每个研究患者中测量疫苗抗原特异性ctl应答,并计算和报告临床研究群体中的应答率。在模型群体的每个受试者中用≥1pepi3+测试研究19项临床试验的每种疫苗肽。每种肽的≥1pepi3+评分计算为具有至少一种疫苗衍生的pepi3+的模型群体中受试者的比例。如实例9所述,将实验确定的试验报告的应答率与pepi评分进行比较(表20)。观察到应答率与≥1pepi3+评分(r2=0.70)之间呈线性相关(图8)。该结果证实,预测与个体的多种hla结合的肽的鉴定可以预测受试者的t细胞应答,并且计算机模拟试验可以预测临床试验的结果。表20临床试验中公布的应答率表21pepi评分和应答率之间呈线性相关(r2=0.7)*具有≥1疫苗衍生pepi3+的模型群体中的受试者百分比实例11基于在多肽疫苗中鉴定多种hla结合表位的计算机模拟试验预测了报告的临床试验免疫应答率ima901是用于肾细胞癌(rcc)的治疗性疫苗,其包含9种来肿瘤相关肽(tumaps)衍生的肽,其天然存在于人癌症组织中。在二项独立的临床研究(i期和ii期)中,用ima901治疗总共96例患有晚期rcc的hla-a*02+受试者。ima901的9种肽中的每一种在现有技术中已被鉴定为hla-a2限制性表位。基于目前公认的标准,它们都是在试验受试者中促进对抗肾癌的t细胞应答的强候选肽,因为已经在肾癌患者中检测到它们的存在,并且因为试验患者被特异性地选择为具有至少一种能够呈递每种肽的hla分子。对于模型群体中的每个受试者,测定ima901疫苗的九种肽中有多少能够结合三种或更多种hla。由于ima901疫苗中的每种肽是9-mer,因此这对应于pepi3+计数。将结果与i期和ii期临床试验报告的免疫应答率进行比较(表22)。表22在模型群体和二项临床试验中ima901的免疫应答率*无评估免疫应答的患者i期和ii期研究结果显示了在不同试验组群中对相同疫苗的免疫应答的变异性。然而,总体而言,由≥2pepi3+测试预测的应答率与报告的临床应答率之间存在良好的一致性。在一项回顾性分析中,上述试验的临床研究者发现,与仅对一种肽应答或没有应答的受试者相比,对ima901疫苗的多种肽应答的受试者明显(p=0.019)更可能经历疾病控制(稳定的疾病,部分应答)。对多种肽应答的8位受试者中的6位(75%)在试验中经历了临床益处,分别与14%和33%的0位和1位肽反答者形成对比。随机ii期试验证实,对多种tumap的免疫应答与较长的总生存率有关。由于pepi的呈递准确地预测了tumap的应答者,所以ima901的临床应答者很可能是可以呈递来自tumap的≥2pepi的患者。该亚群仅占hla-a*02选择患者的27%,并且根据临床试验结果,预期75%的该亚群将经历临床益处。相同的临床结果表明,如果患者选择基于来自tumap的≥3pepi,则100%的患者将经历临床益处,尽管该群体将仅代表hla-a*02选择的患者群体的3%。这些结果表明,在ima901临床试验中研究的患者群体中,疾病控制率(稳定的疾病或部分应答)在3%和27%之间。在缺乏完全应答的情况下,这些患者中只有一部分可以经历生存益处。这些发现解释了在iii期ima901临床试验中缺乏改善的生存率。这些结果还表明,研究群体的hla-a*02富集不足以达到iii期ima901试验中的初级总体生存终点。如ima901试验研究者所指出的,需要开发伴随诊断(cdx)来选择对肽疫苗的可能应答者。这些发现还表明选择具有≥2tumap特异性pepi的患者可以提供足够的富集以证明ima901的显著临床益处。实例12基于鉴定疫苗衍生的多hla结合表位的计算机模拟试验预测了报告的实验临床应答率测定在实例8中描述的模型群体中测定的免疫疗法疫苗的≥2ppi3+评分与临床试验中测定的报告的疾病控制率(dcr,具有完全应答和部分应答和稳定疾病的患者的比例)之间的相关性。从同行评审的科学期刊中发现了用基于肽和dna的癌症免疫疗法疫苗进行的17项临床试验已经公开了疾病控制率(dcr)或客观应答率(orr)(表23)。这些试验涉及594例患者(5个种族),涵盖了29种肿瘤和病毒抗原。根据实体瘤应答评价标准(recist)测定dcr,该标准是目前临床试验的标准,其中临床应答基于最大横截面尺寸的变化42,43,44。在没有可用dcr数据的情况下,使用同样根据recist指南定义的客观应答率(orr)数据。表24比较了模型群体和公开的dcr或orr中每种疫苗的≥2ppi3+评分。观察到预测的和测量的dcr之间的相关性,提供了不仅免疫原性而且癌症疫苗效力取决于个体的多种hla序列(r2=0.76)的进一步证据(图9)。表23选择用于疾病控制率(dcr)预测的临床试验*montanideisa51vg作为佐剂**根据国际骨髓瘤工作组应对标准评估疾病应答45表2417项临床试验中的疾病控制率(dcr)和multipepi评分(预测的dcr)实例13基于多种hla结合表位鉴定的计算机模拟试验预测报告的针对靶向突变抗原的疫苗的细胞免疫应答率表皮生长因子受体变体iii(egfrviii)是广泛表达于多形性胶质母细胞瘤(gbm)和其他肿瘤中的肿瘤特异性突变。突变包括从egfr胞外结构域的801bp的框内缺失,其分裂密码子并在融合连接处产生新的甘氨酸1,2。该突变编码组成型活性酪氨酸激酶,其增加肿瘤形成和肿瘤细胞迁移并增强对辐射和化学疗法的抗性3,4,5,6,7,8,9。这种插入产生了在正常成人组织中没有发现的肿瘤特异性表位,使得egfrviii成为抗肿瘤免疫疗法的合适候选靶10。rindoppimum是一种跨越egfrviii突变的十三氨基酸肽疫苗(leekkgnyvvvtdhc),具有额外的c末端半胱氨酸残基11。在ii期临床研究中,将与匙孔血蓝蛋白(klh)缀合的肽施用于新诊断的表达egfrviii的gbm患者。在辐射完成后4周开始,每二周进行头三次疫苗接种。随后每月给予疫苗直至肿瘤进展或死亡的放射照相证据。所有疫苗在腹股沟区皮内给予。通过dth反应测试评估的18例患者中只有3例发生细胞免疫应答。将具有rindoppeimmut序列的433名受试者的模型群体进行计算机模拟试验。433名受试者中有4名具有pepi3+,证实了ii期研究中发现的低免疫原性(表25)。表25临床试验和计算机模拟研究结果应答者应答率临床试验(ii期)3/1816.6%计算机模拟研究(pepi3+测试)4/4331%模型群体中受试者的hla等位基因上的rindoppimult的hla图谱(图10)说明极少数hla-a和hla-c等位基因可以结合疫苗表位,这解释了在计算机模拟组群中缺乏pepi3+。在最近的iii期临床研究中,当745例患者入选并随机分配到rindoppimult和替莫唑胺(n=371)或对照和替莫唑胺(n=374)组时,无效性得到进一步证明12。在中期分析后,试验终止无效。分析显示总生存率没有显著差异:rindoppeimmut组的平均总生存期为20.1个月(95%ci18.5-22.1),对照组的平均总生存期为20.0(18.1-21.9)个月(hr1.01,95%ci0.79-1.30);p=0.93)。实例13的参考文献1bigneretal.characterizationoftheepidermalgrowthfactorreceptorinhumangliomacelllinesandxenografts.cancerres1990;50:8017–22.2libermannetal.amplification,enhancedexpressionandpossiblerearrangementofegfreceptorgeneinprimaryhumanbraintumoursofglialorigin.nature1985;313:144–7.3chuetal.receptordimerizationisnotafactorinthesignallingactivityofatransformingvariantepidermalgrowthfactorreceptor(egfrviii).biochemj1997;324:855–61.4batraetal.epidermalgrowthfactorligand-independent,unregulated,cell-transformingpotentialofanaturallyoccurringhumanmutantegfrviiigene.cellgrowthdiffer1995;6:1251–9.5nishikawaetal.amutantepidermalgrowthfactorreceptorcommoninhumangliomaconfersenhancedtumorigenicity.pnas1994;91:7727–31.6lammeringetal.inhibitionofthetypeiiiepidermalgrowthfactorreceptorvariantmutantreceptorbydominant-negativeegfr-cd533enhancesmalignantgliomacellradiosensitivity.clincancerres2004;10:6732–43.7naganeetal.acommonmutantepidermalgrowthfactorreceptorconfersenhancedtumorigenicityonhumanglioblastomacellsbyincreasingproliferationandreducingapoptosis.cancerres1996;56:5079–86.8lammeringetal.radiation-inducedactivationofacommonvariantofegfrconfersenhancedradioresistance.radiotheroncol2004;72:267–73.9montgomeryetal.expressionofoncogenicepidermalgrowthfactorreceptorfamilykinasesinducespaclitaxelresistanceandaltersβ-tubulinisotypeexpression.jbiolchem2000;275:17358–63.10humphreyetal.anti-syntheticpeptideantibodyreactingatthefusionjunctionofdeletion-mutantepidermalgrowthfactorreceptorsinhumanglioblastoma.pnas1990;87:4207–11.11sampsonetal.immunologicescapeafterprolongedprogression-freesurvivalwithepidermalgrowthfactorreceptorvariantiiipeptidevaccinationinpatientswithnewlydiagnosedglioblastoma.jclinoncol28:4722-4729.12welleratal.rindopepimutwithtemozolomideforpatientswithnewlydiagnosed,egfrviii-expressingglioblastoma(activ):arandomised,double-blind,internationalphase3trial.lancetoncol2017;18(10):1373-1385.实例14个体的多种hla结合肽可以预测免疫毒性血小板生成素(tpo)是一种在许多患者中引起毒性的高免疫原性蛋白质药物。epivax/genentech使用现有技术鉴定ii类hla限制性表位,并发现tpo免疫原性最强的区域位于tpo的c末端(us20040209324a1)。根据本公开,我们根据400名hlaii类基因分型的美国受试者中的tpo定义了多重ii类hla结合表位(pepi3+)。这些个体的大部分pepi3+肽位于tpo的n末端区域1至165个氨基酸之间。偶尔也在一些受试者中的c末端区域鉴定pepi3+。然而,我们的结果不同于现有技术。公开的文献证实了所公开的结果,展示了免疫毒性区域位于tpo的n-末端的实验证据。40,41大多数用tpo药物治疗的个体制备了针对该药物区域的抗药物抗体(ada)。这些抗体不仅消除了药物的治疗效果,而且还引起全身性不良事件,即免疫毒性,如与血小板减少症、中性白细胞减少症和贫血症相关的抗体依赖性细胞毒性(adcc)和补体依赖性细胞毒性。这些数据证明个体的多种hla结合肽的鉴定预测tpo的免疫毒性。因此,该公开内容可用于鉴定药物的毒性免疫原性区域,鉴定可能经历来自药物的免疫毒性的受试者,鉴定可能被ada靶向的多肽药物的区域,以及鉴定可能经历ada的受试者。实例15用于治疗卵巢癌的个性化免疫疗法组合物本实例描述了用个性化免疫疗法组合物治疗卵巢癌患者,其中基于本文所述的公开内容,基于其hla基因型为患者特别设计组合物。本实例和下面的实例16提供临床数据以支持关于受试者的多种hla结合表位以诱导本公开所基于的细胞毒性t细胞应答的原理。转移性卵巢腺癌患者xyz的hlai类和ii类基因型由唾液样本确定。为了制备用于患者xyz的个性化药物组合物,选择13种肽,每种肽满足以下二个标准:(i)衍生自卵巢癌中表达的抗原,如在同行评审的科学出版物中所报告的;和(ii)包含能够结合患者xyz的至少三种hlai类分子的t细胞表位的片段(表26)。此外,优化每种肽以结合患者的最大数量的hlaii类分子。表26卵巢癌患者xyz个性化疫苗xyz的疫苗靶抗原抗原表达20-mer肽hlai类最大数量hlaii类最大数量poc01_p1akap489%nslqkqlqavlqwiaasqfn35poc01_p2boris82%sgdersdeivltvsnsnvee42poc01_p3spag976%vqkedgrvqafgwslpqkyk33poc01_p4oy-tes-175%evestpmimeniqelirsaq34poc01_p5sp1769%ayfesllekrektnfdpaew31poc01_p6wt163%psqassgqarmfpnapylps41poc01_p7hiwi63%rrsiagfvasinegmtrwfs34poc01_p8prame60%mqdikmilkmvqldsiedle34poc01_p9akap-358%ansvvsdmmvsimktlkiqv34poc01_p10mage-a437%realsnkvdelahfllrkyr32poc01_p11mage-a937%etsyekvinylvmlnarepi34poc01_p12amage-a1052%dvkevdptghsfvlvtslgl34poc01_p12bbage30%saqllqarlmkeespvvswr32根据表10中所示的pepi测试的验证,该免疫疗法组合物中的11种pepi3肽可以以84%的概率诱导xyz中的t细胞应答,并且二种pepi4肽(poc01-p2和poc01-p5)以98%的概率诱导t细胞应答。t细胞应答靶向在卵巢癌中表达的13种抗原。未测试这些癌症抗原在患者xyz中的表达。相反,基于患者癌细胞中抗原表达的概率和≥1pepi3+测试(agp计数)的阳性预测值确定成功杀死癌细胞的概率。agp计数预测疫苗在受试者中的有效性:用pepi在患者肿瘤(卵巢腺癌)中表达的疫苗抗原的数量。agp计数表示疫苗鉴定并诱导针对患者肿瘤的t细胞应答(击中靶标)的肿瘤抗原的数量。agp计数取决于受试者肿瘤中的疫苗—抗原表达率和受试者的hla基因型。正确的值必须在0(没有表达抗原呈递pepi)和抗原的最大数量(所有抗原都表达并呈递pepi)之间。患者xyz将表达12种抗原中的一种或多种的概率如图11所示。agp95=5,agp50=7.9,magp=100%,ap=13。用于患者xyz的药物组合物可以由13种肽中的至少2种组成(表26),因为确定在疫苗或免疫疗法组合物中呈递至少二种可以结合个体的至少三种hla(≥2pepi3+)的多肽片段(表位)可预测临床应答。合成上述肽,并溶解于药学上可接受的溶剂中,在注射前与佐剂混合。希望患者接受至少二种肽疫苗的个性化免疫疗法,但更优选增加杀死癌细胞的可能性并减少复发的机会。为了治疗患者xyz,将12种肽配制成4x3/4肽(poc01/1,poc01/2,poc01/3,poc01/4)。一个治疗周期定义为在30天内施用所有13种肽。患者病史:诊断:转移性卵巢腺癌年龄:51岁家族既往症:结肠癌和卵巢癌(母亲);乳腺癌(祖母)肿瘤病理学:brca1-185delag,braf-d594y,map2k1-p293s,notch1-s2450n·2011:首次诊断为卵巢腺癌;wertheim手术和化疗;淋巴结清除术·2015:心包脂肪组织转移,切除·2016:肝转移瘤·2017:腹膜后及肠系膜淋巴结肿大;初期腹膜癌合并少量腹水先前治疗:·2012:紫杉醇—卡铂(6×)·2014:楷莱—卡铂(1×)·2016-2017(9个月):lymparza(奥拉帕尼)2×400mg/天,口服·2017:和美新(hycamtin)输注5×2.5mg(3x一个系列/月)pit疫苗治疗始于2017年4月21日。表27患者xyz肽治疗方案患者的肿瘤mri检查结果(基线2016年4月15日):·疾病主要限于肝和淋巴结。mri的使用限制了在肺(肺的)转移的检测·2016年5月至2017年1月:奥拉帕尼治疗·2016年12月25日(pit疫苗治疗之前):随着在fu2处获得的应答的确认,肿瘤负荷显著减少·2017年1至3月——topo方案(拓扑异构酶)·2017年4月6日:fu3展示了现有病变的再生长及新病变的出现导致疾病进展·2017年4月21日开始pit·2017年7月21日(在pit的第2个周期之后):fu4表现为病变持续生长,胰腺全面增大,胰腺旁信号异常以及腹水增加·2017年7月26日——cbp+gem+avastin·2017年9月20日(pit的3个周期后)fu5显示病变生长的逆转和改善的胰腺/胰腺旁信号。结果提示假性进展·2017年11月28日(在pit的4个周期之后)fu6在非靶病变消除时表现出最佳应答患者xyz的mri数据如表28和图12所示。表28病变应答汇总表实例16用于治疗乳腺癌的个性化免疫疗法组合物的设计从唾液样本确定转移性乳腺癌患者abc的hlai类和ii类基因型。为了制备用于患者abc的个性化药物组合物,选择12种肽,每种肽满足以下二个标准:(i)衍生自乳腺癌中表达的抗原,如在同行评审的科学出版物中所报告的;和(ii)包含能够结合患者abc的至少三种hlai类分子的t细胞表位的片段(表29)。此外,优化每种肽以结合患者的最大数量的hlaii类。这12种肽靶向12种乳腺癌抗原。患者abc表达12种抗原中的一种或多种的概率如图13所示。表29对治疗乳腺癌患者abc的12种肽brc09疫苗肽类靶抗原抗原表达20-mer肽hlai类最大数量hlaii类最大数量pbrc01_cp1fsip149%isdtkdyfmsktlgigrlkr36pbrc01_cp2spag988%fdrnteslfeelssagsgli32pbrc01_cp3akap485%sqkmdmsnivlmliqkllne36pbrc01_cp4boris71%savfheryaliqhqkthkne36pbrc01_cp5mage-a1159%dvkevdptshsyvlvtslnl34pbrc01_cp6ny-sar-3549%enahgqsleedsaleallnf32pbrc01_cp7hom-tes-8547%masfrkltlsekvppnhpsr35pbrc01_cp8ny-br-147%krasqysgqlkvliaentml36pbrc01_cp9mage-a944%vdpaqlefmfqealklkvae38pbrc01_cp10scp-138%eyereetrqvymdlnnniek33pbrc01_cp11mage-a137%peifgkaseslqlvfgidvk33pbrc01_cp12mage-c221%dsessftytldekvaelvef42预测疗效:agp95=4;pit疫苗诱导针对brc09乳腺癌细胞中表达的4种cta的ctl应答的可能性为95%。其他疗效参数:agp50=6.3,magp=100%,ap=12。在第一次接种所有12种肽后检测到的疗效:肿瘤代谢活性降低83%(petct数据)。为了治疗患者abc,将12种肽配制成4×3肽(pbr01/1、pbr01/2、pbr01/3、pbr01/4)。一个治疗周期定义为在30天内施用所有12种不同的肽疫苗。患者病史:诊断:双侧转移性乳腺癌:右侧乳房er阳性,pr阴性,her2阴性;左侧乳房为er、pr和her2阴性。首次诊断:2013(pit疫苗治疗前4年)2016:伴有膈上和膈下淋巴结累及的广泛转移性疾病。多发性肝肺转移瘤。2016–2017治疗:etrozole,哌柏西利(ibance)和诺雷德(zoladex)结果:2017年3月7日:先前pit疫苗治疗肝脏多发性转移性疾病,伴有胆总管起源真性外部压迫和肝内胆管大量扩张。腹腔、肝门及腹膜后腺病2017年5月26日:1个pit周期后检测疗效:8的肿瘤代谢活性(petct)肝脏、肺淋巴结和其他转移瘤降低3%。检测到的安全性:皮肤反应疫苗施用后48小时内注射部位的局部炎症随访:用5个周期的pit疫苗治疗brc-09。她感觉良好,2017年9月她拒绝了petct检查。11月她出现症状,petct扫描显示进行性疾病,但她拒绝所有治疗。此外,她的肿瘤医生发现,自春夏以来她停止服用pablocyclib。患者abc于2018年1月去世。pablocyclib和个性化疫苗的组合可能是施用疫苗后观察到的显著早期应答的原因。已经证明palbocyclib通过增加hlas的cta呈递和减少treg的增殖来改善免疫疗法的活性:(goeletal.nature.2017:471-475)。pit疫苗可作为现有技术治疗的附加物,以获得最大疗效。实例17用于大规模群体和组合物的乳腺癌疫苗设计考虑到肿瘤抗原和患者hla的异质性,我们使用上述pepi3+测试来设计用于乳腺癌疫苗的肽,该肽在大部分患者中是有效的。如在同行评审的出版物中报告的,乳腺癌cta基于在乳腺癌肿瘤样本中发现的抗原的总表达频率进行鉴定和分级(chenetal.multiplecancer/testisantigensarepreferentiallyexpressedinhormone-receptornegativeandhigh-gradebreastcancers.plosone2011;6(3):e17876.;kanojiaetal.sperm-associatedantigen9,anovelbiomarkerforearlydetectionofbreastcancer.cancerepidemiolbiomarkersprev2009;18(2):630–639.;sainietal.anovelcancertestisantigen,a-kinaseanchorprotein4(akap4)isapotentialbiomarkerforbreastcancer.plosone2013;8(2):e57095)。对于选择的cta,我们使用pepi3+测试和实例8中描述的模型群体来鉴定9-mer表位(pepi3+),其最常由模型群体中的个体的至少3种hla呈递。我们在本文中将这些表位称为“bestepi”。图14显示了prame抗原的“pepi3+热点”分析和bestepi鉴定的说明性实例。我们将报告的每种cta的表达频率(n%)乘以模型群体中pepi3+热点的频率(b%),以鉴定将在最高比例的个体中诱导针对乳腺癌抗原的免疫应答的t细胞表位(9-mer)(表30)。然后我们选择了包含每种选定的9-mer的15-mer(表30)。使用下面实例22中描述的方法,选择15-mer与大多数受试者的大多数hlaii类等位基因结合。这些15-mer可以在最高比例的受试者中诱导ctl和辅助性t细胞应答。表30用于选择用于疫苗组合物的乳腺癌肽的bestepi列表。ntotal:分析某种抗原表达的样本数量;n+:表达某种抗原的个体数量;n%:某种抗原的表达频率;b%:bestepi频率,即在模型群体中具有bestepi的个体的百分比;n%*b%:表达式频率乘以bestepi频率。然后我们设计了31种30-mer肽。每个片段由二个优化的15-mer片段组成,通常来自不同频率的cta,其中15-mer片段首尾相连排列,每个片段包含表30中的9-mer(bestepi)中的一个。选择这些30-mer肽中的9个作为一组肽,被称为polypepi915(表31)。图15以单一和组合形式显示了polypepi915靶向的10种cta的表达频率。表31选定的用于polypepi915组/组合物的乳腺癌疫苗肽*在模型群体(n=433)中具有cd8+t细胞特异性pepi3+的个体的百分比。**在模型群体(n=433)中具有cd4+t细胞特异性pepi4+的个体的百分比。polypepi915的表征可以通过包括靶向疫苗或免疫疗法方案中的多种cta的肽序列来解决肿瘤异质性。polypepi915组合物靶向10种不同的cta。基于这10种cta的抗原表达率,我们模拟了癌细胞中预测的表达抗原平均数(ag50)和具有95%可能性的表达抗原的最小数量(ag95)。95%的个体表达10种靶抗原中的最少4种(ag95=4),如图16中的抗原表达曲线所示。上述ag值表征独立于目标患者群体的疫苗。它们可用于预测特定癌症(例如乳腺癌)表达特定疫苗或免疫疗法组合物靶向的抗原的可能性。ag值基于已知的肿瘤异质性,但不考虑hla异质性。某些群体的hla异质性可以通过代表pepi3+的抗原数量从免疫疗法或疫苗组合物的角度来表征。这些是预测≥1pepi3+的疫苗特异性cta抗原,在本文中称为“ap”。具有pepi3+的抗原的平均数量(ap50)显示疫苗如何诱导针对组合物靶向的抗原的免疫应答(乳腺癌疫苗特异性免疫应答)。polypepi915组合物可诱导针对平均5.3种疫苗抗原的免疫应答(ap50=5.30),并且95%的模型群体可诱导针对至少一种疫苗抗原的免疫应答(ap95=1)(图17)。疫苗可以通过agp值进一步表征,所述agp值是指具有pepi的抗原。该参数是前二个参数的组合:(1)ag取决于特定肿瘤类型中的抗原表达频率,但不取决于群体中个体的hla基因型,和(2)ap取决于群体中的个体的hla基因型,而不考虑抗原表达频率。agp取决于疾病中疫苗抗原的表达频率和群体中个体的hla基因型。结合模型群体中乳腺癌ag和ap的数据,我们确定了polypepi915的agp值,它代表诱导针对乳腺肿瘤中表达的抗原的免疫应答的疫苗抗原的概率分布。对于polypepi915,模型群体中的agp50值为3.37。agp92=1,意味着模型群体中92%的受试者诱导针对至少一种表达的疫苗抗原的免疫应答(图18)。实例18使用疫苗伴随诊断测试的可能的应答者患者选择特定患者对例如如上所述的一种或多种癌症疫苗肽的治疗具有免疫应答或临床应答的可能性可以基于(i)疫苗肽内(能够结合患者的至少三种hla的9-mer表位)pepi3+的鉴定来确定;及/或(ii)患者癌细胞中的靶抗原表达的测定,例如在肿瘤活检中测量来确定。在一些情况下,二个参数都是理想确定的,并选择疫苗肽的最佳组合用于治疗患者。然而,如果例如通过活组织检查确定表达的肿瘤抗原是不可能的、不建议的或由于活组织检查错误而不可靠(即从小部分或转移的肿瘤中获取的活组织检查组织样本不代表患者中表达的cta的全部所有组成成分),则可以单独使用pepi3+分析。实例19polypepi915与竞争性乳腺癌疫苗的比较我们使用上述的计算机模拟临床试验模型来预测已经在临床试验中研究的竞争性乳腺癌疫苗的免疫应答率(表32)。免疫应答率在3%至91%之间。单肽疫苗在3%至23%的个体中具有免疫原性。相比之下,上述实例18(表29)中描述的30-mer肽各自在相同组群中44%至73%的个体中具有免疫原性。该结果代表了每种肽在polypepi915中免疫原性的显著改善。竞争组合肽产物免疫应答率在10%至62%之间。本发明的polypepi915组合产品在模型群体中为96%,在乳腺癌患者群体中为93%,代表免疫原性的改善。表32竞争性乳腺癌疫苗的预测免疫应答率*具有≥1pepi3+的受试者的比例使用polypepi915疫苗的另一个改进是肿瘤逃逸的机会较低。polypepi915中的每个30-mer肽靶向2种肿瘤抗原。针对更多肿瘤抗原的ctl比针对单一肿瘤抗原的ctl更有效地针对异源肿瘤细胞。另一个改进是polypepi915疫苗是可能应答疫苗接种的个体可以使用本文所述的方法基于其hla基因型(序列)和任选地在其肿瘤中的抗原表达来鉴定。含有polypepi疫苗的药物组合物不会施用于这类的个体,其中的hla不能呈递任何来自疫苗的pepi3。在临床试验期间,将polypepi915方案中magp或agp的数量与个体应答的持续时间之间进行相关。最可能需要具有>1agp的疫苗组合来破坏异源肿瘤细胞。实例20结肠直肠癌疫苗设计和组合物我们示出了使用上述相同设计方法的结肠直肠疫苗组合物的另一个实例。考虑到肿瘤抗原和患者hla的异质性,我们使用上述pepi3+测试设计用于结肠直肠癌疫苗的肽,其在大部分患者中是有效的。根据同行评审的出版物中报告的,结肠直肠癌cta基于在结肠直肠癌肿瘤样本中发现的抗原的总表达频率进行鉴定和分级(图19)。(choij,changh.theexpressionofmageandssx,andcorrelationofcox2,vegf,andsurvivinincolorectalcancer.anticancerres2012.32(2):559-564.;goossens-beumerij,zeestratenec,benarda,christent,reimersms,keijzerr,siercf,liefersgj,morreauh,putterh,vahrmeijeral,vandeveldecj,kuppenpj.clinicalprognosticvalueofcombinedanalysisofaldh1,survivin,andepcamexpressionincolorectalcancer.brjcancer2014.110(12):2935-2944.;lim,yuanyh,hany,liuyx,yanl,wangy,guj.expressionprofileofcancer-testisgenesin121humancolorectalcancertissueandadjacentnormaltissue.clinicalcancerres2005.11(5):1809–1814).为了选择最常表达的结肠直肠癌cta,我们使用实例8中描述的pepi3+测试和模型群体来鉴定“bestepis”。我们将报告的每种cta的表达频率(n%)乘以模型群体中pepi3+热点的频率(b%),以鉴定将在最高比例的个体中诱导针对乳腺癌抗原的免疫应答的t细胞表位(9-mer)(表33)。然后我们选择了包含每种选定的9-mer的15-mer(表33)。使用下面实例22中描述的方法,选择15-mer与大多数受试者的大多数hlaii类等位基因结合。这些15-mer可以在最高比例的受试者中诱导ctl和辅助性t细胞应答。表33用于选择结肠直肠癌肽疫苗组合物的bestepi列表。ntotal:分析某种抗原表达的活检样本(人结肠直肠癌组织中的肿瘤特异性抗原表达)的数量;n+:表达某种抗原的个体数量;n%:某种抗原的表达频率;b%:bestepi频率,即在模型群体中具有bestepi的个体的百分比;n%*b%:表达式频率乘以bestepi频率。然后我们设计了31种30-mer肽。每个片段由二个优化的15-mer片段组成,通常来自不同频率的cta,其中15-mer片段首尾相连排列,每个片段包含上述的9-mer(bestepi)中的一个。选择这些30-mer肽中的9个作为一组肽疫苗,被称为polypepi1015(表34)。图19以单一和组合形式显示了polypepi1015靶向的8种cta的表达频率。表34-选定的用于polypep1015组合物的结肠直肠癌疫苗肽*在模型群体(n=433)中具有cd8+t细胞特异性pepi3+的个体的百分比。**在模型群体(n=433)中具有cd4+t细胞特异性pepi4+的个体的百分比。polypep1015大肠癌疫苗的表征肿瘤异质性:polypep1015组合物靶向8种不同的cta(图19)。基于这8种cta的抗原表达速率,ag50=5.22且ag95=3(图20)。患者异质性:ap50=4.73且ap95=2(ap95=2)(图21)。肿瘤和患者的异质性:agp50=3.16且agp95=1(模型群体)(图22)。实例21结肠直肠癌疫苗肽与竞争性结肠直肠癌疫苗的比较我们使用上述的计算机模拟临床试验模型来测定现有技术和目前开发的crc肽疫苗的t细胞应答者比率,并与polypep1015进行比较(表34)。我们的pepi3+测试证明竞争疫苗可以在一部分受试者(2%至77%)中诱导针对一种肿瘤抗原的免疫应答。然而,对于2种竞争性多抗原疫苗的多抗原(多pepi)应答测定导致没有或2%应答者。*在疫苗组合物的1种或2、3、4或5种抗原的情况下,应答者的百分比是来自具有hlai(cd8+t细胞应答)的1≥pepi3+模型群体的受试者的比率。由于多pepi应答与肿瘤疫苗诱导的临床应答相关,因此任何竞争性疫苗在98%的患者中不太可能显示临床益处。相反,我们预测95%受试者中的多pepi应答,表明在大多数患者中临床益处的可能性。表35polypep1015和竞争性结肠直肠癌疫苗的预测免疫应答率实例22通过polypep1018结肠直肠癌疫苗举例说明的设计方法的疗效polypep1018结肠直肠癌(crc)疫苗(polypep1018)组合物是一种肽疫苗,旨在用作使用伴侣体外诊断试验(cdx)鉴定为可能应答者的患者的标准护理crc治疗选择的附加免疫疗法。美国和意大利正在进行临床试验以评估转移性结肠直肠癌患者中的polypep1018。该产品含有与佐剂montanide混合的6种肽(实例18至20中描述的30-mer肽polypep1015中的6种)。选择这6种肽以诱导针对最常在crc中表达的7种癌睾丸抗原(cta)的12个表位的t细胞应答。优化这6种肽以诱导持久的crc特异性t细胞应答。可以使用伴随诊断(cdx)来选择具有针对肿瘤中表达的多种cta的t细胞应答的可能应答患者。该实例阐述了用于设计polypep1018的精确工艺。该方法可用于设计针对其他癌症和疾病的疫苗。a.多抗原靶标的选择肿瘤抗原的选择对于癌症疫苗的安全性和效力是必需的。良好抗原的特征是在正常组织中表达受限,从而防止自身免疫。几类抗原满足该要求,包括独特突变的抗原(例如p53)、病毒抗原(例如宫颈癌中的人乳头瘤病毒抗原)和分化抗原(例如b细胞淋巴瘤中表达的cd20)。发明人选择多种癌睾丸抗原(cta)作为靶抗原,因为它们在各种类型的肿瘤细胞和睾丸细胞中表达,但不在任何其他正常体细胞组织或细胞中表达。cta是疫苗的理想靶标,原因至少如下:·组织学分级较高且临床分期较晚的肿瘤常表现出较高的cta表达频率·只有肿瘤细胞亚群表达某种cta·不同的癌症类型在cta表达频率上有显著差异·对cta呈阳性的肿瘤通常表现出多于一种cta的同时表达·没有一种cta似乎是细胞表面抗原,因此它们是癌症疫苗的独特靶标(它们不是基于抗体的免疫疗法的合适靶标)为了鉴定polypep1018的靶cta,发明人构建了cta表达知识库。该知识库包含以按表达率分级的crc表示的cta。发明人进行的相关研究(参见实例11)表明诱导针对肿瘤细胞中表达的多种抗原的ctl应答的疫苗可使患者受益。因此,选择在crc中具有高表达率的7种cta包含在polypep1018开发中。详情列于表36中。表36polypep1018crc疫苗中的靶ctab.通过基于pepi3+生物标志物的疫苗设计实现精确靶向如上所述,pepi3+生物标志物预测受试者的疫苗诱导的t细胞应答。发明人开发并验证了从抗原序列和hla基因型准确鉴定pepi的测试(实例1、2、3)。pepi测试算法用于从包含在polypep1018crc疫苗中的7种靶cta中鉴定优势pepi(bestepi)。用本文所述方法鉴定的优势pepi可以在最高比例的受试者中诱导ctl应答:i.在模型群体的433名受试者中的每一名中鉴定来自7种cta靶标的所有hlai类结合pepi;ii.鉴定优势pepi(bestepi),它们是存在于最大亚群中的pepi。下表给出了衍生自聚pep1018中7种cta的12个优势pepi。模型群体中pepi%表示具有所示pepi的433名受试者的比例,即其中所示pepi可诱导ctl应答的受试者的比例。尽管在鉴定过程中使用了优化步骤,但是在诱导ctl应答的优势pepi中存在非常高的变异性(18%-78%)。表37polypep1018中crc特异性hlai类结合的优势pepi发明人优化了每种优势pepi以结合大多数受试者的多数hlaii类等位基因。这应该增强效力,因为它将诱导cd4+辅助性t细胞,其可以增强cd8+ctl应答并有助于长期持续的t细胞应答。图4所示的实例证明,结合≥3hlaii类等位基因的pepi最可能激活辅助性t细胞。用本文所述方法选择的15-mer肽含有hlai类和ii类结合的优势pepi。因此,这些肽可以在最高比例的受试者中诱导ctl和辅助性t细胞应答。过程:1.鉴定400例正常供体的hlaⅱ类基因型*;2.用与来源抗原匹配的氨基酸在二侧延伸每个9-mer的优势pepi(表33);3.iedb算法预测400例正常供体的hlaii类pepi;4.选择最高比例的具有hlaii类结合pepi的受试者15-mer肽;5.当连接二种15-mer肽时,确保每种疫苗肽中存在一个优势hlaii类pepi。表38显示了衍生自polypep1018中7种cta的12种优化的15-mer肽。这些肽具有不同的hlaii类结合特征。尽管这种优化的个性化疫苗设计,这些肽中pepi生成能力(≥3hla结合)存在高变异性(0%至100%)。表38polypep1018中抗原特异性hlaii类结合pepi与较短的肽相比,30-mer疫苗肽具有以下优点:(i)多个精确选择的肿瘤特异性免疫原:每种30-mer含有二种精确选择的癌症特异性免疫原性肽,其能够在大多数相关群体(类似于模型群体)中诱导ctl和辅助性t细胞应答。(ii)确保天然抗原呈递:长为30-mer的多肽可被视为前药:它们本身不具有生物活性,但被加工成较小的肽(长为9至15个氨基酸),以便被装载到专门的抗原呈递细胞的hla分子中。由长肽接种产生的抗原呈递反映了在hlai类和ii类分子中呈递的生理途径。此外,细胞中的长肽加工比大的完整蛋白质的加工更有效。(iii)排除诱导耐受性t细胞应答:9-mer肽不需要由专业抗原呈递细胞加工,因此与hlai类分子外源结合。因此,注射的短肽将大量结合到具有表面hlai类的所有有核细胞的hlai类分子上。相反,>20-mer长的肽在与hlai类结合之前由抗原呈递细胞加工。因此,用长肽接种不太可能导致耐受性并将促进所需的抗肿瘤活性。(iv)诱导持久的t细胞应答,因为它可以通过与多种hlaii类分子结合来刺激辅助性t细胞应答(v)实用性:gmp的生产、配制、质量控制和施用较少数量的肽(每种具有所有上述特征)比提供不同特征的较多数量的肽更可行。polypep1018中的每种30-mer肽由2种hlai类结合的优势pepi和至少一种hlaii类强结合的pepi组成。强结合pepi在>50%的个体中与4种hlaii类等位基因结合。因此,疫苗肽适合于一般群体(其是crc疫苗设计的相关群体)中的个体受试者的hlai类和ii类等位基因。如上所述,受试者中的hla基因型高度变异性导致由polypep1018诱导的t细胞应答的高变异性。这证明了确定可能的应答者的cdx的共同开发是合理的。pep13+和>2pep13+生物标志物可分别预测用实例11和12中详述的polypep1018接种的受试者的免疫应答和临床应答。这些生物标志物将用于共同开发预测对polypep1018crc疫苗的可能应答者的cdx。实例23polypep1018crc疫苗的组成和免疫原性的分析所选的用于polypep1018组合物的肽如表39所示。表39选择的用于polypep1018组合物的结肠直肠癌疫苗肽*在模型群体(n=433)中具有cd8+t细胞特异性pepi3+的个体的百分比。**在正常供体(n=400)中具有cd4+t细胞特异性pepi4+的个体的百分比。免疫原性表征发明人使用pepi3+测试来表征在具有完整hla基因型数据的37例crc患者组群中polypepi018的免疫原性。预测每个患者中针对将用于临床试验的相同9-mer肽的t细胞应答。这些肽代表了polypep1018肽中12种优势pep13+。9-mer如表39所示。pepi3+预测的特异性和敏感性取决于预测结合特定表位的hla的实际数量。具体地,发明人已经确定了一种hla限制性表位在受试者中诱导t细胞应答的概率通常为4%,这解释了基于hla限制性表位预测的现有技术预测方法的低敏感性。应用pepi3+方法,发明人确定了在37例crc患者中,polypepi018诱导t细胞对每种优势pepi3+特异性应答的概率。该分析的结果总结于表40中。表4037例crc患者中polypep1018的6种肽中的优势pepi的概率缩写:crc=结肠直肠癌;pepi=个人表位注:百分比代表polypepi1018诱导的cd8+t细胞应答的可能性。总之,这些结果表明polypep1018中免疫原性最强的肽是crc-p8,预测其在大多数患者中结合>3hla。最不具有免疫原性的肽crc-p3在许多患者中与>1hla结合并且具有22%的机会诱导t细胞应答。由于用于检测t细胞应答的生物测定法不如pepi3+准确,该计算可以是crc患者中t细胞应答的最准确表征。尽管mage-a8和spag9在用于疫苗设计的模型群体中具有免疫原性,但是37例crc患者中不存在mage-a8特异性pepi3+,并且只有1例患者(3%)具有spag9特异性pepi3+。毒性表征——immunoblast开发了一种可以对任何抗原进行的方法,以确定其诱导毒性免疫反应如自身免疫的可能性。该方法在本文中称为immunoblast。polypep1018含有6种30-mer多肽。每种多肽由衍生自在crc中表达的抗原的二种15-mer肽片段组成。新表位可能在二种15-mer肽的连接区域产生,并且可能诱导针对健康细胞的不希望的t细胞应答(自身免疫)。使用发明人应用immunoblast方法评估了这一点。设计了polypep1018的每种30-mer组分的16-mer肽。每种16-mer含有来自30-mer的第一15个残基末端的8个氨基酸和来自30-mer的第二15个残基起点的8个氨基酸,因此精确地跨越二个15-mer的连接区域。然后使用blast(https://blast.ncbi.nlm.nih.gov/blast.cgi)分析这些16-mer以鉴定与人序列的局部相似性的交叉反应区域,其将蛋白质序列与序列数据库进行比较并计算匹配的统计学显著性。选择16-mer中的8-mer作为检测长度,因为该长度代表肽形成表位所需的最小长度,并且是hla结合过程中锚定点之间的距离。如图23所示,多肽中氨基酸的位置被编号。可与hla结合并形成新表位的潜在9-mer肽的起始位置是8–15位的8个氨基酸。由可形成药物活性表位的15-mer携带的肿瘤抗原衍生肽的起始位置在位置1–7和16–22为7+7=14个氨基酸。可能的新表位生成肽的比例为36.4%(8/22)。pep13+测试用于鉴定连接区域9-mer表位中的新表位和neopep1。通过确定在连接区域的9-mer中具有pep1i3+的受试者的比例,在模型群体的433名受试者中评估了polypep1018诱导不需要的t细胞应答的风险。新表位/neopepi分析的结果总结于表41中。在模型群体的433名受试者中,可通过细胞内加工产生的平均预测表位数为40.12。经常产生新表位;40.12个表位中的11.61(28.9%)个是新表位。大多数肽能够被鉴定为新表位,但是呈递新表位的受试者的数量不同。polypep1018携带的表位平均产生5.21pep13+。这些pepi可以激活受试者中的t细胞。潜在的新pepi的量远低于新表位(3.7%)。在一些受试者中,这些neopepi与pepi竞争t细胞激活的可能性很小。重要的是,激活的neopepi特异性t细胞在健康组织上没有靶标。表41polypep1018的潜在新表位的鉴定缩写:crc=结肠直肠癌;hla=人白细胞抗原;pepi=个人表位polypep1018中的每种30-mer肽都被释放用于临床开发,因为除了靶标cta外,连接区域中的8-mer中没有一种与任何人类蛋白匹配。活性/效力表征发明人已经开发了药效学生物标志物以预测疫苗在个体人类受试者以及人类受试者群体中的活性/效力。这些生物标志物加速了更有效的疫苗开发并且还降低了开发成本。发明人有以下工具:抗原表达知识库:发明人已经收集了在同行评审的科学期刊中发表的关于肿瘤细胞表达的肿瘤抗原的实验的数据,并且通过肿瘤类型组织以创建cta表达水平的数据库——cta数据库(ctadb)。截至2017年4月,ctadb包含来自来自41,132个肿瘤样本的145个cta的数据,并且由不同类型癌症中的cta表达频率组织。计算机模拟试验群体:发明人还收集了关于几种不同模型群体的hla基因型的数据。群体中的每个个体具有完整的4位hla基因型和种族数据。群体总结于表42中。表42计算机模拟试验群体缩写:crc=结肠直肠癌;hla=人白细胞抗原使用这些工具(或可能等效的数据库或模型群体),可以评估以下标记:·ag95——疫苗效力:癌症疫苗中特异性肿瘤类型以95%概率表达的抗原数量。ag95是疫苗效力的指标,并且不依赖于疫苗抗原的免疫原性。根据在ctadb中收集的肿瘤抗原表达率数据计算ag95。在技术上,ag95由cta的二项式分布确定,并考虑了所有可能的变化和表达率。在该研究中,ag95通过用最宽范围的抗原累积一定数量的表达抗原的概率来计算,其中概率总和小于或等于95%。正确的值在0(95%概率预期没有表达)和抗原的最大数量(95%概率所有抗原表达)之间。·pepi3+计数——受试者中疫苗的免疫原性:疫苗衍生的pepi3+是在受试者中诱导t细胞应答的个人表位。可在已知完整4位hla基因型的受试者中使用pepi3+测试确定pepi3+。·ap计数——受试者中疫苗的抗原性:具有pepi3+的疫苗抗原的数量。如polypep1018的疫苗含有来自在肿瘤细胞中表达的抗原的序列。ap计数是疫苗中含有pepi3+的抗原数量,ap计数代表疫苗中可以在受试者中诱导t细胞应答的抗原数量。ap计数表征了受试者的疫苗—抗原特异性t细胞应答,因为其仅依赖于受试者的hla基因型并且独立于受试者的疾病、年龄和药物治疗。正确的值在0(没有抗原呈递pepi)和抗原的最大数量(所有抗原均呈递pepi)之间。·ap50——群体中疫苗的抗原性:群体中具有pepi的疫苗抗原的平均数量。ap50适于在给定群体中表征疫苗—抗原特异性t细胞应答,因为它取决于群体中受试者的hla基因型。在技术上,在模型种群中计算ap计数,并将结果的二项分布用于计算ap50。·agp计数——受试者中疫苗的效力:具有pepi的肿瘤中表达的疫苗抗原的数量。agp计数表示疫苗鉴定并诱导t细胞应答(击中靶标)的肿瘤抗原的数量。agp计数取决于受试者肿瘤中的疫苗—抗原表达率和受试者的hla基因型。正确的值在0(没有表达抗原呈递的pepi)和抗原的最大数量(所有抗原都表达并呈递pepi)之间。·agp50——群体中的癌症疫苗效力:群体中具有pepi(即agp)的指定肿瘤中表达的疫苗抗原的平均数。agp50表示疫苗诱导的t细胞应答能够鉴定的肿瘤抗原的平均数。agp50取决于所示肿瘤类型中抗原的表达率和目标群体中抗原的免疫原性。agp50可评估不同群体中的疫苗效力,并可用于比较相同群体中的不同疫苗。agp50的计算类似于用于ag50的计算,除了表达通过受试者中表达的疫苗抗原上pepi3+的出现加权。在每个受试者具有来自每种疫苗抗原的pepi的理论群体中,agp50将等于ag50。在另一个理论群体中,其中没有受试者具有来自任何疫苗抗原的pepi,agp50将为0。通常,以下陈述有效:0≤agp50≤ag50。·magp——用于选择可能的应答者的候选生物标志物:癌症疫苗诱导针对在指定肿瘤中表达的多种抗原的t细胞应答的可能性。magp由crc中疫苗—抗原的表达率和受试者中疫苗衍生的pepi的呈递率来计算。在技术上,基于agp分布,magp是多个agp(>2个agp)的概率之和。应用这些标志物评估个体crc患者的抗原性和效力表43显示了分别使用ap和agp50的37例crc患者中polypep1018的抗原性和效力。正如从polypep1018特异性t细胞应答的高度变异性所预期的(见表41),ap和agp50具有高度变异性。polypep1018中免疫原性最强的抗原是foxo39;每例患者都具有pepi3+。然而,foxo39仅表达39%的crc肿瘤,表明61%的患者将具有不识别肿瘤的foxo39特异性t细胞应答。免疫原性最弱的抗原为mage-a8;尽管抗原在44%的crc肿瘤中表达,但37例crc患者中没有一例具有pepi3+。这些结果表明在确定癌症疫苗的效力时,可以考虑抗原的表达和免疫原性。agp50表示具有pepi的crc肿瘤中表达的抗原的平均数量。具有较高agp50值的患者更可能应答polypep1018,因为较高agp50值表明疫苗可诱导针对crc细胞中表达的更多抗原的t细胞应答。表43中的最后一列显示了37例crc患者中每一例中magp(多个agp;即,至少2agp)的概率。crc患者中平均magp为66%,表明crc患者诱导针对肿瘤中表达的多种抗原的t细胞应答的可能性为66%。表4337例crc患者中polypep1018的抗原性(ap计数)、效力(agp50计数)和magp缩写:crc=结肠直肠癌;pepi=个人表位;cta=癌睾丸抗原;ap=具有≥1pepi的表达抗原这些生物标志物在疫苗开发和常规临床实践中具有直接效用,因为它们不需要侵入性活检。抗原表达数据可以从获得的肿瘤样本获得并组织在数据库中。可以从唾液样本进行4位hla基因型分型。它是由全球认证实验室进行的用于移植和亲子鉴定的经过验证的测试。这些评估将使得药物开发人员和医生更深入地了解肿瘤应答的免疫原性和活性以及可能出现的耐药性。应用这些标志物评估polypepi1018在群体中的抗原性和效力polypep1018crc疫苗在普通群体中的抗原性polypep1018在受试者中的抗原性通过ap计数确定,ap计数指示在受试者中诱导t细胞应答的疫苗抗原的数量。使用pepi测试在模型群体中的433名受试者中的每一名中测定polypep1018的ap计数,然后计算模型群体的ap50计数。如图24所示,模型群体中polypep1018的ap50为3.62。因此,普通群体中polypep1018中免疫原性抗原(即≥1pepi的抗原)的平均数为3.62。polypep1018crc疫苗在普通群体中的效力如果疫苗中的pepi由肿瘤细胞呈递,则疫苗诱导的t细胞可以识别并杀死肿瘤细胞。agp(具有pepi的表达抗原)的数量是个体中疫苗效力的指标,并且取决于polypep1018的效力和抗原性。如图25所示,在模型群体中,polypep1018中免疫原性cta(即ap[具有≥1pepi的表达抗原])的平均数为2.54。polypep1018在模型群体中的受试者中诱导针对多种抗原(即magp)的t细胞应答的可能性是77%。不同群体polypep1018crc疫苗活性比较表44显示了polypep1018在不同群体中的免疫原性、抗原性和效力的比较。表44polypep1018在不同亚群中的免疫原性、抗原性和效力的比较缩写:crc=结肠直肠癌;pepi=个人表位;sd=标准偏差;ap=具有≥1pepi的表达抗原pepi3+和ap结果的平均数表明,polypepi018在所有群体中具有高度免疫原性和抗原性;polypep1018可诱导针对2.9–3.7crc抗原的平均3.7–6.0crc特异性t细胞克隆。polypep1018免疫原性在crc患者和平均群体中相似(p>0.05),这种相似性可能是由于crc群体的样本量较小。其他分析表明,与爱尔兰或普通群体相比,polypep1018在中国群体中具有显著更高的免疫原性(p<0.0001)。免疫原性的差异也反映在以agp50为特征的疫苗效力上;polypep1018在中国群体中最有效,在爱尔兰群体中效果较差。由于cdx将用于选择对polypep1018的可能应答者,种族差异将仅反映在与爱尔兰个体相比有资格接受治疗的中国个体的较高百分比中。实例24用于治疗患有晚期转移性乳腺癌患者的个性化免疫疗法组合物患者brc05被诊断为患有右侧炎性乳腺癌合并广泛的淋巴管癌。炎性乳腺癌(ibc)是一种罕见但侵袭性的局部晚期乳腺癌。它被称为炎性乳腺癌,因为其主要症状是肿胀和发红(乳房通常看起来发炎)。大多数炎性乳腺癌是浸润性导管癌(从乳管开始)。这种类型的乳腺癌与高风险人乳头瘤病毒的癌蛋白的表达有关。实际上,该患者的肿瘤中诊断出hpv16dna。2011年患者阶段(pit疫苗治疗前6年)t4:直接延伸至胸壁及/或皮肤的任何大小的肿瘤(溃疡或皮肤结节)pn3a:腋窝淋巴结转移≥10个(至少1个肿瘤沉积≥2.0mm);或转移到锁骨下(iii级腋窝淋巴结)节点。为患者brc05设计并制备了14种疫苗肽(表45)。基于群体表达数据为该患者制备肽pbrc05-p01-p10。表45中的最后3种肽(ssx-2、morc、mage-b1)是从直接在患者肿瘤中测量表达的抗原设计的。表45患者brc05的疫苗肽brc05疫苗肽靶抗原抗原表达20-mer肽hlai类最大值hlaii类最大值pbrc05_p1spag988%xxxxxxxxxxxxxxxxxxxx34pbrc05_p2akap485%xxxxxxxxxxxxxxxxxxxx34pbrc05_p3mage-a1159%xxxxxxxxxxxxxxxxxxxx33pbrc05_p4ny-sar-3549%xxxxxxxxxxxxxxxxxxxx33pbrc05_p5fsip149%xxxxxxxxxxxxxxxxxxxx33pbrc05_p6ny-br-147%xxxxxxxxxxxxxxxxxxxx34pbrc05_p7mage-a944%xxxxxxxxxxxxxxxxxxxx33pbrc05_p8scp-138%xxxxxxxxxxxxxxxxxxxx36pbrc05_p9mage-a137%xxxxxxxxxxxxxxxxxxxx33pbrc05_p10mage-c221%xxxxxxxxxxxxxxxxxxxx33pbrc05_p11mage-a1213%xxxxxxxxxxxxxxxxxxxx34pbrc05_p12ssx-26%xxxxxxxxxxxxxxxxxxxx31pbrc05_p13morcndxxxxxxxxxxxxxxxxxxxx34pbrc05_p14mage-b1ndxxxxxxxxxxxxxxxxxxxx33注意:粗红色表示cd8pepi,下划线表示最佳结合cd4等位基因。在第一次用肽pbrc05_p1、pbrc05_p2、pbrc05_p3、pbrc05_p4、pbrc05_p5、pbrc05_p6、pbrc05_p7混合物免疫2周后,在外周单核细胞中检测t细胞应答。表46抗原特异性t细胞应答:斑点数/300,000pbmc抗原刺激物经验值1经验值2平均值spag9pbrc05_p1211.5akap4pbrc05_p21147.5mage-a11pbrc05_p3263229ny-sar-35pbrc05_p4472497484.5fsip1pbrc05_p5317321319ny-br-1pbrc05_p681210mage-a9pbrc05_p7232725无阴性对照(dmso)031.5结果显示用7种肽进行的单次免疫诱导了针对7种肽中的3种的有效t细胞应答,证明了有效的mage-a11、ny-sar-35、fsip1和mage-a9特异性t细胞应答。对akap4和ny-br-1的应答较弱,对spag9没有应答。参考资料1bagarazzietal.immunotherapyagainsthpv16/18generatespotentth1andcytotoxiccellularimmuneresponses.sciencetranslationalmedicine.2012;4(155):155ra138.2gudmundsdotteretal.amplifiedantigen-specificimmuneresponsesinhiv-1infectedindividualsinadoubleblinddnaimmunizationandtherapyinterruptiontrial.vaccine.2011;29(33):5558-66.3bioleyetal.hlaclassi-associatedimmunodominanceaffectsctlresponsivenesstoanesorecombinantproteintumorantigenvaccine.clincancerres.2009;15(1):299-306.4valmorietal.vaccinationwithny-eso-1proteinandcpginmontanideinducesintegratedantibody/th1responsesandcd8tcellsthroughcross-priming.proceedingsofthenationalacademyofsciencesoftheunitedstatesofamerica.2007;104(21):8947-52.5yuanetal.integratedny-eso-1antibodyandcd8+t-cellresponsescorrelatewithclinicalbenefitinadvancedmelanomapatientstreatedwithipilimumab.procnatlacadsciusa.2011;108(40):16723-16728.6kakimietal.aphaseistudyofvaccinationwithny-eso-1fpeptidemixedwithpicibanilok-432andmontanideisa-51inpatientswithcancersexpressingtheny-eso-1antigen.intjcancer.2011;129(12):2836-46.7wadaetal.vaccinationwithny-eso-1overlappingpeptidesmixedwithpicibanilok-432andmontanideisa-51inpatientswithcancersexpressingtheny-eso-1antigen.jimmunother.2014;37(2):84-92.8weltersetal.inductionoftumor-specificcd4+andcd8+t-cellimmunityincervicalcancerpatientsbyahumanpapillomavirustype16e6ande7longpeptidesvaccine.clin.cancerres.2008;14(1):178-87.9kenteretal.vaccinationagainsthpv-16oncoproteinsforvulvarintraepithelialneoplasia.nengljmed.2009;361(19):1838-47.10weltersetal.successorfailureofvaccinationforhpv16-positivevulvarlesionscorrelateswithkineticsandphenotypeofinducedt-cellresponses.pnas.2010;107(26):11895-9.11http://www.ncbi.nlm.nih.gov/projects/gv/mhc/main.fcgi?cmd=initthemhcdatabase,ncbi.(2016年3月7日访问)12karkadaetal.therapeuticvaccinesandcancer:focusondpx-0907.biologics.2014;8:27-38.13buttsetal.randomizedphaseiibtrialofblp25liposomevaccineinstageiiibandivnon-small-celllungcancer.jclinoncol.2005;23(27):6674-81.14yuanetal.safetyandimmunogenicityofahumanandmousegp100dnavaccineinaphaseitrialofpatientswithmelanoma.cancerimmun.2009;9:5.15kovjazinetal.immucin:anoveltherapeuticvaccinewithpromiscuousmhcbindingforthetreatmentofmuc1-expressingtumors.vaccine.2011;29(29-30):4676-86.16cathcartetal.amultivalentbcr-ablfusionpeptidevaccinationtrialinpatientswithchronicmyeloidleukemia.blood.2004;103:1037-1042.17chapuisetal.transferredwt1-reactivecd8+tcellscanmediateantileukemicactivityandpersistinpost-transplantpatients.scitranslmed.2013;5(174):174ra27.18keilholzetal.aclinicalandimmunologicphase2trialofwilmstumorgeneproduct1(wt1)peptidevaccinationinpatientswithamlandmds.blood;2009;113(26):6541-8.19walteretal.multipeptideimmuneresponsetocancervaccineima901aftersingle-dosecyclophosphamideassociateswithlongerpatientsurvival.natmed.2012;18(8):1254-61.20phuphanichetal.phaseitrialofamulti-epitope-pulseddendriticcellvaccineforpatientswithnewlydiagnosedglioblastoma.cancerimmunolimmunother.2013;62(1):125-35.21kantoffetal.overallsurvivalanalysisofaphaseiirandomizedcontrolledtrialofapoxviral-basedpsa-targetedimmunotherapyinmetastaticcastration-resistantprostatecancer.jclinoncol.2010;28(7):1099-105.22tagawaetal.phaseistudyofintranodaldeliveryofaplasmiddnavaccineforpatientswithstageivmelanoma.cancer.2003;98(1):144-54.23slingluffetal.randomizedmulticentertrialoftheeffectsofmelanoma-associatedhelperpeptidesandcyclophosphamideontheimmunogenicityofamultipeptidemelanomavaccine.jclinoncol.2011;29(21):2924-32.24kaidaetal.phase1trialofwilmstumor1(wt1)peptidevaccineandgemcitabinecombinationtherapyinpatientswithadvancedpancreaticorbiliarytractcancer.jimmunother.2011;34(1):92-9.25fenoglioetal.amulti-peptide,dual-adjuvanttelomerasevaccine(gx301)ishighlyimmunogenicinpatientswithprostateandrenalcancer.cancerimmunolimmunother;2013;62:1041–1052.26krugetal.wt1peptidevaccinationsinducecd4andcd8tcellimmuneresponsesinpatientswithmesotheliomaandnon-smallcelllungcancer.cancerimmunolimmunother;2010;59(10):1467-79.27slingluffetal.clinicalandimmunologicresultsofarandomizedphaseiitrialofvaccinationusingfourmelanomapeptideseitheradministeredingranulocyte-macrophagecolony-stimulatingfactorinadjuvantorpulsedondendriticcells.jclinoncol;2003;21(21):4016-26.28hodietal.improvedsurvivalwithipilimumabinpatientswithmetastaticmelanoma.nengljmed;2010;363(8):711-23.29carmonetal.phasei/iistudyexploringimmucin,apan-majorhistocompatibilitycomplex,anti-muc1signalpeptidevaccine,inmultiplemyelomapatients.brjhematol.2014;169(1):44-56.30http://www.merckgroup.com/en/media/extnewsdetail.html?newsid=eb4a46a2ac4a52e7c1257ad9001f3186&newstype=1(2016年3月28日访问)31trimbleetal.safety,efficacy,andimmunogenicityofvgx-3100,atherapeuticsyntheticdnavaccinetargetinghumanpapillomavirus16and18e6ande7proteinsforcervicalintraepithelialneoplasia2/3:arandomised,double-blind,placebo-controlledphase2btrial.lancet.2015;386(10008):2078-88.32cusietal.phaseitrialofthymidylatesynthasepolyepitopepeptide(tspp)vaccineinadvancedcancerpatients.cancerimmunolimmunother;2015;64:1159–1173.33asaharaetal.phasei/iiclinicaltrialusinghla-a24-restrictedpeptidevaccinederivedfromkif20aforpatientswithadvancedpancreaticcancer.jtranslmed;2013;11:291.34yoshitakeetal.phaseiiclinicaltrialofmultiplepeptidevaccinationforadvancedheadandneckcancerpatientsrevealedinductionofimmuneresponsesandimprovedos.clincancerres;2014;21(2):312-21.35okunoetal.clinicaltrialofa7-peptidecocktailvaccinewithoralchemotherapyforpatientswithmetastaticcolorectalcancer.anticancerres;2014;34:3045-305.36rapoportetal.combinationimmunotherapyafterasctformultiplemyelomausingmage-a3/poly-iclcimmunizationsfollowedbyadoptivetransferofvaccine-primedandcostimulatedautologoustcells.clincancerres;2014;20(5):1355–1365.37greenfieldetal.aphaseidose-escalationclinicaltrialofapeptidebasedhumanpapillomavirustherapeuticvaccinewithcandidaskintestreagentasanovelvaccineadjuvantfortreatingwomenwithbiopsy-provencervicalintraepithelialneoplasia2/3.oncoimmunol;2015;4:10,e1031439.38snyderetal.geneticbasisforclinicalresponsetoctla-4blockadeinmelanoma.nengljmed.2014;371(23):2189-99.39vanallenetal.genomiccorrelatesofresponsetoctla-4blockadeinmetastaticmelanoma.science;2015;350:6257.40lietal.thrombocytopeniacausedbythedevelopmentofantibodiestothrombopoietin.blood;2001;98:3241-324841takedatsuetal.determinationofthrombopoietin-derivedpeptidesrecognizedbybothcellularandhumoralimmunitiesinhealthydonorsandpatientswiththrombocytopenia.2005;23(7):975-98242eisenhaueretal.newresponseevaluationcriteriainsolidtumors:revisedrecistguideline(version1.1).eurjcancer;2009;45(2):228-47.43therasseetal.newguidelinestoevaluatetheresponsetotreatmentinsolidtumors:europeanorganizationforresearchandtreatmentofcancer,nationalcancerinstituteoftheunitedstates,nationalcancerinstituteofcanada.jnatlcancerinst;2000;92:205-216.44tsuchida&therasse.responseevaluationcriteriainsolidtumors(recist):newguidelines.medpediatroncol.2001;37:1-3.45durieetal.internationaluniformresponsecriteriaformultiplemyeloma.leukemia;2006;20:1467–1473.序列表<110>特雷斯生物公司(treosbiozrt)<120>现成的<130>n409650wo-a<150>ep17159242.1<151>2017-03-03<150>ep17159243.9<151>2017-03-03<150>gb1703809.2<151>2017-03-09<160>188<170>patentinversion3.5<210>1<211>9<212>prt<213>人工序列<220><223>9mert细胞表位1<400>1tyrleumetasnargproglnasnleu15<210>2<211>9<212>prt<213>人工序列<220><223>9mert细胞表位2<400>2metmetalatyrseraspthrthrmet15<210>3<211>9<212>prt<213>人工序列<220><223>9mert细胞表位3<400>3phethrserserargmetserserphe15<210>4<211>9<212>prt<213>人工序列<220><223>9mert细胞表位4<400>4tyralaleuglypheglnhisalaleu15<210>5<211>9<212>prt<213>人工序列<220><223>9mert细胞表位5<400>5lysmetserserleuleuprothrmet15<210>6<211>9<212>prt<213>人工序列<220><223>9mert细胞表位6<400>6phethrvalcysasnserhisvalleu15<210>7<211>9<212>prt<213>人工序列<220><223>9mert细胞表位8<400>7metalaphevalthrserglygluleu15<210>8<211>9<212>prt<213>人工序列<220><223>9mert细胞表位8<400>8tyrleuhisalaargleuarggluleu15<210>9<211>9<212>prt<213>人工序列<220><223>9mert细胞表位9<400>9valmetsergluargvalserglyleu15<210>10<211>9<212>prt<213>人工序列<220><223>9mert细胞表位10<400>10phethrglnserglythrmetlysile15<210>11<211>9<212>prt<213>人工序列<220><223>9mert细胞表位11<400>11pheserserserglythrthrserphe15<210>12<211>9<212>prt<213>人工序列<220><223>9mert细胞表位12<400>12phemetpheglnglualaleulysleu15<210>13<211>9<212>prt<213>人工序列<220><223>9mert细胞表位13<400>13phevalleualaasnglyhisileleu15<210>14<211>9<212>prt<213>人工序列<220><223>9mert细胞表位15<400>14lysalametvalglnalatrpprophe15<210>15<211>9<212>prt<213>人工序列<220><223>9mert细胞表位15<400>15tyrsercysaspserargserleuphe15<210>16<211>9<212>prt<213>人工序列<220><223>9mert细胞表位16<400>16argalailegluglnleualaalamet15<210>17<211>9<212>prt<213>人工序列<220><223>9mert细胞表位17<400>17alametaspalailepheglyserleu15<210>18<211>9<212>prt<213>人工序列<220><223>9mert细胞表位18<400>18metalaserphearglysleuthrleu15<210>19<211>9<212>prt<213>人工序列<220><223>9mert细胞表位19<400>19serserileservaltyrtyrthrleu15<210>20<211>9<212>prt<213>人工序列<220><223>9mert细胞表位20<400>20seralaphegluproalathrglumet15<210>21<211>9<212>prt<213>人工序列<220><223>9mert细胞表位21<400>21phesertyrgluglnaspprothrleu15<210>22<211>9<212>prt<213>人工序列<220><223>9mert细胞表位22<400>22argthrtyrtrpileileilegluleu15<210>23<211>9<212>prt<213>人工序列<220><223>9mert细胞表位23<400>23thrthrmetgluthrglnpheproval15<210>24<211>9<212>prt<213>人工序列<220><223>9mert细胞表位24<400>24pheserphevalargilethralaleu15<210>25<211>9<212>prt<213>人工序列<220><223>9mert细胞表位25<400>25lysmetserserleuleuprothrmet15<210>26<211>9<212>prt<213>人工序列<220><223>9mert细胞表位26<400>26lysmethisserleuleualaleumet15<210>27<211>9<212>prt<213>人工序列<220><223>9mert细胞表位27<400>27phemetasnprotyrasnalavalleu15<210>28<211>9<212>prt<213>人工序列<220><223>9mert细胞表位28<400>28lyssermetthrmetmetproalaleu15<210>29<211>9<212>prt<213>人工序列<220><223>9mert细胞表位29<400>29tyrvalaspglulysalaprogluphe15<210>30<211>9<212>prt<213>人工序列<220><223>9mert细胞表位30<400>30lysthrmetserthrphehisasnleu15<210>31<211>9<212>prt<213>人工序列<220><223>9mert细胞表位31<400>31argalailegluglnleualaalamet15<210>32<211>9<212>prt<213>人工序列<220><223>9mert细胞表位32<400>32valmetsergluargvalserglyleu15<210>33<211>9<212>prt<213>人工序列<220><223>9mert细胞表位33<400>33tyrargalaglnargphetrpsertrp15<210>34<211>9<212>prt<213>人工序列<220><223>9mert细胞表位34<400>34phephephegluargilemetlystyr15<210>35<211>9<212>prt<213>人工序列<220><223>9mert细胞表位35<400>35serthrphelysasntrppropheleu15<210>36<211>9<212>prt<213>人工序列<220><223>9mert细胞表位36<400>36alailetrpglualaleuservalmet15<210>37<211>9<212>prt<213>人工序列<220><223>9mert细胞表位37<400>37lysvalalagluleuvalargpheleu15<210>38<211>9<212>prt<213>人工序列<220><223>9mert细胞表位38<400>38phevalglngluasntyrleuglutyr15<210>39<211>9<212>prt<213>人工序列<220><223>9mert细胞表位39<400>39argalaleualagluthrsertyrval15<210>40<211>9<212>prt<213>人工序列<220><223>9mert细胞表位40<400>40tyrilephealathrcysleuglyleu15<210>41<211>30<212>prt<213>人工序列<220><223>乳腺癌疫苗肽1<400>41leuglnlystyralaleuglypheglnhisalaleuserprosermet151015metalatyrseraspthrthrmetmetseraspaspileasp202530<210>42<211>30<212>prt<213>人工序列<220><223>乳腺癌疫苗肽2<400>42valcysmetphethrserserargmetserserpheasnarghisval151015asnileasptyrleumetasnargproglnasnleuargleu202530<210>43<211>30<212>prt<213>人工序列<220><223>乳腺癌疫苗肽3<400>43asnmetalaphevalthrserglygluleuvalarghisargarghis151015thrargphethrglnserglythrmetlysilehisileleu202530<210>44<211>30<212>prt<213>人工序列<220><223>乳腺癌疫苗肽4<400>44leuaspserphethrvalcysasnserhisvalleucysilealalys151015leuglypheserphevalargilethralaleumetvalser202530<210>45<211>30<212>prt<213>人工序列<220><223>乳腺癌疫苗肽5<400>45alaglnlysmetserserleuleuprothrmettrpleuglyalamet151015metglnmetpheglyleuglyalaileserleuileleuval202530<210>46<211>30<212>prt<213>人工序列<220><223>乳腺癌疫苗肽6<400>46leugluargleualatyrleuhisalaargleuarggluleuleugln151015thrleulysalametvalglnalatrpprophethrcysleu202530<210>47<211>30<212>prt<213>人工序列<220><223>乳腺癌疫苗肽7<400>47sersertyrphevalleualaasnglyhisileleuproasnserleu151015arghislyscyscyspheserserserglythrthrserphe202530<210>48<211>30<212>prt<213>人工序列<220><223>乳腺癌疫苗肽8<400>48thralalyslysvalargargalailegluglnleualaalametgln151015leugluphemetpheglnglualaleulysleulysvalala202530<210>49<211>30<212>prt<213>人工序列<220><223>乳腺癌疫苗肽9<400>49thrserhissertyrvalleuvalthrserleuasnleusertyrtyr151015sercysaspserargserleuphegluserseralalysile202530<210>50<211>30<212>prt<213>人工序列<220><223>乳腺癌疫苗肽10<400>50leuaspserphethrvalcysasnserhisvalleucysilealaval151015cysmetphethrserserargmetserserpheasnarghis202530<210>51<211>30<212>prt<213>人工序列<220><223>乳腺癌疫苗肽91<400>51leuarghislyscyscyspheserserserglythrthrserphegln151015thrleulysalametvalglnalatrpprophethrcysleu202530<210>52<211>30<212>prt<213>人工序列<220><223>乳腺癌疫苗肽12<400>52tyrsercysaspserargserleuphegluserseralalysilethr151015alalyslysvalargargalailegluglnleualaalamet202530<210>53<211>30<212>prt<213>人工序列<220><223>乳腺癌疫苗肽13<400>53metmetalatyrseraspthrthrmetmetseraspaspileasphis151015thrargphethrglnserglythrmetlysilehisileleu202530<210>54<211>30<212>prt<213>人工序列<220><223>乳腺癌疫苗肽14<400>54alaglnlysmetserserleuleuprothrmettrpleuglyalaleu151015glnlystyralaleuglypheglnhisalaleuserproser202530<210>55<211>30<212>prt<213>人工序列<220><223>乳腺癌疫苗肽15<400>55thrserhissertyrvalleuvalthrserleuasnleusertyrasn151015metalaphevalthrserglygluleuvalarghisargarg202530<210>56<211>30<212>prt<213>人工序列<220><223>乳腺癌疫苗肽16<400>56metmetglnmetpheglyleuglyalaileserleuileleuvalval151015asnileasptyrleumetasnargproglnasnleuargleu202530<210>57<211>30<212>prt<213>人工序列<220><223>乳腺癌肽17<400>57sersertyrphevalleualaasnglyhisileleuproasnserlys151015leuglypheserphevalargilethralaleumetvalser202530<210>58<211>30<212>prt<213>人工序列<220><223>乳腺癌疫苗肽18<400>58leugluargleualatyrleuhisalaargleuarggluleuleugln151015leugluphemetpheglnglualaleulysleulysvalala202530<210>59<211>30<212>prt<213>人工序列<220><223>乳腺癌疫苗肽19<400>59glyasnileleuaspserphethrvalcysasnserhisvalleuleu151015glnlystyralaleuglypheglnhisalaleuserproser202530<210>60<211>30<212>prt<213>人工序列<220><223>乳腺癌疫苗肽20<400>60asnmetalaphevalthrserglygluleuvalarghisargargphe151015serserserglythrthrserphelyscysphealaprophe202530<210>61<211>30<212>prt<213>人工序列<220><223>乳腺癌疫苗肽21<400>61alaglnlysmetserserleuleuprothrmettrpleuglyalamet151015phethrserserargmetserserpheasnarghismetlys202530<210>62<211>30<212>prt<213>人工序列<220><223>乳腺癌疫苗肽22<400>62thrserhissertyrvalleuvalthrserleuasnleusertyrhis151015serglnthrleulysalametvalglnalatrpprophethr202530<210>63<211>30<212>prt<213>人工序列<220><223>乳腺癌疫苗肽23<400>63metalaserphearglysleuthrleuserglulysvalproproser151015prothralametaspalailepheglyserleuseraspglu202530<210>64<211>30<212>prt<213>人工序列<220><223>乳腺癌疫苗肽24<400>64aspglnvalasnileasptyrleumetasnargproglnasnleuarg151015hisserglnthrleulysalametvalglnalatrpprophe202530<210>65<211>30<212>prt<213>人工序列<220><223>乳腺癌疫苗肽25<400>65cysserglysersertyrphevalleualaasnglyhisileleuser151015glyalavalmetsergluargvalserglyleualaglyser202530<210>66<211>30<212>prt<213>人工序列<220><223>乳腺癌疫苗26<400>66aspleuserphetyrvalasnargleuserserleuvalileglnser151015serileservaltyrtyrthrleutrpserglnpheaspglu202530<210>67<211>30<212>prt<213>人工序列<220><223>乳腺癌疫苗肽27<400>67serglyalavalmetsergluargvalserglyleualaglyserser151015argleuleugluphetyrleualametprophealathrpro202530<210>68<211>30<212>prt<213>人工序列<220><223>乳腺癌疫苗肽28<400>68metalaserphearglysleuthrleuserglulysvalproproglu151015serpheserprothralametaspalailepheglyserleu202530<210>69<211>30<212>prt<213>人工序列<220><223>乳腺癌疫苗肽29<400>69phetyrleualametprophealathrprometglualagluleulys151015proseralaphegluproalathrglumetglnlysserval202530<210>70<211>30<212>prt<213>人工序列<220><223>乳腺癌疫苗肽30<400>70alametaspalailepheglyserleuseraspgluglyserglyhis151015serglnthrleulysalametvalglnalatrpprophethr202530<210>71<211>30<212>prt<213>人工序列<220><223>乳腺癌疫苗肽32<400>71phevalleualaasnglyhisileleuproasnsergluasnalagly151015thrglylysleuglypheserphevalargilethralaleu202530<210>72<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽1<400>72valcyssermetgluglythrtrptyrleuvalglyleuvalsertyr151015argsercysglyphesertyrgluglnaspprothrleuarg202530<210>73<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽2<400>73valargthrtyrtrpileileilegluleulyshislysalaargleu151015proserthrthrmetgluthrglnpheprovalserglugly202530<210>74<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽3<400>74thralalyslysvalargargalailegluglnleualaalametmet151015glyalaprothrleuproproalatrpglnpropheleulys202530<210>75<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽4<400>75leualaserlysmethisserleuleualaleumetvalglyleupro151015lyssermetthrmetmetproalaleuphelysgluasnarg202530<210>76<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽5<400>76lysleuglypheserphevalargilethralaleumetvalserleu151015aspserphethrvalcysasnserhisvalleucysileala202530<210>77<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽6<400>77lysphemetasnprotyrasnalavalleuthrlyslyspheglnphe151015lyslysthrmetserthrphehisasnleuvalserleuasn202530<210>78<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽7<400>78alaglnlysmetserserleuleuprothrmettrpleuglyalalys151015valasnphephephegluargilemetlystyrgluargleu202530<210>79<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽8<400>79lysasphisargileserthrphelysasntrppropheleuglupro151015gluglualailetrpglualaleuservalmetglyleutyr202530<210>80<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽9<400>80tyrargsercysglyphesertyrgluglnaspprothrleuargval151015cyssermetgluglythrtrptyrleuvalglyleuvalser202530<210>81<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽10<400>81valargthrtyrtrpileileilegluleulyshislysalaargthr151015alalyslysvalargargalailegluglnleualaalamet202530<210>82<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽111<400>82leuproserthrthrmetgluthrglnpheprovalsergluglylys151015leuglypheserphevalargilethralaleumetvalser202530<210>83<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽12<400>83metglyalaprothrleuproproalatrpglnpropheleulyspro151015gluglualailetrpglualaleuservalmetglyleutyr202530<210>84<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽13<400>84leualaserlysmethisserleuleualaleumetvalglyleulys151015asphisargileserthrphelysasntrppropheleuglu202530<210>85<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽14<400>85prolyssermetthrmetmetproalaleuphelysgluasnargleu151015aspserphethrvalcysasnserhisvalleucysileala202530<210>86<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽15<400>86lysphemetasnprotyrasnalavalleuthrlyslyspheglnlys151015valasnphephephegluargilemetlystyrgluargleu202530<210>87<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽16<400>87alaglnlysmetserserleuleuprothrmettrpleuglyalaphe151015lyslysthrmetserthrphehisasnleuvalserleuasn202530<210>88<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽17<400>88glyphesertyrgluglnaspprothrleuargaspproglualaval151015cyssermetgluglythrtrptyrleuvalglyleuvalser202530<210>89<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽18<400>89prolyssermetthrmetmetproalaleuphelysgluasnarggly151015asnileleuaspserphethrvalcysasnserhisvalleu202530<210>90<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽19<400>90proserthrthrmetgluthrglnpheprovalsergluglylysser151015argtyrargalaglnargphetrpsertrpvalglyglnala202530<210>91<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽20<400>91tyrvalaspglulysalaprogluphesermetglnglyleulysasp151015glulysvalalagluleuvalargpheleuleuarglystyr202530<210>92<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽21<400>92argsercysglyphesertyrgluglnaspprothrleuargaspgly151015thrglylysleuglypheserphevalargilethralaleu202530<210>93<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽22<400>93serargalaprogluglualailetrpglualaleuservalmetgln151015tyrphevalglngluasntyrleuglutyrargglnvalpro202530<210>94<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽23<400>94prolyssermetthrmetmetproalaleuphelysgluasnargser151015glyalavalmetsergluargvalserglyleualaglyser202530<210>95<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽24<400>95serglyalavalmetsergluargvalserglyleualaglyserarg151015asnserileargserserpheileserserleuserphephe202530<210>96<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽25<400>96asnilegluasntyrserthrasnalaleuileglnprovalaspglu151015lysvalalagluleuvalargpheleuleuarglystyrgln202530<210>97<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽26<400>97argglnphegluthrvalcyslysphehistrpvalglualaphelys151015leuleuthrglntyrphevalglngluasntyrleuglutyr202530<210>98<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽27<400>98glupheleutrpglyproargalaleualagluthrsertyrvallys151015leuleuthrglnhisphevalglngluasntyrleuglutyr202530<210>99<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽28<400>99alaserserserserthrleuilemetglythrleuglugluvalgln151015thrleuiletyrtyrvalaspglulysalaproglupheser202530<210>100<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽29<400>100serargthrleuleuleualaleuproleuproleuserleuleuile151015glyhisleutyrilephealathrcysleuglyleusertyr202530<210>101<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽30<400>101pheileilevalvalphevaltyrleuthrvalgluasnlysserile151015glyhisvaltyrilephealathrcysleuglyleusertyr202530<210>102<211>30<212>prt<213>人工序列<220><223>结肠直肠癌疫苗肽31<400>102leuleualaalaalathralathrphealaalaalaglngluglugln151015thrleuiletyrtyrvalaspglulysalaproglupheser202530<210>103<211>16<212>prt<213>人工序列<220><223>额外肽1<400>103metmetasnleumetglnprolysthrglnglnthrtyrthrtyrasp151015<210>104<211>21<212>prt<213>人工序列<220><223>额外肽2<400>104glyargglyserthrthrthrasntyrleuleuaspargaspasptyr151015argasnthrserasp20<210>105<211>22<212>prt<213>人工序列<220><223>额外肽3<400>105leulyslysglyalaalaaspglyglylysleuaspglyasnalalys151015leuasnargserleulys20<210>106<211>22<212>prt<213>人工序列<220><223>额外肽4<400>106pheproprolysaspasphisthrleulyspheleutyraspaspasn151015glnargprotyrpropro20<210>107<211>21<212>prt<213>人工序列<220><223>额外肽5<400>107argtyrarglysproasptyrthrleuaspaspglyhisglyleuleu151015argphelysserthr20<210>108<211>18<212>prt<213>人工序列<220><223>额外肽6<400>108glnargpropropheserglnleuhisargpheleualaaspalaleu151015asnthr<210>109<211>25<212>prt<213>人工序列<220><223>额外肽7<400>109alaleuaspglncyslysthrsercysalaleumetglnglnhistyr151015aspglnthrsercyspheserserpro2025<210>110<211>25<212>prt<213>人工序列<220><223>额外肽8<400>110serthralaproproalahisglyvalthrseralaproaspthrarg151015proalaproglyserthralapropro2025<210>111<211>9<212>prt<213>人工序列<220><223>额外肽9<400>111tyrleugluproglyprovalthrala15<210>112<211>21<212>prt<213>人工序列<220><223>额外肽10<400>112metthrproglythrglnserprophepheleuleuleuleuleuthr151015valleuthrvalval20<210>113<211>9<212>prt<213>人工序列<220><223>额外肽11<400>113serserlysalaleuglnargproval15<210>114<211>9<212>prt<213>人工序列<220><223>额外肽12<400>114argmetpheproasnalaprotyrleu15<210>115<211>9<212>prt<213>人工序列<220><223>额外肽13<400>115argmetpheproasnalaprotyrleu15<210>116<211>20<212>prt<213>人工序列<220><223>xyz1<400>116asnserleuglnlysglnleuglnalavalleuglntrpilealaala151015serglnpheasn20<210>117<211>20<212>prt<213>人工序列<220><223>xyz2<400>117serglyaspgluargseraspgluilevalleuthrvalserasnser151015asnvalgluglu20<210>118<211>20<212>prt<213>人工序列<220><223>xyz3<400>118valglnlysgluaspglyargvalglnalapheglytrpserleupro151015glnlystyrlys20<210>119<211>20<212>prt<213>人工序列<220><223>xyz4<400>119gluvalgluserthrprometilemetgluasnileglngluleuile151015argseralagln20<210>120<211>20<212>prt<213>人工序列<220><223>xyz5<400>120alatyrphegluserleuleuglulysargglulysthrasnpheasp151015proalaglutrp20<210>121<211>20<212>prt<213>人工序列<220><223>xyz6<400>121proserglnalaserserglyglnalaargmetpheproasnalapro151015tyrleuproser20<210>122<211>20<212>prt<213>人工序列<220><223>xyz7<400>122argargserilealaglyphevalalaserileasngluglymetthr151015argtrppheser20<210>123<211>20<212>prt<213>人工序列<220><223>xyz8<400>123metglnaspilelysmetileleulysmetvalglnleuaspserile151015gluaspleuglu20<210>124<211>20<212>prt<213>人工序列<220><223>xyz9<400>124alaasnservalvalseraspmetmetvalserilemetlysthrleu151015lysileglnval20<210>125<211>20<212>prt<213>人工序列<220><223>xyz10<400>125argglualaleuserasnlysvalaspgluleualahispheleuleu151015arglystyrarg20<210>126<211>20<212>prt<213>人工序列<220><223>xyz11<400>126gluthrsertyrglulysvalileasntyrleuvalmetleuasnala151015arggluproile20<210>127<211>20<212>prt<213>人工序列<220><223>xyz12<400>127aspvallysgluvalaspprothrglyhisserphevalleuvalthr151015serleuglyleu20<210>128<211>20<212>prt<213>人工序列<220><223>xyz13<400>128seralaglnleuleuglnalaargleumetlysglugluserproval151015valsertrparg20<210>129<211>20<212>prt<213>人工序列<220><223>abc1<400>129ileseraspthrlysasptyrphemetserlysthrleuglyilegly151015argleulysarg20<210>130<211>20<212>prt<213>人工序列<220><223>abc2<400>130pheaspargasnthrgluserleupheglugluleuserseralagly151015serglyleuile20<210>131<211>20<212>prt<213>人工序列<220><223>abc3<400>131serglnlysmetaspmetserasnilevalleumetleuileglnlys151015leuleuasnglu20<210>132<211>20<212>prt<213>人工序列<220><223>abc4<400>132seralavalphehisgluargtyralaleuileglnhisglnlysthr151015hislysasnglu20<210>133<211>20<212>prt<213>人工序列<220><223>abc5<400>133aspvallysgluvalaspprothrserhissertyrvalleuvalthr151015serleuasnleu20<210>134<211>20<212>prt<213>人工序列<220><223>abc6<400>134gluasnalahisglyglnserleuglugluaspseralaleugluala151015leuleuasnphe20<210>135<211>20<212>prt<213>人工序列<220><223>abc7<400>135metalaserphearglysleuthrleuserglulysvalproproasn151015hisproserarg20<210>136<211>20<212>prt<213>人工序列<220><223>abc8<400>136lysargalaserglntyrserglyglnleulysvalleuilealaglu151015asnthrmetleu20<210>137<211>20<212>prt<213>人工序列<220><223>abc9<400>137valaspproalaglnleugluphemetpheglnglualaleulysleu151015lysvalalaglu20<210>138<211>20<212>prt<213>人工序列<220><223>abc10<400>138glutyrgluargglugluthrargglnvaltyrmetaspleuasnasn151015asnileglulys20<210>139<211>20<212>prt<213>人工序列<220><223>abc11<400>139progluilepheglylysalasergluserleuglnleuvalphegly151015ileaspvallys20<210>140<211>20<212>prt<213>人工序列<220><223>abc12<400>140aspsergluserserphethrtyrthrleuaspglulysvalalaglu151015leuvalgluphe20<210>141<211>9<212>prt<213>人工序列<220><223>crc-p11<400>141glnpheprovalsergluglylysser15<210>142<211>9<212>prt<213>人工序列<220><223>crc-p12<400>142pheprovalsergluglylysserarg15<210>143<211>9<212>prt<213>人工序列<220><223>crc-p13<400>143provalsergluglylysserargtyr15<210>144<211>9<212>prt<213>人工序列<220><223>crc-p14<400>144valsergluglylysserargtyrarg15<210>145<211>9<212>prt<213>人工序列<220><223>crc-p15<400>145sergluglylysserargtyrargala15<210>146<211>9<212>prt<213>人工序列<220><223>crc-p16<400>146gluglylysserargtyrargalagln15<210>147<211>9<212>prt<213>人工序列<220><223>crc-p17<400>147glylysserargtyrargalaglnarg15<210>148<211>9<212>prt<213>人工序列<220><223>crc-p18<400>148lysserargtyrargalaglnargphe15<210>149<211>9<212>prt<213>人工序列<220><223>crc-p21<400>149ilegluleulyshislysalaargthr15<210>150<211>9<212>prt<213>人工序列<220><223>crc-p22<400>150gluleulyshislysalaargthrala15<210>151<211>9<212>prt<213>人工序列<220><223>crc-p23<400>151leulyshislysalaargthralalys15<210>152<211>9<212>prt<213>人工序列<220><223>crc-p24<400>152lyshislysalaargthralalyslys15<210>153<211>9<212>prt<213>人工序列<220><223>crc-p25<400>153hislysalaargthralalyslysval15<210>154<211>9<212>prt<213>人工序列<220><223>crc-p26<400>154lysalaargthralalyslysvalarg15<210>155<211>9<212>prt<213>人工序列<220><223>crc-p27<400>155alaargthralalyslysvalargarg15<210>156<211>9<212>prt<213>人工序列<220><223>crc-p28<400>156argthralalyslysvalargargala15<210>157<211>9<212>prt<213>人工序列<220><223>crc-p31<400>157gluphesermetglnglyleulysasp15<210>158<211>9<212>prt<213>人工序列<220><223>crc-p32<400>158phesermetglnglyleulysaspglu15<210>159<211>9<212>prt<213>人工序列<220><223>smqglkdek<400>159sermetglnglyleulysaspglulys15<210>160<211>9<212>prt<213>人工序列<220><223>crc-p34<400>160metglnglyleulysaspglulysval15<210>161<211>9<212>prt<213>人工序列<220><223>crc-p35<400>161glnglyleulysaspglulysvalala15<210>162<211>9<212>prt<213>人工序列<220><223>crc-p36<400>162glyleulysaspglulysvalalaglu15<210>163<211>9<212>prt<213>人工序列<220><223>crc-p37<400>163leulysaspglulysvalalagluleu15<210>164<211>9<212>prt<213>人工序列<220><223>crc-p38<400>164lysaspglulysvalalagluleuval15<210>165<211>9<212>prt<213>人工序列<220><223>crc-p61<400>165leuleualaleumetvalglyleulys15<210>166<211>9<212>prt<213>人工序列<220><223>crc-p62<400>166leualaleumetvalglyleulysasp15<210>167<211>9<212>prt<213>人工序列<220><223>crc-p63<400>167alaleumetvalglyleulysasphis15<210>168<211>9<212>prt<213>人工序列<220><223>crc-p64<400>168leumetvalglyleulysasphisarg15<210>169<211>9<212>prt<213>人工序列<220><223>crc-p65<400>169metvalglyleulysasphisargile15<210>170<211>9<212>prt<213>人工序列<220><223>crc-p66<400>170valglyleulysasphisargileser15<210>171<211>9<212>prt<213>人工序列<220><223>crc-p67<400>171glyleulysasphisargileserthr15<210>172<211>9<212>prt<213>人工序列<220><223>crc-p68<400>172leulysasphisargileserthrphe15<210>173<211>9<212>prt<213>人工序列<220><223>crc-p71<400>173proalaleuphelysgluasnargser15<210>174<211>9<212>prt<213>人工序列<220><223>crc-p72<400>174alaleuphelysgluasnargsergly15<210>175<211>9<212>prt<213>人工序列<220><223>crc-p73<400>175leuphelysgluasnargserglyala15<210>176<211>9<212>prt<213>人工序列<220><223>crc-p74<400>176phelysgluasnargserglyalaval15<210>177<211>9<212>prt<213>人工序列<220><223>crc-p75<400>177lysgluasnargserglyalavalmet15<210>178<211>9<212>prt<213>人工序列<220><223>crc-p76<400>178gluasnargserglyalavalmetser15<210>179<211>9<212>prt<213>人工序列<220><223>crc-p77<400>179asnargserglyalavalmetserglu15<210>180<211>9<212>prt<213>人工序列<220><223>crc-p78<400>180argserglyalavalmetsergluarg15<210>181<211>9<212>prt<213>人工序列<220><223>crc-p81<400>181alavalleuthrlyslyspheglnlys15<210>182<211>9<212>prt<213>人工序列<220><223>crc-p82<400>182valleuthrlyslyspheglnlysval15<210>183<211>9<212>prt<213>人工序列<220><223>crc-p83<400>183leuthrlyslyspheglnlysvalasn15<210>184<211>9<212>prt<213>人工序列<220><223>crc-p84<400>184thrlyslyspheglnlysvalasnphe15<210>185<211>9<212>prt<213>人工序列<220><223>crc-p85<400>185lyslyspheglnlysvalasnphephe15<210>186<211>9<212>prt<213>人工序列<220><223>crc-p86<400>186lyspheglnlysvalasnphephephe15<210>187<211>9<212>prt<213>人工序列<220><223>crc-p87<400>187pheglnlysvalasnphephepheglu15<210>188<211>9<212>prt<213>人工序列<220><223>crc-p88<400>188glnlysvalasnphephephegluarg15当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1